第四章、第5章、第6章习题及大题答案
编码-第4讲-讲义、习题(第5、6章)

第五章其他动物产品(一)本章的编排结构(1)本章是第1.3章动物的副产品, 特点是不能供人食用(0504的肠、胃、膀胱及动物血除外), 能食用的归2.3.4章。
(2)本章11个品目, 所列产品基本都是未加工或仅经过简单加工, 如洗涤、梳理、酸处理、脱胶、制成粉末和废品、废料, 绝对没有加工成成品, 否则就要归入其他章了, 比如0506到0508的产品的深加工品归到9601, 它们排列的顺序如下:0501人发02猪毛(含猪科动物)04肠、胃、膀胱05羽毛、羽绒06~08动物的角、骨、壳等10可入药动物产品0511其他未列名不可食用的动物产品(注: 可食用的未列名归0410)(二)本章商品的归类要点提示:(1)未按发根、梢整理的人发或废人发归入0501, 深加工的人发归6703, 人发的制品归6704。
(2)猪科动物毛发较硬, 多制刷, 一般制刷原材料归0502, 但是若这些原材料为成束成簇的话, 则归到9603.9090, 制成刷子也归到9603中。
羊毛(绵羊, 羔羊)等可用作纺织材料的动物毛一般归入51章, 但短而发硬的山羊毛、黄鼠狼尾毛仍归入本章0502。
马毛包括马科动物和牛科动物的鬃毛和尾毛, 这些毛也是比较硬的, 可以用来制刷, 也可用来纺织, 马毛本身归到0511.9940, 但是马毛纱线, 马毛制的机织物, 则归到51章。
(3)注意★0504中的动物肠衣, 是纯天然的肠衣, 一般用来灌香肠, 此外还有人造肠衣, 是塑料做的, 归到3917.1000, 而羊的肠衣很多时候是用来制作肠线的, 要是制成的肠线经过消毒, 医疗用归到3006.1000, 而未消毒的肠衣, 则归到4206中。
★0504中还要注意肠衣≠肠, 肠衣是肠外面的一层薄膜, 用来灌香肠的, 而肠很多时候是食用的, 像猪大肠等, 肠归0504.0090 ★动物的胃, 像鸡胗、牛百叶, 羊肚, 猪肚等都是可以供人食用的, 它们虽是动物的食用杂碎, 但一定要归0504中。
《企业文化》每章习题及部分答案

第一章复习思考题二、选择题1.在日本,企业文化被称为( C )A. 商业文化B. 公司文化C. 社风D. 会社文化2.企业文化理论是(C )美国学者在受到日本经济增长经验的启示,总结、比较日、美企业管理差异的基础上提出来的。
A.60 年代B.70 年代C.80 年代D.90 年代3. 在《日本企业管理艺术》中提出了著名的“7S'管理模式,其中(ACD )为硬性要素。
A. 战略B. 技能C. 制度D. 结构4. 特雷斯•迪尔和阿伦•肯尼迪将企业文化分成(C )种类型。
A. 二种B. 三种C. 四种D. 五种5. 企业文化作为一种稳定的管理方式是在(A)企业实现的。
A. 日本B. 美国C.英国D. 中国6. 企业管理发展的最高阶段是( C )。
A. 经营管理B. 科学管理C. 文化管理D. 生产管理三、判断题(V )1 •企业文化理论促使企业经营者将管理方式从“以物为中心”转移到“以人为中心”上来。
(x )2 .企业文化研究在20世纪80年代出现了两种方法的派别,其中,以爱德加•沙因教授为代表的派别主要以定量化研究为主,以罗伯特・奎恩教授为代表的派别主要以定性化研究为主。
(x )3 .企业文化对企业长期经营业绩没有太大的影响。
(x )4.在企业文化理论传入我国之前,我国企业已经形成系统而科学的企业文化管理方式。
(x )5.美国文化最突出的特点是个人主义,强调实现自我价值。
(x )6.任何一国的企业管理并非要与本国文化特色相结合。
第二章复习思考题、选择题1.在企业文化的结构中,A )最重要,它决定和制约着企业文化的其它层次。
A. 企业精神文化B.企业制度文化C. 企业行为文化D.企业物质文化2.企业行为中主要包括((ABD )的行为。
A. 企业家的行为B.企业模范人物的行为、C. 企业股东行为D.企业员工的行为3.企业文化的(B )功能是指企业文化像一种“润滑剂”,能够协调人际关系,营造和谐的工作氛围,以一只“看不见的手”自动地调节员工的心态和行动。
机械制造工艺学4,6章习题答案

关于同轴度误差引起的定位误差: 如下图,工艺基准为孔的下母线,而定位基准为轴的中心线,若外圆及孔的 尺寸无误差,则引起工序基准位置变化的原因为孔轴的同轴度误差,工序基 准位置最大的变动量=T(同轴度公差值),即Δdw =Δjb =T; 若考虑外圆
和孔的尺寸的公差Td和TD,则Δjw = Δdw =Δjb+ Δjw
+0.0895 0
习题4-18 某零件的轴向尺寸如图a),轴向尺寸加工工序如图b),c),d,试校核工序图
上标注的工序尺寸及公差是否正确(加工符号表示本道工序的加工面)
解:先校核 b)图上的工序 尺寸:计算由a),b),c)图有 关尺寸组成的尺寸链, L1=40.30-0.1 L2=10.40-0.2 L3=100-0.1 L4=40
L3 L2
20 = 60 + L 4 − 70 L 4 = 30 mm ES L 4 = + 0 . 1mm
L1
+ 0 . 15 = ES L 4 + 0 − (− 0 . 05 )
0 = EI L 4 − 0 . 025 − ( − 0 . 025 _ EI L 4 = 0 mm
+ ∴ L 3 = 30 0 0 .1 mm
解尺寸链得: L=130±0.04mm, 50±0.04mm
第六章习题 6-1:选择粗、精加工基准分析定位方案:1)指出限制的自由度
数;2)判断有无欠定位或过定位;3)对不合理的定位方案提出改进意见
在O处钻孔
形块共限制六个自由度;为 保证孔轴线过中心O应该限制六个 自由度,因此无过定位和欠定位
Td 2 sin
α
2
; Δjb =T+ Td/2;
第六章习题 6-4:定位误差计算
第四、五、六章练习题答案

图3-18
14.利用影响线,求得结构在图3-20所示荷载作用下,C截面的剪力等于-20kN。(×)
15.结构的附属部分某截面某量值的影响线在基本部分的影响线竖标为零。(√)
第六章力法
1.超静定结构中有几个多余约束就有几个建立力法方程的变形条件。(√)
7.图3-14a所示梁的剪力图,竖标 是截面C左的剪力值,图3-14b是截面C的剪力影响线,竖标- 也是表示在移动荷载作用下截面C左的剪力值。(×)
图3-14
8.图3-15b可以代表图3-15a所示梁EF段任意截面的剪力影响线。(√)
图3-15
9.任何静定结构的支座反力、内力影响线,军事有一段或是数段直线组成。(√)
2.力法方程中的主系数的符号在任何情况下都取正值。(√)
3.把超静定结构的基本未知力求出来后,画最后内力图时,实际上是在画静定结构的内力图。(√)
4.图5-14所示超静定结构当支座A发生位移时,构建CD不会产生内力。(√)
图5-14
5.对图5-15(a)所示超静定刚架,若进行内力分析时采用5-15b所示的基本结构,并画出了最后的内力图,当计算C点的竖向位移时可选用图5-15 C所示的基本结构。(√)
2.剪力的结构包络图表示梁在已知荷载作用下各截面剪力可能变化的极限范围。(√)
3.静定桁架的影响线在结点之间必是一条直线。(√)
4.下图3-10所示两根梁的MC影响线不相同。(×)
图3-10图3-11
5.同4题图所示两根梁的QC影响线不相同。(√)
6.图3-11所示单位荷载在AB区间移动,绘制界面C的某内力影响线时,也应限制在AB区间内。(√)
10.静定梁某截面弯矩的临界荷载位置一般就是最不利荷载位置。(×)
原子物理学第四,五,六,七章课后习题答案

第四章 碱金属原子1. 已知Li 原子光谱主线系最长波长0A 6707=λ,辅线系系限波长A 3519=∞λ.求Li 原子第一激发电势和电离电势.解:主线系最长波长是原子从第一激发态跃迁至基态的光谱线的波长E h hc νλ∆==第一激发电势1eU E =∆34811976.626210310V 1.850V 1.602210 6.70710E hc U e e λ---∆⨯⨯⨯====⨯⨯⨯辅线系系限波长是原子从无穷处向第一激发态跃迁产生的 辅线系~~*2n R n νν∞=-,~~*n n νν∞→∞=192 5.648910J hc eU λ-∞==⨯2 3.526V U =电离电势:U =U 1+U 2=5.376V2. Na 原子的基态3S .已知其共振线波长为58930A ,漫线系第一条的波长为81930A ,基线系第一条的波长为184590A ,主线系的系限波长为24130A 。
试求3S 、3P 、3D 、4F 各谱项的项值. 解:主线系波数~p 22s p ,3,4,(3)()n R Rn n ν=-=-∆-∆~~p 2s ,(3)n Rn νν∞→∞==-∆系限波长:p λ∞=24130A =72.41310m -⨯~1613S 71m 4.144210m 2.41310T ν--∞-===⨯⨯共振线为主线系第一条线, 是原子从3P 到3S 跃迁产生的光谱线 共振线波长:λp1=58930A =75.89310m -⨯~61p13S 3P 71 1.696910m 5.89310mT T ν--=-==⨯⨯1616S 3P 3m 104473.2m 106969.1--⨯=⨯-=T T漫线系(第一辅线系)波数~d 22p d ,3,4,(3)()n R Rn n ν=-=-∆-∆漫线系第一条线是原子从3D 到3P 跃迁产生的光谱线 漫线系第一条光谱线的波长7d18.19310m λ-=⨯167D 3P 31~d m 102206.1m10193.81--⨯=⨯=-=T T ν1616P 3D 3m 102267.1m 102206.1--⨯=⨯-=T T基线系(柏格曼线系)波数,5,4,)()3(2f 2d ~f =∆--∆-=n n RR n ν 基线系第一条线是原子从4F 到3D 跃迁产生的光谱线 基线系第一条光谱线的波长6f1 1.845910m λ-=⨯156F 4D 31fm 104174.5m108459.1--⨯=⨯=-=T T ν 1515D 3F 4m 108496.6m 104174.5--⨯=⨯-=T T3. K 原子共振线波长为7665Å,主线系系限波长为2858Å. 已知K 原子的基态为4S. 试求4S 、4P 谱项的量子数修正项∆S 、∆P 值各为多少?K 原子的主线系波数,5,4,)()4(2P 2S ~p=∆--∆-=n n RR n ν 2S ~~p )4(,∆-==∞→∞Rn n νν 1617~m 104990.3m 10858.211---∞∞⨯=⨯==p λν 16~S 4m 104990.3-∞⨯==νT而 2S S 4)4(∆-=RT 所以 S4S 4T R =∆- 17m 100973731.1-∞⨯=≈R R 7709.14S =∆-2291.2S =∆K 原子共振线为主线系第一条线, 是原子从4P 到4S 跃迁产生的光谱线1p A 7665=λ167P 4S 41pm 103046.1m10665.7--⨯=⨯=-=T T ν 1616S 4P 4m 101944.2m 103046.1--⨯=⨯-=T T而 2P P 4)4(∆-=RT 所以 P4P 4T R =∆- 17m 100973731.1-∞⨯=≈R R7638.14P4P =-=∆T R第五章 多电子原子1. He 原子的两个电子处在2p3d 电子组态.问可能组成哪几种原子态?用原子态的符号表示之.已知电子间是LS 耦合.解:p 电子的轨道角动量和自旋角动量量子数分别为,11=l 211=s . d 电子的轨道角动量和自旋角动量量子数分别为,21=l 212=s . 因为是LS 耦合,所以.,,1,212121l l l l l l L -⋯-++=.1,2,3=L.0,1.2121=-+=S s s s s S 或而 .,,1,S L S L S L J -⋯-++=.1,0,1===J S L 原子态为11P . .0,1,2,1,1===J S L 原子态为30,1,2P ..2,0,2===J S L 原子态为12D ..1,2,3,1,2===J S L 原子态为31,2,3D ..3,0,3===J S L 原子态为13F . .2,3,4,1,3===J S L 原子态为32,3,4F .2. 已知He 原子的两个电子被分别激发到2p 和3d 轨道,其所构成的原子态为3D ,问这两电子的轨道角动量p l 1与p l 2之间的夹角,自旋角动量p s 1与p s 2之间的夹角分别为多少?(1). 解:已知原子态为3D ,电子组态为2p3d, 所以2,1,1,221====l l S L因此'1212221211212221222211113733212/)(cos cos 26)1(6)1(22)1(οθθθπ==---=-+==+==+==+=l l l l L l l l l L L l l p p p p P p p p p P L L P l l p hl l p 所以'0'0471061373180=-=οθL(2).1212122s s S s s p p P =======因为所以而'2212221222212221228109312/)(cos cos 2οθθθ=-=---=-+=s s s s S s s s s S p p p p P p p p p P 所以'0'0327028109180=-=οθS4. 试以两个价电子l 1=2和l 2=3为例说明,不论是LS 耦合还是jj 耦合都给出同样数目的可能状态. (1) LS 耦合.3,221==l l.,,1,212121l l l l l l L -⋯-++=.1,23,4,5=L .2121==s s .0,1=S.,,1,S L S L S L J -⋯-++=当S =0时,J =L , L 的5个取值对应5个单重态, 即1=L 时,1=J ,原子态为11P .2=L 时,2=J ,原子态为12D .3=L 时,3=J ,原子态为13F . 4=L 时,4=J ,原子态为14G .5=L 时,5=J ,原子态为15H .当S =1时,.1,,1-+=L L L J代入一个L 值便有一个三重态.5个L 值共有5乘3等于15个原子态,分别是:1=L 时,0,1,2=J 原子态为30,1,2P2=L 时,1,2,3=J 原子态为31,2,3D3=L 时,2,3,4=J 原子态为32,3,4F 4=L 时,3,4,5=J 原子态为33,4,5G5=L 时,4,5,6=J 原子态为34,5,6H因此,LS 耦合时共有20个可能状态. (2) jj 耦合.,...,.2527;2325;21212121j j j j j j J j j s l j s l j -++===-=+=或或或 将每个j 1、j 2 合成J 得:.1,2,3,42523.2,3,4,52723.0,1,2,3,4,52525.1,2,3,4,5,6272521212121============J j j J j j J j j J j j ,合成和,合成和,合成和,合成和4,3,2,15,4,3,25,4,3,2,1,06,5,4,3,2,1)25,23()27,23()25,25()27,25(共20个可能状态所以,无论是LS耦合还是jj耦合,都会给出20种可能状态.6.已知He原子的一个电子被激发到2p轨道,另一个电子还在1s轨道,试做出能级跃迁图来说明可能出现哪些光谱线跃迁.解:在1s2p组态的能级和1s1s基态之间存在中间激发态,电子组态为1s2s.利用LS耦合规则求出各电子组态的原子态如下:1s1s:1S01s2s:1S0、3S11s2p:1P1、3P0,1,2根据选择定则,这些原子态之间可以发生5条光谱线跃迁。
电路分析基础第四版课后习题第四章第五章第六章答案
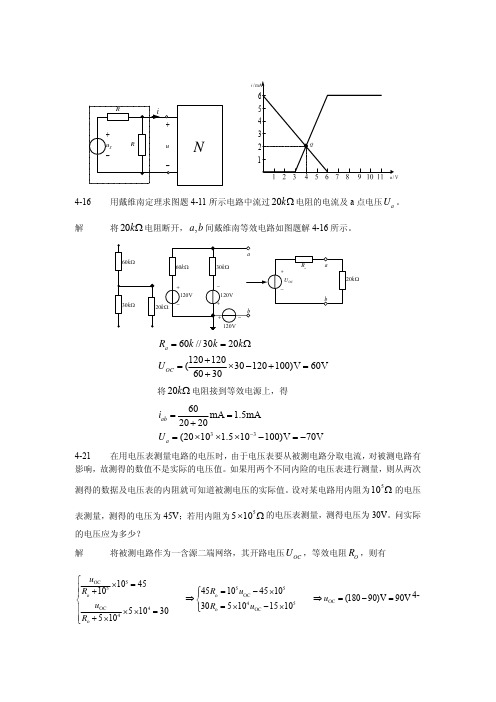
/i4-16 用戴维南定理求图题4-11所示电路中流过20k Ω电阻的电流及a 点电压。
a U 解将电阻断开,间戴维南等效电路如图题解4-16所示。
20k Ω,a bk Ω60//3020120120(30120100)V 60V6030a OCR k k k U ==Ω+=×−+=+ 将电阻接到等效电源上,得20k Ω3360mA 1.5mA2020(2010 1.510100)V 70V ab a i U −==+=×××−=− 4-21 在用电压表测量电路的电压时,由于电压表要从被测电路分取电流,对被测电路有影响,故测得的数值不是实际的电压值。
如果用两个不同内险的电压表进行测量,则从两次测得的数据及电压表的内阻就可知道被测电压的实际值。
设对某电路用内阻为的电压表测量,测得的电压为45V ;若用内阻为510Ω5510×Ω的电压表测量,测得电压为30V 。
问实际的电压应为多少? 解将被测电路作为一含源二端网络,其开路电压,等效电阻OC U O R ,则有5OC 555o o OC OC 454OCo OC 4o 10451045104510(18090)V 90V 30510151051030510u R R u u u R u R ⎧×=⎪⎧+=−×⎪⎪⇒⇒=⎨⎨=×−×⎪⎪⎩××=⎪+×⎩−=4-28 求图题4-20所示电路的诺顿等效电路。
已知:12315,5,10,R R R =Ω=Ω=Ω。
10V,1A S S u i ==解对图题4-20所示电路,画出求短路电流和等效内阻的电路,如下图所示SC i对左图,因ab 间短路,故0,0i i α==,10A 0.5A 155SC i ==+ 对右图,由外加电源法,106ab R α=Ω− 4-30 电路如图题4-22所示。
第四章答案及第五章习题与答案

第四章筹资管理一、单项选择题1、C2、C3、D4、C5、C6、D7、C8、D9、B 10、A 11、B 12、D 13、A 14、A 15、C 16、D 17、D 18、C 19、C 20、B 21、B 22、C 23、D 24、C 25、A 26、C 27、B 28、C 29、C 30、A 31、A 32、A 33、B 34、D 35、C 36、C 37、B二、多项选择题1、AB2、ABCE3、AE4、BC5、ACD6、ABCD7、ABCD8、ACD9、BCE 10、ABC 11、AB 12、ABC 13、ABC 14、ABCD 15、ABCD 16、ACE 17、ABC 18、CDE 19、BDE 20、AC 21、AB 22、AC 23、ABC 24、ABCE 25、AC 26、BCD 27、ABE 28、CDE 29、ACDE 30、ABCDE 31、ABC 32、BD 33、ACE三、判断题1、×2、×3、×4、×5、×6、×7、√8、√9、×10、√11、√12、×13、√14、×15、√16、√17、√18、√19、×20、×21、√22、√四、计算题1、方案一:债券成本=6%,股票成本=8.4%,综合资本成本=7.2%方案二:长期借款成本=6%,优先股成本=18%,综合资本成本=8.4%应采用方案一。
2、(1)200万元(2)100万元(3)DOL=2 DFL=1.28 DTL=2.563、DFL=1.25 DOL=2 息税前利润增长率=2×10%=20%今年息税前利润=500×10%×(1+20%)=60万元4、(1)10%(2)12%(3)16%5、无差别点EBIT=132万元,增资后EBIT=200万元大于132万元,故采用B方案。
6、债券成本=547%,优先股成本=1031%,普通股成本=155%综合资本成本=1129%大于资产收益率10%,故该筹资方案不可行。
大学计算机课程 操作系统习题解答

习题及参考答案
第1章习题及参考答案
3.简述操作系统的五大管理的主要功能。 简述操作系统的五大管理的主要功能。
存储器管理的主要功能包括:内存分配、地址映射、内存 保护和内存扩充。处理机管理的功能包括:作业和进程调度、 进程控制和进程通信。设备管理的主要功能包括:缓冲区管理、 设备分配、设备驱动和设备无关性。文件功能应包括:文件存 储空间的管理、文件操作的一般管理、目录管理、文件的读写 管理和存取控制。现代操作系统向用户提供图形界面、命令界 面、程序界面三种类型的界面。
习题及参考答案
第1章习题及参考答案
5.什么是批处理系统、分时系统和实时系统?它们 什么是批处理系统、分时系统和实时系统? 各自有什么特征? 各自有什么特征?
批处理系统:操作员把用户提交的作业进行分类, 批处理系统:操作员把用户提交的作业进行分类 , 把一批 作业编成一个作业执行序列, 作业编成一个作业执行序列,由专门编制的监督程序自动一次 处理。其主要特征是:用户脱机使用计算机、成批处理、 处理。其主要特征是:用户脱机使用计算机、成批处理、多道 程序执行。 程序执行。 分时系统:把处理机的运行时间分成很短的时间片, 分时系统:把处理机的运行时间分成很短的时间片 , 按时 间片轮转的方式,把处理机分给各进程使用。 间片轮转的方式,把处理机分给各进程使用。其主要特征是: 交互性、多用户同时性、独立性和及时性。 交互性、多用户同时性、独立性和及时性。 实时系统:在被控对象允许( 规定) 实时系统:在被控对象允许 ( 规定 ) 的时间范围内做出响 应。其主要特征是:除具备分时系统的四大特征外,还具备实 其主要特征是:除具备分时系统的四大特征外, 时时钟管理、高可靠性、连续的人机对话和过载保护。 时时钟管理、高可靠性、连续的人机对话和过载保护。
习题答案(第4章~第6章)

《汽车机械基础》习题参考答案第4章金属材料的性能1.什么是金属的力学性能?根据载荷形式的不同,力学性能主要包括哪些指标?答:在外力作用下,材料所表现出来的一系列特性和抵抗破坏的能力称力学性能。
材料的力学性能指标分为强度、塑性、硬度,冲击韧性和疲劳强度等。
2.什么是弹性变形?什么是塑性变形?答:随着载荷的存在而产生、随着载荷的去除而消失的变形称为弹性变形。
载荷卸掉后形变不能恢复的变形称为塑性变形。
3.什么是强度?什么是塑性?衡量这两种性能的指标有哪些?各用什么符号表示?答:金属材料抵抗塑性变形或断裂的能力称为强度。
根据载荷的不同,可分为抗拉强度b ,抗压强度bc、抗弯强度bb、抗剪强度b和抗扭强度t等几种。
断裂前金属材料产生永久变形的能力称为塑性,用延伸率和断面收缩率来表示。
4.什么是硬度?HBS、HBW、HRA、HRB、HRC各代表什么方法测出的硬度?答:材料抵抗另一硬物压入其内的能力叫硬度,即受压时抵抗局部塑性变形的能力。
HBS布氏硬度(当用淬火钢球压头时)、HBW布氏硬度(当用硬质合金球时);HRA、HRB、HRC都是洛氏硬度,只是压头以及总载荷不同:压头分别是金刚石圆锥、1/16”钢球、金刚石圆;总载荷分别为60kgf、100kgf、150kgf。
5.下列硬度的写法是否正确?HBS150、HRC140、HRC70、HRB10、HRA79、474HBWHBS150错,改为150HBSHRC140错,HRC硬度范围为20~67HRB10错,HRB硬度范围为25~100HRA79错,改为79HRA474HBW对6.下列各种工件一般应采用何种硬度试验方法来测定其硬度值?(1)锉刀;(2)黄铜轴套;(3)硬质合金刀片;(4)渗碳合金钢;(5)供应状态的各种碳钢钢材。
答:(1)锉刀:用HRC试验测定;(2)黄铜轴套:用HRB试验测定;(3)硬质合金刀片:用HRA试验测定;(4)渗碳合金钢;用HRA试验测定;(5)供应状态的各种碳钢钢材:用HB试验测定;7.什么是冲击韧性?用什么符号表示?答:材料抵抗冲击载荷作用的能力称为冲击韧性。
钢结构习题5-6章参考答案

第5章 受弯构件14. 一简支梁,梁跨为7m,焊接组合工字形对称截面150mm 450mm 18mm 12mm ×××(图5-57),梁上作用有均布恒载(标准值,未含梁自重)17.1kN/m ,均布活荷载6.8kN/m ,距梁端2.5m 处,尚有集中恒荷载标准值60kN ,支承长度200mm ,荷载作用面距离钢梁顶面为120mm ,钢材抗拉强度设计值为2215N/mm ,抗剪强度设计值为2125N/mm ,荷载分项系数对恒载取1.2,对活载取1.4。
试验算钢梁截面是否满足强度要求(不考虑疲劳)。
解:截面积2A=1501824141210368mm ××+×=334150450138414323046144mm 1212××=−=x I3x W 1440000mm 2==xI h梁自重 32-67850kg/m 10368mm 10=81.4kg/m=0.814kN/m ××简支梁承受的均布恒载荷载标准值k (0.814+17.1)kN/m=17.9kN/m q =均布线荷载设计值y 1.217.9+1.4 6.8=31kN/m q =××集中荷载设计值y 1.26072kN p =×=(1)验算该简支梁的抗弯强度按y xx nx y ny+γW γW M M f ≤计算,取y 0M =。
集中恒荷载作用处有2x 317 4.512.572 2.531 2.5290.1kN m 272M ×=×+××−××=⋅ 跨中处2x 317 4.513.572 3.531 3.5721279.9kN m 272M ×=×+××−××−×=⋅受压翼缘的宽厚比:w 1b-t b 15012= 3.8t 2t 36−==取x 1.05γ=截面模量6y 22xx nx y ny 290.110+192.3N/mm 215N/mm 1.051440000γγ×==<=×M M f W W (满足) (2)验算抗剪强度 支座处剪力最大且317 4.572108.546.3154.8kN 27V ×=+×=+= 320715018(2079)20712840294mm 2S =××++××=322v w 154.810840294=33.5N/mm 125N/mm 32304614412VS f It τ××==<=×(满足) (3)局部承压强度集中力沿腹板平面作用于梁上翼缘,该荷载作用处未加加劲肋,应验算该处腹板计算高度上边缘的局部承压强度。
第4-6章 微生物皮肤病 习题及答案

第4章细菌性皮肤病一填空题1.脓疱疮临床上可分为__、__、__。
2.麻风的五级分类法为__、__、__、__、__。
3.__是麻风重要的传播方式。
4.脓疱疮多由__引起,亦可由__或__感染发病。
5.疖是由__引起的__和__的急性化脓性炎症。
二判断改错题1.引起脓疱疮的最常见病原菌是溶血性链球菌。
2.丹毒的病原菌为凝固酶阳性的金黄色葡萄球菌。
3.麻风患者是麻风杆菌的天然宿主,也是本病的唯一传染源。
4.麻风临床类型的差别是由机体免疫力、麻风杆菌量及类型演变所决定的。
总的趋势是:体液免疫水平和麻风杆菌量结核样型(TT)>界限类偏结核样型(BT)>中间界限类(BB)>界限类偏瘤型(BL)>瘤型(LL)。
5.皮肤结核病是由念珠菌引起的一种慢性传染病。
三选择题【A型题】1.在疖和痈,下列正确的是__。
BA.因化脓菌侵入皮下组织而发生B.反复发病者,应疑有糖尿病C.近卫淋巴结有疼痛、肿大者少见D.作为治疗原则,应早期切开排脓2.结核样型麻风的麻风菌素试验应为__。
BA.阴性B.阳性C.假阳性D.弱阳性E.个体有差异3.麻风患者皮肤感觉障碍,最开始表现是__。
AA.先失温觉(冷热觉)B.先失痛觉C.先失触觉D.节段性痛觉丧失E.同时丧失4.麻风患者发生兔眼是病变侵犯__。
CA.三叉神经B.眶上神经C.面神经D.桡神经E.耳大神经5.麻风杆菌进入人体是否引起发病以及发病的类型取决于__。
EA.麻风杆菌的毒力B.麻风杆菌的数量C.接触者创面的大小D.性别E.机体对麻风杆菌的抵抗力6.哪型麻风可在鼻粘膜查到抗酸杆菌__。
BA.未定类麻风B.瘤型麻风C.结核样型麻风D.界限类偏结核样型麻风E.以上都可查到7.各型麻风细胞免疫反应强度依序为__。
AA.TT>BT>BB>BL>LLB.LL>BL>BB>BT>TTC.BB>BT>TT>BL>LLD.BT>TT>BB>BL>LLE.BL>LL>BB>BT>TT(注:TT—结核样型麻风BT—界限类偏结核样型麻风BB—中间界线类麻风BL—界限类偏瘤型LL—瘤型麻风)8.麻风菌素试验强阳性表示__。
《S7-200_PLC基础教程》第2版部分习题参考答案

《S7-200 PLC 基础教程》第2版部分习题参考答案由于设计方法和设计思路的不同,程序设计的题目可能有多个答案,给出的答案仅供参考。
可以用PLC 或仿真软件检验设计的程序是否正确。
第2章习题答案题6的答案:转换后的数字量0~32 000对应的频率为4500~5500(单位为0.01Hz ),频率的计算公式为450032450003200045005500+=--NN f +=(0.01Hz)题7的答案:4~20mA 的模拟量对应于数字量6 400~32 000,即温度值−100~1 000(单位为0.1°C )对应于数字量6 400~32 000,根据上述比例关系,得出温度T 的计算公式为640032000)100(10006400)100(---=---N T 100)6400(25611100)6400(640032000)100(1000--=-----=N N T (0.1°C ) 可以用N =32 000和6 400来检验温度值是否为1 000和-100(单位为0.1°C )。
第3章习题答案题3的答案题2的答案题4的答案LD AN O AI LDNI A OLD NOT = I A SI LDN O ALD RI0.7I1.4I0.2I0.3I0.5I0.1Q0.3I1.0Q0.5, 1I1.2I1.3M2.4, 1LD O LPS AN A =LR D A =LPP I0.0M1.2I0.1T37Q0.3I0.5M2.2LDN O C 21ALD =Q2.4I0.4LDN O O LD AN A LD AI OLD ON C 22M1.3M3.5M2.1I0.4T21I0.2I2.7Q0.4ALD O I1.4EU S Q3.3, 1A M2.2TONT37, 100LPS LPP LPS LPP题6的答案I0.0 Q0.0I0.4Q 2.1I0.2I0.0Q 0.3I0.4I0.1M0.2M3.7I0.5I1.5M3.7IIPNOTI0.4SI 1Q 0.3题7的答案题8的答案I0.1I0.2I0.0I0.5I4.6Q 2.1Q 0.3M3.6I0.4I0.4R 125T37IN PTTO N 100ms题9的答案I0.1I2.7I0.5I0.7I0.3M0.1II0.4NOTI0.3M0.2IQ 0.4I2.5M3.530C UR PTC TUC 41N题10:I0.3的常开触点不能放在线圈的右边,梯形图中不能出现输入点的线圈,不能使用两个M0.2的线圈,立即赋值指令只能用于输出Q ,M0.8中的位地址不能大于7,立即输入触点只能用于输入位I ,M0.2的线圈不能直接连接在左侧母线上,T32是1ms 定时器,其常闭触点不能接在它自己的IN 输入端,T32无设定值。
《第四章 牛顿运动定律》试卷及答案_高中物理必修第一册_教科版_2024-2025学年

《第四章牛顿运动定律》试卷(答案在后面)一、单项选择题(本大题有7小题,每小题4分,共28分)1、1、一物体从静止开始,在水平面上受到一恒力作用,以下说法正确的是:A、物体的加速度会随着时间的增加而减小B、物体的速度会随着时间的增加而减小C、物体的位移会随着时间的增加而增大D、物体的位移会随着时间的增加而减小2、2、一个物体在水平面上受到两个力的作用,一个向左,一个向右,大小相等,方向相反,那么:A、物体一定处于静止状态B、物体的加速度一定为零C、物体的合力为零,但可能存在加速度D、物体的速度一定为零3、一个物体在水平地面上受到一个恒力F的作用,该物体沿直线做加速运动。
以下说法正确的是()A、物体的加速度与力F成正比,与物体质量成反比B、物体的加速度与力F成正比,与物体质量无关C、物体的加速度与物体质量成正比,与力F成反比D、物体的加速度与物体质量成反比,与力F成正比4、一个物体在光滑的水平面上,受到一个方向与物体运动方向成30°的恒力F的作用。
以下说法错误的是()A、物体在水平方向上的加速度与力F成正比,与物体质量成反比B、物体在垂直方向上的加速度为0,因为没有垂直方向上的力作用C、物体在斜方向上的合加速度小于30°方向上的分力产生的加速度D、物体在斜方向上的合加速度等于30°方向上的分力产生的加速度5、一个物体在光滑水平面上做匀速直线运动,下列说法正确的是:A、物体的加速度为零B、物体受到的合外力为零C、物体受到的摩擦力为零D、物体的速度为零6、一辆汽车以恒定功率启动,下列说法正确的是:A、汽车的速度越大,其加速度越大B、汽车的速度越大,其加速度越小C、汽车的速度越大,其功率越小D、汽车的功率与速度无关7、一个质量为2kg的物体,在光滑水平面上受到大小为8N的恒力作用,由静止开始运动。
根据牛顿第二定律,求该物体加速度的大小是多少?•A) 1m/s²•B) 2m/s²•C) 4m/s²•D) 8m/s²二、多项选择题(本大题有3小题,每小题6分,共18分)1、关于牛顿第一定律,以下说法正确的是:A、物体不受外力作用时,将保持静止状态或匀速直线运动状态。
《第四章 基本平面图形》试卷及答案_初中数学七年级上册_北师大版_2024-2025学年

《第四章基本平面图形》试卷(答案在后面)一、选择题(本大题有10小题,每小题3分,共30分)1、在下列图形中,哪一个不是由线段构成的?A. 正方形B. 圆形C. 三角形D. 矩形2、如果两条直线相交形成四个角,其中一个角是直角,那么其余三个角分别是:A. 一个锐角和两个钝角B. 三个直角C. 一个直角和两个锐角D. 一个钝角和两个锐角3、下列图形中,不属于平行四边形的是()A. 矩形 B、菱形 C、梯形 D、正方形4、已知平行四边形ABCD,对角线AC与BD相交于点O,若OA=5cm,OB=7cm,则OD 的长度为()A. 5cm B、7cm C、10cm D、14cm5、在以下选项中,哪一项正确描述了两条直线在同一平面上的关系?A. 平行B. 相交C. 重合D. 平行或相交或重合6、下列哪一个图形不是由线段组成的?A. 正方形B. 圆形C. 三角形D. 矩形7、在下列图形中,是轴对称图形的是()A. 等边三角形B. 等腰梯形C. 矩形D. 正五边形8、已知等腰三角形ABC中,底边BC=6cm,腰AB=AC=8cm,那么三角形ABC的周长是()A. 22cmB. 24cmC. 26cmD. 28cm9、在下列选项中,哪一项正确描述了线段、射线和直线之间的区别?A. 线段有两个端点;射线有一个端点,无限延伸;直线没有端点,双向无限延伸。
B. 线段和射线都有两个端点;直线没有端点,但只向一个方向无限延伸。
C. 线段有一个端点;射线有两个端点;直线没有端点,双向无限延伸。
D. 线段、射线和直线都没有端点,它们都向两个方向无限延伸。
10、给定平面上不重合的三个点A、B、C,如果通过这三个点中的任意两个可以画一条直线,那么最多能画出多少条不同的直线?A. 1B. 2C. 3D. 无数二、计算题(本大题有3小题,每小题5分,共15分)第一题:在直角坐标系中,点A(2,3)关于x轴的对称点为A’,关于y轴的对称点为B,关于原点的对称点为C。
高鸿业微观第七版第4,5,6,7章习题参考答案

第四章生产函数第一部分教材配套习题本习题详解一、简答题1. 如何准确区分生产的短期和长期这两个基本概念?生产的短期:指生产者来不及调整全部生产要素的数量,至少有一种生产要素的数量是固定不变的时间周期。
短期不可调整的生产要素称不变生产要素,一般包括厂房、大型设备、高级管理者、长期贷款等,可调整的生产要素成为可变生产要素,一般包括原材料、燃料、辅助材料、普通劳动者等。
生产的长期:指生产者可以调整全部生产要素的数量的时间周期。
生产的短期和长期是相对的时间概念,不是绝对的时间概念,其与企业所属行业、所用技术设备和规模等因素有关。
2.下面是一张一种可变生产要素的短期生产函数的产量表(表4—1):(1)在表中填空。
(2)该生产函数是否表现出边际报酬递减?如果是,是从第几单位的可变要素投入量开始的?—解答:(1)在表4—1中填空得到表4—2。
3.区分边际报酬递增、不变和递减的情况与规模报酬递增、不变和递减的情况。
解答:边际报酬变化是指在生产过程中一种可变要素投入量每增加一个单位时所引起的总产量的变化量,即边际产量的变化,而其他生产要素均为固定生产要素,固定要素的投入数量是保持不变的。
边际报酬变化一般包括边际报酬递增、不变和递减三个阶段。
很显然,边际报酬分析可视为短期生产分析。
规模报酬分析方法是描述在生产过程中全部生产要素的投入数量均同比例变化时所引起的产量变化特征,当产量的变化比例分别大于、等于、小于全部生产要素投入量变化比例时,则分别为规模报酬递增、不变、递减。
很显然,规模报酬分析可视为长期生产的分析视角。
区别:①前提条件不同,边际报酬变化生产要素分为不变和可变生产要素,生产要素比例发生变化;规模报酬分析研究生产要素同比例变动。
②考察时间长短不同。
边际报酬变化分析的是短期生产规律;规模报酬研究长期生产规律。
③指导意义不同。
边际报酬变化指出要按比例配置生产要素;规模报酬指出要保持企业的适度规模。
④由于前提条件不同,两规律独立发挥作用,不存在互为前提,互为影响关系。
计算机体系结构1-6章习题答案

1 2 3 4 5 6
8 16 24 32 40 48
1*82
2*82 3*82 4*82 5*82 6*82 7*82
4/8 5/8 6/8
7/8
7
56
2)规格化浮点数表: rm=2时,规格化浮点数共有4*8=32个 rm=8时,规格化浮点数共有7*8=56个,在[0.5,112]中, 有数19个(上表中红的数字表示)。
§4通道(CH)
一、CH的基本工作原理 CH执行CH程序的过程 CH的任务 二、CH流量计算和时空图绘制 CH的类型 CH流量计算 字节多路CH响应处理时空图的绘制 1)计算每个子CH提供一个字节时间(1/f) 2)画出一个完整申请周期时空图 3)计算字节多路CH对每个字节响应的最长用时
第一章参考答案: 1.应用语言级 高级语言级 汇编语言级 操作系统级 机器语言级 微程序语言级。 2. 从上而下 从下到上 专用机 通用机 3. 软、硬件交界面 计算机系统的性能/价格比 4 . 1 T FLOPS 的计 算能力 1 TBy te 的 主存容量 1 TByte/s 的I/O带宽 5. 虚拟机 实际机器 6. 统一高级语言 模拟 仿真 系列机 7. 控制流 数据流 SISD SIMD MISD MIMD 8. 汇编语言程序员 9. 任务单一化 操作重叠化 吞吐匹配化 程序多道 化
嵌套
中断处理程序 一 二 三 响② 嵌套 四 五
t
返回主程序
例4 解 (1)处理顺序为 2-3-1-5-4 (2)中断响应处理时空图 中断请求 主程序 ①③ ②③④⑤
嵌套
中断处理程序 一 二 三 四 五
响① 嵌套
t
返回主程序
1 分别利用两级描述符和三级描述符描述下列阵列数
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、 描述核外电子运动的四个量子数中,________是原子轨道能级的主要参数,________是描述原子轨道或电子云的不同形状的参数。
2、络合物[Co(NH 3)6]Cl 2 中心离子是________, 配位数是_____,配体的配位原子是_____。
3、H 2O 分子采用的杂化类型是 。
4.、分子间力有 , , , 。
5、BF 3分子中中心原子的杂化轨道类型为:
6、配合物K 3[Fe(CN)5(CO)]中配离子的电荷数为 ,配离子的空间构型 ,配位原子为 ,中心离子的配位数 。
7、 BF 3分子的空间构型是 ,B
是 。
8、第35号元素溴核外电子构型为 1s 2
2s 2
2p 6
3s 2
3p 6
3d 10
4s 2
4p 5
为____4s 2
4p 5
_____,元素位于___四___周期,___ⅦA___族。
9.主量子数n=3时,角量子数l 可取 0,1,2 ;磁量子数m 可取 0,±1,±3 。
10、 半导体的能带结构,与绝缘体的主要差别在于其禁带 较窄 ,导体能带结构的特征是存在 未满 带。
应用最广的单质半导体是 Si, 和 Ge ,化合物半导体是 GaAs 。
11、(本题四分)已知BeCl 2、BF 3、SiCl 4三种分子的电偶极矩都等于零,试填下表:
1、 下列量子数组合中,原子轨道符号为2p 的是( )
A. n =3,l =0,m =0
B. n =4,l =2,m =0
C. n =5,l =1,m =1
D. n =2,l =1,m =1
2、化合物[Co(NH 3)4Cl 2]Br 的名称是: ( )
A.溴化二氯四氨钴酸盐(Ⅱ)
B.溴化二氯四氨钴酸盐(Ⅲ)
一、填空题:(每空1分,共18分)
二、单选题:(每题2分,共30分)
C.溴化二氯四氨合钴(Ⅱ)
D.溴化二氯四氨合钴(Ⅲ)
3、下列含氢的化合物中含有氢键的是( D. )
A. H cl
B. CH4
C. H2S
D. HF
4、氧原子具有顺磁性可归因于.......................................。
( C. )
A.沸点极低; B. 与铁易化合; C. 有三电子 键; D. 键级为2。
5、CCl4分子之间的相互作用力有……………………………( D )
A.氢键B.取向力C.诱导力D.色散力
6、某元素位于第四周期,其副量子数等于2的轨道内电子数为半充满,则该元素为( D )。
A: Cu;B: K;C: Br;D: Cr
7、下列说法错误的是…………………… ( C )
A.分子构型中以sp3杂化轨道成键的是正四面体型;
B.半导体和绝缘体的区别在于禁带宽度不同;
C.非极性分子中的化学键一定是非极性键;
D.聚集状态相同的物质构成的系统不一定是单相系统;
8、根据核外电子排布规则,可以肯定的是:()
A. 原子的价层电子数不超过8
B. 周期数等于基态原子的能级最高轨道的主量子数
C. 族数等于基态原子的价层电子数
D. 一个原子中,没有两个电子具有四个完全相同的量子数
三、判断题:(每题1分,共10分)
1、微观粒子具有波粒二象性。
()
2、配位离子的空间构型和稳定性主要决定于杂化轨道的类型和数目。
()
3、配合物的磁性大小与物质内部成单电子数有关。
()
4、主量子数n=3时,有3s、3p、3d、3f等四种原子轨道。
()
5、多电子原子轨道的能级只与主量子数n有关。
()
6、 C和H形成CH4时,是H原子的1s轨道和C原子的3个2p轨道杂化形成4个SP3杂化轨道成键的。
( )
7、波函数描述核外电子在固定轨道中的运动状态。
( )
8、在CCl4、CHCl3、CH2Cl2分子中,碳原子都采取sp3杂化,因此这些分子都呈正四面体构型。
( )
9、P原子轨道呈“8”字形,说明核外电子运行轨迹是“8”字形。
( )
10、主量子数n=3时,有3s、3p、3d、3f等四种原子轨道。
()
11、P区元素最后填充的是p电子。
四、简答题:(每题5分,共15分)
1、简述核外电子排布需遵循的的三条原则。
(5分)
2、同周期元素的原子半径大致有什么递变规律?怎么解释?(5分)
同周期主族元素自左至右原子半径明显递减,同周期副族原子半径也同向减少,但减少缓慢。
(3分)这是因为,按照斯莱特规则,同周期主族元素从左至右每增加一个核电荷数,原子外层的有效核电荷数增加0.65,而副族元素只增加0.15,所以副族元素原子半径收缩较主族元素慢。
(2分)
3、已知某元素原子的外层电子构型为3d104s1,试写出其电子构型、原子序数,判断它为第几周期,第几族?属于元素周期表中的哪一区?
解:其电子构型为:1s22s22p63s23p63d104s1原子序数:29号元素第四周期ⅠB族 ds区
4. 简述电解法精炼铜的基本原理。
(5分)
电解法精炼铜时,以粗铜为阳极,发生氧化反应变成Cu2+,(2分)以纯铜为阴极,
为电解液。
(1分)
Cu2+在阴极上发生还原反应变成Cu,(2分)以CuSO
4
5.已知某铜锌原电池的电动势为1.06V,并已知其中[Cu2+]=0.02 mol·L-1,请问该原电池中[Zn2+]为多少?已知(Zn2+/ Zn) = -0.76V,(Cu 2+/ Cu) = 0.34V。
(8分)
4.(8分)已知E(Ag+/Ag) = +0.7991V, 在含有Ag+/Ag电对体系中, 加入NaCl溶液, 使溶液中c(Cl-) = 1.00 mol L-1, 计算E(Ag+/Ag)。
(2(2分)
(2分)
(2分)。
