羟基结构及性质ppt课件
羟基类、羰基类比较

芳香醇
酚
CH 3CH 2OH C6 H 5 CH 2OH C6 H 5 OH -OH -OH -OH
-OH 与链烃基 相连
-OH 与芳烃侧
链相连
-OH 与苯环直 接相连
(1)弱酸性 (2)取代反应 (3)显色反应
( 1 )与钠反应( 2 )取代反应 ( 3 )脱水反应( 4 )氧化反应 (5)酯化反应 红热铜丝插入醇中有刺激性气 味(生成醛或铜)
加 成 消 去 加 水
NaOH
R’ OH
(NaOH △)
R ’ CH2=CH2
卤代烃、醇、醛、羧酸、酯是怎样相互转化的?
叙述工业上或实验室实现相互转化的方法。
1、与银氨溶液反应 水浴加热 CH3CHO+2[Ag(NH3)2]++2OH CH3COO-+NH4++2Ag+3NH3+H2O 2、与新制的氢氧化铜反应
3.设置问题情境,培养学生良好的思维模式 醇 (1) CH3CH2—CH—CH3+NaOH △ Br 思维: 醇 ①CH3Br+NaOH △ 醇 ②CH2=CH—CH—CH3+NaOH △ Br
浓硫酸 ③CH3—CH—CH2CH3 △ OH
+ H ④CH3—CH=CH2+H2O
(2)分子式为 C6H14O的醇A经催化氧化得一分子 式为C6H12O的有机物B,已知B能发生银镜反应, 则写出A可能的结构简式_________________ 伯醇(—CH2OH)
三溴苯酚
苯酚与溴的取代反应比苯、甲苯易进行
酚羟基对苯环的影响使苯环上的氢原子变得活 泼、易被取代
羟基性质及脱水反应

羟基官能团的性质与有机物的脱水反应倪小重2012.09.04教学目标:使学生进一步理解羟基官能团的结构和主要反应,掌握羟基的各种脱水反应原理。
能力培养:通过复习归纳,使知识在头脑中有序贮存,提高迁移、转换、重组及分析、归纳的能力。
科学方法:讨论、归纳发散思维。
重点、难点通过羟基官能团的复习,掌握一些有机物脱水反应的原理。
教学过程设计教师活动【引言】我们学习各类重要的有机化合物,必须紧紧抓住物质的结构特征,特别是官能团的结构。
从官能团着手,理解物质的性质。
今天,我们复习羟基的性质及有机物的脱水反应。
【板书】一、羟基的性质:学生活动明确复习的内容。
领悟、思考。
【设问】我们知道醇、酚、羧酸分子结构中都有共同的官能团--羟基。
想一想:O-H键属哪一种类型的键?这三类物质中氢原子的活泼性有什么不同?而不同的原因又是怎样造成的?请举例分析说明。
思考回答:羟基中O-H键是一个强极性键,其中氢原子都具有一定的活泼性。
例如:都可以与金属钠等活泼金属反应,但它们的剧烈程度不同,反应最剧烈的是酸,其次是酚、醇。
造成氢原子的活泼性不同的原因是由于与羟基相连的基因吸引电子能力不同,由于吸引电子的能力是羰基>苯环>烷烃基。
因此,羧酸的羟基中氢的活泼性最大,具有弱酸性;与苯环相连的羟基中的氢活泼性次之,酚具更弱的酸性;醇的羟基中氢的活泼性最小,醇不显酸性。
【评价】对学生的回答给予肯定。
【投影】下列反应能否发生,能反应的请完成反应的化学方程式。
乙醇与金属钠苯酚与金属钠乙醇与氢氧化钠苯酚与氢氧化钠醋酸与碳酸钠苯酚与碳酸钠同学回答并到黑板上书写。
2C2H5OH+2Na→2C2H5ONa+H22C6H5OH+2Na→2C6H5ONa+H2C2H5OH+NaOH→不反应C6H5OH+NaOH→C6H5ONa+H2O2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2OC6H5OH+Na2CO3→C6H5ONa+NaHCO3【小结】(1)键断裂,可提供H+,使之与Na或NaOH反应,但由于与羟基相连的基团吸引电子的能力不同,其提供H+的能力有很大区别。
有机化学 第10章 羟基酸和羰基酸

9
7
5
3
1
COOH
10
11
13
15
17
19
前列腺(烷)酸
前列腺素可分为PG A、B、C、D、E、F、G 、H及I九型。它们彼此间的区别是五碳环上的 取代基及双键位置不同。体内PG A、E及F较多 。根据侧链R′及R″所含双键的数目而分为1、2 、3类。又根据五碳环上9位-OH基的立体构型而 分为α 及β 两型;α -型用虚线表示,β -型用实 线表示。天然前列腺素均为α -型,不存在β -型 。支链上手性碳原子的立体构型用R或S表示(S 用虚线,R用实线);链上C=C的构型用Z或E 表示。
O R'
O R'
O R'
OH
R'
R''
R''
OH
R''
OH
R''
A
B
E
F
O
C
O
OH
H O H
O
H
11(α ),15(S)-二羟基-9-酮基-5(Z),13(E)前列二烯酸Leabharlann O HC O O HH
O H
O
H
9(α),11(α),15(S)-三羟基-13(E)前列烯酸
10.8 酮型-型互变异构
乙酰乙酸乙酯 Ethyl Acetoacetate
NH3 HOOCCH2CH2COCOOH + H3C CH COO
a-酮戊二酸 丙氨酸
+
GPT
NH3 OOCCH2CH2CHCOO
谷氨酸
+
+
O H3C C COOH
第八组 羟基的化学性质

水分子中的两个氢原子均被烃基取代的化合物称为醚。 醚类化合物都含有醚键。醚是由一个氧原子连接两个 烷基或芳基所形成,醚的通式为:R–O–R。它还可看 作是醇或酚羟基上的氢被烃基所取代的化合物。醚类 中最典型的化合物是乙醚,它常用于有机溶剂与医用 麻醉剂。醚类化合物的应用常见于有机化学和生物化 学,它们还可作为糖类和木质素的连接片段。
羟基直接和苯的sp2 杂化碳原子相连的分子称为酚, 这种结构与脂肪烯醇有相似之处,故也会发生互变异 构,称为酚式结构互变。但是,酚的结构较为稳定, 因为它能满足一个方向环的结构,故在互变异构平衡 中苯酚是主要存在形式。
酚类化合物种类繁多,有苯酚、甲酚、氨基酚、 硝基酚、萘酚、氯酚等,而以苯酚、甲酚污染最突出。 苯酚简称酚,又名石炭酸,微酸性(腐蚀性),常温下 能挥发,放出一种特殊的刺激性臭味,在空气中变粉 红色。
醇羟基不是一个好的离去基团,需要酸的帮助, 使羟基质子化后以水的形式离去。各种醇的反应性为 3°>2°>1°,三级醇易反应,只需浓盐酸在室温振 荡即可反应,氢溴酸在低温也能与三级醇进行反应。 如用氯化氢、溴化氢气体在0℃通过三级醇,反应在 几分钟内就可完成,这是制三级卤代烷的常用方法。
在氢卤酸中,氢碘酸酸性最强,氢溴酸其次,浓盐酸 相对最弱,而卤离子的亲核能力又是I->Br->Cl-,故氢 卤酸的反应性为HI> HBr>HCl。若用一级醇分别与这三 种氢卤酸反应,氢碘酸可直接反应,氢溴酸需用硫酸 来增强酸性,而浓盐酸需与无水氯化锌混合使用,才 能发生反应。氯化锌是强的路易斯酸,在反应中的作 用与质子酸类似。
2.与卤化磷反应 醇与卤化磷反应生成卤代烷。
醇羟基是一个不好的离去基团,与三溴化磷作用 形成CH3CH2OPBr2,Br进攻烷基的碳原子,-OPBr2作 为离去基团离去。- OPBr2中还有两个溴原子,可继续 与醇发生反应。
有机化学课件——Chapter 10 羟基酸和酮酸

第十章 羟基酸和酮酸
Hydroxy Acids and Keto Acids
1
导言
¾ 取代羧酸: 羧酸分子中烃基上的氢原子被其他原子或官能团取代 后的化合物.
¾ 常见取代羧酸: 卤代酸、羟基酸、氧代酸(酮酸)和氨基酸.
R CH COOH
X
卤代酸(halogeno acid)
烯醇型分子存在的条件
OO CH3CCH2COCH2CH3
酮型(93%)
H
O
O
C
C
CH2CH3
H3C
CH
O
烯醇型(7%)
分子中的亚甲基氢受两个吸电子基团影响而酸性增强。 形成烯醇型产生的双键应与羰基形成π-π共轭,使共 轭体系有所扩大和加强,能量有所降低。 烯醇型可形成分子内氢键,构成稳定性更大的环状螯合物。
NADH + H+
NAD+ + H2O
NH3+
HOOCCH2CH2COCOOH + NH3 α -酮戊二酸
谷氨酸脱氢酶
-OOCCH2CH2CHCOO谷氨酸
有机化学课件
31
第10章 羟基酸和酮酸
4. 酶催化下醇酸和酮酸的相互转化
OH
苹果酸脱氢酶
HOOCCH2CHCOOH
苹果酸
O HOOCCH2CCOOH
O
= =
OH HO-C
R-CH +
HC-R
C OH HO
-2H2O △
O
¾ β-醇酸分子内脱水成共轭烯酸
O
O=
R-CH C
交酯
O=C CH-R
O
CH3CH2CHCH2COOH OH COOH H OH
羟基结构及性质

醇的脱水反应
01
02
03
分子内脱水
在加热条件下,醇可以在 分子内发生脱水反应生成 不饱和键。
分子间脱水
在加热条件下,两个醇分 子之间可以发生脱水反应 生成醚。
消除反应
在加热条件下,醇可以发 生消除反应生成烯烃。
04
羟基的应用
醇在工业上的应用
溶剂
醇类化合物是常见的工业 溶剂,可用于溶解和稀释 其他物质。
燃料添加剂
醇可作为燃料添加剂,提 高燃料的辛烷值和燃烧效 率。
化工原料
醇是许多化工产品的原料, 如塑料、合成橡胶、涂料 等。
醇在生物体内的角色
代谢中间体
醇在生物体内是许多代谢反应的中间体,如糖酵 解和三羧酸循环。
生物活性物质
某些醇类化合物具有生物活性,如乙醇(酒精) 和固醇类激素。
溶剂
醇在生物体内作为溶剂,帮助溶解和运输其他物 质。
团取代。
羟基的亲核性与溶剂有关,在 极性溶剂中,羟基的亲核性较 强,而在非极性溶剂中,羟基
的亲核性较弱。
羟基的氧化性
羟基可以被氧化成醛、 酮、酸等化合物。
在常温下,醇可以在 酸性条件下被高锰酸 钾等强氧化剂氧化成 酮或酸。
羟基的氧化性与氧化 剂的种类和浓度、温 度、压力等条件有关。
03
羟基的反应
醇的氧化反应
氧化生成酮
氧化生成羧酸
在催化剂的作用下,醇的α-H可以被 氧化生成酮。
在催化剂的作用下,醇可以被完全氧 化生成羧酸。
氧化生成醛
在催化剂的作用下,醇的α-H可以被 氧化生成醛。
醇的酯化反应
与羧酸反应
01
醇可以与羧酸பைடு நூலகம்应生成酯。
与酸酐反应
第九章 羟基酸 酮酸

酮式(92.5%)
烯醇式(7.5%)
互变异构现象 互变异构体
52
CH3
O O C CH2 C OC2H5
Br2/CCl4
CH3
OH O C CH C OC2H5
FeCl3溶液
CH3
OH H C C
Br Br
O C OC2H5
紫红色络合物
酮式和烯醇式互变的本质是α-H 的转移
53
烯醇型结构能稳定存在的条件:
48
1863年 Geuther 提出烯醇式结构
OH C O C H C OC2H5 H3C
1865年 Frankland 提出酮式结构
O C H3C H2 C O C OC2H5
1911年 Knorr
-78℃ 得到酮式晶体, 分离得到 烯醇式油状物。
49
1.与氢氰酸、亚硫酸氢钠加成,与羟胺、
苯肼试剂生成肟或腙。
对-羟基苯甲酸
8
三、羟基酸的物理性质(了解)
四、羟基酸的化学性质(掌握)
(一)醇酸的化学性质
共性:羟基酸具有羟基和羧基的典型反应。
特性:反应产物常根据羟基和羧基的相对位置
不同而有所不同。
9
1.酸性
CH3CH2CH2COOH pKa 4.83 CH3CH2CHCOOH OH 3.65 CH3CHCH 2COOH OH 4.41
16
维生素C分子结构
17
4. α-醇酸的分解反应
R-CH-COOH OH 稀硫酸 △
R-C-H + HCOOH O
醛
R 稀硫酸 R-C-COOH △ OH
R-C-R + HCOOH O
酮
18
(二)酚酸的化学性质
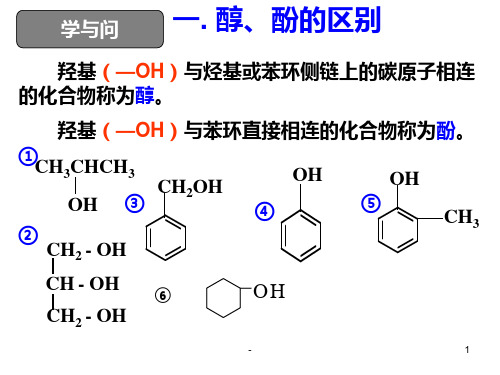
羟基(OH)与烃基或苯环侧链上的碳原子相连的化合物称...PPT课件
下列物质中,能使铜丝变红,且质量仍为m
g的是
BE
A.盐酸
B.酒精
C.稀硝酸
D.浓硫酸 E .CO
延伸:铜丝先放在外焰烧,后放在内焰烧,现象?
-
18
• 3.一元醇
A CH3OH
B
CH3
CH3
C
CH3
OH
C
CH3
CH2OH D C H 3 C
CH2OH
E
CH3
CH3 C
CH2 CH3
F
CH3 CH3 OH
中提取乙醇?如何检验是否还含有水?
3、能用乙醇萃取碘水中的碘吗?为什么?
-
5
醇的化学性质和应用
• 乙醇的化学性质——取代反应
(1)与活泼金属的反应 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 其它活泼金属如钾、钙、镁等也可与乙醇反应
2CH3CH2OH+Mg→(CH3CH2O)2Mg+H2↑
H2O
结论:①醇分子间脱水得到醚。
②可以是相同的醇,也可以是不相同的醇。
练习:CH4O和C3H8O在浓硫酸加热的条件 下可以得到的产物有多少种?
解析: CH4O只能是CH3OH,而C3H8O有 两种1-丙醇、2-丙醇。然后考虑分子内脱水:
有一种;分子间脱水:有6种。
-
9
2)氧化反应
①燃烧
燃烧时产生淡蓝色的火焰,可作燃料
0.7893g/cm3 ❖溶解性:跟水以任意比互溶
能够溶解多种无机物和有机物
❖挥发性:易挥发
-
4
束
小知识:
含乙醇99.5%以上的酒精叫做无水酒精。 制取无水酒精时,通常需要把工业酒精(乙醇体积 含量96%)跟新制的生石灰混合,加热蒸馏才能制得
羟基性质及脱水反应

羟基官能团的性质与有机物的脱水反应倪小重2012.09.04教学目标:使学生进一步理解羟基官能团的结构和主要反应,掌握羟基的各种脱水反应原理。
能力培养:通过复习归纳,使知识在头脑中有序贮存,提高迁移、转换、重组及分析、归纳的能力。
科学方法:讨论、归纳发散思维。
重点、难点通过羟基官能团的复习,掌握一些有机物脱水反应的原理。
教学过程设计教师活动【引言】我们学习各类重要的有机化合物,必须紧紧抓住物质的结构特征,特别是官能团的结构。
从官能团着手,理解物质的性质。
今天,我们复习羟基的性质及有机物的脱水反应。
【板书】一、羟基的性质:学生活动明确复习的内容。
领悟、思考。
【设问】我们知道醇、酚、羧酸分子结构中都有共同的官能团--羟基。
想一想:O-H键属哪一种类型的键?这三类物质中氢原子的活泼性有什么不同?而不同的原因又是怎样造成的?请举例分析说明。
思考回答:羟基中O-H键是一个强极性键,其中氢原子都具有一定的活泼性。
例如:都可以与金属钠等活泼金属反应,但它们的剧烈程度不同,反应最剧烈的是酸,其次是酚、醇。
造成氢原子的活泼性不同的原因是由于与羟基相连的基因吸引电子能力不同,由于吸引电子的能力是羰基>苯环>烷烃基。
因此,羧酸的羟基中氢的活泼性最大,具有弱酸性;与苯环相连的羟基中的氢活泼性次之,酚具更弱的酸性;醇的羟基中氢的活泼性最小,醇不显酸性。
【评价】对学生的回答给予肯定。
【投影】下列反应能否发生,能反应的请完成反应的化学方程式。
乙醇与金属钠苯酚与金属钠乙醇与氢氧化钠苯酚与氢氧化钠醋酸与碳酸钠苯酚与碳酸钠同学回答并到黑板上书写。
2C2H5OH+2Na→2C2H5ONa+H22C6H5OH+2Na→2C6H5ONa+H2C2H5OH+NaOH→不反应C6H5OH+NaOH→C6H5ONa+H2O2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2OC6H5OH+Na2CO3→C6H5ONa+NaHCO3【小结】(1)键断裂,可提供H+,使之与Na或NaOH反应,但由于与羟基相连的基团吸引电子的能力不同,其提供H+的能力有很大区别。
羟基的性质作用课件

CHAPTER
羟基的制备方法
通过醇的氧化制备
总结词
详细描述
通过醛的还原制备
总结词
详细描述
醛的还原制备羟基通常使用氢气、金 属氢化物或醇铝等还原剂,将醛还原 为醇。其中,氢气是最常用的还原剂 之一,反应条件温和,产物纯净。
通过其他化合物的转化制备
总结词
详细描述
CHAPTER
羟基的应用实例
在药物合成中的应用
的负担。
WATCHING
羟基是醇类物质的基本组成单位,能够影响有机化合物的物理性质和化学性质。 羟基可以与其它官能团发生反应,如脱水反应、氧化反应等,生成新的有机化合物。
羟基可以形成氢键,影响化合物的溶解度、沸点和粘度等性质。
在生物化学中的作用
羟基在生物体内发挥着重要的生 理功能,如参与代谢反应、维持
酸碱平衡等。
某些生物活性物质,如激素、维 生素等,含有羟基,能够调节生
物体的生理活动。
羟基能够与其它生物分子相互作 用,如与蛋白质、核酸等结合,
影响生物分子的结构和功能。
在工业生产中的应用
羟基在化工生产中广泛应用, 如合成醇类、酚类等有机化合物。
羟基可以用于制造表面活性剂、 涂料、粘合剂等工业产品。
羟基可以用于水处理、环保等 领域,如去除水中的有害物质、 降低废水的酸性或碱性等。
农业领域
研究羟基化合物在农药和植物生长调 节剂中的应用,提高农作物的产量和 品质。
对环境友好性的改进
降低能耗
优化羟基化合物的生产工艺,降 低能源消耗,实现低碳化生产。
减少废弃物排放
改进生产过程中的废弃物处理技 术,降低废水、废气和废渣的排
放。
循环利用
推动羟基化合物的循环利用,实 现资源的有效利用和减少对环境
三种羟基的区别和应用

加入足量金属钠; ⑤通入过量的二氧化碳; ⑥
加入足量的氢氧化钠溶液; ⑦ 加入足量的三
氯化铁溶液; ⑧加入乙醇与浓硫酸混合加热.
其合理的步骤程序为( )
A. ④⑤③
B. ⑥①⑤③
C. ⑧①
D. ⑧②⑤③
例题2解析:
练习题2
设计一个实验:除去乙醇中的乙酸.写出操 作的主要步骤.
①加CaO ;②蒸馏。
一条侧链:
两条侧链:
练习题1
今有化合物甲:
乙:
丙:
(1)请写出丙中含氧官能团的名称
;
(2)请判别上述哪些化合物互为同分异构体的是
;
(3)请分别写出鉴别甲.乙.丙化合物的方法(指明所选 试剂及主要现象)
鉴别甲的方法
;
鉴别乙的方法
;
鉴别丙的方法
.
2.物质的提纯
例题2.欲从苯酚的乙醇溶液回收苯酚,有下列操作:ຫໍສະໝຸດ ①蒸馏; ②过滤; ③ 静置分液; ④
热点试剂 溴水
………
有机物结 构与性质 推测
①烯.炔加成反应 ②酚取代 ③氧化醛基 ④液态烃萃取
………
注:找例题和练习题各1个,并附有答案.
mol.
4.某有机物结构简式为右
式,现有等量的该有机物分别
与钠.氢氧化钠溶液.新制氢氧
化铜悬浊液三种物质反应的物
质的量之比为
练习题3解析
练习题4解析
4.有机合成
例题4.以1-丙醇为主要原料(其它原料
自选)制取
写出
有关反应的化学方程式并注明反应类型.
〔例题4解析〕采用"逆推法"
例题4解答
练习题5
代表 电离 酸性 与钠 与NaOH 与Na2CO3 与NaHCO3
羟基结构及性质ppt课件

4.可发生置换反应,醇羟基与金属钠反应置 换了羟基中的氢原子,生成了氢气。
5
羟基的还原性
具有还原性,可以被氧化成醛、酮或酸; 一级醇及二级醇与醇羟基相连的碳
原子上有氢, 三级醇与醇羟基相连的碳原子上没
有氢,不易被氧化,
6
羟基的弱酸性
醇羟基——不体现酸性(阿伦尼乌斯酸碱理论中), 酚羟基和羧羟基——体现弱酸性(因而苯酚可与钠反
-C,因为能生成稳定烯烃。该规则称8
羟基的置换反应
9
羟基的消去反应
10
羟基的取代反应
与氢卤酸的反应生成卤代烷
氢卤酸与醇反应生成卤代烷,反应中醇羟基被卤原子取代。
ROH+HX——>RX+H20 醇与卤化磷反应生成卤代烷
醇羟基是一个不好的离去基团,与三溴化 磷作用形成 CH3CH2OPBr2,Br进攻烷基 的碳原子,-OPBr2作为离去基团 离去。OPBr2中还有两个溴原子,可继续与醇发生11 反
羟基的取代反应
12
物质 结构简式
羟基的性质 羟基中
氢原子 的活泼
性
酸性
与金
属Na 反应
与
NaOH
反应
乙醇
CH3CH2OH
苯酚
增
C6H5OH
强
乙酸 CH3COOH
中性 能 不 能
比能H2CO能3还弱能 能
与
Na2CO3
反应
-OH
羟基、羟
不能 基氢均可
被取代
羟基难取 代、羟基
能 氢能电离
-H易电离 羟基可取 代
羟基的结构和性质
高中有机化学
1
“羟”的由来
三种羟基的区别和应用

1.物质鉴别 物质鉴别
例题1.某芳香烃衍生物的分子式为 例题 某芳香烃衍生物的分子式为C7H8O,根 某芳香烃衍生物的分子式为 根 据下列实验,确定其结构简式 确定其结构简式. 据下列实验 确定其结构简式 (1)若该有机物不能与金属钠反应 则结构简式 若该有机物不能与金属钠反应,则结构简式 若该有机物不能与金属钠反应 为 ; (2)若该有机物遇三氯化铁溶液显色 则其可能 若该有机物遇三氯化铁溶液显色,则其可能 若该有机物遇三氯化铁溶液显色 的结构简式 . 为 (3)若该有机物遇三氯化铁溶液不显色 但与金 若该有机物遇三氯化铁溶液不显色;但与金 若该有机物遇三氯化铁溶液不显色 属钠反应放出氢气,则其结构简式为 . 属钠反应放出氢气 则其结构简式为
三种羟基的区别和应用
三种羟基的化学性质比较
醇羟基(乙醇 醇羟基 乙醇) 乙醇 1.与钠反应 与钠反应 2.催化氧化 催化氧化 3.脱水 脱水 (1)分子内脱水 分子内脱水 (2)分子间脱水 分子间脱水 ①成醚 ②成酯 ③成卤代烃 酚羟基(苯酚 酚羟基 苯酚) 苯酚 1.酸性 酸性 2.取代反应 取代反应 3.显色反应 显色反应 4.氧化反应 氧化反应 5.酚醛缩聚 酚醛缩聚 羧羟基(乙酸 羧羟基 乙酸) 乙酸 1.酸性 酸性 2.酯化反应 酯化反应
例题3解析 例题 解析: 解析
练习题3 练习题
3.已知某有机物的结构简式如下 已知某有机物的结构简式如下: 已知某有机物的结构简式如下
取1mol该有机物与足量的 该有机物与足量的NaOH溶液混合共 溶液混合共 该有机物与足量的 充分反应最多可消耗NaOH mol. 热,充分反应最多可消耗 充分反应最多可消耗 4.某有机物结构简式为右 某有机物结构简式为右 式,现有等量的该有机物分别 现有等量的该有机物分别 与钠.氢氧化钠溶液 氢氧化钠溶液.新制氢氧 与钠 氢氧化钠溶液 新制氢氧 化铜悬浊液三种物质反应的物 质的量之比为
羟基的保护与脱保护

应用最广泛的几种保护基
硅醚保护基
三甲基硅醚 (TMS-OR) 叔丁基二甲基硅醚 (TBDMS-OR or TBS-OR) 叔丁基二苯基硅醚 (TBDPS-OR )
苄醚保护基 烷氧基甲基醚或烷氧基取代甲基醚 其他保护基
3
硅醚保护的优点
硅醚是最常见的保护羟基的方法之一。主要优点有:
易保护,也容易去保护
4
硅醚保护的稳定性
硅醚对酸和碱都敏感; 但是不同的硅醚对酸,碱有相对的 稳定性。空间效应及电子效应是主要的影响因素 。
在酸中的稳定性为:
TMS (1)<TES (64)<TBDMS (20,000)<TIPS (700,000)<TBDPS (5,000,000);
一般而言,对于没有什么位阻的伯醇和仲醇பைடு நூலகம்尽量不要 选用TMS作为保护基团,因为得到的产物一般在硅胶这 样弱的酸性条件下也会被裂解掉。
T B D P S -O R '
5
T B S -O R '
硅醚去保护
硅醚可以用酸或碱或四烷基氟化胺脱去
在用TBAF裂解硅醚后,分解产生的四丁铵离子有时通过柱层析或HPLC很 难除干净,而季铵盐的质谱丰度(Bu4N+: 242)又特别的强有时会干扰质 谱,因此这时需要使用四甲基氟化铵或四乙基氟化铵来脱除。
8
叔丁基二甲基硅醚事例
CH2OBn
O
OH
O
1
TMSCl, imdazole DMF
O O
CH2OBn
OTBDMS
2
J. Am. Chem. Soc. 1972, 94, 6190
CH3 CN
H OH
1
TBSOTf
选修五《醇》PPT课件

CH3—CH2OH
浓硫酸 170℃
CH2=CH2↑+H2O
浓硫酸作催化剂、脱水剂 需加沸石或碎瓷片防暴沸 温度计应放 在反应液中 乙烯中会混有哪些气体? CO2、SO2 、乙醇、乙醚
测反应液温度
混合液温度要 迅速升到170℃
140℃时乙醇 会生成乙醚
混合液颜色如何 变化?为什么?
除去SO2、CO2 、乙醇
CH2=CHCH3
CH3CH=CHCH3
C. CH3CH2CH2OH
CH2=CHCH3
CH3 D. CH3 C CH2OH CH3
②
①
H H
④
H—C—C—O—H
H
① ①③ ②④ ①
H
③
反应
与金属钠反应 Cu或Ag催化氧化 浓硫酸加热到170℃
断键位置
浓硫酸条件下与乙酸加热
置换反应 (与活泼金属) ABCD
COOH COOH
HO HO
CH2 CH2
Br CH2 CH2
原料分子
Br
C H 3C H性质
1) 与钠的置换反应——羟基氢
CH2OH
CH2OH CH2OH CH2OH
2
+ 2Na →2
CH2ONa
+ H 2↑
+ 2Na →
CH2ONa CH2ONa
+
H2↑
2CHOH + 6Na →2CHONa + 3 H2↑
CH2OH CH2ONa
CH2ONa
练
一
练
【例1】0.1 mol 某有机物完全燃烧后生成0.3molCO2, 同质量的该有机物与足量的金属钠反应生成 0.1molH2, 该有机物可能是( ) BC B.1,2-丙二醇 D.乙二醇
醇、酚——羟基化合物PPT 苏教版

明 月 几 时 有 把 酒 ? 问 青 天
各类酒精
工业酒精约含乙醇96%(体积分数), 无水酒精含乙醇99.5%以上 啤酒含酒精3%—5%
葡萄酒含酒精10%—20%,
黄酒含酒精8%—15%, 白酒含酒精50%—70%
乙醇的分子组成和结构
1.乙醇的分子式:C2H6O
H H - - 2.乙醇的结构式: H-C-C-O-H - - H H
(1)取代反应 A、与活泼金属的反应 2CH3CH2-OH + 2Na 2CH3CH2ONa + H2↑
H H C H H C H O H
断键的位置:
产物乙醇钠在水中强烈水解 CH3CH2-ONa + H2O CH3CH2OH + NaOH
B 、分子间取代: CH3CH2O—H + 断键的位置
浓H2SO4 HO—CH2CH3 140℃
CH3CH2OH
浓硫酸、加热到 170℃ C—O、C—H C=C CH2=CH2、H2O
化学键的断裂
化学键的生成 反应产物
(3)氧化反应
H H C H O H + O2
Cu或Ag
H
△
H C O + 2H2O
2H
C H
2H
C H
断键的位置 思考:若遇强氧化剂,乙醇会发生怎样的变化?
CH3CH2OH
氧化
8、为何教材中使用NaOH溶液进行洗气?要除去什么 杂质气体? 因CH3CH2OH、SO2气体能使酸性KMnO4溶液褪色影响 乙烯的检验,故必须用NaOH溶液先将其除去。
交流与讨论:
溴乙烷与乙醇都能发生消去反应,它们有什么异同? CH3CH2Br
反应条件 NaOH的乙醇溶 液、加热 C—Br、C—H C=C CH2=CH2、HBr
有机化学课件ppt完整版

阐述烷烃的碳原子以单键相连形成的链状 或环状结构,以及碳原子剩余的价键全部 与氢原子结合的特点。
烷烃的物理性质
烷烃的化学性质
探讨烷烃的沸点、熔点、密度等物理性质 随碳原子数增加的变化规律。
介绍烷烃的取代反应、氧化反应、裂化反应 等化学性质及反应机理。
烯烃、炔烃和芳香烃概述
烯烃的结构与性质
阐述烯烃分子中含有碳碳双键的结构 特点,以及烯烃的物理性质、化学性 质及反应类型。
羧酸及其衍生物的合成
阐述通过醛酮的氧化反应、腈的水解反应等方法合成羧酸 及其衍生物的方法。
04
醇、酚、醚类化合物
醇类化合物结构与性质分析
80%
醇类化合物的结构特点
含有羟基(-OH)官能团,与碳 链相连。
100%
物理性质
随着分子量的增加,醇的沸点逐 渐升高,水溶性逐渐降低。
80%
化学性质
醇具有还原性,可被氧化为醛或 酮;与羧酸反应生成酯;与卤化 氢反应生成卤代烃。
研究方法
主要包括实验方法和理论方法。实验方法包括合成、分离提纯、结构测定、性 质测试等;理论方法包括量子化学计算、分子模拟等。同时,现代有机化学还 借鉴了物理学、生物学等其他学科的研究手段和技术。
02
有机化合物结构与性质
有机化合物分类及命名规则
按碳骨架分类
开链化合物、碳环化合物
按官能团分类
烃类、醇类、醛类、酮类、羧酸类、胺类等
羧酸衍生物的合成
通过羧酸的衍生化反应,如酯化、酰卤化、 酰胺化等方法合成相应的衍生物。
绿色合成策略
采用环保、高效的合成方法,如原子经济性 反应、生物催化等,实现绿色合成。
07
含氮有机化合物
胺类化合物结构与性质探讨
羟基反应

O
α OAc
OAc OR
OAc
_OAc
AcO OAc
OAc
O
+ OAc H,OAc
AcO
OAc
OAc OAc
OAc OAc
CH2OAc
精品课件
4.反应速率
⑴.苷键邻位有电负性强的基团或苷键
邻位羟基能乙酰时,苷键裂解反应变慢。
⑵.β-苷键葡萄糖双糖乙酰解速率
(1→6) >> (1→4) > (1→3) > (1→2)
精品课件
3、三苯甲醚化
①使用三苯甲氯在吡啶溶液中与糖及其苷进行 反应,可制得三苯甲醚类化合物。 ② 本法可用于C6或C5伯羟基的保护,其脱除保 护基也很方便,只要在HBr的醋酸溶液中室温 下放置即可。
精品课件
(二)酰化反应(酯化反应)
1、常用酰化反应:乙酰化与甲苯磺酰化
2、不同羟基反应活性:
C1-OH > C6-OH 》C3最难 3、磺酸酯水解时常引起羟基的构型发生改变
O 转变成 呋 O
喃 糖 结 构
D-葡 萄 糖
呋 喃 糖
硫 酸 丙酮
O O
O
O O
1,2;5,6-二 -O-异 丙叉 -D-葡 萄 糖
精品课件
7、糖与苯甲醛生成的六元环状缩醛称为 苯甲叉衍生物。 ① 吡喃糖与与苯甲醛生成的苯甲叉衍生物 有顺式与反式两种构象,其中顺式还有O-内 位和H-内位两种存在方式。
精品课件
2,6-二去氧糖 > 2-去氧糖 >6-去氧糖 > 2-
羟基糖 > 2-氨基糖(从易到难)
⑹ 芳香属苷较脂肪属苷易水解。
酚苷(如蒽醌苷)> 醇苷(如萜、甾苷等)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.可发生置换反应,醇羟基与金属钠反应置换了 羟基中的氢原子,生成了氢气。
5.可发生取代反应,分子间脱水成醚(R-O-R”) R与R“为烃基。
5
羟基的还原性
具有还原性,可以被氧化成醛、酮或酸; 一级醇及二级醇与醇羟基相连的碳原子上有氢, 三级醇与醇羟基相连的碳原子上没有氢,不易被氧化,
6
羟基的弱酸性
醇羟基——不体现酸性(阿伦尼乌斯酸碱理论中), 酚羟基和羧羟基——体现弱酸性(因而苯酚可与钠反应),
酚羟基酸性比碳酸弱,强于碳酸氢根; 羧羟基(羧基),比碳酸强。
7
羟基的消去反应
消去反应——分子内脱水生成烯烃。
能生成稳定的烯烃(烯烃双键碳原子链烷基越多越稳定),有利于 消除反应。 醇的分子内脱水,是由于羟基的吸电子诱导效应,是β-H易于消除 而产生的,当有多种不同的β-H时,最容易消去的是含氢较少的β -C,因为能生成稳定烯烃。该规则称为Saytzeff规则。
醇的反应活性:3°醇 > 2°醇 > 1°醇 。 消去反应有两种情况
其一是卤代烃在NaOH的醇溶液下发生消去反应,生成烯烃; 另一个则是醇在浓硫酸的条件下生成烯烃。
8
羟基的置换反应
9
羟基的消去反应
10
羟基的取代反应
与氢卤酸的反应生成卤代烷 氢卤酸与醇反应生成卤代烷,反应中醇羟基被卤原子取代。 ROH+HX——>RX+H20
体现氢的活泼性 发生取代反应 发生脱水缩合反应
2
1
R—O—H
14
2、二者电子式不同: 氢氧根的氧原子有8个电子包围, 羟基的氧原子外有7个电子包围。 水溶液则多呈偏酸性
4
羟基的性质
1.还原性,可被氧化成醛或酮或羧酸。
2.弱酸性,酚羟基与氢氧化钠反应生成酚钠。虽 然呈偏酸性,但很多含羟基有机物的水溶液酸 性比水更弱。如甲醇(CH3OH)、乙醇(CH3CH2OH) 等。
羟基的结构和性质
高中有机化学
1
“羟”的由来
“羟”是化学家发明的字, 以“氢”与“氧”二字各取一部份造出。
羟基的结构
2
1
R—O—H
2
羟基存在形式
无机物中的“羟基”--氢氧根 氢氧化钠、
酚 (苯环上羟基)
3
羟基与氢氧根的区别:
1、电子数不同: 氢氧根为十电子,羟基为九电子; 在水溶液中呈碱性
性
乙醇 CH3CH2OH
酸性
中性
与金 与 属Na NaOH 反应 反应
能
不能
与
Na2CO3
反应
-OH
羟基、羟 不能 基氢均可
被取代
苯酚
增
C6H5OH
强
比
能
H2CO3
能
还弱
能
羟基难取 代、羟基
氢能电离
乙酸 CH3COOH
强于
能
能
H2CO3
能 -H易电离 羟基可取 代
13
羟基的性质
小结 只断 1 键 只断 2 键 断 1 2 键
醇与卤化磷反应生成卤代烷 醇羟基是一个不好的离去基团,与三溴化磷作用形成 CH3CH2OPBr2,Br进攻烷基的碳原子,-OPBr2作为离去基团 离去。- OPBr2中还有两个溴原子,可继续与醇发生反应。
醇分子间脱水成醚 醇与羧酸之间脱水成酯
11
羟基的取代反应
12
羟基的性质
物质 结构简式
羟基中 氢原子 的活泼
