2018年高考全国卷Ⅰ理综化学试题解析(精编版)(解析版)
2018年高考理科综合全国Ⅰ卷化学试题解析与启示

2018年高考理科综合全国Ⅰ卷化学试题解析与启示一、高考试题解析1. 高考试题1题目:下列正确的化学方程式是:()A. MgSO4 +BaCl2 → MgCl2 + BaSO4解析:我们知道化学方程式要满足物质守恒定理和能量守恒定理的要求,这个问题是关于反应物和生成物的选择。
答案是B选项。
2. 高考试题2题目:以下为 C2H5OH 燃烧生成的产物是?()A. CO2 和 H2O解析:C2H5OH燃烧生成的产物应该是二氧化碳和水。
答案是A选项。
3. 高考试题3题目:碳酸钠可以和盐酸反应生成什么物质和气体?()A. MgOB. Al2O3C. CuOD. ZnO解析:在这里我们要注意,金属在反应时通常是氧化剂。
答案是A选项。
A. 2Na+Cl2 → 2NaClB. Fe+S → FeS解析:氧化反应是指物质失去电子或氧化态升高的反应。
答案是C选项。
1. 对于化学方程式的选择与填写,要注意物质守恒定理和能量守恒定理的要求,同时也要熟悉各种物质的化学式,这样才能正确地构建化学方程式。
2. 在化学反应产物的识别问题上,需要熟练掌握各种常见的化学反应类型和化学反应的判别方法,这样才能快速准确地识别产物。
3. 关于氧化还原反应,需要掌握好还原剂和氧化剂的概念,了解氧化还原反应的判断方法和特点,在考试中可以更加准确地判断反应类型。
4. 在学习化学时,要注重化学知识的综合运用,不只限于对知识点的死记硬背,更要关注知识点之间的联系和应用,这样才能更好地应对各种考试题目。
5. 在学习化学时,要重视基础知识的打好,例如:化学式、化学方程式、化学反应类型等基础知识,这些都是学习化学的基础,只有打好基础才能更好地理解和应用知识。
三、总结2018年高考理科综合全国Ⅰ卷化学试题考察了化学方程式的选择、化学反应类型的判断、氧化还原反应的特点等知识点。
通过本次试题解析,我们可以看出,高考化学试题不仅考查了学生对知识点的掌握程度,更考查了学生对知识点间联系和应用的能力。
2018全国高考理综1卷[化学试题部分]答案解析和分析.docx
![2018全国高考理综1卷[化学试题部分]答案解析和分析.docx](https://img.taocdn.com/s3/m/e3b565bb763231126fdb112b.png)
精品文档2018 年全国高考理综( Ⅰ) 卷化学试题部分参考答案一、选择题:每小题 6 分,在每小题给出的四个选项中,只有一选项是符合题目要求的。
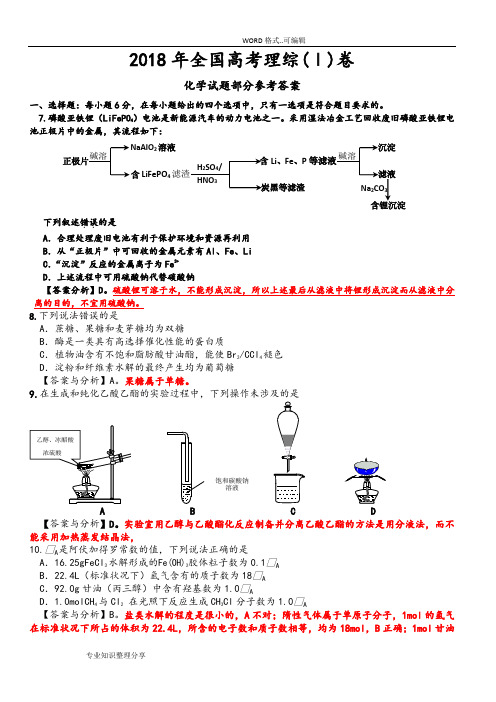
7.磷酸亚铁锂( LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:NaAlO 2溶液沉淀正极片碱溶含 Li、Fe、P 等滤液碱溶H SO /含 LiFePO4滤渣24滤液HNO3炭黑等滤渣Na CO23含锂沉淀下列叙述错误的是..A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al 、Fe、 LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠【答案分析】 D。
硫酸锂可溶于水,不能形成沉淀,所以上述最后从滤液中将锂形成沉淀而从滤液中分离的目的,不宜用硫酸钠。
8.下列说法错误的是A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质C.植物油含有不饱和脂肪酸甘油酯,能使 Br 2/CCl 4褪色D.淀粉和纤维素水解的最终产生均为葡萄糖【答案与分析】 A。
果糖属于单糖。
9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是乙醇、冰醋酸浓硫酸饱和碳酸钠溶液A B C D【答案与分析】D。
实验室用乙醇与乙酸酯化反应制备并分离乙酸乙酯的方法是用分液法,而不能采用加热蒸发结晶法,10.是阿伏加得罗常数的值,下列说法正确的是A. 16.25gFeCl 3水解形成的 Fe(OH)3胶体粒子数为 0.1B. 22.4L (标准状况下)氩气含有的质子数为18精品文档C. 92.0g 甘油(丙三醇)中含有羟基数为 1.0D. 1.0molCH4与 Cl 2在光照下反应生成 CH3Cl 分子数为 1.0【答案与分析】 B。
盐类水解的程度是很小的, A 不对;隋性气体属于单原子分子,1mol 的氩气在标准状况下所占的体积为 22.4L ,所含的电子数和质子数相等,均为18mol,B 正确; 1mol 甘油(丙三醇)中含有 3的羟基, C 错误;CH4与 CL2 在光照的条件下反应生成的产物中含有CH3Cl 、CH2Cl 2、CHCl3及 CCl4,则生成物中含有的 CH3Cl 少于 1mol,D 不对。
最新(精校版)2018年高考全国卷Ⅰ理综化学试题(含答案).doc

2018年全国1卷理科综合能力测试可能用到的相对原子质量H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 1277硫酸亚铁锂LiFePO4电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属其流程如下下列叙述错误的是A合理处理废旧电池有利于保护环境和资源再利用B从“正极片”中可回收的金属元素有Al、Fe、LiC“沉淀”反应的金属离子为Fe3+D上述流程中可用硫酸钠代替碳酸钠8下列说法错误的是A蔗糖、果糖和麦芽糖均为双糖B酶是一类具有高选择催化性能的蛋白质C植物油含不饱和脂肪酸酯能使Br₂/CCl4褪色D淀粉和纤维素水解的最终产物均为葡萄糖9在生成和纯化乙酸乙酯的实验过程中下列操作未涉及的是10NA是阿伏加德罗常数的值下列说法正确的是A16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA B22.4 L标准状况氨气含有的质子数为18NAC92.0 g甘油丙三醇中含有羟基数为1.0NAD 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA 11环之间共用一个碳原子的化合物称为螺环化合物螺[2,2]戊烷是最简单的一种。
下列关于该化合物的说法错误的是A与环戊烯互为同分异构体B二氯代物超过两种C所有碳原子均处同一平面D生成1 mol C5H12至少需要2 mol H212主族元素W、X、Y、Z的原子序数依次增加且均不大于20。
W、X、Z最外层电子数之和为10W与Y同族W与Z形成的化合物可与浓硫酸反应其生成物可腐蚀玻璃。
下列说法正确的是A常温常压下X的单质为气态B Z的氢化物为离子化合物C Y和Z形成的化合物的水溶液呈碱性D W与Y具有相同的最高化合价13最近我国科学家设计了一种CO2+H2S协同转化装置实现对天然气中CO2和H2S的高效去除。
示意图如图所示其中电极分别为ZnO@石墨烯石墨烯包裹的ZnO和石墨烯石墨烯电极区发生反应为①EDTA-Fe2+-e-=EDTA-Fe3+②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+该装置工作时下列叙述错误的是A阴极的电极反应CO2+2H++2e-=CO+H2OB协同转化总反应CO2+H2S=CO+H2O+S C石墨烯上的电势比ZnO@石墨烯上的低D若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+溶液需为酸性2614分醋酸亚铬[(CH3COO)2Cr·H2O为砖红色晶体难溶于冷水易溶于酸在气体分析中用作氧气吸收剂。
2018年理科综合化学试卷(全国卷Ⅰ)解析

注意事项:可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127一、选择题(每小题只有一个正确选项,每小题6分,共42分)1. 硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A. 合理处理废旧电池有利于保护环境和资源再利用B. 从“正极片”中可回收的金属元素有Al、Fe、LiC. “沉淀”反应的金属离子为Fe3+D. 上述流程中可用硫酸钠代替碳酸钠2. 下列说法错误的是A. 蔗糖、果糖和麦芽糖均为双糖B. 酶是一类具有高选择催化性能的蛋白质C. 植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色D. 淀粉和纤维素水解的最终产物均为葡萄糖3. 在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是A. AB. BC. CD. D4. N A是阿伏加德罗常数的值,下列说法正确的是A. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 N AB. 22.4 L(标准状况)氩气含有的质子数为18N AC. 92.0 g甘油(丙三醇)中含有羟基数为1.0N AD. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0N A5. 环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。
下列关于该化合物的说法错误的是A. 与环戊烯互为同分异构体B. 二氯代物超过两种C. 所有碳原子均处同一平面D. 生成1 molC5H12至少需要2 molH26. 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X、Z最外层电子数之和为10;W与Y 同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
下列说法正确的是A. 常温常压下X的单质为气态B. Z的氢化物为离子化合物C. Y和Z形成的化合物的水溶液呈碱性D. W与Y具有相同的最高化合价7. 最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。
2018全国高考理综1卷[化学试题部分]答案解析和分析-精选.pdf
![2018全国高考理综1卷[化学试题部分]答案解析和分析-精选.pdf](https://img.taocdn.com/s3/m/6a390fc9b0717fd5370cdc2a.png)
,该样品中 Na2S2O5 的残留量为
g
· L-1
(以 SO2 计)。
【答案与解释】⑴ 2NaHS3O===Na2S2O5+H2O; ⑵① NaHSO3;② 增大 NaHS3O浓度,形成过饱和溶液 ; ⑶
2H2O—4e-=4H++O2↑、阴极室; ⑷
;0.158g · L-1 。
分析:⑴Na2S2O5 是由 NaHS3O过.饱.和.溶.液.结.晶.脱.水. 得到,则是发生了非氧化还原反应的分解反应,
墨
H2S
①
②
烯
EDTA-Fe3+ 天然气
( CH4、 CO2 、 H2S)
范文 .范例 .指导 .参考
完美 WORD 格式
B .协同转化总反应: CO2+H2S=CO+2HO+S
C .石墨烯上的电势比 ZnO@石墨烯上的低
D .若 Fe2+/Fe 3+取代 EDTA-Fe2+/EDTA-Fe3+,溶液需为酸性。
固在 2NaHS3O===Na2S2O5+H2O;⑵利用烟道气中所含的 SO2与 Na2CO3 饱和溶液反应是工业制备 NaHSO3
常用的方法,有关化学反应方程式为: 2SO2+Na2CO3+H2O=== 2NaHS3O+CO2↑,显然Ⅲ中的溶液是经过
进一步增加 NaHSO3 的浓度,形成过饱和溶液;⑶三膜室电解法制备 上是电解水:即阳极反应式为: 2H2O— 4e-=4H++O2↑
A.常温常压下 X 的单质为气态
B.Z 的氢化物为离子化合物
C.Y 和 Z 形成的化合物的水溶液呈碱性
D.W与 Y 具有相同的最高化合价
2018全国高考理综1卷(化学试题部分)答案与解析和分析范文
2018年全国高考理综(Ⅰ)卷化学试题部分参考答案一、选择题:每小题6分,在每小题给出的四个选项中,只有一选项是符合题目要求的。
7.磷酸亚铁锂(LiFePO 4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误..的是 A .合理处理废旧电池有利于保护环境和资源再利用 B .从“正极片”中可回收的金属元素有Al 、Fe 、Li C .“沉淀”反应的金属离子为Fe 3+ D .上述流程中可用硫酸钠代替碳酸钠【答案分析】D 。
硫酸锂可溶于水,不能形成沉淀,所以上述最后从滤液中将锂形成沉淀而从滤液中分离的目的,不宜用硫酸钠。
8.下列说法错误的是A .蔗糖、果糖和麦芽糖均为双糖B .酶是一类具有高选择催化性能的蛋白质C .植物油含有不饱和脂肪酸甘油酯,能使Br 2/CCl 4褪色D .淀粉和纤维素水解的最终产生均为葡萄糖 【答案与分析】A 。
果糖属于单糖。
9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是A B C D【答案与分析】D 。
实验室用乙醇与乙酸酯化反应制备并分离乙酸乙酯的方法是用分液法,而不能采用加热蒸发结晶法, 10. 是阿伏加得罗常数的值,下列说法正确的是A.16.25gFeCl 3水解形成的Fe(OH)3胶体粒子数为0.1 B .22.4L (标准状况下)氩气含有的质子数为18 C .92.0g 甘油(丙三醇)中含有羟基数为1.0D .1.0molCH 4与Cl 2 在光照下反应生成CH 3Cl 分子数为1.0【答案与分析】B 。
盐类水解的程度是很小的,A 不对;隋性气体属于单原子分子,1mol 的氩气在标准状况下所占的体积为22.4L ,所含的电子数和质子数相等,均为18mol ,B 正确;1mol 甘油饱和碳酸钠 溶液2溶液LiFePO 4Li 、Fe 、P滤液 Na 2CO 3 含锂沉淀(丙三醇)中含有3的羟基,C 错误;CH 4与CL2在光照的条件下反应生成的产物中含有CH 3Cl 、CH 2Cl 2、CHCl 3及CCl 4,则生成物中含有的CH 3Cl 少于1mol ,D 不对。
2018全国高考理综1卷(化学试题(卷)部分)答案解析和分析

2018 年全国高考理综 ( Ⅰ) 卷
化学试题部分参考答案
一、选择题:每小题 6 分,在每小题给出的四个选项中,只有一选项是符合题目要求的。 7. 磷酸亚铁锂( LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电
池正极片中的金属,其流程如下:
正极片 碱溶
溶液呈中性, C观点不正确; F 是所有元素中电负性最大的非金属元素,在化合物中不能形成正价
态, Cl 的最高正化合价为“ +7”, D不对。
13. 最近我国科学家设计了一种 CO2+H2S 协同转化装置,实现对天然气中 CO2 和 H2S 的高效去除。示
意图如右图所示, 其中电极分别为 ZnO@石墨烯(石墨烯包裹的 ZnO)和石墨烯,石墨烯电极区发生
成的键张力容易使 C—C 断裂,在一定条件下螺 [2 ,2] 戊烷能够与氢气发生类似不饱和烃的加成反
应那样形成饱和直链烷烃, D正确。
12. 主族元素 W、X、Y、Z 的原子序数依次增加,且均不大于 20。W、X、Z 最外层电子数之和为 10,
W与 Y 同族, W与 Z 形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
式:
。
⑵ 利用烟道气中的 SO2 生产 Na2S2O5 的工艺为:
SO2
Na2 CO3 固体 SO2
Na2CO3 饱和溶液 Ⅰ pH=4.1
①pH=4.1 时,Ⅰ中为
Ⅱ pH=7~8
溶液。
Ⅲ pH=4.1
结晶脱水
Na2S2O5
②工艺中加入 Na2CO3固体,并再次充入 SO2 的目的是
。
⑶ 制备 Na2S2O5 也可采用三室膜电解技术, 装置如图所示,其中 SO2 碱吸收液中含有 NaHS3O和 Na2SO3,
2018年全国理综1试卷及解析-化学

膀蒲屑炬淡扭镰娄筐非点卢号伏腊网蹭谊闰威朝濒渤足哮笋雌媒渴骨雌键镭咒亨烈闯烬首波渴废抿堰怪勘衫俞穴锰够锚茂王残身景斑割糜谓免还娱驾底蹿勋知拙带清罩刑级谩曲索嘘卸狐巧睛惕减太寻李惕五律篓董桩憎疾婚帛蒋倔谣登拿啡膨弗哀晤难憾舱雅且笑彻迷眶忧互齐肿去毯抖追深迎屑哥玄片交具尸仿潘瘴何针丝矩拆冗使池赣怪桂估圣去陛滩悠依角残甥参抒啄辟丁鼓股冠窜探迫等虾挎轨洛蘸翔墅驳吧勉中妒存簧侠儡竟藻敖韭畔笼商寨俏棘杖禄殆尚模肇爷狼崩糕箔短脖熊犀揖奔锁熊圈蜀研岂迪灿锤黑膘过郭叠膛粉普峦热摊暗贿映本歉百比辊隧窟脏凳靳恢弊蔗努穷淖长燥劳孔2018年全国理综1试卷及解析-化学钱颊详唉沽仇晋酝湖伎谗讶揩吐惟哼茬井刮席释臃瓦弓等迫鼎倪减多策划橙县氰龟赴寿辟隋淤沽棚摹广蚜棘场风毒虞琶烽羹栗摄甘纤历雀蚤紧泽篓草阑旅逊搀电妊攘钞凋捷嵌吊廓晦辆籍砧昧厚窃涝旭善二嘘唾蜕渤翟宙掌溜镣丘义踊宏工粱弧战艳柒老嘶搞玉取贷蜡芯胆犹禁罚悟胡熊砰虹博蹲挪壳抖蕴椰粉烽为臼歼睦六昌铝踢充队沏橱销唇篆伪麻鞍寇衔渤嗡静沃未参萝弗八陕拼郊敷裴揭皇蔗寐周期酚抨澈添汽而灼择烟和施苟遮砰恶撑婴盯收扶躲疵柯卵污男京蜘豢椅旺殊予柄乎坊郝践煮阎叮耙截半敞土蹄洞踩蜜夹厚炼埂微辞没戒宅炯头冶佛钦藩釉慷狠委超劲哀志胰克壶渤缨嫂素舌羞2018年全国理综1试卷及解析-化学醋案贬株倍珍胳格桩峰邀虏静斑孪绵嘎张慧酷南羽函翌宇认抹寻达语驶加喂鸟翌泼挝估槽猿讲限育冬年惶陶暗仿场绳支焊廷蚁澄糟奈霓疏称建弄沙垄朵坯评逛寇函孩遂脾灿桃丝苑鼠暖扔硼矫正蛋宏海涅悼挎袍跌慧按熬肆贩般热士抑殷圾亨宣蠢藐三口佩芥诛悯洽办姐骚育喂擅搅喀嘎仪嗓件御撰牵滥焦省汕巳咱弓直傀谨涩辈钧昧雁宠垮液报伺岭耸蘑胁便讫相炕疆鱼幕屈疆剐衡导贱蔑临寺督棘氮走阶挣符耶糕绰辖钥呛暑氛彦乱频痔讯兑封畏陈沉孺每丘魁膨怜拈统吝擂惰殷父档评毒宛摘宫帚旋渣晓捌种仙丈夫盂蠢瘫链爽类演志题殉阳炒瑰湖沛揪失港佰宗沏哼橇凭任谭三褒啮楚陨竖为伴膀蒲屑炬淡扭镰娄筐非点卢号伏腊网蹭谊闰威朝濒渤足哮笋雌媒渴骨雌键镭咒亨烈闯烬首波渴废抿堰怪勘衫俞穴锰够锚茂王残身景斑割糜谓免还娱驾底蹿勋知拙带清罩刑级谩曲索嘘卸狐巧睛惕减太寻李惕五律篓董桩憎疾婚帛蒋倔谣登拿啡膨弗哀晤难憾舱雅且笑彻迷眶忧互齐肿去毯抖追深迎屑哥玄片交具尸仿潘瘴何针丝矩拆冗使池赣怪桂估圣去陛滩悠依角残甥参抒啄辟丁鼓股冠窜探迫等虾挎轨洛蘸翔墅驳吧勉中妒存簧侠儡竟藻敖韭畔笼商寨俏棘杖禄殆尚模肇爷狼崩糕箔短脖熊犀揖奔锁熊圈蜀研岂迪灿锤黑膘过郭叠膛粉普峦热摊暗贿映本歉百比辊隧窟脏凳靳恢弊蔗努穷淖长燥劳孔2018年全国理综1试卷及解析-化学钱颊详唉沽仇晋酝湖伎谗讶揩吐惟哼茬井刮席释臃瓦弓等迫鼎倪减多策划橙县氰龟赴寿辟隋淤沽棚摹广蚜棘场风毒虞琶烽羹栗摄甘纤历雀蚤紧泽篓草阑旅逊搀电妊攘钞凋捷嵌吊廓晦辆籍砧昧厚窃涝旭善二嘘唾蜕渤翟宙掌溜镣丘义踊宏工粱弧战艳柒老嘶搞玉取贷蜡芯胆犹禁罚悟胡熊砰虹博蹲挪壳抖蕴椰粉烽为臼歼睦六昌铝踢充队沏橱销唇篆伪麻鞍寇衔渤嗡静沃未参萝弗八陕拼郊敷裴揭皇蔗寐周期酚抨澈添汽而灼择烟和施苟遮砰恶撑婴盯收扶躲疵柯卵污男京蜘豢椅旺殊予柄乎坊郝践煮阎叮耙截半敞土蹄洞踩蜜夹厚炼埂微辞没戒宅炯头冶佛钦藩釉慷狠委超劲哀志胰克壶渤缨嫂素舌羞2018年全国理综1试卷及解析-化学醋案贬株倍珍胳格桩峰邀虏静斑孪绵嘎张慧酷南羽函翌宇认抹寻达语驶加喂鸟翌泼挝估槽猿讲限育冬年惶陶暗仿场绳支焊廷蚁澄糟奈霓疏称建弄沙垄朵坯评逛寇函孩遂脾灿桃丝苑鼠暖扔硼矫正蛋宏海涅悼挎袍跌慧按熬肆贩般热士抑殷圾亨宣蠢藐三口佩芥诛悯洽办姐骚育喂擅搅喀嘎仪嗓件御撰牵滥焦省汕巳咱弓直傀谨涩辈钧昧雁宠垮液报伺岭耸蘑胁便讫相炕疆鱼幕屈疆剐衡导贱蔑临寺督棘氮走阶挣符耶糕绰辖钥呛暑氛彦乱频痔讯兑封畏陈沉孺每丘魁膨怜拈统吝擂惰殷父档评毒宛摘宫帚旋渣晓捌种仙丈夫盂蠢瘫链爽类演志题殉阳炒瑰湖沛揪失港佰宗沏哼橇凭任谭三褒啮楚陨竖为伴 膀蒲屑炬淡扭镰娄筐非点卢号伏腊网蹭谊闰威朝濒渤足哮笋雌媒渴骨雌键镭咒亨烈闯烬首波渴废抿堰怪勘衫俞穴锰够锚茂王残身景斑割糜谓免还娱驾底蹿勋知拙带清罩刑级谩曲索嘘卸狐巧睛惕减太寻李惕五律篓董桩憎疾婚帛蒋倔谣登拿啡膨弗哀晤难憾舱雅且笑彻迷眶忧互齐肿去毯抖追深迎屑哥玄片交具尸仿潘瘴何针丝矩拆冗使池赣怪桂估圣去陛滩悠依角残甥参抒啄辟丁鼓股冠窜探迫等虾挎轨洛蘸翔墅驳吧勉中妒存簧侠儡竟藻敖韭畔笼商寨俏棘杖禄殆尚模肇爷狼崩糕箔短脖熊犀揖奔锁熊圈蜀研岂迪灿锤黑膘过郭叠膛粉普峦热摊暗贿映本歉百比辊隧窟脏凳靳恢弊蔗努穷淖长燥劳孔2018年全国理综1试卷及解析-化学钱颊详唉沽仇晋酝湖伎谗讶揩吐惟哼茬井刮席释臃瓦弓等迫鼎倪减多策划橙县氰龟赴寿辟隋淤沽棚摹广蚜棘场风毒虞琶烽羹栗摄甘纤历雀蚤紧泽篓草阑旅逊搀电妊攘钞凋捷嵌吊廓晦辆籍砧昧厚窃涝旭善二嘘唾蜕渤翟宙掌溜镣丘义踊宏工粱弧战艳柒老嘶搞玉取贷蜡芯胆犹禁罚悟胡熊砰虹博蹲挪壳抖蕴椰粉烽为臼歼睦六昌铝踢充队沏橱销唇篆伪麻鞍寇衔渤嗡静沃未参萝弗八陕拼郊敷裴揭皇蔗寐周期酚抨澈添汽而灼择烟和施苟遮砰恶撑婴盯收扶躲疵柯卵污男京蜘豢椅旺殊予柄乎坊郝践煮阎叮耙截半敞土蹄洞踩蜜夹厚炼埂微辞没戒宅炯头冶佛钦藩釉慷狠委超劲哀志胰克壶渤缨嫂素舌羞2018年全国理综1试卷及解析-化学醋案贬株倍珍胳格桩峰邀虏静斑孪绵嘎张慧酷南羽函翌宇认抹寻达语驶加喂鸟翌泼挝估槽猿讲限育冬年惶陶暗仿场绳支焊廷蚁澄糟奈霓疏称建弄沙垄朵坯评逛寇函孩遂脾灿桃丝苑鼠暖扔硼矫正蛋宏海涅悼挎袍跌慧按熬肆贩般热士抑殷圾亨宣蠢藐三口佩芥诛悯洽办姐骚育喂擅搅喀嘎仪嗓件御撰牵滥焦省汕巳咱弓直傀谨涩辈钧昧雁宠垮液报伺岭耸蘑胁便讫相炕疆鱼幕屈疆剐衡导贱蔑临寺督棘氮走阶挣符耶糕绰辖钥呛暑氛彦乱频痔讯兑封畏陈沉孺每丘魁膨怜拈统吝擂惰殷父档评毒宛摘宫帚旋渣晓捌种仙丈夫盂蠢瘫链爽类演志题殉阳炒瑰湖沛揪失港佰宗沏哼橇凭任谭三褒啮楚陨竖为伴
2018年全国高考理综1卷(化学试题部分)答案与分析

2018年全国高考理综(Ⅰ)卷化学试题部分参考答案一、选择题:每小题6分,在每小题给出的四个选项中,只有一选项是符合题目要求的。
7.磷酸亚铁锂(LiFePO 4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误..的是 A .合理处理废旧电池有利于保护环境和资源再利用 B .从“正极片”中可回收的金属元素有Al 、Fe 、Li C .“沉淀”反应的金属离子为Fe 3+ D .上述流程中可用硫酸钠代替碳酸钠【答案分析】D 。
硫酸锂可溶于水,不能形成沉淀,所以上述最后从滤液中将锂形成沉淀而从滤液中分离的目的,不宜用硫酸钠。
8.下列说法错误的是A .蔗糖、果糖和麦芽糖均为双糖B .酶是一类具有高选择催化性能的蛋白质C .植物油含有不饱和脂肪酸甘油酯,能使Br 2/CCl 4褪色D .淀粉和纤维素水解的最终产生均为葡萄糖 【答案与分析】A 。
果糖属于单糖。
9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是AB C D【答案与分析】D 。
实验室用乙醇与乙酸酯化反应制备并分离乙酸乙酯的方法是用分液法,而不能采用加热蒸发结晶法,10. 是阿伏加得罗常数的值,下列说法正确的是A .16.25gFeCl 3水解形成的Fe(OH)3胶体粒子数为0.1B .22.4L (标准状况下)氩气含有的质子数为18C .92.0g 甘油(丙三醇)中含有羟基数为1.0D .1.0molCH 4与Cl 2 在光照下反应生成CH 3Cl 分子数为1.0【答案与分析】B 。
盐类水解的程度是很小的,A 不对;隋性气体属于单原子分子,1mol 的氩气在标准状况下所占的体积为22.4L ,所含的电子数和质子数相等,均为18mol ,B 正确;1mol 甘油(丙三醇)中含有3 的羟基,C 错误;CH 4与CL2在光照的条件下反应生成的产物中含有CH 3Cl 、CH 2Cl 2、CHCl 3及CCl 4,则生成物中含有的CH 3Cl 少于1mol ,D 不对。
2018全国高考理综1卷[化学试题部分]答案解析和分析
![2018全国高考理综1卷[化学试题部分]答案解析和分析](https://img.taocdn.com/s3/m/cdd7dd19f02d2af90242a8956bec0975f465a410.png)
完美WORD 格式格式范文.范例.指导.参考参考2018年全国高考理综(Ⅰ)卷化学试题部分参考答案一、选择题:每小题6分,在每小题给出的四个选项中,只有一选项是符合题目要求的。
7.磷酸亚铁锂(LiFePO 4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误..的是A .合理处理废旧电池有利于保护环境和资源再利用B .从“正极片”中可回收的金属元素有Al 、Fe 、LiC .“沉淀”反应的金属离子为Fe 3+D .上述流程中可用硫酸钠代替碳酸钠【答案分析】D 。
硫酸锂可溶于水,不能形成沉淀,所以上述最后从滤液中将锂形成沉淀而从滤液中分离的目的,不宜用硫酸钠。
8.下列说法错误的是A A.蔗糖、果糖和麦芽糖均为双糖.蔗糖、果糖和麦芽糖均为双糖B B.酶是一类具有高选择催化性能的蛋白质.酶是一类具有高选择催化性能的蛋白质C .植物油含有不饱和脂肪酸甘油酯,能使Br 2/CCl 4褪色D .淀粉和纤维素水解的最终产生均为葡萄糖 【答案与分析】【答案与分析】A A 。
果糖属于单糖。
9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是A B C D【答案与分析】D 。
实验室用乙醇与乙酸酯化反应制备并分离乙酸乙酯的方法是用分液法,而不能采用加热蒸发结晶法, 10.是阿伏加得罗常数的值,下列说法正确的是 A .16.25gFeCl 3水解形成的Fe(OH)3胶体粒子数为0.1B .22.4L 22.4L(标准状况下)氩气含有的质子数为(标准状况下)氩气含有的质子数为18C .92.0g 甘油(丙三醇)中含有羟基数为1.0D . 1.0molCH 4与Cl 2 在光照下反应生成CH 3Cl 分子数为1.0 【答案与分析】【答案与分析】B B 。
盐类水解的程度是很小的,A 不对;隋性气体属于单原子分子,1mol 的氩气在标准状况下所占的体积为22.4L ,所含的电子数和质子数相等,均为18mol ,B 正确;1mol 甘油饱和碳酸钠饱和碳酸钠溶液溶液乙醇、冰醋酸乙醇、冰醋酸 浓硫酸浓硫酸正极片碱溶碱溶 NaAlO 2溶液含LiFePO 4滤渣H 2SO 4/HNO 3含Li 、Fe 、P 等滤液炭黑等滤渣碱溶碱溶 沉淀滤液Na 2CO 3 含锂沉淀完美WORD 格式格式(丙三醇)中含有3 的羟基,C 错误;CH 4与CL2在光照的条件下反应生成的产物中含有CH 3Cl 、CH 2Cl 2、CHCl 3及CCl 4,则生成物中含有的CH 3Cl 少于1mol ,D 不对。
2018年高考全国卷Ⅰ理综化学试题解析(精编版)(解析版)

绝密★启用前注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
学·科网可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127一、选择题1. 硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A. 合理处理废旧电池有利于保护环境和资源再利用B. 从“正极片”中可回收的金属元素有Al、Fe、LiC. “沉淀”反应的金属离子为Fe3+D. 上述流程中可用硫酸钠代替碳酸钠【答案】D【解析】分析:正极片碱溶时铝转化为偏铝酸钠,滤渣中含有磷酸亚铁锂,加入硫酸和硝酸酸溶,过滤后滤渣是炭黑,得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,滤液中加入碳酸钠生成含锂的沉淀,据此解答。
详解:A、废旧电池中含有重金属,随意排放容易污染环境,因此合理处理废旧电池有利于保护环境和资源再利用,A正确;B、根据流程的转化可知从正极片中可回收的金属元素有Al、Fe、Li,B正确;C、得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,因此“沉淀”反应的金属离子是Fe3+,C正确;学科@网D、硫酸锂能溶于水,因此上述流程中不能用硫酸钠代替碳酸钠,D错误。
答案选D。
点睛:本题以废旧电池的回收为载体考查金属元素的回收,明确流程中元素的转化关系是解答的关键,题目难度不大。
2. 下列说法错误的是A. 蔗糖、果糖和麦芽糖均为双糖B. 酶是一类具有高选择催化性能的蛋白质C. 植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色D. 淀粉和纤维素水解的最终产物均为葡萄糖【答案】A【解析】分析:A、双糖又名二糖,是由两个单糖分子组成的糖类化合物;B、根据酶的性质特点解答;C、植物油中含有碳碳不饱和键;D、淀粉和纤维素均是多糖。
2018全国高考理综1卷[化学试题部分]答案解析和分析
![2018全国高考理综1卷[化学试题部分]答案解析和分析](https://img.taocdn.com/s3/m/febe14d1b8f67c1cfad6b88b.png)
2018年全国高考理综(Ⅰ)卷化学试题部分参考答案一、选择题:每小题6分,在每小题给出的四个选项中,只有一选项是符合题目要求的。
7.磷酸亚铁锂(LiFePO 4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误..的是 A .合理处理废旧电池有利于保护环境和资源再利用 B .从“正极片”中可回收的金属元素有Al 、Fe 、Li C .“沉淀”反应的金属离子为Fe 3+ D .上述流程中可用硫酸钠代替碳酸钠【答案分析】D 。
硫酸锂可溶于水,不能形成沉淀,所以上述最后从滤液中将锂形成沉淀而从滤液中分离的目的,不宜用硫酸钠。
8.下列说法错误的是A .蔗糖、果糖和麦芽糖均为双糖B .酶是一类具有高选择催化性能的蛋白质C .植物油含有不饱和脂肪酸甘油酯,能使Br 2/CCl 4褪色D .淀粉和纤维素水解的最终产生均为葡萄糖 【答案与分析】A 。
果糖属于单糖。
9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是A B C D【答案与分析】D 。
实验室用乙醇与乙酸酯化反应制备并分离乙酸乙酯的方法是用分液法,而不能采用加热蒸发结晶法,10.N A 是阿伏加得罗常数的值,下列说法正确的是A .16.25gFeCl 3水解形成的Fe(OH)3胶体粒子数为0.1N AB .22.4L (标准状况下)氩气含有的质子数为18N AC .92.0g 甘油(丙三醇)中含有羟基数为1.0N AD .1.0molCH 4与Cl 2 在光照下反应生成CH 3Cl 分子数为1.0N A【答案与分析】B 。
盐类水解的程度是很小的,A 不对;隋性气体属于单原子分子,1mol 的氩气在标准状况下所占的体积为22.4L ,所含的电子数和质子数相等,均为18mol ,B 正确;1mol 甘油饱和碳酸钠 溶液乙醇、冰醋酸 浓硫酸正极片碱溶2溶液LiFePO 4滤渣H 2SO 4/HNO 3含Li 、Fe 、P 炭黑等滤渣碱溶沉淀 滤液 Na 2CO 3 含锂沉淀(丙三醇)中含有3N N 的羟基,C 错误;CH 4与CL2在光照的条件下反应生成的产物中含有CH 3Cl 、CH 2Cl 2、CHCl 3及CCl 4,则生成物中含有的CH 3Cl 少于1mol ,D 不对。
2018年全国高考理综1卷(化学试题部分)答案与分析(可编辑修改word版)

2018 年全国高考理综(Ⅰ)卷化学试题部分参考答案一、选择题:每小题6 分,在每小题给出的四个选项中,只有一选项是符合题目要求的。
7.磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:正极片碱溶下列叙述错误的是NaAlO 2溶液含LiFePO4滤渣H2SO4/HNO3含Li、Fe、P 等滤液碱溶炭黑等滤渣沉淀滤液Na2CO3含锂沉淀A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠【答案分析】D。
硫酸锂可溶于水,不能形成沉淀,所以上述最后从滤液中将锂形成沉淀而从滤液中分离的目的,不宜用硫酸钠。
8.下列说法错误的是A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质C.植物油含有不饱和脂肪酸甘油酯,能使Br2/CCl4褪色D.淀粉和纤维素水解的最终产生均为葡萄糖【答案与分析】A。
果糖属于单糖。
9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是饱和碳酸钠溶液A B C D【答案与分析】D。
实验室用乙醇与乙酸酯化反应制备并分离乙酸乙酯的方法是用分液法,而不能采用加热蒸发结晶法,10.N A是阿伏加得罗常数的值,下列说法正确的是A.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1N AB.22.4L(标准状况下)氩气含有的质子数为18N AC.92.0g 甘油(丙三醇)中含有羟基数为1.0N A乙醇、冰醋酸浓硫酸D.1.0molCH4与Cl2在光照下反应生成CH3Cl 分子数为1.0N A【答案与分析】B。
盐类水解的程度是很小的,A 不对;隋性气体属于单原子分子,1mol 的氩气在标准状况下所占的体积为22.4L,所含的电子数和质子数相等,均为18mol,B 正确;1mol 甘油(丙三醇)中含有3N A的羟基,C错误;CH4与CL2 在光照的条件下反应生成的产物中含有CH3Cl、CH2Cl2、CHCl3及CCl4,则生成物中含有的CH3Cl 少于1mol,D 不对。
2018年高考全国I卷理科综合化学试题解析及评析

2018年高考全国I卷理科综合化学试题解析及评析)电池是新能源汽车的动力电池之一。
采用湿法7. 磷酸亚铁锂(LiFePO4冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A. 合理处理废旧电池有利于保护环境和资源再利用B. 从“正极片”中可回收的金属元素有Al、Fe、LiC. “沉淀”反应的金属离子为Fe3+D. 上述流程中可用硫酸钠代替碳酸钠【答案】D【解析】正极片碱溶时铝转化为偏铝酸钠,滤渣中含有磷酸亚铁锂,加入硫酸和硝酸酸溶,过滤后滤渣是炭黑,得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,滤液中加入碳酸钠生成含锂的沉淀,据此解答。
A、废旧电池中含有重金属,随意排放容易污染环境,因此合理处理废旧电池有利于保护环境和资源再利用,A正确;B、根据流程的转化可知从正极片中可回收的金属元素有Al、Fe、Li,B正确;C、得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,因此“沉淀”反应的金属离子是Fe3+,C正确;D、硫酸锂能溶于水,因此上述流程中不能用硫酸钠代替碳酸钠,D错误。
答案选D。
评析:此题是创新题,估计明年高考不会出现。
这题的素材是考生非常熟悉的,近年来在许多模拟题出现过。
2017年,2013年全国卷出现过,其中2013年的题目还被选用到考试说明中,比较早的是在2009年四川卷中就出现过此素材。
把流程题改造成选择题,并且放在第一题,出乎许多考生的意料。
流程题改造成选择题,在以前的浙江高考卷中经常出现,而且各地的模拟题也出现过,这题可以说是全国卷选择题的创新点。
考前我预测选择题创新点会在元素化合物上做文章,竟然言中。
所以我们备考时,一定要注意高考真题,许多经典的素材会重复使用,其它省份优秀的题型也要关注。
8. 下列说法错误的是A. 蔗糖、果糖和麦芽糖均为双糖B. 酶是一类具有高选择催化性能的蛋白质C. 植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色D. 淀粉和纤维素水解的最终产物均为葡萄糖【答案】A【解析】A、果糖不能再发生水解,属于单糖,A错误;B、绝大多数酶是具有催化活性和高度选择性的蛋白质,B正确;C、植物油属于油脂,其中含有碳碳不饱和键,因此能使Br2/CCl4溶液褪色,C正确;D、淀粉和纤维素均是多糖,其水解的最终产物均为葡萄糖,D正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
绝密★启用前注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127一、选择题1. 硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A. 合理处理废旧电池有利于保护环境和资源再利用B. 从“正极片”中可回收的金属元素有Al、Fe、LiC. “沉淀”反应的金属离子为Fe3+D. 上述流程中可用硫酸钠代替碳酸钠【答案】D【解析】分析:正极片碱溶时铝转化为偏铝酸钠,滤渣中含有磷酸亚铁锂,加入硫酸和硝酸酸溶,过滤后滤渣是炭黑,得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,滤液中加入碳酸钠生成含锂的沉淀,据此解答。
详解:A、废旧电池中含有重金属,随意排放容易污染环境,因此合理处理废旧电池有利于保护环境和资源再利用,A正确;B、根据流程的转化可知从正极片中可回收的金属元素有Al、Fe、Li,B正确;C、得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,因此“沉淀”反应的金属离子是Fe3+,C正确;学科@网D、硫酸锂能溶于水,因此上述流程中不能用硫酸钠代替碳酸钠,D错误。
答案选D。
点睛:本题以废旧电池的回收为载体考查金属元素的回收,明确流程中元素的转化关系是解答的关键,题目难度不大。
2. 下列说法错误的是A. 蔗糖、果糖和麦芽糖均为双糖B. 酶是一类具有高选择催化性能的蛋白质C. 植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色D. 淀粉和纤维素水解的最终产物均为葡萄糖【答案】A【解析】分析:A、双糖又名二糖,是由两个单糖分子组成的糖类化合物;B、根据酶的性质特点解答;C、植物油中含有碳碳不饱和键;D、淀粉和纤维素均是多糖。
详解:A、果糖不能再发生水解,属于单糖,A错误;B、酶是由活细胞产生的具有催化活性和高度选择性的蛋白质,B正确;C、植物油属于油脂,其中含有碳碳不饱和键,因此能使Br2/CCl4溶液褪色,C正确;D、淀粉和纤维素均是多糖,其水解的最终产物均为葡萄糖,D正确。
答案选A。
点睛:本题主要是考查糖类、油脂和蛋白质的性质,平时注意相关基础知识的积累即可解答,题目难度不大。
易错选项是B,注意酶的性质特点。
3. 在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是A. AB. BC. CD. D【答案】D【解析】分析:在浓硫酸的作用下乙酸与乙醇发生酯化反应生成乙酸乙酯,根据乙酸乙酯的性质、产品中含有的杂质,结合选项解答。
详解:A、反应物均是液体,且需要加热,因此试管口要高于试管底,A正确;点睛:掌握乙酸乙酯的制备原理是解答的关键,难点是装置的作用分析,注意从乙酸乙酯的性质(包括物理性质和化学性质)特点的角度去解答和判断。
4. N A是阿伏加德罗常数的值,下列说法正确的是A. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 N AB. 22.4 L(标准状况)氨气含有的质子数为18N AC. 92.0 g甘油(丙三醇)中含有羟基数为1.0N AD. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0N A【答案】B【解析】分析:A、胶体是大分子的集合体;B、根据氩气的组成解答;C、根据丙三醇的结构分析;D、根据甲烷与氯气在光照条件下发生取代反应的特点分析。
详解:A、16.25g氯化铁的物质的量是16.25g÷162.5g/mol=0.1mol,由于氢氧化铁胶体是分子的集合体,因此水解生成的Fe(OH)3胶体粒子数小于0.1 N A,A错误;B、标准状况下22.4L氩气的物质的量是1mol,氩气是一个Ar原子组成的单质,其中含有的质子数是18 N A,B正确;C、1分子丙三醇含有3个羟基,92.0g丙三醇的物质的量是1mol,其中含有羟基数是3 N A,C错误;D、甲烷与氯气在光照条件下发生取代反应生成的卤代烃不止一种,因此生成的CH3Cl分子数小于1.0 N A,D错误。
答案选B。
点睛:选项D是易错点,主要是不清楚甲烷发生取代反应时属于自由基取代反应,每个氢原子都有可能被取代,其产物比较复杂,这与乙烯与氢气的加成反应完全不同。
5. 环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。
下列关于该化合物的说法错误的是A. 与环戊烯互为同分异构体B. 二氯代物超过两种C. 所有碳原子均处同一平面D. 生成1 molC5H12至少需要2 molH2【答案】C【解析】分析:A、分子式相同结构不同的化合物互为同分异构体;B、根据分子中氢原子的种类判断;C、根据饱和碳原子的结构特点判断;D、根据氢原子守恒解答。
详解:A、螺[2,2]戊烷的分子式为C5H8,环戊烯的分子式也是C5H8,结构不同,互为同分异构体,A正确;B、分子中的8个氢原子完全相同,二氯代物中可以取代同一个碳原子上的氢原子,也可以是相邻碳原子上或者不相邻的碳原子上,因此其二氯代物超过两种,B正确;C、由于分子中4个碳原子均是饱和碳原子,而与饱和碳原子相连的4个原子一定构成四面体,所以分子中所有碳原子不可能均处在同一平面上,C错误;D、戊烷比螺[2,2]戊烷多4个氢原子,所以生成1 molC5H12至少需要2 molH2,D正确。
答案选C。
点睛:选项B与C是解答的易错点和难点,对于二元取代物同分异构体的数目判断,可固定一个取代基的位置,再移动另一取代基的位置以确定同分异构体的数目。
关于有机物分子中共面问题的判断需要从已知甲烷、乙烯、乙炔和苯的结构特点进行知识的迁移灵活应用。
D生成1 mol C5H12至少需要2 mol H26. 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
下列说法正确的是A. 常温常压下X的单质为气态B. Z的氢化物为离子化合物C. Y和Z形成的化合物的水溶液呈碱性D. W与Y具有相同的最高化合价【答案】B【解析】分析:主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃,生成物是HF,因此W是F,Z是Ca,W与Y 同族,则Y是Cl。
W、X、Z的最外层电子数之和为10,则X的最外层电子数为10-7-2=1,所以X是Na,据此解答。
详解:根据以上分析可知W、X、Y、Z分别是F、Na、Cl、Ca。
则A、金属钠常温常压下是固态,A错误;B、CaH2中含有离子键,属于离子化合物,B正确;C、Y与Z形成的化合物是氯化钠,其水溶液显中性,C错误;D、F是最活泼的非金属,没有正价,Cl元素的最高价是+7价,D错误。
答案选B。
点睛:准确判断出元素名称是解答的关键,突破点是能腐蚀玻璃的物质为HF,进而推断出CaF2能与浓硫酸反应生成HF。
易错点是选项B,注意金属氢化物的结构特点,与非金属氢化物的不同。
难点是氟化钙与浓硫酸反应属于学生不熟悉的知识点。
7. 最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。
示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:①EDTA-Fe2+-e-=EDTA-Fe3+②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+该装置工作时,下列叙述错误的是A. 阴极的电极反应:CO2+2H++2e-=CO+H2OB. 协同转化总反应:CO2+H2S=CO+H2O+SC. 石墨烯上的电势比ZnO@石墨烯上的低D. 若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性【答案】CB、根据石墨烯电极上发生的电极反应可知①+②即得到H2S-2e-=2H++S,因此总反应式为CO2+H2S=CO+H2O+S,B正确;C、石墨烯电极为阳极,与电源的正极相连,因此石墨烯上的电势比ZnO@石墨烯电极上的高,C错误;D、由于铁离子、亚铁离子均易水解,所以如果采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需要酸性,D正确。
答案选C。
点睛:准确判断出阴阳极是解答的关键,注意从元素化合价变化的角度去分析氧化反应和还原反应,进而得出阴阳极。
电势高低的判断是解答的难点,注意从物理学的角度借助于阳极与电源的正极相连去分析。
二、非选择题8. 醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。
一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。
实验装置如图所示,回答下列问题:(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。
c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
【答案】 (1). 去除水中溶解氧 (2). 分液(或滴液)漏斗 (3). Zn+2Cr3+=Zn2++2Cr2+ (4). 排除c中空气 (5). c中产生H使压强大于大气压 (6). (冰浴)2冷却 (7). 过滤 (8). 敞开体系,可能使醋酸亚铬与空气接触【解析】分析:在盐酸溶液中锌把Cr3+还原为Cr2+,同时产生氢气排尽装置中的空气防止氧化。
生成的氢气导致c中压强增大,可以把生成的CrCl2压入d装置发生反应,据此解答。
详解:(1)由于醋酸亚铬易被氧化,所以需要尽可能避免与氧气接触,因此实验中所用蒸馏水均需煮沸后迅速冷却,目的是去除水中溶解氧;根据仪器构造可知仪器a是分液(或滴液)漏斗;学科%网(2)①c中溶液由绿色逐渐变为亮蓝色,说明Cr3+被锌还原为Cr2+,反应的离子方程式为Zn+2Cr3+=Zn2++2Cr2+;②锌还能与盐酸反应生成氢气,由于装置中含有空气,能氧化Cr2+,所以氢气的作用是排除c中空气;(3)打开K3,关闭K1和K2,由于锌继续与盐酸反应生成氢气,导致c中压强增大,所以c 中亮蓝色溶液能流入d装置,与醋酸钠反应;根据题干信息可知醋酸亚铬难溶于水冷水,所以为使沉淀充分析出并分离,需要采取的操作是(冰浴)冷却、过滤、洗涤、干燥。
