化工热力学第二章习题解答
化工热力学答案

第二章 均相反应动力学习题1. 【动力学方程形式】有一气相反应,经实验测定在400℃下的速率方程式为:23.66A A dP P dt= 若转化为2(/.)A kC A r mol hl =形式,求相应的速率常数值及其单位。
2. [恒温恒容变压定级数]在恒容等温下,用等摩尔H 2和NO 进行实验,测得如下数据: 总压(MPa )0.0272 0.0326 0.038 0.0435 0.0543 半衰期(s ) 256 186 135 104 67 求此反应级数3.[二级反应恒容定时间]4.醋酸和乙醇的反应为二级反应,在间歇反应反应器中,5min 转化率可达50%,问转化率为75%时需增加多少时间?4、【二级恒容非等摩尔加料】溴代异丁烷与乙醇钠在乙醇溶液中发生如下反应: i-C 4H 9Br+C 2H 5Na →Na Br+i-C 4H 9 OC 2H 5(A)(B) (C) (D)溴代异丁烷的初始浓度为C A0=0.050mol/l 乙醇钠的初始浓度为C B0=0.0762mol/l,在368.15K 测得不同时间的乙醇钠的浓度为:t(min) 0 5 10 20 30 50 C B (mol/l) 0.0762 0.0703 0.0655 0.0580 0.0532 0.0451已知反应为二级,试求:(1)反应速率常数;(2)反应一小时后溶液中溴代异丁烷的浓度;(3)溴代异丁烷消耗一半所用的时间。
5. [恒温恒容变压定级数]二甲醚的气相分解反应CH 3OCH 3 → CH 4 +H 2 +CO 在恒温恒容下进行,在504℃获得如下数据:t (s ) 0 390 777 1195 3155 ∞Pt ×103(Pa ) 41.6 54.4 65.1 74.9 103.9 124.1试确定反应速率常数和反应级数6.[恒温恒压变容定常数]气体反应2A→B,经测定该反应为一级,压力保持不变,组分A为80%,惰性物为20%,三分钟后体积减小了20%,求反应速率常数。
化工热力学课后答案完整版

.第二章流体的压力、体积、浓度关系:状态方程式2-1 试分别用下述方法求出400 ℃、 4.053MPa 下甲烷气体的摩尔体积。
( 1 )理想气体方程;( 2 ) RK 方程;( 3)PR 方程;( 4 )维里截断式( 2-7)。
其中 B 用 Pitzer 的普遍化关联法计算。
[解 ] ( 1 )根据理想气体状态方程,可求出甲烷气体在理想情况下的摩尔体积V id为V id RT8.314(400273.15) 1.381 103m3mol 1p 4.053106(2)用 RK 方程求摩尔体积将RK 方程稍加变形,可写为V RT a(V b)b(E1)p T 0.5 pV (V b)其中0.42748R2T c2.5ap c0.08664 RT cbp c从附表 1 查得甲烷的临界温度和压力分别为T c=190.6K,p c=4.60MPa,将它们代入a, b 表达式得a0.42748 8.3142 190.62.5 3.2217m 6 Pa mol -2 K 0.54.60106b0.086648.314190.6 2.9846 10 5 m3 mol 14.60106以理想气体状态方程求得的V id为初值,代入式( E1)中迭代求解,第一次迭代得到V1值为V18.314673.15 2.984610 54.053106.3.2217 (1.381 100.56673.15 4.053 10 1.381 103 2.9846 10 5 )3(1.381 10 3 2.984610 5 )1.38110 32.984610 5 2.124610 51.3896331 10m mol第二次迭代得 V2为V2 1.381103 2.98461053.2217(1.389610 3 2.984610 5)673.15 0.5 4.05310 61.389610 3(1.389610 3 2.984610 5)1.38110 32.984610 5 2.112010 51.389710 3 m3 mol1V1和 V2已经相差很小,可终止迭代。
化工热力学(下册)第二版-夏清-第2章-吸收答案

第二章 吸收1. 从手册中查得101.33 KPa 、25 ℃时,若100 g 水中含氨1 g ,则此溶液上方的氨气平衡分压为0.987 KPa 。
已知在此组成范围内溶液服从亨利定律,试求溶解度系数H (kmol/ (m 3·kPa))及相平衡常数m 。
解:(1) 求H 由33NH NH C P H *=.求算.已知:30.987NH a P kP *=.相应的溶液浓度3NH C 可用如下方法算出:以100g 水为基准,因为溶液很稀.故可近似认为其密度与水相同.并取其值为31000/kg m .则:333331/170.582/100110000.582/0.590/()0.987NH NH NH a C kmol m H C P kmol m kP *==+∴===⋅ (2). 求m .由333333330.9870.00974101.331/170.01051/17100/180.00974/0.9280.0105NH NH NH NH NH NH NH NH y m x P y P x m y x ****======+=== 2. 101.33 kpa 、10 ℃时,氧气在水中的溶解度可用p O2=3.31×106x 表示。
式中:P O2为氧在气相中的分压,kPa 、x 为氧在液相中的摩尔分数。
试求在此温度及压强下与空气充分接触后的水中,每立方米溶有多少克氧。
解: 氧在空气中的摩尔分数为0.21.故: 222266101.330.2121.2821.28 6.43103.31106 3.3110O O aO O P Py kP P x -==⨯====⨯⨯⨯ 因2O x 值甚小,故可以认为X x ≈即:2266.4310O O X x -≈=⨯ 所以:溶解度6522232()6.431032 1.1410()/()11.4118()g O kg O kg H O m H O --⎡⎤⨯⨯==⨯=⎢⎥⨯⎣⎦3. 某混合气体中含有2%(体积)CO 2,其余为空气。
化工热力学第2章流体的PVT关系
例如:H2 和N2这两种流体
对于H2
状态点记为1,P1 V1 T1
Tr1 =T1/TcH2
Pr1=P1/PcH2
对于N2
状态点记为2,P2 V2 T2
Tr2 =T2/TcN2
Pr2=P2/PcN2
当Tr1=Tr2 ,Pr1=Pr2 时,此时就称这两种流体处
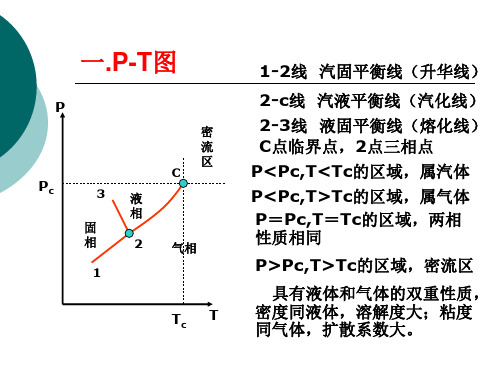
一.P-T图
P
Pc
3液
相
固
相
2
1
密 流 区 C
气相
Tc T
1-2线 汽固平衡线(升华线)
2-c线 汽液平衡线(汽化线) 2-3线 液固平衡线(熔化线) C点临界点,2点三相点 P<Pc,T<Tc的区域,属汽体 P<Pc,T>Tc的区域,属气体 P=Pc,T=Tc的区域,两相 性质相同
P>Pc,T>Tc的区域,密流区
压缩因 子,方 程的计 算值和 实测值 的符合 程度是 判断方 程的优 劣标志 之一。
2. R-K Equation (1949年,Redlich and Kwong)
(1) R-K Eq的一般形式:
P
RT V-b
-
a T0.5V(V
b)
(2-11)
① R-K Equation中常数值不同于范德华方程中的a、b值, 不能将二者混淆。 在范德华方程中,修正项为a/V2,没有考虑温度的影响 在R-K方程中,修正项为,考虑了温度的影响。 ② R-K Equation中常数a、b值是物性常数,具有单位。
为表征物质分子的偏心度,既非球型分子偏离球对称的 程度,简单流体为0
R-K Eq经过修改后,应用范围扩宽。 SRK Eq:可用于两相PVT性质的计算,对烃类计算,其 精确度很高。
【精品】化工热力学第二章习题解答

【精品】化工热力学第二章习题解答化工热力学第二章习题解答1.一个理想气体在恒定温度下,其压强与体积的关系如下所示:P = A / V^2其中P是压强,V是体积,A是常数。
求该气体的热力学过程方程。
解答:根据热力学第一定律,对于恒温过程,有dU = dq + dw = dq - PdV,其中U是内能,q是热量,w是对外界做的功。
由于该气体是理想气体,可以假设其内能只与温度有关,即dU = Cdt,其中C 是常数,t是温度。
将上式代入热力学第一定律中,得到Cdt = dq - PdV。
根据理想气体状态方程PV = nRT,其中n为物质的量,R为气体常数,T为温度。
将P = A / V^2代入上式,得到Cdt = dq - (A / V^2)dV。
对上式两边同时积分,得到∫Cdt = ∫dq - ∫(A / V^2)dV。
即Ct = q - A / V + B,其中B为常数。
综上所述,该气体的热力学过程方程为Ct = q - A / V + B。
2.一个气体在等体过程中,其压强与温度的关系如下所示:P = A * T^2其中P是压强,T是温度,A是常数。
求该气体的热力学过程方程。
解答:根据热力学第一定律,对于等体过程,有dU = dq + dw = dq - PdV,其中U是内能,q是热量,w是对外界做的功。
由于该气体是理想气体,可以假设其内能只与温度有关,即dU = Cdt,其中C 是常数,t是温度。
将上式代入热力学第一定律中,得到Cdt = dq - PdV。
根据理想气体状态方程PV = nRT,其中n为物质的量,R为气体常数,T为温度。
将P = A * T^2代入上式,得到Cdt = dq - (A * T^2)dV。
对上式两边同时积分,得到∫Cdt = ∫dq - ∫(A * T^2)dV。
即Ct = q - (A / 3)T^3 + B,其中B为常数。
综上所述,该气体的热力学过程方程为Ct = q - (A / 3)T^3 + B。
化工热力学第二章习题答案

习题:2-1.为什么要研究流体的pVT 关系?答:在化工过程的分析、研究与设计中,流体的压力p 、体积V 和温度T 是流体最基本的性质之一,并且是可以通过实验直接测量的。
而许多其它的热力学性质如内能U 、熵S 、Gibbs 自由能G 等都不方便直接测量,它们需要利用流体的p –V –T 数据和热力学基本关系式进行推算;此外,还有一些概念如逸度等也通过p –V –T 数据和热力学基本关系式进行计算。
因此,流体的p –V –T 关系的研究是一项重要的基础工作。
2-2.理想气体的特征是什么?答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。
严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理想气体的,可以当作理想气体处理,以便简化问题。
理想气体状态方程是最简单的状态方程:RT pV =2-3.偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?答:纯物质的偏心因子ω是根据物质的蒸气压来定义的。
实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合:⎪⎪⎭⎫ ⎝⎛-=r sr Tp 11log α 其中,c s s r p p p =对于不同的流体,α具有不同的值。
但Pitzer 发现,简单流体(氩、氪、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过r T =0.7,1log -=sr p 这一点。
对于给定流体对比蒸气压曲线的位置,能够用在r T =0.7的流体与氩、氪、氙(简单球形分子)的sr p log 值之差来表征。
Pitzer 把这一差值定义为偏心因子ω,即)7.0(00.1log =--=r s r T p ω任何流体的ω值都不是直接测量的,均由该流体的临界温度c T 、临界压力c p 值及r T =0.7时的饱和蒸气压s p 来确定。
2-4.纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而减小吗?答:正确。
化工热力学第二章习题及答案

化⼯热⼒学第⼆章习题及答案化⼯热⼒学第⼆章作业解答2.1试⽤下述三种⽅法计算673K ,4.053MPa 下甲烷⽓体的摩尔体积,(1)⽤理想⽓体⽅程;(2)⽤R-K ⽅程;(3)⽤普遍化关系式解(1)⽤理想⽓体⽅程(2-4) V =R T P=68.3146734.05310=1.381×10-3m 3·mol -1(2)⽤R-K ⽅程(2-6)从附录⼆查的甲烷的临界参数和偏⼼因⼦为 T c =190.6K ,Pc =4.600Mpa ,ω=0.008 将T c ,Pc 值代⼊式(2-7a )式(2-7b )22.50.42748ccR T a p ==2 2.560.42748(8.314)(190.6)4.610=3.224Pa ·m 6·K 0.5·mol -20.0867ccRT b p ==60.08678.314190.64.610=2.987×10-5 m 3·mol -1将有关的已知值代⼊式(2-6) 4.053×106= 58.3146732.98710V -?-?-0.53.224(673)( 2.98710)V V -+?迭代解得V =1.390×10-3 m 3·mol -1(注:⽤式2-22和式2-25迭代得Z 然后⽤PV=ZRT 求V 也可) (3)⽤普遍化关系式673 3.53190.6r T T T c=== 664.053100.8814.610r P P Pc===? 因为该状态点落在图2-9曲线上⽅,故采⽤普遍化第⼆维⾥系数法。
由式(2-44a )、式(2-44b )求出B 0和B 1B 0=0.083-0.422/T r 1.6=0.083-0.422/(3.53)1.6=0.0269 B 1=0.139-0.172/T r 4.2=0.139-0.172/(3.53)4.2=0.138 代⼊式(2-43)010.02690.0080.1380.0281B P c B B RTcω=+=+?=由式(2-42)得Pr 0.881110.0281 1.0073.53BPc Z RTc Tr=+=+?= ? ?V =1.390×10-3 m 3·mol -12.2试分别⽤(1)Van der Waals,(2)R-K ,(3)S-R-K ⽅程计算273.15K 时将CO 2压缩到⽐体积为550.1cm 3·mol -1所需要的压⼒。
化工热力学第二章习题解答

a 0.42748
b 0.08664
R 2Tc 2.5 3.222 Pa m 6 K 0.5 mol 2 Pc
RTc 2.985 105 m 3 mol 1 Pc
对于 15℃、0.1013MPa 的甲烷气体:
P
RT a 1/2 V b T V (V b)
= 1.401 107 Pa = 138.3 atm > p 安 = 100 atm 故 储气罐会发生爆炸。 2) P = 100 atm = 1.013 10 7 pa 由 RK 方程
1.013 10 7
8.314T 3.2217 0.5 用 Excell 单 5 4 1.6 10 2.985 10 T 1.6 10 (1.6 10 4 2.985 10 5)
3
2-15. 液化气的充装量、操作压力和温度是液化气罐安全操作的重要依据。我国规定液化气罐在最高使用 温度 60℃下必须留有不少于 3%的气相空间,即充装量最多为 97%才能安全。 假设液化气以丙烷为代表物,液化气罐的体积为 35 L,装有 12kg 丙烷。已知 60℃时丙烷的饱和气体摩 尔体积 Vg= 0.008842 m3 mol1 , 饱和液体摩尔体积 Vl= 0.0001283 m3 mol1 。 问在此条件下,液化气 罐是否安全?若不安全,应采取什么具体的措施?若要求操作压力不超过液化气罐设计压力的一半,请问 液化气罐的设计压力为多少? (用 SRK 方程计算) 解:(1) 12kg 丙烷的摩尔总数: n总
n总 n液总 n汽总
V液总 Vl
V气总 Vg
33.95 103 1.05 103 1.283 104 8.842 103
完整版化工热力学答案-冯新-宣爱国-课后总习题答案详解1

解:⑴查附录2知:Tc=369.8K,Pc=4.246MPa,ω=0.152
=4.746Mpa
答:由于钢瓶的实际压力大于其安全工作压力,因此会发生爆炸。
2-17.作为汽车发动机的燃料,如果15℃、0.1013MPa的甲烷气体40 m3与3.7854升汽油相当,那么要多大容积的容器来承载20MPa、15℃的甲烷才能与37.854升的汽油相当?
解:查表得:甲烷Tc=190.6K , Pc=4.60MPa
解:(1) 12kg丙烷的摩尔总数:
按照安全要求,液化气充装量最多为液化气罐的97%,则
液化气罐允许的总丙烷摩尔数为:
显然装载的12kg丙烷已超出液化气罐允许量,此时液化气罐是不安全的。(2)只有将丙烷量减至 以下,才能安全。
(3)用SRK方程(免费软件:/~pjb10/thermo/pure.html)计算得:此时液化气罐的操作压力为3.026bar,因此,液化气罐的设计压力为6.052 bar。
【参考答案】:不同。真实气体偏离理想气体程度不仅与T、p有关,而且与每个气体的临界特性有关,即最本质的因素是对比温度、对比压力以及偏心因子 , 和 。
2-5偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?
【参考答案】:偏心因子ω为两个分子间的相互作用力偏离分子中心之间的作用力的程度。其物理意义为:一般流体与球形非极性简单流体(氩,氪、氙)在形状和极性方面的偏心度。为了提高计算复杂分子压缩因子的准确度。
一、问答题:
2-1为什么要研究流体的pVT关系?
【参考答案】:流体p-V-T关系是化工热力学的基石,是化工过程开发和设计、安全操作和科学研究必不可少的基础数据。(1)流体的PVT关系可以直接用于设计。(2)利用可测的热力学性质(T,P,V等)计算不可测的热力学性质(H,S,G,等)。只要有了p-V-T关系加上理想气体的 ,可以解决化工热力学的大多数问题。
化工热力学第2章习题解答

第2章P-V-T关系和状态方程一、是否题1. 纯物质由蒸汽变成固体,必须经过液相。
(错。
如可以直接变成固体。
)2. 当压力大于临界压力时,纯物质就以液态存在。
(错。
若温度也大于临界温度时,则是超临界流体。
) 3. 由于分子间相互作用力的存在,实际气体的摩尔体积一定小于同温同压下的理想气体的摩尔体积,所以,理想气体的压缩因子Z=1,实际气体的压缩因子Z<1。
(错。
如温度大于Boyle 温度时,Z >1。
) 4. 纯物质的三相点随着所处的压力或温度的不同而改变。
(错。
纯物质的三相平衡时,体系自由度是零,体系的状态已经确定。
) 5. 在同一温度下,纯物质的饱和液体与饱和蒸汽的吉氏函数相等。
(对。
这是纯物质的汽液平衡准则。
)6. 纯物质的平衡汽化过程,摩尔体积、焓、热力学能、吉氏函数的变化值均大于零。
(错。
只有吉氏函数的变化是零。
) 7. 气体混合物的virial 系数,如B ,C …,是温度和组成的函数。
(对。
) 二、选择题1. 指定温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为(C 。
参考P -V 图上的亚临界等温线。
) A. 饱和蒸汽 B. 超临界流体 C. 过热蒸汽2. T 温度下的过热纯蒸汽的压力P (B 。
参考P -V 图上的亚临界等温线。
)A. >()T P sB. <()T P sC. =()T P s3. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到(A 。
要表示出等温线在临界点的拐点特征,要求关于V 的立方型方程)A. 第三virial 系数B. 第二virial 系数C. 无穷项D. 只需要理想气体方程4. 当0→P 时,纯气体的()[]P T V P RT ,-的值为(D 。
因()[]0lim lim ,lim 000=⎪⎭⎫⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂=-=→→→BT T P T P P P Z P Z RT P T V P RT ,又) A. 0 B. 很高的T 时为0 C. 与第三virial 系数有关D. 在Boyle 温度时为零三、填空题1. 表达纯物质的汽平衡的准则有()()()()sl sv sl sv V T G V T G T G T G ,,==或(吉氏函数)、vapvapsV T HdT dP ∆∆=(Claperyon 方程)、()⎰-=svslV V sl sv s V V P dV V T P ),((Maxwell 等面积规则)。
化工热力学第二章_习题解答

第二章习题解答一、问答题:2-1【参考答案】:流体p-V-T 关系是化工热力学的基石,是化工过程开发和设计、安全操作和科学研究必不可少的基础数据。
(1)流体的PVT 关系可以直接用于设计。
(2)利用可测的热力学性质(T ,P ,V 等)计算不可测的热力学性质(H ,S ,G ,等)。
只要有了p-V-T 关系加上理想气体的id p C ,可以解决化工热力学的大多数问题。
2-2【参考答案】:1)超临界流体区的特征是:T >T c 、p >p c 。
2)临界点C 的数学特征:3)饱和液相线是不同压力下产生第一个气泡的那个点的连线;4)饱和汽相线是不同压力下产生第一个液滴点(或露点)那个点的连线。
5)过冷液体区的特征:给定压力下液体的温度低于该压力下的泡点温度。
6)过热蒸气区的特征:给定压力下蒸气的温度高于该压力下的露点温度。
7)汽液共存区:在此区域温度压力保持不变,只有体积在变化。
2-3【参考答案】:气体只有在低于T c 条件下才能被液化。
2-4【参考答案】:不同。
真实气体偏离理想气体程度不仅与T 、p 有关,而且与每个气体的临界特性有关,即最本质的因素是对比温度、对比压力以及偏心因子r T ,r P 和ω。
2-5【参考答案】:偏心因子ω为两个分子间的相互作用力偏离分子中心之间的作用力的程度。
其物理意义为:一般流体与球形非极性简单流体(氩,氪、氙)在形状和极性方面的偏心度。
为了提高计算复杂分子压缩因子的准确度。
偏心因子不可以直接测量。
偏心因子ω,ω由测定的对比温度为0.7时的对比饱和压力的数据计算而得,并不能直接测量。
2-6 【参考答案】:所谓状态方程的普遍化方法是指方程中不含有物性常数a ,b ,而是以对比参数作为独立变量;普遍化状态方程可用于任何流体、任意条件下的PVT 性质的计算。
普遍化方法有两种类型:(1)以压缩因子的多项式表示的普遍化关系式 (普遍化压缩因子图法);(2)以()()()()点在点在C V PC V PT T 0022==∂∂∂两项virial 方程表示的普遍化第二virial 系数关系式(普遍化virial 系数法)2-7【参考答案】:三参数对应状态原理与两参数对应状态原理的区别在于为了提高对比态原理的精度,引入了第三参数如偏心因子ω。
化工热力学课后题答案杨 版很好

第二章习题解答2-13. 某反应器容积为31.213m ,内装有温度为0227C 的乙醇45.40kg 。
现请你试用以下三种方法求取该反应器的压力,并与实验值(2.75M Pa )比较误差。
(1)用理想气体方程;;(2)用RK 方程;(3)用普遍化状态方程。
解:(1)用理想气体方程 M P a Vn R T P 38.310213.115.50010314.8987.063=⨯⨯⨯⨯==误差:%9.22 (2)用R-K 方程乙醇:K T C 2.516=, M P a P C 38.6= 765.2625.22108039.21038.62.51610314.842748.042748.0⨯=⨯⨯⨯⨯==CCP T R a0583.01038.62.51610314.808664.008664.063=⨯⨯⨯⨯==CCP RT b3229.1987.0213.1m V ==/mol()()MPab V V Ta bV RT P 76.2109247.7105519.30583.0229.1229.115.500108039.20583.0229.115.50010314.85625.0735.0=⨯-⨯=⨯+⨯--⨯⨯=+--=误差:%36.0(3)用三参数普遍化关联 (2<r V 用普压法关联,MPa P 7766.2=) 设P=2.75MPa查图2-12~2-13:82.00=Z, 055.01-=Z7845.0055.0645.082.01=⨯-=+=Z Z Z ω误差:%64.32-16. 乙烷是重要的化工原料,也可以作为冷冻剂。
现装满290 K 、2.48 MPa 乙烷蒸气的钢瓶,不小心接近火源被加热至478 K ,而钢瓶的安全工作压力为4.5 MPa ,问钢瓶是否会发生爆炸? (用RK 方程计算)解:(1)先根据290 K 、2.48 MPa ,求摩尔体积v=7.729×10-4m3/mol 过程略。
化工热力学习题及答案 第二章 流体的PVT关系

第二章 流体的PVT 性质2-1使用下述三种方法计算1kmol 的甲烷储存在容积为0.1246m3、温度为50℃的容器中所产生的压力是多少? (1) 理想气体状态方程; (2) Redlich -Kwong 方程; (3) 普遍化关系式。
解:查附录表可知:KTc6.190=,MPap c6.4=,1399-⋅=molcmVc,008.0=ω(1)理想气体状态方程:MPaPa VnRT p 56.2110156.21246.015.323214.810173=⨯=⨯⨯⨯==(2)R -K 方程:15.0365.225.22225.3106.46.190314.84278.04278.0-⋅⋅⋅=⨯⨯⨯==molKm Pa p TcR a c135610987.2106.46.190314.80867.00867.0--⋅⨯=⨯⨯⨯==molm p RTc b c545.055.010)987.246.12(10246.115.323225.310)987.246.12(15.323314.8)(---⨯+⨯⨯⨯-⨯-⨯=+--=a V V TabV RT p M P a Pa 04.1910904.17=⨯=(3) 遍化关系式法226.1109.910246.154=⨯⨯==--VcV Vr 应该用铺片化压缩因子法Pr 未知,需采用迭代法。
ZZ Vp ZRT p c r 688.410246.1106.415.323314.846=⨯⨯⨯⨯==-令875.0=Z得:10.4=rp查表2-8(b )和2-7(b )得:24.01=Z ,87.00=Z872.024.0008.087.01=⨯+=+=ZZZ ωZ 值和假设值一致,故为计算真值。
MPaPa VZRT p 87.1810877.110246.115.323314.8875.074=⨯=⨯⨯⨯==-2-2 欲将25Kg 、298K 的乙烯装入0.1m 3的刚性容器中,试问需多大压力: 解:乙烯的摩尔数:mol n 857.8922825000==乙烯的摩尔体积:)(1012.1857.8921.0134--⋅⨯==molm V查表得:KTc4.282=,)(10129136--⋅⨯=mol m Vc,MPap c036.5=,085.0=ω28682.01029.11012.144 =⨯⨯=--r V 可见由普遍化压缩因子法计算0552.14.282298==TrZZ VZRT p r 7410212.21012.1298314.8⨯=⨯⨯⨯==- (A )有由rr c p p p p610036.5⨯==1ZZZ ω+= (B )设Z 值代入A 式求p ,由Pr 、Tr 查图得Z0和Z1,代入B 式迭代求解Z 结果为:45.1=r p ,33.0=ZM P a Z p 677103.733.010212.210212.2⨯=⨯⨯=⨯=2-3 分别用理想气体方程和Pitzer 普遍化方法,计算510K 、2。
化工热力学(下册)第二版夏清第2章吸收答案

化工热力学(下册)第二版夏清第2章吸收答案第二章吸收1. 从手册中查得 KPa 、25 ℃时,若100 g 水中含氨1 g ,则此溶液上方的氨气平衡分压为KPa 。
已知在此组成范围内溶液服从亨利定律,试求溶解度系数H (kmol/ (m 3·kPa))及相平衡常数m 。
解:(1)求H 由33NH NH C P H*=.求算.已知:30.987NH a P kP *=.相应的溶液浓度3NH C 可用如下方法算出:以100g 水为基准,因为溶液很稀.故可近似认为其密度与水相同.并取其值为31000/kg m .则:333331/170.582/100110000.582/0.590/()0.987NH NH NH a C kmol m H C P kmol m kP *==+∴===? (2). 求m .由333333330.9870.00974101.331/170.01051/17100/180.009740.0105NH NH NH NH NH NH NH NH y m x P y P x m y x ****======+=== 2. kpa 、10 ℃时,氧气在水中的溶解度可用p O2=×106x 表示。
式中:P O2为氧在气相中的分压,kPa 、x 为氧在液相中的摩尔分数。
试求在此温度及压强下与空气充分接触后的水中,每立方米溶有多少克氧。
解:氧在空气中的摩尔分数为0.21.故:222266101.330.2121.2821.28 6.43103.31106 3.3110O O a O O P Py kP P x -==?==== 因2O x 值甚小,故可以认为X x ≈ 即:2266.4310O O X x -≈=?所以:溶解度6522232()6.4310321.1410()/()11.4118()g O kg O kg H O m H O --==?=3. 某混合气体中含有2%(体积)CO 2,其余为空气。
《化工热力学》详细课后习题答案解析(陈新志)

2习题第1章 绪言一、是否题1. 孤立体系的热力学能和熵都是一定值。
(错。
和,如一体积等于2V 的绝热刚性容器,被一理想的隔板一分为二,左侧状态是T ,P 的理想气体,右侧是T 温度的真空。
当隔板抽去后,由于Q =W =0,,,,故体系将在T ,2V ,0.5P 状态下达到平衡,,,)2. 封闭体系的体积为一常数。
(错)3. 封闭体系中有两个相。
在尚未达到平衡时,两个相都是均相敞开体系;达到平衡时,则两个相都等价于均相封闭体系。
(对)4. 理想气体的焓和热容仅是温度的函数。
(对)5. 理想气体的熵和吉氏函数仅是温度的函数。
(错。
还与压力或摩尔体积有关。
)6. 要确定物质在单相区的状态需要指定两个强度性质,但是状态方程 P=P (T ,V )的自变量中只有一个强度性质,所以,这与相律有矛盾。
(错。
V 也是强度性质)7. 封闭体系的1mol 气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积相等,初态和终态的温度分别为T 1和T 2,则该过程的;同样,对于初、终态压力相等的过程有。
(对。
状态函数的变化仅决定于初、终态与途径无关。
)8. 描述封闭体系中理想气体绝热可逆途径的方程是(其中),而一位学生认为这是状态函数间的关系,与途径无关,所以不需要可逆的条件。
(错。
) 9. 自变量与独立变量是一致的,从属变量与函数是一致的。
(错。
有时可能不一致)10. 自变量与独立变量是不可能相同的。
(错。
有时可以一致)三、填空题1. 状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态 。
2. 单相区的纯物质和定组成混合物的自由度数目分别是 2 和 2 。
3. 封闭体系中,温度是T 的1mol 理想气体从(P ,V )等温可逆地膨胀到(P ,V ),则所做的功为i i f f(以V 表示)或 (以P 表示)。
4. 封闭体系中的1mol 理想气体(已知),按下列途径由T 1、P 1和V 1可逆地变化至P,则mol ,温度为 和水 。
化工热力学答案

第二章1. 在常压和0℃下,冰的熔化热是334.4Jg -1,水和冰的质量体积分别是1.000和1.091cm 3 g -1,且0℃时水的饱和蒸汽压和汽化潜热分别为610.62Pa 和2508Jg -1,请由此估计水的三相点数据。
解:在温度范围不大的区域内,汽化曲线和熔化曲线均可以作为直线处理。
对于熔化曲线,已知曲线上的一点是273.15K ,101325Pa ;并能计算其斜率是 7103453.1⨯-=∆∆=fusm fus m V T H dT dP PaK -1 熔化曲线方程是()15.273103453.11013257-⨯-=T P m对于汽化曲线,也已知曲线上的一点是273.15K ,610.62Pa ;也能计算其斜率是4688.262.61015.273314.815.2732508=⨯⨯=∆≈∆∆=svb vapvap b vap s V T H V T H dT dPPaK -1汽化曲线方程是()15.2734688.262.610-+=T P s解两直线的交点,得三相点的数据是:09.615=tP Pa ,1575.273=t T K第三章试由饱和液体水的性质估算(a)100℃,2.5MPa 和(b)100℃,20MPa 下水啊101325.0=s P MPa ,04.419=sl H Jg-1,3069.1=slS J g-1K -1,0435.1=sl V cm 3 g -1,0008.0=⎪⎪⎭⎫ ⎝⎛≈⎪⎭⎫ ⎝⎛dT dV T V sl P ∂∂cm 3 g -1 K -1 解:体系有关状态点如图所示所要计算的点与已知的饱和点是在同一条等温线上,由0008.0-=⎪⎪⎭⎫ ⎝⎛-≈⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂dT dV T V P S sl p T cm 3 g -1 K -1得()()101325.00008.03069.10008.00008.0--=-≈-≈-⎰P S P P dP S S PP ssl s或又 745.00008.015.3730435.1=⨯-=⎪⎪⎭⎫ ⎝⎛-≈⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂dT dV T V T V T V P H sl sl P T cm 3 g -1得()()101325.0745.004.419745.0745.0-+=-=≈-⎰P H P P dP H H PP ssl s或 当P =2.5MPa 时,S =1.305 Jg -1 K -1;H = 420.83J g -1; 当P =20MPa 时,S = 1.291Jg -1 K -1;H =433.86J g -1。
(整理)化工热力学答案

第二章 均相反应动力学习题1. 【动力学方程形式】有一气相反应,经实验测定在400℃下的速率方程式为:23.66A A dP P dt= 若转化为2(/.)A kC A r mol hl =形式,求相应的速率常数值及其单位。
2. [恒温恒容变压定级数]在恒容等温下,用等摩尔H 2和NO 进行实验,测得如下数据: 总压(MPa )0.0272 0.0326 0.038 0.0435 0.0543 半衰期(s ) 256 186 135 104 67 求此反应级数3.[二级反应恒容定时间]4.醋酸和乙醇的反应为二级反应,在间歇反应反应器中,5min 转化率可达50%,问转化率为75%时需增加多少时间?4、【二级恒容非等摩尔加料】溴代异丁烷与乙醇钠在乙醇溶液中发生如下反应: i-C 4H 9Br+C 2H 5Na →Na Br+i-C 4H 9 OC 2H 5(A)(B) (C) (D)溴代异丁烷的初始浓度为C A0=0.050mol/l 乙醇钠的初始浓度为C B0=0.0762mol/l,在368.15K 测得不同时间的乙醇钠的浓度为:t(min) 0 5 10 20 30 50 C B (mol/l) 0.0762 0.0703 0.0655 0.0580 0.0532 0.0451已知反应为二级,试求:(1)反应速率常数;(2)反应一小时后溶液中溴代异丁烷的浓度;(3)溴代异丁烷消耗一半所用的时间。
5. [恒温恒容变压定级数]二甲醚的气相分解反应CH 3OCH 3 → CH 4 +H 2 +CO 在恒温恒容下进行,在504℃获得如下数据:t (s ) 0 390 777 1195 3155 ∞Pt ×103(Pa ) 41.6 54.4 65.1 74.9 103.9 124.1试确定反应速率常数和反应级数6.[恒温恒压变容定常数]气体反应2A→B,经测定该反应为一级,压力保持不变,组分A为80%,惰性物为20%,三分钟后体积减小了20%,求反应速率常数。
化工热力学第二章作业参考答案

1、 针对以下体系写出能量平衡方程式的简化形式:(这是修改后的正确答案)QU QW U U H U H Z g U QQU =∆+=∆=∆+∆=∆+∆=∆+∆=∆=∆)7()6(021)5(021)4(021)3(H )2()1(222 2、实验室有一瓶氢气为60atm ,0.100m 3,由于阀门的原因缓慢漏气。
试问到漏完时:(1)该气体作了多少功?吸收了多少热?(2)该气体在此条件下最大可以作多少功?吸收多少热量?(3)该气体焓的变化为多少?瓶中气体焓的变化为多少?已知室温为20℃,气体可以认为是理想气体。
解:(1)id.g ,T 恒定⇒0=∆U ;J V P P V P V P V P V P V V P dV P W sur V V sur 5112111222122110*5.978)()(21-=-=-=-=-=-=⎰ J W Q 510*978.5=-=(2)等温可逆过程做功最大J P P V P V V nRT PdV W V V 612111210*489.2ln ln 21==-=-=⎰ J W Q 610*489.2=-=(3)id.g, T 恒定⇒0=∆H ,故总气体的焓变为0。
设起初瓶中气体的焓为1H ,则终态总气体的焓仍1H ,终态气瓶中气体的焓为111212111601H H P P H V V H n n ===瓶⇒11126059)1(H H P P H =-=∆瓶 4. 一台透平机每小时消耗水蒸气4540kg 。
水蒸气在4.482MPa 、728K 下以61m/s 的速度进入机内,出口管道比进口管道低3m ,排气速度366m/s 。
透平机产生的轴功为703.2kW ,热损失为1.055×105kJ/h ,乏气中的一小部分经节流阀降压至大气压,节流阀前后的流速变化可以忽略不计。
试求经节流阀后水蒸气的温度及其过热度。
解:取透平机为体系,则能量方程为:s W Q u z g H +=∆+∆+∆2/2其中:Q = -4540/10055.15⨯= - 23.238 kJ·kg -1s W = =⨯-4540/36002.703- 557.604 kJ·kg -1=∆z g - 9.81⨯3 = - 0.0294 kJ·kg -1 2/2u ∆= (3662-612) / 2 = 65.118 kJ·kg -1则:2/2u z g W Q H s ∆-∆-+=∆= - 23.238 - 557.604 + 0.0294 - 65.118 = - 645.930 kJ/kg 采用内插法查表得4.482 MPa, 728 K 时的蒸汽焓为 3334.78 kJ·kg -1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
变量求解得 T =261.25 K, 即温度不超过 -11.9 C
0
。
3)P = 100 atm = 1.013 10 7 Pa 解法 1:由 RK 方程
T = 40℃
1.013 107
8.314 313.15 3.2217 5 0.5 V 2.985 10 313.15 V (V 2.985 10 5 )
B 0 0.083 0.422 /( 1.5652 )1.6 0.123 B 0.139 0.172 /( 1.5652 )4.2 0.113 BPc B 0 B 0.123 0.098 0.113 0.1119 RTc
B 0.1119 8.314 305.4 5.817 10 5 m 3 / mol 4.884 10 6 PV BP z 1 RT RT
1
2-14. 容积 1m3 的贮气罐,其安全工作压力为 100 atm,内装甲烷 100 kg,问: 1)当夏天来临,如果当地最高温度为 40℃时,贮气罐是否会爆炸?(本题用 RK 方程计算) 2)上问中若有危险,则罐内最高温度不得超过多少度? 3)为了保障安全,夏天适宜装料量为多少 kg? 4)如果希望甲烷以液体形式储存运输,问其压缩、运输的温度必须低于多少度? 解:1)甲烷的临界参数为 : Tc = 190.6 K , Pc = 4.6 MPa
第二章部分习题解答
2-13. 某反应器容积为 1.213 m ,内装有温度为 227 C 的乙醇 45.40 kg 。现请你试用以下三种方法求取 该反应器的压力,并与实验值( 2.75 MPa )比较误差。 (1)用理想气体方程; ; (2)用 RK 方程; (3) 用普遍化状态方程。 解: (1)用理想气体方程
=54.597×105-7.1341×105 =4.746Mpa 答:由于钢瓶的实际压力大于其安全工作压力,因此会发生爆炸。
5
2-17. 作为汽车发动机的燃料,如果 15 ℃、0.1013 MPa 的甲烷气体 40 m3 与 3.7854 升汽油相当,那么要 多大容积的容器来承载 20 MPa、15 ℃的甲烷才能与 37.854 升的汽油相当? 解:查表得:甲烷 Tc=190.6K , Pc=4.60MPa 利用 RK 方程计算:
∴使用普遍化第二维里系数法。
B 0 0.083 0.422 / 0.951.6 0.375 B 0.139 0.172 / 0.95 4.2 0.074 BPC B 0 B 0.375 0.098 ( 0.074 ) 0.3823 RTC z 1 BPC Pr 0.51 1 0.3823 0.795 RTC Tr 0.95
查图 2-12~2-13: Z 0 0.82 ,
Z 1 0.055
Z Z 0 Z 1 0.82 0.645 0.055 0.7845
P ZRT 0.7845 8.314 10 3 500.15 10 6 2.65MPa V 1.229
误差: 3.64%
T = 40 ℃
又
p
=
RT a 0.5 V b T V (V b)
8.314 313.15 3.2217 4 5 0.5 4 1.6 10 2.985 10 313.15 1.6 10 (1.6 10 4 2.985 10 5 )
b 0.08664 RTC / PC 0.08664 8.314 305 .4 / 4.884 10 6 4.5 10 5 m 3 / mol
RT a V b T 0.5V ( V b ) 8.314 478 9.86 7.729 10 4 4.5 10 5 478 0.5 7.729 10 4 ( 7.729 10 4 4.5 10 5 ) p
直接迭代得:V = 2.259 10 4 m 3 /mol
2
解法 2:
Bb
RT
2.985 10
5
[8.314 ( 273.15 40)]
1.147 10 8
Bp 1.147 10 8 100 1.013 10 5 0.1162 h z z z z 1 2.343 h 1 h 1 h
= 1.401 107 Pa = 138.3 atm > p 安 = 100 atm 故 储气罐会发生爆炸。 2) P = 100 atm = 1.013 10 7 pa 由 RK 方程
1.013 10 7
8.314T 3.2217 0.5 用 Excell 单 5 4 1.6 10 2.985 10 T 1.6 10 (1.6 10 4 2.985 10 5)
R 2Tc a = 0.42748 pc
b = 0.08664
2.5
=0.42748
8.314 2 190.6 2.5 = 3.2217 4.6 10 6
RTc 8.314 190.6 5 = 0.08664 =2.985 10 6 pc 4.6 10
V=
1 4 =1.6 10 m 3 /mol 3 100 10 16
n总 n液总 n汽总
V液总 Vl
V气总 Vg
33.95 103 1.05 103 1.283 104 8.842 103
264.6mol 0.11875mol 264.7185mol
显然装载的 12kg 丙烷已超出液化气罐允许量,此时液化气罐是不安全的。 (2)只有将丙烷量减至 264.7185 44.1 11.674kg 以下,才能安全。 (3)用 SRK 方程(免费软件: /~pjb10/thermo/pure.html)计算得: 此时液化气 罐的操作压力为 3.026bar,因此,液化气罐的设计压力为 6.052 bar。
W 12000 272.1mol M 44.1
按照安全要求,液化气充装量最多为液化气罐的 97%,则
V液总 97%V总 0.97 35 103 33.95 103 m3 V气总 3%V总 0.03 35 103 1.05 103 m3
液化气罐允许的总丙烷摩尔数为:
m=n·M=4.427×103×16×10-3=70.8kg 夏天适宜装料量为 70.8kg 解法 3:用 Excell 单变量求解得 V = 2.259 10 4 m 3 /mol 则适宜装料量 m =
1 16 = V
70827.8 g = 70.83 kg
4) 要使甲烷以液体形式储存运输,则 T < Tc ,即温度须低于 190.6K , 即–82.55 0 C 。
则 P RT
V B
8.314 478 4.78 MPa 7.732 10 4 5.817 10 5
解法 2:R-K 方程
a 0.42748 R 2TC
2.5 2 2.5 / PC 0.42748 8.314 305.4
4.884 10 6
9.86( Pa m 6 K 0.5 ) / mol 2
8.314 288.15 3.222 5 1/2 V 2.985 10 288.15 V (V 2.985 105 )
101300
利用 Excel“单变量求解”工具或者直接迭代法 得 V=0.0236 m 3 mol 1
40 mol 1694.9mol 0.0236
4
2-16. 乙烷是重要的化工原料,也可以作为冷冻剂。现装满 290 K、2.48 MPa 乙烷蒸气的钢瓶,不小心接 近火源被加热至 478 K,而钢瓶的安全工作压力为 4.5 MPa,问钢瓶是否会发生爆炸? (用 RK 方程计算) 解:由附录查得乙烷的临界参数。 TC=305.4K,PC=4.884MPa,VC=1.48×10-4 m3/mol; ω=0.098, 1)T=290K,P=2.48Mpa ∵Tr=T/Tc=0.95 Pr=P/Pc=0.51
3
2-15. 液化气的充装量、操作压力和温度是液化气罐安全操作的重要依据。我国规定液化气罐在最高使用 温度 60℃下必须留有不少于 3%的气相空间,即充装量最多为 97%才能安全。 假设液化气以丙烷为代表物,液化气罐的体积为 35 L,装有 12kg 丙烷。已知 60℃时丙烷的饱和气体摩 尔体积 Vg= 0.008842 m3 mol1 , 饱和液体摩尔体积 Vl= 0.0001283 m3 mol1 。 问在此条件下,液化气 罐是否安全?若不安全,应采取什么具体的措施?若要求操作压力不超过液化气罐设计压力的一半,请问 液化气罐的设计压力为多少? (用 SRK 方程计算) 解:(1) 12kg 丙烷的摩尔总数: n总
3 0
P
nRT 0.987 8.314 10 3 500.15 10 6 3.38MPa V 1.213
误差: 22.9% (2)用 R-K 方程 乙醇: TC 516.2 K ,
PC 6.38MPa
0.42748 R 2TC a PC
2.5
0.42748 8.314 2 10 6 516.2 2.5 2.8039 10 7 6.38 10 6
用迭代法求解如下 迭代次数 0 1 2 3 z=0.8788 又 pV=nZRT z 1 0.8876 0.8794 0.8788 h 0.1162 0.1309 0.1321 0.1321
pV 100 1.013 10 5 1 n 4.427 10 3 mol RTZ 8.314 313.15 0.8788
b
V
0.08664 RTC 0.08664 8.314 10 3 516.2 0.0583 PC 6.38 10 6
