辛酸-硫酸铵法纯化单克隆抗体
辛酸_硫酸铵联合沉淀法在单克隆抗体纯化中的应用_陈丹

5 结束语 脂质筏结构被人们认识以来, 其确切的生理功能仍然
glycolipids enriched membrane subdomains during transport to the apical cell surface[J].Cell, 1992, 68( 3) : 533- 544. [7] BROWN D A, LONDON E.Structure and function of sphingolipid
[9] DANIELSEN E M.Lipid rafts in epithelial brush borders: atypical membrane microdomains with specialized functions[J].Biochim Biophys Acta, 2003, 1617( 1- 2) : 1- 9.
[13] 杨 福 愉 .生 物 膜 结 构 研 究 的 一 些 进 展[J].生 物 化 学 与 生 物 物 理 进
有待大量研究, 特别是对质膜微囊和脂筏介导的内吞途径
and cholesterol- rich membrane rafts [J].Biol Chem, 2000, 275( 23) :
的分子细节了解, 而脂筏与微生物相互作用为这方面的研 究提供了一个非常好的实验模型。通过对病原微生物如何
17221- 17224. [8] SILVIUS J R.Role of cholesterol in lipid raft formation: lessons
from lipid model systems [J].Biochim Biophys Acta, 2003, 1610( 2) :
利用脂筏介导其内吞及内吞入胞后在胞内的转运的研究,
hGH单克隆抗体的筛选及双抗体夹心ELISA检测方法的建立

体 的效价 与特异性 , 并进行抗体类型 、 相对 亲和 力测 定; 应用纯化的单抗建立 h H双抗体 夹心 E IA检测 方法。筛 G LS 选 出两株 可以稳 定分泌抗 h H单抗 的杂 交瘤细胞株 , 别命名 为 3 2 9 抗体 类型均 为 IG , G 分 E G, g 1 抗体 滴度 均 可达 1 , 0 特异性好 , 相对 亲和 力高 , 以筛选到 的 两株 单抗建 立的双 抗 夹心 E IA法 线性 范围为 00 LS .9~152 n/ L .6 5 g m , R > . ,灵敏度 为 0 0 n/ L 09 .9 g m 。筛选出高效抗 h H的单抗 , G 并建立 了 h H双抗体 夹心 E IA检测方法。 G LS 关键词 : 人生长激素 ; 克隆抗体 ; 单 双抗体夹心 E IA法 LS 中图分类 号 :5 3 R 9 .1 Q 0 ; 3 2 1 文献标识码 : B 文章编号 :0 5—13 (0 1 0 0 9 0 29 76 2 1 )5— 04— 4
第2 8卷第 5期
21 0 1年 1 0月
生 物 学 杂 志
J RNAL OF BI OGY OU OL
Байду номын сангаас
V0 . 8 No 5 I2 . 0e .2 t 011
di 0 36 /.sn2 9 13 .0 10 .9 o: .99 ji .0 5— 7 6 2 1. 50 4 1 s
S r e i g o o o l n la tb d g i tr c m b n n u a r wt c e n n fm n co a n i o y a ans e o i a th m n g o h
辛酸硫酸铵纯化方法

所需溶液配制:1.0.06mol/L pH=4.8醋酸盐缓冲液:无水醋酸钠0.29g,冰醋酸0.141mL,纯水定容至100mL。
2.2mol/L氢氧化钠溶液:16g氢氧化钠固体用于200ml纯水中。
3.2mol/L盐酸溶液:取33m L36.4%的浓盐酸定容至200mL纯水中。
4.0.1mol/L PBS缓冲液:80.0 NaCl,KCl 2.0g,Na2HPO4· 12H2O 29.0g,KH2PO4 2.0g,加超纯水定容至1L。
单克隆抗体采用辛酸-硫酸铵方法纯化,具体步骤如下:(1)将腹水从-20°C冰箱拿出室温解冻。
腹水用双层滤纸过滤,初步除去杂质、脂肪及细胞碎片。
4°C,12000r/min,离心15min,收集上清,弃沉淀。
精确定量腹水体积。
(2)一份体积的腹水与2-4份体积的醋酸盐缓冲液磁力搅拌混匀,用2mol/L HCL 调PH至4.5-4.8。
(3)磁力搅拌下缓慢加入正辛酸,33μL/mL腹水,加完后室温磁力搅拌半小时,后置4°C静置2h以上。
(4)4°C ,12000r/min,离心5min,收集上清,双层滤纸过滤,收集滤液。
(5)量取滤液体积,加入1/10体积的0.1M pH=7.4 的PBS,用2mol/L NaOH(记录NaOH 体积)调pH至7.4。
(6)将上清冰浴预冷,加硫酸铵固体至0.277g/mL,边加边搅拌,并于30min内加完,置4°C过夜。
(7)12000r/min,离心15min,弃上清。
用一定体积的0.01mol/LPBS溶解沉淀。
用PB 透析两天后换0.01mol/LPBS 透析两天。
收集透析液,12000r/min,离心15min,取上清,置-20°C预冻后真空冻干成粉保存。
张道宏师姐版本:用1/10原腹水体积的0.01mol/L pH值7.4 PBS溶解沉淀;对0.01mol/L pH值7.4的PBS透析一天,离心去掉不溶杂质,用纯水进行透析,优球蛋白析出后离心收集澄清抗体溶液,置于-20°C预冻;冻干保存。
应用辛酸硫酸胺法提取小鼠腹水和血清中的IgG抗体

应用辛酸硫酸胺法提取小鼠腹水和血清中的IgG抗体
白丽;钱金;王晶
【期刊名称】《大理学院学报(医学版)》
【年(卷),期】2000(009)004
【摘要】目的:从小鼠腹水和血清中纯化IgG抗体.方法:首先用辛酸沉淀小鼠腹水和血清中的非免疫球蛋白,然后用固体硫酸胺提取抗人T和B细胞白血病单克隆抗体(IgG1和Ig2b)和多克隆IgG抗体.结果:经SDS-PAGE和活细胞免疫荧光法鉴定,获得了纯度高、活性好的抗体,腹水中单抗的回收率达80%以上.结论:本方法是一种简单、价廉且有效的纯化小鼠腹水和血清IgG抗体的方法.
【总页数】2页(P3-4)
【作者】白丽;钱金;王晶
【作者单位】大理医学院微生物学及免疫学教研室云南大理 671000;大理医学院微生物学及免疫学教研室云南大理 671000;大理医学院微生物学及免疫学教研室云南大理 671000
【正文语种】中文
【中图分类】R392.11
【相关文献】
1.辛酸-硫酸铵联合沉淀法在单克隆抗体纯化中的应用 [J], 陈丹;孙广瑞;柳增善
2.改良的紫外荧光光度计法检测小鼠血清中多巴胺β羟化酶活性的方法 [J], 刘林林;孙宝胜;杨巍;刘晓岚
3.ELISA法检测囊尾蚴虫病IgG抗体中弱阳性质控血清的制备及应用 [J], 杨柳莹;孙黎;赵仪;陈曦阳;王晓凤;凌攀
4.应用辛酸硫酸铵法提取纯化兔IgG [J], 马贵军;韩素娟;剡根强;周霞
5.辛酸-硫酸铵法在纯化血清旋毛虫特异性IgG抗体中的应用 [J], 刘俊琴;申丽洁因版权原因,仅展示原文概要,查看原文内容请购买。
辛酸-硫酸铵法纯化单克隆抗体

辛酸-硫酸铵法纯化单克隆抗体??辛酸-硫酸铵法纯化单克隆抗体(一) 原理蛋白质在溶液中的溶解度取决于蛋白质周围亲水基团与水形成水化膜的程度, 以及蛋白质分子带有的电荷。
如改变这两个因素,蛋白质就容易沉淀折出。
引起蛋白质沉淀的主要方法有(1) 盐析, 即加入大量中性盐破坏蛋白质的胶体稳定性而使其析出, 沉淀不同蛋白质所需盐浓度及pH 值不同;(2) 生物碱以及某些酸类, 在pH 值小于等电点时可以与蛋白质形成不溶的盐使其沉淀;(3) 重金属离子如隶、铅、铜、银等, 在pH 值大于等电点时可以与蛋白质结合成不溶的盐使其沉淀;(4) 有机溶剂如酒精、甲醇、丙酮等, 对水的亲和力很大, 能破坏蛋白质水化膜, 在等电点时使蛋白质沉淀。
辛酸(caprylic acid) 在偏酸条件下能与血清或腹水中除IgG外的其他蛋白质结合并将其沉淀下来,IgG 则溶于上清液中, 再用硫酸镀盐析, 即可达到纯化IgG 的目的。
辛酸-硫酸铵法是目前实验室中较常用的纯化单克隆抗体的方法, 利用该方法纯化单克隆抗体, 回收率和纯度都可达80% 以上。
(二) 试剂和器材1. 试剂(1) 小鼠腹水。
(2) 硫酸铵或饱和硫酸铵溶液。
称(NH4)2S04(AR)400~425 克, 以50 ℃~80 ℃蒸馆水500ml溶解, 搅拌2O min, 趁热过滤。
冷却后以浓氨水(15M NH40H) 调pH 值至7.4 。
配制好的饱和硫酸铵, 瓶底应有结晶析出。
(3)0.06M pH 4.8 醋酸盐缓冲液。
贮存液: A 液,0.06M NaAc: 无水NaAc0.49218g 加蒸馆水至100mlB 液,0.06M HAc: 冰醋酸0.344ml 加蒸馆水至100ml应用液: 取上述 A 液59ml 与 B 液41ml 昆合, 用5M NaOH 调pH 值至 4.80.(4)0.lM pH 7.4 磷酸盐缓冲液(PBS). 取Na2HP04 · 12H20 28.94g,KH2P04 2.61g, 加蒸馆水至100Om1(5) 含137mM NaCl 2.6mM KCl 0.2mM EDTA 的pH 7.4 磷酸盐缓冲液(PBS): 取Na2HP04 12H20 28.94g KH2P04 2.61g NaC1 8.Og 、KCl 0.2g EDTA 0.06g, 加蒸馆水至100Oml2. 器材普通冰箱、低温离心机、电磁搅拌器, 紫外分光光度计、天平; 透析袋、塑料夹、精密pH 试纸; 烧杯、量桶、吸管、滴管、小瓶等。
小鼠单抗腹水纯化步骤

小鼠单抗腹水纯化一、初纯——辛酸—硫酸铵法【原理】在酸性条件下(pH=4.5),非IgG的蛋白成分(包括白蛋白,部分Ig),能被辛酸等短链脂肪酸沉淀,上清中剩余的蛋白主要为IgG,再用硫酸铵沉淀上清,即可获得纯度较高的IgG。
辛酸—硫酸铵法比硫酸铵法能或得更高纯度的IgG。
【溶液配制】1、60mM的醋酸缓冲液(pH4.0)200ml取0.2M醋酸缓冲液母液60ml,加ddH2O至200ml,调pH为4.04.0.2M醋酸缓冲液母液60ml:○10.2mM乙酸49.2ml,折合566μl的冰乙酸。
○20.2M乙酸钠10.8ml(0.2M乙酸钠:2.72g三水合乙酸钠(MW136.08),溶解于100ml ddH2O中)2、10*PBS (0.1M,pH7.4) 500ml取0.2M PB母液250ml加水定容到500ml,加入45gNaCl(使NaCl终浓度为9%),此时pH约为7.35,调pH至7.4.0.2M PB母液250ml:0.2M Na2HPO4202.5ml (折合14.5g Na2HPO4·12H2O)0.2M NaH2PO447.5ml (折合1.482g NaH2PO4·2H2O)3、1M Tris——Cl(pH9.0)100ml称取12.11gTris——Base(MW 121.1),加水至98ml,用HCl调pH至9.0.【步骤】1、腹水4℃,12000rpm离心15min,去除细胞碎片和大的蛋白聚集物。
2、腹水上清滤纸过滤去除脂质和大的颗粒沉淀,滤液用4倍体积的60mM醋酸缓冲液(pH4.0)稀释后,用1M NaOH调pH至4.5(一般pH刚好在4.5左右,可不再调)。
3、逐滴加入辛酸(终浓度为25μl/ml稀释腹水),待溶解后再加入另一滴,室温搅拌30min,然后4℃静置2h以上,使其充分沉淀。
注意:缓慢滴加避免局部的浓度一下子很高,这样就可能将不需要的蛋白沉淀下来。
产气荚膜梭菌β毒素单克隆抗体的研制

产气荚膜梭菌β毒素单克隆抗体的研制刘萌萌;樊金;刘雪慧;秦贵平;张慧蓉;柴同杰【摘要】为了得到产气荚膜梭菌β毒素单克隆抗体,以重组产气荚膜梭菌β毒素为抗原免疫小鼠,取其脾细胞与骨髓瘤细胞 SP2/0融合并筛选出阳性单克隆杂交瘤细胞株,接种至小鼠腹腔,培养后抽取腹水并用正辛酸-硫酸铵纯化法进行纯化,从而获得抗产气荚膜梭菌β毒素单克隆抗体。
该单克隆抗体经特异性试验,能与天然β毒素及重组β毒素发生特异性反应,且效价较高,为进一步建立快速有效的临床检测技术奠定了基础。
%In order to get the monoclonal antibodies of Clostridium perfringens β-toxin,the recombinant Clostridium perfringensβ-toxin was used as antigen to immunize mice.After cell fusion between spleen cells and SP2/0,the positive hybridoma cells were screened.The positive monoclonal hybridoma cell lines were inoculated intraperitoneally into mice.The monoclonal antibodies againstβ-toxin of Clostridium per-fringens were obtained,which were purified by octanoic-ammonium sulfate purification method.The speci-ficity experiments showed that the monoclonal antibodies specifically reacted with recombinantβ-toxin and crude naturalβ-toxins,and the potency was high.The study laid the foundation for establishing a rapid and effective method for clinical test.【期刊名称】《动物医学进展》【年(卷),期】2015(000)012【总页数】5页(P116-120)【关键词】产气荚膜梭菌;β毒素;单克隆抗体;研制【作者】刘萌萌;樊金;刘雪慧;秦贵平;张慧蓉;柴同杰【作者单位】山东农业大学动物科技与动物医学院,山东泰安 271000;山东农业大学动物科技与动物医学院,山东泰安 271000;山东农业大学动物科技与动物医学院,山东泰安 271000;山东农业大学动物科技与动物医学院,山东泰安 271000;山东农业大学动物科技与动物医学院,山东泰安 271000;山东农业大学动物科技与动物医学院,山东泰安 271000【正文语种】中文【中图分类】S852.616.3产气荚膜梭菌(Clostridium perfringens,CP)又名魏氏梭菌,是革兰阳性产芽胞杆菌[1],在自然界分布广泛,可见于土壤、污水、饲料、食物、粪便以及人畜肠道中,是重要的人兽共患传染病病原[2]。
单克隆抗体制备实验过程
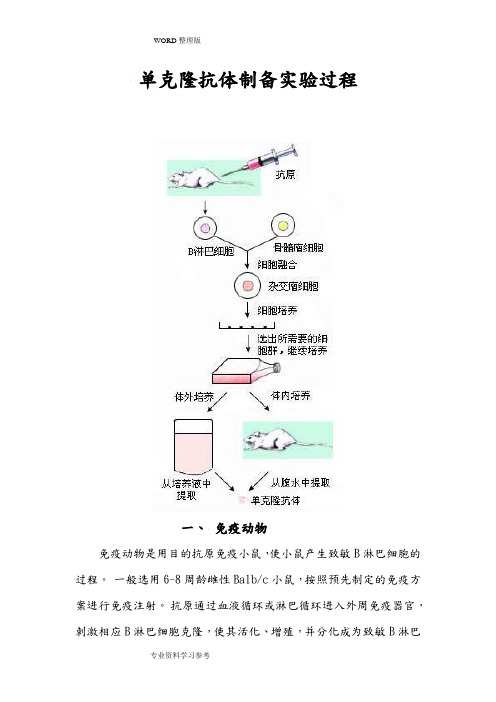
单克隆抗体制备实验过程一、免疫动物免疫动物是用目的抗原免疫小鼠,使小鼠产生致敏B淋巴细胞的过程。
一般选用6-8周龄雌性Balb/c小鼠,按照预先制定的免疫方案进行免疫注射。
抗原通过血液循环或淋巴循环进入外周免疫器官,刺激相应B淋巴细胞克隆,使其活化、增殖,并分化成为致敏B淋巴细胞。
说明:FCA,弗氏完全佐剂;FIA,弗氏不完全佐剂;Quickantibody,北京康碧泉公司研制的佐剂。
上表中第四种免疫方法产生的抗体大部份都为IgM,存在亲和力弱等缺点,慎用。
PS:1、一般皮下注射每个注射点注射30-50ul左右混有佐剂的抗原,每只小鼠注射6-8个点为宜。
2、腹腔注射时,如果抗原混有弗氏佐剂,建议注射在左侧腹腔,如果采用右侧腹腔注射,则在免疫过程中,很容易导致小鼠脾脏与腹膜粘连的情况,造成后期取出脾脏麻烦。
3、冲击免疫完成后,应在96小时内完成细胞融合,否则相应的B细胞数量会下降到未冲击前的水平。
二、细胞融合(Cell fusion)【材料和试剂】(1)骨髓瘤细胞悬液选好骨髓瘤细胞株,取体外培养对数生长期细胞或体内生长的肿瘤分离骨髓瘤细胞,制备细胞悬液。
(2)免疫小鼠脾细胞悬液取3天前加强免疫的小鼠,眼眶放血,•分离血清冻存备用。
拉颈处死小鼠,浸泡于75%酒精中3~5min。
无菌操作取出脾脏,置入盛有5ml不完全培养液的平皿中洗涤,剪去周围的结缔组织,将脾脏移入另一盛有5ml不完全培养液的平皿中的钢网上,先用剪刀剪成3~5个小块,然后用注射器内芯研磨。
将脾脏细胞悬液移至50ml离心管中,加不完全培养液50ml,1000r/min 离心5min,弃上清,再以同法洗涤离心一次。
然后将沉淀细胞重新悬浮于10ml不完全培养液中,计活细胞数,一般一只小鼠可得0.5~2×108个脾细胞。
(3)饲养细胞将小鼠致死、体表消毒和固定后,用消毒剪镊从后腹掀起腹部皮肤,暴露腹膜。
用酒精棉球擦拭腹膜消毒。
用注射器注射10ml不完全培养基至腹腔,注意避免穿入肠管。
抗体纯化方法汇总与比较

抗体纯化方法汇总与比较
1. 概论
制备出效价高,特异性强,稳定性好的抗体是免疫学实验取得成功的基础,抗体质量的好坏直接影响着研究者研究的成败,不同的免疫学实验方法(如ELISA,IHC,IP,ICC,SDS-PAGE, WB等)对抗体的效价,浓度和纯度有不同的要求。
我们知道,一般免疫血清中含有特异性抗体和非特异性抗体,血清蛋白以及其他各种杂蛋白等,在制备特异性抗体过程中当抗体的效价达到实验预期之后,我们所制备的抗体的纯度关键取决于所选择的纯化方法。
下面就一一介绍常用抗体纯化方法及其相关原理。
免疫球蛋白主要有5种,轻链和重链的组成也有较大差异。
其结构如下图所示:
各类免疫球蛋白有不同的亚型,下图展示人免疫球蛋白各亚型的理化性质:
2. 沉淀法
硫酸铵/辛酸沉淀法是纯化抗体最传统的方法之一,被广泛用于血清和腹水抗体的浓缩和粗纯,此方法可大规模粗纯抗体,但纯化后纯度不高,还需配合其它方法继续纯化。
通常是将饱和硫酸加入血清或腹水中,将抗体沉淀下来,然后在溶解沉淀继续下一步的纯化。
辛酸沉淀抗体通常要先将腹水或血清的pH调至4.8,然后缓慢的滴加辛酸,是蛋白沉淀,抗体在上清中,上清继续下一步的纯化。
3. 离子交换层析
离子交换层析也常用于抗体的纯化,通量大,工业上用离子交换层析成本低,主要用于除去非抗体蛋白,及用亲和层析纯化时混入的Protein A/G等亲和填料脱离的配基,内毒素的去除等。
离子交换纯化时,根据抗体的pI选择合适的离子交换类型,在pI未知时可以分别用阴阳离子交换填料去试验。
27抗体的纯化——沉淀法

抗体的纯化方法很多,最为常用的为以下四种方法,基于工业化生产工艺开发的规模化生产方法要比这些复杂得多,甚至多个纯化策略联合使用,有兴趣的科研工作者可以查阅相关的文献。
1)沉淀法:利用抗体蛋白疏水性不同,提高盐离子浓度蛋白沉淀,常用的沉淀方法有硫酸铵沉淀法、辛酸沉淀法、辛酸-硫酸铵沉淀法、优球蛋白沉淀法和聚乙二醇沉淀法;这类纯化各有各的优缺点,往往对某些亚型抗体有偏爱性。
2)广谱亲和纯化:这类纯化主要是利用金黄色葡萄球菌ProteinA /G蛋白可以特异性与抗体的Fc结合的原理进行的。
3)抗原特异性纯化:将特异性的抗原偶联到琼脂糖凝胶等固相载体上,纯化方法与ProteinA /G纯化方法相同。
4)离子交换法:DEAE-Sephadex A-50(二乙氨基—乙基-葡萄糖凝胶A-50)为弱碱性阳离子交换剂。
用NaOH 将Cl-型转变为OH-型后,可吸附酸性蛋白。
血清中的γ球蛋白属于中性蛋白(等电点为pH6.85~7.5),其余均属酸性蛋白。
pH7.2~7.4的环境中,酸性蛋白均被DEAE- Sephadex A-50吸附,只有γ球蛋白不被吸附。
因此,通过柱层析,γ球蛋白便可在洗脱中先流出,而其他蛋白则被吸附在柱上,从而便可分离获得纯化的IgG。
1. (NH4)2SO4沉淀法纯化抗体1.1 饱和硫酸铵配制:无菌去离子水加入足量硫酸铵之后,加热到65℃以上,在磁力搅拌器上搅拌溶解至底部仍有未溶解的硫酸铵,待冷却后,取上清滤纸过滤。
1.2 样品(血清或腹水),12,000rpm离心30min(4℃),除去细胞碎片,保留上清液并测量体积。
1.3 边搅拌边缓慢加入等体积的饱和硫酸铵溶液到上清液中,溶液放在磁力搅拌器上室温搅拌6h或搅拌过夜(4℃),使蛋白质充分沉淀。
1.4 蛋白溶液12,000rpm离心30min(4℃),沉淀用原样品体积的PBS溶液重悬,重悬后12,000rpm离心10min(4℃),上清转移到一个新离心管。
辛酸-硫酸铵法纯化细胞培养上清中单克隆抗体的条件优化

[ 关键 词 ] 辛酸- 硫酸铵法 ; m A b ; 纯化 ; 正交实验
常 用 的单 克 隆抗 体 ( mo n o c l o n a l a n t i b o d y ,m A b )
离, E , 3 o m i n ; 重复 2 7 7 g / L饱 和度硫 酸铵沉淀 1次 , 终 沉淀溶
辛 酸一 硫 酸铵 法纯 化 细胞 培 养上 清 中单 克 隆抗 体 的条 件 优 化
刘若 飞 ,张 萃 ,葛如 意 ,陈 玉琼 ,刘晓 波 ( 广东药学院微生物学与免疫学教研室, 广东 F - k ' q l 5 1 0 0 0 6 )
[ 中图分类号 ] R 3 9 2 . 1 1 ,Q 8 1 3 . 2 [ 文献标志码 ] A
1 材料 和 方法
1 . 1 材料 本 室建立 的 3株 鼠源性 杂交 瘤细胞 含血 清培 养
辛酸终浓度分别 为( 1 5 、2 0 、2 5 、3 0 、3 5 ) L / m L的条件 下进 行实验 。实验重复 3次 。 1 . 2 . 5 硫 酸铵 溶液饱 和度单 因素 实验 实 验条件 设定 为上
量抗 体 丢 失 ,为 mA b的 进 一 步 开 发 利 用 提 供 实 验 进行实验 。所有实 验重复 3次。 条件 。 1 . 2 . 4 辛 酸终浓度单 因素 实验 实验条 件设定为 上清一 缓冲
液体积 比为 1 : 1 , 硫 酸铵饱 和度为 2 43 g / L ,p H为 6 . 8 , 在 正
清- 缓 冲液体 积比为 1 : 1 , 辛酸终浓度为 2 0 L / m L , p H为6 . 8 ,
在硫酸铵溶液 饱和 度分 别为 ( 2 0 9 、2 43 、 2 7 1 、3 1 3 、3 5 1 )g / L
单克隆抗体纯化

单克隆抗体的纯化一、简介抗体或免疫球蛋白(Ig)是B 淋巴细胞针对暴露于外源抗原后产生的独特的可溶性糖蛋白。
通常可从血浆(占总蛋白20%),血清,腹水,细胞培养基,蛋黄,植物提取物或细菌和酵母培养物中分离得到抗体。
常用于纯化的材料主要以腹水和细胞培养上清为主。
单抗纯化方式常用的技术:DEAE 离子交换层析柱,凝胶过滤法和亲和层析。
二、技术方法及原理(一)单抗粗提1.硫酸铵沉淀法(1)原理:高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来。
各种蛋白质的溶解度不同,故可利用不同盐浓度来沉淀不同蛋白质,硫酸铵因其溶解度大,温度系数小,不易使蛋白质变性而应用广泛。
(2)方法:①若样本体积较小,可配置100%饱和硫酸铵(375 g 硫酸铵加入500 mL 的蒸馏水中,加热至完全溶解,室温过夜,析出晶体任其留在瓶中,用氨水或者硫酸调节pH 至7.0);若体积较大直接使用固体硫酸铵,根据表格(1)称取所需质量。
②盐析:缓慢向腹水中加入一定量的饱和硫酸铵溶液(或者缓慢加入固体硫酸铵,0.277 mg/mL 终浓度为45%),缓慢搅拌30 min ,室温静置2 h ,再5000 rpm 离心25 min ,去上清,沉淀用PBS 溶解。
③脱盐:主要有柱层析和透析法a)柱层析:将上述样品过Sephadex G-25 层析柱,以PBS 或Tris-HCl 缓冲液为平衡液和洗脱液,第一个蛋白峰即为脱盐后的抗体溶液;b)透析法:将样品装入处理后的透析袋(2% NaHCO3,1mM EDTA 煮沸10 min,蒸馏水洗净)中,置换缓冲溶液为PBS 或Tris-HCl 缓冲液,期间更换4-5 次透析液;2.辛酸-硫酸铵沉淀法(1)适用范围:该法简单易行,适用于提纯IgG1 和IgG2b ,但对IgG3 和IgA 的回收率及纯化效果差。
(2)试剂:0.06M 醋酸缓冲溶液(pH5.0),1M HCl,辛酸,1xPBS ,1M NaOH;(3)方法:在预处理后的腹水中加入2 倍体积的0.06M 醋酸缓冲溶液(pH5.0),按比例加入辛酸(11uL 辛酸/mL 腹水),室温搅拌下逐滴加入,30min 内加完,4℃静置2 h ,10000 rpm 离心30 min ,弃沉淀,上清过滤(经尼龙筛125uM),加入1/10 的1xPBS,再用1M NaOH 调节pH 至7.2;4℃下加入饱和硫酸铵至45% 饱和度,静置1h ,10000 rpm 离心30 min ,弃上清;沉淀用PBS 溶解;3.优球蛋白沉淀法(1)适用范围:适用于提纯IgG3 和IgM 的提取,不会影响抗体活性;复溶缓冲溶液(1M NaCl ,0. 1M Tris-HCl ,pH8.0)(2)试剂:NaCl ,CaCl2,(3)方法:取一定量的预处理后腹水,先后加入NaCl(终浓度0.2M)和CaCl2 (终浓度25mM),可看到纤维蛋白的产生;经滤纸过滤后,透析或层析过滤,缓冲体系为去离子水,超高速离心30min;弃上清,沉淀用1M NaCl,0. 1M Tris-HCl,pH8.0 溶液复溶,再经过透析或层析过滤更换缓冲体系;(二)亲和层析法1.基本原理:基因工程改造的protein A 和protein G 能特异性结合哺乳动物IgG 的Fc 区段,将protein A 和protein G 结合到柱料上,通过亲和层析的方式,可将IgG 及其亚类与片段纯化出来。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
辛酸-硫酸铵法纯化单克隆抗体
辛酸-硫酸铵法纯化单克隆抗体
(一) 原理蛋白质在溶液中的溶解度取决于蛋白质周围亲水基团与水形成水化膜的程度, 以及蛋白质分子带有的电荷。
如改变这两个因素,蛋白质就容易沉淀折出。
引起蛋白质沉淀的主要方法有
(1) 盐析, 即加入大量中性盐破坏蛋白质的胶体稳定性而使其析出, 沉淀不同蛋白质所需盐浓度及pH 值不同;
(2) 生物碱以及某些酸类, 在pH 值小于等电点时可以与蛋白质形成不溶的盐使其沉淀;
(3) 重金属离子如隶、铅、铜、银等, 在pH 值大于等电点时可以与蛋白质结合成不溶的盐使其沉淀;
(4) 有机溶剂如酒精、甲醇、丙酮等, 对水的亲和力很大, 能破坏蛋白质水化膜, 在等电点时使蛋白质沉淀。
辛酸(caprylic acid) 在偏酸条件下能与血清或腹水中除IgG外的其他蛋白质结合并将其沉淀下来,IgG 则溶于上清液中, 再用硫酸镀盐析, 即可达到纯化IgG 的目的。
辛酸-硫酸铵法是目前实验室中较常用的纯化单克隆抗体的方法, 利用该方法纯化单克隆抗体, 回收率和纯度都可达80% 以上。
(二) 试剂和器材
1. 试剂
(1) 小鼠腹水。
(2) 硫酸铵或饱和硫酸铵溶液。
称(NH4)2S04(AR)400~425 克, 以50 ℃~80 ℃蒸馆水500ml溶解, 搅拌2O min, 趁热过滤。
冷却后以浓氨水(15M NH40H) 调pH 值至7.4 。
配制好的饱和硫酸铵, 瓶底应有结晶析出。
(3)0.06M pH 4.8 醋酸盐缓冲液。
贮存液: A 液,0.06M NaAc: 无水NaAc0.49218g 加蒸馆水至100ml
B 液,0.06M HAc: 冰醋酸0.344ml 加蒸馆水至100ml
应用液: 取上述 A 液59ml 与B 液41ml 昆合, 用5M NaOH 调pH 值至4.80.
(4)0.lM pH 7.4 磷酸盐缓冲液(PBS). 取Na2HP04 · 12H20
28.94g,KH2P04 2.61g, 加蒸馆水至100Om1
(5) 含137mM NaCl 2.6mM KCl 0.2mM EDTA 的pH 7.4 磷酸盐缓冲液(PBS): 取Na2HP04 12H20 28.94g KH2P04 2.61g NaC1 8.Og 、KCl 0.2g EDTA 0.06g, 加蒸馆水至100Oml
2. 器材普通冰箱、低温离心机、电磁搅拌器, 紫外分光光度计、天平; 透析袋、塑料夹、精密pH 试纸; 烧杯、量桶、吸管、滴管、小瓶等。
(三) 操作步骤
方案一( 硫酸铵沉淀法)
1. 腹水4 ℃12000 rpm 离心15min, 去除杂质。
2. 取1 份腹水与2 份醋酸盐缓冲液混合, 室温搅拌下逐滴加入正辛酸33 μ l/ml 腹水。
3. 室温混合30min
4. 4 ℃静置2h 以上, 使其充分沉淀。
5. 4 ℃,12000 rpm 离心3Omin, 弃沉淀。
6. 上清经砂芯漏斗或125 μm 的尼龙网过滤后, 加入1/10 体积的
0.1M pH 7.4 Pbs , 用2M NaOH 调pH 值至7.4.
7. 冰浴下于30min 内加入0.277g/ml 的硫酸铵, 使成45%饱和度。
8. 4 ℃静置1h 以上。
9. 4 ℃,10000 rpm 离心30min, 弃上清。
10. 沉淀用适量含137mM NaC1 、2.6mM KCl 、0.2mM EDTA 的pH 7.4 PBS 溶解, 于50~100 倍体积的上述PBS 中4 ℃透析过夜。
11. 取少量透析后样品适当稀释后, 以紫外分光光度计检测蛋白含
量,SDSPAGE 检测抗体纯度。
方案二( 饱和硫酸铵溶液沉淀法) 1~5 同方案一。
6. 上清经砂芯漏斗或125 μ m 的尼龙网过滤后, 于50 倍体积的0.01M pH
7.4 PBS 中4 ℃透析6h 7. 在透析后的上清中加入等体积饱和硫酸铵溶液。
8. 4 ℃静置1h 以上0 9.4 ℃,10000 rpm 离心3Omin, 弃上清。
10. 沉淀用适量含137mM NaCl 、2.6mM KC1 、0.2mM EDTA 的
pH7.4PBS 溶解, 于50~100 倍体积的上述PBS 中4 ℃透析过夜。
11. 取少量透析后样品适当稀释后, 以紫外分光光度计检测蛋白含
量,SDSPAGE 检测抗体纯度。
(四) 注意事项
1. 无论是含有单克隆抗体的腹水还是细胞培养上清, 均含有脂蛋白、脂质、细胞碎片等杂质, 必须预先去除。
通常采用过滤的方法去除脂质和大的颗粒,
用离心的方法去除细胞碎片和大的蛋白聚合物; 如果材料里含有大量脂质, 还必须用二氧化硅粉或玻璃纤维吸附等将其去除。
2. 盐析时, 溶液中的蛋白浓度对沉淀有双重影响。
蛋白浓度愈高, 沉淀所需的盐饱和度极限愈低, 但杂蛋白的共沉作用也随之增加。
因此, 在盐析时血清和腹水都应作适当稀释, 一般血清作倍比稀释, 腹水作 2 倍稀释。
3. 辛酸-硫酸铵法还可以用来纯化血清中的抗体, 此时辛酸用量因抗体来
源不同而稍有变化, 人血清为70 μ/ml, 兔血清为75 μ/ml, 小鼠血清为40 μ/ ml 。
4.pH 值对盐析的影响: 抗体的溶解度与pH 值和盐浓度有密切关系, 选
择适当的pH 值可大大提高对单克隆抗体的沉淀效果。
通常溶液的pH 值与目标蛋白的等电点相等时, 沉淀效果最好, 另外, 硫酸铵在水中显酸性, 为防
止对蛋白质的破坏, 应将溶液的pH 值调至中性。
5. 该法主要用于IgG1 和IgG2b 的纯化, 对IgA 和IgG3 的回收率及纯化效果都较差。
蛋白质经硫酸铵沉淀、离心分离后, 沉淀中含有硫酸铵, 在此状态下冷冻保存,蛋白质比较稳定。
若需进一步处理,首先需要除盐,方法可选择透析,凝胶过滤等。
