己二酸的合成 教案教程文件
己二酸的合成教案

己二酸的合成教案 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
2
教 案
课程名称:有机化学实验 授课教师 丁长江等 所在单位 公共化学教学与研究中心
课程类型 必修基础课
授课时间
春季学期
授课对象
医学五年制、七年制
教学内容提要 时间分配及备注
己二酸(3~4 h )
一、实验原理:
己二酸是合成尼龙-66[1]的主要原料之一,实验室可用硝酸或高锰酸钾氧化环己醇而得。
环己醇:环己醇熔点为24℃,熔融时为粘稠液体。
己二酸:溶解度如下表。
温度(℃) 15 34 50 70 87 100
溶解度(g/100g 水) 1.44 3.08 8.46 34.1 94.8 100
尼龙(Nylon)通常指的是聚酰胺纤维。
这类纤维有很多种,其中尼龙-66是我国目前生产量最大的品种之一。
它是己二酸或其衍生物与已二胺两种单体发生缩聚反应生成的一种线性高分子化合物。
由于参加反应的两种单体分子中都含有6个碳原子,所以商品名称为尼龙-66。
尼龙-66用途广泛,其中线材可用制作针织品,纺织品,轮胎帘子线,鱼网,绳索和滤布等。
经过加工制成的弹力尼龙更适于制袜子等。
二、实验材料:
仪器:三颈瓶、温度计、滴液漏斗、抽滤装置
药品:10%氢氧化钠、水、高锰酸钾、环己醇、亚硫酸氢钠、浓盐酸、活性炭
其它:滤纸、机械搅拌器、pH 试纸
OH
3
+ 8KMnO 4 +H 2O 3HOOC(CH 2)4COOH + 8MnO 2 + 8KOH
4。
【精品】实验12. 己二酸的制备

【精品】实验12. 己二酸的制备一、实验目的:1.掌握己二酸的制备方法;2.学习己内酰胺的化学反应转化。
二、实验原理:1.己内酰胺(C6H9NO)通过氧化加水解可以制备己二酸(HOOC(CH2)4COOH)并伴随着氨气的生成,反应方程式为:C6H9NO+3O2+3H2O→HOOC(CH2)4COOH+NH3↑2.氧化过程是通过过氧化氢/铕离子或者过硫酸铵等氧化剂来实现的。
三、实验操作:1.植入灭菌棉,并称取50mL锥形瓶一只,加入6g吉兰酸和1.8g锌粉。
2.制备己内酰胺,称取9.6g辛醇(C8H18O)放入25mL的三口瓶中,加入9.5mL浓氨水,在搅拌的同时,缓缓加入4mL硝酸一水合物(HNO3 H2O),保持温度在5-10℃。
待搅拌反应约20分钟后,过滤得清晰的液体,称取其中的15mL,加入50mL锥形瓶中。
3.加热反应,向锥形瓶中加入15mL过氧化氢/氨水(30%),盖上橡胶塞,用醇灯加热使温度达到60℃,稍加搅拌。
4.添加潮气剂,加入50mL蒸馏水和少量碳酸钠。
反应结束后,转移液体至250mL锥形瓶中。
5.中和和除杂,用0.5mol/L盐酸加入至中性,过滤后倒弃,再加入0.5mol/L氢氧化钠调节pH至7-8,然后再次过滤。
6.干燥,用低温干燥将滤液干燥,分得1.8-2.0g淡黄色非结晶粉末己二酸。
7.收集氨气,将刚刚反应过程中,在黑色瓶中收集的氨气,用盐酸中和,常温常压下固定氨气的含量,根据氨气的含量和体积,可由理想气体状态方程计算出实际反应中生成的氨气体积,进而计算出定量的己二酸产率。
四、实验注意事项:1.吉兰酸和锌粉必须干燥且保存在干燥器或是防潮箱中;2.反应时必须始终保持灭菌;3.制备己内酰胺时,氨气过多需要适量放到通风处去;4.收集的氨气不宜长时间放置,应尽快加入盐酸中和;5.干燥时,不宜用高温急干,否则会使产物质量受到影响。
己二酸的制备及检测

化学与化工学院实验课程教案模板(试行)实验名称己二酸的制备一、实验目的要求:1、学习利用环己醇氧化制备己二酸的原理和方法;2、掌握浓缩、结晶、重结晶、过滤等固体有机物分离提纯的操作方法;3、掌握有毒有害气体的处理方法。
二、实验重点与难点:1 重点:己二酸的化学性质2 难点:浓缩、结晶、重结晶、过滤等固体有机物分离提纯三、实验教学方法与手段:实验教学中,强调教学互动,增强学生学习的积极性与主动性。
在第一层次实验课程的教学过程中,在实验前、实验中和实验后的三个阶段,均结合教师的讲解或指导,设置学生提问与讨论的环节,避免教师过细过多的讲授、学生被动接受的不足,以提高教学效果。
四、实验用品(主要仪器与试剂):1 主要仪器:三口烧瓶烧杯电动搅拌棒球形冷凝管抽滤瓶布氏漏斗循环水多用真空泵温度计试纸2 试剂:环己醇高锰酸钾氢氧化钠亚硫酸氢钠浓盐酸五、实验原理:羧酸是一类重要的有机化工产品,一般是利用醇为原料通过氧化反应而制得。
常用的氧化剂为:K2Cr2O7-H2SO4、KMnO4、HNO3、H2O2、过氧酸等。
伯醇氧化首先生成醛,进一步氧化可得到羧酸。
由于中间产物醛易与原料生成半缩醛,半缩醛又能被氧化为酯,所以得到的产物是复杂的混合物。
仲醇氧化时首先生成酮,酮不能被弱氧化剂氧化,但遇到强氧化剂时,可被氧化,碳链断裂后生成多种碳原子数减少的羧酸混合物,在合成上意义不大。
叔醇一般不被氧化。
环己醇被KMnO4、HNO3氧化时,先得到环己酮,由于它是环状结构,进一步氧化碳链断裂后得到单一的产物己二酸。
33HOOC(CH2)COOH + 8NO +7H2O2NO + O2 2NO2氧化反应一般都是放热反应,必须严格控制反应温度和反应条件,防止反应过于剧烈,发生危险。
考虑到HNO3的挥发性和易分解,在反应中使用了过量的HNO3。
反应产生的NO2、NO气体有毒有害,必须进行处理,不能直接排放大气。
实验室要注意室内通风,减少对人体的危害。
《己二酸的制备》PPT课件

4. 环己醇被氧化成己二酸的同时会生成NO,NO遇到O2后就 转变成有毒的NO2。故应接上气体吸收装置.
5.控制环己醇的滴加速度是制备己二酸实验的关键.若滴加太 快,反应过于剧烈,无法控制,会使反应液冲出烧瓶造成 事故。先预热反应瓶中的稀硝酸接近沸腾。在振摇下, 慢慢滴加5-6滴环己醇,反应发生,同时放出热量。这时 应控制滴加环己醇的速度,维持反应液在微沸状态,直 至滴加完所有的环己醇。若反应液出现暴沸时,应及时 用冷水浴冷却至微沸状态。注意不能冷却太久,否则, 又得重新加热,才能继续发生反应。
返回
6.反应完毕后,要趁热倒出反应液,若任其冷却至室温的话, 己二酸就结晶析出,不容易倒出,造成产品的损失。
六、数据处理
理论值(g)
实验值(g)
产率(%)
H [O]
OH
4g
O [O]
O
O
HOC(CH2)4COH
?
六、思考题
1、为什么必须严格控制氧化反应的温度? 2、如果烧瓶中温度超过90摄氏度,应如 何处理?
返回
三、试剂及仪器
三口烧瓶、恒温加热搅拌器、温度计、电炉、抽滤瓶、布氏漏斗、恒压 滴液漏斗、环己醇、浓硝酸、冰块、滤纸、玻棒
返回
三、试剂及仪器
反应装置:
返回
四、实验步骤
1、在三口烧瓶中加入磁子,10ml水、10ml浓硝酸混合均匀, 搭好装置,并在水浴中加热至80摄氏度。在恒压滴液漏斗中 加入4.2ml(约4g)环己醇。开启搅拌按扭,控制滴速,使烧瓶 中混合物温度控制在85-90摄氏度之间(必要时向水浴中添加 冷水)。当醇全部加入而且溶液温度降至80摄氏度以下时, 将混合物在85-90摄氏度下加热约15min,使其充分反应。 2、将反应物放入冰水浴中冷却,析出的晶体经布氏漏斗抽滤, 用3ml水洗涤滤饼,并将所得晶体尽量压干并称重。
己二酸的制备-精品文档

己二酸的制备
下页 返回 退出
己二酸的制备
实验目的
实验原理
试剂及仪器
实验步骤
注意事项
思考题
上页 下页 返回 退出
一、实验目的
1、学习使用环己醇制备己二酸的原理和方法
2、学习抽滤操作分离固液物质的方法
上页 下页 返回 退出
二、实验原理
H O H
[ O ]
O
O [ O ]
O
H O C C ( H ) C O H 2 4
氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰 酸钾。本实验采用浓硝酸作氧化剂。
上页 下页 返回 退出
三、试剂及仪器
三口烧瓶、恒温加热搅拌器、 温度计、电炉、抽滤瓶、布氏 漏斗、恒压滴液漏斗、环己醇、 浓硝酸、冰块、滤纸、玻棒
上页 下页 返回 退出
三、试剂及仪器
上页 下页
退出
六、数据处理
理论值(g) 实验值(g) 产率(%)
H O H
[ O ]
O
O [ O ]
O
H O C C ( H ) C O H 2 4
4g
?
上页 下页
退出
六、思考题
1、为什么必须严格控制氧化反应的温度? 2、如果烧瓶中温度超过90摄氏度,应如 何处理?
上页 下页 返回 退出
、实验步骤
1、在三口烧瓶中加入磁子,10ml水、10ml浓硝酸混合均匀, 搭好装置,并在水浴中加热至80摄氏度。在恒压滴液漏斗中 加入4.2ml(约4g)环己醇。开启搅拌按扭,控制滴速,使烧瓶 中混合物温度控制在85-90摄氏度之间(必要时向水浴中添加 冷水)。当醇全部加入而且溶液温度降至80摄氏度以下时, 将混合物在85-90摄氏度下加热约15min,使其充分反应。 2、将反应物放入冰水浴中冷却,析出的晶体经布氏漏斗抽滤, 用3ml水洗涤滤饼,并将所得晶体尽量压干并称重。
实验七:己二酸的制备

2020/5/8
【操作要点】
1.KMnO4要研细,以利于充分反应。 2.环己醇要逐滴加入,滴加速度不可太快。否则,因反应强烈 放热,使温度急剧升高而难以控制。 3.严格控制反应温度,稳定在43~47℃之间。 4.反应终点的判断: •反应温度降至43℃以下。 •用玻璃棒蘸一滴混合物点在平铺的滤纸上,若无紫色存在表明 已没有KMnO4。 5.用热水洗涤MnO2滤饼时,每次加水量约5-10ml,不可太多。 6.用浓硫酸酸化时,要漫漫滴加,酸化至pH=1-3。 7.浓缩蒸发时,加热不要过猛,以防液体外溅。浓缩至10 ml左 右后停止加热,让其自然冷却、结晶。
2020/5/8
【本实验的成败关键】
环己醇的滴加速度和反应温度的控制
2020/5/8
【产品性质】
•纯己二酸为白色棱柱状结晶,m.p. 152℃, d4241.366,b.p. 330.5℃(分解)
2020/5/8
【思考题】
1.制备羧酸的常用方法有哪些? 2.为什么有些实验在加入最后一个反应物前应预先加
答:浓硝酸的浓度和相对密度:16mol/l,1.42g/ml 浓硫酸的浓度和相对密度:18 mol/l,1.84
g/ml 浓盐酸的浓度和相对密度:12 mol/l,1.19
g/ml 用浓硫酸配制稀硫酸时应将浓硫酸缓慢加入蒸
馏水中。
2020/5/8
实验七:己二酸的制备思考题解答
6、本实验中为什么必须控制反应温度和环乙 醇的滴加速度?
18 己二酸的制备

苏州大学材料与化学化工学部课程教案[实验名称] 己二酸的制备[教学目标] 知识与技能: 学习用硝酸氧化环己醇制备已二酸的原理和方法,掌握尾气吸收、过滤、等操作技术。
[教学重点] 已二酸的原理和方法,尾气吸收操作技术。
[教学难点] 控制好氧化反应速度,防止有毒的二氧化氮气体外逸。
[教学过程]【实验目的】 通过本次实验,要求大家掌握己二酸的制备原理和方法,掌握尾气吸收、过滤等操作技术。
【实验原理】 OH O3HOC(CH 2)4COH OO3++ 7H 2O322 硝酸和高锰酸钾都是强氧化剂,由于其氧化的选择性较差,故硝酸主要用于羧酸的制备,高锰酸钾氧化的应用范围较硝酸广些,它们都可以将环己醇直接氧化为己二酸。
本实验以50%硝酸为氧化剂,并以(偏)钒酸铵为催化剂,氧化环己醇至环己酮,后者再通过烯醇式被氧化开环而生成己二酸。
在反应过程中产生的一氧化氮极易被空气中的氧气氧化成二氧化氮气体,用碱液吸收。
【实验装置图】图1 己二酸制备装置图【实验步骤】反应瓶中加入6 mL 50%的硝酸[1]和少许钒酸铵[2],水浴加热至50 ︒C 后移去水浴[3],缓慢滴加5~6滴环己醇[4],摇动至反应开始,即有红棕色二氧化氮气体放出,维持反应温度50~60 ︒C ,将剩余的环己醇滴加完毕,总量为2 mL [5]。
加完后继续振荡,并用80~90 ︒C 水浴加热10 min 。
无红棕色气体逸出,反应即结束。
将反应液倒入50 mL 烧杯中[6],冷却,结晶,抽滤,3 mL 水洗,2 mL 石油醚分两次洗[7],干燥,称重。
纯己二酸为白色晶体,mp.153 ︒C 。
【实验流程图】50-60 o C ,产生抽滤3 mL 水洗涤,2 mL 石油醚洗涤【注释】[1] 浓硝酸和环己醇切不可用同一个量筒取用,以防两者相遇剧烈反应发生爆炸。
建议两位学生合用两个量筒。
[2] 钒酸铵不可多加,否则产品发黄。
不加钒酸铵也可以。
[3] 实验中要同时监测水浴温度和反应液的温度。
实验十六 己二酸的制备

实验十六己二酸的制备一、实验目的1、学习环己醇氧化制备己二酸的原理和方法;2、掌握重结晶、搅拌等基本操作。
二、实验原理己二酸是合成尼龙-66的主要原料之一,可以用硝酸氧化环己醇制得。
反应方程式如下:三、实验药品及其物理常数药品名称分子量用量熔点(℃)沸点(℃)比重(d420)溶解性(水)环己醇100.16 5.3 mL24160.90.96微溶于水硝酸(50%)6316 mL 溶于水钒酸铵116.990.01 g其它5%NaOH溶液四、主要仪器和材料水浴锅三口烧瓶(100 mL、19#×3) 恒压滴液漏斗空心塞(14#) 球形冷凝管(19#) 螺帽接头(19#,2只) 温度计(100℃) 布氏漏斗吸滤瓶烧杯冰滤纸水泵等.五、实验装置滴加、回流、尾气吸收装置六、操作步骤【操作要点及注意事项】⑴搭装置:仪器的选用,搭配顺序,各仪器高度位置的控制要合理。
⑵检验气密性:实验产生的二氧化氮气体有毒,所以装置要求严密不漏气。
注意尾气吸收装置中三角漏斗的高度。
⑶加料:环己醇和硝酸切不可用同一量筒量取。
钒酸铵不可多加,否则产品发黄。
⑷滴加:本实验为强烈放热反应,所以滴加环己醇的速度不宜过快,以免反应过剧,引起爆炸。
一般可在环己醇中加1mL水,一是减少环己醇因粘稠带来的损失,二是避免反应过剧。
⑸加热:可选择水浴加热,滴加完后继续用80-90 ℃水浴加热约15 min, 同时要摇动反应瓶,至几乎无棕色二氧化氮气体放出为止。
七、实验结果1、产品性状:;2、理论产量:;3、实际产量:;4、产率: .八、实验讨论1、在该反应中为何要检查装置气密性?2、为什么反应必须严格控制环己醇的滴加速度?3、为什么有些实验在加入最后一个反应物前应预先加热?九、实验体会谈谈实验的成败、得失。
己二酸的制备

己二酸的制备一、实验目的:1.学习用环己醇氧化制备己二酸的原理和方法;2.学习重结晶、减压过滤等操作。
二、实验原理: OHKMnO4OH -HO 2C(CH 2)4CO 2H + 32+MnO 2388氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰酸钾。
本实验采用碱性高锰酸钾作氧化剂。
三、主要原料、产品和副产物的物理常数【试剂】环己醇;高锰酸钾;碳酸钠;亚硫酸氢钠;浓硫酸;活性炭;10%的碳酸钠溶液M bp mp d n s 环己醇 100 161 25 0.9624 1.4641 微溶 己二酸 146 265 152 1.360 / 微溶四、实验装置本实验在烧杯中进行;普通过滤与热过滤均用抽滤装置。
五、实验步骤:1、投料在烧杯中,加入 2.6mL 环己醇和自配的碳酸钠溶液(3.8 g 碳酸钠溶于35mL 温水),搅拌下,分批小量加入11.2g 高锰酸钾粉末。
加入高锰酸钾时,控制温度在30-40o C,加完后继续搅拌至反应液温度不在上升为止。
(变为褐色,然后在50-60℃水浴中加热搅拌,至反应完全。
若长时间反应不完全,可加少量固体亚硫酸氢钠。
2、抽滤、酸化、脱色、抽滤趁热抽滤混合物,用10 ml10%的碳酸钠溶液洗涤滤渣,合并滤液。
在滤液中加入少量活性炭,煮沸5min,趁热抽滤。
冷至室温,慢慢向滤液中加入浓硫酸酸化,使溶液呈强酸性。
冷却,结晶。
得产品。
熔点151-152℃。
六、实验注意事项:1. 制备羧酸采取的都是比较强烈的氧化条件,一般都是放热反应,应严格控制反应温度,否则不但影响产率,有时还会发生爆炸事故;2.环己醇常温下为粘稠液体,防止转移中损失。
3. 注意反应终点的判断。
七、思考题:1 反应完后如果反应混合物呈淡紫红色,为什么要加入亚硫酸氢钠?2. 为什么要控制好反应温度?。
己二酸的制备
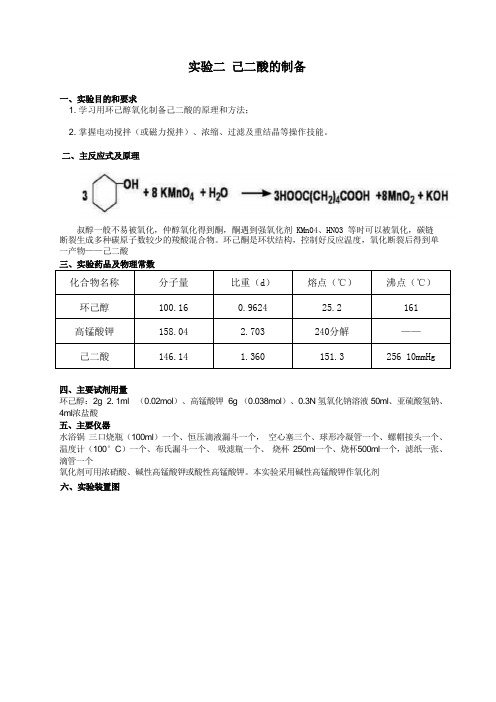
实验二己二酸的制备
一、实验目的和要求
1. 学习用环己醇氧化制备己二酸的原理和方法;
2. 掌握电动搅拌(或磁力搅拌)、浓缩、过滤及重结晶等操作技能。
二、主反应式及原理
叔醇一般不易被氧化,仲醇氧化得到酮,酮遇到强氧化剂 KMn04、HN03 等时可以被氧化,碳链
断裂生成多种碳原子数较少的羧酸混合物。
环己酮是环状结构,控制好反应温度,氧化断裂后得到单一产物——己二酸
四、主要试剂用量
环己醇:2g 2. 1ml (0.02mol)、高锰酸钾 6g (0.038mol)、0.3N 氢氧化钠溶液 50ml、亚硫酸氢钠、4ml浓盐酸
五、主要仪器
水浴锅三口烧瓶(100ml)一个、恒压滴液漏斗一个,空心塞三个、球形冷凝管一个、螺帽接头一个、温度计(100°C)一个、布氏漏斗一个、吸滤瓶一个、烧杯250ml一个、烧杯500ml一个,滤纸一张、滴管一个
氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰酸钾。
本实验采用碱性高锰酸钾作氧化剂
六、实验装置图
图1 反应装置图2 抽滤装置
七、粗产品纯化过程及原理
八、产率计算
m 理=n ·M=0.02molX146g/mol=2.92g 理论产量:2.92g
产率=实际产量理论产量×100%。
实验8 己二酸的合成(高锰酸钾法)

实验8 己二酸的合成(高锰酸钾法) 4学时每组带瓶开水一、实验目的1.学习用环己醇氧化制备己二酸的原理和方法。
(应知)2.掌握电动搅拌器的使用方法及浓缩、过滤等基本操作。
(应会) 二、实验原理OH MnO 338H 2+KMnO 4+HO 2C(CH 2)4CO 2H ++8KOH8三、物理常数四、电动搅拌装置安装要点1.搅拌器的轴与搅拌棒在同一直线上。
2.先用手试验搅拌棒转动是否灵活,再以低转速开动搅拌器,试验运转情况。
3.搅拌棒下端位于液面以下,以离烧杯底部3~5 mm 为宜。
4.温度计应与搅拌棒平行且伸入液面以下。
五、仪器和试剂仪 器:搅拌回流加热装置1套,抽滤装置1套,玻棒,500mL 烧杯1个,滴管1个。
试 剂:环己醇2g(2.1mL,约0.02mol),高锰酸钾6.3g(0.038mol),10%氢氧化钠溶液5mL ,浓盐酸4mL,固体亚硫酸氢钠,广泛pH 试纸,滤纸六、实验步骤在装有搅拌装置、温度计和回流冷凝管的100mL 三颈(或四颈瓶)瓶中加入5mL10%氢氧化钠溶液(或0.5gNaOH 固体)和50mL 水,搅拌使其溶解,然后加入6.3g 高锰酸钾。
小心预热溶液到40oC ,高锰酸钾溶解后,从冷凝管上口【也可四颈烧瓶的一个口滴管加入,漏气关系不大】用滴管缓慢滴加2.1mL 环己醇[1],【滴1滴休息3秒左右】反应随即开始(放热)。
控制滴速,使反应温度维持在45oC 左右[2]。
滴完,反应温度开始下降时,水浴保温45oC 左右【55度左右的水浴】,继续搅拌保温20min 后,在沸水浴上加热5min ,促使反应完全并使MnO 2沉淀凝聚[3]。
用玻璃棒蘸一滴反应混合物点到滤纸上做点滴实验。
如有高锰酸盐存在,则在棕色二氧化锰点的周围出现紫色的环,可加入少量【0.1g 左右】固体亚硫酸氢钠直到点滴试验呈阴性为止。
趁热抽滤混合物,用少量热水【溶剂尽量少,否则后面蒸发时间很长】洗涤滤渣MnO 23次,将洗涤液与滤液合并置于烧杯中。
己二酸的合成方案

己二酸的合成方案己二酸是一种重要的有机化合物,在化工、医药等领域具有广泛的应用。
本文将介绍一种合成己二酸的方案,以供参考。
一、材料及设备准备1. 己烷、高锰酸钾、浓硫酸、甲醇、氯化氢2. 理化实验室所需设备,如反应瓶、恒温槽、冷凝器等。
二、实验步骤1. 反应物准备:将2.5 mol己烷取入反应瓶中。
2. 高锰酸钾氧化:向反应瓶中加入适量高锰酸钾,使其与己烷摩尔比为1:1。
使用搅拌棒将溶液充分搅拌均匀。
3. 反应进行:将反应瓶放入恒温槽中,保持恒温,温度控制在50-70°C之间,同时进行反应。
4. 冷却降温:反应持续一定时间后,将反应瓶取出,放置于冷水中进行冷却降温。
5. 己二酸析出:将冷却后的反应液慢慢加入浓硫酸中,并用搅拌棒充分搅拌。
随着加入浓硫酸,己二酸逐渐析出并形成沉淀。
6. 沉淀处理:将沉淀从溶液中分离出来,使用真空滤器进行过滤。
过滤后的己二酸沉淀用甲醇进行洗涤。
7. 己二酸干燥:将洗涤后的己二酸沉淀置于通风器中,进行干燥处理。
8. 己二酸的纯化:将干燥后的己二酸置于冷凝器中,在氯化氢气氛下进行加热,通过蒸馏的方式对己二酸进行纯化。
三、注意事项1. 实验过程中应严格遵守安全操作规程,避免发生化学品外溢、热源泄漏等危险。
2. 己烷需储存于密闭容器中,避免接触空气。
高锰酸钾需防潮保存,放置于干燥处。
3. 反应物与溶液的加入,应控制速度和顺序,以免发生剧烈反应或溅溶液事故。
4. 冷却降温和沉淀处理的过程中,需要逐步操作,避免温度、压力的快速变化。
5. 纯化过程中,氯化氢气体具有一定的腐蚀性和毒性,请注意安全操作。
总结:通过上述合成方案,可以获得较纯的己二酸。
在实际操作中,应遵循实验室的安全规程,掌握好反应条件与操作步骤,确保合成过程的安全性和产物的质量。
己二酸作为重要的有机化合物,其合成方案具有重要的实际应用价值。
己二酸的制备

实验二己二酸的制备一、实验目的1、练习并熟练掌握液体的搅拌、浓缩、过滤、重结晶等基本操作;2、了解KMnO4氧化环己醇制备己二酸的原理和方法。
二、实验原理叔醇一般不易被氧化,仲醇氧化得到酮,酮遇到强氧化剂KMnO4、HNO3等时可以被氧化,碳链断裂生成多种碳原子数较少的羧酸混合物。
环己酮是环状结构,控制好反应温度,氧化断裂后得到单一产物——己二酸。
环己酮是对称酮,在碱作用下只能得到一种烯醇负离子,氧化生成单一化合物,若为不对称酮,就会产生两种烯醇负离子,每一种烯醇负离子氧化得到的产物不同,合成意义不大。
三、实验药品及物理常数四、主要仪器名称、规格烧杯300ml 150ml 温度计滴管玻璃棒抽滤装置1套五、主要试剂、用量环己醇 2.1ml(2g 约0.02mol)KMnO4 8.5g(约0.053mol)10%NaOH溶液5ml浓HCl 4ml活性炭NaHSO4 (备用)六、实验步骤、现象记录八、产率计算:m理论=nM=2.0÷100.16×146.14=2.92g 产率w=m实际÷m理论×100%=1.35÷2.92=46.23%九、思考题1、在实验过程中为什么必须控制反应温度和环己醇的滴加速度?答案:因为该反应为放热反应,控制好反应温度和环己醇的滴加速度,其目的均在于反应能在一个较为理想的条件下进行,若反应温度太高,产物中可能会有其他副产物生成(碳键断裂,形成羧酸)温度太低,又阻碍了反应的进行。
2.为什么有些实验在加入最后一个反应物前要预热,而开始滴加时却又不能滴加的太快?反应开始反而可以适当的加快加料速度,原因何在?答案:预热是为了提供一个适宜的反应条件;反应开始时速度较慢,若滴加速度过快,会使环己醇积聚,反应进行过程中又释放出大量的热量,不利于得到单一产物;反应开始后,反应速度较快,可以适当的加快滴加的速度,此时环己醇能及时的反应。
己二酸绿色合成实验流程

己二酸绿色合成实验流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!己二酸绿色合成实验流程一、实验准备阶段在开展己二酸绿色合成实验之前,需要做好充分的准备工作。
己二酸制备

实验报告尼龙66前体的制备一、实验目的1、学习由环己醇氧化制备环几酮和由环几酮氧化制备己二酸的基本原理。
2、掌握由环己醇氧化制备环己酮和由环己酮氧化制备己二酸的实验操作。
3、进一步了解盐析效应及萃取在分离有机化合物中的应用。
4、综合训练并掌握控温、减压抽滤、蒸馏、重结晶等操作技能。
二、实验原理实验室制备脂肪和脂环醛、酮最常用的方法是将伯醇和仲醇用铬酸氧化。
铬酸是重铬酸盐与40-50%硫酸的混合液。
制备相对分子量低的醛,可以将铬酸滴加到热的酸性醇溶液中,以防止反应混合物中有过量的氧化剂存在,同时将较低沸点的醛不断蒸出,可以达到中等产率。
尽管如此,仍有部分醛被进一步氧化成羧酸,并生成少量的酯。
用此法制备酮,酮对氧化剂比较稳定,不易进一步被氧化。
铬酸氧化醇是放热反应,必须严格控制反应温度以免反应过于剧烈。
本实验反应方程式为:羧酸常用烯烃、醇、醛、酮等经硝酸、重铬酸钾的硫酸溶液或高锰酸钾等氧化来制备。
本实验以环己酮为原料,在碱性条件下以高锰酸钾为氧化剂来制备己二酸,反应方程式:C6H10O+MnO4-+2OH-→HOOC(CH2)4COOH+MnO2+H2O三、实验试剂和仪器装置:1、仪器:圆底烧瓶(250ml,100ml),烧杯(250ml,100ml) ,量筒(100ml ,10ml),,直型冷凝管,尾接管,蒸馏头,温度计,电热套,抽滤瓶,布氏漏斗,真空泵,蒸发皿,表面皿,分液漏斗,玻璃棒,石棉网,铁架台,酒精灯。
2、主要试剂:浓H2SO4,Na2Cr2O7,H2C2O4,NaCl,无水MgSO4,KMnO4,NaOH10%,Na2SO33、主要实验装置:四.实验步骤(一)环己酮的制备步骤:1、在250 ml圆底烧瓶中加入56 ml H2O,慢慢加入9.3 ml 浓H2SO4。
充分混合后,搅拌下慢慢加入9.8 ml环己醇。
(必要时用水冲洗),混匀,然后冷却至30℃以下。
2、将11.5g Na2Cr2O7溶于盛有6 ml H2O的100 ml烧杯中,搅拌使之充分溶解。
己二酸的制备

教学实验原理:
反应方程式
OH [O]
O [O]
HOOC(CH2)4COOH
实验步骤:
在装有搅拌器、温度剂的250 mL的三颈 烧瓶中,加入5.2 mL环己醇和7.5 g的碳 酸钾的50 mL的溶液,开动搅拌,在迅速 搅拌下,分批加入小量的研细的22.5 g的 高锰酸钾,控制反应温度在30一下,加 完后继续搅拌,直到温度不再升高为止, 然后在50水浴中加热搅拌0.5 h,过滤, 用20 mL的10%的碳酸钾洗涤滤渣,滤液 在搅拌下缓慢递加浓硫酸至强酸性,冷 却过滤,干燥,计算产率。
实验步骤流程图:
5.2 mL环己醇,7.5 g碳酸钾和50 mL 水 22.5g 高锰酸钾(分批)30oC 50oC, 0.5 h
混合物
MnO2 20 mL 10% 碳酸钠
水层
MnO2
水层 浓盐酸
残液(弃之)
己二酸
过滤 过滤 过滤
实验注意事项或实验关键环节:
温度必须控制在规定的范围内,防止氧 化反应过于剧烈;
必须使用电动搅拌; 酸化过程要充分,使己二酸完全析出。
课堂提问:
1、可否使用量取过环己醇而没有洗涤的量筒来量 取浓硫酸,为什么?
2、反应过程中发现有气体放出,该气体是什么气 体?
3、环己醇在反应过程中要缓慢加入,为什么? 4、如用环戊醇作反应物,产物为什么? 5应、温如度采要用控K制M在nO340法℃氧以化下来? 制备己二酸,为什么反 6、如产物中混有少量MnO2,怎样除去? 7、能否采用浓盐酸来代替硫酸酸化,为什么?
实验名称:己二酸的制备
教学目的:1、掌握实验室氧化环醇反应 制备二酸的方法和原理;2、掌握和巩固 搅拌、洗涤、过滤、重结晶和熔点测定 等基本操作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
己二酸的合成教案
仅供学习与交流,如有侵权请联系网站删除 谢谢2
教 案
课程名称:有机化学实验 授课教师 丁长江等 所在单位 公共化学教学与研究中心
课程类型 必修基础课
授课时间
春季学期
授课对象
医学五年制、七年制
教学内容提要 时间分配及备注
己二酸(3~4 h )
一、实验原理:
己二酸是合成尼龙-66[1]的主要原料之一,实验室可用硝酸或高锰酸钾氧化环己醇而得。
环己醇:环己醇熔点为24℃,熔融时为粘稠液体。
己二酸:溶解度如下表。
温度(℃) 15 34 50 70 87 100
溶解度(g/100g 水) 1.44 3.08 8.46 34.1 94.8 100
尼龙(Nylon)通常指的是聚酰胺纤维。
这类纤维有很多种,其中尼龙-66是我国目前生产量最大的品种之一。
它是己二酸或其衍生物与已二胺两种单体发生缩聚反应生成的一种线性高分子化合物。
由于参加反应的两种单体分子中都含有6个碳原子,所以商品名称为尼龙-66。
尼龙-66用途广泛,其中线材可用制作针织品,纺织品,轮胎帘子线,鱼网,绳索和滤布等。
经过加工制成的弹力尼龙更适于制袜子等。
二、实验材料:
仪器:三颈瓶、温度计、滴液漏斗、抽滤装置
药品:10%氢氧化钠、水、高锰酸钾、环己醇、亚硫酸氢钠、浓盐酸、活性炭
其它:滤纸、机械搅拌器、pH 试纸
OH
3
+ 8KMnO 4 +H 2O 3HOOC(CH 2)4COOH + 8MnO 2 + 8KOH
仅供学习与交流,如有侵权请联系网站删除谢谢4。
