TILLING技术的最新进展及其在辐射诱变育种中的应用前景
新型分子标记的开发和利用

新型分子标记的开发和利用黄磊;唐光绪;田东;何庆元【摘要】比较遗传分析中常用的随机DNA分子标记、目的基因标记、功能性分子标记.综述了近年开发的几种分子标记,并对新型分子标记(功能性分子标记)进行阐述,如何利用Tilling技术和关联分析的方法开发功能性分子标记,并介绍了功能性分子标记的优点和利用前景.【期刊名称】《安徽农学通报》【年(卷),期】2010(016)023【总页数】4页(P43-45,61)【关键词】功能性分子标记;目的基因标记;Tilling;关联分析【作者】黄磊;唐光绪;田东;何庆元【作者单位】安徽科技学院生命科学学院,安徽凤阳,233100;安徽科技学院生命科学学院,安徽凤阳,233100;安徽科技学院生命科学学院,安徽凤阳,233100;安徽科技学院生命科学学院,安徽凤阳,233100【正文语种】中文【中图分类】Q75长期以来,植物育种选择都是基于植物的表型性状进行的,当性状的遗传基础较为简单或即使较为复杂但表现加性基因遗传效应时,表型选择是有效的。
但许多数量性状难以准确鉴定,根据表型提供的性状遗传潜力的度量是不确切的,因而选择是低效的。
遗传育种家们很早就提出了利用标记进行辅助选择以加速育种改良进程的设想。
但形态标记和常规遗传标记数量少、遗传稳定性差、且常常与不良性状连锁,因而利用受到很大限制。
分子标记是近年迅速发展起来的一种技术手段,它的出现使人们对于基因的准确检测,目标基因的分离,克隆和转移更为方便。
自1974年Grodzicker创立RFLP技术以来,目前已发展起了多种分子标记,按其技术基础主要可分为3类:(1)依赖杂交技术手段的分子标记,如RFLP;(2)依赖于PCR为基础的分子标记,如RAPD,SSR等;(3)一些新型的分子标记,如SNPs等[1]。
按其作用分为随机DNA分子标记(random DNA markers,RDMs)、目的基因分子标记(gene targeted makders,GTMs)和功能性分子标记(functional markers,FMs)[2]。
基因创新技术在育种中的应用与展望

基因创新技术在育种中的应用与展望近年来,随着科技的不断发展,基因创新技术在育种领域中得到了广泛的应用。
通过基因创新技术,我们可以对作物的特性进行精确、高效的改良,大大提高了作物产量、品质和抗病性。
本文就基因创新技术在育种中的应用和未来展望进行阐述。
一、基因编辑技术基因编辑技术是目前育种中的一项最为前沿的技术之一。
它可以对特定的基因序列进行定向改变和修复,从而达到精确育种的目的。
目前最常用的基因编辑技术是CRISPR/Cas9技术,该技术具有定向性、高效性、简便性等优点,已经广泛应用于农业领域。
在玉米、水稻、番茄等作物的育种中,利用CRISPR/Cas9技术改变目标基因序列,可以实现提高产量、改善口感、增强抗病性等目的。
例如,美国农业部科学家利用CRISPR/Cas9技术实现了玉米中一个有害的基因NPR1的精确编辑,从而增加了玉米的抗病性。
此外,基因编辑技术还可以应用于无公害农业和无公害畜牧业的发展,从而推动了可持续农业的发展。
二、基因组学技术基因组学技术是一种较为高级的基因创新技术,它可以通过测序和分析生物的基因组序列,探寻特定因果关系并发现潜在的目标基因序列,从而进行育种。
目前,基因组学技术的应用已经拓展到了所有生物体,包括植物、动物、微生物等。
在植物育种中,基因组学技术通常可以通过对不同品种的基因组进行比较,以找到一些与特定生长条件相关的基因,用于普及农作物生长等情况。
基因组学技术的应用可以降低育种周期和成本,从而可以大大提高作物的育种效率和效果。
此外,基因组学技术还可以用于动物育种,如猪、牛、鸡等,旨在节约资源、改善肉品品质、提高生产效率。
三、表观遗传学技术表观遗传学技术是近年来快速发展的基因创新技术之一,它可以通过DNA甲基化修饰、组蛋白修饰等方式,从而影响基因表达,从而参与调整生物个体的发育、繁殖、代谢等过程。
表观遗传学技术还可以通过对DNA序列的改变,从而控制基因表达,这样就可以达到育种的目的。
我国作物遗传育种学科的发展现状与“十三五”发展重点

作物遗传育种学科在农业科学中占有核心地位[1],其根本任务是从基因型和环境2个层面研究并形成作物持续高产、优质、高效的理论、方法和技术,是关于大田作物生产与品种遗传改良的学科。
学科的创新发展,对保障国家粮食安全具有重大的意义。
粮食产量的“十一连增”[2]离不开作物遗传育种学科的创新和进步。
近年来,随着生物技术、信息技术和新材料技术的快速发展,我国的传统作物遗传育种学科迎来了新的发展机遇,成为生命科学领域具有发展潜力的学科之一,在基础、应用基础和应用研究方面取得了突破性进展,研发了1批重大的科技成果,对国家粮食安全和农业可持续发展做出了显著贡献。
1我国作物遗传育种学科的主要研究进展1.1基因组学等新技术广泛渗透近10a ,由“Next Generation Sequencing (NGS )”技术引领的基因组学技术正在一个空前的高速度推动下迅猛发展。
目前,高通量NGS 技术已经成为生命科学领域中应用最为广泛的研究手段。
例如,完成了小麦A 、D 基因组等图谱的绘制[3,4];构建了第2代玉米单体型图谱,其中包含了5500万个SNP 标记[5];对二倍体棉花———雷蒙德氏棉全基因组进行测序,并阐述了棉花基因组的多倍化及其纤维发育[6]。
此外,基DOI :10.16318/ki.hbnykx.2015.06.018河北农业科学,2015,19(6):66-70Journal of Hebei Agricultural Sciences编辑蔡海燕我国作物遗传育种学科的发展现状与“十三五”发展重点张江丽1,董文琦2,杜晓东3*(1.中国农业科学院科技管理局,北京100081;2.河北省农林科学院,河北石家庄050051;3.河北省农林科学院农业信息与经济研究所,河北石家庄050051)摘要:作物遗传育种学科的创新发展,对促进现代农业的健康发展和保障我国粮食安全具有重大的意义。
作者总结了近年来我国在作物遗传育种学方面取得的主要进展,从基因组学、种质资源保护与利用、新基因挖掘、作物杂种优势机理及利用、分子标记育种、分子设计育种、作物细胞工程和诱变育种等方面分析了“十三五”重点发展的方向。
CRISPR技术的进展与未来展望

CRISPR技术的进展与未来展望近年来,CRISPR技术成为了生命科学领域的热点话题。
CRISPR是一种基因编辑技术,能够精确地改变DNA序列。
它的诞生标志着生命科学领域的一个巨大飞跃,对疾病治疗、新药开发等有着深远的影响。
本文将探讨CRISPR技术的进展与未来展望。
一、CRISPR技术的背景CRISPR技术源于自然界中细菌免疫系统的一种特殊机制,可将外来病毒基因特异性地剪切并摧毁。
如何将这一机制应用到人类基因领域,则是CRISPR首要面临的问题。
许多科学家在CRISPR上投入了大量时间和精力,致力于寻找新的方法和实践,以便能更好地应用CRISPR技术。
人们解锁了生命科学的新奥秘,启动了新的基因编辑革命的源头。
二、CRISPR技术的进展CRISPR技术的进展无处不在。
截至目前,全球已经有超过50个国家和地区的400多家学术机构和企业,开展了与CRISPR相关的科研工作。
下面,将从四个方面进行具体阐述。
1、基因诊断CRISPR技术可用于诊断基因突变等人类基因缺陷。
科研人员可以通过不到10美元的成本检测千兆碱基,并对其进行编辑。
CRISPR技术在基因诊断领域可谓是一个巨大的进展,有望缩短疾病的初期诊断时间。
2、基因治疗基因治疗是指通过基因编辑技术,对特定基因进行修正或加工,从而治疗一系列人类疾病。
CRISPR技术的出现使得基因治疗成为可能。
一些重大的疾病,比如癌症,可以被CRISPR技术治愈。
3、农业科技CRISPR技术在农业科技领域也有着有捷径的应用。
通过改变植物的基因,可以使其生长更快更健康,从而提高农业产量。
这对解决全球日趋严重的食品短缺问题是非常重要的。
4、新药开发新药的开发需要花费巨额的时间和成本。
CRISPR技术的出现为新药的开发带来了新的思考方式。
CRISPR技术可以帮助科学家更好地理解疾病发病机理,从而研发出更安全有效的药物。
三、CRISPR技术的未来展望CRISPR技术创造了一种全新的生命科学生态系统。
植物物理(辐射)诱变育种

植物物理(辐射)诱变育种物理诱变又称辐射诱变,是指通过各种辐射源对生物进行辐射诱变,常见辐射诱变源有中子、γ射线、X射线、电子束、离子束、紫外线等。
植物辐射诱变育种材料包括植物种子、小鳞片、活体植株、花粉、幼穗、幼胚及组织培养物等,由于处理方法、时间的不同,可分为内照射、外照射、急性照射、慢性照射。
辐射可以通过使相关材料在细胞、分子、生理和形态等方面发生变异,人们则通过对产生的突变体的选择和鉴定,直接或间接培育可供农业生产的新品种。
1植物物理(辐射)诱变育种特点遗传变异是生物进化和新品种选育的基础,植物物理诱变育种可以从以下几个方面为育种工作提供区别于自然变异产生的更多的材料。
(1)丰富种质资源:植物物理诱变育种可以通过诱导植物体产生变异,从而提高植物体变异频率,诱导产生具有自然界原本没有的新性状的突变体,在一定程度上极大地丰富了种质资源,直接或间接地为人们的育种工作的进行提供材料。
(2)打破基因连锁:通过基因重组,使基因进行重组是植物物理诱变育种工作中诱发突变体的表现之一,可以将一些伴随不良性状的有利性状间的紧密连锁打破,从而使育种工作者有更多的机会和选择。
(3)保持优良特性:物理诱变往往只是个别位点的基因产生突变,可以基本保持品种原有遗传特性基础上,对某个或某些性状进行改良,从而品种品质。
(4)缩短育种年限:诱变育种可以提高植物变异频率,且多为隐形突变,稳定快,育种年限短。
(5)改良植物育性:将远缘材料的花粉进行辐照处理,可促进受精结合,克服杂种不育;还能使正常植株产生雄性不育,为育种提供雄性不育材料;可以改良植物自交不亲和性。
2 植物物理(辐射)诱变育种不足之处辐射诱变可以为人们育种工作带来诸多便宜之处,但相对应的,也存在着一些缺点。
虽然辐射处理育种材料可以诱导其变异频率大幅度提升,但是诱导突变的方向却是难以控制的;虽然可以保持优良特性,但是难以在一次辐射后代中得到多种性状都优秀的突变体,同时改良多个或综合性状较为困难;有的辐射诱变,如快中子诱变,虽然可以大规模产生突变株系,但存在操作复杂和不可控的缺点,这是其在育种工作中的难题;此外,辐射诱变不随机、不可控的突变特点会使育种工作者投入更多的时间和资金。
tilling技术的原理与方法述评

tilling技术的原理与方法述评
Tilling技术是一种基因组高效筛选方法,其原理是利用化学或物理学手段随机诱导出基因组的点突变,并利用高通量测序技术对突变个体进行全基因组测序。
然后,将突变个体与野生型对照组的基因组序列进行比较分析,以鉴定和定位突变,从而快速识别相关基因和突变位点。
通常使用化学诱变剂例如EMS (ethyl methanesulfonate) 或物理诱变剂比如gamma射线,通过随机的方式改变DNA序列,从而导致突变。
突变后生成的杂种子代可以直接用于筛选目标基因,避免了常规定向构建突变库的过程。
Tilling技术的优点是能够快速、高效地筛选出多个基因组突变,而且无需构建特定基因的突变库,因此可以广泛应用于各种生物体中的基因功能分析和基因改良。
总体而言,Tilling技术是一种可靠、快速、高通量的基因组突变筛选方法,应用前景广阔。
TILLING技术原理及其路线

• 玉米
3)斑马鱼
参考文献
1.High-Throughput Screening for Induced Point Mutations. Plant Physiol.2019,126:480
2.TILLING by Sequencing (TbyS) for targeted genome mutagenesis in crops. Mol Breeding . 2019,37: 14
5.Discovery of induced point mutations in maize genes by TILLING. BMC Plant Biology 2019, 4:12
6.TILLING: practical single-nucleotide mutation discovery. The Plant Journal (2019) 45, 684–694
• 但需要预先知道所研究基因的序列。
操作流程
操作流程
1)用甲基磺酸乙酯处理种子诱导位点突变;
2)播种诱变处理种子,按单株种植得到诱变 M1代植株;
3)播种M1代种子得到诱变M2代植株,自交获 得M2代种子并保存建库;
4)按单株提取M2代组织DNA,存放于96孔微孔 板建库;
5)5-8倍混合单株DNA库,构建DNA样品池以增 加扫描通量;
TILLING(定向诱导基因组局部突变) 技术原理及其路线
中国农业大学 齐孟文
TILLING是后基因组时代出现的,一种 将烷基化试剂EMS或辐射诱导的位点突变技 术,与特定基因的PCR扩增技术和突变单核 苷酸多态性检测技术或下一代基因俘获高 效测序技术相结合的反相遗传学方法。提 供了一种几乎对所有物种都适应的、低成 本、高通量和自动化的诱发突变筛选技术。 该技术也可用于天然群体自发突变的筛选, 称之为Eco-TILLING。
诱变育种的发展趋势

诱变育种是指用物理、化学因素诱导动植物的遗传特性发生变异,再从变异群体中选择符合人们某种要求的单株/个体,进而培育成新的品种或种质的育种方法。
它是继选择育种和杂交育种之后发展起来的一项现代育种技术。
通过近几十年的研究人们对诱变原理的认识也逐步加深。
常规助杂交育种是染色体的重新组合,一般并不引起染色体变异,更难以触及到基因。
而辐射会对染色体的数目、结构等都会产生影响,使染色体发生缺失、断裂、倒位移位等变化。
诱变育种也有自身的弱点:一是诱变产生的有益突变体频率低;二是还难以有效地控制变异的方向和性质;另外,诱发并鉴定出数量性状的微突变比较困难。
因此,诱变育种应该与其它技术相结合,同时谋求技术上的自我完善。
而提高诱变效率,迅速鉴定和筛选突变体以及探索定向诱变的途径,是当前研究的重要课题。
空间诱变是20世纪80年代发展起来的助航天技术手段的诱变新技术,是空间技术、生物技术和农业育种技术相结合的产物。
生物体在空间特殊的环境下,产生可遗传的变异,从而获得有利的突变体。
空间诱变育种迄今已在农作物、蔬菜、花卉、微生物和昆虫卵等上进行了研究应用,特殊的的太空环境, 对植物生长、发育、生殖、遗传、癌变及衰老等方面有强烈的影响,很容易引起生物体的变异,通过对有益的变异体进行筛选,从而培育出作物的优良新品种,在生产上应用将产生巨大的社会经济效益。
空间诱变育种突变频率高、突变谱广、变异幅度大,良性变异多,有益突变率高,变异性状稳定较快,育种周期缩短,生物安全性高。
空间诱变既能明显改良作物的某些农艺性状,又可获得地面育种所难以得到且在重要经济性状上产生突破性影响的罕见突变。
因此,在生物品种改良上具有重要的现实意义。
我国政府十分重视空间诱变育种技术的研究与应用,并加大投入。
空间诱变作为产生新基因源和创造新种质的重要途径之一,已选育出的太空作物、太空蔬菜、太空花草、太空林木等越来越多。
空间诱变育种已成为我国空间生命科学研究的重要方面我国“神舟”号飞船的成功发射,为利用宇宙空间研究诱变育种开拓了广阔的前景。
TILLING技术及其在农作物中的应用现状

扰 沉默 和插 入外 源 DN 片段 这 两 种 反 向遗 传 学 A 研 究方 法 , 通常 伴 随着 转基 因技 术 以及 组 织 培 养
技术 , 应用 于少 数 物种 l 。TI L NG 技术 则将 仅 l 3 ] L I
T L I G 操作 流 程 见 图 1 ① 将 干种 子 利用 ILN , 甲基 磺 酸 乙酯 ( MS 进 行 处 理 , 其 受 到 诱 导 , E ) 使 从 而 产生 一系 列 的 点 突变 , 用 单 株 种 植 的方 式 采
产 生 M 株 ; M 株 自交 , 植 ② 植 获得 M 种子 , 种
生 型和 突变 型 2种 扩 增 片 段 ; 使用 限制 性 内切 ⑦
酶切 开 异源 双链 , 通常 使 用 的酶 为 C L 酶 , 能 E lቤተ መጻሕፍቲ ባይዱ它
有效 识别 出错 配 的碱基 , 即突变 的位 点 , 切开 这 并 杂 合双 链 ; ③利 用 电泳 的 方 法分 析 酶 切 后 得 到 的产 物 , 而 得 到 突变 池 ; 当发 现有 突 变体 时 , 从 ⑨
它 是一 种 高通 量 、 成本 , 高效 筛选 由化 学诱 变 低 可 剂E MS诱 发 产 生 的 点 突 变 个 体 的 技 术 。近 年 来 , I L NG技 术 已经应 用 于植物 功能 基 因组 学 TL I 的研 究 、 突 变 体 的筛 选 、 NP 的检 测 和开 发 以 点 S 及标 记辅 助 育 种 等 方 面 。早 在 2 0世 纪 3 0年 代 , 人工 可诱 发 产生 突变 成为 遗传 学发 展史 上一 项最 重 大 的突破 以来 , 打破 了智 能 研 究 自发 突 变体 的 局 限 , 动 了之 后 的 遗 传 学研 究 [ 。对 于高 等 生 推 2 ] 物 的各种 遗传 特性 研究 便 可 以通过 对诱 导突 变体 进 行 的基 因功 能研 究来 实现 。由诱导 突 变体 推动
枸杞分子育种现状及展望

枸杞分子育种现状及展望段淋渊;秦垦;戴国礼【摘要】基于分子育种概念的基础,对近年来枸杞部分农艺性状相关基因克隆及调控的研究进展进行综述,简要阐述了枸杞分子育种研究现状,为枸杞分子育种的发展提供参考.【期刊名称】《宁夏农林科技》【年(卷),期】2018(059)005【总页数】3页(P26-28)【关键词】枸杞;农艺性状;分子标记育种【作者】段淋渊;秦垦;戴国礼【作者单位】宁夏农林科学院枸杞工程技术研究所,宁夏银川 750002;宁夏农林科学院枸杞工程技术研究所,宁夏银川 750002;宁夏农林科学院枸杞工程技术研究所,宁夏银川 750002【正文语种】中文【中图分类】S567.1+9枸杞(Lycium chinenseMill.)最早见于殷商甲骨文,为茄科枸杞属多年生木本植物,全世界约有80种,主要分布在美洲和亚洲,我国有7个种和3个变种,集中分布于我国的西北地区。
宁夏中宁是世界枸杞的重要发源地和正宗原产地,也是我国枸杞的主产区和新品种选育、新科技研究推广示范区,有600多年枸杞栽种历史。
20世纪80年代以来,科研人员广泛收集并已建成我国唯一的枸杞种质资源圃,并在此基础上选育出宁杞1号等一系列品种。
笔者从分子育种角度综述了近年来在枸杞分子生物学、基因组学等领域的研究进展,对枸杞分子育种发展方向进行分析探讨和展望。
1 分子育种传统的植物育种,一般通过将现有种质资源进行有性杂交并对其后代表型进行选择来进行,育种周期较长、遗传改良率低。
分子育种是基于对控制相关农艺性状关键基因或QTL功能认识,将先进生物技术作为辅助手段应用于常规育种,实现对育种目标的设计。
分子育种在提高效率、缩短周期、增产抗逆等方面的突出优势,使之成为当下植物育种的重要方向。
基于分子育种的不同利用方式,分子育种包括两方面:①分子标记辅助选择育种。
即利用目标基因本身或其紧密连锁标记作为标记完成对目标性状的选择,实现由表型到基因型选择的过渡。
基因组学研究的最新进展与未来发展趋势

基因组学研究的最新进展与未来发展趋势现代科学技术与医学领域的不断进步,使得人们对于基因组的认识与研究也越来越深入。
基因组学是研究基因组整体结构、功能和演化的科学。
它是整个生物学领域的一个重要组成部分,而随着技术的进步,基因组学在医学、农业、环保等领域的应用也越来越广泛。
一、基因组学研究的最新进展1. 基因编辑技术基因编辑技术是一种基于DNA序列精准修复或改变的方法,常用的基因编辑技术有CRISPR-Cas9、TAL effector nuclease (TALENs)和Zinc-Finger Nuclease(ZFNs)等。
通过这些技术,科学家们可以精确、高效地改变基因的序列,这将对遗传疾病的治疗、精准医学领域的发展等产生深远影响。
2. 基因变异的功能解析基因变异是导致疾病的原因之一。
科学家们正在研究基因变异的功能解析,以期发现更多可能导致疾病的基因变异,为疾病的诊断和治疗提供新思路和方法。
同时,基因变异也可以帮助我们了解人类进化历程以及不同种类之间的关系。
3. RNA修饰的研究RNA修饰是指RNA分子上的化学修饰。
这项研究热点涵盖了RNA的各个方面,从RNA的合成到稳定,再到它们的功能。
近年来,研究表明RNA修饰在调控基因表达、蛋白质合成和细胞的分化等方面起着重要的作用。
4. 固体状态NMR技术固体状态NMR技术是研究纳米分子结构的有力工具。
这种技术可以利用核磁共振原理,揭示分子之间的结构、动力学和功能性信息。
除了广泛应用于物理、化学等领域以外,近年来,固体状态NMR技术也开始在生物学和医学领域发挥作用。
二、基因组学研究的未来发展趋势1. 大数据分析随着大数据时代的到来,数据分析技术的发展将成为基因组学研究的重要发展趋势。
现在,利用计算机软件处理和分析海量的基因组数据已成为基因组学研究不可或缺的手段。
随着数据量的增加,基因组学研究将更加依赖于这些技术。
2. 单细胞基因组学单细胞基因组学是指通过对单个细胞进行基因组检测和分析,了解不同细胞间的基因组变化、个体差异以及细胞发育过程中的动态变化,从而更深入地了解人类的生物学文化、疾病发生的机制以及药物筛选等方面。
定向诱导基因组局部突变技术研究及应用进展

定向诱导基因组局部突变技术研究及应用进展摘要:定向诱导基因组局部突变(TILLING)技术是反向遗传学中研究功能基因的一种全新的方法。TILLING技术借助高通量检测手段,快速有效地从突变群体中鉴定出点突变。系统介绍了TILLING技术的基本原理和技术路线,同时总结了TILLING技术本身有待解决的一些问题。关键词:定向诱导基因组局部突变(TILLING)技术;反向遗传学;点突变;检测Research and Application Progress on TILLING TechnologyAbstract: TILLING(Targeting induced local lesions in genomes) technology is a nove1 reverse genetics strategy that provides a completely solutions for high throughput and low cost discovery of induced point mutations in populations of chemically mutagenized individuals. The TILLING methodology and its technological routine were introduced. Meanwhile, some problems in TILLING were presented.Key words: Targeting induced local lesions in genomes(TILLING); reverse genetics; point mutations; detection诱导突变一直是遗传学发展的主要动力之一。在各种诱变方法中,化学诱变应用特别普遍。化学诱变剂中的烷化剂类能与核苷酸结合,从而造成互补碱基的错配,进而引起复制后的碱基系列改变。例如EMS(甲基磺酸乙酯)使鸟嘌呤(G)烷基化,生成O6-鸟嘌呤,后者能与胸腺嘧啶(T)配对而不再与胞嘧啶(C)配对[1]。适宜浓度的EMS诱变具有染色体断裂较少(染色体断裂可引起突变体染色体非整倍化、不育甚至显性致死)、点突变频率高的优点,因此EMS的诱变效果通常比较好[1,2]。化学诱变剂处理后产生的突变多为点突变,其中发生在蛋白质编码区的突变可分为三类:无义突变、沉默突变、错义突变。对于功能基因而言,EMS诱导的点突变可产生静息基因(null allele或silent gene)、条件型等位基因(conditional allele)或只影响特定的蛋白质结构域,所有这些突变型对阐释目标基因的功能非常有益[3]。随着大规模测序数据的积累,科学家们对基因组的注意力从基因的结构转向基因的功能,而这就依赖于反向遗传学的发展[4]。反向遗传学研究方法常分为两类,一是特定目标位点的定向诱变,另一个就是全基因组范围内的诱变和筛选。前者常用反义RNA抑制或RNA干扰(RNA interference,RNAi)来实现,后者常用T-DNA 随机插入或转座子标签法来实现[5]。但是,要获得并分析基因组中每个基因的敲除突变体并不容易。目前,对RNAi的研究十分热门,然而RNAi的功效仍旧不明朗,主要表现在后代表型的多样性及不可预见性。同时,由于上述技术均依赖于农杆菌介导转化或内源标签系统,需耗时的转基因和复杂的组织培养技术,作为常规方法加以应用目前仅限于少数物种。当然,还有一些其他研究方法,但都存在不少问题(表1)。因此,在拟南芥等模式生物测序完成后,迫切需要一种新的兼具自动化、适用性广、突变率高的反向遗传学工具用于功能分析。TILLING技术就是在这一背景下应运而生的[6]。1 TILLING技术的原理TILLING(Targeting induced local lesions in genomes)技术是美国华盛顿Fred Hutchinson癌症研究中心以Steven为首的科学家发展建立的[7],它将诱发产生高频率点突变的化学诱变方法与PCR筛选技术和高通量检测方法有效结合,以便发现、分析目标区域点突变,是一种全新的高通量、低成本的反向遗传学研究方法。TILLING技术的原理是先用化学诱变剂诱发产生一系列的点突变,再根据目标基因设计特异性引物,对目标基因进行PCR扩增,而后将PCR扩增产物变性退火生成错配的异源双链核酸分子,利用仪器分析技术区分出纯合双链和异源双链。为了增加通量,避免假阳性,它将突变群体若干个个体样本的DNA混合建池(如拟南芥ATP项目组用8个单株建成8倍池),在检测出含突变体的混合池后再对该池中的每个个体分别重新进行PCR扩增,验证混合池是否为假阳性并确定对应的突变个体。在明确突变体后,再对目标基因测序,测序结果可以再次验证是否真的为阳性突变。1.1 群体准备产生适合TILLING技术的诱变群体要求考虑以下因素:目标群体的遗传组成、诱变剂的种类和处理方式、DNA提取与建池策略等。目标群体的遗传组成最好比较简单,首选纯合自交系。并且为了减少亲本个体间的遗传差异,在保证能产生数千子代的前提下,应当选择单个或尽可能少的供体亲本。这方面,有些单倍体育种技术开展得比较成功的作物(如甘蓝型油菜等)无疑具有比较优势。而且只要有可能,供体亲本就应当选择大部分测序信息已经知道的株系或品种。诱变剂应选择点突变率高的诱变剂。EMS由于突变密度高、使用简便可靠而倍受青睐。拟南芥种子EMS突变体后代中,点突变随机分布在染色体组上,其中编码区5%突变为编码产物的提前终止突变,50%为改变编码蛋白氨基酸系列的错义突变[8]。诱变强度也是考虑因素之一,同样处理的诱变方法在不同物种中的突变率相差很大。诱变会出现致死和不育现象,所以应在突变率、致死率和不育率之间找到平衡。例如果蝇EMS诱变剂量为50 mmol/L时,平均每155.6 kb发生一个突变(1/155.6 kb,下同);当剂量提高到125 mmol/L时,突变频率增加到1/90.5 kb,但F2存活数从1 915只(50 mmol/L)锐减至171只(125 mmol/L)[3]。比较已有研究结果中的EMS诱发突变的频率,相差最高达40倍。适宜浓度下最高突变率为六倍体小麦(1/25 kb),接下来依次为四倍体小麦(1/40 kb)[9],果蝇(1/155.6 kb)[3],拟南芥(1/170 kb)[8],斑马鱼(1/230 kb)[10,11],玉米(1/500 kb)[12,13],水稻(1/500 kb)[14]和大麦(1/1.4 Mb)[15],这些数据可能表明影响突变率的是生物体的倍性而不是基因组大小,多倍体生物可能耐受更高剂量的EMS。但总体上,诱变处理后变异的分子机理方面的信息还不多,今后这方面的工作可能对改进TILLING技术很有帮助。3 TILLING有待解决的问题虽然TILLING是反向遗传学研究领域的一把利器,但在实际应用中有些技术尚需改进。1)诱变强度(包括诱变剂浓度、处理时间)和处理方式是影响TILLING效果的很重要的因素。如前文所述,不同文章报道的诱变结果相差很大。虽然有多倍体可能更耐EMS处理的推测,但针对不同物种何种诱变强度和处理方式最佳,实际工作中常常只能凭经验来确定,今后可能还要在这方面做系统的研究[16]。2)突变体的保存也是个问题。对多个功能基因的研究是相当费时的工作,在研究完成前,如何保存突变体?对植物而言,低温保存可以解决这个问题。而对动物来说,就比较难了。Stemple领导的研究小组收集了6 000条斑马鱼用于TILLING计划,如此大的群体,饲养工作和饲养空间无疑增加了实验成本,而且由于寿命限制,还必须在鱼死亡前完成突变体检测和表型验证工作。期间部分个体的死亡不可避免,而这些个体可能就是突变基因的载体[27,28]。3)功能基因的突变与对应突变表型的分析仍然有大量工作要做。一旦点突变被发现后,对那些引起编码蛋白功能损伤的突变就要进行表型分析。但化学诱变引入了大量点突变,使得表型分析变得相对困难。例如MaCallum等首次报道了用TILLING研究甲基化酶CMT3等位基因,但一年多以后才完成详细的表型分析。TILLING突变体越多,表型鉴定就越慢。而且,除了敲除突变,等位基因还可能有其他差异表达,所以下游工作变得更复杂。在基因组存在大量背景突变的前提下,如何避免把背景突变的表型误检为目标基因的表型,这些问题,就连TILLING领域的权威Steven等人[6]也感到“如同潮水般涌现的基因组测序结果一样,突然出现的大量突变体材料令每个研究人员束手无策”。也许,解决这个问题还得依靠多国科学家共同努力。参考文献:[1] ASHBURNER M. Drosophila: A Laboratory Handbook[M]. NewYork:Cold Spring Harbor Laboratory Press, 1990.[2] HAUGHN G,SOMERVILLE C R. Selection for herbicide resistance at the whole-plant level [A]. LEBARON H M, MUMMA R O,HONEYCUTT R C,et al. Applications of Biotechnology to Agricultural Chemistry[M]. Easton,PA:American Chemical Society,1987.98-107.[3] SYLKE W,ANJA S,DANA B,et al. Target-selected mutant screen by TILLING in Drosophila[J]. Genome Research,2005, 15:718-723.[4] CLAIRE M M,LUCA C,ELIZABETH A G,et al. Targeting induced local lesions in genomes(TILLING) for plant functional genomics[J]. Plant Physiol,2000,123:439-442.[5] ERIN J G,GEORGE W H. TILLING without a plough:a new method with applications for reverse genetics[J]. Plant Bio,2005,8:211-215.[6] STEVEN H,LUCA C. Single-nucleotidemutations for plant functional genomics[J]. Annu Rev Plant Biol,2003,54:375-401.[7] CLAIRE M M,LUCA C,ELIZABETH A G,et al. Targeted screening for induced mutations[J]. Nat Biotechnol,2000,18:455-457.[8] ELIZABETH A G, CHRISTINE A C, NICHOLAS E T, et al. Spectrum of chemically induced mutations from a large-scale reverse-genetic screen in Arabidopsis[J]. Genetics,2003,164:731-740.[9] ANN J S, SUSAN I F, DAYNA L, et al. A reverse genetic, nontransgenic approach to wheat crop improvement by TILLING[J].Nature Biotechnology,2004,12:1-7.[10] DRAPER B W,MCCALLUM C M,STOUT J L,et al. A high-throughput method for identifying N-ethyl-Nnitrosourea (ENU)-induced point mutations in zebrafish[J]. Methods Cell Biol, 2004,77: 91-112.[11] WIENHOLDS E,V AN EEDEN F,KOSTERS M,et al. Efficient target-selected mutagenesis in zebrafish[J]. Genome Res, 2003,13:2700-2707.[12] TILL B J,BURTNER C,COMAI L,et al. Mismatch cleavage by single-strand specific nucleases[J]. Nucleic Acids Res,2004,32,2632-2641.[13] TILL B J,REYNOLDS S H,WEIL C,et al. Discovery of induced point mutations in maize genes by TILLING[J]. BMC Plant Biol,2004, 4:1-8.[14] WU J L,WU C J,LEI C L,et al. Chemical-and irradiation-induced mutants of Indica rice IR64 for forward and reverse genetics[J]. Plant Mol Biol,2005,59:85-97.[15] DA VID G C,NICOLA M,PAUL S,et al. A structured mutant population for forward and reverse genetics in barley (Hordeum vulgare L.)[J]. Plant J,2004,40:143-150.[16] LUCA C,STEVEN H. TILLING: Practical single-nucleotide mutation discovery[J]. Plant J,2006,45:684-694.[17] JOY K,JULIATI R,JOHN S W. Application of TILLING/EcoTILLING to screen for small mutations in mammals[EB/OL]./docs/2005/Tilling_Ecotilling.pdf.[18] BRADLEY J T,TROY Z,ELISABETH B,et al. High-throughput discovery of rare human nucleotide polymorphisms by Ecotilling[J]. Nucleic Acids Res,2006,13:1-12.[19] ROZEN S,SKALETSKY H. Primer3 on the WWW for general users and for biologist programmers[J]. Methods Mol Biol,2000,132:365-386.[20] GRAHAM R T. Enzymatic and chemical cleavage methods[J].Electrophoresis,1999,20:1125-1130.[21] WU J,SUN R F,ZHANG Y G,et al. Establishment of Ecotilling for discovery of DNA polymorphisms in Brassica rapa natural population[J]. China Agri Sci,2005,9:654-659.[22] YUTAKA SATO,KENTA SHIRASAWA,YOSHINOBU TAKAHASHI,et al. Mutant selection from progeny of Gamma-ray -irradiated rice by DNA heteroduplex cleavage using Brassica petiole extract[J].Breeding Science,2006,56:179-183.[23] RAMAN S,MILTON A E,MARY P J,et al. Methods for reverse genetic screening in zebrafish by resequencing and TILLING[J].Methods,2006,39(3):220-227.[24] TRENTON C,BRADLEY J T,RACHEL T,et al. High-throughput screening for induced point mutations[J]. Plant Physiol, 2001,126:480-484.[25] LUCA C,KIM Y,BRADELY J T,et al. Efficient discovery of DNA polymorphisms in natural populations by Ecotilling[J]. Plant J,2004,37:778-786. [26] ERIN J G,GEORGE W H,CHENG C Y,et al. Use of Ecotilling as an efficient SNP discovery tool to survey genetic variation in wild populations of Populus trichocarpa[J]. Mol Eco,2006,15: 1367-1378.[27] JANE B. Small fish,big science[J]. PloS Biology,2004,2:568-572.[28] DEREK L S. TILLING—a high-throughput harvest for functional genomics[J]. Nat Rev Genet,2004,5:1-6.。
TILLING技术及其应用的研究进展

展起来的定 向诱导基因组局部突变技术( a en — Tr t gI gi n d cdL cl ei sI e o s , TL I G技 术 能 u e oa L s n N G nme ) 即 ILN o 够检 测到单个 碱基 的突变和变 异 , 种技 术首 先 由 这 Mc l m 提 出 J后来 由 于 C L I核 酸 内切 酶 的 应 用 ll au , E
一
,
在各种诱导突变的物质 中, 化学诱变剂的应用尤其广 泛, 比如其 中之一 的甲基磺酸 乙酯 ( t l e aeu Eh t nsl ym h —
fnt, MS 就 尤 为 有 效 , 是 因 为 E S能 对 碱 基 进 oaeE ) 这 M
收 稿 日期 :0 1—பைடு நூலகம்2—1 21 0 9
s e tc i e d b o-r d a d c ae t s d mo a u ・ w e o s e i・ i n o td wi P e o n s f o n p me h l -
d f n i d i pt ns E p n ’ ed [ ] Se c— ie gs e m ai t’ xo Wie ses J . ed si fr i z e
缺 失 突变体 , 于那 些 点 突 变却 无 能 为 力 。几 年 前 发 对
突变体分析是生物学研究中最重要的研究工具之 人们对植物生长发育 、 细胞生物学以及生物代谢的 深入研究和理解都离不开突变体分析。人为地创造突 变体 已经成 为 近 8 0年来 遗传 学研 究 的主要 驱动力 … 。
变化的突变体 , 这致使人们只能鉴定 出很少一部分突 变 。随着 多种 模式 生物 的基 因组计 划 的完 成和生 物 信
CRISPR技术的发展历程及其应用前景

CRISPR技术的发展历程及其应用前景人类基因计划的完成引发了科学技术的革命,越来越多的科学家开始思考如何将基因组编辑技术应用于实际。
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats)是一种在细菌免疫系统中发现的DNA序列,可以被人工复制和重新搭建,修改目标基因组。
CRISPR技术的发展历程及其应用前景备受关注。
一、CRISPR技术的历史2002年,西班牙研究人员Francisco Mojica发现了一种存在于细菌中的神奇DNA序列,这个DNA序列有一种特殊的能力——它可以存储病毒攻击的记忆,并在将来的攻击中保护细菌免于病毒侵袭。
研究人员将这种DNA序列命名为CRISPR。
2007年,法国研究人员Emmanuelle Charpentier开始研究CRISPR的机制,她和美国研究人员Jennifer Doudna一起发现了细菌抵御病毒侵袭的能力便是一种基于CRISPR的“基因剪刀”。
2012年,研究人员成功地将脱氧核糖核酸(DNA)'修剪'为CRISPR段与特定DNA梯度的DNA评估。
这个过程被称为“CRISPR基因组编辑”,并且以巨大的速度在全球范围内被广泛采用,而科学家也赢得了年度突破奖和洛克菲勒综合癌症中心的一份重要奖项。
二、CRISPR的应用领域1、医学CRISPR技术的应用最为广泛的领域便是基因治疗和癌症研究。
如在2014年,美国密歇根州立大学研究团队利用CRISPR技术对乳腺癌的晚期肿瘤进行了治疗,成功地使肿瘤体积缩小了50%。
这项研究意味着所有类型的癌症治疗可能都潜伏着发展的可能性,在未来被治愈的故事为数不多的患者中,这项研究将为他们掀起崭新的希望。
2、农业高产量的作物、高效的养殖业、恢复生态平衡等方面都需要CRISPR技术。
CRISPR作为一种基因编辑技术,可以改变特定物种的表现形态、表达模式和发育特征等,因此CRISPR已经被广泛应用到改进植物品种、获得更好的产量和提高作物对环境变化的抵抗力等方面。
粮食安全背景下现代育种产业变革及发展对策
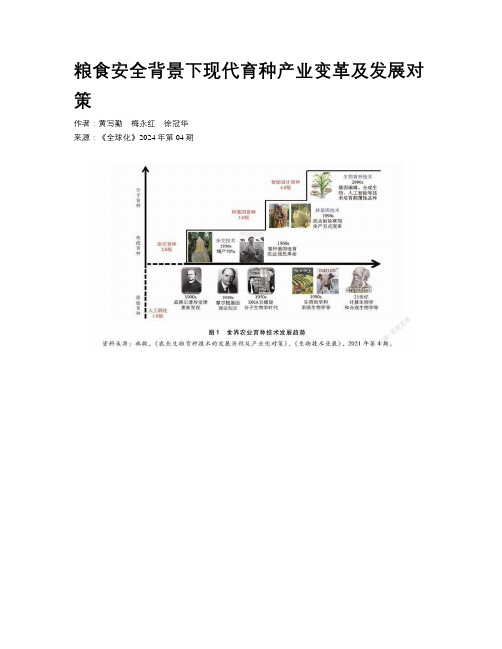
粮食安全背景下现代育种产业变革及发展对策作者:黄写勤梅永红徐冠华来源:《全球化》2024年第04期摘要:现代农业的持续发展面临着粮食安全的重大挑战。
在生命科学时代,粮食安全问题在很大程度上取决于现代育种技术和其产业化进展。
近年来,生物技术迅速发展,育种技术已经从传统育种逐步跨入现代育种时代。
如今,转基因、基因编辑、合成生物等技术为世界粮食安全带来了新的希望。
尽管现代育种技术取得了显著进步,但其在全球范围内的产业化进程仍存在一些挑战。
首先,传统育种技术在面对农作物产量、品质、抗病虫性等问题时已难有突破。
其次,在转基因育种、基因编辑、合成生物技术等领域,新技术如何与产业化相结合,提升农业生产的产量与效益,也是值得探讨的问题。
本文系统介绍转基因、基因编辑、合成生物等主流育种技术,并对这些作物的优势、前景以及对农业格局的影响做概括性介绍,进而分析当前中国的优势和差距;结合国内外的典型案例,通过大量统计数据综合介绍中国的应用现状,并对未来的发展提出对策建议。
关键词:粮食安全现代育种技术转基因作物基因编辑合成生物学作者简介:黄写勤,中山大学测绘科学与技术学院教师;梅永红,华谷研究院理事长;徐冠华,中国科学院院士。
在生命科学时代,粮食安全问题在很大程度上将取决于现代育种技术和产业化的突破。
当前,全球的农作物育种技术已由原始育种、传统育种,逐步跨入了大分子育种时期(林敏,2021)。
转基因、基因编辑、合成生物等现代育种技术正在给世界粮食安全问题带来新希望。
一、现代育种技术概述李家祥等认为,诱变、杂交、分子标记辅助以及转基因都是生物育种技术的第二代或第三代,基因编辑是当前全球育种最高水平技术,是第四代(见图1)。
而全合成生物工程技术被视为是影响未来的十项颠覆性科技之一,将带来第三次生物科学革命(林敏,2021)。
(一)转基因技术在20世纪70年代,科学家斯坦利·科恩(Stanley Cohen)进行了一项开创性的研究,他在实验室中将抗青霉素基因转入大肠杆菌体内,这一成就不仅为转基因技术的发展奠定了基础,而且为后续的生物技术研究开辟了广阔的道路。
诱变育种的方法

诱变育种的方法引言:诱变育种是一种通过人为诱导生物体遗传物质的突变来改变其性状的育种方法。
它在农业、植物育种、动物育种等领域都有广泛应用。
本文将介绍诱变育种的基本原理、常用方法以及其在农业生产中的应用。
一、诱变育种的基本原理诱变育种的基本原理是通过诱导生物体的遗传物质发生突变,从而改变其性状。
突变是指基因发生改变,导致生物体的某些特征发生明显变化。
诱变育种利用这种突变来创造新的优良品种,以满足人们对农作物产量、品质、抗病性等方面的需求。
二、诱变育种的常用方法1. 辐射诱变法:辐射诱变法是最常见的诱变育种方法之一。
它通过使用不同类型的辐射源(如X射线、γ射线、紫外线等)照射生物体,使其遗传物质发生突变。
这种方法简单易行,广泛应用于农作物、家禽、家畜等的育种中。
2. 化学诱变法:化学诱变法是利用化学物质诱导生物体遗传物质发生突变的方法。
常用的化学诱变剂有EMS(乙基甲磺酸甲酯)、NMU (亚硝基甲基脲)等。
这些化学物质能够与DNA分子发生反应,导致碱基的改变,从而引发突变。
3. 基因工程诱变法:基因工程诱变法是近年来发展起来的一种新型诱变育种方法。
它利用基因工程技术,通过直接改变生物体的基因序列来诱导突变。
这种方法具有高效、精确的特点,可用于特定基因的定向突变。
三、诱变育种在农业生产中的应用1. 提高产量:诱变育种可以通过诱导农作物的突变,改变其生长发育过程中的关键基因,从而提高产量。
例如,通过诱变使水稻产生更多的穗粒,或使玉米产生更大的穗子,从而提高农作物的产量。
2. 改良品质:诱变育种还可以改良农作物的品质,使其具有更好的口感、营养价值或抗病性。
例如,通过诱变使水果的口感更甜、更脆,或使蔬菜的抗病能力增强,从而提高产品的市场竞争力。
3. 培育新品种:诱变育种可以创造出新的品种,满足市场需求。
通过诱变,育种者可以获得具有新颖特征的作物品种,如颜色、形状、味道等方面的变化,从而开拓市场。
结论:诱变育种是一种有效的育种方法,通过诱导生物体遗传物质的突变,改变其性状,以满足人们对农作物产量、品质、抗病性等方面的需求。
遗传学进展中的新技术与方法

遗传学进展中的新技术与方法遗传学是研究遗传现象和遗传规律的科学,它对于人类的生命和健康具有重要意义。
随着科技的不断进步,遗传学领域也涌现出许多新的技术和方法,为我们深入了解遗传现象和应用遗传知识提供了更多的可能性。
本文将介绍遗传学进展中的一些新技术与方法。
一、基因编辑技术基因编辑技术是近年来遗传学领域的一项重大突破。
它通过对基因组进行精确的修改,可以实现对生物体基因的精准编辑和修复。
其中最为著名的技术是CRISPR-Cas9系统。
CRISPR-Cas9系统利用一种特殊的酶(Cas9)和一段RNA序列(CRISPR)来识别和切割特定的DNA 序列,从而实现对基因组的编辑。
这项技术具有操作简便、高效率和精确性高等优点,被广泛应用于基因功能研究、疾病治疗和农业改良等领域。
二、单细胞测序技术传统的基因测序技术通常需要大量的细胞样本,而单细胞测序技术则可以对单个细胞进行基因组测序和分析。
这项技术的出现,使得我们可以更加深入地了解细胞的异质性和个体间的差异。
单细胞测序技术在癌症研究、胚胎发育和免疫学等领域发挥了重要作用,为我们揭示了细胞的多样性和功能的多样性。
三、群体基因组学群体基因组学是研究群体中基因组的变异和演化的一门学科。
随着高通量测序技术的发展,我们可以对大规模的个体进行基因组测序,并通过比较分析来揭示基因组的变异和演化规律。
群体基因组学的研究成果不仅可以帮助我们了解人类的起源和演化,还可以为疾病的研究和预防提供重要的参考。
四、表观遗传学表观遗传学是研究基因组中非编码DNA序列的功能和调控机制的学科。
它研究的是基因组中的化学修饰和染色质结构的变化对基因表达的调控作用。
表观遗传学的研究成果对于理解基因调控网络、疾病的发生机制以及环境因素对基因表达的影响具有重要意义。
近年来,随着高通量测序技术的发展,表观遗传学研究取得了许多重要的突破,为我们揭示了基因组的复杂性和多样性。
五、人工智能在遗传学中的应用人工智能是一种模拟人类智能的技术,它在遗传学领域的应用也越来越广泛。
诱变育种方案

诱变育种方案植物育种一直是人类追求农作物高产、抗病虫害和适应环境的重要手段之一。
在过去的几十年里,随着科技的进步,诱变育种逐渐成为一种较为成熟的育种方法。
通过诱变,可以创造具有新的性状和特点的植物品种,为农业生产做出更大的贡献。
本文将探讨诱变育种的方案及其应用前景。
诱变育种是指通过人为手段诱导植物基因发生突变,进而创造新的植物品种。
传统的诱变方法主要包括辐射诱变和化学诱变。
辐射诱变是将植物种子或组织暴露在不同剂量的辐射源下,通过辐射的电离作用使基因发生改变。
而化学诱变是利用化学物质诱导植物基因突变,常用的化学诱变剂包括EMS(亚硝酸乙酯)和NTG(亚硝基甲基尿苷酸)。
这些方法可以有效地增加植物基因的突变率,为育种提供了更多的遗传变异资源。
随着现代分子生物学和基因组学的发展,人们对诱变育种的认识也不断深入。
利用基因工程技术,可以实现对特定基因的有针对性改造,通过靶向诱变和基因编辑等手段,可以实现对单个基因位点的精确改变。
这为育种工作者提供了更多的选择,并且在一定程度上减少了不必要的随机突变。
另外,基因组学的研究也为诱变育种提供了更多的理论基础。
深入了解植物基因组的结构和功能,可以更好地指导育种的方向和目标。
诱变育种在实践中取得了骄人的成绩。
以辐射诱变为例,培育了大量优良的新品种,不仅提高了农作物的产量和质量,还创造了许多具有耐旱、耐寒、耐盐碱等抗逆性能的新品种。
通过化学诱变和基因编辑等方法,可以精确改变植物的花色、叶片形态、果实大小等性状,创造出更加美观和实用的新品种。
此外,基因组学的快速发展也为诱变育种开辟了新的途径。
通过利用基因组学工具,我们可以揭示出植物基因的功能和网络关系,为育种解决了许多难题,提升了育种效率。
然而,诱变育种也面临着一些挑战和局限。
首先,诱变育种是基于随机突变的,经常会产生许多无效变异或甚至有害变异,这对育种进程带来了一定的不确定性。
因此,在引入诱变育种方案时,必须进行大规模的筛选和评估,以确保选育出的品种具有良好的表现和稳定的遗传背景。
分子生物学新技术TILLING技术的原理与方法述评

分子生物学新技术TILLING技术的原理与方法述评分子生物学新技术TILLING (Targeting Induced Local Lesions IN Genomes)技术是一种高效的基因突变筛选方法。
它可以快速、准确地发现目标基因中的突变,有助于研究基因功能和分子遗传学。
在本文中,我将描述TILLING技术的原理和方法,并对其特点和应用进行评述。
TILLING技术的原理基于PCR扩增和DNA测序的结合。
首先,通过化学或物理方法,诱发植物或动物基因组中的随机突变。
这些突变可以是点突变、插入突变或删除突变。
然后,通过PCR扩增目标基因的一部分,并使用特定的引物对扩增产物进行测序。
通过比较突变体与野生型测序结果之间的差异,可以鉴定目标基因中的突变位点。
TILLING技术的方法包括四个主要步骤:DNA提取、PCR扩增、核酸修饰和DNA测序。
首先,从植物或动物组织中提取总DNA。
然后,使用特定的引物对目标基因进行PCR扩增。
为了增加PCR扩增的特异性,可以使用特殊的引物设计策略,例如引入一对mismatch引物或使用nested PCR。
接下来,通过核酸修饰方法,例如化学修饰或酶修饰,对PCR扩增产物进行处理。
这种修饰将使野生型和突变型的DNA序列在测序中产生特异性信号。
最后,使用DNA测序技术对修饰后的PCR产物进行测序,并将测序结果与野生型序列比对,以鉴定突变位点。
然而,TILLING技术也存在一些局限性。
首先,TILLING技术只能检测已知位点的突变,无法发现新的突变位点。
其次,由于突变位点通常很少,TILLING技术需要大量的样本和测序深度才能发现突变。
此外,TILLING技术对于复杂的多基因突变或基因组重组事件的筛选有一定的限制。
分子生物学新技术TILLING 技术的原理与方法述评

TILLING 技术的原理与方法述评摘要TILLING,即Targeting Induced Local Lesions IN Genomes(定向诱导基因组局部突变技术),是由美国Fred Hutchinson 癌症研究中心Steven Henikoff 领导的研究小组发展起来的,是一种全新的反向遗传学研究方法。
TILLING 技术借助高通量的检测手段,快速有效地从由化学诱变剂(EMS)诱变过的突变群体中鉴定出点突变。
目前,TILLING 已被应用于多种生物的研究中。
本文系统介绍了TILLING 技术的基本原理、技术路线及其技术优势,同时列举了TILLING 的应用实例,并展望了TILLING 技术的应用前景。
关键词TILLING, 点突变, 检测Introduction to the TILLING StrategyWu Haibin1,2 Zhu Rucai2 Zhao Degang1*1Guizhou Key Laboratory of Agricultural Bioengineering, Guizhou University, Guiyang, 5500252 Hainan Provincial Key Laboratory of Crop Molecular Breeding, Sanya, 572025*Corresponding author, degangzhao@ABSTRACTTILLING,Targeting Induced Local Lesions IN Genomes,was developed by Dr. Steven Henikoff 's ResearchGroup of Fred Hutchinson Cancer Research Center in Seattle, Washington, USA. TILLING is a novel reverse geneticsstrategy that provides a completely solutions for high throughput and low cost discovery of induced pointmutations in populations of chemically mutagenized individuals. Recently TILLING has been applied to lot of organismssuch as arabidopsis, tomato, maize, rice, soybean, lotus, nemetode, mouse, zebrafish, drosophila etc.This paper briefly introduced the TILLING methodologies and its advantages, and also listed the ArabidopsisTILLING Project as an application case.KEYWORDSTILLING, Point mutations, DetectionTILLING,即Targeting Induced Local LesionsIN Genomes(定向诱导基因组局部突变技术),是由美国Fred Hutchinson 癌症研究中心Steven Henikoff领导的研究小组发展起来的,是一种全新的反向遗传学研究方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2001 发现了一种更经济
快速的 T IL L IN G 方法 , 它采用双色红外荧光检测 CEL I 酶切产物。CEL I 是一种对错配碱基( 异源双 链位点) 特异性切割的芹菜核酸酶。目前, 该技术 平台在国内外应用最为广泛。这一技术平台能够有 效排除假阳性条带, 因为杂质和干扰分子在红外光 区几乎不发光 , 用红外荧光检测不仅背景非常低 , 灵敏度也很高, 能够有效排除假阳性条带, 同时也 使得 T ILL ING 技术的高通量得以体现 : 筛选每块 96 孔微量滴定板相当于筛选了 768 个 M 2 单株 ( 8
图 1 植物中 T IL L IN G 的技术路线 [ 4]
3
TILLING 技术平台的发展
最初 T IL LING 技术是结合 EMS 诱导 突变以
96) , 每个目标筛选区段大约为 1000 bp, 那么每块 胶大约可以检测 750 kb 的基因组序列[ 7] 。 随着各种筛选技术的不断革 新, T IL LING 技 术平台日趋多元化 , 各种技术平台的区别主要体现 在异源杂合双链的检测手段方面。虽然, 目前以基 于酶切和双色红外检测系统的技术最为成熟和应用 最为广泛, 但是由于 CEL I 酶的分离步骤繁多和耗 时长, 而商品化的 CEL I 酶价格昂贵, 使得大规模 应用的成本难以承受。于是 , 近年来越来越多的筛 选技术逐渐引入 T IL L ING 技术平台中, 如焦磷酸 测序技术 ( pyr osequencing ) [ 8] 、基质辅助激光解吸 电离飞行时间质谱 ( M atr ix- Assist ed Laser Desorp t ion/ Ionizat io n T ime of Flig ht M ass Spect ro me t ry, 简称 M AL DI - T OF - MS ) 技术[ 9] 、构象 敏感毛 细凝胶电 泳技术 ( Conf orm ation - sensitive capillary elect rophoresis, 简称 CSCE) 以及高分辨率溶解曲 线 ( hig h resolut ion melt ing, 简 称 H RM ) 技
基金项目 : 中国科学院知识创新工程重要方向 项目 ( K JCX 2 -Y W -N 34 -3, K JCX2 -EW -N 05) ; 中国科 学院近代物理 研究所所长基 金 资助项目 ( Y 006090ZY 0) 作者简介 : 杜艳 ( 1983- ) , 女 ( 汉族 ) , 四川南充人 , 博士 , 研究实习员 , 从事植物诱变育种研究 ; E -mail: duyan@ impcas. ac. cn
T IL L IN C) 是一种全新的、高通量和低成本反向遗传学研究方法 。近年来, 随着突变筛选技术的革 新, T IL L ING 技术平台日趋多元化, 使得 T IL L ING 技术的操作更为简单、 快速 , 并广泛应用于作 物育种研究领域。简要介绍了 T IL L ING 技术平台的最新发展动态 , 并初步探讨了将辐射诱变处理 与 T IL L IN G 高通量筛选相结合在诱变育种中的应用前景 。 关 键 词: 定向诱导基因组局部突变技术; 高分辨率溶解曲线 ; 辐射; 诱变育种 中图分类号: Q691. 5; Q691. 8; Q506 文献标识码: A 是由美 国 F red H ut chinson 癌症 研究 中心 St even H eniko f 领导的研究小组发展起来的 , 一种全新的、 高通 量 和 低 成本 的 反 向 遗 传学 研 究 方 法
杜 艳1, 2 , 余丽霞1, 2 , 刘青芳1, 2 , 周利斌1, # , 李文建1,
( 1 中国科学院近代物理研究 所 , 甘肃 兰州 2 中国科学院研究生院 , 北京 730000; 100049)
#
摘
要: 定 向诱 导 基因 组局 部突 变 技术 ( T arget ing Induced Lo cal L esions IN Genomes, 简 称
[ 13]
尽管 T IL LING 技术是一 种高通 量的筛 选手 段 , 但是传统的 T IL L ING 技术在构建初始的筛选 群体以及 DNA 样品的获得时依然需要投入大量的 时间 和 金 钱 , 所 以 目 前 只 有 关 于 Columbia 和 L andsberg erect a 这两个遗传背景的野生型拟南芥 的 T IL L ING 资源[ 16] 。在 H RM 技术 平台的 基础 上 , Bush 和 Kry san 于 2010 年对传统 T ILL ING 技
#
通讯联系人 : 李文建 , E - m ail : w jli@ im pcas. ac. cn; 周利斌 , E -mail: libinz hou@ impcas. ac. cn
344
原子核物理评论
第 28 卷
( 4) 将若干个 96 孔板 DNA 合并到一个 96 孔板( 最 多可合并 8 个) , 形成 DN A 池; ( 5) 根据感兴趣的 基因序列信息, 设计带有红外荧光标记的特异引物 进行多聚酶链式反应 ( Po lymerase Chain React ion, 简称 P CR) 扩增 ; ( 6) PCR 产物经多次变性、复性, 在含有突变位点处形成异源杂合双链 ; ( 7) 酶切, 用特异性核酸内切酶酶切异源双链 ( 一般使用 CEL I 酶, 该酶能有效识别并切开杂合双链中的不配对
位点) ; ( 8) 酶切产物电泳分析 ( 通过变性聚丙烯酰 胺凝胶电泳分离 , 然后用双色红外荧光系统分析电 泳结果 , 获得突变池) ; ( 9) 利用相同方法从突变池 中筛选突变个体; ( 10) 突变个体 PCR 片段测序 ( 通 过全片段 测序 , 确 认核酸 多态 的类型、位置 和数 量) ; ( 11) 调出位点变异对应 的突变单株的种子, 种植 M 3 代, 从表 型上验证变异, 最终揭示该基因 的生物学功能。
及变性高效液相色谱 ( denaturing hig h - perf orm ance liquid chromat ogr aphy, 简称 dH PL C) 来检测野生 型和突变型混合模板的 PCR 扩增产物中异源双链 的错配处
[ 6]
。但该技术的运行时间限制了此方法的
[ 4]
高通量运用。 Co lbert 等
第 28 卷 第 3 期 2011 年 9 月 - 4627( 2011) 03 - 0343 - 06 文章编号: 1007
原子核物理评论
N uclear P hysics Review
V ol 28, N o. 3 Sep. , 2011
TILLING 技术的最新进展及其在辐射 * 诱变育种中的应用前景
* * 收稿日期 : 2011 -01 - 06; 修改日期 : 2011 中应用以来 , 已经成功地 应用于多种生物中。随着研究的深入 , T ILL ING 技 术平台也在多样化。本文总结了近年来 T ILL ING 技术平台 的发展以 及最新 动态 , 为 拟开展 T IL L ING 研究的人员提供综合选择信息。
[ 3]
1
引言
随着多种模式生物基因组 DNA 测序的完成,
基因组学进入了以研究基因功能为目标的后基因组 时代 , 而今功能基因组学已经成为植物科学研究的 主流。反向遗传学是功能基因组学的重要组成部分 之一 , 它利用已有的序列信息, 通过加工、修饰和 改造靶基因达到研究基因功能的目的。目前, 植物 中常用的 反 向遗 传 学方 法 包括 反 义 RNA 技 术、 RNAi 和 DNA 插入突变( 如转座子和 T- DNA) 。但 是, 反义 RNA 抑制技术需要花费相当大的精力来 预先确定目标基因是否将会表达; 而 RNAi 的作用 机理并不十分清楚, 如后代表型的多样性和不可预 知性 ; 插入突变主要是通过转座子和 T- DNA 插入 在基因组中使某些基因发生突变 , 但是一些关键基 因的突变对生物是致命的 , 而且插入突变技术很难 致使每个基因都发生插入突变。同时, 因为这些技 术均需耗时的转基因和组织培养 , 从而使这些技术 在反向遗传学的应用中受到极大限制[ 1- 2] 。 定向诱导基因组局部突变技术 ( T arg et ing In duced L ocal L esions IN Genomes, 简称 T IL L ING)
台 , 成功筛选到经 N - 乙基 -N - 亚硝基脲( N - Et hyl NNit rosourea, ENU) 诱变青 鳉后 P 53 基 因发生突变 的个体。 3. 2 HRM 技术平台的改进 iTILLING 技术
在对燕麦的
T IL L ING 筛选中引入 M AL DI - T OF - MS 技 术, 并 成功鉴定出苯丙氨酸解氨酶基因的 6 个点突变以及 - 葡聚糖合成酶基因的 10 个点突变。 常用的几种筛选突变的方法 都需要经过 PCR 这一过程。 H RM 技术在 PCR 扩增后即可直接用来 分析样品, 不需要样品的分离纯化 , 因而可以降低 分离纯化过程中所带来的样品污染的可能性 , 同时 也能大大减少工作 量。而在众 多的新型检测 手段 中, 以 H RM 技术发展潜力最大 , 在近两年的研究 报道中越来越受到研究者的推崇。 3. 1 HRM 原理及特点 H RM 技术是 2002 年由美国犹他大学 和爱德 华科技公司合作开发而成 , 是应用于突变扫描和基 因分型的最新遗传学分析方法。其基本原理是 : 利 用饱和荧光染料 L C Green 标记 DNA 双链, 由于 突变位点碱基的不匹配会导致双链 DNA 在升温过 程中会先解开, 荧光染料会从局部解链的 DN A 分 子上释放 , 因而从荧光强度与 DNA 溶解曲线就可 以判断突变位点是否存在。 H RM 技术不受突变碱基位点与类型的局限 , 无需序列特异性探针 , 在 PCR 结束后直接 运行高 分辨熔解 , 即可完成对样品基因型的分析。该技术 的优点主要有: ( 1) 快速、高通量 ; ( 2) 准确性好、 灵敏度高、特异性好; ( 3) 重复性接近 100% ; ( 4) 费用低; ( 5) 染料探针在 PCR 前加入, 不需要后续 的分离纯化, 而且染料的加入不影响后续的测序工 作, 实现了真正的闭管操作 ; ( 6) 只需将 P CR 产物 ( 96/ 384 孔板 ) 放入仪器内检测即可
