《氧化还原反应》教学课件1
合集下载
人教版化学《氧化还原反应》ppt完美课件【新教材】1(1)

___燃_料__的_燃__烧______等。
易燃物的自燃
食物的腐败
(2)对人类生活和生产不利:_____________、___________、
钢铁的锈蚀
_______________等。
下列关于氧化还原反应的叙述,正确的是( B ) A.失去电子的反应是还原反应 B.失去电子的物质是还原剂 C.发生氧化反应的物质是氧化剂 D.作氧化剂B的物质不能是还原剂
二、氧化剂和还原剂
1.常见的氧化剂、还原剂
物质种类
常见物质
氧 (1)活泼非金属单质
O2 、 Cl2 等
化 (2)含有高价态元素的 浓H2SO4 、___H_N_O_3____、
剂 化合物
___F_e_C_l3_____、__K_M__n_O_4 ____等
(3)活泼金属单质
__A_l___、_Z_n___、__F_e___等
3、以下表示的是碳及其化合物的转化关系,其中涉及的基本 反应类型依次是( D )
C―C高― u温 O→CO2―H―2O→H2CO3C― a― O→ H2CaCO3―高―温→CO2 A.化合、置换、分解、复分解 B.置换、复分解、化合、分解 C.置换、化合、分解、复分解 D.置换、化合、复分解、分解
9、氧化还原反应中电子转移的表示方法
2.从硫元素的化合价态上判断,下列物质中的硫元素不能
表现氧化性的是( B )
A.S C.SO2
B.Na2S D.H2SO4
3.判断正误(正确的打“√”,错误的打“×”) (1)金属单质作反应物时一定是还原剂。( ) (2)在反应C+O2=点==燃==CO2中,CO2作氧化剂。( ) (3)在氢气燃烧生成水的反应中,氢气作还原剂。( ) (4)在反应SO2+Br2+2H2O===H2SO4+2HBr中,水作氧化 剂。( ) (5)氧化剂在反应中得电子,化合价升高。( )
人教版高中化学必修一 《氧化还原反应》教学课件

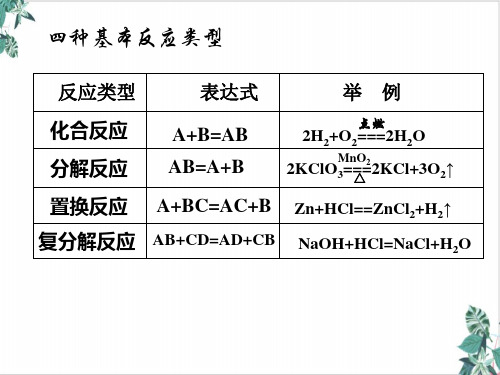
举例
化合 反应
点燃 Na2O H2O 2NaOH,C O2 CO2
分解反 应
高温 CaCO3 CaO CO2 , H2 ?SS H2
置换 反应
高温 C CuOCu CO
复分解 反应
AgNO3+NaCl=AgCl↓+NaNO3
表示式
A+B=AB
AB=A+B
A+BC= AC+B AB+CD= AD+CB
断其升降,进而确定得失电子的元素。 ②连单线:连接等式左边的氧化剂与还原剂,箭头指向氧化剂。
③标出转移的电子总数。
2e
2 MnO2 4HCl(浓)MnCl2 Cl2 2H2O
特别提示:①单线桥表示氧化剂和还原剂中变价元素原子得失电 子的情况;
②不需标明“得”或“失”,只标明电子转移数目; ③箭头标明电子转移的方向; ④单线桥箭头从还原剂中失电子的元素原子指向氧化剂中得
第三节氧化还原反应
1
学习目标
1.使学生能从化合价升降观点,认识氧化还原反应,理解氧化 还原反应的本质。
2.理解氧化还原反应与四种基本类型的关系。 3.掌握氧化反应、还原反应、氧化还原反应、氧化剂、还原剂等
基本概念。 4.了解常见的氧化剂与还原剂。
一、氧化还原反应 1.概念 (1)得到氧原子的反应称为氧化反应,失去氧原子的反应叫做
(1)2NaBr+Cl2=2NaCl+Br2 (2)NaOH+HCl=NaCl+H2O
3 MnO2 4HCl(浓)MnCl2 2H2O Cl2
(4)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
人教版化学必修一《氧化还原反应》教学课件

人教版化学必修一《氧化还原反应》P P T 课件
第二章 化学物质及其变化
第三节 氧化还原反应
人教版化学必修一《氧化还原反应》P P T 课件
第1讲 氧化还原反应 概念
本节课要学习的内容
1、了解氧化还原反应的特征 2、熟练判断一个反应是否氧化还原反应 3、从电子得失角度分析氧化还原反应的本质 4、氧化还原反应与四种基本反应类型的关系
(1)H2是氧化产物
C
(2)H2是还原产物
(3)H2O是氧化剂
(4)CaH2中氢元素,既被氧化又被还原;
(5)氧化产物和还原产物质量比为1:1
A、①②④
B、③④⑤
C、①②③⑤
D、④
人教版化学必修一《氧化还原反应》P P T 课件
23
人教版化学必修一《氧化还原反应》P P T 课件
知识积累
• 1.常见的氧化剂
得电子 化合价降低 发生还原反应 具有氧化性
氧化剂 + 还原剂
还原产物 + 氧化产物 (新还原剂) (新氧化剂)
失电子 化合价升高 发生氧化反应 具有还 原性
人教版化学必修一《氧化还原反应》P P T 课件
人教版化学必修一《氧化还原反应》P P T 课件
相互联系:
化
氧 化 性
具有
氧 化
表现
剂
合 价 降 低
氧 化 剂: 所含元素化合价降低的反应物 还 原 剂: 所含元素化合价升高的物质
氧化产物: 还原剂失去电子被氧化后的产物 还原产物: 氧化剂得到电子被还原后的产物
人教版化学必修一《氧化还原反应》P P T 课件
人教版化学必修一《氧化还原反应》P P T 课件
2、相关概念:
失、升、氧、还; 得、降、还、氧;
第二章 化学物质及其变化
第三节 氧化还原反应
人教版化学必修一《氧化还原反应》P P T 课件
第1讲 氧化还原反应 概念
本节课要学习的内容
1、了解氧化还原反应的特征 2、熟练判断一个反应是否氧化还原反应 3、从电子得失角度分析氧化还原反应的本质 4、氧化还原反应与四种基本反应类型的关系
(1)H2是氧化产物
C
(2)H2是还原产物
(3)H2O是氧化剂
(4)CaH2中氢元素,既被氧化又被还原;
(5)氧化产物和还原产物质量比为1:1
A、①②④
B、③④⑤
C、①②③⑤
D、④
人教版化学必修一《氧化还原反应》P P T 课件
23
人教版化学必修一《氧化还原反应》P P T 课件
知识积累
• 1.常见的氧化剂
得电子 化合价降低 发生还原反应 具有氧化性
氧化剂 + 还原剂
还原产物 + 氧化产物 (新还原剂) (新氧化剂)
失电子 化合价升高 发生氧化反应 具有还 原性
人教版化学必修一《氧化还原反应》P P T 课件
人教版化学必修一《氧化还原反应》P P T 课件
相互联系:
化
氧 化 性
具有
氧 化
表现
剂
合 价 降 低
氧 化 剂: 所含元素化合价降低的反应物 还 原 剂: 所含元素化合价升高的物质
氧化产物: 还原剂失去电子被氧化后的产物 还原产物: 氧化剂得到电子被还原后的产物
人教版化学必修一《氧化还原反应》P P T 课件
人教版化学必修一《氧化还原反应》P P T 课件
2、相关概念:
失、升、氧、还; 得、降、还、氧;
公开课氧化还原反应第一课时课件

0
0
+1-1
H2 + Cl2 === 2 H Cl
电子对偏向,化合价降低,被还原
化合价升降的原因:电子的偏移
[结论] 氧化还原反应的实质是: 发生了电子的转移(得失或偏移)
元素化合价和电子得失的关系
化合价升高,被氧化
0
0
+1 -1
2Na + Cl2 = 2NaCl
离子化合物: 元素化合价数
= 该元素一个原子得失电子数
得到2e -,化合价降低,被还原 失去1e -,化合价升高,被氧化
0
-1
+1
Cl2 + H2O = HCl + HClO
双箭号跨过等号, 从反应物指向生成物, 起止为同一元素。
注明失去或得到 电子的总数,叙述要 完整。
得到1e -,化合价降低,被还原
课堂练习
用双线桥表示同种元素的电子得失。
失去 2e-,化合价升高,被氧化
+4
-1 +2
0
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
得 到2e-,化合价降低,被还原
. 氯 元素化合价升高,被 氧化 (填“氧化”或 “还原”),氧发化生 (填“氧化”或“还原”锰)
反应; .
元素还化原合价降低,被 (填
“氧化”或“还还原原”),发生
(填“氧化”
或“还原”)反应。
化合价降低的反应 得到电子的反应 (或电子对偏向)
化合价升高降 得失电子同时发生
低同时发生
(得失电子总数相等)
有化合价升降的 反应
有电子转移的反应
特征(表现)
本质
四、表示氧化还原反应的方法
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
第三节氧化还原反应1-完整版PPT课件

△
(5)Fe+2HCl = FeCl2+H2↑…………………(置)换(反)应
(6)n+CuSO4 = nSO4+Cu ……………( )(置)换反应
(7)HCl+OH = Cl+H2O…………………( )复(分)解反应
(8)BaCl2+Na2SO4 = BaSO4↓+2NaCl……(复分)解(反)应
氧化还原反应
对于反应2CuO+C 2高C温u+CO2↑; Fe2O3+3CO 2Fe高+温3CO2
化合价升高 的物质
C
氧化反应或还原反应
氧化反应
化合价降低 的物质
CuO
氧化反应或还原反应
还原反应
CO
氧化反应
Fe2O3
还原反应
结论:有化合价变化的反应叫氧化还原反应。
3从电子转移的角度
对于反应 2Na+Cl2 点燃 2NaCl
氧 化 还 原 反 应1
1从得失氧的角度
对于反应2CuO+C 2高C温u+CO2↑; Fe2O3+3CO 2Fe高+温3CO2
得氧物质
C CO
氧化反应或还原反应
氧化反应 氧化反应
失氧物质
CuO Fe2O3
氧化反应或还原反应
还原反应 还原反应
结论:有得失氧的反应叫氧化还原反应。
2从化合价变化的角度
H2+Cl2 点燃 2HCl
结论:有电子转移(得失或共用电子对偏移)的 反应叫氧化还原反应。
四种基本反应Biblioteka 型 是否属于氧化还原反应(1)2NO+O2 = 2NO2 ………………………( )化合反应
(2)CO2+CaO = CaCO3 ……………………(化)合反应 (3)NH4HCO3 N△H3↑+CO2↑+H2O…… ( ) 分解反应 (4)2ClO3 2CMln+O23O2 …………… ( )( ) 分解反应
(5)Fe+2HCl = FeCl2+H2↑…………………(置)换(反)应
(6)n+CuSO4 = nSO4+Cu ……………( )(置)换反应
(7)HCl+OH = Cl+H2O…………………( )复(分)解反应
(8)BaCl2+Na2SO4 = BaSO4↓+2NaCl……(复分)解(反)应
氧化还原反应
对于反应2CuO+C 2高C温u+CO2↑; Fe2O3+3CO 2Fe高+温3CO2
化合价升高 的物质
C
氧化反应或还原反应
氧化反应
化合价降低 的物质
CuO
氧化反应或还原反应
还原反应
CO
氧化反应
Fe2O3
还原反应
结论:有化合价变化的反应叫氧化还原反应。
3从电子转移的角度
对于反应 2Na+Cl2 点燃 2NaCl
氧 化 还 原 反 应1
1从得失氧的角度
对于反应2CuO+C 2高C温u+CO2↑; Fe2O3+3CO 2Fe高+温3CO2
得氧物质
C CO
氧化反应或还原反应
氧化反应 氧化反应
失氧物质
CuO Fe2O3
氧化反应或还原反应
还原反应 还原反应
结论:有得失氧的反应叫氧化还原反应。
2从化合价变化的角度
H2+Cl2 点燃 2HCl
结论:有电子转移(得失或共用电子对偏移)的 反应叫氧化还原反应。
四种基本反应Biblioteka 型 是否属于氧化还原反应(1)2NO+O2 = 2NO2 ………………………( )化合反应
(2)CO2+CaO = CaCO3 ……………………(化)合反应 (3)NH4HCO3 N△H3↑+CO2↑+H2O…… ( ) 分解反应 (4)2ClO3 2CMln+O23O2 …………… ( )( ) 分解反应
《氧化还原反应》PPT课件(完美版)

应属于氧化还原反应,但不属于四种基本反应类型中的
任何一种。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
(2)有单质参加或生成的反应一定是氧化还原反应吗?
提示:不一定。反应3O2
2O3中有单质参加或生
成,但元素的化合价没有变化,不属于氧化还原反应。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
2.文字表述
(1)置换反应_一__定__是氧化还原反应。(填“一定”“不 一定”或“一定不”,下同) (2)复分解反应__一__定__不___是氧化还原反应。 (3)化合反应和分解反应_不__一__定__是氧化还原反应。 ①有单质参加的化合反应_一__定__是氧化还原反应。
(4)Na2O+H2O====2NaOH属于氧化还原反应。( ) 提示:×。此反应中各元素的化合价均没有发生变化,因 此为非氧化还原反应。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
【情境·思考】 《中国诗词大会》是央视首档全民参与的诗词节目,节 目以“赏中华诗词、寻文化基因、品生活之美”为基 本宗旨,力求通过对诗词知识的比拼及赏析,带动全民 重温那些曾经学过的古诗词,分享诗词之美,感受诗词 之趣,从古人的智慧和情怀中汲取营养,涵养心灵。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
(3)当反应中有一种元素被氧化时,一定有另一种元素 被还原。 ( ) 提示:×。可能是同种元素化合价的升降,如 2H2O2====2H2O+O2↑。
《 氧 化 还 原 反应》 PPT课件
课件《氧化还原反应》优质PPT课件_人教版1

和复分解反应与氧化还原反应的交叉分类
HCl + HClO
是
依据反应物和生成物的类别及反应前后物质种类的多少来分
(10) 2H S + SO 特征:反应前后有元素化合价的升降。
2 2 不涉及氧化还原反应的是( )
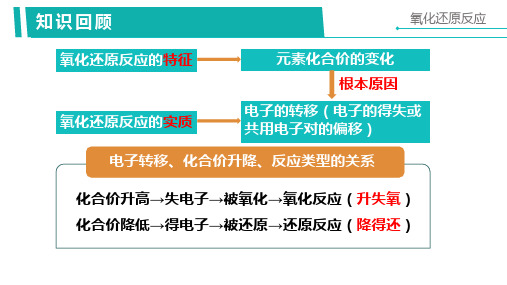
氧化还原反应与元素化合价的升降的关系:
3S + 2H2O 是
不涉及氧化还原反应的是( )
CaCO3+2HCl==CaCl2+H2O+CO2↑
化合价降低、还原反应(被还原)
C+u2 O + H02
高温
Cu0+
+1
H2O
化合价升高,氧化反应(被氧化)
从化合价升降的角度
有元素化合价升降的化学反应称为 氧化还原反应。
化合价升高、氧化反应(被氧化)
0
+2
Fe + CuSO4
+2
0
FeSO4 + Cu
化合价降低,还原反应(被还原)
注意:并非只有得氧、失氧的反应才是氧
H2+CuO == Cu+H2O
(8) Na CO + 2HCl 2CuO + C
2Cu + CO2
2 3 氧化反应一定先与还原反应发生
电子的得失
2NaCl +H2O +CO2 ↑
爆竹声中一岁除,春风送暖入屠苏
(9) Cl + H O 氧化还原反应的实质是什么呢?
2 2 本质定义:有电子转移(得失或偏移)的化学反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
1、下列叙述正确的是( )
特征:反应前后有元素化合价的升降。
HCl + HClO
是
依据反应物和生成物的类别及反应前后物质种类的多少来分
(10) 2H S + SO 特征:反应前后有元素化合价的升降。
2 2 不涉及氧化还原反应的是( )
氧化还原反应与元素化合价的升降的关系:
3S + 2H2O 是
不涉及氧化还原反应的是( )
CaCO3+2HCl==CaCl2+H2O+CO2↑
化合价降低、还原反应(被还原)
C+u2 O + H02
高温
Cu0+
+1
H2O
化合价升高,氧化反应(被氧化)
从化合价升降的角度
有元素化合价升降的化学反应称为 氧化还原反应。
化合价升高、氧化反应(被氧化)
0
+2
Fe + CuSO4
+2
0
FeSO4 + Cu
化合价降低,还原反应(被还原)
注意:并非只有得氧、失氧的反应才是氧
H2+CuO == Cu+H2O
(8) Na CO + 2HCl 2CuO + C
2Cu + CO2
2 3 氧化反应一定先与还原反应发生
电子的得失
2NaCl +H2O +CO2 ↑
爆竹声中一岁除,春风送暖入屠苏
(9) Cl + H O 氧化还原反应的实质是什么呢?
2 2 本质定义:有电子转移(得失或偏移)的化学反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
1、下列叙述正确的是( )
特征:反应前后有元素化合价的升降。
氧化还原反应(教学课件)鲁科版高中化学必修一
0 Cl2
一、氧化剂与还原剂及相关概念
氧化剂 还原剂
酸性KMnO4溶液和KI溶液的反应:
+7
-1
+2
0
2MnO4-+10I-+16H+= 2Mn2++ 5I2+ 8H2O
1. 处于高价态的是 锰 元素,处于低价态的
是 碘 元素。
2. 氧化剂是
,还原剂是
。
3. 强氧化剂一定能与强还原剂发生氧化还原反应吗?
下反应制得:2KClO3+H2C2O4+H2SO4= 2ClO2↑+2CO2↑+K2SO4+2H2O.下
列有关该反应的说法正确的是( B )
A.KClO3在反应中失去电子
B.ClO2是还原产物
C.H2C2O4在反应中被还原
D.1 mol H2C2O4参加反应有4 mol电子转移
三、氧化还原反应的配平和计算
高中同步课堂学案
C
三、氧化还原反应的配平和计算
氧化剂 还原剂
题型三 判断简单反应的产物价态或可能产物物质: 根据得失电子守恒法判断简单反应的产物价态或可能产物物质
例题3.R2O8n-在一定条件下可以把Mn2+氧化为MnO4-,若反应后R2O8n-变成 RO42-,又知反应中氧化剂与还原剂的物质的量之比为5∶2,则R2O8n-中R元素
Zn2+ H2O CO2 Fe3+ S
I2
二、常见的氧化剂与还原剂
氧化剂 还原剂
(3)元素化合价处于中间价态的物质既有氧化性,又有还原性。如:
Fe
S
H2OFe3+源自SO24-O2其中:Fe2+、SO23- 主要表现 还原 性,H2O2主要表现氧化 性。
课堂练习
氧化剂 还原剂
1.分析下列反应并按要求填空。
化学人教版高中必修1高一化学《氧化还原反应》课件-PPT

还原剂:反应中失电子的物质,表现还原性,具 有还原能力,起还原作用。
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
小组合作任务一: 氧化还原反应与四种基本反应类型的关系
氧化还原
分解
置换
化合
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
复分解
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
小结
还原剂+氧化剂=氧化产物+还原产物 氧化还原的本质是电子的转移 判断的依据是化合价的变化
还原剂:2 氧化剂:2
2. MnO2 + 4 HCl = MnCl2 + 2 H2O + Cl2
氧化剂:2 还原剂:2
1. Fe + CuSO4 = FeSO4 + Cu
还原剂:2 氧化剂:2
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
小组合作任务一: 氧化还原反应与离子反应的关系
离子反应
氧化还原反应
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
反应实例
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
一、氧化剂、还原剂、氧化产物、还原产物
失2e-电子,化合价升高,发生氧化反应
• 【总结】含有最高价态的元素的物质具有氧化 (填“氧化”或“还原”,下同)性;含有最低 价态的元素的物质具有__还_原___性;含有中间 价态的元素的物质既有__氧_化___性又有__还_原___ 性。
• 【巧记】高价氧化,低价还;中间价态两俱 全。
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
强弱律:
氧化性:氧化剂〉氧化产物 还原性:还原剂〉还原产物
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
学会比较,学会总结
化合价升高 化合价降低
( 特征)
失电子 被氧化(氧化反应) 还原剂
得电子 被还原(还原反应) 氧化剂
(本质) (变化)
(作用)
模型:升失氧作还,降得还作氧
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
守恒律:
氧化剂得到的电子总数= 化合价降低的总价数= 还原剂失去的电子总数= 化合价升高的总价数
电子守恒是解决氧化还原计算 的基本依据
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
练习: 找出下列反应中的氧化剂、还原剂、
氧化产物、还原产物,比较氧化性、还原
性的强弱。
1. 2Na
还原剂
+ Cl2
氧化剂
=
2NaCl
氧化产物
还原产物
2. MnO2 + 4 HCl = MnCl2 + 2 H2O + Cl2
氧化剂 还原剂 还原产物
氧化产物
1. Fe + CuSO4 = FeSO4 + Cu
三、氧化还原规律 还原剂+氧化剂=氧化产物+还原产物
还原性 氧化性
得电子,化合价降低
失电子,化合价升高
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
▪ 【思考】物质中所含元素的化合价高低与物 质的氧化性、还原性有什么关系?
还原剂 氧化剂 氧化产物 还原产物
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
练习: 找出下列反应中的氧化剂、还原剂, 计算氧化剂得到的电子数和还原剂失去的 电子数,找出两者存在的关系 1. 2Na + Cl2 = 2NaCl
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
第三节 氧化还原反应
第二课时
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
每课一题
下列反应那些是氧化还原反应?分析化合价变化 的情况,说明反应中电子得失,分析发生氧化反 应还是还原反应。
得2e-
双线桥法
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
2e-
Fe+H2SO4=FeSO4+H2 单线桥法
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
Fe+H2SO4=FeSO4+H2
得2e-电子,化合价降低,发生还原反应
还原剂 氧化剂
氧化产物 还原产物
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
失2e-
Fe+H2SO4=FeSO4+H2
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
二、氧化还原关系
失电子,化合价升高,发生氧化反应
还原剂+氧化剂=氧化产物+还原产物
得电子,化合价降低,发生还原反应
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
1. CuO+2HCl=CuCl2+H2O 2. MnO2 + 4 HCl = MnCl2 + 2 H2O + Cl2 • Fe + CuSO4 = FeSO4 + Cu • Ca(OH)2+CO2=CaCO3 + H2O
《氧化还原反应》教学课件1课件优秀 课件ppt课件 免费课 件优秀 课件课 件下载
