第七章_催化氧化(第二节)
第七章 生物氧化-2

3、呼吸链各组分在体外重组:
NADH可以使NADH脱氢酶(FMN)还原,但不能 直接还原b ,c1 ,c, aa3
NADH呼吸链:大多数代谢产物
FADH2呼吸链:琥珀酸、脂酰辅酶A
三、线粒体外NADH的氧化
线粒体外NADH不能穿过线粒体膜,要借助穿
梭作用才能参加呼吸链。
线粒体外的NADH将所带的H交给某种能穿过线
(2)氧化磷酸化偶联机理: 化学渗透假说
1961年英国生物化学家P.Mitchell首先提 出,1974年P.Mitchell与Moyle又作了修改。 电子传递的结果使H+从线粒体内膜基质 “泵”到膜外液体中,形成一个跨内膜的H+ 离子梯度,这梯度所含的势能促使ATP生成。
设想:
在完整的线粒体膜中, 呼吸
OH CH 3 CH 3 CH 3O CH 3O OH CH 3 CH 3
泛醌
O CH 3O CH 3O O
(CH 2CH=CCH 2)nH
(CH 2CH=CCH 2)nH
5、细胞色素类
只存在需氧生物中,以铁卟啉作为辅基,递电子体
铁离子的氧化与还原
Fe3+ + e Fe2+
b,c1,c,a,a3: 辅基结构不同,与蛋白质的连接方式 也不同。
在结构完整的线粒体中,氧化(底物脱氢或失电子) 与磷酸化(ADP与Pi合成ATP)这两个过程是紧密地 偶联在一起的,即氧化释放的能量用于ATP合成,这 个过程就是氧化磷酸化。
依靠呼吸链上的电子传递体系完成-----电子 传递体系磷酸化。
(1)氧化磷酸化偶联部位的确定
A、自由能变化值
第七章_催化氧化 (第二节)(共40张PPT)

催化剂活性较高、选择性较好 反应条件不太苛刻,反应比较平稳 设备简单,容积较小,生产能力较高 反应温度通常不太高,反应热利用率较低 在腐蚀性较强的体系时要采用特殊材质 催化剂多为贵金属,必须分离回收
一、催化自氧化
具有自由基链式反响特征,能自动加速 的氧化反响。使用催化剂加速链的引发 ,称为催化自氧化。 工业上生产有机酸、过氧化物
主反响:以乙烯和氧气〔或空气〕为原料,在由氯化钯、氯化铜、盐酸组成的催化剂水溶液中,进行液相氧化生产乙醛。
氯化钯是催化剂,氯化铜氧化剂,没有氯化铜的存在,是不能完成催化过程的。
具有自由基链式反响特征,能自动加速的氧化反响。
3其、结工构艺简条单件,影检响修及工很选方择业便 生产中对催化剂溶液的控制指标主要有:钯含量、铜含量、
副反响:
络合催化氧化
① 平行副反响:主要生成氯乙烷、氯乙醇 等 副产物;
② 连串副反响:主要生成氯代乙醛、醋酸、氯代醋酸、 丁烯醛、草酸及深度氧化产物等。
副产品虽然种类繁多,但它们的量甚少, 一般除一氯乙醛外,均无别离回收价值。通常将气体副产 物通入火炬燃烧,液体副产物作生化处理后排放。
络合催化氧化
优点
原料廉价,本钱低及乙醛收率高,副反响少等
目前被认为是生产乙醛最经济的方法,世界上约有70 %的乙醛是采用此法来进行生产的
缺点
氯化钯、氯化铜的盐酸溶液作催化剂,对设备的腐蚀极为 严重。贵金属钛等特殊材料。
2、反响原理
1〕根本反响过程:
主反响:以乙烯和氧气〔或空气〕为原料, 在由氯化钯、氯化铜、盐酸组成的催化剂水溶液中, 进行液相氧化生产乙醛。
④ 氧化度:氧化度——指在总铜中Cu2+所占比
例,即[Cu2+]/{[Cu2+]+[Cu+]}。氧化度过
第七章第二节课时1乙烯

溶解性 __难__溶于水
如何收集乙烯?
排水法
三、乙烯的分子结构 1.乙烯的分子结构
分子式 电子式 结构式 结构简式 球棍模型
120°
C2H4
: :
HH H :C ::C :H
H H
C=C
H H
CH2=CH2
120° 120°
空间填充 模型
2.乙烯的结构特点
(1)空间构型:平面型分子(6个原子共平面) 键角:120º
2.加成反应——烯烃的特征反应
【实验7-3】把乙烯通入溴的CCl4溶液或溴水溶液中 现象:乙烯使溴水或溴的CCl4溶液褪色
CH2=CH2 + Br2→CH2Br-CH2Br 1, 2 - 二溴乙烷 (无色液体,ρ>ρ水)
反应中量的关系: 1 mol碳碳双键消耗 1 mol Br2 n(碳碳双键)=消耗n(Br2)
点燃
C2H4 + 3O2 2CO2 + 2H2O
【思考】为什么伴有黑烟? 乙烯含碳量高,燃烧不充分
应用: 可用于鉴别CH4和C2H4
黑烟 乙烯
甲烷
(2)被酸性KMnO4溶液氧化 现象: 溶液紫红色褪去
-2
CH2=CH2
KMnO4(H+)
+4
CO2
应用: 可用于鉴别CH4和C2H4(烷烃和烯烃)
【思考】能用酸性KMnO4除去烷烃中混有的乙烯吗?
1.来源
经过分馏→裂化→裂解
石油
乙烯
乙烯的产量:衡量一个国家石油化工的发展水平
2.用途 (1)合成有机高分子材料、药物等。 (2)是植物生长的调节剂和果蔬的催熟剂。
重要的化工原料
塑料—聚乙烯PE 合成乙醇
第七章 有机化合物- 高中化学全册必背章节知识清单(人教版2019必修第二册)

第七章有机化合物第一节认识有机化合物一、有机化合物中碳原子的成键特点1、甲烷是最简单的有机化合物,甲烷的分子式为CH4,电子式为,结构式为。
2、有机物中碳原子的结构及成键特点(1)有机物中,碳原子可以形成4个共价键。
(2)碳原子间成键方式多样①碳碳之间的结合方式有单键()、双键()、三键(—C≡C—)。
②多个碳原子之间可以结合成碳链,也可以结合成碳环(且可带支链)。
(3)有机物分子可能只含有一个或几个碳原子,也可能含有成千上万个碳原子。
注意:有机物中碳原子成键特点和碳原子间的连接特点决定了有机物种类繁多。
二、烷烃1.烷烃的结构(1)甲烷的结构甲烷的空间结构是正四面体结构,碳原子位于正四面体的中心,4个氢原子位于4个顶点上。
分子中的4个C—H的长度和强度相同,相互之间的夹角相同,为109°28′。
(2)空间示意图是。
甲烷的球棍模型为,空间填充模型为。
2、烷烃——只含有碳和氢两种元素(1)示例:乙烷的结构式为,分子式为C2H6,丙烷的结构式为,分子式为C3H8。
(2)结构特点①分子中碳原子之间都以单键结合;②碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”,称为饱和烃,又称烷烃。
(3)分子组成通式:链状烷烃中的碳原子数为n,氢原子数就是2n+2,分子通式可表示为C n H2n+2。
(4)烷烃的一般命名①方法碳原子数(n)及表示n≤1012345678910甲乙丙丁戊己庚辛壬癸n>10相应汉字数字②示例:C4H10称丁烷,C8H18称辛烷,C12H26称十二烷。
3、同系物(1)概念:结构相似,在分子组成上相差一个或若干个CH2原子团的化合物。
(2)实例:CH4、C2H6、C3H8互为同系物。
4、同分异构体(1)概念①同分异构现象:化合物具有相同的分子式,但具有不同结构的现象。
同分异构现象是有机物种类繁多的重要原因之一。
②同分异构体:具有同分异构现象的化合物互称为同分异构体。
(2)写出C4H10的同分异构体:CH3CH2CH2CH3和,其名称分别为正丁烷和异丁烷。
酶工程-07-酶非水相催化2

(2)具有良好的化学稳定性,对设备没有腐蚀性。
(3)超临界温度不能太高或太低,最好在室温附近或 在酶催化的最适温度附近。 (4)超临界压力不能太高,可节约压缩动力费用。
(5)容易获得,价格要便宜。
4
第七章 酶非水相催化
第一节 酶非水相催化的主要内容和特 点
二 、
根据所用非水介质的不同,分为四种:
酶
非
水 相 催 化 的 主 要 内 容
中( 的四 酶) 催离 化子
液 介 质
概念:是指酶在离子液介质中进行 的催化作用。
5
第七章 酶非水相催化
第一节 酶非水相催化的主要内容和特 点
三
1、酶的热稳定性提高。
、
2、酶的催化活性有所降低。
酶
非
3、水解酶可以在非水介质中催化水解反应的逆反应。
水
相
4、非极性底物或者产物的溶解度增加。
酶催
催化 化反 反应 应都 的要 体在 系一 主定 要的 有反
非
水 有机介质反应体系
介 质 反
(研究最多,应用 最广泛)
应
体 超临界流体介质反
系 应体系
与水溶性有机溶剂组 成的均一体系
与水溶性有机溶剂组成 的两相或多相体系
(正)胶束体系
:
应 体
离子液介质反应体系
反胶束体系
7
第七章 酶非水相催化
第二节 有机介质中水和有机溶剂对酶催化反应的影响 (一)微水介质体系
KLD L
D
Km Kcat
立体选择系数 L-型异构体 D-型异构体 米氏常数 酶的转换数
酶在有机介质与在水溶液中催化比较,
影
由于介质的特性发生改变,使酶的对映体选
第七章2二氧化硫污染控制技术

煤的液化
通过化学加工转化为液态烃燃料或化工原料等液体产品 直接液化和间接液化
燃烧前脱硫
3.重油脱硫
在催化剂作用下通过高压加氢反应,切断碳与
硫的化学键,使氢与硫作用形成H2S从重油中
分离
直接脱硫和间接脱硫
燃烧中脱硫
流化床燃烧技术
气流速度介于临界速度和输送速度之间,煤粒保
持流化状态
再生并分离出来的NaOH或Na2SO3溶液循环脱硫,滤渣可抛 弃也可加工为石膏回收。
(2)钙-钙双碱法
塔内用来自循环池的亚硫酸钙(第一钙)浆 液脱硫并生成Ca(HSO3)2,脱硫浆液返回循环池, 池内加入Ca(OH)2(第二钙)浆液与Ca(HSO3)2反 应,再生出亚硫酸钙循环脱硫。 脱硫:CaSO3· 1/2H2O+SO2+1/2H2O→Ca(HSO3)2
ZnO脱硫技术特别适用于有氧化锌烟灰来源又 存在SO2污染源的铅、锌冶炼企业和立德粉 生产企业。日本、韩国、德国都有ZnO脱硫 的工业装置。
存在最佳脱硫温度范围
温度低时,孔隙量少、孔径小,反应被限制在颗粒外表面 温度过高,CaCO3的烧结作用变得严重
流化床燃烧脱硫的影响因素
流化床燃烧脱硫的影响因素
流化床燃烧脱硫的影响因素
3.脱硫剂的颗粒尺寸和孔隙结构
颗粒尺寸小于临界尺寸时发生扬析,并非越小越好 颗粒孔隙结构应有适当的孔径大小,既保证一定孔隙 容积,又保证孔道不易堵塞
870~930oC(二级再生法)
CaSO 4 4CO CaS 4CO 2 CaSO 4 4H 2 CaS 4H 2O
540~700oC CaS H 2O CO 2 CaCO 3 H 2S
催化氧化(烃类选择性氧化)
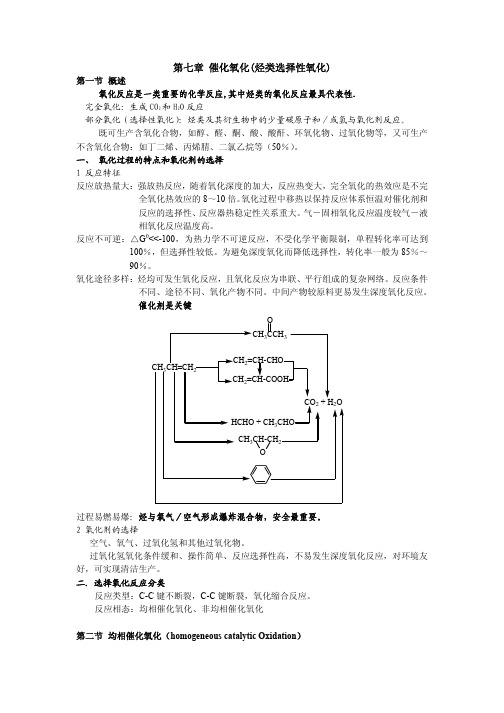
R +.H2O.
2R.OOH
.ROO + RO +H2O
RO.O . R'O + R'CHO (或酮)
.
R'O(或RO) + RH
R'OH(或ROH) + R
(5) E=167kJ/mol (6) (7)
(8) (9) (10)
分支反应生成不同碳原子数的醇和醛,进一步氧化为酮和酸,反应产物复杂。
2、催化剂体系 催化剂:Co、Mn 等过渡金属离子的醋酸盐和环烷酸盐;助催化剂
H3C
CH3
HOOC
COOH 反应产物为稳定的有机物,不易进一步氧化
CH3CHO
CH3COOH 高转化率和高选择性
而对于目的产物为中间产物的,由于中间产物较原料更易氧化,故应控制单程转化率,
通过循环操作实现高转化率。
OH
O
COOH
COOH 10%
O
C40
C-C-C-C
HAC 12%
反应产物分布与反应器物料返混程度相关
溴化物: NaBr, NH4Br,C2H2Br4,CBr4 3、反应影响因素
◇杂质:
以自由基为载链体的自氧化反应速度取决于链的传递速度,稳态时自由基的产生速度与
消失速度平衡,若体系中自由基浓度降低则反应速度急剧降低。自由基的再化合、自由基的
歧化、自由基与容器壁碰撞和反应体系中存在夺取自由基的杂质(阻化作用)
◇反应温度和氧分压 供氧能力大,反应由动力学控制
T 提高,k 增大,但不宜太高,否则 Q 吸〈Q 放,导致温度偏高,选择性降低,k 急
剧加速导致飞温。 T 降低,k 减小,Q 吸>Q 放,T 进一步降低,反应停止。
高中化学必修二第七章《有机化合物》经典题(2)

一、选择题1.乙烯的结构简式是A.C2H4B.CH2=CH2C.CH2CH2D.2.完全燃烧0.1 mol两种气态烃的混合物,将燃烧产物依次通过足量浓硫酸和足量氢氧化钠溶液,称得浓硫酸增重3.6克,氢氧化钠溶液增重6.6 g,则混合物中A.一定存在CH4B.可能存在C2H2C.一定含有C2H4D.可能含有C2H63.下列物质的化学用语表达正确的是A.甲烷的球棍模型:B.33(CH)COH的名称:2,2-二甲基乙醇C.乙醛的结构式:3CH CHOD.羟基的电子式:·····O:H4.医用一次性口罩的结构如图所示,过滤层所用的材料是聚丙烯,具有阻隔病毒和细菌的作用。
下列有关说法不正确的是A.该口罩是一种混合物B.聚丙烯难溶于水C.该口罩用完后不应随意丢弃D.用“84”消毒液清洗该口罩上的污溃后可继续使用5.化学与抗击“新冠”病毒密切相关。
下列说法错误的是A.双氧水中含有H2O2分子B.“84”消毒液应该避光保存C.过氧乙酸(CH3COOOH)的相对分子质量为76D.75%的酒精消毒效果不如95%的酒精6.下列物质既能使酸性高锰酸钾溶液又能使溴水(发生化学反应)褪色的是A.乙烯B.乙烷C.乙醇D.苯7.下列化学用语正确的是()A.乙烯的结构简式:CH2CH2B.丙烯的实验式:CH2C.四氯化碳分子的电子式:D.聚丙烯链节的结构简式:-CH2-CH2-CH2-8.下列实验方案能达到目的的是A.用浓硫酸干燥NH3B.用焰色反应鉴别KCl和K2SO4C.用NaOH溶液除去Cl2中的HCl D.用灼烧闻气味的方法鉴别棉线和羊毛线9.下列物质的检验、分离和提纯方法,不正确的是A.用分液漏斗分离四氯化碳与水B.用硝酸银溶液检验自来水中的氯离子C.用溴水区别乙烯与甲烷D.用浓硫酸干燥NH310.下列说法不正确...的是A.臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且不影响水质B.在食品包装袋内放入铁系保鲜剂可以防止食品因氧化而变质C.因铝制品表面有致密的氧化膜保护层,故可长时间盛放咸菜等腌制食品D.工业上,二氧化硫可用于漂白纸浆以及草帽等编织物二、填空题11.A~G是几种烃的分子球棍模型(如图),据此回答下列问题:(1)常温下含氢量最高的气态烃是________(填字母)。
2021年高中化学必修二第七章《有机化合物》经典练习(答案解析)(3)

一、选择题1.下列物质或方法中不可以用来鉴别甲烷和乙烯的是A.溴水B.H2C.酸性KMnO4溶液D.燃烧法答案:B解析:A.甲烷与溴水不能反应,因而不能使溴水褪色;乙烯能够与溴水发生加成反应而使溴水褪色,因此可以使用溴水鉴别甲烷和乙烯,A不符合题意;B.H2与甲烷不能发生反应;乙烯与H2在一定条件下发生反应,但无明显现象,不能鉴别二者,B符合题意;C.甲烷与酸性KMnO4溶液不能反应,因而不能使酸性KMnO4溶液褪色;乙烯能够被酸性KMnO4溶液氧化而使溶液褪色,因此可以使用酸性KMnO4溶液鉴别甲烷和乙烯,C不符合题意;D.甲烷燃烧火焰呈淡蓝色,乙烯燃烧火焰明亮,并伴有黑烟,二者现象不同,可以鉴别,D不符合题意;故合理选项是B。
2.某课外活动小组利用如图所示装置进行乙醇的催化氧化实验并制取乙醛。
实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝呈红热状态。
若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
下列说法错误的是A.乙醇的催化氧化反应是放热反应B.装置甲应置于70~80℃的水浴中,目的是使装置甲中乙醇平稳汽化成乙醇蒸气C.装置丙的作用为收集乙醛D.可通过装置甲中冒气泡的速率控制空气的通入速率答案:C【分析】利用如图所示装置进行乙醇的催化氧化实验并制取乙醛,向甲中通入空气,空气携带乙醇蒸汽一同进入乙装置,在镀银铜丝作催化剂作用下加热,空气中的氧气与乙醇发生氧化还原反应生成乙醛,并用装置丙为安全瓶,丁装置进行尾气处理。
解析:A.乙醇和氧气在乙装置中费用一段时间后,将酒精灯撤走,控制鼓入空气的速度,铜丝仍能长时间保持红热,说明乙醇的催化氧化反应是放热反应,故A正确;B.装置甲的作用是提供反应物乙醇蒸汽,水浴加热温度易控制,更容易获得平稳的气流,故B正确;C .根据分析可知,装置丙的作用为安全瓶,防止倒吸,故C 错误;D .根据题意,实验过程中需要控制一定的鼓气速度,则可根据通过装置甲中冒气泡的速率控制空气的通入速率,故D 正确;答案选C 。
人教版必修第二册第七章第三节《乙醇的催化氧化》课件

2、在试管中加入3-5mL无水乙醇,将刚刚灼烧过的铜丝, 迅速插入乙醇中,反复多次,观察铜丝颜色和乙醇气味 的变化。
寻找证据
〖实验探究二〗乙醇的催化氧化
1、将铜丝放在酒精灯外焰灼烧,观察铜丝的变化。
铜丝 外焰 变黑
2、在试管中加入3-5mL无水乙醇,将刚刚灼烧过的铜丝, 迅速插入乙醇中,反复多次,观察铜丝颜色和乙醇气味 的变化。
乙醇的催化氧化
问题引入
有一个铜制工艺品,因被放置在较高温的地方而表 面变黑,该如何除掉表面那层黑色物质?
△
2Cu+O2
2CuO
分析结构
2、乙醇的结构
结构式:
HH H C—C—O—H
HH
ቤተ መጻሕፍቲ ባይዱ
官能团: —羟基
写作-OH
寻找证据
〖实验探究〗乙醇的催化氧化 1、将铜丝放在酒精灯外焰灼烧,观察铜丝的变化。
寻找证据
羟基
思路点拨
预测有机反应的一般思路
分析结构
官能团 是否含有不饱和键
键的极性 基团之间的相互影响
......
实验
预测反应
验证
寻找证据
实验
现象
将铜丝在火焰上烧热 铜丝由红色变成黑色
将烧热的铜丝插入无 铜丝由黑色变成红色,反
水乙醇中
复多次后闻到刺激性气味
追根溯源 乙醇的催化氧化
红色→黑色 黑色→红色
2Cu+O2 △ 2CuO ①
H O H
H O
H C C H + CuO △ H C C H + Cu +H2O ②
H H
H
乙醛
①+②×2:
生物化学 第07章 生物氧化

糖酵解反应全过程
ATP ADP
葡萄糖
6-磷酸葡萄糖
ATP ADP 6-磷酸果糖 1,6-二磷酸果糖
2×乳酸
磷酸二羟丙酮 2×丙酮酸 2×NADH+ 2H+ 2×NAD+
3-磷酸甘油醛 2×Pi
2×烯醇式丙酮酸 2×ATP
2×ADP
2×磷酸烯醇式丙酮酸
2× 2-磷酸甘油酸
2×H2O
2×1,3-二磷酸甘油酸 2×ADP
物质在体内外氧化时所消耗的氧量、 最终产物(CO2,H2O)和释放能量均 相同。
生物氧化与体外氧化的不同点
生物氧化
体外氧化
反应条件
温和
反应过程 逐步进行的酶促反应
能量释放 逐步进行
CO2生成方式 有机酸脱羧
H2O
需要
速率
受体内多种因素调节
剧烈 一步完成 瞬间释放 碳和氧结合
不需要
(二)需氧脱氢酶
脑、骨骼肌
苹果酸-天冬氨酸穿梭
苹果酸、 谷氨酸 天冬aa、α-酮戊二酸
NADH+ H+
NADH 氧化呼吸链
2.5
肝脏和心肌组织
相同点 将胞浆中NADH的还原当量转送到线粒体内
高能化合物
含高能磷酸键或高能硫 酸键的化合物称为高能 化合物
概念:水解时释放的能量 大于21kJ/mol的化学键称 为高能键,常用符号“~” 表示。
细胞色素的传递方向
笔洗一洗AA散 b、c1、c、aa3
洗一洗
4. Cyt在呼吸链中的作用
2Cyt-Fe3++2e
2Cyt-Fe2+
2Cytaa3-Fe2+ +1/2O2 2Cytaa3-Fe3+ +O2-
有机工艺学--烃类选择性氧化

7.2.2 配位催化氧化
催化剂由中心金属离子和配位体构成,金属离子 与反应物形成配位键并使其活化,反应物被氧化,金 属离子或配位体被还原,还原态的催化剂再被分子氧 氧化为初始态,完成循环。
●配位催化氧化过程
配位
初始态 催化剂
反应物 氧化
还原态 催化剂
产物
催化剂由中心金属 离子与配位体构成
k4反应速率最慢,对羧基苯甲醛氧化为对苯二甲酸
为控制步骤
◆副反应
◆氧化机理p227
催化剂能活化第一个甲基,但难以氧化第二个甲 基;溴化物活化第二个甲基。
●加氢精制
◆加氢精制 在高温、高压下使粗TPA溶于水,然后在钯催化剂
存在下对杂质进行加氢反应,使粗对苯二甲酸产品中 的杂质对羧基苯甲醛(4-CBA)还原为易溶于水的对甲 基苯甲酸(即PT酸),其他有色杂质也同时被分解。
★压力 由反应温度确定
●乙烯配位催化氧化制乙醛工艺
◆一段法----Hoeschst工艺 三个反应在同一反应器进行
◆二段法----Wacker-Chemie工艺 乙烯羰化和钯的氧化在一台反应器中, Cu+的氧化在另一反应器中。
调节温度,保证回流液中 乙醛含量尽可能少
65%乙烯和8%氧,排放防 止惰性气体积累
工业上用于生产有机酸、过氧化物p224
●烃类自氧化反应机理—自由机链式反应机理
烃分子均裂生成自由基 决定性步骤
ROOH的生成是链传递反应的控制步骤
烃分子发生均裂的活化能 叔C-H<仲C-H<伯C-H
链传递受(7-3)控制,ROOH不稳定,可生成新自由基 产物组成中有:醇、醛、酮、酸,组成复杂
●催化自氧化催化剂p224
进一步吸 收未冷凝 回收 的乙醛 乙醛 和催 化剂 雾沫
第七章 化学反应速率和化学平衡第二节 化学平衡状态

二、化学平衡常数 1.化学平衡常数:化学平衡状态是在一 定条件下可逆反应进行的最大限度。对 于可逆反应aA+bBcC+dD,在一 定温度下,无论反应物的起始浓度如何, 反应达到平衡状态后,________除以 ________为一个定值。我们把这个定 值称为该反应的化学平衡常数,简称平 衡常数。表达式为:K=________。K 值越大,表示正向反应进行得 ________;K值越小,表示反应进行得 ________。
●案例精析 【例1】 (2009·宁波模拟)可逆反应: 2NO2(g)2NO(g)+O2(g),在体积 固定的密闭容器中,达到平衡状态的标 志是 ( ) ①单位时间内生成n mol O2的同时生成 2n mol NO2 ②单位时间内生成n mol O2的同时生成 2n mol NO ③用NO2、NO、O2表示的反应速率的比 为2∶2∶1的状态
一、化学平衡状态 1.化学平衡的建立 用可逆反应中正反应速率和逆反应速率 的变化表示化学平衡的建立过程,如图 所示。 2.化学平衡的本质 正反应速率________逆反应速率。
3.化学平衡的特征 (1)逆:研究的对象必须是________。 (2)动:化学平衡是________平衡,即 当反应达到平衡时,正反应和逆反应仍 在继续进行。 (3)等:正反应速率________逆反应速 率,即v(正)=v(逆)≠0。 (4)定:反应混合物中,各组分的百分含 量________。 (5)变:改变影响平衡的外界条件,平衡 会________,然后达到新的平衡。
6.下列叙述中,不正确的是 ( ) A.某特定反应的平衡常数仅是温度的函 数 B.催化剂不能改变平衡常数的大小 C.平衡常数发生变化,化学平衡必定发 生移动达到新的平衡 D.化学平衡发生移动,平衡常数必发生 变化 答案:D
第七章 醛

铬酰氯亦是芳烃侧链氧化成醛的良好试剂。一般是将芳烃慢慢加到铬酰氯的 氯仿或四氯化碳溶液中,首先生成络合物,继而酸性水解成醒,被称为Etard反 应。
在硫酸溶液中,活性二氧化锰可直接将芳烃的侧链氧化成芳醛。为了防止醛 的进一步氧化,二氧化猛的用量仅与芳烃等当量
第二节 还原反应 羧酸、酰卤、酰胺、腈均具有较高的氧化状态,它们易被还原成醛,醛亦可进 一步还原成醇。因此利用还原法合成醛时,必须选择反应性能温和、选择性较好的 还原试剂并控制适当的反应条件。 酰卤在适当的条件下,可被催化氢化成醛;利用还原试剂亦可达到同样目的。 由于羧酸不易被一般试剂还原成醛,因此借酰卤的还原方法可使羧酸转变成醛。 酯、酰胺被金属氢化物的还原是合成醛的新方法。 若将腈转变成它的某些衍生物,再进行还原,即可避免腈直接还原时生成胺的 副反应。
3、铬酰氯氧化
末端双键控可与铬酰氯反应,使双键氧化断裂即可转变为醛
三、从卤代烃制醛 1、Sommelet 反应 苄卤化合物与六亚甲基四胺在乙醇中反应,首先生成铵盐,继而水解,生 成芳醛,这一反应被称为Sommelet反应。
反应的中间体铵盐不需祈离,即可用50%乙酸水溶液直接水解。苄卤反应收率 80%左右,其它卤代烃的反应收率在50%左右。
4、DMSO 氧化 二甲基亚矾(DMSO)被多种亲电试剂活化后,与伯醇反应生成烷氧基硫盐,接着 发生消除反应,生成醛与二甲硫醚,是氧化伯醇的温和试剂,可广泛用于甾 族、生物 碱及碳水化合物等许多对一般氧化剂敏感的化合物的氧化。
在磷酸或三氟乙酸吡啶盐的存在下,二甲基亚砜-双环己基碳二亚胺(DCC), 是氧化伯醇的温和试剂。分子中存在的双键、叁键、酯、磺酸酯、酰胺、叠氮、糖 苷键等不受影响。
H3C DMSO,(COCl)2 OH H3C O Et3N,-60 C H3C H3C CH3 O O O CH3 O CHO
(必考题)初中高中化学必修二第七章《有机化合物》知识点(答案解析)

一、选择题1.乙醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸乙酯,反应温度为115~125℃,反应装置如图。
下列对该实验的描述正确的是A .换成用水浴加热实验效果会更好B .a 试管上换成长玻璃导管能提高原料利用率C .实验完毕,可将乙酸乙酯从混合物中萃取出来D .向a 试管中先加乙酸,再加浓硫酸和乙醇2.一定质量的甲烷燃烧后得到的产物为CO 、2CO ,和水蒸气,此混合气体质量为49.6g ,当其缓慢经过无水2CaCl 时,2CaCl 增重25.2g ,原混合气体中2CO 的质量为( ) A .12.5gB .13.2gC .19.7gD .24.4g3.下列说法正确的是A .H 与D ,16O 与18O 互为同位素;H 216O 、D 216O 、H 218O 、D 218O 互为同素异形体;甲醇、乙二醇和丙三醇互为同系物B .在SiO 2晶体中,1个Si 原子和2个O 原子形成2个共价键C .HI 的相对分子质量大于HF ,所以HI 的沸点高于HFD .由IA 族和VIA 族元素形成的原子个数比为1:1、电子总数为38的化合物,可能是含有共价键的离子化合物4.下列说法正确的是A .氨基酸分子中含有氨基(-NH 2)、羧基(-COOH),所以其既能和酸反应又能和碱反应B .用FeCl 3溶液能区分CH 3COOH 、CH 3CH 2OH 、苯酚三种物质C .诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”都是高级烃D .在酸性条件下,CH 3CO 18OC 2H 5的水解产物是CH 3CO 18OH 和C 2H 5OH5.化学与抗击“新冠”病毒密切相关。
下列说法错误的是A .双氧水中含有H 2O 2分子B .“84”消毒液应该避光保存C .过氧乙酸(CH 3COOOH)的相对分子质量为76D .75%的酒精消毒效果不如95%的酒精6.2019年在武汉举办的“世界军运会”开幕式上,主火炬(燃料是天然气)在水中点燃呈现“水交融”的景象,惊艳世界。
新教材高中化学第七章有机化合物第二节第2课时有机高分子材料课件新人教版必修2

课堂合作探究
探究任务一
几种常见塑料的结构和性能
【生活情境】
有机高分子材料在生活生产的各个领域都有极为广泛的应用。
“三大合成材料”是指塑料、合成纤维、合成橡胶。你能列举有关“三大合
成材料”的应用吗?
【问题探究】
由聚氯乙烯制造的塑料包装袋能不能盛装食品?
提示:不能,聚氯乙烯有毒。
【探究总结】
【探究训练】
提示:实验室中盛放KMnO4溶液、浓硝酸、液溴、汽油、苯、四氯化碳等药品
的试剂瓶的瓶塞不能用橡胶塞。
3.合成纤维
(1)分类
(2)合成纤维的性质和用途
强度高
弹性好
耐磨
①性质:合成纤维具有_______、_______、_____、耐化学腐蚀、不易虫蛀等
优良性能。
②用途:制作衣物、绳索、渔网、滤布和飞机、船舶的结构材料等。
高性能陶瓷时代。在生活中你都用到过哪些高分子材料?你知道它们都有怎样
的性质?
1.塑料
(1)塑料的分类:根据塑料加热时的表现可把塑料分为热塑性塑料和热固性塑
料两大类。
(2)常见合成塑料
①聚乙烯(PE)
②聚氯乙烯(PVC)
③聚苯乙烯(PS)
④聚四氟乙烯(PTFE)
⑤聚丙烯(PP)
⑥聚甲基丙烯酸甲酯(PMMA)
第2课时
有机高分子材料
课前自主学习
学习任务
有机高分子材料
任务驱动:
材料被视为人类社会发展的里程碑,满足社会发展的需求是材料不断创新与发
展的源动力。历史上,对材料的认识和利用的能力,决定着社会的形态和人类
生活的质量,历史学家也把材料及其器具作为划分时代的标志:如从旧石器时
代开始,经过新石器时代、青铜器时代、铁器时代、钢铁时代、高分子时代、
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙烯 PdCl2-CuCl2-HCl 乙醛
1. 乙醛的性质
物性:乙醛是无色透明、易挥发的液体,具有辛辣 的刺激性气味。沸点20.8℃,冰点-124℃,着火点 43℃,自燃温度185℃。乙醛蒸汽与空气形成爆炸性 混合 物,爆炸范围3.8~57%。 乙醛与水、乙醇、 乙醚及其它多种有机液体能以任何比例混和。
乙醛及催化剂溶液入口位于塔 的上部,氧气由塔下部进入,反 应液用循环泵从塔底抽出,经冷 却器冷却后返回氧化塔。氧化产 物液从接近塔顶处采出,也可从 循环泵抽出口采出,氧化尾气由 塔顶排出。
催化自氧化
按移热方式不同
内冷却型氧化塔
外冷却型氧化塔
分段控制冷却水和 通氧量,传热面积 太小,结构复杂, 成本较高
酸
生
反应原理
热动力学:①热力学:放热反应 ②动力学:初期速度慢,后期速度快
产
影响因素:①原料配比及纯度:对反应过程和产品质量影响 ②氧化剂:影响原料转化率及产品收率
③氧的扩散和吸收:氧气分布器
④ 温度,压力:55-85℃;0.15MPa
工艺流程
流程:氧化反应,产物分离,产品精制
三、乙烯络合催化氧化制乙醛
均相络合催化氧化所用的催化剂是由金属离子和配位体构 成,最主要的是Pd络合物。
催化自氧 化反应
可变价过渡金属离子通过单电 子转移促使链的引发及过氧化 氢物的分解。
不
同
络合催化 氧化反应
金属离子与反应物形成配位键并 使其活化,反应物被氧化,金属离子
被还原,还原态的催化剂再被分子
具有代表性的络合催化氧化反应: 氧氧化为初始态,完成循环。
一、催化自氧化
具有自由基链式反应特征,能自动加速 的氧化反应。使用催化剂加速链的引 发,称为催化自氧化。
工业上生产有机酸、过氧化物
乙醛氧化制醋酸
1.氧化反应机理及动力学
加速自由基的生成 催化剂
2.催化自氧化催化剂
催化剂多为Co、Mn等过渡金属离子的盐类 或者他们的混合物。乙酸锰。
催化剂作用
加速链的引发,缩短或消除反应诱导期; 加速RCOOOH的分解,促进氧化产物醇、醛、 酮、酸的生成。
第二节 均相催化氧化
均相催化氧化大多是气—液相氧化反应, 气相氧化因缺少合适的催化剂,且反应控制 也较困难,故工业上很少采用。
均相催化氧化的类型
催化自氧化反应 络合催化氧化反应
均相催化氧化的特点
催化剂活性较高、选择性较好 反应条件不太苛刻,反应比较平稳 设备简单,容积较小,生产能力较高 反应温度通常不太高,反应热利用率较低 在腐蚀性较强的体系时要采用特殊材质 催化剂多为贵金属,必须分离回收
通氧速度过快,氧的吸收率就越高,但是超过一定限 度,反而会下降。设置氧气分布器:上中下三段通入。
4)温 度
升高温度,有利于过氧乙酸的形成、分解,但是太高, 爆炸危险。用纯氧做氧化剂,温度控制在55-85 ℃
5)压力
压力升高,有利于氧的吸收,过高会使费用增加, 最终可能造成爆炸。用纯氧做氧化剂,稍加压力使 乙醛在反应温度下保持液态,控制在0.15MPa。
增加塔内 液体的流 动性,有 利于传热; 其结构简 单,检修 很方便
工艺流程
催化自氧化
氧化反应,氧化液产物分离,产品精制
氧 乙酸锰、不挥发的副产物 化
蒸发器
液 的
未反应的乙醛、 副产物乙酸乙酯
组
脱轻组分塔
成 乙酸、高沸物
脱重组分塔
氧的吸收率98% 醋酸选择性98%
氧化产物
催化自氧化
乙醛、醋酸甲酯 甲酸、水、醋酸(50%)
CH3COOOH ﹢CH3CO
链终止:CH3COOOH ﹢ CH3CHO 醋酸锰 中间复合物
醋酸锰
2CH3COOH
3、工艺条件影响及选择
1)原料纯度
乙醛>99.7%,水含量<0.03%
杂质可能使体系中的自由基失活,破坏链的引 发和传递,导致反应速率下降甚至终止反应。
2)氧化剂:常用纯氧,充分吸收
3)氧的扩散和吸收
2、反应原理
催化自氧化
主反应
乙醛氧化生产乙酸是一个放热反应,其主反应为:
副反应主要有:
主要副产物有甲酸、醋酸甲酯、甲醇、二氧化碳等
催化自氧化
自由基反应机理
.
链的引发:CH3CHO﹢Mn3﹢
CH3CO﹢H﹢ ﹢Mn2﹢
.
链的传递:CH3CO﹢O2
CH3.COOO
.
CH3COOO ﹢ CH3CHO
.
二、乙醛催化自氧化制乙酸
乙 性质 酸 的 性 质 及 用 用途 途
乙酸又名醋酸,是具有刺激气味的无色透明 液体,无水乙酸在低温时凝固成冰状,(凝 固点为16.8℃)俗称冰醋酸。其沸点 118.1℃。爆炸极限4-17.0%,
乙酸能与水、醇、酯和氯仿等有机溶剂 以任何比例相混合。
乙酸除用作溶剂外,还有乙酸在食品工业 作防腐剂;在有机化工生产中,乙酸裂解 可制得乙酸酐,而乙酸酐是制取乙酸纤维 的原料;可作为油漆的溶剂和增塑剂;
催化自氧化
鼓泡式塔式反应器
反应器
(氧化塔)
鼓泡式塔式反应器
催化自氧化
G
特点:鼓泡塔多为空塔,塔内充满液 L 体,一般在塔内设有挡板,以减少液 体返混。在塔体下部装上分布器,将 气体分散在液体中进行传质、传热的 一种塔式反应器。结构简单,具有极
G
高的储液量。
L
鼓泡式塔式反应器
气体从塔底向上经分布器以气 泡形式通过液层,气相中的反应 物溶入液相并进行反应。向装满 液体的塔内鼓气泡。
4、反应器及工艺流程
液相自氧化具有以下特点:
催化自氧化
☆气液相反应,氧的传递过程对氧化反应速度起着 重要的作用;
☆强放热反应; ☆介质往往具有强腐蚀性; ☆原料中间产物或产物与空气或氧能形成爆炸混合 物, 而具有爆炸危险等。
故采用的反应器必须是:
◆能提供充分的氧接触表面; ◆能有效地移走反应热; ◆设备材料必须耐腐蚀; ◆有安全装置; ◆返混程度满足具体反应的要求。
反应温度:70-75 反应时间:3h 乙醛:97%
概述
物理性质:液体,Tb=391.3K,溶于水、苯、醇类有机溶剂 化学性质:可进行酯化等反应 用途:生产醋酸乙烯酯、醋酸纤维素、酸酐、醋酸酯等
生产方法:乙醛氧化
反应:①主反应:乙醛+氧气→乙酸
乙
②副反应:氧化、酯化生成甲酸、醋酸甲酯、甲醇等
催化剂:可变价金属(Mn,Ni,Co,Cu等)的醋酸盐
化学性质: ①乙醛在硫酸催化下能自聚,生成三聚乙醛,沸点 124.5℃。由于乙醛易挥发,故在输送时往往加工成三 聚乙醛。三聚乙醛在硫酸存在下加热,复解聚为乙醛。
