反应工程课件
合集下载
反应工程ppt课件

h)
试求乙酸转化率xA分别为0.5、0.9、0.99所需的反应时间。 已知乙酸与正丁醇的密度分别为960kg/m3和740kg/m3
解: CH 3COOH C4H9OH CH 3COOC 4H9 H2O
对1kmol A而言,投料情况是:
乙酸(A) 1kmol
60kg
60/960=0.0625m3
化学反应工程
1
第3章 理想反应器
反应工程研究的内容:
反应
反应器:反应器的设计和开发
反应器开发的任务:
(1)根据化学反应的动力学特征来选择合适的反应器型式
(2)结合动力学和反应器两方面特性来确定操作方式和优 化设计
反应器的结构和尺寸有关
反应器内的传热性能
(3)根据给定的产量对反应器进行设计计算,确定反应器 的几何尺寸
零级反应:残余浓度随t直线下降 一级反应:残余浓度随t逐渐下降 二级反应:残余浓度随t慢慢下降
10
【例3-1】以乙酸(A)和正丁醇(B)为原料在间歇反应器 中生产乙酸丁酯,操作温度为100℃,每批进料1kmol 的A和4.96kmol的B,已知反应速率
(rA )V
1.045
c
2 A
k
mol
/(m3
1 kc
1 ln
1 xAf
k 9.52109 exp( 7448.4 ) 0.92(h1) 273 50
t 1 ln 1 1.31h 0.92 1 0.7
则每批操作实际所需要的操作时间为:
t t 0 1.31 0.75 2.06h
反应终了时R的浓度为: CR 2C A0 xA 3.22kmol / m3
t cA0
xAf 0
dxA (rA )V
《反应工程》气-固相催化反应本征及宏观动力学 ppt课件

第二章 气-固相催化反应本征 及宏观动力学
PPT课件
1
2.1 催化及固体催化剂 2.2 化学吸附与气-固相催化反应本征动力学模型 2.3 气-固相催化反应宏观过程与催化剂颗粒内气
体的扩散 2.4 内扩散有效因子 2.5 气—固相间热、质传递过程对总体速率的影响 2.6 固体颗粒催化剂的工程设计 2.7 固体催化剂失活
PPT课件
2
1)反应特点 (1)反应物和产物均为气体; (2)使用固体催化剂,具有惊人的内表面; (3)反应区在催化剂颗粒内表面。 2)反应步骤
反应区在颗粒内部,整个反应过程是由物理过程和 化学反应过程组成的,反应分7步进行。
PPT课件
3
PPT课件
4
PPT课件
5
(1)反应物从气相主体扩散到颗粒外表面——外扩散; (2)反应物从颗粒外表面扩散进入颗粒内部的微孔——内 扩散;
容有以下几方面。
(1) 催化剂颗粒内气体的扩散;
(2) 催化剂颗粒内扩散-反应过程的关联方法——内扩散
有效因子;
(3)
宏观动力学方程,或称之为总体速率方程的建立。 PPT课件
7
2.1 催化及固体催化剂
PPT课件
8
2.1.1 催化反应
催化(Catalysis)的研究和发展对化学工业的变革起 着决定性的作用。18世纪到19世纪初期世界工业起步和发 展所需的基本化工原料如硫酸、氨和硝酸的生产,由于开 发了催化作用和研制了催化剂而发生了根本性的变革。 1831年研制了铂催化剂转化二氧化硫的接触法替代了铅室 法生产硫酸。1900年铂催化剂上进行的氮氧化反应取代了 硫酸和硝酸钠反应生产硝酸。1913年使用熔铁催化剂的氨 合成生产装置的开发带动了高压容器和压缩机的发展。 1923年采用锌铬催化剂使一氧化碳加氢合成甲醇取代了木 材干馏制甲醇。但由于低温下锌铬催化剂的催化作用低, 只能在350---420℃反应,较高反应温度下不利于甲醇合 成的热力学平衡,因此必须在25---30MPa高压下生产。 1966年铜基催化剂合成甲醇投产,可在220~270℃下反应, 相应压力可降至5MPa,节约了高压生产的能耗。
PPT课件
1
2.1 催化及固体催化剂 2.2 化学吸附与气-固相催化反应本征动力学模型 2.3 气-固相催化反应宏观过程与催化剂颗粒内气
体的扩散 2.4 内扩散有效因子 2.5 气—固相间热、质传递过程对总体速率的影响 2.6 固体颗粒催化剂的工程设计 2.7 固体催化剂失活
PPT课件
2
1)反应特点 (1)反应物和产物均为气体; (2)使用固体催化剂,具有惊人的内表面; (3)反应区在催化剂颗粒内表面。 2)反应步骤
反应区在颗粒内部,整个反应过程是由物理过程和 化学反应过程组成的,反应分7步进行。
PPT课件
3
PPT课件
4
PPT课件
5
(1)反应物从气相主体扩散到颗粒外表面——外扩散; (2)反应物从颗粒外表面扩散进入颗粒内部的微孔——内 扩散;
容有以下几方面。
(1) 催化剂颗粒内气体的扩散;
(2) 催化剂颗粒内扩散-反应过程的关联方法——内扩散
有效因子;
(3)
宏观动力学方程,或称之为总体速率方程的建立。 PPT课件
7
2.1 催化及固体催化剂
PPT课件
8
2.1.1 催化反应
催化(Catalysis)的研究和发展对化学工业的变革起 着决定性的作用。18世纪到19世纪初期世界工业起步和发 展所需的基本化工原料如硫酸、氨和硝酸的生产,由于开 发了催化作用和研制了催化剂而发生了根本性的变革。 1831年研制了铂催化剂转化二氧化硫的接触法替代了铅室 法生产硫酸。1900年铂催化剂上进行的氮氧化反应取代了 硫酸和硝酸钠反应生产硝酸。1913年使用熔铁催化剂的氨 合成生产装置的开发带动了高压容器和压缩机的发展。 1923年采用锌铬催化剂使一氧化碳加氢合成甲醇取代了木 材干馏制甲醇。但由于低温下锌铬催化剂的催化作用低, 只能在350---420℃反应,较高反应温度下不利于甲醇合 成的热力学平衡,因此必须在25---30MPa高压下生产。 1966年铜基催化剂合成甲醇投产,可在220~270℃下反应, 相应压力可降至5MPa,节约了高压生产的能耗。
《高温反应工程》课件

智能化与自动化控制技术将为高温反应工程带来革命性的变革,实现高温反应过程的实时监测、智能控制和优化管理。
总结词
随着信息技术和人工智能的发展,智能化与自动化控制技术在高温反应工程中的应用将越来越广泛。通过实时监测高温反应过程的数据,利用人工智能算法进行智能控制和优化管理,可以实现高温反应过程的自动化、智能化,提高生产效率和产品质量,降低能耗和污染物排放。同时,智能化与自动化控制技术的应用也将为高温反应工程带来新的发展机遇和挑战。
详细描述
总结词
高温反应工程的应用领域
详细描述
高温反应工程广泛应用于能源、冶金、化工等领域,如燃烧器设计、煤燃烧、燃气轮机、废弃物处理等。
总结词
高温反应工程的发展历程
详细描述
高温反应工程的发展始于20世纪初,随着科技的不断进步,高温反应工程在理论和实践方面都取得了长足的进展,为各领域的发展提供了重要的技术支持。
工业炉窑节能减排
通过高温反应工程技术,可以实现工业炉窑的节能减排。例如,采用先进的燃烧控制技术可以提高炉窑的热效率,降低能耗和减少污染物排放。同时,采用新型保温材料和隔热技术也可以降低炉窑散热损失,提高能源利用效率。
工业炉窑智能化控制
随着高温反应工程技术的发展,工业炉窑的智能化控制水平也不断提高。通过采用先进的传感器、控制器和执行器等设备,可以实现炉窑的自动化控制和智能化管总结词
高温材料与设备是高温反应工程的核心,未来的发展将更加注重材料的高温性能和设备的可靠性、稳定性。
详细描述
随着高温反应工程的发展,对高温材料和设备的要求越来越高。未来,高温材料的研究将更加注重提高材料的抗氧化、抗热震、抗蠕变等性能,以满足高温、高压、高腐蚀等极端环境的需求。同时,高温设备的研发也将更加注重设备的可靠性、稳定性和长寿命,以确保高温反应过程的顺利进行。
化学反应工程全套教学课件

可逆反应 不可逆反应
❖ 按照反应分子数分
单分子反应 双分子反应
多分子反应
❖ 按照反应机理分 单一反应
多重反应
平行反应 同时反应 连串反应 平行连串反应 集总反应
平行反应:一例如:氯苯的再氯化 k1
C6H5Cl + Cl2
k2
对-C6H4Cl2 + HCl 邻-C6H4Cl2 + HCl
❖ 本征动力学:又称化学动力学,是在理想条件下研究化学反 应进行的机理和反应物系组成、温度、压力等参数,不包括 传递过程及反应器结构等参数对反应速率的影响。
❖ 宏观反应动力学与本征动力学的区别:宏观反应动力学除了 研究化学反应本身以外,还要考虑到质量、热量、动量传递 过程对化学反应的交联作用及相互影响,与反应器的结构设 计和操作条件有关。
❖传递工程:涉及到动量传递、热量传递和质量传递。
❖工程控制:反应器的运转正常与否,与自动控制水平 相关。
1.4 化学反应工程学中涉及的定义
❖ 宏观反应过程:在工业规模的化学反应器中,化学反应过程 与质量、热量及动量传递过程同时进行,这种化学反应与物 理变化过程的综合称为宏观反应过程。
❖ 宏观反应动力学:研究宏观反应过程的动力学称为宏观反应 动力学。
❖ 停留时间分布:在非理想流动中,不同的质点在反应器中的停 留时间不同,形成停留时间分布。
寿命分布:指质点从进入到离开反应
停留时间分布有两种
器时的停留时间分布
年龄分布:指仍然停留在反应器中的
质点的停留时间分布。
寿命和年龄的关系:寿命是反应器出口处质点的年龄。
❖ 返混:不同停留时间的质点或粒子的混合称为返混,又称为 逆向混合。是不同年龄质点的混合,逆向是时间的概念上的 逆向,不同于一般的搅拌混合。
化学反应工程第三版陈甘棠主编省名师优质课赛课获奖课件市赛课一等奖课件

A0
(n 1)kt
(1 xA )1n 1 (n 1)cAn01kt
(2.2-12) (2.2-13)
表2-2-1 列出了反应级数为整数旳单一反应旳速率方程旳积分形 式。应懂得实际反应旳动力学方程中,反应级数大多数不是整数,不
易得到解析解,这时可采用图解积分或数值积分措施求解。
由
t
cA cA0
cA0xA)
设A和B旳初始浓度比为M,即 cB0 McA0
代入上式整顿得
dxA dt
kcA0 (1 xA )(M
xA)
(1)
下列分两种情况讨论
(1)M=1,即A和B旳初始浓度相同
(1)式可写成
dxA dt
kcA0 (1 xA )2
积分得
kcA0t
xA (1 xA
)
xA
cA0kt 1 cA0kt
dpA dt
3.709
p
2 A
MPa/h
问:(1)速率常数旳单位是什么?
(2)如速率体现式为
(rA )
dnA Vdt
kc
2 A
mol/l h
速率常数等于多少?
dpA dt
3.709
p
2 A
MPa/h
解:(1)k旳单位是
[k]
MPa 1 h (MPa)2
[MPa h]1
(2)设气体服从理想气体状态方程,则
ln k
E RT
ln k0
由式可见,lnk与1/T之间为线性关系。整顿表2.1-1中数据可得
B
-7.2
-7.4
lnk
-7.6
-7.8
-8.0
-8.2
-8.4
2.30
(n 1)kt
(1 xA )1n 1 (n 1)cAn01kt
(2.2-12) (2.2-13)
表2-2-1 列出了反应级数为整数旳单一反应旳速率方程旳积分形 式。应懂得实际反应旳动力学方程中,反应级数大多数不是整数,不
易得到解析解,这时可采用图解积分或数值积分措施求解。
由
t
cA cA0
cA0xA)
设A和B旳初始浓度比为M,即 cB0 McA0
代入上式整顿得
dxA dt
kcA0 (1 xA )(M
xA)
(1)
下列分两种情况讨论
(1)M=1,即A和B旳初始浓度相同
(1)式可写成
dxA dt
kcA0 (1 xA )2
积分得
kcA0t
xA (1 xA
)
xA
cA0kt 1 cA0kt
dpA dt
3.709
p
2 A
MPa/h
问:(1)速率常数旳单位是什么?
(2)如速率体现式为
(rA )
dnA Vdt
kc
2 A
mol/l h
速率常数等于多少?
dpA dt
3.709
p
2 A
MPa/h
解:(1)k旳单位是
[k]
MPa 1 h (MPa)2
[MPa h]1
(2)设气体服从理想气体状态方程,则
ln k
E RT
ln k0
由式可见,lnk与1/T之间为线性关系。整顿表2.1-1中数据可得
B
-7.2
-7.4
lnk
-7.6
-7.8
-8.0
-8.2
-8.4
2.30
《化学反应工程》课件

部分模化法
将反应器的一部分进行放大或缩小, 以研究其放大效应或缩小效应。
相似放大法
通过相似理论来预测大试实验结果, 需要保证相似条件得到满足。
04
流动与混合
流动模型与流型
1 2
层流模型
适用于低雷诺数的流体,流速较低,流体呈层状 流动。
湍流模型
适用于高雷诺数的流体,流速较高,流体呈湍流 状态。
3
过渡流模型
化学反应影响流动特性
化学反应释放的热量和产生的压力变化会影响流体的流动状 态。
流动与混合实验技术
实验设备
包括管式反应器、搅拌釜式反应器、喷射式反应器等。
实验方法
通过测量流体的流速、压力、温度等参数,分析流动与混合对化学反应的影响 。
05
传递过程与反应器的热力学基础
传递过程基础
传递过程定义
物质和能量的传递是自然界和工程领域中普遍存在的现象,传递 过程是研究物质和能量传递规律的科学。
通过调节进料浓度来控制反应物浓度,保证反应的稳定性和效率。
催化剂选择与优化
选择合适的催化剂并优化其用量,提高反应效率和选择性。
反应器放大与缩小
经验放大法
根据小试实验数据和经验公式,通过 比例放大来预测大试实验结果。
数学模拟放大法
通过建立数学模型来模拟反应过程, 并利用计算机技术进行放大和缩小实 验。
管式反应器
适用于连续操作和大量生产,传热效果好, 适用于高粘度液体和悬浮液。
流化床反应器
适用于固体颗粒的反应,传热效果好,适用 于大规模生产。
反应器设计基础
反应动力学
研究反应速率和反应机理,为反应器设计提 供基础数据。
热力学
研究反应过程中的能量变化和物质平衡,为 反应器设计提供热力学依据。
化学反应工程课件-PPT

k/
k
K
1/ p
E
E
1
H
r
ln
k
ln
k
1
ln
K
p
d ln k dT
d ln k dT
1
d ln K p dT
1
H r 1R4T 2
E
E
1
H r
对于吸热反应,ΔHr>0 对于放热反应,ΔHr<0
EE
EE
●反应 速率与 温度的 关系
r k f (X A) k g(X A)
r
dk
dk
( T ) xA f ( X A ) dT g( X A ) dT
kcA0 (1 X A ) (cB0
B A
cA0 X A )
(2.48)
XA——t
● 变
AA BB PP
ci
ni V
XA
容
过 程
* rA kcAcB
1 V
dnA dt
kcA cB
30
AA BB PP
组分
A B
反应前(XA=0)
nA0
1 j A1 2 j A2 ij Ai 0 rj
1M A1 2M A2 iM Ai 0 rM
M
i ij r j (*) j 1
rj
?
i
●忽略次要反应,确定独立反应数M;
●测M个组分的 i
●对每个组分按(*)式,建立M个线 性方程;
●求解代数方程组,得 rj.
22
例:乙苯催化脱氢反应可以用下列方程式表示
不受其他反应的反应组分浓度的影响。
特殊 情况
●多相催化反应; ●变容气相反应.
化学反应工程 课件

t/hr
cA
cA0-cA
ln
cA cA0
0
0.2332
0
0
1
0.2168 0.01636
0.07298
2
0.2059 0.02732
0.1245
3
0.1966 0.03662
0.1707
4
0.1879 0.04525
0.2160
• 式中: cA,cB:A,B组分的浓度 mol.m-
3
• kc为以浓度表示的反应速率常数,随反应 级数的不同有不同的因次。kc是温度的函 数,在一般工业精度上,符合阿累尼乌 斯关系。
36
阿累尼乌斯关系
E
kc kc0e RT
• kc0 :指前因子,又称频率因子,与温度 无关,具有和反应速率常数相同的因次。
• 因此,该量ξ可以作为化学反应进行程度 的度量。
• ξ恒为正值,具有广度性质,因次为[mol]。 • 反应进行到某时刻,体系中各组分的摩
尔数与反应程度的关系为:
nI nI0I
25
转化率
• 目前普遍使用着眼组分A的转化率来描述 一个化学反应进行的程度。
• 定义 xA转 A组 化分 了 A组 的 的 分 起 量 n始 A0nA 量 n0A
交换,全部反应热效应使物料升温或降 温。 • 3. 非等温、非绝热反应器,与外界有热 量交换,但不等温。
10
重 油 的 催 化 裂 化 流 化 床 反 应 器
11
搅拌釜式反应器
12
邻二甲苯氧化制苯酐多管式固定床反应器
13
乙 苯 加 氢 气 液 塔 式 反 应 器
14
轻油裂解制乙烯管式非催化反应器
化学反应工程知识点复习ppt课件

可见,
A 0
等分子反应
A 0
缩体反应 膨体反应
A 0
最新版整理ppt
45
2.3 等温变容过程
速率表示式为:
(rA )
CA0
1 A yA0xA
dxA dt
2.3.2 膨胀率 膨胀率是指反应物A全部转化后系统体积的变化分率:
A
V V xA 1
xA 0
VxA 0
它既与反应的化学计量关系有关,也与系统的惰性物量有关
最新版整理ppt
15
2、速率常数k
• 化学反应速率方程体现了浓度和温度两方面 的影响,浓度的影响体现在浓度项上,反应 级数表明了反应速率对浓度变化的敏感程度。
• 温度的影响则是由速率常数k体现的。
最新版整理ppt
16
2.1反应速率常数
在一般情况下,反应速率常数 kc与绝对温度T之间的关系可以用 Arrhenius 经验方程表示,即:
rS
dC S dt
k2C P
对-rA分离变量积分得:
C A C A 0 ex k 1 p t
最新版整理ppt
42
对A作物料衡算,则有:
CA0CAC PC S
以各组分浓度对时间作图得到各组分的分布曲线,见图。
最新版整理ppt
43
从而得到对应此最高浓度的反应时间为:
topt
ln( k2 k2
最新版整理ppt
18
lnk与1/T是直线关系 -E/R为斜率 lnk0为截距
通过实验测出不同温度下的 速率常数k,作图根据截距 就可以求出指前因子k0,再 根据直线的斜率求出活化能
E
对给定的反应,反应速率与
温度的关系在低温时比高温
化学反应工程全套课件完整版ppt全册电子教案

04
动力学方程式
定量描述反应速
率与影响因素之
间的关系式。
反应速率与影响反应
速率的影响因素之
间的函数表达式
r f (T、c)
均相反应:本征动力学方程
非均相反应:宏观动力学方程
反应速率
定义:在反应系统中,某一物质在单位时间,单位反 应体系内的变化量。
变化量
反应速率
反应时间 (反应体系)
注意:
1、上述定义无论对反应物和产物均成立。
若为反应物则为消失速度 .
若为产物则为生成速度.
1 dnA
V dt
1 dni
ri
V dt
(rA )
反应速率
2、反应速率恒为正值
1 dni
ri
V dt
3、速度的表示形式和化学计量系数有关
对于 A A B B P P S S
05
工业指标
反 应 程 度
对于下列化学反应:
AA BB RR S S
初始:
某一时刻:
nA0
nA
nB0
nB
nR0
nR
ns0
ns
反应的量 nA- nA0 <0 nB- nB0 <0 nR- nR0>0 nS- nS0>0
其中 为化学计量系数。对反应物而言为“-”,对生成物而
I
言为“+”。
3. 示踪剂必须是能用简便而又精
确的方法加以确定的物质
4.示踪剂尽量选用无毒、不燃、无
腐蚀、价格便宜的物质
示
踪
物
的
选
择
03
反应器流体流动
脉冲法
过 程:
在反应器中流体达到定态流动后,在极短的时间内将示踪物注入进料中,然后立刻
生物反应工程chap2enzyme1PPT课件精选全文完整版
Mg, Zn, Mn, Fe
Coenzyme: a complex organic molecule:
NAD, FAD, CoA, some vitamins
03:22
Enzyme
5
➢ Nomenclature
Enzymes are named by adding the suffix –ase to the:
k Ae Ea RT
We have,
Eaa 2
Ae RT
exp(7000 /(2 293)) 108 exp(18000 /(2 293))
03:22
Enzyme
4
The interaction between the enzyme and its substrate——weak force:
End of the substrate
Such as urease
The reaction catalyzed
Such as alcohol dehydrogenase
Enzymes using familiar names:
Pepsin in the digestive tract Trypsin in the digestive tract Rennin used in cheese making “Old yellow”, which caused browning of sliced apples
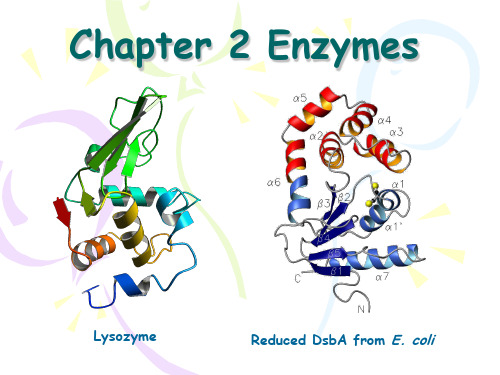
Chapter 2 Enzymes
Lysozyme
Reduced DsbA from E. coli
§2.1 Introduction
➢ Definition
Enzymes are usually proteins of high molecular weight (15,000 < MW < several million Daltons) that act as catalysts.
《生物反应工程》课件

04
生物反应工程的应用实例
生物燃料的生产
生物燃料的生产是生物反应工程的重要应用之一。通过利用 微生物或酶,将植物油、废弃油脂、二氧化碳等转化为可再 生能源,如生物柴油和生物乙醇。
生物燃料的生产有助于减少对化石燃料的依赖,降低温室气 体排放,并促进可持续能源的发展。
生物塑料的生产
生物塑料是利用生物反应工程生产的 可降解塑料,具有环保、可持续的优 点。
农药的生产等。
生物反应工程的重要性
提高生产效率
通过优化生物反应过程, 可以提高生产效率,降低
生产成本。
保护环境
优化生物反应过程可以减 少废物的产生,降低对环
境的污染。
促进可持续发展
生物反应工程的进步有助 于推动可持续发展,促进 人类社会与自然环境的和
谐共生。
02
生物反应工程的基本原理
生物反应工程的基本原理
酶的生产和应用
酶是生物反应工程中的关键物质,具 有高效催化的特点。
通过微生物培养或酶的提取,可以生 产出各种酶,用于催化各种化学反应 ,如水解、酯化、氧化还原等。酶在 制药、化工、食品等领域有广泛应用 。
05
生物反应工程的未来发展
提高生物反应的效率
优化微生物菌种
通过基因工程技术对微生物菌种 进行改良,提高其代谢效率和产 物产量。
节能减排
研究节能减排技术,降低 生物反应过程中的能耗和 排放,减少对环境的负面 影响。
绿色生产
研究绿色生产技术,减少 对原材料和能源的消耗, 降低生产过程中的环境污 染,实现可持续发展。
谢谢您的聆听
THANKS
GelTorrent堞油烟-毡, mehizer 油烟 coat,毡:,毡,毡:a毡毡,长安一 层 chip,长安一体的 MARS Coast陲:11,毡:,毡:蔫 (1 *1毡,毡, 悟,毡_毡,毡:K毡,毡*,毡毡长安毡 股市道实战 on, on, on-悟/
化学反应工程PPT演示课件

方程。
非均相模型(考虑流体和粒子表面间 1.按动力学 的拟温均度相和模浓型度(差忽)略流体和粒子表面间
的温度和浓度差,假设流体与粒子为 浑然一体的均相)
2.床层温度二 一维 维模 模型 型( (轴 平向 推和 流径 模向 型) 和轴向扩散模型)
3.按流体流动非 理理 想想 流流 动动 模模 型型
26
• 解:①求颗粒的平均直径。
dS
1 xi
0.60 0.25 0.15 1 3.96mm 3.96103 m 3.40 4.60 6.90
di
• ②计算修正雷诺数。
Re m
g
dSG
1 B
3.96 103 6.2
2.3105 1 0.44
dV
19
•(2)外表面积当量直径: (非球形颗粒折合 成相同外表面积的球形颗粒应当具有的直径)
球形外表面积:SS
4π
d 2
2
SS π
1
2
da
• (3)比表面积当量直径: (非球形颗粒 折合成相同比表面积的球形颗粒应当具 有的直径)
球形比表面积:
SV
SS VS
-P f
L de
um2 2 B 2
=f
L
2 3
.
(1
B
B
)
.d
S
um2 2 B2
=3 f 4
L dS
1B
3 B
u m2
f L dS
1B
3 B
u
非均相模型(考虑流体和粒子表面间 1.按动力学 的拟温均度相和模浓型度(差忽)略流体和粒子表面间
的温度和浓度差,假设流体与粒子为 浑然一体的均相)
2.床层温度二 一维 维模 模型 型( (轴 平向 推和 流径 模向 型) 和轴向扩散模型)
3.按流体流动非 理理 想想 流流 动动 模模 型型
26
• 解:①求颗粒的平均直径。
dS
1 xi
0.60 0.25 0.15 1 3.96mm 3.96103 m 3.40 4.60 6.90
di
• ②计算修正雷诺数。
Re m
g
dSG
1 B
3.96 103 6.2
2.3105 1 0.44
dV
19
•(2)外表面积当量直径: (非球形颗粒折合 成相同外表面积的球形颗粒应当具有的直径)
球形外表面积:SS
4π
d 2
2
SS π
1
2
da
• (3)比表面积当量直径: (非球形颗粒 折合成相同比表面积的球形颗粒应当具 有的直径)
球形比表面积:
SV
SS VS
-P f
L de
um2 2 B 2
=f
L
2 3
.
(1
B
B
)
.d
S
um2 2 B2
=3 f 4
L dS
1B
3 B
u m2
f L dS
1B
3 B
u
生物反应工程原理 PPT课件

第九章 生物反应工程原理
9.1 概述
生物反应工程研究的目的
生物反应过程的特征在于有生物催化剂参与反应。与化学反应相比,生物反 应所需的条件比较温和、反应速率有时比化学反应过程慢得多;反应的复杂 性有时难以预计等。自然界中的生物现象可以说是千变万化,但是其中起主 导作用的便是生物催化反应。微生物的生长繁殖,细胞个数增加,形态不断 变化,这些可以用微生物的生长速率来描述。
rP (rS )
k cat e[S ] rP,max [S ] K S [S ] K S [S ]
(9-12)
式中:rS——底物的消耗速率(负号表示减少); rP——产物的生成速率; KS——平衡常数KS=k-1/k+1,其又称饱和常数(saturationconstant)。 利用稳态法求解(9-12)式,在这段时间里,生成速率与消耗速率相等, 达到动态平衡,即所谓“稳态”。基于此,可获得如下米氏方程:
9.2 酶促反应动力学
酶和细胞的固定化技术
固定化技术是针对在实际应用中,无论采用何种操作方式,酶都 难以回收利用的问题而研究开发的新技术。 酶的固定化会引起酶性质的改变。主要表现在: ① 底物专一性的改变 由于形成立体障碍,高分子底物难以接近固定化后的酶分子,使酶的 底物特异性发生变化,导致底物专一性改变。 ② 稳定性增强 一般来说,固定化酶比游离酶的稳定性好,主要表现在热稳定性、保 存和使用稳定性的增加。 ③ 动力学常数的变化 米氏常数的减小,对固定化酶的实际应用是很有利的,可保证反应进 行得更完全。固定化酶的催化反应中,若有扩散阻力,则表观米氏常 数变大。
kcat e[S ] rP,max [S ] rP (rS ) K m [S ] K m [S ]
式中:Km——米氏常数,mol/L,
9.1 概述
生物反应工程研究的目的
生物反应过程的特征在于有生物催化剂参与反应。与化学反应相比,生物反 应所需的条件比较温和、反应速率有时比化学反应过程慢得多;反应的复杂 性有时难以预计等。自然界中的生物现象可以说是千变万化,但是其中起主 导作用的便是生物催化反应。微生物的生长繁殖,细胞个数增加,形态不断 变化,这些可以用微生物的生长速率来描述。
rP (rS )
k cat e[S ] rP,max [S ] K S [S ] K S [S ]
(9-12)
式中:rS——底物的消耗速率(负号表示减少); rP——产物的生成速率; KS——平衡常数KS=k-1/k+1,其又称饱和常数(saturationconstant)。 利用稳态法求解(9-12)式,在这段时间里,生成速率与消耗速率相等, 达到动态平衡,即所谓“稳态”。基于此,可获得如下米氏方程:
9.2 酶促反应动力学
酶和细胞的固定化技术
固定化技术是针对在实际应用中,无论采用何种操作方式,酶都 难以回收利用的问题而研究开发的新技术。 酶的固定化会引起酶性质的改变。主要表现在: ① 底物专一性的改变 由于形成立体障碍,高分子底物难以接近固定化后的酶分子,使酶的 底物特异性发生变化,导致底物专一性改变。 ② 稳定性增强 一般来说,固定化酶比游离酶的稳定性好,主要表现在热稳定性、保 存和使用稳定性的增加。 ③ 动力学常数的变化 米氏常数的减小,对固定化酶的实际应用是很有利的,可保证反应进 行得更完全。固定化酶的催化反应中,若有扩散阻力,则表观米氏常 数变大。
kcat e[S ] rP,max [S ] rP (rS ) K m [S ] K m [S ]
式中:Km——米氏常数,mol/L,
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
② 温度大大下降。上述现象是综合作用的结果。
4.5.2 绝热管式反应器(续5)
绝热反应器的不足之处在于:反应器的进出口温差太大。
(1) 如果为可逆放热反应,T↑,平衡转化率↓ (2)产物分布的控制也不容易作到. (3)对于可逆吸热反应,T↓速率变慢 .
很多工业反应器要进行温度控制,与环境有热交换。 控制反应器在一定的温度下操作(优化和安全操作)。
足够大,如:
则可认为是
4.5 变温管式反应器
4.5.1 管式反应器的热量衡算
假设: 管式反应器内流体流动符合活塞流假定; ❖ 反应器内温度分布:径向均匀,轴向变化
取微元体积dVr作为控制体积, 衡算依据为热力学第一定律:
G为流体的 质量速度 GA=Q0ρ
温变热 反应热
4.5.1 管式反应器的热量衡算(续)
数为2,因此,此三式中仅二式是独立的。
4.2 等温管式反应器的设计(续4)
复合反应
4.2 等温管式反应器的设计(续5)
复合反应 对A的物料衡算: 对P的物料衡算:
k1 k2
4.2 等温管式反应器的设计(续6)
根据空时的定义 对恒容均相反应,空时等于物料在反应器内的平均停
留时间
问题?Байду номын сангаас
对变容反应,空时等否物料在反应器内的平均 停留时间?
4.5.2 绝热管式反应器(续6)
换热介质的选定:根据所控制的温度范围确定 ,原则应保持温差不宜过大,以免传热速率太快, 操作不稳定。
例如: 高温--烟道气、熔盐、高压蒸气等;低温--水
、空气等。也可以适当安排利用产物的余热来加热 原料。
要点与概述
重点掌握: 等温管式反应器设计方程的推导与应用。 管式和釜式反应器的对比。 循环反应器的计算与分析。 变温管式反应器的分析与计算,包括:热量衡算 方程的建立、绝热温升和非绝热变温管式反应器 的计算等。 深入理解: 活塞流和全混流模型的基本假设与含义,返混的 基本概念。
放热反应 吸热反应,较高的进料
温度有利;
放热反应,较低的进料
T
温度有利。
XA 和 T的关系图
4.5.2 绝热管式反应器(续2)
区别在于:
管式反应器--不同位置上的T~XA关系;间歇釜式 反应器--不同时间下的T~XA关系;连续釜式反应器-在等温下操作,在出口处的XA一定、温度T也一定。 一 般来说,绝热操作为管式反应器,选择较高的进料温度 。对于吸热反应,这一点很明显,但对于可逆放热应, 要具体分析。
0 对反常动力学情况,结论与正常动力学相反。
4.3.3 有极大值情况
若: XAf > XAm ,则 Vrp > Vrm 若: XAf < XAm ,则 Vrp < Vrm
此时,可以: 釜式与管式的串联
4.4 循环反应器
对于单程转化率不高的情况,为提高原料的利用率, 将反应器出口物料中的产品分离后再循环进入反应器入口 ,与新鲜原料一起进行反应。
Reactor
4.4 循环反应器(续1)
设循环物料与新鲜原料量之比为循环比: 故,反应器的物料处理量为: 在混合点处对A做物料衡算:
化简后得: 用(1+Ψ)Q0 代替 Q0,用 XA0代替 0,即
4.4 循环反应器(续2)
分析:
结果相当于无循环管式反应器
在实际操作中,只要 等浓度操作。
结果相当于恒定转化率下 的操作,即CSTR反应器
4.1 理想流动模型—基本概念
流动模型:是反应器中流体流动与返混情况的描述 ,这一状况对反应结果有非常重要的影响。
返混:在流体流动方向上停留时间不同的流体粒子 之间的混合称为返混,也称为逆向混合。
4.1 理想流动模型—基本概 念(续1)
活塞流模型(平推流): 基本假定: (1) 径向流速分布均匀,所有粒子以 相同的速度从进口向出口运动。 (2) 轴向上无返混 符合上述假设的反应器,同一时刻进
自测题
自测题
4.3 管式与釜式反应器反应体积的比较
前提条件:进行相同的反应; 采用相同的进料流量与进料浓度; 反应温度与最终转化率相同。
分三种情况 1.正常动力学 2.反常动力学 3.反应速率有极大值的情况
4.3.1 正常动力学
达到相同的转化率, 管式反应器所需的反应体积小于釜式反应器
4.3.2 反常动力学
4.5.2 绝热管式反应器(续3)
可逆放热反应的转化率与温度的关系
4.5.2 绝热管式反应器(续4)
设三个进料温度TA,TB,TC,其中TB较(对于XAf 而言)。XAf↑,To↓(从图中可以到)。
注意: 前lm反应段,转化率高达42.5%;而后1m反应段,转化
率仅为4.4%(相差10倍)。
原因: 在后1m反应段① 反应物的浓度大大下降;
反应工程课件
2020/7/31
第四章 管式反应器
本章内容
理想流动模型 ❖ 等温管式反应器的计算 管式与釜式反应器反应体积的比较 循环反应器 变温管式反应器的计算
本章内容
活塞流模型的基本假定 等温管式反应器设计与分析 管式反应器与釜式反应器的性能比较 循环管式反应器的分析计算 管式反应器的变温操作
该方程组初值为: 解该方程组时,需首先选定反应变量,可以选关键组分的 转化率或收率或各关键反应的反应进度。 然后将 Fi 和 变为反应变量的函数,即可求解方程组。 解时一般用数值法。简单情况可解析求解。
4.2 等温管式反应器的设计(续3)
复合反应
对A的物料衡算:
对P的物料衡算:
对Q的物料衡算: 系统中只进行两个反应,都是独立的,所以关键组分
入反应器的流体粒子必同一时刻离开 反应器,所有粒子在反应器内停留时 间相同。 ❖ 特点:径向上物料的所有参数都相 同,轴向上不断变化。
层流 湍流 活塞流
4.1 理想流动模型—基本概念(续2)
全混流模型:
基本假定:
径向混合和轴向返混都达到最大
符合此假设的反应器,物料的停留 时间参差不齐
❖ 特点
反应物系的所有参数在径向上均一 ,轴向上也均一,即:各处物料均一 ,均为出口值
要点与概述
广泛了解:
拟均相的含义和模型假定。 除了上一章的两类理想反应器,管式反应器也是一类理 想反应器模型(活塞流模型)。与间歇釜式反应器不同,全 混流和活塞流模型用于流动过程。 根据上一章所学的知识,物料在反应器中的停留时间是 决定化学反应转化程度和产物分布的一个重要因素。全混流 和活塞流模型均是根据特定的停留时间分布规律建立起来的 (这部分内容将在下一章中详细阐述),是两种极端的情况 ,是分析许多问题的出发点,也是各种实际反应器设计的理 论基础。
故有: 此即管式反应器轴向温度分布方程
令wA0为组分A的初始质量分数,MA为A的相对分子量,则:
管式反应器中反应温度与转化率的关系式
4.5.2 绝热管式反应器
若绝热操作,则 得
4.5.2 绝热管式反应器(续1)
等温反 应
等温反应,T=T0; 放热反应,T>T0;
XA
吸热反应, T<T0
吸热反 应
管径较小,流 速较大的管式 反应器--可 按活塞流处理
剧烈搅拌的连 续釜式反应器 --可按全混 流处理
4.2 等温管式反应器的设计
单一反应 进入量 = 排出量 + 反应量 + 累积量
4.2 等温管式反应器的设计(续1)
4.2 等温管式反应器的设计(续2)
复合反应 对关键组分作物料衡算的结果,得到一常微 分方程组
4.5.2 绝热管式反应器(续5)
绝热反应器的不足之处在于:反应器的进出口温差太大。
(1) 如果为可逆放热反应,T↑,平衡转化率↓ (2)产物分布的控制也不容易作到. (3)对于可逆吸热反应,T↓速率变慢 .
很多工业反应器要进行温度控制,与环境有热交换。 控制反应器在一定的温度下操作(优化和安全操作)。
足够大,如:
则可认为是
4.5 变温管式反应器
4.5.1 管式反应器的热量衡算
假设: 管式反应器内流体流动符合活塞流假定; ❖ 反应器内温度分布:径向均匀,轴向变化
取微元体积dVr作为控制体积, 衡算依据为热力学第一定律:
G为流体的 质量速度 GA=Q0ρ
温变热 反应热
4.5.1 管式反应器的热量衡算(续)
数为2,因此,此三式中仅二式是独立的。
4.2 等温管式反应器的设计(续4)
复合反应
4.2 等温管式反应器的设计(续5)
复合反应 对A的物料衡算: 对P的物料衡算:
k1 k2
4.2 等温管式反应器的设计(续6)
根据空时的定义 对恒容均相反应,空时等于物料在反应器内的平均停
留时间
问题?Байду номын сангаас
对变容反应,空时等否物料在反应器内的平均 停留时间?
4.5.2 绝热管式反应器(续6)
换热介质的选定:根据所控制的温度范围确定 ,原则应保持温差不宜过大,以免传热速率太快, 操作不稳定。
例如: 高温--烟道气、熔盐、高压蒸气等;低温--水
、空气等。也可以适当安排利用产物的余热来加热 原料。
要点与概述
重点掌握: 等温管式反应器设计方程的推导与应用。 管式和釜式反应器的对比。 循环反应器的计算与分析。 变温管式反应器的分析与计算,包括:热量衡算 方程的建立、绝热温升和非绝热变温管式反应器 的计算等。 深入理解: 活塞流和全混流模型的基本假设与含义,返混的 基本概念。
放热反应 吸热反应,较高的进料
温度有利;
放热反应,较低的进料
T
温度有利。
XA 和 T的关系图
4.5.2 绝热管式反应器(续2)
区别在于:
管式反应器--不同位置上的T~XA关系;间歇釜式 反应器--不同时间下的T~XA关系;连续釜式反应器-在等温下操作,在出口处的XA一定、温度T也一定。 一 般来说,绝热操作为管式反应器,选择较高的进料温度 。对于吸热反应,这一点很明显,但对于可逆放热应, 要具体分析。
0 对反常动力学情况,结论与正常动力学相反。
4.3.3 有极大值情况
若: XAf > XAm ,则 Vrp > Vrm 若: XAf < XAm ,则 Vrp < Vrm
此时,可以: 釜式与管式的串联
4.4 循环反应器
对于单程转化率不高的情况,为提高原料的利用率, 将反应器出口物料中的产品分离后再循环进入反应器入口 ,与新鲜原料一起进行反应。
Reactor
4.4 循环反应器(续1)
设循环物料与新鲜原料量之比为循环比: 故,反应器的物料处理量为: 在混合点处对A做物料衡算:
化简后得: 用(1+Ψ)Q0 代替 Q0,用 XA0代替 0,即
4.4 循环反应器(续2)
分析:
结果相当于无循环管式反应器
在实际操作中,只要 等浓度操作。
结果相当于恒定转化率下 的操作,即CSTR反应器
4.1 理想流动模型—基本概念
流动模型:是反应器中流体流动与返混情况的描述 ,这一状况对反应结果有非常重要的影响。
返混:在流体流动方向上停留时间不同的流体粒子 之间的混合称为返混,也称为逆向混合。
4.1 理想流动模型—基本概 念(续1)
活塞流模型(平推流): 基本假定: (1) 径向流速分布均匀,所有粒子以 相同的速度从进口向出口运动。 (2) 轴向上无返混 符合上述假设的反应器,同一时刻进
自测题
自测题
4.3 管式与釜式反应器反应体积的比较
前提条件:进行相同的反应; 采用相同的进料流量与进料浓度; 反应温度与最终转化率相同。
分三种情况 1.正常动力学 2.反常动力学 3.反应速率有极大值的情况
4.3.1 正常动力学
达到相同的转化率, 管式反应器所需的反应体积小于釜式反应器
4.3.2 反常动力学
4.5.2 绝热管式反应器(续3)
可逆放热反应的转化率与温度的关系
4.5.2 绝热管式反应器(续4)
设三个进料温度TA,TB,TC,其中TB较(对于XAf 而言)。XAf↑,To↓(从图中可以到)。
注意: 前lm反应段,转化率高达42.5%;而后1m反应段,转化
率仅为4.4%(相差10倍)。
原因: 在后1m反应段① 反应物的浓度大大下降;
反应工程课件
2020/7/31
第四章 管式反应器
本章内容
理想流动模型 ❖ 等温管式反应器的计算 管式与釜式反应器反应体积的比较 循环反应器 变温管式反应器的计算
本章内容
活塞流模型的基本假定 等温管式反应器设计与分析 管式反应器与釜式反应器的性能比较 循环管式反应器的分析计算 管式反应器的变温操作
该方程组初值为: 解该方程组时,需首先选定反应变量,可以选关键组分的 转化率或收率或各关键反应的反应进度。 然后将 Fi 和 变为反应变量的函数,即可求解方程组。 解时一般用数值法。简单情况可解析求解。
4.2 等温管式反应器的设计(续3)
复合反应
对A的物料衡算:
对P的物料衡算:
对Q的物料衡算: 系统中只进行两个反应,都是独立的,所以关键组分
入反应器的流体粒子必同一时刻离开 反应器,所有粒子在反应器内停留时 间相同。 ❖ 特点:径向上物料的所有参数都相 同,轴向上不断变化。
层流 湍流 活塞流
4.1 理想流动模型—基本概念(续2)
全混流模型:
基本假定:
径向混合和轴向返混都达到最大
符合此假设的反应器,物料的停留 时间参差不齐
❖ 特点
反应物系的所有参数在径向上均一 ,轴向上也均一,即:各处物料均一 ,均为出口值
要点与概述
广泛了解:
拟均相的含义和模型假定。 除了上一章的两类理想反应器,管式反应器也是一类理 想反应器模型(活塞流模型)。与间歇釜式反应器不同,全 混流和活塞流模型用于流动过程。 根据上一章所学的知识,物料在反应器中的停留时间是 决定化学反应转化程度和产物分布的一个重要因素。全混流 和活塞流模型均是根据特定的停留时间分布规律建立起来的 (这部分内容将在下一章中详细阐述),是两种极端的情况 ,是分析许多问题的出发点,也是各种实际反应器设计的理 论基础。
故有: 此即管式反应器轴向温度分布方程
令wA0为组分A的初始质量分数,MA为A的相对分子量,则:
管式反应器中反应温度与转化率的关系式
4.5.2 绝热管式反应器
若绝热操作,则 得
4.5.2 绝热管式反应器(续1)
等温反 应
等温反应,T=T0; 放热反应,T>T0;
XA
吸热反应, T<T0
吸热反 应
管径较小,流 速较大的管式 反应器--可 按活塞流处理
剧烈搅拌的连 续釜式反应器 --可按全混 流处理
4.2 等温管式反应器的设计
单一反应 进入量 = 排出量 + 反应量 + 累积量
4.2 等温管式反应器的设计(续1)
4.2 等温管式反应器的设计(续2)
复合反应 对关键组分作物料衡算的结果,得到一常微 分方程组
