17第十七章杂环化合物PPT课件
第十七章 杂环化合物

重要的杂环 N
O 呋喃
furan
N H 吡咯
pyophene
N N
环
吡啶
pyridine
N
嘧啶
稠杂环
N
喹啉
嘌呤
杂环化合物的命名方法有两种:译音法和系统命名法。最常用的是译音法。
O
N H
S
N
furan
呋喃
pyrrole
吡咯
thiophene
噻吩
pyridine
吡啶
有取代基时,将杂原子编为1号,或与杂原子相邻的碳原子编为α,依次 为α,β,γ······
3
溶于水, pKa=8.9,弱碱 性
O
N
嘌呤
NH2 N N
鸟嘌呤
CH3 N
H3C O
N N CH3
N
N
咖啡碱,存在于茶 叶和咖啡中
作业p574
(一) (五)(2)(5)(7)(9)(11)(12)
(十)
(十五)
17.2 五元杂环化合物 17.2.1 五元杂环化合物的化学性质 1、亲电取代反应 相当于苯酚或苯胺的活性——反应主要发生在α-位 硝化
N H
O + H3C C ONO2
乙醇 -10℃
N H SO 3H
N H NO 2
-硝基吡咯
磺化
N H
+ SO3
吡啶 100℃
-吡咯磺酸
O
卤化
O
+ Br2
O 0℃
α –溴代呋喃 (90%)
O
Br
S
+ Br2 AcOH
室温
Br S α –溴代噻吩
Friedel–Crafts酰基化
有机化学精品课件——杂环化合物

05
有机化学与绿色化学
有机化学的发展趋势
1 2 3
新的合成方法
例如,定向合成、组合合成和高选择性催化等 新技术的开发和应用,极大地推动了有机化学 的发展。
新的反应性和反应机制
例如,电化学和光化学反应以及超分子和纳米 反应器等新技术的应用,为有机化学提供了新 的反应性和反应机制。
总结词
杂环化合物在分子生物学领域具有广泛的应用,涉及多种生物学实验技术。
详细描述
杂环化合物可以作为药物分子、基因治疗剂、分子探针等应用于分子生物学研究中。生物学实验技术包括细胞 培养、基因克隆和表达、蛋白质分离和分析等。这些技术可以用来研究杂环化合物在生物体内的吸收、分布、 代谢和排泄等特性。
杂环化合物的应用研究实验
合成方法
通过取代反应
杂环化合物可以通过取代反应合成,如卤代烃、醇、羧酸等 中的杂原子被其他原子取代。
通过成环反应
某些杂环化合物可以通过成环反应合成,如氨基酸、腺苷等 。
02
杂环化合物的种类与性质
含氮杂环化合物
吡啶
弱碱,碱性来自于氮原子上的孤对电子,可参与多种有机反应。
咪唑
碱性较弱,作为配体参与有机反应。
抗疟活性
青蒿素及其衍生物是具有抗疟活性的重要杂环化合物,通过干扰疟原虫的细胞膜 结构和功能,导致疟原虫死亡。
04
有机化学实验技术
杂环化合物的合成实验
总结词
有机化学实验技术中,杂环化合物的合成 实验是掌握杂环化合物性质的重要环节。
VS
详细描述
杂环化合物的合成实验涉及到多种反应类 型,如缩合反应、取代反应、加成反应等 。在实验过程中需要用到各种不同的试剂 和溶剂,如酸、碱、氧化剂、还原剂等。 实验操作也有一定难度,需要掌握一定的 实验技能和操作技巧。
杂环化合物

O
CHO
O
COONa
+
O
« ¼ ² ¹
CH2OH
«È ¼ ® Á Ã
õ · È Ì £ ·
O
CHO
+ (CH3CO)2O
NaOAc
O
+ CH=CHCOOH
通常,杂环化合物是指含有杂原子构成环的、有一定芳香 性的环状化合物。
•分类
1、脂杂环
三元杂环 四元杂环 五元杂环
O
没有芳香特征的杂环化合物称为脂杂
H N
O NH
(氮杂环丙烷) (β-丙内酰胺)
O O
(顺丁烯二酸酐)
七元杂环
O
(氧杂 )
N H
(1H-氮杂 )
2 、芳杂环
O H
HO
OH2
OH
OH
OH
亲电取代反应
(1)概述 *1 亲电取代反应的活性顺序为:
N H
>
O
>
S
>
①电子密度 ②σ-络合物
E N H H
E H
E N H H
E H
E N H H
E H
八隅体结构最稳定
无最稳定结构
吸电子诱导:O(3.5) > N(3.0) > S(2.6) 给电子共轭:N > O > S 综合:N贡献电子最多,O其次,S最少
*2 取代反应主要发生在α-C上; *3 吡咯、呋喃对酸及氧化剂比较敏感,选择试 剂时需要注意; *4 噻吩、吡咯的芳香性较强,所以易取代而不易 加成;呋喃的芳香性较弱,虽然也能与大多数 亲电试剂发生亲电取代,但在强亲核试剂存在 下,能发生亲核加成。
离域能:噻吩:121.3 kJ· mol-1 呋喃:66.9 kJ· mol -1
S017 第十七章 杂环化合物 有机化学 教学课件
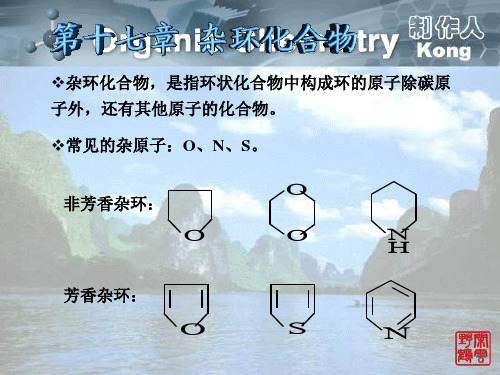
❖常见的杂原子:O、N、S。
O
非芳香杂环:
O
O
N
H
芳香杂环:
O
S
N
2 杂环化合物的命名
❖音译法:按照IUPAC推荐的普通名称,用2~3个汉字音 译,使用带口字旁的同音汉字。
❖系统命名法:根据相应的碳环命名。
N H
氮杂-2,4,6-环庚三烯
3 呋喃、吡咯、噻吩、吡啶的性质
(1) 亲电取代反应
❖呋喃、吡咯、噻吩具有芳香性,能进行卤代、硝化、 磺化等亲电取代反应,且反应的速度比苯快得多,发生 反应时取代基优先进入α-位。
H2SO4, 25℃
SO3H
S
S
α-噻吩磺酸
❖呋喃和吡咯对及氧化剂都比较敏感,应使用特殊的试 剂乙酰硝酸酯进行硝化,使用吡啶三氧化硫进行磺化。
戊糖 碱基
磷酸
❖脱氧核糖核酸(DNA)中的戊糖是脱氧核糖,核糖核 酸(RNA)中的戊糖是核糖。 ❖RNA中的碱基是胞嘧啶、脲嘧啶、腺嘌呤、鸟嘌呤;
❖DNA中的碱基是胞嘧啶、胸腺嘧啶、腺嘌呤、鸟嘌呤。
(1) 戊糖:
CHO OH OH OH
C H 2O H
D-核糖
CHO
OH OH C H 2O H
D-2-脱氧核糖
4 N3
5
N2
O
1
1,2,3-噁二唑
❖有些稠杂环化合物的原子编号是固定的。
5 6
7 8
4 3
N2
1
异喹啉
6
1N
2
N
3
5 N7
8
4
N H
9
嘌呤
有机化学 第十七章杂环化合物

第十七章杂环化合物(heterocyclic compounds)在环状化合物的环中含有碳以外的杂原子,这类化合物统称为杂环化合物。
常见的杂原子是: O, N, S1芳杂环的数目很多,可根据环的大小、杂原子的多少以及单环和稠环来分类。
•常见的杂环为五元、六元单杂环及稠杂环。
稠杂环是由苯环及一个或多个单杂环稠合而成的。
317.2 杂环化合物的命名杂环化合物的命名采用外文名的译音,用带“口”字旁的同音汉字表示。
编号从杂原子开始,用阿拉伯数字(1,2,…) 表示顺序,也可以将杂原子旁的碳原子依次用α、β、γ表示。
417.3 结构和芳香性呋喃、噻吩、吡咯是最重要的含一个杂原子的五元杂环化合物。
呋喃、噻吩、吡咯都是平面结构,环上所有原子都是sp2杂化,各原子均以sp2杂化轨道重叠形成σ键。
9碳未杂化的p 轨道中有一个电子,杂原子的p轨道中有一对电子,p 轨道相互平行重叠,形成闭合的共轭体系,具有芳香性。
下表中给出的1H NMR数据可证实这一点,环上质子的化学位移在7ppm左右与苯类似。
1011表17-1 五元芳杂环的物理性质分别存在于木焦油、煤焦油和骨焦油中αβαβαβ17.4 五元杂环化合物4.1 五元杂环化合物的化学性质呋喃、噻吩、吡咯具有芳香性,容易进行亲电取代反应。
杂原子的大小及电负性不同,它们的活性有差异,但它们的活性都比苯大,顺序为:吡咯> 呋喃> 噻吩> 苯12(丙)吡咯和吲哚•吡咯的物理性质和鉴定•无色油状液体,沸点131℃,微溶于水,易溶于有机溶剂。
•吡咯蒸气遇浸过盐酸的松木片呈红色,可用来检验吡咯。
•吡咯环不如苯环稳定,易被氧化呈褐色并发生树脂化。
2017.5 六元杂环化合物5.1 吡啶和嘧啶吡啶存在于煤焦油和骨焦油中,工业上用无机酸从煤焦油的轻油部分中提取。
吡啶的衍生物广泛存在于自然界中,许多药物也含有吡啶环。
23一、吡啶的物理性质及结构吡啶是一个无色有恶臭的液体b.p. 115.5℃,m.p.-42℃,d: 0.9819与水及许多有机溶剂如乙醇,乙醚等混溶它是良好的溶剂25吡啶的结构与苯的相似吡啶环上的氮以sp2杂化成键,一个p电子参与共轭,形成具有6个p电子的闭合的共轭体系,具有芳香性。
第十七部分杂环化合物409页教学课件

4
3 CH3 N
5
2CHO
S
N
1
H
3
5
COOH6
4 3
N2
1
7 8
N2
OH 1
2-噻吩甲醛 4-甲基咪唑 3-吡啶甲酸 8-羟基喹啉
也可以用希腊字母表示位置,与杂原子相邻位为α-位, 依次为 β,γ 位。 α-噻吩甲醛
杂环大体可分为:单杂环和稠杂环两类 411页表17-1
17.2杂环化合物 的结构与芳香性
具有芳性
富电子芳环
H C
HC C
H
H C
CH C
H
: 芳香性大小,试验结果表明
光谱性质:IR: νc-H = 3077~3003cm-1,νN-H = 3500~3200 cm-1 (在非极性溶剂的稀溶液中,在3495 cm-1,有一尖峰。在浓溶 液中则于3400 cm-1,有一尖峰。在浓和淡的中间浓度时,两种 谱带都有),杂环C=C伸缩振动:1600~1300 cm-1 (有二至四个 谱带)。
吡嗪(pyrazine)
六元杂环苯并环系
5 6
7 8
4 3
2 N 1
喹啉
(quinoline)
54
54
O
6
36
3
7
N2 7
2 O
81
81
O
异喹啉
苯并吡喃
苯并--吡喃酮
(isoquinoline) (benzopyran) (benzo--pyrone)
杂环并杂环
67
1N
5N
8
2
N 3
4
N H
9
嘌呤(purine)
第十七部分杂环化合物409页教学课 件
有机化学-第十七章 杂环化合物

氮杂-2,4,6-环庚三烯
二、命名 1、音译法命名:根据英文音义,用带口字旁的同音汉字
N H (pyrrole) 吡咯
O (furan) 呋喃
N
N (pyrimidine)
嘧啶
N
(quinoline) 喹啉
S (thiophene)
噻吩
N H (indole) 吲哚
N (pyridine)
吡啶
S
α-噻吩磺酸
呋喃和吡咯对及氧化剂都比较敏感,应使用特殊的试 剂乙酰硝酸酯进行硝化,使用吡啶三氧化硫进行磺化。
+
-
N SO3
SO3H
O
O
α-呋喃磺酸
O
CH3 C ONO2
N
(CH3CO)2O,-10℃
N
NO2
H
H
α-硝基吡咯
吡啶比苯难发生亲电取代反应,反应条件要求和硝基 苯差不多;在发生反应时取代基主要进入β-位。
1 α-呋喃甲醛
HO CH CH OH H2SO4
H CH C H Δ CHO
OH OH
+ 3H2O O CHO
糠醛是没有α-氢的醛,化学性质和苯甲醛相似。
浓 NaOH
+
O CHO
O CH2OH O COOH
2 卟啉化合物
卟啉化合物是一类广泛存在于自然界中的化合物,它
们的分子中都含有卟吩环。
2α314 NhomakorabeaNH
N
δ
β
N
HN
8
5
7
γ
6
卟吩环
CH CH2
吡咯的酸性极弱,介于醇和酚之间。
Δ + KOH(固)
S-17杂环化合物课件

2
N1
喹啉
quinoline
5 6
4 3
7
N2
8
1
异喹 啉
isoquinoline
4
5
3
6 7
2
N1 H
吲哚
indole
O
苯 并呋喃 benzofuran
6
1N 5 N7
2
8
N3 4
N9 H
嘌呤
purine
8
9
1
7
2
6 5
3
N 10
4
吖啶
acridine
前面所讲的内酯、内酰胺、环氧乙烷等从结构上来看,也 属于杂环化合物,但其性质与同类的开链化合物相似。且 很容易开环形成链状化合物。
杂环化合物种类繁多,数量庞大,是有机化合物中数量最 大的一类。广泛存在于自然界中,很多在动植物体内起着 重要的生理作用。如:中草药的有效成分生物碱、血红素、 叶绿素、核酸的碱基等,都是含氮杂环化合物;为数不少 的维生素、抗生素以及一些植物色素和植物染料都含有杂 环;目前合成的杂环化合物也是为数众多,不少合成药物, 合成染料、新型高分子材料也含有杂环结构。在现代药物 中,杂环化合物占了相当大的比重。因此可以说:杂环化 合物在生命科学中占有重要地位;杂环化学是有机化学的 一个重要组成部分。
键长没有完全均匀化
N 0.1383nm
二. 化学性质
1.亲电取代反应
杂原子具有吸电诱导效应,又具有供电共轭效应。 吡咯中氮的供电共轭效应大于吸电诱导效应。
a. 亲电取代反应的活性
吡咯 > 呋喃 > 噻吩 >> 苯
溴化相对速度:3*1018 6*1011 5*1011
1
b. 亲电基团一般进入杂原子的邻位
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
取代反应活性的次序
• 吡咯 > 呋喃 > 噻吩 > 苯
位电子
云密度 -0.10 -0.03 -0.06
0 (不一致)
(2)六元杂环化合物——吡啶
• 氮原子与碳原子处在同一平面。 • 吡啶的结构与苯相似,符合休克尔规则,具有芳香性。
p(1), Sp2(1,1,2)
• 吡啶在发生亲电取代反应较苯困难,主要发生在位。 • 吡啶较易发生亲核取代反应,取代基往往进入位。
电子数=6
有芳香性
电子数=8
反芳香性
电子数=6
有芳香性
非共轭体系
无芳香性
电子数=6
有芳香性
电子数=6
有芳香性
17.3 五元杂环化合物
17.3.1 呋喃
•存在于松木焦油中,为无色液体,难溶于水,易溶于有机溶剂。 其蒸汽遇有被盐酸浸过的松木时,即呈绿色(叫松木反应,鉴 别呋喃的存在)。
(1)呋喃的制备
17.2 杂环化合物的结构与芳香性
(1)五元杂环化合物——呋喃、噻吩、吡咯的结构 五个原子处于同一平面;有一个闭合的共轭体系。
呋喃:p(2), sp2(1,1,2)
• 杂原子的未共用电子对参加了 芳香性的六电子体系的形成。 体系符合4n+2休克尔规则。
吡咯:p(2), sp2(1,1,1)
•杂原子的未共 用电子对参加了 芳香性的六电子 体系的形成。体 系 符 合 4n+2 休 克 尔规则。
• 由于芳杂环中电子的离域作用,环中的单、双键与孤立的单、 双键不同:
• 共振式的叠加来表示,如吡咯:
• 芳香族化合物的电荷分布:
• 环上碳原子电荷密度比苯大的称为多芳杂环,通常为五元芳杂 环;比苯小的,称为缺芳杂环,六元杂环。
作业第8题:下列化合物哪些具有芳香性?
N有3个键的,如-NH-,则N为SP2(1,1,1),剩余P=2电子(电子) N有2个键的,如-N=,则N为SP2(1,1,2),剩余P=1电子(电子)
• 已经学过的杂环化合物:
• 本章介绍的是具有不同芳香性的杂环化合物(简称芳杂化 合物)。
17.1 杂环化合物的分类和命名
•按骨架分类:五元杂环、六元杂环;单杂环和稠杂环等。 •命名——按英文音译。常见的杂环有:
吡啶
吡咯
呋喃
噻吩
• 命名1:带有取代基的杂环化合物,以杂环为母体,从杂原子 开始顺着环编号;当环上含有两个或以上相同的杂原子时,应 使杂原子所在位次的数字最小;环上有不同杂原子时,按O、S、 N的次序编号:
(1)存在和制取——存在于煤焦油和页岩油中。 (2)性质 (A)碱性—吡啶环上氮原子有一对未共用电子没参加环上的共轭 体系,因此能与质子结合,具有弱碱性:
• 吡啶容易和SO3结合生成N-磺酸吡啶,作为缓和的磺化剂。
• 吡啶与叔胺相似,可与卤烷结合生成相当于季铵盐的产 物,受热则发生分子重排而生成吡啶的同系物:
噻吩:p(2), sp2(1,1,2)
芳香性程度的比较:
• 呋喃、吡咯、噻吩环中的杂原子上的未共用电子对参与了环 的共轭体系,使环上的电子云密度增大,故比苯容易发生亲电 取代反应,取代通常发生在-位。
芳香性强弱的次序
• 苯 > 噻吩 > 吡咯 > 呋喃
离域能:152 117 88
67 KJ/mol
• 糠醛为没有-氢的醛,其性质与苯甲醛或甲醛相似: A:坎尼扎罗反应(歧化反应)
B:生成-呋喃丙烯酸
普尔金反应 (Perkin)
17.3.3 噻吩
• 噻吩存在于煤焦油的粗苯中,约为粗苯含量的0.5% •在石油和页岩油中也含有噻吩及其同系物。 • 噻吩的结构:
(1)噻吩的制法
方法1
丁烷、丁烯和丁 二烯
(C)氧化与还原——吡啶比苯稳定,不易被氧化剂氧化。吡 啶的同系物被氧化时总是侧链先氧化而芳杂环不破坏,生成相 应的吡啶甲酸:
• 工业上用糠醛(-呋喃甲醛)制备:
• 实验室采用糠酸加热脱羧制得:
(2)化学性质
• 呋喃具有芳香性,较苯活泼,容易发生取代反应;还有一定程 度的不饱和化合物的性质(发生加成反应)。 (A)取代反应—— 位取代
•溴代:
• 硝化(缓和试剂):
• 磺化(缓和试剂):
吡咯与SO3的络合物
• 傅-克酰基化反应 (使用缓和路易斯酸催化剂)
• 命名2:环上只有一个杂原子时,有时也把靠近杂原子的位 置叫位,其次为位,再次为位:
• 含有两个或以上的相同杂原子的单杂环衍生物,编号从连有 取代基(或氢原子)的那个杂原子开始,顺序定位,使另一个 杂原子的位次保持最小:
命名3:根据相应的碳环来命名。把杂环看作相应碳环中的碳原 子被杂原子取代而形成的化合物,命名时在相应的碳环名称前 加上杂原子的名称:
第十七章 杂环化合物
Homework(P429~430)
5、(1)(2)(4)(5) 7、 10、 11。
•一般把除碳以外的成环原子叫杂原子,常见的杂原子有氧、 硫和氮:
• 环系中可含一个、两个或多个相同或不同的杂原子。 •环可以有三元环、四元环、五元环、六元环或更大,可以 是稠合的环。 • 杂环化合物种类繁多,约占全部已知有机化合物的 三分之一。
(B)加成反应 呋喃具有共轭双键的性质(双烯合成)
•在催化剂作用下,呋喃加氢生成四氢呋喃 (优良的溶剂和有机原
料):
无芳学名: -呋喃甲醛。制造糠醛树脂等。 (1)糠醛的制法(麦杆、花生壳、甘蔗渣等含多缩戊糖 的物质):
(2)性质和用途
• 糠醛在醋酸存在下与苯胺作用显红色—检验糠醛; • 糠醛可发生银镜反应; • 糠醛具有一般醛基的性质:
方法2 方法3——实验室制法
(2) 噻吩的性质
亲电取代发生在 位
傅-克反 应
17.3.4 吡咯
• 吡咯的制备
(A)弱酸性
(B)取代反应
四碘吡咯常用来代替碘仿作伤口消毒剂.
偶合反应
17.3.5 吲哚 ——苯并吡咯
• 吲哚的结构 • 异吲哚的结构
N H
NH
17.4 六元杂环化合物 17.4.1 吡啶
• 吡啶与酰氯作用生成盐,是良好的酰化剂:
(B)取代反应—亲电取代反应与硝基苯类似,发生在位;较 苯难磺化、硝化和卤化。
吡啶不能起傅-克反应
亲电取代 位取代
• 与硝基苯相似:吡啶与强的亲核试剂起亲核取代反应,主要 生成取代产物(齐齐巴宾反应):
强的亲核试剂
亲核取代 取代产物
• 与2-硝基氯苯相似,2-氯吡啶与碱或氨等亲核试剂作用,可 生成相应的羟基吡啶或氨基吡啶:
