化工分离工程例题 天大第一版 陈洪钫
天大分离工程试题库-(填写答案版)

118.吸附负荷曲线是分析( 119.透过曲线是以(时间 120. 121. 122. 透过曲线是分析(
透过曲线是以(流出物中吸附剂的浓度
透过曲线与吸附符合曲线是(镜面对称相似关系)相似关系。
6
第二部分 选择题
1. 计算溶液泡点时,若 K i X i 1 0 ,则说明 C a.温度偏低 b.正好泡点 c.温度偏高 2. 在一定温度和压力下,由物料组成计算出的 K i X i 1 0 ,且 Z i / K i 1 ,该 进料状态为 C a.过冷液体 b.过热气体 c.汽液混合物 3. 计算溶液露点时,若 yi / K i 1 0 ,则说明 22 A a.温度偏低 b. 正好泡点 c.温度偏高 4. 进行等温闪蒸时,对满足什么条件时系统处于两相区 22A a. K i Z i 1且 Z i / K i 1 b. K i Z i 1且 Z i / K i 1 c. K i Z i 1且 Z i / K i 1 d.
70. 低压下二元非理想农液的对挥发度 α12 等于( 71. 气液两相处于平衡时, ( 73. 逸度是(修正的 )压力
72. Lewis 提出了等价于化学位的物理量( 逸度) 。 74. 在多组分精馏中塔顶温度是由( 75. 露点方程的表达式为( ΣKixi=1 76. 泡点方程的表达式为( 露点议程)方程求定的。 ) )
3
)方程求 V j ,由( S )方程求 T j 。
41. 对窄沸程的精馏过程,其各板的温度变化由(组成的改变)决定,故可由(相
51. 为表示塔传质效率的大小,可用(级效率)表示。 52. 对多组分物系的分离,应将(分离要求高 )或(最困难)的组分最后分离。 )所消耗的净功之比。 53. 热力学效率定义为(系统)消耗的最小功与(过程 耗的功。 55. 在相同的组成下,分离成纯组分时所需的功(大于)分离成两个非纯组分时 所需的功。 56. 超临界流体具有类似液体的(溶解能力)和类似气体的(扩散能力) 。 57. 泡沫分离技术是根据(表面吸附)原理来实现的,而膜分离是根据(膜的选 择渗透作用)原理来实现的。 58. 新型的节能分离过程有(膜分离) 、 (吸附分离) 。 59. 常用吸附剂有(硅胶) , (活性氧化铝) , (活性炭 61. 离程分为( 机械分离 62. 传质分离过程分为( 63. 分离剂可以是(能量 64. 机械分离过程是( )和( 传质分离 ) 。 ) 。 ) 。 60. 54A 分子筛的孔径为( 5 埃 ) ,可允许吸附分子直径(小于 5 埃)的分子。 )两大类。 速率控制过程)两大类。 平衡分离过程 )和( )和(物质 吸收、萃取) 。 吸收、萃取) 。膜分离。渗透。
化工分离过程课件陈洪钫,刘家祺编第一章绪论

1.2.2 速率分离过程
膜分离 热扩散
速率分离:
在某种推动力(浓度差、压 力差、温度差、电位差等)的 作用下,有时在选择性膜的 配合下,利用各组分扩散速 率的差异实现组分的分离。
微孔过滤(MF):
目的:溶液脱离子,气体脱离子
进料
颗粒、纤维
(液体和气体)
溶剂、水、 气体
推动力:压力差(~100kPa) 传递机理:筛分 膜类型:多孔膜
超滤(UF):
目的:溶液脱大分子,大分子溶液脱小分子,大 分子分级。
进料
胶体大分子
溶剂、水
推动力:压力差(100~1000kPa) 传递机理:筛分 膜类型:非对称性膜
反渗透(RO):
目的:溶剂脱溶质,含小分子溶质溶液浓缩。
进料
溶质、盐 溶剂、水
推动力:压力差(1000~10000kPa) 传递机理:优先吸附毛细管流动溶解、扩散模型 膜类型:非对称性膜或复合膜
本课程的任务和内容
■地位:专业基础课 ■前期课程:
物理化学、化工原理、化工热力学 ■重点: 1.基本概念的理解
2.讨论各种分离方法的特征 3.对设计、分析能力的训练 4.提高解决问题能力
一般化工生产过程:
煤
石油
化
天然气
工 原
反应
分离
产 品
生物物质
料
第一章 绪论
第一节 分离过程在化工生产中的重要性
(蒸汽压)化装置主
(MSA);有较大差 蒸塔顶产
加入热量 别
物中回收
L
(ESA)
乙烷及较
轻的烃。
萃
取
MSA
或 L或V 共
沸
精
馏
化工分离工程试题库 -

分离工程试题库目录第一部分填空题 (1)第二部分选择题 (3)第三部分简答题 (7)第四部分计算题 (9)第一部分填空题1. 传质分离可分为和。
2 分离过程常见的开发方法有和。
3.相平衡关系的表示方法有、、。
4.精馏的数学模型有、、、。
5.产生恒沸物的原因是,二元恒沸物的判别式为。
6.在萃取精馏中,为使分离效果较好,所选溶剂与塔顶产品形成,与塔釜产品形成,常用的方法是。
7.常用的解吸方法有、、。
8.与物理吸收相比较,化学吸收平衡分压,推动力,溶解度,传质系数。
9.解吸操作中,解吸因数S 解吸分率β,解吸操作方能进行,当S增加时,β,理论板数。
10.在液流主体进行缓慢化学反应的吸收过程,传质速率由决定。
11. 衡量分离的程度用表示,处于相平衡状态的分离程度是。
12. 汽液相平衡是处理过程的基础,相平衡的条件是。
13. 当混合物在一定的温度、压力下,满足条件即处于两相区,可通过计算求出其平衡汽液相组成。
14.萃取精馏塔在萃取剂加入口以上需设。
15. 最低恒沸物,压力降低是恒沸组成中汽化潜热的组分增加。
16.吸收因子为,其值可反应吸收过程的。
17. 吸收剂的再生常采用的是,,。
18. 精馏塔计算中每块板由于改变而引起的温度变化,可用确定。
19. 用于吸收过程的相平衡关系可表示为。
20. 多组分精馏根据指定设计变量不同可分为型计算和型计算。
21. 在塔顶和塔釜同时出现的组分为。
22. 吸收的相平衡表达式为,在操作下有利于吸收,吸收操作的限度是。
23. 解吸收因子定义为,由于吸收过程的相平衡关系为。
24. 精馏有个关键组分,这是由于的缘故25. 采用液相进料的萃取精馏时,要使萃取剂的浓度在全塔内为一恒定值,所以在进料。
26.原溶液为非理想型较强的物系,则加入萃取剂起作用。
27.提高萃取剂的选择性,可萃取剂的浓度。
28.在多组分精馏计算中为了给严格计算提供初值,通常用或方法进行物料预分布。
29.通过精馏多级平衡过程的计算,可以决定完成一定分离任务所需的,为表示塔实际传质效率的大小,则用加以考虑。
“化工分离过程”考资料资料精

“化工分离过程”考资料1. 陈洪钫. 基本有机化工分离工程. 北京: 化学工业出版社, 1981.2. 陈洪钫, 刘家祺. 化工分离过程. 北京: 化学工业出版社, 1995.3. 刘家祺, 姜忠义, 王春艳. 分离过程与技术. 天津: 天津大学出版社, 2001.4. 刘家祺. 分离过程. 北京: 化学工业出版社, 2002.5. 李淑芬, 姜忠义. 高等制药分离工程. 北京: 化学工业出版社,2004.6. 刘家祺. 传质分离过程. 北京: 高等教育出版社, 2005.7. 刘家祺. 分离过程与模拟. 北京: 清华大学出版社, 2007.8. 史季芬. 多级分离过程——蒸馏、吸收、萃取、吸附. 北京: 化学工业出版社, 1991.9. 吴俊生, 邓修等. 分离工程. 上海: 华东化工学院出版社, 1992.10. 郁浩然. 化工分离工程. 北京: 中国石油出版社, 1992.11. 蒋维钧. 新型传质分离技术. 北京: 化学工业出版社, 1992.12. (日)大矢晴彦著,张瑾译. 分离的科学与技术. 北京: 中国轻工业出版社 1999.13. 邓修,吴俊生. 化工分离工程. 北京: 科学出版社, 2000.14. 耿信笃. 现代分离科学理论导引. 北京: 高等教育出版社, 2001.15. (美)塞德等,分离过程原理. 北京: 化学工业出版社,2002.16. 袁惠新. 分离工程. 北京: 中国石化出版社, 2002.17. 伍钦. 传质与分离工程. 广州: 华南理工大学出版社, 2005.18. 陈欢林. 新型分离技术. 北京: 化学工业出版社, 2005.19. 宋海华. 多级分离理论(一)精馏模拟. 天津: 天津大学出版社, 2005.20. 丁玉明. 现代分离方法与技术. 北京: 化学工业出版社, 2006.21. 郁浩然. 化工分离工程,北京: 中国石化总公司情报研究所出版社, 2006.22. 胡小玲, 管萍. 化学分离原理与技术. 北京: 化学工业出版社, 2006.23. 蒋维均, 余立新. 新型传质分离技术(第二版). 北京: 化学工业出版社, 2006.24. 西德尔, 亨利著; 朱开宏, 吴俊生译. 分离过程原理. 上海: 华东理工大学出版社, 2007.25. 袁惠新. 分离过程与设备. 北京: 化学工业出版社, 2008.26. 小岛和夫著; 傅良译. 化工过程设计的相平衡. 北京: 化学工业出版社, 1985.27. 张建侯, 许锡恩. 化工过程分析与计算机模拟. 北京: 化学工业出版社, 1989.28. 时钧, 汪家鼎, 余国琮, 陈敏恒. 化学工程手册. 第二版. 北京: 化学工业出版社, 1996.29. 倪进方. 化工过程设计, 北京: 化学工业出版社, 2001.30. 杨志才. 化工生产中的间歇过程-原料、工艺及设备. 北京: 化学工艺出版社, 2001.31. 武汉大学编写组. 化学工程基础, 北京: 高等教育出版社, 2002.32. 顾觉奋. 分离纯化工艺原理. 北京: 中国医药科技出版社, 2002.33. (美)吉科利斯著,齐鸣斋译. 传递过程与分离过程原理. 上海: 华东理工大学出版社, 2007.34. 刘茉娥. 膜分离技术. 北京: 化学工业出版社, 1998.35. 王湛. 膜分离技术基础. 北京: 化学工业出版社, 2000.36. 时钧, 袁权, 高从堦. 膜技术手册. 北京: 化学工业出版社, 2001.37. 徐南平, 邢卫红, 赵宜江. 无机膜分离技术与应用. 北京: 化学工业出版社, 2003.38. 任建新. 膜分离技术及其应用. 北京: 化学工业出版社,2003.39. 于丁一,宋澄章,李航宇. 膜分离工程及典型设计实例. 北京: 化学工业出版社, 2005.40. 许振良, 马炳荣. 微滤技术与应用. 北京: 化学工业出版社, 2005.41. 王湛, 周翀. 膜分离技术基础(第二版) . 北京: 化学工业出版社, 2006.42. 陈观文. 分离膜应用与工程案例. 北京: 国防工业出版社, 2007.43. 高自立, 孙思修, 沈静兰. 溶剂萃取化学. 北京: 科学出版社, 1991.44. 陈维枢. 超临界流体萃取的原理和应用. 北京: 化学工业出版社, 1998.45. 张镜 . 超临界流体萃取. 北京: 北京化学工业出版社, 2000.46. 朱自强. 超临界流体技术—原理和应用. 北京: 北京化学工业出版社, 2000.47. 汪家鼎, 陈家镛. 溶剂萃取手册. 北京: 北京化学工业出版社, 2001.48. 戴猷元. 新型萃取分离技术的发展及应用. 北京: 化学工业出版社, 2007.49. 孙彦. 生物分离工程. 北京: 化学工业出版社, 1998.50. 毛忠贵. 生物工业下游技术. 北京: 中国轻工业出版社, 1999.51. 欧阳平凯. 生物分离技术. 北京: 化学工业出版社, 1999.52. 严希康. 生化分离工程 . 北京: 化学工业出版社, 2000.53. 严希康. 生化分离工程. 北京: 化学工业出版社, 2001.54. 孙彦. 生物分离工程(第二版. 北京: 化学工业出版社, 2005.55. 卢鲜花. 中药有效成分提取分离技术. 北京: 化学工业出版社, 2005.56. 刘小平, 李湘南,徐海星. 中药分离工程. 北京: 化学工业出版社, 2005.57. 曹学君. 现代生物分离工程. 上海: 华东理工大学出版社, 2007.58. 谭天伟. 生物分离技术. 北京: 化学工业出版社, 2007.59. 辛秀兰. 生物分离与纯化技术. 北京: 科学出版社, 2008.60. 田瑞华. 生物分离工程. 北京: 科学出版社, 2008.61. 丁绪淮, 谈遒. 工业结晶. 北京: 化学工业出版社, 1985.62. 冯霄, 李勤凌. 化工节能原理与技术. 北京: 化学工业出版社, 1998.63. 褚良银等. 旋转流分离理论. 北京: 冶金工业出版社, 2002.65. 陈翠仙, 韩宾兵, 朗宁威 . 渗透蒸发和蒸气渗透. 北京: 化学工业出版社, 2004.66. (英])什顿,沃德, 霍尔迪奇著; 朱企新译. 固液两相过滤及分离技术(第2版) . 北京: 化学工业出版社, 2005.67. 蒋培华. 反应与分离工程基础. 北京: 中国石化出版社, 2008 .68. King C J. Separation Processes, 2nd. New York : McGraw Hill, 1980.69. Henley E J, Seader J D. Equilibrium Stage Separation in Chemical Engineering. New York : John Wiley&Sons, 1981.70. Rousseau R W. Handbook of Separation Process Technology. New York: John Wiley & Sons, 1987.71. Wankat P C. Equilibrium-Stage Separations in Chemical Engineering. New York : Elsevier, 1988.72. Wankat P C. Rate-Controlled Separations. New York : Elsevier Applied Science, 1990.73. Schweitzer P. Handbook of Separation Technique for Chemical Engineers, 3rd ed. New York : McGraw Hill, 1997.74. Seader J D, Henley E J. Separation Process Principles. New York : John Wiley & Sons, 1998.75. Clifton E. Meloan. Chemical Separations: Principles, Techniques and Experiments (Techniques in Analytical Chemistry) . Wiley-Interscience, 1999.76. Christie John Geankoplis. Transport Processes and Separation Process Principles (Includes Unit Operations) (4th Edition) . New Jersey, 2003.77. Phillip C. Wankat,Separation Process Engineering (2nd Edition). Prentice Hall PTR,2006.78. Michael E. Prudich, Huanlin Chen, Tingyue Gu, Ram B. Gupta, Keith P. Johnston, Herb Lutz, Guanghui Ma, Zhiguo Su . Perry's Chemical Engineers' Handbook 8/E Section 20:Alternative Separation Processes . McGraw-Hill Professional, 2007.79. Robinson C S, Gilliland E R. Elements of Fractional Distillation, 4th ed. New York : McGraW-Hi11, 1950.80. Smith B D. Design of Equilibrium Stage Processes. New York : McGraw-Hill, 1963.81. McCade W L, Smith J C. Unit Operation of Chemical Engineering. New York : McGram Hill, 1976.82. Broul M, Nyvlt K, Sohnel O. Solubilities in Binary Aqueous Solution. Prague : Academia, 1981.83. Lo T C, Baird M I, Hanson C. Handbook of Solvent Extraction. New York : John Wiley&Sons, 1983.84. Walas S M. Phase Equilibria in Chemical Engineering. Boston : Butterworths, 1985.85. Yang R T. Gas Separation by Adsorption Processes. Boston : Butterworths, 1987.86. Duong D D. Adsorption Analysis: Equilibria and Kineties. New York : Lmperial College Press, 1988.87. Myerson A S. Handbook of Industrial Crystallization. Boston : Butterworth-Heinemann, 1992.88. Thornton J D. The Science and Practice of Liquid-Liquid Extraction. Oxford : Oxford Press, 1992.89. Garside J. Separation Technology: The Next Ten Years. London : Institution of Chemical Engineers, 1994.90. Ruthven D M, Farooq S, Kanebel K S. Pressure Swing Adsorption. New York : VCH, 1994.91. Diwekar M U. Batch Distillation. US: Taylor&Francis, 1995.92. Michael C. Flickinger. Encyclopedia of bioprocess technology: fermentation, biocatalysis and bioseparation. New York : John Wiley&Sons, 1999.93. Antonio A. Garcia, Mathew R. Bonen. Bioseparation Process Science. Blackwell Science Inc, 1999.94. Seider W D, Seader J D, Lewin D R. Process design principles:synthesis, analysis,and evaluation. 北京: 化学工业出版社, 2002.95. Jones A G. Crystallization Process Systems. Boston : Butterworth-Heinemann, 2002.96. David Baldacci ,Split Second,艺州出版社, 2004.97. J.M. Smith, Hendrick C Van Ness, Michael Abbott. Introduction to Chemical Engineering Thermodynamics. McGraw-Hill, 2004.98. Richard M. Felder, Ronald W. Rousseau. Elementary Principles of Chemical Processes. Wiley, 2004.99. F. B. Petlyuk. Distillation Theory and its Application to Optimal Design of Separation Units . Cambridge University Press, 2004.100. J. D. Seader , Ernest J. Henley. Separation Process Principles,Wiley, 2005.101. Wallace,Woon-Fong Leung. Centrifugal Separations in Biotechnology. Academic Press, 2007.102. Henry Z. Kister, Paul Mathias, D. E. Steinmeyer, W. R. Penney, B. B. Crocker,James R. Fair. Equipment for Distillation, Gas Absorption, Phase Dispersion, and Phase Separation . McGraw-Hill Professional, 2007.网上资源:1. 泡露点及闪蒸过程计算Free Software about bubble point and dew point1.1 Flash Calculator/chemsim.htm#FTTech("FLSC") is a self-contained, easy-to-use product for getting single flash solutions and bubble or dew points. It contains Digital Analytics' vapor-liquid equilibrium database and modelling methodology which includes Peng-Robinson EOS, UNIFAC, and Wilson methods.1.2 ThermoSolver/education/Thermosolver/ThermoSolver is a software program which accompanies the textbook Engineering and Chemical Thermodynamics by Milo Koretsky. This software allows students to perform complex thermodynamics calculations, and explore thermodynamics for systems which would be impossible to solve without a significant investment in programming.•Thermodynamic properties for 350+ compounds are provided.•Saturation pressure calculator can be used with 338 species in the database. •Solver for the Peng-Robinson and Lee-Kesler equations of state is provided. •Fugacity coefficients can be solved for pure species or mixtures.•Models for Gibbs energy can be fit to isobaric or isothermal vapor-liquid equilibrium data. Sample data sets are provided. The results can be plotted.•Bubble-point and dew-point calculations can be made.•Equilibrium constant (KT) solver is provided.•General chemical reaction equilibria solver is provided.•Equations used in the calculation process can be viewed.1.3 BR AET Calculation Shareware/fractional-distillation/shareware.htmlThis program is a useful utility when estimating boiling points at reduced pressures. It allows the calculation of AET (Atmospheric Equivalent Temperature) by entering the actual temperature and pressure. The actual temperature can be calculated by entering the AET and the actual pressure.2.精馏过程计算2. Free Software about distillation2.1 /McCabe-Thiele.html2.2 Online Calculation of a Binary Distillation Column2.3 Pressure Swing Adsorption Calculator by James Ritter at the University of South CarolinaAdsorption and Chromatography Software at the University of Bath Basic programs and MS Excel spreadsheets employing the tanks in series modelNumerical Simulation of Nonlinear Multicomponent Chromatography Quattro Pro spreadsheet developed by D. D. Frey at UMBC. It's more sophisticated and accurate than the U. of Bath and UMCP software. Assorted online calculators for engineering problems3.膜分离过程计算3. Free Software about Membrane Separation3.1 Membrane Simulator Version 2.0/koros/index.php?do=resources3.2 Membrane Simulation 2.0/Default.asp?Category=Simulation4. 美国麻省理工学院“分离”开放课程网站(1) /OcwWeb/Chemical-Engineering/10-32Spring-2005/CourseHome/(2)/OcwWeb/Chemical-Engineering/10-445Summer-2005/CourseHome/。
《化工分离工程》试卷与答案
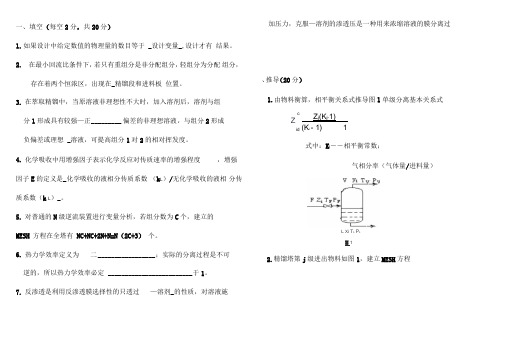
一、填空(每空2分,共20分)1.如果设计中给定数值的物理量的数目等于 _设计变量_,设计才有结果。
2.在最小回流比条件下,若只有重组分是非分配组分,轻组分为分配组分,存在着两个恒浓区,出现在_精镏段和进料板位置。
3.在萃取精镏中,当原溶液非理想性不大时,加入溶剂后,溶剂与组分1形成具有较强—正_________ 偏差的非理想溶液,与组分2形成负偏差或理想 _溶液,可提高组分1对2的相对挥发度。
4.化学吸收中用增强因子表示化学反应对传质速率的增强程度,增强因子E的定义是_化学吸收的液相分传质系数(k L)/无化学吸收的液相分传质系数(k°L)_。
5.对普通的N级逆流装置进行变量分析,若组分数为C个,建立的MESH 方程在全塔有NC+NC+2N+N=N(2C+3)个。
6.热力学效率定义为二_________________ ;实际的分离过程是不可逆的,所以热力学效率必定_________________________ 于1。
7.反渗透是利用反渗透膜选择性的只透过—溶剂_的性质,对溶液施加压力,克服—溶剂的渗透压是一种用来浓缩溶液的膜分离过、推导(20分)1.由物料衡算,相平衡关系式推导图1单级分离基本关系式cZidZ j(K j-1)(K i- 1) 1式中:K i――相平衡常数;气相分率(气体量/进料量)L Xi T L P L團12.精馏塔第j级进出物料如图1,建立MESH方程、简答(每题5分,共25分) 4.在精馏塔中设中间换热器为什么会提高热力学效率?1•什么叫相平衡?相平衡常数的定义是什么?由混合物或溶液形成若干相,这些相保持物理平衡而共存状态。
热力学上看物系的自由焓最小;动力学上看相间表观传递速率为零。
K i=y/X i。
2.关键组分的定义是什么;在精馏操作中,一般关键组分与非关键组分在顶、釜的分配情况如何?由设计者指定浓度或提出回收率的组分。
LK绝大多数在塔顶出现,在釜中量严格控制;HK绝大多数在塔釜出现,在顶中量严格控制;LNK全部或接近全部在塔顶出现;HNK全部或接近全部在塔釜出现。
化工分离工程考试题库

化工分离工程考试题库
1. 请解释传质系数和相对挥发度的概念,并说明它们在化工分离过程中的作用。
2. 请列举并简要描述至少五种常见的化工分离技术,包括其原理和应用领域。
3. 以乙醇和水的蒸馏分离为例,说明常压蒸馏和精馏的区别以及适用条件。
4. 请解释气液平衡和液液平衡的概念,以及它们在化工分离过程中的重要性。
5. 请说明萃取过程的基本原理,以及在化工生产中的应用和优缺点。
6. 请简要描述气相色谱和液相色谱的原理及其在化工分离工程中的应用。
7. 请解释膜分离技术的原理,以及其在化工领域中的优势和局
限性。
8. 以一个具体的工业应用为例,说明冷冻结晶过程的工艺流程和关键操作步骤。
以上题目涉及了化工分离工程中的基本理论和常见技术,希望能够帮助你更好地准备化工分离工程的考试。
如果你有其他问题,欢迎继续提问!。
天津大学化工学院 2003 级化工分离过程期末试卷答案.

天津大学化工学院2003级“化工分离过程”期末试卷答案一概念题(35分)1 填空题(19分)1) 分离过程可分为机械分离和传质分离两大类。
其中传质分离过程的特点是过程中有质量传递现象发生。
常见的传质分离过程有精馏、吸收、萃取。
2) 在泡点法严格计算过程中,除用修正的M-方程计算液相组成外,在内层循环中用S-方程计算级温度,而在外层循环中用H-方程计算汽相流率。
3) 效率常见的表示方法有全塔效率、默弗里板效率和点效率。
4)影响气液传质设备处理能力的主要因素有液泛、雾沫夹带、压力降和停留时间。
5) 常见的精馏节能技术有多效精馏、热泵精馏、采用中间冷凝器和中间再沸器的精馏和SRV精馏。
2选择题(6分)1)常压下a) 物系的相平衡常数更适合于用公式K i = p i s / P计算。
a) 苯-甲苯b) 甲醇-水2)假设相对挥发度与组成关系不大且不同组分的塔板效率相同,通过对若干不同组分系统的精馏计算结果分析研究发现,c) 下组分的分配比接近于实际操作回流比下的组分分配比。
a) 高回流比b) 低回流比c) 全回流d) 最小回流比3)多组分精馏与多组分吸收过程均不能对所有组分规定分离要求,而只能对分离操作中起关键作用的组分即关键组分规定分离要求,其中多组分精馏过程最多只能有 b) 个关键组分,多组分吸收过程最多只能有a) 个关键组分。
a) 1 b) 2 c) 3 d) 44)在二元精馏中,易挥发组分表面张力小于难挥发组分的物系宜采用a) ,反之宜采用b) 。
a) 泡沫接触状态b) 喷射接触状态3判断题(10分)1)分离因子相对于汽液平衡常数而言,随温度和压力的变化不敏感。
(√ )2)若轻、重关键组分是挥发度相邻的组分,则由Underwood公式可得出不止一个R m。
(×)3)由芬斯克公式可看出,最少理论板数与进料组成有关,且公式计算的精确度在很大程度上取决于相对挥发度数据的可靠性。
(×)三 计算题 (40分)1 (6分) 计算塔顶全凝器单元的固定设计变量数和可调设计变量数。
化工分离工程第2章 习 题

第2章 习 题2.11. 计算在0.1013MPa 和378.47K 下苯(1)-甲苯(2)-对二甲苯(3)三元系,当x 1 = 0.3125、x 2 =0.2978、x 3 =0.3897时的K 值。
汽相为理想气体,液相为非理想溶液。
并与完全理想系的 K 值比较。
已知三个二元系的wilson 方程参数(单位: J/mol ):λ12-λ11=-1035.33; λ12-λ22=977.83 λ23-λ22=442.15; λ23-λ33=-460.05 λ13-λ11=1510.14; λ13-λ33=-1642.81在T =378.4 K 时液相摩尔体积(m /kmol )为:=100.91×10 -3 ;=177.55×10 -3 ; =136.69×10 -3安托尼公式为(p :Pa ; T :K ):苯:1n =20.7936-2788.51/(T -52.36); 甲苯:1n=20.9065-3096.52/(T -53.67);对 -二甲苯:1n=20.989 1-3346.65/(T -57.84);2.11.答案解: 由Wilson 方程得:Λ12=l lV V 12exp[-(λ12-λ11)/RT]=331091.1001055.177⨯⨯×exp[-(1035.33)/(8.314×378.47)]=2.4450Λ21=0.4165Λ13=0.8382 Λ31=1.2443 Λ23=0.6689 Λ32=1.5034ln γ1=1-ln(Λ12X 2+Λ13X 3)-[323121221X X X Λ+ΛΛ+232131331X X X Λ+ΛΛ ]=0.0497γ1=1.0509同理,ln γ2=0.05148, γ2=1.6732 ln γ3=0.4190, γ3=1.5203lnP 1S =20.7936-2788.51/(378.47-52.36)=12.2428, P 1S =0.2075Mpa lnP 2S =20.9062-3096.52/(378.47-53.67)=11.3729, P 2S =0.0869Mpa lnP 3S =20.9891-3346.65/(378.47-57.84)=10.5514, P 3S =0.0382Mpa作为理想气体实际溶液,K 1=PP S11γ=2.134,K 2=1.4354, K 3=0.2733 若完全为理想系,K 1=PP S 1=2.0484K 2=0.8578 K 3=0.37712.在361K 和4136.8kPa 下,甲烷和正丁烷二元系呈汽液平衡,汽相含甲烷0.60387%( mol ),与其平衡的液相含甲烷0.1304%。
化工分离工程第3章答案

3.1—1解①无解;②有唯一解;③多解。
3.1—2:解3.1—3:解3.1—4解 3.1—5解解:以100摩尔进料为计算基准。
根据题意定甲苯为轻关键组分,异丙苯为重关键组分。
从相对挥发度的大小可以看出,二甲苯为中间组分。
在作物料衡算时,要根据它的相对挥发度与轻、重关键组分相对挥发度的比例,初定在馏出液和釜液中的分配比,并通过计算再行修正。
物料衡算表如下:组分进料,f 1馏出液,d i釜液,w iB 20 20 — T 30 35—0.03W0.003W X 101*9*C10040 D 0015.0 W0015.040-*为二甲苯的初定值。
解得 D=50.929,W=49.071 则 d T =29.853,w T =0.147 d C =0.0764,w C =39.924 代入式(3-9)42.721.00.1lg 924.390764.0147.0853.29lg =⎪⎭⎫ ⎝⎛⎥⎥⎦⎤⎢⎢⎣⎡⎪⎭⎫ ⎝⎛⎪⎭⎫ ⎝⎛=m N由N m 值求出中间组分的馏出量和釜液量:519.021.033.0924.390764.0121.033.0924.390764.01042.742.7=⎪⎭⎫ ⎝⎛⎪⎭⎫ ⎝⎛+⎪⎭⎫ ⎝⎛⎪⎭⎫ ⎝⎛⨯=x dw x =10-0.519=9.481由于与初定值偏差较大,故直接迭代重做物料衡算:组分进料,f 1馏出液,d i釜液,w i B 20 20 — T 30 30—0.03W 0.003W X 100.5199.481C10040D D 0015.0WD0015.040-二次解得 D=50.446,W=49.554 则 d T =29.852,w T =0.148 d C =0.0757,w C =39.924 再求N m :42.721.00.1lg 924.390757.0148.0852.29lg =⎪⎭⎫ ⎝⎛⎥⎥⎦⎤⎢⎢⎣⎡⎪⎭⎫ ⎝⎛⎪⎭⎫ ⎝⎛=m N校核d x :515.021.033.0924.390757.0121.033.0924.390757.01042.742.7=⎪⎭⎫ ⎝⎛⎪⎭⎫ ⎝⎛+⎪⎭⎫⎝⎛⎪⎭⎫ ⎝⎛⨯=x d再迭代一次,得最终物料衡算表:组分 进料,f 1 馏出液,d i釜液,w i 苯 20 20 — 甲苯 30 29.8513 0.1487 二甲苯 10 0.5150 9.4850 异丙苯400.075739.92433.2—9解解:查苯、甲苯、联苯的Antone 方程参数得t KPa)/log(*+-=C BA PABC苯 6.060395 1225.188222.155 甲苯6.086576 1349.15 219.9785 联苯6.36881997.558202.608估算塔顶温度88.5℃,则苯、甲苯的饱和蒸汽压分别为130.7702、51.6425KPa ,根据p p K *=求得两者的分配系数分别为1.0059、0.3972。
化工分离工程第7章习题

2•对如下闪蒸操作计算:① 有效能改变(T0 =311K);②净功耗
H2
N2
苯
环己烷
温度K
压力kPa
焓kJ/h
熵kJ/hxk
解:
(1)已知To=311K,
311X =
Bf=H=-T)Sf=—311X =
D=++=h
习题2附图
流率kmol/h
1.在环境状态下,将含有35%(摩尔)丙酮的水溶液分离成99%(摩; 的水。 ①若丙酮和水被认为是理想溶液,计算以1kmol进料为单位的最小功; 活度系数用Van Laar方程联立,其常数A?=,A=(丙酮组分为1),
解:
(1)丙酮和水生成理想溶液,以1h为标准,
设料液量为1kmol,计算两股产品nQ1和nQ2
nQ1+nQ2=1
nQ1x99%+乐x2%=K35%
联立解得%1=h,nQ2=h
分离最小功的计算:
Wn
(2)应用VanLaar方程计算液相活度系数
2.0
(1
进料:m1=1.70.65=,同理ln2=
99% 丙酮流股:ln1=x10-4,ln2=
98% 水流股:ln1=,ln2=x10-4
Wn= x298x{x[x+x10 -4)+x+]+x[x+x10 -4)+x+]—[x++
物流
物流2
1
0
物流
物流2
1
322322
2068
进料1-F,馏出物2-D,釜液3-W
物流3
物流3
322
10年真题(天大化工)

一、【基本题(单选与填空)】1.在一定温度下,测得某液体的粘度为1.0cp,其折合成___Pa.s (2分)2.某二维流场的速度分布方程可表示为:Ux= -ax-bθˆ2,Uy=ax+ay(其中a,b为常数,θ为时间)。
若该流动为稳态(定态,定常)流动,则b的数值为__(2分)3.用离心泵输送某液体,当离心泵出口调节阀开度关小时,管路系统的总压头损失将增加,离心泵的轴功率将()A 增加B 减小 C不变 D可能增加,也可能减小4.在工程设计中,水及低粘度液体在管内的流速一般可在()m/s范围内选择A. 0.5-1.0B. 1.0-3.0C.10-20D. 40以上5.用转子流量计测量流量,流量计应()A 竖直安装,流向自下而上 B竖直安装,流向自上而下C 水平安装,流向以方便操作为准D 竖直水平安装均可,视现场而定6.在流体输送设计中,经计算某离心泵的允许安装高度为10.0M,为安全起见,实际安装高度一般不超过()M7.离心通风机的风量是指()A 单位时间内从风机出口排出的以出口状态计的气体体积B 单位时间内从风机出口排出的以进口状态计的气体体积C 单位时间内从风机出口排出的以标准状态计的气体体积D 单位时间内从风机出口排出的气体质量8.一般地,在旋风分离器,旋液分离器和离心机中,离心分离因数较高的是()9.对于多层平壁式一维稳态导热,各层内的温度梯度随其导热系数(热导率)的增加而()10.一般的,金属材料的热导系数随温度的升高而()11.在B,S部分互溶的溶液中加入溶剂A,则BS的互溶度将()12.某二元理想溶液的连续精馏过程,塔顶采用全凝器,塔釡采用直接蒸汽加热,用M-T 法图解得到的理论板数是10.若操作条件下全塔效率为50%,则塔内应安装___块塔板13.在吸收塔内用1mol/l的NaOH溶液吸收空气中的CO2,该过程属于___膜控制14.用纯溶剂S萃取分离AB混合物,已知BS不互溶,操作条件下平衡关系为Y=1.5X(均为质量比,若要求萃余相中溶质含量为原料中溶质含量的4%,则操作中单位质量稀释剂B 中溶剂S的消耗量为___15.在填料塔计算中,等板高度的含义是___.现在需要设计一板式塔完成给定精馏任务,请给出三种由于设计时考虑不周,使精馏塔发生液泛的情况___ ____ _____16现在需要设计一板式塔完成给定的精馏任务,请给出三种由于设计时考虑不周而使精馏塔发生液泛的情况:________,_________和_________.17.两种物料,A烟草,B陶土,现将两种物料用相同的干燥器,在相同的条件下进行干燥,则在恒速干燥阶段干燥速率Ua()UbA大于B小于C等于D无法确定18.已知湿空气的如下两个参数,可以利用H-I图查出其它参数的是()A湿度和水分分压B干球温度和湿球温度C露点和水汽分压D焓和湿球温度19.气体通过一层塔板的压降包括()()和()20.在吸收系数的关联式中,能反映流体五项对吸收系数影响的数群是()AShB.GaC.ScD.Gc二、【流体输送】附图A附图B如图所示,高位槽中某液体经一管路系统流入低位槽中,在球阀C全开时,液体流量为30 m3 /h,此时U形管压差计的读数为50.0mm。
化工分离工程试题库 -

化工分离工程试题库 -分离工程试题库I目录第一部分填空题 ........................................................................... ........... 1 第二部分选择题 ........................................................................... ........... 3 第三部分简答题 ........................................................................... ........... 7 第四部分计算题 ........................................................................... .. (9)II第一部分填空题1. 传质分离可分为和。
2 分离过程常见的开发方法有和。
3.相平衡关系的表示方法有、、。
4.精馏的数学模型有、、、。
5.产生恒沸物的原因是,二元恒沸物的判别式为。
6.在萃取精馏中,为使分离效果较好,所选溶剂与塔顶产品形成,与塔釜产品形成,常用的方法是。
7.常用的解吸方法有、、。
8.与物理吸收相比较,化学吸收平衡分压,推动力,溶解度,传质系数。
9.解吸操作中,解吸因数S 解吸分率β,解吸操作方能进行,当S增加时,β ,理论板数。
10.在液流主体进行缓慢化学反应的吸收过程,传质速率由决定。
11. 衡量分离的程度用表示,处于相平衡状态的分离程度是。
12. 汽液相平衡是处理过程的基础,相平衡的条件是。
13.当混合物在一定的温度、压力下,满足条件即处于两相区,可通过计算求出其平衡汽液相组成。
14. 萃取精馏塔在萃取剂加入口以上需设。
15. 最低恒沸物,压力降低是恒沸组成中汽化潜热的组分增加。
化工分离过程(陈洪钫刘家祺著)课后习题答案下载

化工别离过程(陈洪钫刘家祺著)课后习题答案下载化工别离过程这本书为高等学校化学工程与工艺专业教学指导委员会根据化学工程与工艺专业的教学方案,组织编写的专业根底课教材。
以下是由关于化工别离过程(陈洪钫刘家祺著)课后习题答案下载地址,希望大家喜欢!第一章绪论第一节别离操作在化工生产中的重要性第二节传质别离过程的分类和特征1.2.1平衡别离过程1.2.2速率别离过程第三节本课程的任务和内容参考文献第二章单级平衡过程第一节相平衡2.1.1相平衡关系2.1.2相平衡常数的计算第二节多组分物系的泡点和露点计算2.2.1泡点温度和压力的计算2.2.2露点温度和压力的计算第三节闪蒸过程的计算2.3.1等温闪蒸和局部冷凝过程2.3.2绝热闪蒸过程本章符号说明参考文献习题第三章多组分多级别离过程分析与简捷计算第一节设计变量3.1.1单元的设计变量3.1.2装置的设计变量第二节多组分精馏过程3.2.1多组分精馏过程分析3.2.2最小回流比3.2.3最少理论塔板数和组分分配3.2.4实际回流比和理论板数第三节萃取精馏和共沸精馏3.3.1萃取精馏3.3.2共沸精馏第四节吸收和蒸出过程3.4.1吸收和蒸出过程流程3.4.2多组分吸收和蒸出过程分析3.4.3多组分吸收和蒸出的简捷计算法3.4.4化学吸收第五节萃取过程3.5.1萃取流程3.5.2逆流萃取计算的集团法本章符号说明参考文献习题第四章多组分多级别离的严格计算第一节平衡级的理论模型第二节逐级计算法第三节三对角线矩阵法4.3.1方程的解离方法和三对角线矩阵方程的托玛斯解法4.3.2泡点法(BP法)4.3.3流率加和法(SR法)4.3.4等温流率加和法本章符号说明参考文献习题第五章别离设备的处理能力和效率第一节气液传质设备的处理能力和效率5.1.1气液传质设备处理能力的影响因素5.1.2气液传质设备的效率及其影响因素5.1.3气液传质设备效率的估计方法第二节萃取设备的处理能力和效率5.2.1萃取设备的处理能力和塔径5.2.2影响萃取塔效率的因素5.2.3萃取塔效率第三节传质设备的选择5.3.1气液传质设备的选择5.3.2萃取设备的选择本章符号说明参考文献习题第六章别离过程的节能第一节别离的最小功和热力学效率6.1.1等温别离的最小功6.1.2非等温别离和有效能6.1.3净功消耗和热力学效率第二节精馏的节能技术6.2.1精馏过程的热力学不可逆性分析6.2.2多效精馏6.2.3低温精馏的热泵6.2.4设置中间冷凝器和中间再沸器的精馏第三节别离顺序的选择6.3.1简单别离顺序的合成6.3.2复杂塔的别离顺序本章符号说明参考文献习题第七章其它别离技术和别离过程的选择第一节膜别离技术7.1.1别离用膜和膜别离设备7.1.2反渗透7.1.3超滤7.1.4电渗析7.1.5气体膜别离7.1.6液膜别离第二节吸附别离7.2.1吸附原理和吸附剂7.2.2吸附平衡7.2.3吸附速率7.2.4吸附别离工艺简介第三节反响精馏7.3.1反响精馏过程分析7.3.2反响精馏过程的数学模拟第四节别离过程的选择7.4.1可行性7.4.2别离过程的类型7.4.3生产规模7.4.4设计的可靠性7.4.5别离过程的独立操作性能本章符号说明参考文献附录一、多组分闪蒸过程计算源程序二、多组分精馏塔的简捷计算源程序三、多组分精馏塔的泡点法计算源程序四、吸收和蒸出计算的流率加和法源程序看过“化工别离过程(陈洪钫刘家祺著)课后习题答案下载”的人还看了:1.2.3.4.5.。
天津大学化工分离工程教案第7章习题和解答

天津大学化工别离工程教案第7章习题和解答7.1.1最小别离功别离的最小功表示了别离过程耗能的最低限.最小别离功的大小标志着物质别离的难易程度,实际别离过程能耗应尽量接近最小功.图7-1连续稔定别离系统由热力学第一定律:£9做出立十承in out和热力学第二定律〔对于等温可逆过程〕:.=?[处限-»卉]out fn得到等温下稳定流动的别离过程所需最小功的表达式:(7-3 ) 或表示为自由能的形式:[例 7-2] [例 7-3]或表示为逸度的形式:-配7 =依乏几立% In AJ-2 W(2> J In 几・)]一、别离理想气体混合物对于理想气体混合物:一 心?=在4 Z必,此必必,口 一 2%〔Z 必,/111% J 〕】对于由混合物别离成纯组分的情况:在等摩尔进料下,无因次最小功的最大值是0.6931 .对于别离产品不是纯组分的情况:过程的最小别离功等于原料别离成纯组分的最小别离功减去产品别离成纯组分 所需的别离功.[例 7-1]二、别离低压下的液体混合物-吗弧L 灯{JXW风力网-上〕]一[ X 石J 风力,产J 〕]〕out 2in i〔 7-10 〕对于二元液体混合物别离成纯组分液体产品的情况:-忆二一皮阿【“山〔7"%〕+〔 7-11 〕可见,除温度以外,最小功仅决定于进料组成和性质,活度系数大于1的混合物比活度系数小于1的混合物需 较小的别离功.当进料中两组分不互溶时,一 /始07=0 ♦〔7-8〕—=2 % G .5(7-4 )(7-7 )_取.T廿二一[^ 1n 几 F+力(7-9 )7-1. 2非等温别离和有效能当别离过程的产品温度和进料温度不同时,不能用自由能增量计算最小功,而应根据有效能来计算.有效能定义:B=H-T°S ⑴为环境温度)有效能是温度、压力和组成的函数.稳态下的有效能平衡方程:Z %取- Z 叼%•+型冲生=(1 -一所.现正(7-18 )等当功:系统的净功(总功):_阴争=唯一好5=工改配8七_ Z 盯% +/ZS 产生别离+7Jj/S 产生(7-20 )过程可逆时,可得最小别离功:该式说明,稳态过程最小别离功等于物流的有效能增量.71.3热力学效率和净功消耗别离过程的热力学效率:系统有效能的改变与过程所消耗的净功之比.不二^^别离/卜0净〕〔7-22〕普通精饰操作〔图7-2〕过程所消耗的净功:out一%与=独介禽—(7-21a )图7-2普通精慵塔〔7-23〕实际别离过程,热力学效率必定小于1.试求20 -C、101. 3kPa条件下,将Ikmol含苯44% 〔摩尔〕的苯一甲苯溶液别离成纯组分产品所需的最小别离功.解:苯一甲苯溶液可视为理想溶液,,在等温、等压下将Ikmol含苯44%的苯一甲基溶液别离成纯组分所需的最小别离功为:-Wminj & 314)073+40)(l)[0.443n(0.44)+0.561n 3 56)] = 1.671 xlO^kJIh[例7-1]环境温度为294. 4K ,压力lOl.SkPa ,在该环境条件下将流率为600 kmol/h的丙烯-丙烷的混合气体, 连续别离成相同温度、压力下的产品.混合气体中含丙烯0.60 〔摩尔分数〕0别离要求为:①产品为纯丙烯和纯丙烷;②含丙烯99%〔摩尔〕和含丙烷95% 〔摩尔〕的两个物流.确定所需最小功.解:这两个组分在分子结构上相似,且压力为常压,故进料和产品均可看作理想气体.①此物系可以认为是理想气体的混合物,由式〔7-9 〕得,-Wninj =电314〕〔224〕〔60010.601ng60〕+0.401n〔0.40〕] = 9.88x106/11②首先通过物料衡算计算出别离所得两个产品的流率为:含丙烯99%〔摩尔〕的产品流率351.0 kmol/h ;含丙烷95% 〔摩尔〕的产品流率249.0 kmol/h.由式〔7-8 〕得,=〔8314〕〔294.4〕〔〔35 l〕[0.991n〔0.99〕+ O.Olln〔0.01〕]+〔249〕[0.051n〔0.05〕4-0.951n〔0.95〕]- 〔600〕[0,60 In〔0.60〕 + 0.40 In 〔O.4Q〕〕 = 8.19xlO8J/h可见,别离成非纯产品时所需最小功小于别离成纯产品时所需最小功.在环境温度为294.4K ,压力为lOl.SkPa的条件下别离流率为24898kmol/h的甲醇-水混合液体.原料中含甲醇58.07 % 〔摩尔〕所得产品为:含甲醇99.05% 〔摩尔〕的富甲醇产品和含甲稗1.01% 〔摩尔〕的废水.确定过程需要的最小功.解:根据Van Laar方程计算液相活度系数,, 0.25 , 0.20[og ---------- 7- log % = -------- ;—口+ 1.25上『口 + 0.8上『% . 4式中M代表甲醇,W代表水.计算所得活度系数如下:组分原料活度系数g 富甲醇产品废水甲醇 1.08 1.00 1.75水 1.20 1.57 1.00通过物料衡算计算出两个产品的流率为:含甲醇99. 05%〔摩尔〕的产品流率14491 kmol/h :含甲醇1.01% 〔摩尔〕的废水流率10407 kmol/h.计算最小功时,可将式〔7-10 〕分解为一个理想溶液局部和一个由于与理想溶液的偏差而产生的过剩部分之和,最终方程为,-涉…r =尺〞£ .【£殳E In星- -£ %[>苧h % ]〕3 i fx i+曾归嘲X%/ h外,J - 2叫2 F In尸力]) out 2 沏 2(7-12 )代入数据得,=3,8x1010 - 7.086 X109 = 3.101x1010irh可见,由于该物系与理想溶液呈正偏差,使得最小功比理想溶液的减小18.6% o7. 2.1精福塔的多股进料和侧线采出一、多股进料(a)西塔式(七)进料泡混合一塔式(O两段进料一塔式图7-3两种不同浓度进料的精储流程两段进料一塔式别离过程的操作线更接近于平衡线,各平衡级传质和传热的推动力减少,精储过程的热力学效率得以提升,减少了有效能损失.然而由于精馈段操作斜率减小,回流比减小,所需塔板数增加.图7-4 精饰塔McCabo-Thiele 图二、侧线塔以别离三组分混合物为例,假设其中某一个组分的含量很少或者对组分之间的切割要求不严格,那么采用侧线塔代替两个相邻的常规塔,可降低基建投资和操作费用.侧线出料位置:假设第一个塔是A/BC 切割塔,那么改用侧线出料时,侧线出料位置在进料板之下;假设第 一个塔为AB/C 切割塔,那么侧线出料位置在进料板之上.砍掉原第二塔.考察由 C 2馆分生产聚合级乙烯的精情系统的别离流程.原料为脱乙烷塔顶馆分,其中含乙块 0. 72%〔mol 〕,而聚合级乙烯的主要指标为:C2H4含量不低于99.95%; C2H2含量不高于5X10-6 0 为了使乙焕含量合格,必须首先对脱乙烷塔塔顶出料中乙块用催化加氢的方法脱除,加氢反响器出口物料的 组成为:乙烯塔操作压力为2.0MPa,在该操作条件下:解:〔1〕设假设采用乙烯塔侧线出料的流程〔附图1〕,用式〔7-26〕计算乙烯产品中甲烷的最小含量:0.0051(1.49-1)网 的 一 [149(07343) + 0,2606](3.94 一1)在侧线出料中还有C 2 H 6 ,其含量在0.02%-0.04%左右,乙烷和甲烷相加已到达0・1%左右,因此,用侧 线塔的方法不能满足聚合级乙烯规格的要求,必须用两个常规塔:加氢反响器出口物料先进入第二脱甲烷 塔,脱除甲烷后再进入乙烯精饰塔别离乙烯和乙烷,见附图2o例7-5附图1带侧线乙烯精饵塔例7-5附图2第二脱甲烷流程经平衡级计算,两个塔的主要计算结果和消耗的能量见附表10京fi 乙快加不 反城B ・乙烷由农反响ai 出后CH4C2H4C2H6 流率,kmol/h 组成,摩尔%14. 66 0.512097.11 744. 36 73. 4326. 06a = 3.94GM 〞〞= 1.49= 0.06%⑵假设经过工艺改良,使加氢反响器出口物料的组成为:CH 4 C 2 H 4 C 2 H 6 流率,kmol/h 3. 69 2111.6 729. 77 组成,摩尔%0.1374.2225.65在这种情况下,假设直接采用乙烯塔侧线出料,乙烯产品中CH 4最低含量能降低到:0.0013x(1.49-1)(1.49 x Q.7422 + 0.2565)x(3.94 -1)因此,用侧线塔的方案是可行的.经平衡级严格计算得到带侧线的乙烯精饰塔的计算结果见附表lo例7飞附表1乙烯精储系统常规与侧线塔方案比拟工程常规塔方案侧线塔方案第二脱甲烷塔乙烯精慵塔带侧线的乙烯精饵塔塔顶组成:CH 4 %24. 385. 65C 2 H 4 % 75. 6299. 95 94. 34 侧线组成:C 2 H 4 %99. 95CH 4 %塔釜组成:CH 4 % 0. 03 1. 00回流比43. 543. 324.31 塔顶出料流量,kmol/h 56.3 2048.6260. 44 例1线出料流量,kxol/h2048. 62冷凝器物料温度,K 237 242 239 冷剂温度,K 230 230 230 热负荷,10 6 kW 22. 307 82. 343 85. 340 功耗(1) , kW 49451825618920再沸器物料温度,K 253 266 266 冷剂温度,K 273 273 273 热负荷,10 6 kW 10. 285 68. 479 62, 250 功耗⑵,kW -864-5757-5233 总功耗,kW 1657913687kW 计;〔2〕再沸器的冷量回收,每10 6 kW 相当于84kW.由附表1所列数据可知,采用侧线出料的乙烯精馈塔代替第二脱甲烷塔和乙烯塔,节省功耗2892KW.h,占原 方案功耗的17.4%.= 0.016%注MD230K 的冷量功耗按221.7kW/10 67. 2. 2热泵精储7.3.1别离方法的选择和别离顺序数多组分混合物的别离有多个可能的别离流程方案.图7-15三元混合物简单精储塔别离(a)产品组分相对挥发度递降的顺序(b)产品组分相对挥发度递增的顺序对C个组分的物系,欲分禹成C个根本纯的产品,需要C-1个塔,可组合成的流程方案数为: 假设要用一种以上的别离方法,那么别离所需总顺序数S为:图7-5闭式热泵1 一精饰塔,2—冷凝器,S 一再沸器,4一压缩机,5一节流阀.(T :别离方法数).选择别离方法的探试规那么: ①选择具有较大别离因子的别离过程. ②尽量防止极端的过程条件.③当别离过程需要多个别离级时,应优先选择平衡别离过程而不选择速度限制过程. ④当别离因子相同时,选择能量别离剂而不选择质量别离剂.⑤选择别离方法时首先考虑采用精储,只有在精健方案被否认后才考虑其他别离方案.表7-3影响别离因子的物质性质分子性质 受影响的别离过程举例 分子性质 分子量 精储,蒸发,气相扩散 偶极矩、极性 分子形状 吸附,结晶 分子电负荷 分子体积吸附化学活性受影响的别离过程举例 萃取、吸附 电除法、电除雾 化学吸收、反响精懦通过外加功将热量自低位传至高位的系统称为热泵系统. 精储塔的热泵主要有两种形式:(1)闭式热泵:用外界的工作介质为冷剂,液态冷剂在冷凝器中蒸发,使塔顶物料冷凝.汽化后的冷剂进 入压缩机升压,然后在压缩机出口压力下在再沸器将热量传递给塔釜物料,本身冷凝成液体,如此循环不已. 塔内物料与制冷系统的工质两者之间是封闭的系统.图7-6开式热泵7-7制冷循环的压始图1 一精情塔,2—冷凝器,3一再沸密,4一压缩机,5一节流阀.(2)开式热泵:以过程本身的物料为制冷系统的工作介质.其中一种形式是以塔釜物料为工质,在冷凝器汽化,取消再沸器,如图7-6a所示.另一种形式是以塔顶物料为工质,在再沸器冷凝,取消冷凝器,见图7-6b.7. 2.3设置中间冷凝器和中间再沸器的精健增设中间再沸器,把再沸器加热量分配到塔的下段,或者设置中间冷凝器,把冷凝器热负荷分配到塔的上段,都可以取得节省能量的效果.图7-8二级再沸、二级冷凝精馆塔14415 xl8 276^1.0432 xlO"4(fc>节省功耗的百分数=6.432= 15.6%6.697. 2.4精储系统的热集成一、多效精馈①加压一常压;②加压一减压;③常压一减压;④减压一减压. 两效精储操作所需热量与单塔精储相比,可以减少30~40% •图7f 多效精馆的根本流程简单精情塔应设有一个再沸得和一个冷凝器,如果能用物流直接传热来提供热量,那么可砍掉再 沸器和〔或〕冷凝器,实现热耦合.热耦合精用在热力学上是最理想的流程结构,即可节省设备投资,又可节省能耗.所以,这种方 式受到广泛注意和大量研究.但是,至今热耦合精馈并未在工业中获得广泛应用,这是由于在操作中 使主、副塔之间气液分配保持设计值是较困难的;别离难度越大,其对气液分配偏离的灵敏度越大, 操作越难稳定.因此,只对易别离体系推荐采用热耦精馈.嗯龙廿〉苴绰以仆〕①〕平史很1管南段分、麻勒兜分〕线区窟塔轴构图7-12按相对挥发度递降顺序别离产品的简单精储塔热耦合(a)两筒单精饵塔的热耦合(b)侧线精掠塔图7-13按相对挥发度递增顺序别离产品的简单精掠塔热耦合(a)两简单精储塔的热耦合(b)侧线精饰塔[例7-7]有邻、间、对二甲苯混合物欲别离成纯物质,试根据其分子性质选择别离方法.解:表7-S所列各种分子性质中除了分子形状外,邻、间、对二甲苯的其他性质都差异不大,因此可以预计精憎、萃取、吸收等过程都不能有效地将该混合物别离成纯化合物.但随着温度降低,各异构体变成固体后其分子形状的差异比拟显著,故建议采用冷冻结晶别离.各异构体的分子体积、偶极矩和极性也有细小的差异,如果有适当的外加物质能使这些异构体的反响活性有显著差异,或者选择对异构体有较高吸附选择性的吸附剂,那么也可以考虑采取化学反响分离或者吸附别离.7.3.2别离序列确实定常用方法:先用探试规那么产生初始流程,再用调优法加以改良.一、探试合成法到目前为止,探试规那么仅适用于简单清楚切割塔,即只有一个进料,两个出料,进料组分只出现在一个出料中的精饰塔.对于普通精饰塔组成的塔序可从以下探试规那么考虑:〔1〕按相对挥发度递减的顺序逐个从塔顶别离出各组分.〔2〕最难的别离应放在塔序的最后.〔3〕应使每个塔的惚出液与釜液的摩尔流率尽量接近.〔4〕回收率要求高的别离应放在最后.〔5〕进料中含量高的组分尽量提前分出.〔6〕有害组分应先分.〔7〕进入低温别离系统的组分尽量少.[例7-8] [例7T]二、调优合成法调优合成法是以某个初始的流程为根底,经过一系列修正而合成接近最优系统的方法.其具体步噱为:①利用已有的流程,或者根据探试规那么确定初步流程;②根据调优规那么开发当前流程所允许的结构变化;③对得到的各种结构变化进行分析,确定替代方案,选择最好的方案作为改良方案;④以改良的方案为根底,再进行分析,进一步改良,如此反夏进行直到不再改动为止.用于产生一个别离序列所有允许的结构变化的调优规那么,应当具有以下特性:①有效性:根据调优规那么所产生的所有别离序列都应当是可行的;②完备性:从任意初始流程开始,反发应用调优规那么能产生所有可能的流程;③直观合理性:根据调优规那么所产生的流程与当前进行调优的流程没有显著的区别.以下两条规那么完全满足上述三项要求:规那么1:将一个别离任务移至所在别离序列的前一个位置;规那么2:改变一个别离任务的别离方法.[例7-8]将一点类混合物送入精储装置进行别离,各组分的流率为组分丙烷异丁烷正丁烷戊烷己烷庚烷合计流率,kmol/h10101010101060要求产品的指标:丙烷懒分一含丙烷94% 〔摩尔〕;异丁烷情分一含异丁烷94% 〔摩尔〕;正丁烷馆分一含丁烷94% 〔摩尔〕;戊烷储分——含戊烷以上94% 〔摩尔〕;试比拟可行的别离方案.解:根据要求,作粗略的物料衡算:组分丙烷情分异丁烷情分正丁烷馈分kmol/h戊烷惚分C 39.80.2i- C 40.58.90.20.4n"C 40.10.38.5 1.1C 50.39.7C 610.0C 710.0合计10.49.49.031.2如附图所示,可以有五种不同的别离方案.根据沸点差及产品纯度考虑,异丁烷和正丁烷之间别离要求最高,应将其别离放在最后,故(a)、(d)、(e)三种流程可不予考虑.根据产品组成,作流程(b)和(c) 中第一塔与第二塔的物料衡算,如下表所示.与流程(c)相比,流程(b)的蚀出液与釜液之比更接近于1,因此可认为流程(b)可能是较好的方案.第一塔流率,kmol/h第二塔流率,懦出液kmol/h釜液懦出液釜液流程(b)28.831.210.318.5流程(c)10.349.718.531.2例7-8附图不同塔序的别离方案[例7-9]在以柴油为裂解原料的乙烯装置中,来自裂解炉的裂解气经废热锅炉和淬冷器急冷后降温到200 o C 左右进入深冷别离系统,裂解气组成(不计水蒸气)见附表1 °例7-9附表1裂解气组成组分摩尔,% 组分摩尔,%甲烷23.91甲基乙快+丙二烯0. 55乙烯29. 70碳四 5. 42乙烷 6.10碳五0, 82乙焕0. 46碳六一碳八 4.90丙烯11.6燃料油 2. 40丙烷0. 35其它13.79主要别离产品的规格为:①高纯度乙烯乙烯:> 99.95% (mol);乙焕:V 5X10 W ( mol)②高纯度丙烯丙烯>99. 5% (mol):乙烯 V 10 X10 -6 ( mol);乙块 V 1 X10 -6 ( mol);甲基乙快 + 丙二烯 < 5 X10 -6 (mol) •③甲烷宫气甲烷 > 95 % (mol);乙烯<0.2% (mol);④碳三液化气丙饰 < 15% (mol);碳四循分 V 1 % (mol);⑤碳四储分碳三点 < 0.5 % (wt);碳五烧 < 0. 5 % (wt):⑥碳五及汽油慵分碳四点<0-5 %(wt); ASTM 终沸点205 0 C;试以探试法合成可能的别离流程.解:(1)加氢方案产品规格要求乙缺等有害组分的含量极为严格,允许含量为L5X10 -6 .用精馈方法到达这么高的纯度是比拟困难或不经济的,因此应通过催化加氢使乙快转化成乙烯和乙烷.催化加氢有两种工艺,一种是裂解气全馆分加氢,称为前加氢,另一种是碳二储分加氢,称为后加氢.通过催化加氢方法,还可将甲基乙快和丙二烯转化成为丙烯和丙烷,作为液化气使用.(2)轻克分高流程确实定①由于乙烯与乙烷和丙烯与丙烷两个二元混合物中的两组分间沸点差均很小,故这两个二元系统是母难别离的混合物.同时,乙烯与丙烯的回收率要求也最高,因此根据探试规那么(2)和(4),应把乙烯与乙烷的别离和丙烯与丙烷的别离放在最后.②第一个别离塔应如何切割铺分,根据不同的探试规那么可以得出不同的结论:Q)根据探试规那么(1),应采用按沸点由低而高,逐个脱除轻组分的流程,即顺序别离流程.我国从美国鲁默斯公司引进乙烯装置都采用这种流程.缶)根据探试规那么(7),应减少进深冷系统的物料数量,因此第一个塔应是脱乙烷塔,使比碳二重的情分都不进深冷系统,我国吉林化工厂乙烯装置就采用这种前脱乙烷的流程.(C)根据探试规那么(6),应把容易聚合结焦的丁二烯首先别离掉,因此应采用前脱丙烷流程.我国上海石油化工股份公司从日本三菱公司引进的乙烯装置就采用这种流程.美国的斯通韦柏斯特公司和勃朗公司也采用过前脱丙烷流程.上述三种流程能同时存在是由于各自有不同的优缺点,这些优缺点因不同情况而异.由此可见,别离方案的取舍不仅取决于每个塔系本身能耗的上下,而且还取决于不同别离流程所引起的其他工艺局部能耗的变化.因此,别离流程确实定必须结合过程特点对全系统进行分析和计算,才能得出全面而正确的结论.。
化工分离工程_分离过程的分类和特征

改变原溶 液的相对 挥发度
以苯酚作溶 剂由沸点相 近的非芳烃 中分离芳烃 ;以醋酸丁 酯作共沸剂 从稀溶液中 分离醋酸。
返回
1.2.2 速率分离过程
膜分离 热扩散
速率分离:
在某种推动力(浓度差、压 力差、温度差、电位差等)的 作用下,有时在选择性膜的 配合下,利用各组分扩散速 率的差异实现组分的分离。
将过程所产生的废物最大限度地回收和
循环使用。
产品
原
料
1
1
1
废
物 2
废
物 2
排除
2
1—单元过程;2—处理
实现分离与再循环系统使废物最小化的方法: ●废物直接再循环
例:废水
●进料提纯
例:氧化反应采用纯氧
●除去分离过程中加入的附加物质
例:共沸剂、萃取剂
●附加分离与再循环系统
例:分离废物中的有效物,循环使用
被溶解的组分与吸收剂中的活性组分发生反应 ,增加传质推动力。
化学萃取——化学反应与萃取相结合
溶质与萃取剂反应。如:络合反应;水解;聚合
反应(催化)精馏——化学反应与精馏相结合
例:酯化、皂化、酯交换、胺化、水解…
膜反应器——优良分离性能与催化反应相结合
例:利用多孔陶瓷膜催化反应器,进行丁烯脱氢 制丁二烯。丙烷脱氢制丙烯。
上述原因促使:
传统分离过程不断改进和发展 例:反应精馏;吸附;… 新分离方法不断出现和实现工业化应用 例:膜分离;热扩散;色层分离;…
返回
1.2 传质分离过程的分类和特征
一类:机械分离
特点:被分离物为非均相 简单的将混合物分开 如:过滤、沉降…
化工原 理内容
二类:传质分离 包含: 平衡分离过程;速率控制分离 特点:被分离物为均相
08化工分离工程试题(B)

昆明理工大学试卷(B)考试科目:分离工程考试日期:命题教师:贾庆明学院:化学工程学院专业班级:化工081~084 学生姓名:学号:任课教师:贾愚,贾庆明上课班级:化工081~084 考试座位号:一、选择题(不定项选择,每空1分,共13分)1.下列哪一个是速率分离过程()A. 蒸馏B.吸收C.膜分离D.离心分离2.汽液相平衡K值越大,说明该组分越()A. 易挥发B. 难挥发C. 沸点高D. 蒸汽压小3.一定条件下,当把一个溶液加热时,开始产生气泡的点叫作()A. 露点B. 临界点C. 泡点D. 熔点4.设计变量数就是()A.设计时所涉及的变量数B. 约束数C. 独立变量数与约束数的和D. 独立变量数与约束数的差5.当蒸馏塔的产品不合格时,可以考虑()A. 提高进料量B. 降低回流比C. 提高塔压D. 提高回流比6.多组分精馏与多组分吸收过程均不能对所有组分规定分离要求,而只能对分离操作中起关键作用的组分即关键组分规定分离要求,其中多组分精馏过程最多只能有( )个关键组分,多组分吸收过程最多只能有( )个关键组分。
A. 1B. 2C. 3D. 47.下面有关塔板效率的说法中哪些是正确的?( )A.全塔效率可大于1B. 总效率必小于1C. Murphere板效率可大于1D. 板效率必小于点效率8.假设相对挥发度与组成关系不大且不同组分的塔板效率相同,通过对若干不同组分系统的精馏计算结果分析研究发现,( )下组分的分配比接近于实际操作回流比下的组分分配比。
A.高回流比B. 低回流比C. 全回流D. 最小回流比9.影响气液传质设备处理能力的主要因素有()A. 液泛B. 雾沫夹带C. 压力降D. 停留时间10.在泡点法严格计算过程中,除用修正的M-方程计算()外,在内层循环中用S-方程计算(),而在外层循环中用H-方程计算()。
A. 级间温度B. 液相组成C. 气相流率D. 级间压力二、判断题(判断下列各题正误,正确打√,错误打×,每题1分,共10分)1.计算溶液泡点时,若∑=> -CiiiXK11,则说明温度偏高。
