药液配制系统运行及性能确认方案
药业有限责任公司纯化水制备系统运行确认方案
纯化水制备系统运行确认方案方案批准目录1.介绍 (4)2.目的 (4)3.范围 (4)3.1范围内 (4)3.2范围外 (4)4.职责 (4)4.1奥星职责 (4)4.2[名称] 职责 (5)5.缩略语 (6)6.法规和指南 (7)6.1法规 (7)6.2指南 (7)7.参考文件 (8)8.系统/设备描述 (9)8.1系统设备用途 (9)8.2能力 (9)8.3设计和运行特点 (9)9.文件管理规范 (10)10.测试项目列表 (12)11.运行确认测试 (13)11.1先决条件确认 (13)11.2人员确认 (14)11.3SOP确认 (14)11.4培训确认 (15)11.5测试仪器仪表校准确认 (15)11.6输入/输出确认 (16)11.7断电再恢复确认 (17)11.8权限确认 (18)11.9人机界面显示导航确认 (19)11.10报警和联锁确认 (19)11.11预处理单元消毒确认 (20)11.12反渗透和EDI消毒确认 (20)11.13预处理单元运行确认 (21)11.14反渗透和EDI单元运行确认 (22)11.15数据记录与储存确认 (23)11.16产水确认 (23)12.偏差处理 (24)13.变更控制 (24)14.运行确认总结 (24)15.附件清单 (24)16.支持性附录清单 (24)17.测试报告 (24)1. 介绍xxx有限公司位于xxx,现在xxx新建一个注射剂车间,用于生产xxx。
该厂房名称为xxx,共有xx层,建筑面积xxx。
该项目要通过中国GMP 2010版。
该注射剂车间纯化水制备系统是一个新建系统,其纯化水的质量应该满足中国药典2010版和欧盟药典第7版的要求。
纯化水制备系统为一台产量为xxxx的纯化水机,系统对产水电导、温度进行在线监控并与储罐联动,根据储罐液位进行自动停机和补水。
纯化水制备系统根据系统影响性评估的方法确定为直接影响系统,系统编号[编号]。
药液过滤系统验证方案

1.概述1.1 工艺过程浓配药液→钛棒过滤脱炭→稀配药液→钛棒过滤脱炭→0.45μm筒式微孔滤芯过滤→0.22μm筒式微孔滤芯过滤→终端0.22μm筒式微孔滤芯过滤→灌装。
1.2 药液过滤系统是大容量注射液塑瓶产品的微生物和不溶性微粒符合要求的保证系统,因此车间药液过滤系统的过滤效果必须进行验证。
2.验证目的和内容2.1 验证目的a.确认车间药液过滤系统药液过滤效果能满足生产工艺需要;b.确认车间药液过滤系统与相应SMP和SOP文件规定相符,并具备可操作性。
2.2 验证范围确认大容量注射剂(聚丙烯输液瓶)车间药液过滤系统的过滤效果符合生产工艺要求,能满足生产工艺需要。
3.验证机构组成3.1验证机构的组成公司验证委员会,负责所有验证工作的领导和组织,负责审批验证方案和验证报告、发放验证证书。
验证委员会针对每一个具体验证项目成立专门验证工作小组,负责该验证项目的验证方案起草、实施、组织与协调,负责验证结果记录与评定,负责完成验证报告。
4.验证项目及验证标准4.1 过滤器适用性试验4.1.1过滤器完整性测试0.45μm孔径滤芯起泡点≥0.18Mpa0.22μm孔径滤芯起泡点≥0.25MPa4.1.2兼容性试验(1)重量变化:药液浸泡后,滤芯重量不得减轻。
(2)滤芯完整性测试:药液浸泡后,应满足下列标准0.45μm孔径滤芯起泡点≥0.18Mpa0.22μm孔径滤芯起泡点≥0.25MPa5.1 《药品生产验证指南》(国家食品药品监督管理局)5.2 《药品生产质量管理规范》(1998年修订)5.3 《中华人民共和国药典》2005版5.4 《验证管理规程》SMP/MK/ZL0165.5 《微孔过滤器使用操作程序》SOP/MK/SC3125.6 《钛棒的处理及使用操作程序》SOP/MK/SC3135.7 《药液过滤系统验证规程》STP/MK/SC1066.验证方法6.1 材质说明药液过滤系统选用杭州科百特过滤器材有限公司生产的聚醚砜材质的滤芯,保证系统的过滤效果。
药液过滤系统验证方案
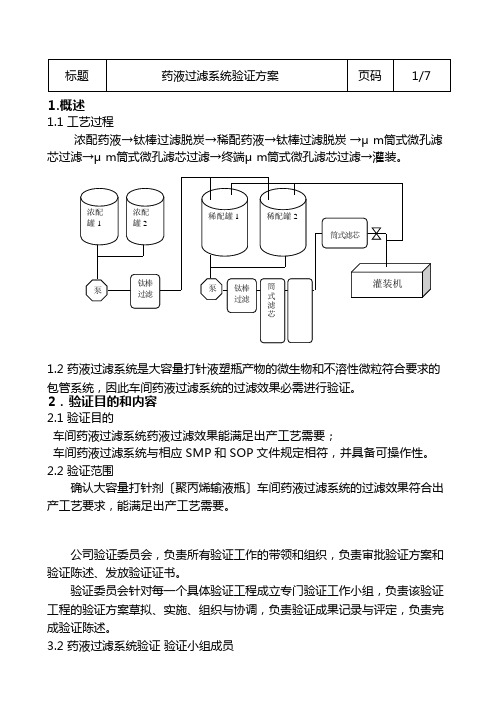
1.概述1.1 工艺过程浓配药液→钛棒过滤脱炭→稀配药液→钛棒过滤脱炭→μm筒式微孔滤芯过滤→μm筒式微孔滤芯过滤→终端μm筒式微孔滤芯过滤→灌装。
1.2 药液过滤系统是大容量打针液塑瓶产物的微生物和不溶性微粒符合要求的包管系统,因此车间药液过滤系统的过滤效果必需进行验证。
2.验证目的和内容2.1 验证目的车间药液过滤系统药液过滤效果能满足出产工艺需要;车间药液过滤系统与相应SMP和SOP文件规定相符,并具备可操作性。
2.2 验证范围确认大容量打针剂〔聚丙烯输液瓶〕车间药液过滤系统的过滤效果符合出产工艺要求,能满足出产工艺需要。
公司验证委员会,负责所有验证工作的带领和组织,负责审批验证方案和验证陈述、发放验证证书。
验证委员会针对每一个具体验证工程成立专门验证工作小组,负责该验证工程的验证方案草拟、实施、组织与协调,负责验证成果记录与评定,负责完成验证陈述。
3.2 药液过滤系统验证验证小组成员4.1 过滤器适用性试验过滤器完整性测试μm孔径滤芯起泡点≥0.18Mpaμm孔径滤芯起泡点≥0.25MPa〔1〕重量变化:药液浸泡后,滤芯重量不得减轻。
〔2〕滤芯完整性测试:药液浸泡后,应满足以下尺度μm孔径滤芯起泡点≥0.18Mpaμm孔径滤芯起泡点≥0.25MPa吸附研究〔含量变化〕过滤后含量≥过滤前含量的97%5.验证依据5.1 药品出产验证指南〔国家食品药品监督办理局〕5.2 药品出产质量办理尺度〔1998年修订〕5.3 中华人民共和国药典 2005版5.4 验证办理规程 SMP/MK/ZL0165.5 微孔过滤器使用操作程序 SOP/MK/SC3125.6 钛棒的处置及使用操作程序 SOP/MK/SC3135.7 药液过滤系统验证规程 STP/MK/SC1066.验证方法6.1 材质说明药液过滤系统选用杭州科百特过滤器材出产的聚醚砜材质的滤芯,包管系统的过滤效果。
6.2 过滤器完整性试验(起泡点试验)将筒式微孔滤芯, 用纯化水充实润湿后, 按微孔过滤器使用操作程序SOP/MK/SC312要求安装好,翻开气泡点试验仪,预置日期和时间,设置测试滤芯应达到的最低气泡点压力,仪器自动开始气泡点测试并开始计时,显示器显示时间,当测试完成时,发出三声蜂鸣声,显示器显示测得的气泡点值。
配液系统验证方案

类别:设备验证软袋车间配液系统验证方案版次:□新订□替代:起草:年月日审阅会签:(验证领导小组)批准:年月日实施日期:年月日目录1 概述2 范围3 职责3.1 验证领导小组3.2 生产技术部3.3 质量部4 验证4.1 安装确认4.2 运行确认4.3 性能确认5 结果分析和评价6 验证周期6.1 设备再验证7 最终批准1. 概述本公司输液车间配液系统包括浓配罐、稀配罐及其附属设备(管道、泵、过滤器等),本系统为立式封闭型结构,所有与药液直接接触部分均为316L不锈钢材质,浓配罐容量为3000L,稀配罐容量为5000L,均配备搅拌装置及加热降温装置,温度及液位显示装置,精密过滤装置等,滤芯分别为1μm钛棒、0.45μm、0.22μm的聚醚砜滤芯。
2 范围适用于配液系统验证。
本方案包括安装确认(IQ)、运行确认(OQ)、性能确认(PQ)。
3 职责3.1.1 负责验证方案的审批。
3.1.2 负责验证的协调工作,以保证本验证方案规定项目的顺利实施。
3.1.3 负责验证数据及结果的审核。
3.1.4 负责验证报告的审批。
3.1.5 负责发放验证证书。
3.2.1 负责验证方案的起草、设计及实施。
3.2.2 负责提供本设备的详细资料及相关SOP。
3.2.3 负责提供设备的计量器具校正详细情况。
3.3 质量部3.3.1 负责验证方案相关的检验及结果分析报告。
3.3.2 负责数据的选择与评价。
4 验证内容4.1 安装确认(IQ)4.1.1 仪器仪表校正列出设备所有计量器具清单,包括温度显示仪、压力表等,确定校正周期、使用范围等,并按规定程序进行校正。
见仪器仪表校正记录。
4.1.2设备动力部组织人员对设备进行开箱验收及备品备件入库工作。
见设备的开箱验收记录、备品备件入库记录。
4.1.3安装条件确认配制系统浓配罐和稀配罐都应处于万级洁净区下的环境。
见安装条件检查记录。
4.1.4 公用介质的连接确认公用介质的连接已按照设备设计安装说明书的要求进行,各种公用介质的规格与设备相匹配;所用高效过滤器均做完好性检测合格。
配液系统安装确认方案设计

口服液体车间配液系统变更改造安装确认方案福州屏山制药有限公司1.1.文件准备和批准 (2)2.引言 (3)3.安装确认 (4)3.1.接受标准 (4)3.2.本方案实施责任者 (4)3.3.方案实施要求 (4)3.4.技术资料检查 (5)3.5安装情况确认 (5)3.5.1.安装地点 (5)3.5.2 公用系统安装确认 (6)3.5.3化糖罐的安装确认 (6)3.5.4配液罐的安装确认 (8)3.5.5储罐的安装确认 (11)3.5.6缓冲罐的安装确认 (13)3.5.7控制柜安装确认 (14)3.5.8管道阀门的安装确认 (15)3.6配液系统清洗、钝化、消毒确认 (17)3.6.1概述 (17)3.6.2清洗、钝化步骤 (17)3.6.3取样点设置 (17)3.6.4.取样方法 (18)3.6.5.电导率测定操作规程 (18)3.6.6电导率测试结果 (18)3.7.安装确认结论 (19)4.方案偏差报告范例 (20)4.1.偏差和修正一览表(样张) (20)4.2.偏差报告样张 (21)5.方案修改记录范例 (22)6.验证总结论 (22)7.评价与建议 (22)8.附件 (22)1.文件批准1.1.文件准备和批准安装确认方案已由下列人员审查并批准:生效日期:年月日2.引言2.1.概述向温州市天龙轻工设备有限公司购进的口服液配液系统由PYG-1000L化糖罐、PYG-2000L配液罐、PYG-2000L储罐、ZG-100L缓冲罐、控制柜和相应管道组成,安装在福州屏山制药有限公司口服液生产线D级洁净区,将用于口服液化糖、配液、存储生产。
2.2.确认目的检查并确认口服液配液系统安装符合设计要求。
资料和文件符合GMP的管理要求。
2.3.系统描述口服液配液系统主要核心设备为化糖罐、配液罐、储罐、缓冲罐。
化糖罐主要包概罐体、搅拌系统、CIP清洗系统、电加热呼吸器、卫生泵等部分。
配液罐主要包概罐体、搅拌系统、CIP清洗系统、称重模块、钛棒筒式过滤器、电加热呼吸器、卫生泵等部分。
配液系统验证方案要点

配液系统验证方案验证方案组织与实施本配液系统验证工作由生产部负责组织,保障部、质保部、水针车间有关人员组成验证小组参与实施。
验证小组成员方案制订方案审核方案批准目录1.引言1.1验证方案名称1.2验证方案编码1.3概述1.4验证目的1.5相关文件2.安装确认2.1设备质2.2共用介质连接2.3配液系统及相关管道钝化检查3.运行确认3.1目的3.2 运行前检查及准备工作3.3试验过程4.性能确认4.1目的4.2试验过程4.3氮气洁净度检查5.验证周期1 引言1.1验证方案名称: 配液系统验证方案1.2验证方案编码: STP-YZ-009011.3概述本公司配液系统主要用于本公司水针车间所生产的小容量注射剂产品药液的配制。
配液系统由初配和精配两部分组成,初配罐、钛棒过滤器、卫生泵、精配罐、卫生泵、筒式过滤器到高位槽连接组成配液系统,配液罐液位显示均采用数显液位计,罐内设万向淋洗球,泵和配液罐组成小循环装置,与高位槽组成大循环,系统实现在位清洁。
配液系统工艺设计流程:原辅料、注射用水初配罐脱炭过滤器精配罐折叠式过滤器高位槽平板式过滤器灌封配液罐技术参数见下表:1.4验证目的:液系统安装符合设计要求,资料、文件符合GMP管理要求,看配液系统钝化效果是否符合要求。
液系统运行符合要求,看配液系统空载运行情况是否符合要求。
液系统性能符合要求,看配液系统负载运行条件下的运行情况是否符合要求,其所用惰性气体的洁净度是否符合要求。
1.5相关文件2.安装确认目的:通过检查并调整配液系统各项目,以确认配液系统安装是否符合要求。
2.1 设备检查人: 日期:2.1.2 材质检查人: 日期:检查人: 日期: 看液位显示。
精配罐:2.1.4.2 分别往初配罐、精配罐内继续加纯化水看承载最大容量。
初配罐:结论:检查人: 复核人: 日期:2.2公用介质连接2.2.2 注射用水2.2.4氮气结论:检查人: 复核人: 日期:2.3配液系统钝化:加纯化水至1000mlHNO325-35℃500L15分钟水清洗配液系统、清洗后关闭所有阀门。
配液系统验证方案

类别:设备验证软袋车间配液系统验证方案版次:□新订□替代:起草:年月日审阅会签:(验证领导小组)批准:年月日实施日期:年月日目录1 概述2 范围3 职责3.1 验证领导小组3.2 生产技术部3.3 质量部4 验证4.1 安装确认4.2 运行确认4.3 性能确认5 结果分析和评价6 验证周期6.1 设备再验证7 最终批准1. 概述本公司输液车间配液系统包括浓配罐、稀配罐及其附属设备(管道、泵、过滤器等),本系统为立式封闭型结构,所有与药液直接接触部分均为316L不锈钢材质,浓配罐容量为3000L,稀配罐容量为5000L,均配备搅拌装置及加热降温装置,温度及液位显示装置,精密过滤装置等,滤芯分别为1μm钛棒、0.45μm、0.22μm的聚醚砜滤芯。
2 范围适用于配液系统验证。
本方案包括安装确认(IQ)、运行确认(OQ)、性能确认(PQ)。
3 职责3.1.1 负责验证方案的审批。
3.1.2 负责验证的协调工作,以保证本验证方案规定项目的顺利实施。
3.1.3 负责验证数据及结果的审核。
3.1.4 负责验证报告的审批。
3.1.5 负责发放验证证书。
3.2.1 负责验证方案的起草、设计及实施。
3.2.2 负责提供本设备的详细资料及相关SOP。
3.2.3 负责提供设备的计量器具校正详细情况。
3.3.1 负责验证方案相关的检验及结果分析报告。
3.3.2 负责数据的选择与评价。
4 验证内容4.1 安装确认(IQ)4.1.1 仪器仪表校正列出设备所有计量器具清单,包括温度显示仪、压力表等,确定校正周期、使用范围等,并按规定程序进行校正。
见仪器仪表校正记录。
4.1.2设备动力部组织人员对设备进行开箱验收及备品备件入库工作。
见设备的开箱验收记录、备品备件入库记录。
4.1.3安装条件确认配制系统浓配罐和稀配罐都应处于万级洁净区下的环境。
见安装条件检查记录。
4.1.4 公用介质的连接确认公用介质的连接已按照设备设计安装说明书的要求进行,各种公用介质的规格与设备相匹配;所用高效过滤器均做完好性检测合格。
全自动配液系统PQ方案终版
全自动配液系统PQ方案终版全自动配液系统性能确认方案目录1.1 目的 (3)1.2 范围 (3)1.3 职责 (3)1.4 确认前培训 (3)1.5 文件记录要求 (3)1.6 确认对象描述 (4)1.7 可接受标准 (4)1.8 性能确认步骤及结果 (4)1.9 偏差 (20)1.10 变更 (20)1.11 术语 (21)1.12 参考文献 (21)1.13 修订历史 (21)1.1目的1.1.1本性能确认方案的目的是提供文件证据证明江苏复旦复华药业有限公司无菌配液过滤系统的性能确认方法与标准,能基于批准的工艺方法和产品标准,作为组合或分别进行有效的重复的运行。
1.1.2性能测试应在真实生产条件或模拟生产条件下进行,应收集确认数据并记录在附件的测试报告上。
性能确认是正式测试的最后步骤,以及确认需求矩阵中识别为进行性能确认测试的系统正式运行前正确性能的文件证据。
当最终性能确认报告批准后,系统可用于正常生产操作或用于工艺验证。
1.2范围本确认方案适用于江苏复旦复华药业有限公司冻干粉针剂车间二层无菌配液系统的性能确认工作。
1.3职责1.3.1设备使用部门负责确认文件的起草,确认工作的组织与实施。
1.3.2QC负责样品的检测。
1.3.3QA负责现场取样及确认工作实施的监督。
1.3.4QA经理负责相关确认文件的审核。
1.3.5质量管理负责人负责相关确认文件的批准。
1.3.6QA文档管理员负责给出确认文件的文件编号,以及相关文件的发放、回收及归档。
1.4确认前培训确认小组应在本确认方案批准后进行本确认方案的专项培训,并确保所有参加本确认工作的人都已熟知本方案要求,并记录在《培训记录表》(QA-MAN-005-H)。
1.5文件记录要求1.5.1严格按照《良好的文件记录规范》(QA-MAN-003)中对质量记录填写的要求进行确认报告的填写及记录。
1.5.2确认操作及记录应至少两人进行,确保所有的确认测试均完成,并有足够的确认数据被提供。
药液配制系统运行及性能确认方案

1.引言1.1概述1.2验证目的1.3范围2.验证组织及成员工作职责2.1组织成立2.2组织构成2.3工作职责2.4工作职责检查与记录3.文件与资料3.1文件与资料名称3.2文件与资料检查与记录4 仪器仪表的检查与校验5验证方法5.1 运行确认5.2 配制搅拌时间的确认6. 偏差及处理7验证结论8再验证周期1.1 概述:我公司生产车间有两条药液配制生产系统,能够充分满足生产线的使用。
系统包括浓配罐4台,每台700L,其中大线2台、小线2台;稀配罐4台,每台3000L,大、小线各2台。
除此之外,还包括药液输送泵、药液输送管道、过滤器、高位槽等设施。
整个系统与药液接触部分材质均采用316L不锈钢。
系统配置如下:配料时,一般先将浓配罐中放入一定量注射用水,然后往浓配罐中加入原料,加热搅拌溶解后加入活性碳,通过钛棒循环过滤,然后药液进入稀配罐再加入适量注射用水,分别通过0.45μm和0.22μm过滤器过滤后进入高位槽,完成整个配制过程。
配制和过滤系统工艺流程见下图:1.2 验证目的:在安装合格后,检查并确认配制罐及附属设施的运行性能能否符合设计要求,确认在正常生产条件下经该系统配制的药液质量是否符合工艺要求。
1.3 范围:适用于我公司大输液配制系统运行及性能确认。
2.1 根据《验证管理规程》SMP-ZL-02-0001-01由设备部经理担任组长,成立验证工作小组,组织实施该运行及性能确认工作。
2.2 验证工作小组成员:设备部;生产车间;质量保证部;质量检验部。
2.3 工作职责:2.3.1 验证领导小组:负责会签验证方案,审查验证报告,评价验证结果。
2.3.2 验证工作小组组长:向验证领导小组负责,组织成立验证工作组,协调运行性能确认方案的实施,保证运行性能确认工作按计划完成,对确认工作中的偏差提出处理意见。
2.3.3 设备部:由专人起草运行性能确认方案并形成报告,校验各种仪器仪表,提供运行性能确认工作所需的各种技术资料,对运行性能确认中的偏差进行解释和处理。
注射水制备系统性能验证方案.

注射用水制备系统性能确认方案方案起草人:起草日期:年月日方案审核审核人日期生产车间——————————机动能源处——————————生产技术处——————————质量管理处——————————方案批准批准人日期质量管理负责人——————————目录1.目的: (5)2.范围: (5)3.职责: (5)4.依据 (6)5.系统介绍 (6)6.测试程序 (8)7.注射用水全部用水点列表 (8)8.性能确认方案: (9)8.1.人员确认 (9)8.2.培训确认 (10)8.3.文件确认 (11)8.4.先决条件确认 (11)8.5.验证仪器仪表校验 (12)8.6.注射用水取样计划 (13)8.7.注射用水回水流量监测 (15)9.偏差 (15)9.1.偏差清单 (15)9.2.偏差报告 (16)10.附件清单 (16)11.变更控制 (16)12.测试报告 (16)PQ1.人员确认 (17)PQ2.培训确认 (18)PQ3.文件确认 (19)PQ4.先决条件记录 (21)PQ5.验证仪器校验记录 (22)PQ6.性能确认 (24)PQ7.注射用水回水流量 (50)PQ8.偏差清单 (50)PQ9.偏差报告 (52)PQ10.附件清单 (53)13.最终结论: (54)1. 目的:本文件的目的是用于//////为*****冻干粉针(2#)车间的----型多效蒸馏水机及车间注射水系统进行性能确认(PQ)时提供所需遵守的测试规程和接受标准。
2. 范围:本性能确认适用于*****冻干粉针(2#)车间的----型多效蒸馏水机及车间注射水系统。
3. 职责:生产车间审核验证方案,协助进行验证,审核验证报告。
设备动力部起草验证方案,收集验证数据,完成验证报告生产部审核验证方案,协助进行验证,审核验证报告。
质量部审核验证方案,协助进行验证,审核批准报告。
4. 依据《药品生产质量管理规范》(2010年修订)《药品GMP指南》(2011版)《药品生产验证指南》(2003版)《*****注射剂(小容量注射剂与冻干粉针剂)验证与确认总计划》(XY00 YZJ001)5. 系统介绍*****冻干粉针(2#)车间新建一套注射用水制备系统,该系统设计产能3000L/H,系统主要为*****冻干粉针车间提供符合GMP及企业标准的注射用水。
注射用水储存和分配系统运行确认(OQ)方案

运行确认方案(OQ)注射用水储存和分配系统方案审核和批准供应商:客户:版本历史目录1.目的 (4)2.验证范围 (4)3.职责 (4)3.1.供应商的职责 (4)3.2.客户的职责 (4)4.参考文件清单 (4)5.系统描述 (5)5.1.描述 (5)6.OQ实施 (8)6.1.先决条件 (8)6.2.人员确认 (9)6.3.验证仪器校准确认 (11)6.4.人机界面确认 (13)6.5.运行功能确认 (15)6.6.报警和联锁确认 (19)6.7.生产参数确认 (20)6.8.峰流量确认 (24)6.9.消毒过程确认 (26)7.偏差报告 (30)8.附件清单 (30)9.执行的审核和批准 (30)1. 目的本运行确认是为了确认XXX制药有限公司新建项目注射用水储存和分配系统的运行是否符合设计标准和用户工艺要求。
本方案规定了运行确认的内容、测试方法和测试表格。
2. 验证范围本运行确认的范围包括了注射用水储存和分配系统,而不包括注射用水制备系统。
本方案中的注射用水系统(WFI) 仅指注射用水的储存和分配系统。
3. 职责3.1. 供应商的职责➢OQ方案编写➢OQ实施和数据的收集➢准备偏差报告和解决偏差的建议➢如果出现偏差,与客户某个授权的人员进行协调➢最终报告的编写3.2. 客户的职责➢执行前审核和批准本方案➢针对不符合项界定解决方法➢审核和批准最终报告4. 参考文件清单以下是方案编写所依据的参考文件:●(SFDA) 中国GMP2010年修订版●欧盟GMP的附录1-无菌药品的生产,2008版●欧盟GMP的附录15-验证和确认●中国药典2010年版●药品生产验证指南(2003年版)●(ISPE) 新建和改造的工厂制药工程指南,第3卷-无菌生产设施,第1版,1999年1月●(ISPE)新建和改造的工厂医药工程指南,第4卷-水和蒸汽系统,第1版2001年1月5. 系统描述5.1. 描述注射用水储罐容量分别为:注射用水由注射用水制备系统供应到各个储罐。
制药用水和蒸汽系统的试运行和确认指南

Getting pharmaceutical water and steam systems up and running is a crucial step in making pharmaceutical products. But before we dive in, it's super important to make sure everything is good to go. This guide is your go-to for all the ins and outs of testing and confirming these systems. We're talking about some serious procedures and requirements here, but we'll break it down in a way that's easy to understand and maybe even a little bit fun. So buckle up and get ready for a wild ride through the world of pharmaceutical water and steam systems!使药品水和蒸汽系统上下运行,是制造药品的一个关键步骤。
但是在我们潜入之前,确保一切顺利进行是非常重要的。
这个指南是所有测试和确认系统的进出的指南。
我们在这里谈论的是一些严肃的程序和要求,但是我们会以容易理解的方式,甚至可能略为有趣的方式来细分。
系好安全带准备狂奔过药水和蒸汽系统的世界Before diving into the trial run, it's essential to give the water and steam systems a good once-over. Think of it as a deep dive into the layout, construction materials, gadgets and gizmos, and all the doohickeys that make it tick. Any hiccups in the original plan should be noted and fixed up before the trial run kicks off. And let's not forget about checking all the standard operating procedures, safety jazz, and rules and regs to make sureeverything's on the up and up when the trial run goes down.在潜入试运行前,必须给水和蒸汽系统一个好的一次翻转。
制药用水系统的确认的主要流程及说明理由

制药用水系统的确认的主要流程及说明理由下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!制药用水系统的确认流程及其重要性解析制药行业是一个高度受监管的领域,其中制药用水的质量直接影响到药品的安全性和有效性。
口服液配制线验证方案
验证文件文件名称:口服液配制线再验证方案文件编号:部门人员签名及日期起草人审核人批准人XXXXXXX药业目录一、方案概述 (4)二、验证背景 (4)三、验证范围 (4)四、验证的相关人员及责任 (4)五、验证内容 (5)5.1 设备概述 (5)5.2 文件确认 (5)5.3 仪器仪表确认 (5)5.4 运行确认 (5)5.5 性能确认 (5)六、验证实施步骤 (5)6.1 文件确认 (5)6.1.1文件确认记录 (5)6.2 仪器仪表确认 (6)6.2.1仪器仪表校验记录 (6)6.3 运行确认(OQ) (7)6.3.1 浓配系统运行确认 (7)6.3.1.1 运行前的准备 (7)6.3.1.2 运行确认记录表 (7)6.3.1.3 运行确认的偏差情况 (8)6.3.1.4 运行确认评价 (8)6.3.2 稀配系统运行确认 (8)6.3.2.1 运行前的准备 (8)6.3.2.2 运行确认记录表 (9)6.3.2.3 运行确认的偏差情况 (9)6.3.2.4 运行确认评价 (9)6.4 性能确认(PQ) (10)6.4.1 浓配系统性能确认 (10)6.4.1.1 风险评估和检测范围 (10)6.4.1.2 称重显示 (10)6.4.1.3 加热功能 (11)6.4.1.4 冷却功能 (11)6.4.1.5 管道、泵输送 (12)6.4.1.6 性能确认结果的综合评价 (13)6.5.1 稀配系统性能确认 (13)6.5.1.1 风险评估和检测范围 (13)6.5.1.2 称重显示 (14)6.5.1.3 加热功能 (14)6.5.1.4 冷却功能 (15)6.5.1.5 管道、泵输送 (15)6.5.1.6 过滤器完整性测试 (16)6.5.1.7 性能确认结果的综合评价 (16)七、验证实施时间 (17)八、合格标准 (17)九、偏差处理 (17)9.1偏差及处理措施 (17)十、验证周期 (18)十一、附录 (18)一、方案概述:本方案为口服液车间口服液配制线(以下简称配制线)的验证方案。
6-口服液溶配系统验证方案

北京瑞先农科技发展有限公司GMP管理文件1.主题内容:本方案规定了口服液配液系统验证方案的具体要求。
2.适用范围:本方案适用于口服液配液系统的验证。
3.验证小组成员:组长:王鹏成员:纪红梅张士鑫张树华王海月4.内容:4.1引言4.1.1概述本系统是由海宁市圣华桃园医药化工设备厂生产。
系统包括:500L配液罐,不锈钢多功能板框压滤机,输液泵及输送管道等。
和药物接触的设备和管道的材质为316L不锈钢。
整套系统设备配置先进,所用材质、设计、制造均符合GMP要求。
4.1.2主要技术参数:该系统主要技术参数如下:500L配液罐: 500 L板框压滤机: 1T/h(80um)输液泵: 2T/h4.1.3验证目的—检查该系统设备的文件资料齐全且符合GMP要求。
—检查并确认设备的安装符合生产要求、公用工程系统配套齐全且符合设计要求。
—确认该系统设备的各种仪器仪表经过校正且合格。
—确认该系统的各种控制功能符合设计要求。
—检查并确认管路分配系统的安装符合GMP要求。
—确认该系统设备在稳定的操作范围内能稳定的运行且能达到设计标准。
—确认系统生产的水剂能达到设定的质量标准。
—为设备维修、改造和再验证提供数据资料。
4.2口服液配液系统安装确认4.2.1文件资料下列文件资料齐全,并且符合GMP要求:4.2.2主要设备安装确认1)检查所有设备的材质、制造符合GMP要求。
2)检查并确认所有单体设备无外观缺陷和损坏。
3)检查并确认所有设备的安装稳固4)检查并确认可拆卸的工作部件易于拆卸、装配。
(5)检查并确认配液罐装有空气呼吸器。
(6)检查并确认系统各单体设备的安装符合设计要求。
结果见附件4.2.3分配管路的安装确认1)安装情况2) 检查并确认设备与纯化水管道连接正确并符合规范要求。
检查穿墙套管与彩钢板墙间缝隙是否密封良好。
4.2.4公用工程安装确认1)配电:4.2.5仪器仪表的校正:检查并确认所有的仪器、仪表经过校正且合格。
结果见附件4.3运行确认:按照《口服液配液系统操作SOP》和《口服液配液系统维护保养SOP》方法进行操作,检查各功能是否正常。
注射用水储存和分配系统运行确认(OQ)方案
注射⽤⽔储存和分配系统运⾏确认(OQ)⽅案运⾏确认⽅案(OQ)注射⽤⽔储存和分配系统⽅案审核和批准供应商:客户:版本历史⽬录1.⽬的 (4)2.验证范围 (4)3.职责 (4)3.1.供应商的职责 (4)3.2.客户的职责 (4)4.参考⽂件清单 (4)5.系统描述 (5)5.1.描述 (5)6.OQ实施 (8)6.1.先决条件 (8)6.2.⼈员确认 (9)6.3.验证仪器校准确认 (11)6.4.⼈机界⾯确认 (13)6.5.运⾏功能确认 (15)6.6.报警和联锁确认 (19)6.7.⽣产参数确认 (20)6.8.峰流量确认 (24)6.9.消毒过程确认 (26)7.偏差报告 (30)8.附件清单 (30)9.执⾏的审核和批准 (30)1. ⽬的本运⾏确认是为了确认XXX制药有限公司新建项⽬注射⽤⽔储存和分配系统的运⾏是否符合设计标准和⽤户⼯艺要求。
本⽅案规定了运⾏确认的内容、测试⽅法和测试表格。
2. 验证范围本运⾏确认的范围包括了注射⽤⽔储存和分配系统,⽽不包括注射⽤⽔制备系统。
本⽅案中的注射⽤⽔系统(WFI) 仅指注射⽤⽔的储存和分配系统。
3. 职责3.1. 供应商的职责OQ⽅案编写OQ实施和数据的收集准备偏差报告和解决偏差的建议如果出现偏差,与客户某个授权的⼈员进⾏协调最终报告的编写3.2. 客户的职责执⾏前审核和批准本⽅案针对不符合项界定解决⽅法审核和批准最终报告4. 参考⽂件清单以下是⽅案编写所依据的参考⽂件:●(SFDA) 中国GMP2010年修订版●欧盟GMP的附录1-⽆菌药品的⽣产,2008版●欧盟GMP的附录15-验证和确认●中国药典2010年版●药品⽣产验证指南(2003年版)●(ISPE) 新建和改造的⼯⼚制药⼯程指南,第3卷-⽆菌⽣产设施,第1版,1999年1⽉●(ISPE)新建和改造的⼯⼚医药⼯程指南,第4卷-⽔和蒸汽系统,第1版2001年1⽉5. 系统描述5.1. 描述注射⽤⽔储罐容量分别为:注射⽤⽔由注射⽤⽔制备系统供应到各个储罐。
滴眼剂配制系统确认方案

名目概述1.验证目的2.验证范围3、人员和职责4.验证内容5.偏差和漏项6.验证周期7.结果与评价概述滴眼液车间配制系统是依据GMP 要求设计安装的配制系统。
由配液罐,搅拌器,过滤器及相关链接收道,阀门组成。
系统设备组成:配液罐搅拌器过滤器相关链接收道及阀门1.验证目的为确认该配制系统能够正常运行,设备各项性能指标符合生产工艺要求,确保生产出质量合格,稳定的滴眼液,特制订本验证方案,对配制系统进展验证。
2.验证范围本验证方案适用于滴眼液配制系统的验证3.人员与职责验证小组人员:成员分工姓名所在部门职务、职称责任验证小组责任3.1验证小组组长:负责验证方案起草,组织实施验证的全过程,验证完毕写出验证报告。
3.2验证小组组员:分别负责本方案中具体工作。
3.3试验室、试验员:QC 理化室及必需的检测仪器为本工程验证明验室4.验证内容4.1设计确认该系统由配液罐,搅拌器,过滤器,加热冷却系统,及相关管道阀门组成。
物料在配液罐中经搅拌溶解混合均匀后,加热或冷却至肯定温度后经过滤器过滤通过管道输送至灌装系统。
确认内容:工程存放地点保存状况系统流程原理图、使用说明书安装调试记录仪器、仪表检定记录及鉴定证书设备及管道材质报告单设备开箱验收单配制罐确认报告过滤器验证报告纯化水系统验证报告注射用水系统验证报告纯蒸汽系统验证报告Sop4.2安装确认4.2.1检查系统设备到位状况及其完好性要求实际状况全部外观的不锈钢外表抛光,不应有划伤、焊点斑痕、氧化皮等缺陷全部外观棱边要求显直线,坡度不大于1mm,棱边的圆弧大小应全都,各直缝处应平坦工作台面与机器密封良好,经得起水冲洗,无液体内漏现象机体外壳、输送带、纯化水管道为304不锈钢。
与药液直接接触的部位均为304 不锈钢全部管道的连接尽可能削减连焊处干净区配料罐、管道的保温层平坦、光滑、无颗粒性物质脱落与设备连接的主要固定管道标有管内物料名称、流向检查结果:检查人:复核人:4.2.2电气局部是否符合要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.引言1.1概述1.2验证目的1.3范围2.验证组织及成员工作职责2.1组织成立2.2组织构成2.3工作职责2.4工作职责检查与记录3.文件与资料3.1文件与资料名称3.2文件与资料检查与记录4 仪器仪表的检查与校验5验证方法5.1 运行确认5.2 配制搅拌时间的确认6. 偏差及处理7验证结论8再验证周期1.1 概述:我公司生产车间有两条药液配制生产系统,能够充分满足生产线的使用。
系统包括浓配罐4台,每台700L,其中大线2台、小线2台;稀配罐4台,每台3000L,大、小线各2台。
除此之外,还包括药液输送泵、药液输送管道、过滤器、高位槽等设施。
整个系统与药液接触部分材质均采用316L不锈钢。
系统配置如下:配料时,一般先将浓配罐中放入一定量注射用水,然后往浓配罐中加入原料,加热搅拌溶解后加入活性碳,通过钛棒循环过滤,然后药液进入稀配罐再加入适量注射用水,分别通过0.45μm和0.22μm过滤器过滤后进入高位槽,完成整个配制过程。
配制和过滤系统工艺流程见下图:1.2 验证目的:在安装合格后,检查并确认配制罐及附属设施的运行性能能否符合设计要求,确认在正常生产条件下经该系统配制的药液质量是否符合工艺要求。
1.3 范围:适用于我公司大输液配制系统运行及性能确认。
2.1 根据《验证管理规程》SMP-ZL-02-0001-01由设备部经理担任组长,成立验证工作小组,组织实施该运行及性能确认工作。
2.2 验证工作小组成员:设备部;生产车间;质量保证部;质量检验部。
2.3 工作职责:2.3.1 验证领导小组:负责会签验证方案,审查验证报告,评价验证结果。
2.3.2 验证工作小组组长:向验证领导小组负责,组织成立验证工作组,协调运行性能确认方案的实施,保证运行性能确认工作按计划完成,对确认工作中的偏差提出处理意见。
2.3.3 设备部:由专人起草运行性能确认方案并形成报告,校验各种仪器仪表,提供运行性能确认工作所需的各种技术资料,对运行性能确认中的偏差进行解释和处理。
2.3.4 生产车间:协助设备部进行确认工作,对验证文件进行收集和整理,负责验证过程中的记录。
2.3.5 质量保证部:负责验证过程的监督,负责验证文件的归档。
2.3.6 质量检验部:负责验证过程中的取样及检验,做出检验报告。
2.4 参与验证工作的成员及其工作职责请见记录表一。
3. 验证所需检查的文件与资料3.1 所需文件与资料名称3.1.1 《浓配罐标准操作规程》SOP-SB-04-0032-01;3.1.2 《稀配罐标准操作规程》SOP-SB-04-0033-01;3.1.3 《配液设备、管道在线清洗消毒标准操作规程》SOP-SC-01-0020-01;3.1.4 浓配罐使用说明书;3.1.5 稀配罐使用说明书;3.1.6 产品质量证明书(包括浓配罐、稀配罐、过滤器、管道、隔膜阀、卫生级泵);3.1.8 浓配罐装配图;3.1.9 稀配罐装配图;3.1.10 《注射用水检验操作规程》SOP-ZL-03-0003-02 ;3.1.11 《注射用水质量标准》SMP-ZL-02-0102-01;3.1.12 《配液工序清场标准操作规程》SOP-SC-01-0019-01;3.1.13 《注射液中不溶性微粒检查法操作规程》SOP-ZL-03-0413-02。
内容有:文件的名称、编号、存档处,将检查的情况填入记录表二。
4. 仪器仪表的检查与校验4.1 检查的仪器仪表有:压力表、温度计、液位计。
4.2 在确认工作进行之前对上述仪器仪表进行检查与校验,发现校验不合格的仪器仪表在验证前应进行更换。
将检查与校验结果填入记录表三。
5. 验证方法5.1 运行确认5.1.1 目的:检查并确认配料罐及附属设施运行性能能否达到设计要求。
5.1.2 浓、稀配罐搅拌系统运行情况的确认5.1.2.1 按点动铵钮,检查电机运转方向是否正确。
5.1.2.2 接通其电源,检查搅拌桨转动是否平稳、有无卡阻现象、润滑部分有无漏油现象、是否满足最大转数要求。
5.1.2.3 向罐内注入大半罐注射用水,开动搅拌桨,检查搅拌桨是否能够翻起水花、罐内注射用水是否呈湍流状。
5.1.3 泵及管道系统的确认5.1.3.1 将系统中的所有泵一一做点动试验,检查其运转方向是否正确。
5.1.3.2 接通蒸汽管道,检查管道有无蒸汽泄漏,保温是否良好。
5.1.3.3 接通注射用水、冷却水及药液管道,检查管道系统有无泄漏。
5.1.3.4 合格标准:搅拌电机运转方向正确;搅拌桨转动平稳、无卡阻现象、润滑部分无漏油现象、能够满足最大转数要求;注入注射用水搅拌时能够翻起水花、罐内注射用水呈湍流状;各泵运转方向正确;蒸汽、注射用水、冷却水、药液管道均应无泄漏,蒸汽管道保温良好,蒸汽压力正常。
5.1.3.5 将以上结果填入本方案记录表四。
5.1.4 浓、稀配灌、搅拌器及药液管道、高位槽的钝化5.1.4.1 方法:5.1.4.1.1 清洗:按《配液设备、管道在线清洗消毒标准操作规程》SOP-SC-01-0020-01进行清洗;5.1.4.1.2 钝化:配制500L8%HNO3溶液循环处理60min后排放;导率一致,再按《配液设备、管道在线清洗消毒标准操作规程》SOP-SC-01-0020-01进行消毒和冲洗,在高位槽出水口取最后冲洗水按《注射用水检验操作规程》SOP-ZL-03-0003-02进行检测。
5.1.4.2 合格标准:符合《中国药典》注射用水质量标准。
5.1.4.3 将以上结果填入记录表五。
5.1.5 稀配罐液位计的显示准确性确认:稀配罐共有四台,应分别确认。
5.1.5.1 将稀配罐内的水排净,读数。
5.1.5.2 用台秤精确称量常温下的注射用水,换算出准确体积,倒入稀配罐内,读数。
如此继续操作,直至稀配罐内液体体积约3000L。
5.1.5.3 根据液位计读数与注入水量(称量容积)的关系,检查液位计是否显示准确。
5.1.5.4 合格标准:液位容积与称量容积应一一对应。
5.1.5.5 重复试验三次,以检查其重现性。
5.1.5.6 按以上方法对另外三个稀配罐位计的显示准确性进行确认。
5.1.5.7 将以上结果填入记录表六。
5.1.6 稀配罐冷却系统确认:稀配罐共有四台,应分别进行确认。
5.1.6.1 目的:检查并确认能否使稀配罐内液体在规定时间内降至所需最低温度。
5.1.6.2 打开进水阀,注入约80℃注射用水约2700L。
5.1.6.3 启动搅拌桨,打开冷却水进、排水阀,降温。
5.1.6.4 合格标准:30分钟内注射用水温度可降至≤50℃。
5.1.6.5 重复试验三次,以检查其重现性。
5.1.6.6 按以上方法对另外三个稀配罐冷却系统进行确认。
5.1.6.7 将以上结果填入记录表七。
5.1.7 浓配罐加热系统确认:浓配罐共有四台,应分别进行确认。
5.1.7.1 目的:检查并确认浓配罐蒸汽加热系统能否在承压范围内将液体在要求时间内煮沸。
5.1.7.2 打开浓配罐进水阀,注500L40℃的注射用水。
5.1.7.3 打开进汽阀,在0.25MPa压力下加热约40℃的注射用水,监测煮沸时间。
5.1.7.4 合格标准:20分钟内将500L40℃的注射用水煮沸(进汽压力0.25MPa)。
5.1.7.6 将以上结果填入记录表八。
5.1.8 液体排放程度确认5.1.8.1 目的:检查所有浓、稀配罐的液体排放是否彻底。
5.1.8.2 将所有浓、稀配罐一一注入一定量的注射用水,打开排液阀自然排放,通过人孔检查罐内液体排放是否干净,有无残留。
5.1.8.3 合格标准:所有浓、稀配罐内液体排放干净,无残留。
5.1.8.4 将以上结果填入记录表九。
5.1.9 过滤系统过滤效果的确认:试验前应做起泡点试验,以此来证明滤器是否有破损,密封是否好,孔洞率是否符合规定(结果见表十)。
5.1.9.1 目的:检查并确认过滤系统的过滤效果能否达到规定要求。
5.1.9.2 向浓配罐加入注射用水500L,再加入针用碳粉末50g,充分混匀。
5.1.9.3 用泵将上述注射用水经钛过滤器打入稀配罐,用洁净碘量瓶从稀配罐取样50~80ml,目测其有无肉眼可见小颗粒。
5.1.9.4 再将其经0.45µm、0.22µm过滤器打入灌装区高位槽,用洁净碘量瓶从高位槽收集经精密过滤的注射用水,按《注射液中不溶性微粒检查法操作规程》SOP-ZL-03-0413-02检查其不溶性微粒。
5.1.9.5 合格标准5.1.9.5.1 起泡点压力:0.45μm应≥0.16Mpa;0.22μm应≥0.24Mpa。
5.1.9.5.2 浓配后过滤:应无肉眼可见小颗粒。
5.1.9.5.3 稀配后过滤:≥25µm的微粒不得超过2个/ml,≥10µm的微粒不得超过20个/ml;5.1.9.6 试验连续进行三次,以检查其重现性。
5.1.9.7 将以上试验结果填入本方案记录表十。
5.1.10 过滤系统过滤速度的检测5.1.10.1 向稀配罐注入一定量未经过滤的注射用水,启动药液输送泵,使之经0.45µm、0.22µm过滤器过滤,检查过滤压力是否稳定,无太大变化,过滤速度能否满足最快灌装速度。
5.1.10.2 合格标准:0.45µm、0.22µm过滤器过滤压力均在0.25~0.30MPa之间;过滤速度能够满足最快灌装速度,不小于12.5L/分。
5.1.10.4 将以上试验结果填入本方案记录表十一。
5.2 稀配搅拌效果的确认5.2.1 目的:确定配制混匀所需时间,以考查稀配罐的搅拌效果。
5.2.2 配制对象:0.9%氯化钠溶液。
5.2.3称取氯化钠24.3Kg ,直接加入稀配罐中,注入注射用水2700L 开启搅拌桨进行搅拌,并分别于10、15、20、25、30、35分钟取样进行氯化钠的含量测定。
5.2.4 合格标准:用氯化钠作试验对象时,每次混匀时间不得超过25分钟;当连续两次取样测定氯化钠含量相对偏差<1.5%时,可判均匀度合格;第一次取样时间为最短搅拌混匀时间(相对偏差计算公式:|两次取样测定结果之差|两次取样测定结果平均值×100%)。
5.2.5 试验连续进行三次,以检查其重现性。
5.2.6将以上验证结果填入记录表十二。
6.6.偏差及处理偏差及处理::结果见漏项、偏差评估及纠错措施记录。
7. 验证结论验证结论。
8. 再验证周期8.1 配制系统更换关键零配件、中修或大修后需进行再验证; 8.2 配制工艺改变需进行再验证; 8.3 正常生产情况下每二年需进行再验证。
