单抗纯化手册
单克隆抗体纯化工艺流程

单克隆抗体纯化工艺流程
单克隆抗体纯化工艺流程是一个复杂且精细的过程,主要涉及到细胞发酵培养后的处理以及后续的纯化步骤。
以下是对这一工艺流程的详细解释。
首先,在细胞发酵培养结束后,会采用深层过滤或连续流离心深层过滤的方法来去除发酵液中的细胞及细胞碎片。
这一步是至关重要的,因为它能有效地去除杂质,为后续纯化步骤提供高质量的上清液。
接着,上清液会进入纯化工艺。
整个纯化工艺主要包括ProteinA亲和色谱、低PH病毒灭活、阴/阳离子交换色谱(或复合模式色谱)、除病毒过滤、超滤浓缩换液以及除菌过滤等步骤。
在ProteinA亲和色谱步骤中,利用抗体结构中的Fc区域能特异性结合色谱填料偶联配基ProteinA蛋白的特性,进行色谱分离。
大部分杂蛋白等杂质因无法与色谱填料结合而流穿,而抗体则与ProteinA蛋白结合,随后以低PH溶液洗脱柱子,收集粗纯后的抗体,达到初步纯化的效果。
随后,阴离子交换色谱利用等电点的差异进行分离。
病毒、HCP、DNA等杂质因PI相对较低,呈酸性,在较高PH条件下与填料结合,而抗体PI一般相对较高,呈碱性,直接流穿,从而达到进一步分离去除杂质的效果。
除病毒过滤则采用特定规格的滤膜,如20nm左右的滤膜,进行纳滤,截留病毒颗粒,而蛋白则顺利流穿,从而实现病毒的去除。
最后,经过超滤浓缩换液和除菌过滤步骤,即可获得高质量的抗体原液。
这些步骤确保了抗体的纯度、活性和安全性,为后续的应用提供了保障。
整个单克隆抗体纯化工艺流程虽然复杂,但每一步都至关重要,不可或缺。
它充分展示了现代生物技术的精细和高效,为抗体药物的研发和生产提供了坚实的基础。
GE中文-疫苗和载体纯化手册

将乙肝疫苗接种列入各国的计划免疫规划中。
对洗脱组分 1,2,3 中 r-HBsAg 的活性分析显示,组分1 中没
纯化策略
有 r-HBsAg 活性,组分2 中包含了大于 90% 的 r-HBsAg 活性,
据估计全世界约有 5% 的人口被乙肝病毒感染,仅在中国,就 可能有9%的人群是乙肝病毒的携带者,并且每年新增的感染 者高达一百万。为控制这种趋势,就要付出巨大努力,生产
14 对下游纯化工艺的杰出见解和技术支持
迎接现代疫苗和载体纯化的新挑战
正如以蛋白为原料的药物一样,疫苗以及载体也要受到管理 我们的研发人员,技术支持和维修专家可在生产的任何环节
部门的审查,要求产品符合严格的安全性和有效性的质量标 上为您提供帮助,解决问题。我们工程师熟知疫苗和病毒载
准。生物制药公司自身也同样要对自己的产品制定一些保证 体的下游制备过程中的纯化要求标准。由于疫苗,载体只在
Sepharose 4 Fast Flow 层析
Q Sepharose XL virus licensed 层析 超滤、透析
中空纤维柱 截留分子量 750 kDa
去除杂质 (HCP) 去除杂质 (HCP) 和 DNA
病毒浓缩和配制
纯化策略
如同其它所有病毒一样,人流感病毒颗粒远比蛋白质和肽这 类分子大,利用这个特征可以从发酵液中分离病毒。它能应
100 g
17-0448-02
cytodex 1
500 g
17-0448-03
cytodex 2 适合于一般病毒培养 (比表面积 3300 cm2/g)
cytodex 2
25 g
17-0484-01
cytodex 2
100 g
17-0484-02
单克隆抗体纯化工艺流程

单克隆抗体纯化工艺流程英文回答:Single clone antibody purification process is a crucial step in the production of monoclonal antibodies. Itinvolves several steps to ensure the isolation and purification of the desired antibody from the mixture of other proteins and contaminants.The first step in the purification process is toharvest the cells producing the monoclonal antibody. This can be done by centrifugation or filtration to separate the cells from the culture medium. Once the cells are separated, they are lysed to release the intracellular contents, including the antibody of interest.After cell lysis, the next step is to remove celldebris and insoluble components from the lysate. This canbe achieved through centrifugation or filtration methods. The clarified lysate is then subjected to a series ofchromatography steps to purify the antibody.One commonly used chromatography technique is protein A affinity chromatography. Protein A is a bacterial protein that has a high affinity for the Fc region of immunoglobulin G (IgG) antibodies. The lysate is passed through a column packed with protein A resin, and the antibody binds to the resin while other impurities are washed away. Elution of the antibody is then performedusing a low pH buffer or an IgG-specific elution buffer.Another purification step is ion exchange chromatography, which separates proteins based on their charge. The lysate is loaded onto an ion exchange column, and the antibody is selectively retained while otherproteins are washed away. Elution of the antibody is achieved by changing the pH or ionic strength of the buffer.Size exclusion chromatography is also employed to remove aggregates and further purify the antibody. This technique separates proteins based on their size, withlarger molecules eluting first. The antibody is collectedin the void volume while smaller impurities are separated.Finally, the purified antibody is subjected to a viral clearance step to ensure the removal of any potential viral contaminants. This can be achieved through viral filtration or other viral inactivation methods.Once the purification process is complete, the antibody is typically formulated into a suitable buffer for storage and further use. The purity and quality of the antibody are assessed using various analytical techniques, such as SDS-PAGE, HPLC, and ELISA.Overall, the single clone antibody purification process involves a series of steps, including cell harvesting, cell lysis, clarification, chromatography, viral clearance, and formulation. Each step is designed to isolate and purify the antibody of interest while removing impurities and contaminants.中文回答:单克隆抗体纯化工艺流程是单克隆抗体生产过程中的关键步骤。
实验四 腹水型单抗的制备及纯化

实验四腹水型单抗的制备及纯化迄今为止,通常情况下均采用动物体内生产单抗的方法,鉴于绝大多数动物用杂交瘤均由BALB/c小鼠的骨髓瘤细胞与同品系的脾细胞融合而得,因此使用的动物当然首先BALB/c 小鼠。
本方法即将杂交瘤细胞接种于小鼠腹腔内,在小鼠腹腔内生长杂交瘤,并产生腹水,因而可得到大量的腹水单抗且抗体浓度很高。
可见该法操作简便、经济,不过,腹水中常混有细胞及其残渣、小颗粒物质、脂肪滴以及小鼠的各种杂蛋白,因此在很多情况下要提纯后才能使用。
而腹水单抗的纯化是一个相当困难的工作,本实验将进行IgG1型腹水单抗的提纯方法。
材料:1、成年BALB/c小鼠。
2、灭菌液体石蜡或福氏不完全佐剂;处于对数生长期的杂交瘤细胞;新鲜采集的腹水(或冻存的腹水)。
3、饱和硫酸铵(pH7.2-7.4)溶液,正辛酸,0.1M NaOH,1M NaOH,0.06M,pH4.0NaAc-HAc缓冲液,0.01M,pH7.4 PBS,10×PBS(0.01M,pH7.4)。
方法:一、腹水的制备1.取12周龄的BALB/ c小鼠腹腔注射灭菌石蜡,0.5ml/只或腹腔注射福氏不完全佐剂,0.2-0.3ml/只。
2.1周后(注射灭菌液体石蜡)或3天后(注射福氏不完全佐剂)腹腔接种用PBS或无血清培养基稀释的杂交瘤细胞,每只小鼠1—3×106/0.3ml。
3.间隔5天后,每天观察小鼠腹水产生情况,如腹部明显膨大,以手触摸时,皮肤有紧张感,即可用16号针头采集腹水,一般可连续采2-3次,通常每只小鼠可采5-10ml腹水。
将腹水离心(2000rpm离心5min),吸去最上层的脂肪组织,除去细胞成分和其他的沉淀物,收集上清,将上清加入50﹪甘油冻存于-20℃冰箱,留下一小部分测定效价。
二、辛酸—硫酸铵法纯化腹水中的单抗1.取3ml腹水,2500r/min离心弃杂质,加入0.06M,pH4.0 NaAc-HAc缓冲液3ml,调pH 至4.8(用0.1M NaOH调);2.加入99ul正辛酸(33ul/ml腹水),室温搅拌≥30min,4℃搅拌≥60min,逐滴加完,4℃澄清2h(20min);3.取出15000r/min离心30min(10min)(4℃),去沉淀(白蛋白和其它非IgG蛋白),上清加入1/10体积的10×PBS(0.01M,pH7.4),用1M NaOH调pH至7.2;4.上清滴加等量饱和硫酸铵(pH7.2-7.4)溶液,使硫酸铵的饱和度为50%,继续搅拌10-30min,静置30min;5.10000rpm(4℃)离心30min(10min),弃上清,将沉淀溶于1.2ml,0.01M,pH7.4 PBS 中,6.0.01M,pH7.4 PBS透析过夜(4℃),其间换液3次,收集透析袋内液体,—20℃保存备用。
单抗制备步骤及注意事项

单抗制备步骤及注意事项脾细胞的准备:1.将Balb/c小鼠拉颈脱臼处死,浸泡于75%酒精3~5min。
无菌操作取出脾脏,置于盛有5mL不完全培养液的平皿中,洗涤3次去除脾脏表面的脂肪和结缔组织。
2.将洗好的脾脏用剪刀剪成3~5个小块,然后将脾脏研碎,过细胞筛,收集细胞。
3.将脾脏细胞悬液在1000r/min条件下,离心5min,弃上清。
再以同样的方法洗涤离心一次。
4.将沉淀细胞重新悬浮于10mL不完全培养液中,计活细胞数,取108个脾淋巴细胞悬液备用。
注意事项:•免疫脾细胞一般取最后一次加强免疫3天以后的脾脏,制备成细胞悬液,因为此时B 淋巴母细胞比例较大,融合的成功率较高。
骨髓瘤细胞的准备:1.选好骨髓瘤细胞株,取体外培养对数生长期细胞或体内生长的肿瘤分离骨髓瘤细胞。
2.取对数生长骨髓瘤细胞离心,用无血清培养液洗2次。
3.制备细胞悬液,计活细胞数。
4.调整细胞浓度,取107细胞悬液备用。
注意事项:•常用的骨髓瘤细胞系有:NS1、SP2/0、X63、Ag8.653等。
•骨髓瘤细胞系应和免疫动物属于同一品系,这样杂交融合率高,也便于接种杂交瘤细胞在同一品系小鼠腹腔内生产大量McAb。
•骨髓瘤细胞的培养适合于一般的培养液,如RPMI-1640基础培养液,DMEM培养基。
小牛血清的浓度一般在10~20%。
细胞的最大密度不得超过106个/mL。
•一般扩大培养以1:10稀释传代,每3~5天传代一次。
细胞的倍增时间为16~20小时。
•一般准备融合前的两周就应开始复苏骨髓瘤细胞,为确保该细胞对HAT的敏感性,每3~6个月应用8~AG(8氮杂鸟嘌呤)筛选一次,以防止细胞的突变。
•保证骨髓瘤细胞处于对数生长期,良好的形态,活细胞计数高于95%,也是决定细胞融合的关键。
细胞融合:1.将骨髓瘤细胞与脾细胞按1:10 或1:5的比例混合,加入20~50mL RPMI-1640培养液。
2.在1000r/min条件下离心8min,弃上清,用滴管轻轻吸净残留液体。
单抗体制备

单抗体制备引言单抗(monoclonal antibody)是指来源于单一克隆细胞的抗体,具有高度特异性和高亲和力。
单抗在医学、生物工程和疾病治疗等领域具有广泛应用前景。
本文将介绍单抗的制备方法,包括杂交瘤细胞制备、单克隆细胞培养和纯化等步骤。
一、杂交瘤细胞制备杂交瘤细胞是由B淋巴细胞(B lymphocyte)和骨髓瘤细胞(myeloma cell)融合而成的细胞系,具有无限增殖能力和产生单克隆抗体的能力。
制备杂交瘤细胞的步骤如下:1.1.采集B淋巴细胞从免疫动物(如小鼠)的脾脏或淋巴结中采集B淋巴细胞。
这些细胞是免疫系统中产生抗体的关键细胞。
1.2.准备骨髓瘤细胞选择一种骨髓瘤细胞系,如NS-1细胞或SP2/0细胞,作为杂交瘤的母细胞。
这些细胞具有无限增殖能力,适合用于制备杂交瘤细胞。
1.3.融合细胞将采集到的B淋巴细胞和骨髓瘤细胞按照一定比例混合,加入聚乙二醇等融合剂,使细胞融合为杂交瘤细胞。
融合后的细胞称为杂交瘤。
二、单克隆细胞培养杂交瘤细胞具有无限增殖能力,但并不能产生单一的抗体。
为了获得单克隆抗体,需要对杂交瘤细胞进行单克隆化培养。
2.1.稀释培养将融合后的杂交瘤细胞进行稀释培养,使细胞以单个细胞的形式分散在培养基中。
这样可以使每个细胞形成一个单克隆。
2.2.筛选单克隆细胞将稀释后的杂交瘤细胞进行筛选,通常采用限稀稀释法或HTP法。
限稀稀释法是在培养基中加入一定浓度的杂交瘤细胞,使每个细胞在培养皿上形成单个克隆。
HTP法则是将杂交瘤细胞分装到96孔板中,每个孔中只有一个细胞,便于单克隆的筛选。
2.3.培养和扩增单克隆细胞将筛选出的单克隆细胞进行培养和扩增,可以使用无血清培养基,添加合适的生长因子和抗生素,促使细胞的生长和分裂。
三、单抗纯化经过单克隆细胞培养,可以得到大量的单克隆抗体,但其中还含有其他蛋白质和杂质。
为了获得纯净的单抗,需要进行纯化步骤。
3.1.采集培养上清将培养单克隆细胞的上清液收集起来,其中含有分泌的单克隆抗体。
抗体纯化

Hale Waihona Puke 质的选择理想的基质应满足下面的要求: 1.极低的非特异性吸附性 2.高度的亲水性。亲和吸附剂要易与水溶液 中的生命大分子物资接近; 3. 较好的理化稳定性。当配体固化和各种 因素(如PH、离子强度、温度和变性剂等) 变化时,基质很少甚至不受影响;
4.大量的化学基团能被有效地活化,而且容 易和配体结合; 5.适当的多孔性。具体要求须根据分离物的 性质而定。 一般的亲和吸附剂采用的基质有纤维素、 聚丙烯酰胺凝胶、交联葡聚糖、琼脂糖、 胶联琼脂糖以及多孔玻璃珠。目前用的最 多的是琼脂糖珠。
3.2.3.7 将浓度高的收集液集中,于4℃暂时保存
3.2.3.8 加入0.01M Tris (PH7.5)15ml 3.2.3.9 加入15ml PBS冲洗
3.2.3.10 加入2ml含0.02%叠氮钠的PBS储存beads, 4℃
3.3 抗体长期保存条件: 50% 甘油+0.1%叠氮钠
3.2.2连接 3.2.2.1 准备好 1mMol/L HCl,并放入4℃预冷 3.2.2.2 计算所需的CNBr-activated Sepharose4B的量 (1 克冻干的粉末可以活化成3.5ml的beads,1mlbeads吸附510mg蛋白); 3.2.2.3 将称量好的beads放入预冷的HCl中活化,在4℃放 置15min 3.2.2.4 剪好滤纸,装好抽滤装置,先用预冷的HCl冲洗抽滤 装置 3.2.2.5 将beads加入抽滤装置中,1mlbeads用200ml HCl 抽滤
3.2.2.6 将抽滤后beads放在一干净的PE 手套上,与透析好 的抗原一起转移到15ml离心管中,封口膜封口,孵育, 室温2小时或4℃过夜 3.2.2.7 将结合了抗原的beads转移到纯化管中,加入 couping Buffer15ml冲洗 3.2.2.8 加入封闭液3ml,孵育,室温2小时或4℃过夜 3.2.2.9 PBS冲洗3次
抗体纯化手册-
单抗表达量可达 1-2g/L。 类等等。Protein A Protein A 亲和层析如 MabSelect 做快速初纯,再配合疏水层析、分子筛
亲和层析脱落集团。 等多步纯化。
利用基因工程技术表达人源 宿主杂蛋白、核酸、 若以 E.coli 包涵体形式表达,可考虑用 Sepharose 4FF 先纯化包涵体,再
2. 癌症、心血管等疾病的导向治疗:以单抗荷载同位素、 毒素蛋白、抗生素等药物制成生物导弹。
3. 应用抗体 T 细胞、抗 IL-2R 的单抗防治器官移植排斥反 应等。
的结构域可以识别和结合特异性抗原。1987 年单抗技术被成 4. 以单抗制成避孕、传染病的预防药物。
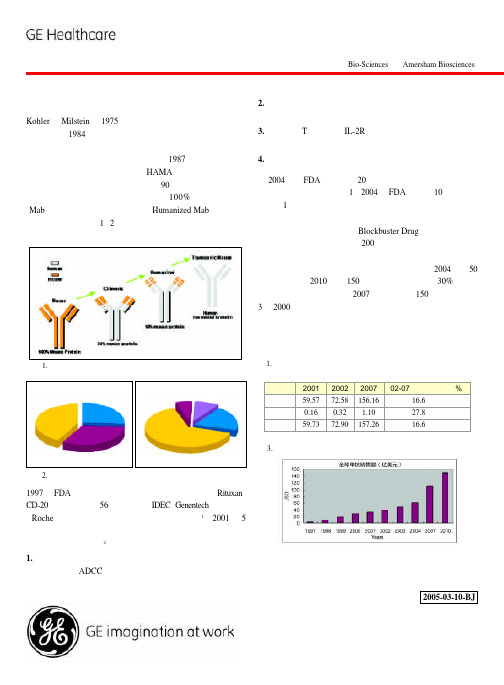
功应用到诊断试剂当中,但由于 HAMA (人抗鼠抗体) 反应, 没能有效应用在人类疾病的治疗上。90 年代,随着基因工程 技术的迅速发展,治疗性单抗从早期 100% 的鼠源性单抗 (Mab),到嵌合抗体,人源化抗体(Humanized Mab),到近年 的全人源性抗体 (图1、2),逐步消除了抗体的免疫源性问题, 在保持对抗原高亲和力的同时,改善了抗体的药动力学。
大多数 IgG 等电点高于一般血清蛋白,建议用阳离子交换层析 3 捕获浓缩抗体或分离纯化
大部分超过 pH6
除去大部分杂蛋白 (图 5)。注意:CHO 细胞表达的基因工程抗体 (Gab) 由于细胞培养过程
带来的糖基化的不均一,等电点往往较分散 (图 5),选择离子交换层析条件时须注意。
疏水性
大多数 IgG 疏水性较强
抗体纯化手册
孙文改 陈昕·通用电气(中国)医疗集团 Bio-Sciences (原 Amersham Biosciences)
一、单抗技术的发展、应用和市场前景
Kohler 和 Milstein 于 1975 年发明了被称之为“魔弹”的单抗 技术,并在1984 年获得了诺贝尔奖。单抗是B淋巴细胞和骨 髓瘤细胞杂交形成的杂交瘤细胞产生,其重链和轻链所形成
单克隆抗体纯化方法

单克隆抗体纯化方法
以下是几种常见的单克隆抗体纯化方法:
1. 亲和层析:利用抗体与特定配体的亲和力进行纯化,例如使用Protein A 或 Protein G 亲和层析来捕获抗体。
2. 凝胶过滤层析:根据抗体分子大小进行分离,可以去除较小的杂质。
3. 离子交换层析:基于抗体的电荷性质进行分离,适用于去除带电荷的杂质。
4. 疏水相互作用层析:利用抗体的疏水性进行纯化,可有效去除亲水性杂质。
5. 亲和洗脱层析:通过改变洗脱条件,如离子强度或 pH 值,从亲和层析柱上洗脱目标抗体。
6. 盐析和透析:通过在高盐浓度下沉淀杂质,然后通过透析去除盐分,实现抗体的纯化。
7. 超速离心:利用离心力将抗体与其他杂质分离开来,适用于大规模制备。
这些方法可以单独或联合使用,以获得高纯度的单克隆抗体。
选择合适的纯化方法取决于抗体的特性和所需的纯度水平。
需要注意的是,在进行单克隆抗体纯化时,应严格遵循实验操作规程,并在适当的条件下进行质量控制和检测,以确保获得高质量的抗体产品。
单抗制备操作规程

单抗制备操作规程单抗(monoclonal antibody)是指一种单一免疫球蛋白,它可以特异性地和抗原结合,用于诊断、治疗和研究不同疾病。
单抗制备是一项复杂的工作,需要准确控制多个关键步骤,下面是一个简化版本的单抗制备操作规程。
请注意,由于操作的精细性和复杂性,操作规程的详细程度可能因实验具体情况而有所不同。
1. 免疫原制备a. 根据实验需要,选择合适的抗原。
抗原可以是蛋白质、多肽、糖蛋白等。
b. 准备抗原的纯度要求高,可以通过自制或购买商业纯化抗原。
c. 对纯化后的抗原进行质量检测,如酶联免疫吸附试验(ELISA)、SDS-PAGE等。
2. 动物免疫a. 选择合适的实验动物,常见的包括小鼠、大鼠、兔子等。
b. 注射一定剂量的抗原到动物体内,通常是通过多次免疫来诱导免疫反应。
c. 免疫前,检查动物的健康状况并确保其免疫力兴盛。
d. 在免疫周期中,对动物进行定期血样采集,检测免疫反应的效果。
3. 单克隆细胞的制备a. 免疫反应结束后,从动物身上采集免疫细胞(如脾脏、淋巴结等)。
b. 对细胞进行分离和稀释,以保证单个细胞的生长。
c. 制备培养基和培养条件,确保细胞的正常生长和营养供应。
d. 进行单克隆分离,筛选出特异性抗体的单克隆细胞。
4. 单抗的筛选和鉴定a. 将单克隆细胞进行扩增培养,并进行抗体的检测。
可以使用ELISA、免疫组织化学等方法。
b. 对候选单抗进行亲和力和特异性的检测,如亲和力柱层析、酵素标记的免疫组织化学等。
c. 从候选单抗中选择出高亲和力和特异性的抗体,作为最终的单抗。
5. 单抗的纯化和制备a. 选择合适的纯化方法,如亲和层析、离子交换层析等,对单抗进行纯化。
b. 进一步对纯化的单抗进行浓缩和储存,以便后续的实验和应用。
6. 单抗的应用a. 单抗可以用于多种实验和应用,包括免疫组织化学、流式细胞术、蛋白质检测等。
b. 进行实验前,根据实验目的和要求,对单抗进行稀释和优化。
在整个单抗制备的过程中,实验者需要严格控制各个步骤的条件和细节,以确保单抗的质量和特异性。
单抗下游生产工艺手册

颇尔公司的Seize深层过滤的滤板由硅藻土、珍珠岩加 助滤剂混合而成,其中又分为P系列,HP系列和Bio系 列。
根据滤饼的形式又分为 Supra disc I, Supra disc II 和 Stax Capsules 三种,可分别与不锈钢的滤壳或Stax不 锈钢的底架整合一起使用。
先进的制药级 深层滤板
备注:具体产品选型和订购信息请直接联系颇尔公司当地销售。
6
(二)深层过滤技术——细胞培养液的澄清
细胞培养液的澄清是单抗分离纯化的首要步骤,用简单 的操作快速去除细胞和细胞碎片。吸附DNA和宿主细 胞蛋白质是这个阶段过滤分离的主要目的。通常CHO 培养的细胞培养液的细胞密度在2~7×106/ml,细胞存 活率在25~98%,浊度在500~1000NTU。如果培养 体积在1000L以内可以直接选择深层过滤技术来处理, 如果培养体积较大可以选择离心和深层过滤结合的方式 来处理料液。
HP 系列深层滤板
双层P级滤板组合 适合处理低存活率、高固液含量的细胞培养液 减少澄清处理工艺步骤 针对HP系列独立进行验证和发行《验证指南》
上层滤板:精度粗 底层滤板:精度细 导流盘 底层滤板:精度细 上层滤板:精度粗
深层滤板P级及HP级的精度选择
Bio 20 Bio 10 PDK5 PDH4 PDE2 PDD1 K900P K700P K250P K200P K100P S80P KS50P SEK1P EKMP EKSP
4
单抗生产中液体过滤器的选型
Supor® EKV ——缓冲液除菌过滤的首选
Ultipleat超级打褶 充分的除菌过滤验证 双层PES膜材,上游0.65um PES高度不对称膜, 下游0.2um对称PES膜 宽广的pH 兼容性 水通量12L/min @ 100mbar 107/cm2 缺陷型假单胞杆菌挑战,100%截留
小鼠单抗腹水纯化步骤

小鼠单抗腹水纯化步骤小鼠单抗是一种通过免疫响应体外制备的抗体,通常通过腹水提取方式来获得。
下面是小鼠单抗腹水纯化的一般步骤:1.小鼠免疫将小鼠注射目标抗原,通常使用免疫佐剂将抗原与免疫系统刺激起来。
免疫期间要注意小鼠的饮食和生活环境,保证其健康状态。
2.收集腹水在免疫后,根据小鼠的体重和免疫剂量,使用注射器从小鼠的腹腔中收集腹水。
使用无菌器具,注意操作过程要无菌。
3.储存和预处理腹水收集到的腹水用离心机离心,去除其中的杂质和细胞。
然后将澄清的腹水分装入无菌离心管中,并进行储存。
4.蛋白质浓缩和沉淀将腹水进行浓缩,可以使用离心或超滤等方法。
浓缩过程中要注意温度和时间的控制,以避免蛋白质降解。
浓缩后的腹水可以进一步进行封冻保存。
5.抗原亲和纯化使用亲和层析柱,将浓缩的腹水与目标抗原相互作用。
亲和层析柱可以选择已经与目标抗原结合的树脂,或者通过动态亲和层析的方法进行柱填充。
6.纯化和洗脱将亲和层析柱上结合的抗原-抗体复合物进行洗脱。
可以使用洗脱液来改变物质之间的亲和力,以实现复合物的解离。
洗脱后的洗脱液可以进行进一步的分析和检测。
7.鉴定和分析对纯化后的抗体进行鉴定和分析,可以使用免疫层析、SDS-、Western blot等方法。
这些方法可以检测纯化后的抗体的纯度、抗体滴度和特异性。
8.储存和保存将纯化后的抗体进行分装并储存,通常以冷冻的形式保存。
在保存的过程中要注意使用无菌的存储容器,避免污染和降解。
以上是小鼠单抗腹水纯化的一般步骤。
根据实际需求和具体实验条件的不同,可能会有所调整。
另外,为了保证实验的安全和可重复性,建议在进行实验前充分了解相关实验操作和操作流程,并遵守实验室安全规范。
单抗下游生产工艺手册

订购信息
KM2 KM5 KA02 KA1
KA2
KA3
KA4
AB1-4 NP6-8
Supor UEAV
★
★
★
★
★
★
Supor EKV
★
★
★
★
★
★
★
★
Fluorodyne II DFL
★
★
★
★
★
★
★
★
Fluorodyne EX EDF ★
★
★
★
★
Fluorodyne EX EDT
★
★
★
KM2: 实验室用针筒式滤器,最小处理样品100ml; KM5: 小型囊式滤器,处理样品体积50ml至2L KA02: 小型中式囊式滤器,处理样品体积2L至50L KA1-4:囊式滤器, 处理体积30L至1000L AB1-4:常规滤芯,10in.至40in. NP6-8:一次性囊式滤器, 内置AB滤芯
Supor® UEAV结构,Ultipleat超级打褶,小核设计 0.2μm不对称PES膜材 经验证对B.diminuta的去除>6LRV 水通量20 L/min @ 100 mbar 广泛的pH兼容 可进行完整性测试 有验证文件
Fluorodyne EX EDF ——中间产品的除菌过滤
Pall产品型号
SX
编码 S M L
公称高度 58 mm (2.3in.) 81 mm (3.2in.) 129 mm (5.1in.)
Stax囊式膜堆双层滤板
Pall产品型号
SX
编码 S M L
公称高度 58 mm (2.3in.) 81 mm (3.2in.) 129 mm (5.1in.)
单抗的制备、纯化和鉴定

单抗的制备、纯化和鉴定单抗的制备、纯化和鉴定一、实验目的:单克隆抗体制备是细胞免疫学的一个重要里程碑,它涵盖了细胞培养、细胞融合、免疫动物和抗体效价检测等各个方面内容。
了解单克隆抗体制备的原理、主要步骤和方法。
二、实验原理:骨髓瘤细胞在体外培养能大量无限增殖,但不能分泌特异性抗体;而抗原免疫的B淋巴细胞能产生特异性抗体,但在体外不能无限增殖。
将免疫脾细胞与骨髓瘤细胞融合后形成的杂交瘤细胞,继承了两个亲代细胞的特性,既具有骨髓瘤细胞能无限制增殖的特性,又具有免疫B 细胞合成和分泌特异性抗体的能力。
经在HAT培养基[含有次黄嘌呤(H)、氨基喋呤(A)和胸腺嘧啶核苷(T)]中进行选择性培养,未融合的脾细胞因不能在体外长期存活而死亡;未融合的骨髓瘤细胞合成DNA的主要途径被培养基中的氨基蝶呤阻断,又因缺乏次黄嘌呤-鸟嘌呤-磷酸核糖转移酶(HGPRT),不能利用培养基中的次黄嘌呤完成DNA 的合成过程而死亡。
只有融合的杂交瘤细胞由于从脾细胞获得了次黄嘌呤-鸟嘌呤-磷酸核糖转移酶,因此能在HAT培养基中存活和增殖。
经过克隆选择,可筛选出能产生特异性单克隆抗体的杂交瘤细胞,在体内或体外培养,即可无限制地大量制备单克隆抗体。
三、试剂与器材:细胞培养板、解剖器械、平皿、酶标仪、加样器、细胞计数板、CO2培养箱、倒置显微镜等。
四、操作方法:1、抗原制备;一般而言,抗原的纯度不很重要,特别是免疫原性较强的抗原。
A.可溶性抗原(蛋白质)以1mg/ml~5mg/ml的溶液加等量的弗氏完全佐剂乳化,分多点小鼠皮下注射,总量为0.3ml~0.6ml,间隔3~5周再同样注射一次,10天后,断尾取血一滴,测抗体效价,选滴度高的小鼠做融合试验。
一个月后可以经静脉(尾静脉)给予无佐剂抗原0.2ml~0.4ml,3~4天后,杀死小鼠取脾做融合用。
B. 颗粒性抗原如抗原来源方便,可以不加佐剂而增加免疫次数,缩短间隔时间。
例如用羊红血球免疫小白鼠,以1%浓度每只皮下注射0.2ml,每周2次,共免疫5~8次,取脾前3天,再免疫一次即可。
单克隆抗体纯化的方法

单克隆抗体纯化的方法单克隆抗体是一种高度特异性、高度灵敏度的抗体,在分子生物学、医学诊断等领域有广泛的应用。
然而,单克隆抗体的纯化是保证其质量和可靠性的关键步骤。
本文将介绍单克隆抗体纯化的方法,包括常用的单克隆抗体纯化技术、纯化过程中需要考虑的因素以及如何优化纯化条件以提高单克隆抗体的质量。
一、单克隆抗体纯化的方法1. 溶剂提取溶剂提取是常用的单克隆抗体纯化方法之一。
这种方法利用单克隆抗体与提取液之间的特异性溶解度,通过溶剂将单克隆抗体从细胞或组织中提取出来。
溶剂提取通常使用多种溶剂,如酒精、丙酮、氯仿等,以溶解单克隆抗体和细胞或组织中的其他成分。
需要注意的是,溶剂的选择会影响单克隆抗体的质量,因此需要根据具体情况进行选择。
2. 细胞培养细胞培养是另一种常用的单克隆抗体纯化方法。
这种方法利用单克隆抗体与细胞之间的特异性结合,通过培养细胞来提取单克隆抗体。
细胞培养通常使用哺乳动物细胞,如大肠杆菌、鼠疫酵母等,这些细胞通常能够产生高度特异性的单克隆抗体。
在细胞培养过程中,需要注意控制细胞数量和培养条件,以提高单克隆抗体的纯度和灵敏度。
3. 抗体分离抗体分离是另一种常用的单克隆抗体纯化方法。
这种方法利用抗体与目标物质之间的特异性结合,通过分离抗体来提取单克隆抗体。
抗体分离通常使用抗体分离剂,如变性银、橙皮提取液等,将抗体与目标物质分离开来。
需要注意的是,抗体分离剂的选择会影响单克隆抗体的质量,因此需要根据具体情况进行选择。
二、单克隆抗体纯化中需要考虑的因素在单克隆抗体纯化过程中,需要考虑以下因素:1. 抗体纯度抗体纯度是保证单克隆抗体质量的关键,它包括单克隆抗体的特异性、灵敏度、稳定性等方面。
因此,在进行单克隆抗体纯化时,需要保证抗体纯度达到要求。
2. 单克隆抗体的来源单克隆抗体的来源也是影响单克隆抗体纯度的重要因素。
如果单克隆抗体的来源不准确,可能会导致单克隆抗体的质量不稳定。
因此,在进行单克隆抗体纯化时,需要保证单克隆抗体的来源准确。
GE蛋白质纯化手册——中文——高段武学

蛋on at work
Handbooks from Amersham Pharmacia Biotech
Antibody Purification Handbook 18-1037-46
The Recombinant Protein Handbook Protein Amplification and Simple Purification 18-1142-75
第八章 储存条件 ......................................................................................................................................................................................55 提取和净化步骤 .......................................................................................................................................................................56
第七章 蛋白纯化策略的例子 .............................................................................................................................................................41 重组酶的三步纯化 ..................................................................................................................................................................41 重组抗原结合片段的三步纯化 .........................................................................................................................................45 单克隆抗体的两步纯化 ........................................................................................................................................................50 膜内蛋白质的一步纯化 .......................................................................................................................................................53
单克隆抗体纯化过程

单克隆抗体纯化过程引言单克隆抗体是一种高度特异性的蛋白质,被广泛应用于生物医学研究、临床诊断和治疗等领域。
单克隆抗体的纯化是制备高纯度、高活性的单克隆抗体的关键步骤之一。
本文将详细介绍单克隆抗体纯化过程及其相关技术。
单克隆抗体纯化过程1. 细胞培养与收获单克隆抗体的制备首先需要进行细胞培养。
通常使用哺乳动物细胞(如CHO细胞)作为表达宿主,将表达目标单克隆抗体的重链和轻链基因转染到CHO细胞中。
经过适当的培养条件,使得CHO细胞表达目标单克隆抗体。
当细胞达到一定密度后,可以进行收获。
收获过程中,需要将培养基与细胞分离,并将细胞沉淀下来。
常用的方法有离心和滤液等。
2. 细胞破碎与抗体提取收获的细胞需要进行破碎,以释放细胞内的抗体。
细胞破碎可以通过超声波、高压均质器、刀式破碎机等方法实现。
破碎后的细胞溶液中含有目标单克隆抗体、细胞碎片和其他杂质。
为了提取目标单克隆抗体,需要进行固液分离。
常用的方法有离心和滤液等。
离心可以将细胞碎片和大颗粒杂质沉淀下来,而滤液可以去除较小颗粒的杂质。
3. 亲和层析亲和层析是单克隆抗体纯化过程中最常用的方法之一。
通过利用抗体与特定配体(如蛋白A或蛋白G)之间的特异性结合,将目标单克隆抗体选择性地吸附到固定在亲和树脂上的配体上。
亲和层析通常包括以下步骤: - 树脂平衡:将亲和树脂与缓冲液进行平衡,以确保树脂处于最佳状态。
- 样品加载:将含有目标单克隆抗体的样品加入亲和树脂中,使得抗体与配体结合。
- 洗脱:使用特定的洗脱缓冲液,将非特异性结合的杂质洗脱,保留目标单克隆抗体。
- 再生:通过使用再生缓冲液,将目标单克隆抗体从亲和树脂上解离下来,以便进行下一轮层析。
4. 尺寸排阻层析尺寸排阻层析是一种基于分子大小差异的纯化方法。
通过利用填充在柱子中的尺寸排阻树脂,较大分子(如聚合物)被排除在外,而较小分子(如单克隆抗体)则可以通过树脂。
这样可以有效去除聚合物等大分子杂质。
尺寸排阻层析通常包括以下步骤: - 树脂平衡:将尺寸排阻树脂与缓冲液进行平衡。
单克隆抗体纯化

单克隆抗体的纯化一、简介抗体或免疫球蛋白(Ig)是B 淋巴细胞针对暴露于外源抗原后产生的独特的可溶性糖蛋白。
通常可从血浆(占总蛋白20%),血清,腹水,细胞培养基,蛋黄,植物提取物或细菌和酵母培养物中分离得到抗体。
常用于纯化的材料主要以腹水和细胞培养上清为主。
单抗纯化方式常用的技术:DEAE 离子交换层析柱,凝胶过滤法和亲和层析。
二、技术方法及原理(一)单抗粗提1.硫酸铵沉淀法(1)原理:高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来。
各种蛋白质的溶解度不同,故可利用不同盐浓度来沉淀不同蛋白质,硫酸铵因其溶解度大,温度系数小,不易使蛋白质变性而应用广泛。
(2)方法:①若样本体积较小,可配置100%饱和硫酸铵(375 g 硫酸铵加入500 mL 的蒸馏水中,加热至完全溶解,室温过夜,析出晶体任其留在瓶中,用氨水或者硫酸调节pH 至7.0);若体积较大直接使用固体硫酸铵,根据表格(1)称取所需质量。
②盐析:缓慢向腹水中加入一定量的饱和硫酸铵溶液(或者缓慢加入固体硫酸铵,0.277 mg/mL 终浓度为45%),缓慢搅拌30 min ,室温静置2 h ,再5000 rpm 离心25 min ,去上清,沉淀用PBS 溶解。
③脱盐:主要有柱层析和透析法a)柱层析:将上述样品过Sephadex G-25 层析柱,以PBS 或Tris-HCl 缓冲液为平衡液和洗脱液,第一个蛋白峰即为脱盐后的抗体溶液;b)透析法:将样品装入处理后的透析袋(2% NaHCO3,1mM EDTA 煮沸10 min,蒸馏水洗净)中,置换缓冲溶液为PBS 或Tris-HCl 缓冲液,期间更换4-5 次透析液;2.辛酸-硫酸铵沉淀法(1)适用范围:该法简单易行,适用于提纯IgG1 和IgG2b ,但对IgG3 和IgA 的回收率及纯化效果差。
(2)试剂:0.06M 醋酸缓冲溶液(pH5.0),1M HCl,辛酸,1xPBS ,1M NaOH;(3)方法:在预处理后的腹水中加入2 倍体积的0.06M 醋酸缓冲溶液(pH5.0),按比例加入辛酸(11uL 辛酸/mL 腹水),室温搅拌下逐滴加入,30min 内加完,4℃静置2 h ,10000 rpm 离心30 min ,弃沉淀,上清过滤(经尼龙筛125uM),加入1/10 的1xPBS,再用1M NaOH 调节pH 至7.2;4℃下加入饱和硫酸铵至45% 饱和度,静置1h ,10000 rpm 离心30 min ,弃上清;沉淀用PBS 溶解;3.优球蛋白沉淀法(1)适用范围:适用于提纯IgG3 和IgM 的提取,不会影响抗体活性;复溶缓冲溶液(1M NaCl ,0. 1M Tris-HCl ,pH8.0)(2)试剂:NaCl ,CaCl2,(3)方法:取一定量的预处理后腹水,先后加入NaCl(终浓度0.2M)和CaCl2 (终浓度25mM),可看到纤维蛋白的产生;经滤纸过滤后,透析或层析过滤,缓冲体系为去离子水,超高速离心30min;弃上清,沉淀用1M NaCl,0. 1M Tris-HCl,pH8.0 溶液复溶,再经过透析或层析过滤更换缓冲体系;(二)亲和层析法1.基本原理:基因工程改造的protein A 和protein G 能特异性结合哺乳动物IgG 的Fc 区段,将protein A 和protein G 结合到柱料上,通过亲和层析的方式,可将IgG 及其亚类与片段纯化出来。
贝伐珠单抗分离纯化流程及工艺参数设计

贝伐珠单抗分离纯化流程及工艺参数设计下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!贝伐珠单抗的分离纯化流程与工艺参数设计贝伐珠单抗,作为一种抗血管生成的靶向药物,已被广泛应用于多种癌症的治疗中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
少 5 个柱体积的灭菌结合缓冲液洗涤。
Superdex 200能有效去除这些杂质。牛免疫球蛋白的污染
问题在单抗纯化中十分显著,一般来说用疏水层析和离
注意
子交换可能会除去此类杂质。白蛋白和转铁蛋白也可用
当使用 70% 乙醇时,需要有特定的规则 (防爆区域及设 离子交换和疏水的方法去除,有一些单抗比它们的疏水
涤步骤,以免过分减少产量。
4. 用脱盐柱对纯化的IgG片段进行去盐处理或者将其转移 实验条件
至适宜的缓冲液 (见 20 页)。
适宜的缓冲液 (举例)
5. G 蛋白琼脂糖介质的再利用:依样品的天然属性而定, 缓冲液A:0.05M硼酸,4.0M NaCl,pH=9.0
只可在前后样品相同的情况下实现,否则会产生交叉 缓冲液B: 0.05M磷酸钠,0.05M柠檬酸钠,0.3M NaCl,
亲和基质中配体脱落是一个问题,尤其是洗脱条件恶劣 时。A蛋白与琼脂糖介质的多位点结合保证其难以被洗下 脱离柱子,因而在广泛的洗脱条件下可以维持极低的配 体脱落水平。
-2-
rProtein A Sepharose 纯化单抗实例:
Protein G Sepharose 纯化单抗实例:
Column:
HiTrap Protein G HP, 1 ml and HiTrap Desalting
的结合能力。
即用至少5个柱体积的滤过灭菌的结合缓冲液 (pH=7 ~
4. * 在 BPGTM、FineLINETM、INdEXTM、ChromaflowTM 这
8) 洗柱,逆转流向。
些柱子中填充,其分离能力与所填体积成正比,易于线
性工艺放大。
注意:当使用高浓度有机溶剂时,应采用递增梯度避免气
5. 该介质可以耐受严酷有效的 CIP 操作。
致抗体失去活性,则应考虑使用 A 蛋白琼脂糖。它的好
推荐 pH 值:工作范围 3-10
处是洗脱条件更加温和。
CIP 操作范围 2-12;
2. 大多数物种及亚类的 IgG 在生理 pH 及离子强度下与 G 推荐流动相速:500 cm/h;
蛋白结合。
热稳定的温度区间:4-40 ˚C;
3. 如果目的蛋白与配体间作用较弱,则应该避免多余的洗 推荐长时间保存条件:4-8 ˚C,20% 乙醇;
被认识到,应用到诊断试剂当中。现在单抗主要应用于疾 病的预防,诊断和治疗,生物物质的纯化及蛋白结构功能 的研究。治疗性单抗的市场在新药开发中有逐年增长的 趋势,1997 年单抗的销售额是 50 亿美金, 每年都有 40% 到 50% 的增长,1999 年时销售额翻倍,预计到2003 年会 是 1997 年的十倍可达 500 亿美金,由此可见单抗技术是 生物技术领域燃起的一颗新星。从1997 年至今已批准了 8 种治疗性单抗药物,现在在美国市场上比较著名的单抗 药物如 Rituxan (IDEC/Genentech/Roche),是嵌合 CD-20 单抗,被 FDA 批准的第一个治疗癌症的单抗药物,治疗 non-hodgkins lymphoma, 1997 年上市,现今以进入 56 个 国家,销售额30亿美金;Herceptin(Genentech), 1998上市, 人源化 HER-2,治疗乳腺癌;Orthoclone OKT3 (Ortho Biotech) 1986,鼠源性单抗,用于器官移植后抗排异;再 有如 Simulect (Novartis), Synagis (Medimmune) R, eoPro (J&J, Centocor, Lilly), Zenapax (PDL, Roche) Remicade (Centocor) 等等。现在大约有100 种单抗在临床实验,这
20%乙醇洗涤柱子和介质 (五个柱体积洗装填的介质),于 冲液 B
4-8˚C 保存。
5. 收集片段于滴定稀释溶剂中 (如 1.0 M Tris-HCl,pH =
8.0,稀释溶剂的体积等于程序片段体积的 5%)
MabSelect
6. 以5到10个柱体积的100%的缓冲液B对柱子实现再生
MabSelectTM 是一种新的 BioProcessTM 亲和介质,用于填 7. 用缓冲液 A 对柱子再平衡
目前天然的和重组的 A 蛋白对于 IgG 的 Fc 段有着相似的
特异性,但是重组的 A 蛋白经改造后含有一个 C 末端半
胱氨酸,使得其以单一位点固定于琼脂糖上,增加了结合
能力。A 蛋白对IgG的结合强度依赖于免疫球蛋白的物种
来源,而其动态结合能力则决定于结合强度及其他因素
(例如上样时的流速)。尽管IgG是人体主要的免疫球蛋白,
泡的产生。
CIP 方法因实验样品不同应有所改良。而日常进行 CIP的
理化性质
频率亦取决于样品的性质。不过推荐每5个循环后进行一
组成:高度交连的琼脂糖;
次 CIP 处理。依照污染物的性质采用不同的CIP 程序。如
包装大小:40-130µm (d 50v H85 µm) ;
果污染严重,则需要进一步优化 CIP 手册。
Detection: UV: 0-2.0 AUFS, 5 mm cell, 280nm
pH: measured on 0.5 ml fractions
Sepharose Protein G G 蛋白是一种源自链球菌 G 族的细胞表面蛋白,除此之 外,它还是一种三型Fc 受体。其通过类似于Α 蛋白的非 免疫机制与抗体的 Fc 段结合。像 A 蛋白一样,G 蛋白与 IgG 的 Fc 区域特异性结合,不同的是,相对于几种多克 隆 IgG 及人 IgG 来说,G 蛋白显然是更加强有力的结合者。
Sample:
Eluted mouse monoclonal IgG from HiTrap Protein G HP
Binding buffer: 20 mM sodium phosphate, pH 7.0
Elution buffer: 0.1 来自 glycine, pH 2.7
Flow rate: 2 ml/min
-4-
冲液洗涤。或者用含0.1M乙酸及20%乙醇的溶液平衡柱, 工作中也经常碰到。BlueSepharose 介质是去除白蛋白的
静置 1小时,然后用至少 5个柱体积的灭菌结合缓冲液洗 一种方法。二聚体和寡聚体在蛋白浓度较高时容易形成,
涤。或者用70% 乙醇平衡柱,静置12 个小时,然后用至 这些聚合物将降低样品的生物活性,一般来讲凝胶过滤
单抗纯化手册
一.前言
单抗作为治疗癌症的候选药物主要机制分两类,一类是
1975 年 Kohler 和 Milstein 发明了单抗技术,他们因此在 直接诱导癌细胞凋亡或抑制癌细胞生长或代谢;另一类 1984 年获得诺贝尔奖。但直到1987 年单抗技术的价值才 通过补体效应或 ADCC 来间接杀死癌细胞。
备)
性更强,疏水介质可以使目的蛋白结合而使杂质流穿。
四.单抗纯化策略及注意事项
占整个生物制药总数的一半,其中四分之一的单抗在临
床三期或等候批准。单抗发展的趋势从100%的鼠源性单 三.安玛西亚公司单抗纯化用产品
抗到嵌合抗体到人源化单抗最终到完全人源单抗,2000 Sepharose protein A, Sepharose protein G, MabSelect
年年中人类基因序列初稿完成,接下来就是对蛋白和基
污染。
pH=3.0
6. 若样品体积较大,则可以将几个HiTrap Protein G HP柱 实验步骤:
连续地接合起来或者在一个大柱子中装填以松散的介 1. 以 10 个柱体积的缓冲液 A 平衡柱子。
质。
2. 上样 (少量抗体)。
3. 以 5 个柱体积的缓冲液 A 洗柱
保存
4. *以10个柱体积的线性梯度洗柱直至洗液为100%的缓
充床层析中可以从大量的样品中分离出单克隆抗体。
* 沉淀或变性的物质:以 2 个柱体积的 6M 胍或者 10 mM
特点 1. 其设计保证一天内可以完成超过10000升高表达发酵样
NaOH or 0.1 M H PO 清洗后,立即以5 个柱体积滤过
2
34
灭菌的结合缓冲液 (pH=7 ~ 8) 洗柱,逆转流动方向
配体:重组 A 蛋白 (E. coli);
偶联化学成分:环氧基;
消毒
动态结合能力:约为 30mg 人 IgG/ml 介质;
消毒把微生物对床的污染减小到最低。
化学稳定性:于所有水溶缓冲液中稳定;
用 2% hibitane digluconate 及 20% 乙醇组成的溶液平衡柱
通常所用缓冲液为:100mM H3PO4 (pH 1.6), 子,静置6 个小时,然后用至少5 个柱体积的灭菌结合缓
它与琼脂糖介质有许多结合位点,如此紧密的结合力把
脱落水平减小到了最低。事实上在相当广泛的洗脱条件
下,该介质只有极低水平的配体脱落。
** 鉴于洗脱条件可能十分恶劣,建议将洗脱的单抗片段
收集于中和缓冲液中 (每毫升片段60-200µl 1M Tris-HCl,
pH=9.0) 或用 Sephadex G-25 进行缓冲液交换,以保证得
Sepharose Protein G由于可以广泛的结合真核生物许多类 型的 IgG而成为了捕捉抗体的极佳选择。其对于抗体IgG 的亲和力超过 A 蛋白,同时又将结合清蛋白的水平减小 到最低,使得产物在量及纯净水平上都有优势。
配体从亲和基质中脱落从来都是一个问题,尤其是在洗
脱条件较为恶劣的时候。在这方面,G蛋白也是有优势的,
到片段的 pH 值最终近乎中性。
-3-
注意
10 mM HCl (pH 2),10 mM NaOH (pH 12),
1. 大多数免疫球蛋白在 pH 值高于 2.7 (或者更低) 时很难
0.1 M 20% 柠檬酸钠 /HCl (pH 3),6M
