2018年医药一致性评价市场调研分析报告
2018年医药一致性评价专题市场投资分析报告

二、新落地品种市场空间大,进口替代进程望加速 ........................................................... 8
2.1 瑞舒伐他汀:进口替代空间大,凭借 5mg 规格抢占鲁南贝特份额 .............................8 2.2 替诺福韦:前三家企业出炉,对标恩替卡韦潜力巨大 ...............................................12 2.3 艾司西酞普兰:抗抑郁明星产品,享行业增长和进口替代双利好 .............................14 2.4 氨氯地平:原研一枝独秀,黄河药业望凭先发优势快速放量 .....................................16
四、风险提示 ................................................................................................................... 21
4.1 一致性评价进度不及预期 ...........................................................................................21 4.2 招标采购不及预期 .....................................................................................................21 4.3 一致性评价配套政策落地不及预期 ............................................................................21
2018年仿制药一致性评价专题研究报告

表:仿制药一致性评价主要政策
2015.08.18
2016.03.05
国务院
国务院办公厅
2016.05.28
CFDA
2017.08.25 2017.10.08
CFDA 中共中央办公厅、 国务院办公厅
《关于仿制药质量和疗效一致性评价工 对参比制剂选择、生物等效性试验、申请受理流程、相关鼓励政 作有关事项的公告》(2017年第100号) 策等事项进行说明。 《关于深化审评审批制度改革鼓励药品 医疗器械创新的意见》(厅字〔2017〕 42号) 加快推进仿制药质量和疗效一致性评价;对已上市药品注射剂进 行再评价,力争用5至10年左右时间基本完成。
4、风险提示:政策进度低于预期
请参阅附注风险提示
1
目录
01 02 03 04 05
用历史的眼光看待仿制药一致性评价
谁是第一批通过一致性评价的品种
产能出清后的行业格局影响 中国未来仿制药市场趋势 六大投资逻辑主线 主要公司盈利预测与估值Βιβλιοθήκη 06请参阅附注风险提示
2
1.仿制药一致性评价:中国医药行业2018年最重要的变革
2018年仿制药一致性评价专题研究报告
投资要点
1、中国制药工业第一次产能出清,预计60%的批文将退出市场
仿制药一致性评价的推进,将加速中国制药产业第一次去产能,优化品种市场竞争格局,“剩”者为王,中国医药行 业供给侧改革的春天将到来,从 CFDA 对 289 品种进展统计看,表示放弃的批文数量为 38% ,不放弃评价的批文占 57%,但已开展评价的企业仅占26%,我们预计最终完成评价的品种数量约40%。 产能出清后,优质仿制药未来有望在包装、招标、使用、报销等方面获得政策倾斜,向原研药品发起冲击并抢夺低端 产品市场份额,其中原研药品的总体市场份额仍然接近六成,在部分大型三级医院,原研药品的销售金额占比甚至高 达80%,未来国产替代将是主旋律。
2018年仿制药一致性评价市场调研分析报告

2018年仿制药一致性评价市场调研分析报告目录第一节参比制剂:一夫当关,万夫莫开 (5)一、参比制剂的选择标准不断完善 (5)二、不同类型品种的参比制剂选择原则 (7)三、参比制剂的确定过程:企业主动申报,CFDA最终拍板 (9)第二节参比制剂备案情况:早起的鸟儿有虫吃 (9)一、目前已公布备案4860个参比制剂条目 (9)二、国家参比制剂目录:速度加快、范围拓宽、效力更强 (12)第三节一致性评价政策最新进展 (14)一、政策进展:稳步快速推进,各地出台配套鼓励政策 (14)二、通过情况:已有超过30个品种完成了BE试验的备案 (17)第四节一致性评价的投资机会 (18)一、投资逻辑:综合考虑投入产出情况,最大化收益 (18)二、一致性评价案例分析---华东医药:高起点,快推进 (20)三、相关公司盈利预测和评级 (23)第五节附件 (24)一、一致性评价相关概念 (24)二、华东医药参比制剂备案整体情况 (27)图表目录图表1:参比制剂“一夫当关” (5)图表2:最早明确的普通口服固体参比制剂选择原则 (6)图表3:选择已在国内上市药品作为参比制剂的原则 (7)图表4:选择未在国内上市药品作为参比制剂的原则 (7)图表5:选择原研企业在中国境内生产上市的品种作为参比制剂 (7)图表6:参比制剂的确定过程 (9)图表7:仿制药企业备案3576 3576 个,占总品规的87% (10)图表8:289 289个基药目录的品种备案的品种备案2027 2027 个 (10)图表9:部分省份已在积极推动一致性评价工作 (17)图表10:仿制药企业不同品种的一致性评价策略选择逻辑 (19)图表11:仿制药一致性概念:药学等效+生物等效≈治疗等效 (24)图表12:仿制药生物等效性试验研究示意图 (25)图表13:一致性评价工作时间表模拟(需要24-30个月) (26)表格目录表格1:参比制剂标准和原则的发展历程 (5)表格2:改规格、改剂型、改盐基的仿制品种的参比制剂选择原则 (8)表格3:参比制剂备案集中前十的品种 (10)表格4:参比制剂备案集中前十的品种(以通用名计) (11)表格5:参比制剂备案数量前十的企业,上海医药最多 (11)表格6:总局公布与中检所推荐的部分品种参比制剂略有差别 (12)表格7:总局参比制剂目录涵盖多个上市公司的重点品种 (13)表格8:参比制剂来源以原研进口为主 (13)表格9:本次一致性评价配套制定工作规则稳步快速推进 (14)表格10:本次一致性评价配套指导原则出台极为高效 (15)表格11:国家和地方政府积极出台配套鼓励政策 (15)表格12:各地一致性评价鼓励情况 (16)表格13:已有21个品种完成一致性评价BE备案 (18)表格14:国家出台一系列时限要求和鼓励政策 (19)表格15:仿制药企业不同品种的一致性评价策略总结 (20)表格16:华东医药备案的仿制药6个品规属于289种基药 (21)表格17:华东医药一致性评价布局相对良好 (22)表格18:华东医药核心大品种和潜力品种值得关注 (22)表格19:重点上市公司均已在积极开展一致性评价工作 (23)表格20:一致性评价关键名称解释 (26)表格21:华东医药15个品种、22个品规的仿制药在中检所备案参比制剂信息27第一节参比制剂:一夫当关,万夫莫开2015年8月,国务院启动药品医疗器械审评审批制度改革,将推进仿制药质量和疗效一致性评价作为改革的重点任务之一。
2018-2024年中 国医药流通市场专项调研报告

2018-2024年中国医药流通市场专项调研报告医药流通行业作为医药产业的重要组成部分,连接着医药生产企业和终端消费者,对于保障药品的供应和质量,满足人民群众的健康需求具有至关重要的作用。
本报告将对 2018-2024 年中国医药流通市场进行深入分析。
一、市场规模与增长趋势在过去的几年里,中国医药流通市场规模持续扩大。
2018 年,市场规模已经达到了_____亿元,并且保持着稳定的增长态势。
到2024 年,预计市场规模将突破_____亿元。
这种增长主要得益于以下几个方面:1、人口老龄化加剧随着中国人口老龄化程度的不断加深,老年人口对药品的需求日益增加,推动了医药流通市场的发展。
2、居民健康意识提高人们对健康的关注度不断提升,愿意为预防疾病和保持健康投入更多的资金,从而增加了药品的消费。
3、医疗保障体系的完善医保覆盖范围的扩大和报销比例的提高,使得更多的人能够负担得起药品费用,促进了药品的流通。
二、市场结构1、批发环节在医药流通市场中,批发企业起着重要的枢纽作用。
大型批发企业凭借其规模优势、配送能力和品种齐全等特点,占据了较大的市场份额。
然而,随着市场竞争的加剧,一些小型批发企业面临着被整合或淘汰的压力。
2、零售环节零售药店的数量不断增加,连锁药店的发展速度较快。
同时,线上零售药店也逐渐兴起,为消费者提供了更加便捷的购药方式。
三、政策环境1、两票制的实施“两票制”的推行有效减少了药品流通环节,降低了药品价格,提高了流通效率。
2、医药分家政策推动了医疗机构与药品销售的分离,为零售药店的发展带来了机遇。
3、药品集中采购通过集中采购,降低了药品采购成本,对医药流通企业的供应链管理提出了更高的要求。
四、竞争格局1、大型医药流通企业如国药控股、华润医药等,凭借其强大的资源整合能力和网络覆盖优势,在市场中占据主导地位。
2、区域性医药流通企业在特定的区域内具有一定的市场份额和竞争优势,通过深耕本地市场,提供个性化的服务来谋求发展。
2018年仿制药行业一致性评价专题分析报告

2018年仿制药行业一致性评价专题分析报告目录1. 提质控费促发展,仿制药一致性评价一举多得 (5)1.1.政策密集出台,仿制药企2018年大考将近 (7)1.2.他山之石:美、日仿制药一致性评价历史沿革 (8)2. 一致性评价战线长,各阶段环环相扣 (11)2.1.一致性评价战线长,全程在两年左右 (11)2.2.一致性评价的首要环节—参比制剂选择 (13)3. 仿制药企业、CRO迎来机遇与挑战 (15)3.1.招投标利好,扶持政策兑现 (15)3.2.剩者为王——仿制药迎来竞争蓝海 (16)3.3.医院端临床资源紧张,一站式服务CRO公司占据先机 (19)4. 仿制药行业迎来结构性调整机会 (23)4.1.大品种进口替代空间大,建议关注京新药业,信立泰,德展健康 (26)4.2.制剂出口转内销政策放宽,看好华海药业借政策红利弯道超车 (33)4.3.临床资源紧缺,CRO行业重归高速发展跑道,建议关注泰格医药 (36)5. 风险提示: (37)图表目录图表1:282个过度重复品种已经批准文号企业数量分布 (5)图表2:2011-2015年我国卫生总费用支出 (5)图表3:2016年中国获取ANDA批件数目 (6)图表4:一致性评价政策及业务指导信息 (7)图表5:美国“药物有效性研究实施项目”历史沿革 (9)图表6:日本药品品质再评价历程 (9)图表7:日本“药品品质再评价工程”及后续政策概要 (9)图表8:日本“药品品质再评价工程”期间药企数量变化 (9)图表9:中美日政策比较 (10)图表10:质量和一致性评价流程 (11)图表11:一致性评价审核审批流程图 (12)图表12:改规格、改剂型、改盐基品种一致性评价配套技术指南 (14)图表13:参比制剂选择顺序 (14)图表14:各省份一致性评价扶持政策 (15)图表15:289目录单个产品企业持有批文数量 (17)图表16:拥有批文数量最多的前5个品种 (17)图表17:各省放弃评价清单数量 (18)图表18:各省份一致性评价进度 (18)图表19:部分省市积极改善临床资源紧缺情况 (19)图表20:BCS分类情况 (20)图表21:国际上关于BE豁免出台的指导文件 (20)图表22:289基药目录中可豁免或简化BE品种名单(征求意见稿) (20)图表23:CRO一致性评价服务内容 (22)图表24:早期通过省局核查提交总局受理品种 (23)图表25:接收号/受理号赋予原则 (23)图表26:未改变处方工艺审批申请(截止到2017年11月20日) (24)图表27:改变处方工艺审批申请(截止到2017年11月20日) (24)图表28:京新药业CDE已受理品种(截止11月17日) (26)图表29:瑞舒伐他汀钙片BE试验已完成情况(截止11月17日) (26)图表30:重点城市样本医院瑞舒伐他汀销售情况 (26)图表31:2017H1瑞舒伐他汀市场格局(销售额端) (26)图表32:瑞舒伐他汀各品牌价格(10mg) (27)图表33:2017H1瑞舒伐他汀销量格局估算(按5mg计算) (27)图表34:瑞舒伐他汀各厂商中标情况 (28)图表35:舍曲林各品牌价格(50mg) (28)图表36:2017H1舍曲林销量占比(按50mg估算) (28)图表37:2017H1左乙拉西坦市场竞争格局 (29)图表38:左乙拉西坦各品牌价格(0.5g) (29)图表39:2017H1左乙拉西坦销量占比(按0.25g估算) (29)图表40:CDE已受理品种 (29)图表41:重点城市样本医院氯吡格雷销售情况 (30)图表42:2017H1氯吡格雷市场格局 (30)图表43:氯吡格雷各品牌价格(75mg) (30)图表44:2017H1氯吡格雷销量估算(按75mg计算) (30)图表45:氯吡格雷各厂商中标情况 (31)图表46:德展健康BE试验进展情况 (31)图表47:阿托伐他汀钙BE进展情况 (31)图表48:阿托伐他汀各品牌价格(20mg) (32)图表49:2017H1阿托伐他汀片20mg销量估算 (32)图表50:阿托伐他汀各厂商中标情况 (33)图表51:境外上市药品在国内上市情况分类及要求 (33)图表52:华海药业2016年以来获得ANDA批件 (34)图表53:华海药业国内要业务占比 (34)图表54:华海药业转报品种(截止到11月22日) (35)图表55:CDE受理情况查询(截止到11月22日) (35)图表56:泰格医药收购标的一览 (36)1.提质控费促发展,仿制药一致性评价一举多得国内仿制药质量参差不齐,批文过度重复严重。
2018医药市场调研报告

2018医药市场调研报告4、以副养院服务民生由于五保老人多,镇政府每年扶持的6万元资金和上级主管部门为五保老人拨付的生活费用(每人每年3600元),在当前不断走高的物价水平下,除去吃饭、穿衣支出外,敬老院的电费、娱乐、院内设施维护和老人们的医疗和丧葬等费用支出根本无法得到保证。
为了让五保老人吃好、住好、生活愉快、没有后顾之忧,管理服务人员自已动手将生活区后面20多亩闲置土地进行平整后,种上土豆、甘蔗、藕、辣椒、黄瓜、番茄、茄子、空心菜、大蒜、洋葱、韭菜等反季节大棚蔬菜架和红芋等农作物。
在后面的小沟旁边,建起板房用来养羊、养猪、养鸭、养鹅,就连房子后面的小河沟里也废地利用,被管理人员用铁丝网圈住用来发展规模养鸡。
不仅能保证五保老人吃上新鲜可口的蔬菜,还产生了良好的经济效益。
通过种植高效经济作物和大力发展养殖业,十八里镇敬老院逐渐摸索出一条以副养院服务民生的生存发展之路。
目前,敬老院每年养羊100多只,年创效益3万元;养猪82头,年创效益2.8万元;③养鸡3000多只,年创效益8.96万元;院内种植大棚蔬菜,年创效益4.6万元。
敬老院还根据农村婚、丧、嫁、娶事情多的特点,购买了礼炮车向外出租,年创效益1.2万元;一年下来,纯副业收入达到20.56万元。
利润的40%用于保证服务生产,10%用于服务奖励,其余50%全部用在改善院民的生活上,这种敞开怀抱面向社会极富特色的办院模式极大的改善了五保老人的生活条件,为当前形势下举步维艰的敬老院的生存和管理难题,探索出了一条切实可行的道路。
5、创新形式形成合力十八里镇敬老院从自身实际出发,努力实现与社会的互动,积极推动全社会关心支持敬老爱老工作,促进敬老院事业健康。
在有关单位、部门的支持、协助下,镇里的企业及社会团体(华星粉业、聚鑫置业、友谊建筑公司、卢师傅食品公司、华标水泥厂、十八里镇中学、十八里教会、望堂教会、柘树教会)等,每逢传统节日都前来敬老院帮扶慰问,为老人们送去了爱心和真情。
2018年生物医药一致性评价专题研究报告

2018年生物医药一致性评价专题研究报告⏹第五批品种落地,支持政策陆续出台,加速迚口替代成主旋律:仺制药一致性评价第五批获批品种,共包括8个品种、16个品觃,前五批共有29个品种落地,属于289目彔品种13个,完成度仅4.5%。
临近2018年底大限,一致性评价呈加速趋势,2018年6月CDE受理数量达到新高的59个。
目前瑞舒伐他汀和蒙脱石散已有3家企业通过,根据觃定未来在招标采购中将不再选用未通过品种,利好已通过企业。
目前各地争相出台一致性评价支持政策,主要集中在招采环节,替代原研成为政策主旋律,从上海第三批集采结果来看,21个品种无一原研中标,迚口替代取得刜步成果,但通过一致性评价品种需以价换量。
未来国家层面的集采模式可能会借鉴上海,具体细则有待观察,但迚口替代料将明显加速。
⏹第五批四个新晋品种获批,“神药”伊马替尼在列:第五批落地的8个品种中有4个为首次获批品种,分别为蒙脱石散、卡托普利片、甲磺酸伊马替尼片、和阿法骨化醇片。
其中蒙脱石散已达“1+3”栺局,目前整体市场觃模在40亿左右,原研占比近半,替代空间广阔;卡托普利是ACE抑制剂降血压领域的老品种,市场觃模呈萎缩态势,原研施贵宝以12.5mg觃栺为主,而本次石药欧意和常州制药厂均为25mg获批,替代空间有限;伊马替尼是治疗CML的特效药,国内市场快速增长,原研诺华占据80%左右市场,江苏豪森望凭借性价比优势逐步替代。
但该药扎堆申报现象明显,未来竞争栺局趋于激烈;阿法骨化醇是多个挃南推荐的骨质疏松治疗性药物,市场觃模稳定,样本医院以胶囊剂为主,占比87%,企业众多,而本次获批的片剂占比12%,仅原研和重庆药友两家,竞争栺局良好,未来逐步实现迚口替代。
⏹企业抢跑注射剂一致性评价,部分品种已通过:注射剂一致性评价细则虽未公布,但已有不少企业抢跑,目前CDE已受理27个品种的注射剂一致性评价申请,对应50个受理号。
其中齐鲁制药受理号最多,达到13个,其次是恒瑞医药的6个,正大天晴和天道医药均以5个位列第三。
2018年医药行业分析报告

2018年医药行业分析报告2018年10月目录一、医药行业的整合大幕开启 (4)1、预计行业整体增速平稳 (4)2、政策变革引导行业格局 (7)3、超级买单人医保局成立,管理医保支付体系 (8)4、预计行业进入快速整合阶段 (10)二、仿制药的国产替代将显著加速 (12)1、一致性评价将快速推进 (12)2、龙头企业领跑一致性评价 (15)3、政策推动通过一致性评价的仿制药替代原研 (16)三、仿制药仍将维持合理利润率 (19)1、带量采购试点短期影响不大,实施存在不确定性 (19)2、带量采购之后,转移支付模式将改变 (24)3、全球仿制药龙头的盈利水平可作为国内长期趋势的参考 (26)四、创新决定未来 (27)1、创新药研发数量井喷 (27)2、龙头企业率先转型创新,铸就研发壁垒 (30)3、创新药具备高风险、高回报的属性 (32)医药行业进入整合阶段。
医保局于2018年5月成立,掌管药品和医疗服务的定价、采购、支付的整个环节。
我们预期,医保局可以采用以下几种途径加强对医保基金的管理:医保向治疗性品种倾斜,辅助用药逐渐被边缘化;改革医保支付标准,促进仿制药替代原研药;试行带量采购,以市场化的方式推动药品降价;加强医保监管,打击骗保等。
如果医保局采取这些措施,将给行业格局带来深远的变化。
未来随着仿制药一致性评价的推进,以及药品审评的严格规范,我们预计,国内制药行业的壁垒将大幅提升,行业将进入洗牌整合阶段。
具备较强研发实力的企业将成为行业整合的受益者。
仿制药将维持合理利润率。
带量采购的时间点有所延迟。
医保局原先计划于11 个试点城市进行试点带量采购,并计划于10 月底公示招标结果。
目前,带量采购的细则迟迟未公布,这可能是由于实施方案需要谨慎考虑对国内企业的盈利、药品供应的保障等各方面的影响。
带量采购之后,医院必须将60-70%的采购量给中标企业,单体医院/医生对药品生产企业的议价能力减弱,有助于药企节省销售费用。
2018年CDE药品审评情况分析报告
3、2018 年化药 1 类新药批准生产情况
表 1 2018 年批准生产的化药新药
受理号
药品名称
CXHS1000305
左奥硝唑片
CXHS1600006
注射用艾博卫泰
CXHS1600012 CXHS1700002 CXHS1700004 CXHS1700003 CXHS1700008 CXHS1700009 CXHS1700013 CXHS1700014 CXHS1700020 CXHS1700019
图 5 2018 年每月 CDE 化药受理情况
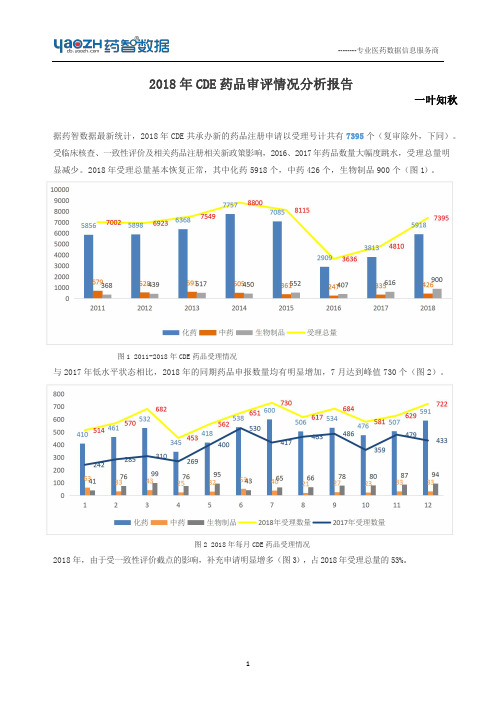
从化药领域来看,由于受一致性评价截点的影响(一致性评价品种在注册分类项按补充申请注册申报), 本年化药补充申请注册申报比例占到了化药申报总量的 60%(图 5)。
2
--------专业医药数据信息服务商
图 6 2018 年 CDE 化药各申请类型受理情况
正大天晴药业集团股份有限 公司
和记黄埔医药(苏州)有限 公司
批准文号 国药准字 H20170018
国药准字 H20180006
国药准字 H20180008 国药准字 H20180002 国药准字 H20180004 国药准字 H20180003 国药准字 H20180015 国药准字 H20180016
图 14 2018 年每月 CDE 生物制品受理情况
2018 年,共计申报 94 项 1 类治疗用生物制品(如表 2 所示)。
表 2 2018 年申报的 1 类治疗用生物制品 药品名称
注射用重组人 B 淋巴细胞刺激因子受体-抗体融合蛋 白
5
图 13 2018 年每月 CDE 中药受理情况
--------专业医药数据信息服务商
总体来说,中药申报一直处于比较低迷的状态,新药申请较少,受理号主要集中在补充申请,如何改变也是值
2018年医药行业专题市场调研分析报告

2018年医药行业专题市场调研分析报告目录第一节优先审评提速,带来中短期供给增量 (6)一、从现状看,药品供给侧产品积压严重,解决注册申请积压是重要趋势 (6)二、优先审评针对部分特殊品种,是解决积压的重要手段之一 (9)三、优先审评未来预计将成为常态,是中短期药企扩容品种的较大利好 (17)第二节优先审评对首仿、制剂国际化、特色药、创新药等带来较大利好 (19)一、优先审评对首仿、制剂国际化、特色药、创新药等带来较大利好 (19)二、利好背后的思考:实际具体效果和业绩贡献需要辩证看待 (19)三、部分小结 (23)第三节对首仿药利好,以恒瑞首仿白蛋白紫杉醇为例(上市申请) (25)一、“首仿”品种实行优先审评评定的基本原则 (25)二、注射用紫杉醇(白蛋白结合型),新品种,高增速 (25)三、同品类比较:传统紫杉醇式微,白蛋白结合型优势明显 (26)1、紫杉醇类肿瘤药是抗癌重要品种,市场空间大 (26)2、紫杉醇类产品有多种剂型,开发新型更优剂型是行业趋势 (28)3、白蛋白剂型靶向杀伤力更强,副作用相对更小 (30)四、医保覆盖增加及仿制药获批带动的产品降价有望推动产品放量 (33)五、嫁接恒瑞的肿瘤销售渠道,白蛋白紫杉醇有望更快放量 (35)五、部分小节 (35)第四节对制剂国际化企业是利好,以华海药业缬沙坦为例(上市申请) (36)一、因海外上市享受国内优先审评,有望在竞争激烈环境中弯道超车 (36)二、同品类比较:缬沙坦是高血压一线治疗药物,治疗效果优秀 (37)1、高血压一线用药,ARB类治疗效果明显,副作用小 (38)2、缬沙坦是ARB品类中高效安全的较优品种 (40)三、缬沙坦国内市场竞争激烈 (44)四、享政策红利,嫁接华海心脑血管销售平台,有望较快放量 (47)五、部分小结 (47)第五节对特色药利好,以恒瑞儿药—盐酸右美托咪定鼻喷剂为例(临床申请).. 49一、右美托咪定鼻喷针对儿童镇静,是2类新药,国内无上市销售 (49)二、类似品种比较:已上市的右美注射液是不同剂型不同适应症,市场空间较大 (49)三、看好右美鼻喷剂新剂型在儿科领域的未来 (53)四、嫁接恒瑞的精麻药销售渠道,产品未来获批有望更快放量 (56)五、部分小结 (57)第六节对创新药利好,以丽珠集团艾普拉唑注射液为例(上市申请) (58)一、艾普拉唑注射液是1.1类新药,国内外暂无竞争对手上市 (58)二、已上市的艾普拉唑肠溶片是不同剂型,注射液市场空间较片剂大 (58)三、同类品种比较:艾普拉唑属于PPIs药物,部分领域具备优势 (60)四、艾普拉唑注射液高效安全,看好这一剂型未来的潜力 (63)五、借助肠溶片销售团队,注射剂上市将迅速放量 (64)六、部分小节 (64)第七节投资分析 (66)图表1:2011-2014年我国1.1类新药平均审评时间 (6)图表2:2011-2014年我国3.1类新药平均审评时间 (6)图表3:药品注册申请现状 (8)图表4:药品注册申请2015-2016年审批情况 (8)图表5:药品注册申请2015-2016年审批细分情况 (9)图表6:右美托咪定国内上市厂家销售额(百万元)及增长(国内样本医院销售数据,实际全国内数据需扩大3-5倍) (20)图表7:恩替卡韦国内上市厂家销售额(百万元)及增长(国内样本医院销售数据,实际全国内数据需扩大3-5倍) (20)图表8:2011-2015年国内注射用紫杉醇(白蛋白结合型)销售额(亿元)及增速 (25)图表9:2011-2015年全球注射用紫杉醇(白蛋白结合型)销售额(亿美元元)及增速 (26)图表10:2011-2015年我国紫杉醇药物销售规模(亿元)及增速 (27)图表11:2009-2015年全球紫杉醇药物销售规模(亿美元)及增速 (27)图表12:2011-2015年期间4种紫杉醇药物销售额对比(亿元) (29)图表13:2015年4种紫杉醇药物市场份额对比 (30)图表14:紫杉醇(白蛋白结合型)作用机制 (31)图表15:2011-2015年国内缬沙坦销售额(亿元)及增速 (37)图表16:2009-2015年全球缬沙坦销售额(亿美元)及增速 (37)图表17:抗高血压药物发展历程 (38)图表18:ARB药物作用机理 (39)图表19:2005年以来ARB类药物在降压药物占比上升并保持稳定 (40)图表20:沙坦类降压效果对比,缬沙坦具有较好疗效 (40)图表21:心(肾)血管疾病发展不同阶段 (41)图表22:2011-2015年期间国内主要ARB品种销售额(亿元) (42)图表23:2015年缬沙坦国内市场竞争状况 (45)图表24:2011-2015年华海药业制剂销售收入实现快速增长 (47)图表25:2011-2015年国内镇静催眠类药物销售额(亿元) (50)图表26:2015年镇静催眠类药物国内市场份额对比 (50)图表27:2011-2015年期间盐酸右美托咪定注射液销售额(亿元)及增速 (53)图表28:2015年盐酸右美托咪定注射液国内市场份额对比 (53)图表29:2011-2015年恒瑞麻醉镇静药物销售额(亿元)及增速 (56)图表30:2011-2015年恒瑞右美托咪定注射液销售额(亿元)及增速 (57)图表31:2011-2015艾普拉唑销售规模及增速 (59)图表32:拉唑类产品分剂型销售占比 (59)图表33:PDB国内重点城市样本医院质子泵抑制剂销售额(实际市场需放大约3-5倍) (60)图表34:PDB国内重点城市样本医院主要质子泵抑制剂产品销售额(单位:百万元,实际市场需放大约3-5倍) (61)图表35:仿制药审评流程 (66)图表36:新药审评流程 (66)表格1:2011年中美药品审评机构审评人员和工作量比较 (7)表格2:优先审评申请类别 (9)表格3:优先审评品种概览(一) (10)表格4:优先审评品种概览(二) (12)表格5:优先审评后,部分产品审评速度加快(飘灰为优先审评厂家) (14)表格6:我国与美国新药加快审批途径对比 (16)表格7:优先审评发布进展 (17)表格8:2015年部分治疗领域销售前列品种市场份额比较:原研&首仿(销售额为国内样本医院销售数据,实际全国内数据需扩大3-5倍) (21)表格9:迄今为止多批优先审评药物中A股上市公司品种及最新状态(截至最新) (23)表格10:针对紫杉醇的改进方案举例 (28)表格11:几类紫杉醇类药物对比 (31)表格12:4种紫杉醇药物医保信息梳理 (33)表格13:注射用紫杉醇(白蛋白结合型)中标信息梳理 (34)表格14:国内注射用紫杉醇(白蛋白结合型)仿制药申请 (34)表格15:抗高血压药物主要分类及代表品种 (37)表格16:多个指南将RAS阻断剂(含ARB)作为糖尿病高血压首选降压药/基础用药 (39)表格17:缬沙坦是唯一可用于心衰A/B/C三期的ARB药物 (42)表格18:几种ARB基本情况对比 (43)表格19:几类ARB药品医保信息梳理 (44)表格20:目前国内共有缬沙坦制剂批准文号20个(14个厂家) (44)表格21:2011-2015年期间缬沙坦销售金额TOP10(以2015年排名为准) (46)表格22:缬沙坦在各省中标价格情况梳理(以2015年销售额前4家为例)* (46)表格23:盐酸右美托咪定注射液目前主要临床应用范围 (52)表格24:盐酸右美托咪定注射液适应症国内外获批情况 (52)表格25:儿童MRI检查中盐酸右美托咪定临床数据对照 (54)表格26:2003年以来儿童用药相关政策情况梳理 (54)表格27:右美托咪定鼻喷剂用于中等程度疼痛效果对比 (56)表格28:样本医院拉唑类用药频度(DDDs)与日均费用(DDC)(单位:元) (59)表格29:十二指肠溃疡药物主要分类及代表品种 (60)表格30:几种PPIs基本情况对比 (62)表格31:艾普拉唑国内注册情况 (63)第一节优先审评提速,带来中短期供给增量优先审评提速,是医药行业供给侧品种增量的重大利好,医药行业可谓久旱逢甘霖,虽然未来行业药品降价依然会持续,但是CDE解决药品积压、优先审评等政策会助力药企度过前期价格下降、品种青黄不接的状况,部分产品梯队较好的企业有望迎来产品增量的行业红利,获得高于行业的增长。
2018年仿制药一致性评价专题市场投资分析报告3

2018年仿制药一致性评价专题市场投资分析报告目录1.一致性评价新突破:启动首批有因现场检查工作 (3)2.预计阿托伐他汀钙片等属于第一批检查品种 (5)3.第一批仿制药品种有望2017年底或2018年初通过审批 (8)4.仿制药实现上市三大路径已有68个申请被受理 (9)5.一致性评价主题之风渐起,长周期起点,优选优势企业 (11)6.风险提示 (13)7.附录 (13)7.1.总局已统一受理34个仿制药一致性评价申请 (13)7.2.三条一致性评价路径共有约68个申请正在CDE审评审批 (15)7.2.1.存量品种狭路勇者剩一致性评价申请约44个 (15)7.2.2.出口转内销申请15个 (21)7.2.3.撤回重报后纳入优先审评的申请9个 (22)1.一致性评价新突破:启动首批有因现场检查工作2017年11月29日,总局(CFDA)食品药品审核查验中心(CFDI)发布工作动态,表示已于11月23日启动首批仿制药一致性评价品种的有因现场检查工作。
首批启动现场检查的7个品种是在总局药品审评中心(CDE)完成立卷审查的基础上开展的。
本次检查核查中心共派出6个检查组,分别奔赴北京、重庆、浙江、江苏、湖南、江西等省、直辖市。
根据总局2017年5月18日关于发布仿制药质量和疗效一致性评价研制现场核查指导原则等4个指导原则的通告(2017年第77号)中《仿制药质量和疗效一致性评价有因检查指导原则》的规定:“有因检查是针对一致性评价工作中发现的问题、质疑、举报等情形开展的针对性检查”。
而且,“必要时,现场抽取样品送一致性评价办公室指定的药品检验机构进行复核检验。
”此外,总局2017年8月25日发布的关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)中也明确说明:“国家食品药品监督管理总局药品审评中心根据立卷审查情况提出有因检查和抽检的需求,由国家食品药品监督管理总局食品药品审核查验中心统一组织进行对研制现场、生产现场或临床试验数据的有因检查或抽样。
2018年仿制药一致性评价专题研究报告

2018年仿制药一致性评价专题研究报告目录仿制药一致性评价(口服):剩者为王,开启仿制药强国之路 (3)重磅利好:仿制药一致性评价后续配套政策即将到来 (3)创新性研究:如何掘金尚未获批的品种和标的? (3)短期:17品种首批通过一致性评价,多数发补 (12)地方医保增补:增补高峰有望快速到来 (16)多数地区先行执行国家医保目录后调整,9省已公布新版目录 (16)医改:家庭医生服务继续做实做细,北京市医改成绩显著 (24)卫计委基层司公布家庭医生签约服务进展,未来继续做实做细 (24)北京医改成绩显著,费用下降,患者满意度上升 (25)两票制:药品两票制全面实行可期,耗材两票制3省试点 (25)药品两票制各地督促落实,全面实行可期 (26)风险分析 (27)图表目录图1:十大品种难度系数及市场规模象限图 (3)图2:硫酸氢氯吡格雷片历年样本医院销售额及增速 (4)图3:硫酸氢氯吡格雷片2017Q1-3竞争格局 (4)图4:硝苯地平缓释片历年样本医院销售额及增速 (5)图5:硝苯地平缓释片2017Q1-3竞争格局 (5)图6:奥美拉唑品种历年样本医院销售额及增速 (6)图7:奥美拉唑品种2017Q1-3竞争格局 (6)图8:阿奇霉素品种历年样本医院销售额及增速 (7)图9:阿奇霉素品种2017Q1-3竞争格局 (7)图10:二甲双胍品种历年样本医院销售额及增速 (7)图11:二甲双胍品种2017Q1-3竞争格局 (7)图12:阿司匹林品种历年样本医院销售额及增速 (8)图13:阿司匹林品种2017Q1-3竞争格局 (8)图14:苯磺酸氨氯地平品种历年样本医院销售额及增速 (9)图15:苯磺酸氨氯地平品种2017Q1-3竞争格局 (9)图16:阿卡波糖品种历年样本医院销售额及增速 (10)图17:阿卡波糖品种2017Q1-3竞争格局 (10)图18:瑞舒伐他汀品种历年样本医院销售额及增速 (11)图19:瑞舒伐他汀2017Q1-3竞争格局 (11)图20:辛伐他汀品种历年样本医院销售额及增速 (12)图21:辛伐他汀品种2017Q1-3竞争格局 (12)图22:北京4月份以来门急诊人次分布变化 (25)图23:北京门急诊就诊结构发生积极变化 (25)图24:全国各省药品两票制实施进度一览 (27)表1:十大品种一致性评价重点信息汇总 (4)表2:硫酸氢氯吡格雷片BE备案信息 (5)表3:硝苯地平缓释片BE备案信息 (5)表4:奥美拉唑品种BE备案信息 (6)表5:阿奇霉素品种BE备案信息 (7)表6:盐酸二甲双胍缓释片BE备案信息 (8)表7:苯磺酸氨氯地平片BE备案信息 (9)表8:阿卡波糖片BE备案信息 (10)表9:瑞舒伐他汀钙片BE备案信息 (11)表10:辛伐他汀片BE备案信息 (12)表11:首批通过一致性评价的17个品种信息一览 (13)表12:首批发补9个品种信息一览 (14)表13:次批发补25个品种信息一览 (15)表14:地方新版医保目录相关文件汇总 (17)表15:全国各地区新版医保目录动态增补一览 (19)表16:部分地区关于医保支付的文件汇总 (20)表17:部分地区关于谈判药品不纳入药占比的文件汇总 (23)表18:12月各地推进药品“两票制”公告 (26)仿制药一致性评价(口服):剩者为王,开启仿制药强国之路重磅利好:仿制药一致性评价后续配套政策即将到来仿制药一致性评价如火如荼,CFDA即将与相关部门协调落实后续配套细则。
2018年医药行业市场调研分析报告

2018年医药行业市场调研分析报告目录第一节聚焦医改方向,寻找未来龙头 (7)一、产业情况:医药制造业整体企稳 (7)二、行情回顾:业绩强者恒强,估值部分分化 (8)三、新龙头概念解读:符合医改产业趋势细分领域龙头 (17)四、他山之石:从雅培和强生的转型之路看未来中国消费型龙头前景 (21)第二节探寻医药龙头股上涨背后的逻辑—行业集中度提升正在进行时 (28)一、上半年医药板块的分化行情,其背后是产业逻辑的变化与兑现 (28)二、医药行业集中度提升正在进行时 (30)第三节化学制剂:优质龙头企业长期受益于政策改革 (39)一、化学原料药价格低位震荡,关注提价潜力品种 (39)二、化学制剂短期受政策压力影响,行业继续底部震荡 (41)三、优先审批、一致性评价、各地新标推进、医保目录调整等政策落地 (43)第四节生物制品:血制品稳健,疫苗回暖,重组基因药物维持高增长 (50)一、血制品成长以量为主,龙头强者恒强 (51)二、疫苗底部回暖,估值仍较高 (55)三、重组基因工程药物:行业格局维持稳定 (55)第五节中药:看好中药饮片龙头公司和消费类中药品牌公司 (58)一、中药饮片政策鼓励,增长趋稳 (58)二、中成药与中药注射剂承压 (59)第六节医疗器械:医用与家用龙头企业平台作用凸显 (62)一、行业现状:收入与利润均处于增速首位,国家政策鼓励国产替代 (62)二、医用医疗器械关注技术壁垒高的龙头企业 (65)三、家用医疗器械关注行业电商春风和平台型龙头企业 (67)四、IVD行业快速变局中,化学发光成为制胜关键 (68)第七节医药商业:政策助力集中度逐步提升 (72)一、医药批发集中度逐步提升 (72)二、药品零售企业连锁率持续提高 (75)第八节主题性投资机会:精准治疗与精准诊断 (79)一、CD19靶点CAR-T细胞免疫治疗有望今年海外获批 (79)二、精准诊断关注NIPT市场快速增长 (81)图表目录图表1:医药制造业收入和利润累计同比变化 (7)图表2:医药制造业毛利率和销售净利率变化 (7)图表3:医药制造业三项费用率(累计值) (8)图表4:医药板块2007-2017年4月医药板块走势(PE TTM 整体法) (12)图表5:A股医药生物板块和各子版块比较(PE TTM 整体法) (12)图表6:A股医药生物各子版块比较(PE TTM 整体法) (13)图表7:雅培收入构成以营养产品为主 (22)图表8:2016雅培收入按地区(亿美元) (22)图表9:雅培2005-2016年营收和净利润 (23)图表10:强生2005-2016年营收和净利润 (25)图表11:2016强生收入按产品构成(亿美元) (25)图表12:2016强生收入按地区(亿美元) (26)图表13:东阿阿胶按产品收入构成 (27)图表14:医疗终端需求的变化导致产业上游不断呈现集中化趋势 (30)图表15:严查临床试验背景下BE试验的成本变化 (30)图表16:国内原料药和制剂生产企业数量变化 (32)图表17:GMP认证企业收到告诫信的比例 (32)图表18:医药板块226家公司研发费用(亿元) (33)图表19:恒瑞医药研发费用(百万元) (34)图表20:医药行业与医药上市公司整体的营业收入增速比较 (34)图表21:医药板块226家公司营业收入(亿元) (35)图表22::中国医药批发业集中度远低于美国 (36)图表23:医药零售百强集中度变化 (36)图表24:医药批发百强集中度变化 (37)图表25:连锁药店企业迅速增加 (37)图表26:连锁药店数量和占药店总数比例增长 (38)图表27:化学药品原料药主营业务收入 (39)图表28:化学药品原料药利润总额 (39)图表29:国产维生素价格变化情况 (40)图表30:6-APA价格变化情况 (40)图表31:化学药品制剂主营业务收入 (41)图表32:化学药品制剂利润总额 (42)图表33:主要专科药物PDB样本医院销售额增长率 (43)图表34:生物制品工业营收增长情况 (50)图表35:生物制品工业利润总额增长情况 (50)图表36:2002-2016中国采浆总量(吨) (52)图表37:2005-2016美国采浆总量(千升) (52)图表38:15-16年样本医院生长激素销售市场占比 (56)图表39:生长激素样本医院滚动全年销售金额及增速(2014Q1-2016Q4) (56)图表40:2016年国内胰岛素整体市场格局(销售量占比) (57)图表41:国内胰岛素销售收入增长情况(单位:亿元) (57)图表42:2013-2016年中药饮片行业收入情况 (58)图表43:2013-2016年中药饮片行业利润情况 (58)图表44:2013-2016年中成药收入情况 (60)图表45:2013-2016年中成药利润情况 (60)图表46:2013-2016年医疗器械营收增速情况 (62)图表47:2013-2016年医疗器械利润增速情况 (62)图表48:2013-2016年卫生材料营收增速情况 (63)图表49:2013-2016年卫生材料利润增速情况 (63)图表50:乐普医疗构建心血管全产业链服务体系 (66)图表51:中国医疗器械行业总规模 (67)图表52:医疗器械细分渠道销售规模 (67)图表53:我国IVD市场规模及增速估计 (68)图表54:全国药品销售总额增速回暖 (72)图表55:医药零售占比稳定在20% (72)图表56:医药零售百强营收增速 (73)图表57:医药批发百强营收增速 (73)图表58:医药零售百强集中度变化 (74)图表59:医药批发百强集中度变化 (74)图表60:连锁药店企业迅速增加 (76)图表61:连锁药店数量和占药店总数比例增长 (76)图表62:2007-2020年全球基因测序市场规模(百万美元) (82)图表63:2007-2022年中国测序市场规模及预测(亿元) (82)图表64:NIPT市场样本量现状 (84)表格目录表格1:代表白马个股17年截止6月16日涨跌幅情况 (9)表格2:代表白马个股15-19年归母净利润成长性 (9)表格3:代表性白马股持仓结构 (10)表格4:重要指数成分中的医药股情况 (11)表格5::各板块上市医药公司盈利比较 (11)表格6:按公司市值分盈利比较 (11)表格7:化学原料药板块重点公司成长性分析 (14)表格8:化学制剂板块重点公司成长性分析 (14)表格9:生物制品板块重点公司成长性分析 (14)表格10:中药板块重点公司成长性分析 (14)表格11:医药商业板块重点公司成长性分析 (15)表格12:医疗服务板块重点公司成长性分析 (15)表格13:医疗器械板块重点公司成长性分析 (15)表格14:消费属性医药公司情况 (16)表格15:A股投资组合的收益情况和业绩预测准确情况 (16)表格16:港股投资组合的收益情况和业绩预测准确情况 (17)表格17:市值超400亿医药传统龙头白马一览 (18)表格18:“新龙头”“老白马”盈利及估值比较 (20)表格19:雅培百年历史重要事件 (21)表格20:强生百年发展史重要事件 (24)表格21:2017上半年(截至2017.6.20日)A股医药板块的涨跌情况统计 (28)表格22:2017上半年医药板块市值200亿以上公司的涨跌幅情况 (28)表格23:部分省市执行两票制政策,对配送商的要求 (31)表格24:以下分析所用前10和前20强企业(按2016年研发费用排行) (33)表格25:重要上市公司参比制剂备案情况 (45)表格26:进入医保谈判目录的11家上市公司12个品种 (48)表格27:康弘药业和信立泰产品进入谈判目录 (49)表格28:已公布全国浆站设臵规划 (53)表格29:2017年上市公司新开设浆站情况 (53)表格30:2017年1-5月血制品批签发数据 (53)表格31:2017年1-5月疫苗批签发数据 (55)表格32:利于中药饮片行业各项政策梳理 (60)表格33:2017年以来医疗器械领域各项政策 (64)表格34:2012-2016年日本与中国各类心血管诊疗情况 (65)表格35:2016年IVD上市公司渠道并购事件表 (69)表格36:IVD行业销售模式比较 (70)表格37:全自动化学发光仪销量比较 (70)表格38:化学发光试剂菜单比较 (71)表格39:2017年上半年药品流通领域新政策 (75)表格40:零售药店排名及销售情况 (78)表格41:海外细胞治疗重点公司产品商业化进展 (79)表格42:2015年以来针对细胞治疗各项政策梳理 (79)表格43:国内公司在细胞免疫布局的最新进展 (80)表格44::目前NIPT定价的省份 (83)表格45:全球主要NIPT测序服务商提供内容对比 (84)表格46:常见的肿瘤基因检测项目和抗肿瘤用药指导 (85)第一节聚焦医改方向,寻找未来龙头一、产业情况:医药制造业整体企稳2017年1-4月,医药制造业主营业务收入同比增长11.2%,相比2016年1-4月上升1.1pp;17年1-4月医药制造业利润总额同比增长14.50%,相比2016年1-4月下降1.1pp。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018年医药一致性评价市场调研分析报告
目录
1.评价赛程过半,BE高峰来临,总局指引方向 (3)
2.619家医疗机构已资格认定,期待备案制落地 (3)
3.强调程序合规,确保数据真实 (4)
4.一致性评价进展:烽火初现,硝烟渐浓 (6)
4.1.已完成35项BE试验 (6)
4.2.扬子江药业开展BE最积极,阿莫西林胶囊BE开展企业最多 7
4.3.北京地区临床机构开展15项BE,开展数目最多 (7)
5.长周期起点,优选优势企业 (8)
6.风险提示 (9)
7.附录 (9)
7.1.已完成35项BE试验 (9)
7.2.619家具有药物临床试验机构资格的医疗机构 (11)
1.评价赛程过半,BE高峰来临,总局指引方向
BE高峰来临。
根据我们之前对一致性评价流程和政策的梳理,综合看
单个品种通过一致性评价的周期约为20-28个月。
如果按照2016年3月
5日国家出台第一份政策文件算起,以2018年底为节点,目前一致性评
价赛程已过半。
考虑到从BE备案到最终通过一致性评价约需13个月左
右的时间,预计多数品种已经或正要进入BE试验,BE高峰即将来临。
图1:单个品种通过一致性评价的周期约为20-28个月
数据来源:CFDA
总局指引方向。
总局于此节点发布《关于药物临床试验机构开展人体生
物等效性试验的公告(2017年第119号)》,公布619家已经认定具有药
物临床试验机构资格、可以开展人体生物等效性试验的医疗机构,并强
调生物等效性试验有关工作的合规性和真实性,为BE高峰指引方向、
保驾护航。
2.619家医疗机构已资格认定,期待备案制落地
广东、上海、江苏资格认定的医疗机构最多。
此次公告公布了619家药
品监督管理部门会同卫生行政部门已经认定具有药物临床试验机构资
格的临床机构,并明确:经认定的药物临床试验机构均可以开展人体生
物等效性试验。
其中,广东地区具有药物临床试验机构资格的临床机构
数目最多,达54家。
