3.2燃烧计算.pdf
【安全课件】第2章燃烧参数计算

•
9、没有失败,只有暂时停止成功!。21.3.721.3.7Sunday, March 07, 2021
•
10、很多事情努力了未必有结果,但是不努力却什么改变也没有。。09:18:1609:18:1609:183/7/2021 9:18:16 AM
•
11、成功就是日复一日那一点点小小努力的积累。。21.3.709:18:1609:18Mar-217-Mar-21
CO2(%) 3 4 5
7~10
表1-2 不同浓度 CO2对身体的影响
对身体的危害情况 刺激,呼吸、脉搏加快,血压升高
头痛,眩晕、耳鸣、心悸 呼吸困难,30min产生中毒症状 数分钟意识不清,出现紫斑,死亡
三、热烟气的危害性作用
1.毒性、刺激性及腐蚀性 2.减光性 3.爆炸性
四、燃烧产物计算
(一)固、液体可燃物燃烧产物体积计算 (二)气体可燃物燃烧产物体积计算 (三)产物百分组成 (四)产物密度计算
(一)固、液体可燃物燃烧产物体积计算
组成:C%+H%+O%+N%+S%+A%+W%=100%
VO.P V 0.CO2 V 0.SO2 V 0.H 2O V 0.N 2
(1C2
S 32
H 2
W 18
2N8)
22.4 100
0.79V0.air
(m3/kg)
(二)气体可燃物燃烧产物体积计算
13、知人者智,自知者明。胜人者有力,自胜者强。21.3.721.3.709:18:1609:18:16March 7, 2021
•
14、意志坚强的人能把世界放在手中像泥块一样任Lor意em揉ip捏su。m 2d0o2lo1r年sit3a月me7t日, c星ons期ec日tet上ur午ad9ip时isc1i8n分g e1li6t.秒Fu0s9c:e1i8d:1u6rn2a1.b3la.7ndit, eleifend nulla ac,
3 燃料与燃烧

87.91 5.49 5.49 0.55 0.55 100Car=Cad(100-Mar,f) 100Car=Cdaf(100-Mar-Aar) 其转化关系见表5-2(改错)
总量
100% 100% 100% 100%
材料工程基础-lvshuzhen
3.1.4 燃料有哪些热工性质?(掌握)
1、基本热工性质——发热量(简称:热值) 2、其它热工性质
3.1.1 燃料是如何分类的?(掌握) 3.1.2 燃料的组成有哪两种表示方法?其基准 内容 有哪些?各种基准之间如何换算?(掌握) 3.1.3 燃料有哪些热工性质?(掌握) 3.1.4 如何选择燃料?(了解)
材料工程基础-lvshuzhen
3.1.燃料的种类和组成
3.1.1 燃料是如何分类的?(掌握) 气体燃料:天然气、煤气、液化气等 液体燃料:汽油、煤油、柴油、重油 固体燃料:煤、柴禾等
根据化学反应计算空气量、烟气量、烟气组成 根据热平衡原理计算火焰温度 计算方法:分析计算法、近似计算法、操作计算法
材料工程基础-lvshuzhen
3.2.2.1 设计计算
分析计算法:已知燃料的种类和元素分析成分,通过化学 反应,根据质量守衡进行定量计算。 假定:
–气体的体积均以标准状态计算; –气体均为理想气体; –计算的基准温度为0℃; –计算时固体、液体燃料用收到基(ar),气体燃料用湿基 – 均在完全燃烧条件下计算空气量 ; – 空气由氧气和氮气组成,其体积百分比为21:79。
(2)实际空气量的计算(掌握)
Va Va0 1.2 5.08 6.09(Nm3 Kg)
例题
材料工程基础-lvshuzhen
(3)理论烟气量V0的计算(掌握)
理论烟气由以下两部分组成:
火灾燃烧中的有关参数计算

3、燃烧速率的计算
• 燃烧速率:单位时间内燃烧消耗的燃烧质量。(对气体, 可用体积来计算)
•
G
3600Van
V
•
Van 火灾中消耗的干空气标 准体积流量
V 单位质量可燃物燃烧所需要的空气量
3、燃烧速率的计算
V的推导过程
依照燃烧前后氮的质量不变,通过质量守恒定律求得。
1kg燃料中含有的氮元素质量为n,单位质量可燃物燃烧所需的空气体积为V, 这部分空气中的氮气质量为:
1、标准条件的空气流量计算
• 对于固态或液态物质用单位质量的可燃物数量来 表示
• 对于气态物质,既可以用单位质量也可以用单位 体积的可燃物数量来表示
• 标准条件:
Tn 273 .15K
Pn 101325 Pa
• 干火灾气体主要成分为:
O2 \ CO2 \ CO \ CH4 \ H2 \ N2
1、标准条件的空气流量计算
mN2
V N2 100
M N2
Vm
1kg可燃物燃烧产生的火灾气体中的N2的体积 VN2 和质量 mN2
VN2
Vdf
[N2] 100
mN2
Vdf
[N2] 100
M N2 Vm
3、燃烧速率的计算
• 燃烧前后氮的质量不变,可知氮的平衡关系为:
Vdf
[N2] M N2 100 Vm
V N2 M N2 100 Vm
chs o
Vo2
22.4( 12
4
32
) 32
2、燃烧时所需空气量的计算
燃烧1kg可燃物所需要的空气体积为:ຫໍສະໝຸດ VoVo2 0.21
22.4 0.21
(c 12
h 4
燃料燃烧计算

第三章 燃料及燃烧过程3-2 燃料燃烧计算一、燃料燃烧计算的内容及目的(一)计算内容:①空气需要量 ②烟气生成量 ③烟气成分 ④燃烧温度 (二)目的:通过对以上内容的计算,以便正确地进行窑炉的设计和对运行中的窑炉进行正确的调节。
二、燃烧计算的基本概念 (一)完全燃烧与不完全燃烧。
1、完全燃烧:燃料中可燃成分与完全化合,生成不可再燃烧的产物。
2、不完全燃烧:化学不完全燃烧:产物存在气态可燃物。
物理不完全燃烧:产物中存在固态可燃物。
(二)过剩空气系数 1、过剩空气系数的概念а=V a /V 0a2、影响过剩空气系数的因素:1)燃料种类:气、液、固体燃料,а值不同; 2)燃料加工状态:煤的细度、燃油的雾化粘度。
3)燃烧设备的构造及操作方法。
3、火焰的气氛:①氧化焰:а>1,燃烧产物中有过剩氧气。
②中性焰:а=1③还原焰:а<1,燃烧产物中含还原性气体(CO 、H 2)三、空气需要量、烟气生成量及烟气成分、密度的计算(一)固体、液体燃料:基准:计算时,一般以1kg 或100kg 燃料为基准,求其燃烧时空气需要量、烟气生成量。
方法:按燃烧反映方程式,算得氧气需要量及燃烧产量,然后相加,即可得空气需要量与烟气生成量。
1、理论空气量计算: 1)理论需氧量: V 0O2=12ar C +4ar H +32ar S -32ar O(Nm 3/kgr)2)理论空气量:V 0a =1004.22(12ar C +4ar H +32ar S -32ar O )21100=0.089C ar +0.267H ar +0.033(S ar -O ar ) (Nm 3/kgr)2、实际空气量计算: V a =а×V o a3、理论烟气生成量的计算:V 0L =V CO2+V H2O +V SO2+V N2=1004.22 (12ar C +2ar H +18ar M +32ar S +28arN )×V o a +0.79V o a =0.01865C ar +0.112H ar +0.01243M ar +0.0068S ar +0.008N ar +0.79V o a4、实际烟气生成量的计算: 1)а>1时,V L = V 0L +(а-1)×V o a2)а<1时,在工程上进上近似认为其燃烧产物中只含有CO 一种可燃气体。
3.2燃烧计算

3.2.1.2基本概念
1.几个假设 (1)气体的体积都用标准状态(0℃、1atm) (2)计算涉及的气体都是理想气体(22.4Bm3/Kmol) (3)计算温度的基准点是0℃ (4)空气看成由氧气和氮气组成 体积比:O2:N2 =21:79 2、几个基本概念 (1)完全燃烧与不完全燃烧
已知燃料组成及烟气组成, 利用碳平衡(燃料中C=烟气中C+灰渣中C)可计算烟气量;
利用氮平衡(燃料中N2+空气中N2=烟气中N2)可计算空气量。
[例题4-5] 某倒焰窑所用煤的收到基组成为:
高温阶段在窑底处测定其干烟气组成为:
灰渣分析:含C17%,灰分83%
高温阶段小时烧煤量为400kg,计算该阶段每小时烟气生成量(Nm3) 及空气需要量(Nm3)
( 1)Va0 ( Bm 3 / kg )
气体燃料
Q net 〈12500KJ / Bm 3时: Va0 0.209Qnet,ar 1000 Va Va0 ( Bm 3 / kg ) VL 0.173Qnet,ar 1000 0.5 ( Bm 3 / kg )
1 ( 1)Va0 ( Bm 3 / kg )
理论空气量:
Va0 VO2
0
100 21
(2)实际空气量:
Va Va0
2 .烟气量及烟气组成的计算 (1)理论烟气量 烟气中CO2含量来源于燃料中CO、CH4、CmHn 中碳的燃烧及气体燃料原有的CO2 :
0 VCO CO2 CO CH 4 mCm H n 2
指单位燃料与理论空气进行完全燃烧生成的烟气(Bm3/Kg)。
CO 2 来源于碳燃烧,即VCO2
0
C ar 22.4 12 100
3.燃料燃烧解析
空气过剩系数
实际空气量:
实际供给的空气量 La 理论论空气L0
a的一些经验值: 气体燃料: 液体燃料: a=1.05~1.15 a=1.15~1.25
La aL0
块状固体燃料:a=1.3~1.7 煤粉燃料: a=1.1~1.3
2.气体燃料完全燃烧生成烟气量的计算 生成烟气的总体积应为各可燃组分燃烧生成物的体积、 燃料中的不可燃组分及燃烧所用空气带入氮的体积。
3.燃烧产物组成计算
CO2 %
CO CH 4 nCn H m CO2
Va
1 100 100%
m 1 H 2 CH C H H S H O 2 4 n m 2 2 2 100 100% H 2O% Va
SO2 %
t 20 4 4 a(t 20)
式中:a――温度修正系数,1/℃
3)固体燃料 固体燃料是由复杂的有机化合物组成的,其基本组 成元素有C、H、O、N、S,还有一些水分和灰分。 天然的固体燃料是煤,按其形成年代不同可分为泥 煤、褐煤、烟煤和无烟煤。
3.2 燃烧计算
燃烧计算的主要内容包括:一定量燃料燃烧所需要的空气 量、生成烟气量及燃烧温度的计算等。
燃烧值的计算公式

燃烧值的计算公式燃烧值,也叫热值,这可是个在物理和化学中相当重要的概念。
它指的是燃料完全燃烧时所放出的热量。
那燃烧值的计算公式是啥呢?咱先来说说燃烧值的基本定义哈。
燃烧值通常用字母 q 表示,单位是焦耳每千克(J/kg)或者焦耳每立方米(J/m³)。
如果是固体或者液体燃料,咱们一般用焦耳每千克;要是气体燃料呢,就常用焦耳每立方米。
燃烧值的计算公式其实挺简单的,就是 Q = m × q 或者 Q = V × q 。
这里的 Q 表示燃料燃烧放出的热量,m 表示燃料的质量,V 表示燃料的体积。
比如说,咱来举个例子。
有一堆煤,质量是 10 千克,它的燃烧值是 3×10^7 焦耳每千克。
那这堆煤完全燃烧能放出多少热量呢?咱们就用 Q = m × q 这个公式来算,也就是 Q = 10 × 3×10^7 = 3×10^8 焦耳。
我还记得有一次,在课堂上讲这个知识点的时候,有个学生特别可爱。
我刚在黑板上写下燃烧值的计算公式,他就举起手来问我:“老师,这燃烧值有啥用啊?咱平时也用不上啊。
”我笑着跟他说:“孩子,你可别小瞧这燃烧值,它用处大着呢!就比如说,咱们家里用的天然气,知道它的燃烧值,就能算出烧一顿饭要用多少气,花多少钱。
还有啊,工厂里计算能源消耗,也得靠它呢!”这孩子听了,似懂非懂地点点头,那模样别提多有趣了。
再说说气体燃料的情况。
假如有一种天然气,它的燃烧值是 8×10^7 焦耳每立方米,体积是 5 立方米,那放出的热量就是 Q = V × q = 5 ×8×10^7 = 4×10^8 焦耳。
在实际生活中,了解燃烧值的计算公式能帮助我们更好地理解能源的利用效率。
比如说,不同的燃料燃烧值不同,有的高有的低。
在选择能源的时候,咱们就得考虑到燃烧值这个因素。
燃烧值高的燃料,相同质量或者体积下能放出更多的热量,可能就更经济实惠,但也得考虑其他因素,像获取的难易程度、对环境的影响等等。
第二章 燃料燃烧计算

气体燃料的理论空气量
CH4
1kmol CH4 1Nm3
+ 2O2 = CO2 + 2H2O
2×4.76 kmol空气 2×4.76Nm3
+
=
1kmol CO2 1Nm3
+
2kmol H2O 2Nm3
+
7.52kmol N2 7.52Nm3
CnHm
+
(n+m/4)O2
=
nCO2
+ (m/2)H2O
1Nm3 n Nm3 4.76×(n+m/4) + = 3空气 CnHm CO2 Nm
代入下式:
Vgyb 100(V RO 2 VCO VCH 4 )/(RO 2 CO CH 4 )
' ' '
得到固、液体燃料不完全燃烧干烟气量:
Vgyb 1.866(C ar 0.375S ar )/(RO 2 CO CH 4 )
' ' '
•气体燃料不完全燃烧干烟气量
CO2体积:
VCO2
1 [CO] [CO 2 ] n[Cn Hm ] 100
SO2体积:
VSO 2
[H 2S] 100
0 N2体积: VN [N 2 ] 0.79V K 100
2
H2O体积:
VH 2O 1 m 0 [H 2 ] [H 2O] [C n H m ] [H 2S] 0.00124W g VK 100 2
2
V •燃料水: h O 22.4/18 War /100 0.0124 War
sh 0 VH 2O 0.00161d VK •湿空气中的水:
3 吉大燃烧学 工程燃烧计算

Aar为燃料中的灰分质量分数; afh为烟气携带出炉膛的飞灰占总灰分的质量分数; my为每公斤燃料的烟气量,kg/kg,包括1kg燃料燃烧所需空气 量及由空气所含水分转入烟气的质量: my=1-Aar+(1+dk)1.293V0 dk为干空气的含湿量
100my
产物成分计算
• 为与燃料成分相区别,上标 ’(体积百分数)
(3-18)
3.3 燃烧烟气量的计算
3.3.1 理论烟气量的计算
• 1kg固体或液体燃料在=1的情况下完全燃烧,所生成的烟气量称 为理论烟气量(m3/kg): Vy0=VRO2+VH2O0+VN20 (3-19) • 根据燃烧反应式,式(3-19)右边各项可按下列各式计算: 22.4/28/100 VRO2=0.01866 Car+0.007Sar= 0.01866 (Car+0.375Sar) (3-20) VH2O0=0.111Har+0.0124Mar+0.0161V0 (3-21) VN20=0.008Nar+0.79V0 (3-22)
3.2 燃烧空气量的计算
3.2.1 理论空气量
• 1kg(或1m3)燃料完全燃烧时所需的最小空气量( 燃烧产物烟气中氧气为零)称为理论空气需要量,简称 理论空气量。 • 理论空气量也就是从燃烧化学反应式出发,计算出 的1kg(或1m3)燃料所含可燃元素完全燃烧所需的空气 量。用容积V0表示,用质量L0表示。 • 通常先求出1kg燃料完全燃烧所需的O2量,然后再 折算成空气量。
2 H2 28 CO 1.293 Vk 22.4 100 22.4 100 Vy
m产物 m燃 m空 Vy Vy
kg/m3
燃烧热计算公式

燃烧热计算公式燃烧热是指物质在燃烧过程中释放的能量。
它是热化学性质的一个重要指标,对于了解物质的燃烧特性和应用具有重要意义。
燃烧热的计算公式可以根据不同的燃烧反应类型和反应条件有所不同。
下面介绍几种常见的燃烧热计算公式。
1. 单质燃烧反应的燃烧热计算公式对于单质燃烧反应,燃烧热的计算公式可以根据反应类型和反应条件来确定。
例如,对于氢气燃烧反应:2H2(g) + O2(g) → 2H2O(l) ΔH = -483.6 kJ/mol上述反应中,氢气和氧气反应生成水,释放的热量为483.6 kJ/mol。
这个值可以通过实验测定得到。
2. 化合物的燃烧热计算公式对于化合物的燃烧热计算,需要了解化合物的燃烧反应式以及燃烧反应的燃烧热值。
例如,对于乙醇的燃烧反应:C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l) ΔH = -1367 kJ/mol上述反应中,乙醇和氧气反应生成二氧化碳和水,释放的热量为1367kJ/mol。
这个值可以通过实验测定得到。
3. 燃烧热的计算公式应用燃烧热的计算公式可以用于预测燃烧过程中的能量变化,也可以用于了解不同物质的燃烧特性。
例如,可以通过计算燃烧热来确定某种燃料的热值,从而评估其作为燃料的适用性。
同时,燃烧热的计算公式也可以用于燃烧反应的热平衡计算,从而确定反应的热效应。
总结起来,燃烧热的计算公式可以根据不同的燃烧反应类型和反应条件有所不同。
通过实验测定或计算,可以确定燃烧反应的燃烧热值,从而了解反应的能量变化和燃烧特性。
燃烧热的计算公式在热化学研究和工业应用中具有重要的意义。
燃料燃烧及热平衡计算参考

燃料燃烧及热平衡计算参考3.1 城市煤气的燃料计算3.1.1 燃料成分表2.2 城市煤气成分(%)[2]成分 CO 2 CO CH 4 C 2H 6 H 2 O 2 N 2 合计 含量105225462101003.1.2 城市煤气燃烧的计算 1、助燃空气消耗量[2](1)理论空气需要量Lo=21O O 0.5H H 3.5C CH 20.5CO 22624-++⨯+ Nm 3/Nm 3 (3.1)(3.1)式中:CO 、CH 4 、 C 2H 6 、 H 2 、 O 2——每100Nm 3湿气体燃料中各成分的体积含量(Nm 3)。
则Lo=212465.055.322255.0-⨯+⨯+⨯+⨯= 4.143 Nm 3/Nm 3(2)实际空气需要量L n =nL 0, Nm 3/Nm 3 (3.2)(1.2)式中:n ——空气消耗系数,气体燃料通常n=1.05 1.1 现在n 取1.05,则L n =1.05×4.143=4.35 Nm 3/Nm 3(3)实际湿空气需要量L n 湿=(1+0.001242H O g 干)L n ,Nm 3/Nm 3(3.3) 则L n 湿=(1+0.00124×18.9)×4.35=4.452 Nm 3/Nm 3 2、天然气燃烧产物生成量 (1)燃烧产物中单一成分生成量CO)H 2C CH (CO 0.01V 6242CO 2+++⨯=’(3.4)2O V 0.21(=⨯′0n-1)L(3.5) 22n N V (N 79L )0.01=+⨯′(3.6))L 0.124g H H 3C (2CH 0.01V n 干O H 2624O H 22+++⨯=(3.7)式中CO 、CH 4 、 C 2H 6 、 H 2 ——每100Nm 3湿气体燃料中各成分的体积含量。
则0.475)5222(100.01V 2CO =+⨯++⨯= Nm 3/Nm 34.4131)(1.050.21V 2O ⨯-⨯==0.046 Nm 3/Nm 3 01.0)35.47910(V 2N ⨯⨯+==3.54 Nm 3/Nm 34.35)18.90.124465322(20.01V O H 2⨯⨯++⨯+⨯⨯==1.152 Nm 3/Nm 3(2)燃烧产物总生成量实际燃烧产物量V n = V CO2+V O2+V N2+V H2O Nm 3/Nm 3(3.8) 则V n =0.47+0.046+3.54+1.152=5.208 Nm 3/Nm 3理论燃烧产物量V 0=V n -(n -1)L O (3.9)V 0=5.208-(1.05-1)×4.143=5.0 Nm 3/Nm 3(3) 燃料燃烧产物成分[2]%100V V CO nCO 22⨯=(3.10)%100V V O n O 22⨯=(3.11)%100V V N nN 22⨯=(3.12)100%V V O H nO H 22⨯=(3.13) 则9%%1005.2080.47CO 2=⨯=0.8%%1005.2080.046O 2=⨯=68%%1005.2083.54N 2=⨯=22.2%100%5.2081.152O H 2=⨯=3.1.3 天然气燃烧产物密度的计算[3] 已知天然气燃烧产物的成分,则:ρ烟=10022.432O 28N O 18H 44CO 2222⨯+++,kg/Nm 3(3.14)式中:CO 2、H 2O 、N 2、O 2——每100Nm 3燃烧产物中各成分的体积含量ρ烟= 217.110022.40.832682822.218944=⨯⨯+⨯+⨯+⨯ Nm 3/Nm 33.1.4 天然气发热量计算 高发热量Q 高=39842CH 4+70351C 2H 6+12745H 2+12636CO (kJ/Nm 3 (3.15) 低发热量Q 低= 35902CH 4+64397C 2H 6+10786H 2+12636CO (kJ/ Nm 3)(3.16)式中:CH 4、C 2H 6、 H 2、CO ——分别为天然气中可燃气体的体积分数(%)。
第二章-燃料及燃料燃烧计算

灰分(Ash): 煤中不可燃矿物杂质,成分十分复杂,大多数煤的灰分 含量7%~40%。
1)A 可燃物减少,Qdw ,着火困难,灰渣量增加,运行 操作繁重;
2)A 且ST ,炉内易结渣,使受热面传热恶化, D
3)A
,烟气流速wy
wy wy
对流受热面磨损严重 对流受热面积灰、堵灰,传热系数K
Car+Har+Oar+Nar+Sar+Aar+Mar=100% 2.空气干燥基ad; 表示在不含外在水分的条件下,燃料各组成成分的质量 百分数总和, 是实验室煤质分析所用煤样的成分组成。
Cad+Had+Oad+Nad+Sad+Aad+Mad=100%
3. 干燥基d; 表示在不含水分的条件下干燥燃料各组成成分的质量百 分数总和 干基中各成分不受水分变化的影响
与燃烧容易。
VAMST分类标准
四、液体燃料和气体燃料
锅炉燃用的液体燃料主要是重油和渣油。
重油——是石油提炼汽油、煤油和柴油后的剩余物, 渣油——是进一步提炼后的剩余物。 重油
重油的成分与煤一样,也是由碳、氢、氧、氮、硫和灰 分、水分组成。它的主要元素成分是碳和氢,其含量甚 高(Car=81~87%,Har=11~14%),而灰分、水分的含量很
空气中只有O2和N2成分,其容积比为: 气体容积计算的单位均为Nm3/kg。
Cd+Hd+Od+Nd+Sd+Ad=100% 4. 干燥无灰基daf; 表示在不含水分和灰分的条件下,干燥无灰燃料各组成 成分的质量百分数总和, 干燥无灰基中只包含燃料的可燃成分,各成分不受水分 和灰分变化的影响, 煤炭交易。
3-2 燃烧计算

V =V0 +(α −1) Va0
2 2
N 79 Car 0 燃料) 燃料) (Nm3/kg燃料) N = ar × 22.4 + α VO × (Nm3/kg燃料) 燃料 V 燃料 = × 22.4 28 21 12
0 3 燃料) ( 燃料 O2 Nm /kg燃料)
VO2 = (α − 1) V
例1 已知发生炉煤气组成如下 COv% H2v% CH4v% C2H4v% CO2v% O2v% N2v% H2Ov% 29.0 15.0 3.0 0.6 7.5 0.2 42.0 2.7 空气过剩系数α为 空气过剩系数 为1.2 求该煤气完全燃烧所需空气量、生成烟气量、 求该煤气完全燃烧所需空气量、生成烟气量、烟气组成以及 标态烟气密度。 标态烟气密度。
x/(21.39-1.88x)=0.05 x=0.98 烟气组成: CO2 烟气组成:CO 0.98 2.91 烟气量
N2 15.66
H2O 3.5
烟气组成: 烟气组成:CO 烟气量 干烟气% 干烟气 湿烟气% 湿烟气 0.98 5.0 4.2
CO2 2.91 14.9 12.6
VSO2
S ar = × 22.4 (Nm3/kg燃料) 燃料) 燃料 32
VH 2O
M ar H =( + ) × 22.4 (Nm3/kg燃料) 燃料) 燃料 18 2
②α<1时
导致烟气中CO生成的不足氧量为:(1-α)VO20(Nm3/kg) 生成的不足氧量为:( ) 导致烟气中 生成的不足氧量为:( ) ∵ 2C+O2→2CO 烟气中的CO量为:VCO=2(1-α)VO20(Nm3/kg) 量为: ∴ 烟气中的 量为 ( ) ) 又烟气中的为: 又烟气中的为:
初中化学知识点归纳物质的燃烧热与燃烧热变化计算公式

初中化学知识点归纳物质的燃烧热与燃烧热变化计算公式初中化学知识点归纳-物质的燃烧热与燃烧热变化计算公式化学燃烧是指物质与氧气在一定条件下发生的放热反应。
在燃烧过程中,物质与氧气发生反应,释放出能量,同时形成新的物质。
通过学习燃烧反应,我们可以了解物质的燃烧热以及燃烧热变化的计算公式。
1. 燃烧热的概念与计算燃烧热是指物质在完全燃烧时所释放出的热量。
燃烧热的计量单位是焦耳/克(J/g)或千焦耳/克(kJ/g)。
燃烧反应一般以化学方程式表示。
例如,苯与氧气发生燃烧反应的化学方程式为:2C6H6(l) + 15O2(g) → 12CO2(g) + 6H2O(g)燃烧反应式中的系数表示了物质的摩尔比例。
通过实验测定,我们可以得到苯燃烧生成的热量,即燃烧热。
例如,苯的燃烧热为-3267 kJ/mol。
2. 燃烧热的影响因素物质的燃烧热受到多种因素的影响,主要包括以下几点:a. 物质的化学组成:不同物质的燃烧热不同,这与其化学结构以及键能有关。
b. 燃烧反应的类型:不同类型的燃烧反应,如完全燃烧、不完全燃烧和反应热,其燃烧热也有所不同。
3. 燃烧热变化的计算公式燃烧热变化是指物质在反应中燃烧热的变化量。
根据热力学定律,燃烧热变化可以通过反应物和生成物的燃烧热之差来计算。
燃烧热变化计算公式为:ΔH = ∑(ΔHf[生成物]) - ∑(ΔHf[反应物])其中,ΔHf表示生成物与反应物的标准燃烧热(焦耳/摩尔或千焦耳/摩尔)。
燃烧热变化的计算公式可以通过燃烧反应的化学方程式和各物质的标准燃烧热来确定。
标准燃烧热是指在标准状况下生成1摩尔产物或消耗1摩尔反应物所释放或吸收的热量。
4. 实例分析例如,我们以甲烷的燃烧反应为例进行分析。
甲烷的燃烧方程式为:CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)通过实验测定,我们可以得到甲烷的燃烧热为-890 kJ/mol。
假设反应温度为298 K,压力为标准大气压,可计算燃烧热变化。
燃料燃烧计算

燃料燃烧计算第三章燃料及燃烧过程3-2 燃料燃烧计算一、燃料燃烧计算的内容及目的(一)计算内容:①空气需要量②烟气生成量③烟气成分④燃烧温度(二)目的:通过对以上内容的计算,以便正确地进行窑炉的设计和对运行中的窑炉进行正确的调节。
二、燃烧计算的基本概念(一)完全燃烧与不完全燃烧。
1、完全燃烧:燃料中可燃成分与完全化合,生成不可再燃烧的产物。
2、不完全燃烧:化学不完全燃烧:产物存在气态可燃物。
物理不完全燃烧:产物中存在固态可燃物。
(二)过剩空气系数 1、过剩空气系数的概念а=V a /V 0a2、影响过剩空气系数的因素:1)燃料种类:气、液、固体燃料,а值不同;2)燃料加工状态:煤的细度、燃油的雾化粘度。
3)燃烧设备的构造及操作方法。
3、火焰的气氛:①氧化焰:а>1,燃烧产物中有过剩氧气。
②中性焰:а=1③还原焰:а<1,燃烧产物中含还原性气体(CO 、H 2)三、空气需要量、烟气生成量及烟气成分、密度的计算(一)固体、液体燃料:基准:计算时,一般以1kg 或100kg 燃料为基准,求其燃烧时空气需要量、烟气生成量。
方法:按燃烧反映方程式,算得氧气需要量及燃烧产量,然后相加,即可得空气需要量与烟气生成量。
1、理论空气量计算: 1)理论需氧量: V 0O2=12ar C +4ar H +32ar S -32ar O(Nm 3/kgr)2)理论空气量:V 0a =1004.22(12ar C +4ar H +32ar S -32ar O )21100=0.089C ar +0.267H ar +0.033(S ar -O ar ) (Nm 3/kgr)2、实际空气量计算:V a =а×V o a3、理论烟气生成量的计算:V 0L =V CO2+V H2O +V SO2+V N2=1004.22 (12ar C +2ar H +18ar M +32ar S +28arN )×V o a +0.79V o a =0.01865C ar +0.112H ar +0.01243M ar +0.0068S ar +0.008N ar +0.79V o a4、实际烟气生成量的计算: 1)а>1时,V L = V 0L +(а-1)×V o a2)а<1时,在工程上进上近似认为其燃烧产物中只含有CO 一种可燃气体。
燃料燃烧计算
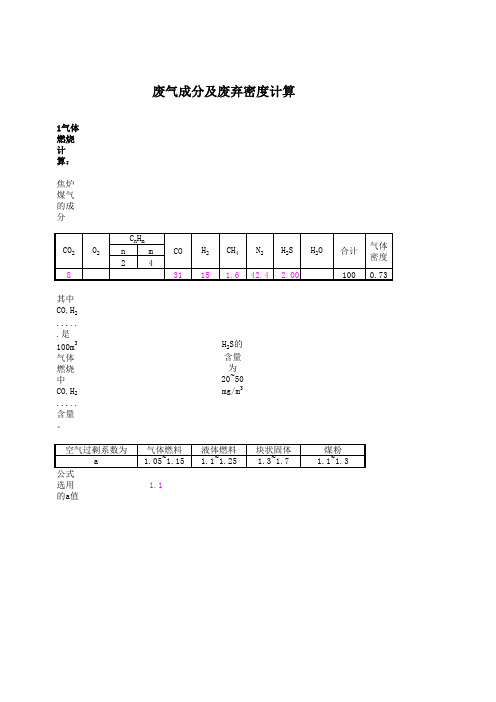
1气体燃烧计算:焦炉煤气的成分其中CO,H 2......是100m 3气体燃烧中CO,H 2.....含量。
H 2S的含量为20~50mg/m 3选用的a值1.1废气成分及废弃密度计算烧1标准立方米的煤气时,0.29m3/Nm3所需标准的立方的氧气的总体积为:所需的理论空1.390m3/Nm3气量为L0:1.25加上过剩的空气量,1.530m3/Nm3所需的空气量为L a:对于1标准立方煤气完全燃烧2.150m3/m3生成的理论烟气量为V o:标准立方煤气完全燃烧生成的实际烟气量为V a : 2.290m 3/m 3燃烧产物组成计算:烟气的标态密度计算: 1.361kg/Nm 3焦炉煤气的标态密度计算:1.124kg/Nm 32.固体、(液体)燃烧计算:煤、或液体的应用基组成1.3选用的a值(1)当燃烧1kg的燃料时,所需145.7Nm3标准的立方的氧气的总体积为:(2)1千克燃料完全燃烧时所6.94Nm3/kg 需的理论空气量为L0:加上过剩的空气量,9.02Nm3/kg 所需的空气量为L a:标准立方煤气完全燃烧7.29Nm3/kg 生成的理论烟气量为V o:对于1标准立方煤气完全燃烧9.38Nm3/kg 生成的实际烟气量为V a:燃烧产物组成计算:(%)烟气的标态密1.33kg/Nm3度计算:公式见硅酸盐工业热工过程及设备(治金工业出版社)。
燃烧热公式计算

燃烧热公式计算燃烧热是指 1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量。
要计算燃烧热,就得用到燃烧热公式啦。
咱先来说说燃烧热的定义哈。
就拿甲烷(CH₄)来说,1 mol 甲烷完全燃烧生成二氧化碳(CO₂)和液态水(H₂O)时放出的热量,这就是甲烷的燃烧热。
那这热量咋算呢?这就得请出咱们的燃烧热公式了。
燃烧热的计算公式是:Q = n × ΔH 。
这里的 Q 表示燃烧放出的热量,n 表示燃烧的物质的量,ΔH 则是燃烧热。
比如说,已知 2 mol 氢气(H₂)燃烧放出的热量是 Q 焦耳,那氢气的燃烧热ΔH 就等于 Q÷2 啦。
我记得之前给学生们讲这个知识点的时候,有个小同学一脸迷糊地问我:“老师,这咋这么绕啊?”我笑着跟他说:“别着急,咱们慢慢来。
”然后我就给他举了个特别形象的例子。
假设咱们要举办一场篝火晚会,准备了一堆木柴。
这堆木柴就好比是要燃烧的物质,数量就是n 。
然后火烧起来后散发的热量,就是Q 。
而每单位木柴能产生的热量,就是燃烧热ΔH 。
咱们再来看个具体的题目。
已知 0.5 mol 乙醇(C₂H₅OH)完全燃烧生成二氧化碳和液态水时放出 1366.8 kJ 的热量,那乙醇的燃烧热是多少呢?这时候咱们就可以用公式来算了。
Q 是 1366.8 kJ,n 是 0.5 mol,所以乙醇的燃烧热ΔH = 1366.8 kJ ÷ 0.5 mol = 2733.6 kJ/mol 。
在实际应用中,燃烧热公式的计算可重要了。
比如在能源研究领域,通过计算不同燃料的燃烧热,就能比较出哪种燃料更高效、更环保。
还有啊,在化工生产中,计算燃烧热可以帮助工程师们设计更合理的反应条件,提高能源利用率,降低成本。
总之,掌握燃烧热公式的计算,对于理解化学反应中的能量变化,以及在实际生活和生产中的应用,都有着至关重要的作用。
希望同学们都能把这个知识点牢牢掌握,在学习和生活中灵活运用,就像熟练地运用一把神奇的钥匙,打开能源世界的大门!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
②燃料燃烧前的加工状态
煤块α=1.3~1.7
③燃烧设备的构造和操作方法
(3) 火焰的气氛 氧化焰 α>1,燃烧产物中有过剩空气
中性焰
α=1,燃烧产物中没有过剩 空气,也没有可燃气体
还原焰
α<1,燃烧产物中含有 CO、H2、CH4 等可燃气体
CO<2%—弱还原性 CO3-5%—强还原性
从理论上 讲温度最
2H 2 S
N2]
1 100
Va0
79 100
(2)实际烟气量:
A、当 1,实际烟气量为
Vl Vl0 1Va0
烟气中VCO2,VH
,V 2O
2
H2S
2CH 4
n
1
2 Cm H n ) 100
烟气中SO2含量来源于H 2 S的氧化
V0 SO2
H
2
S
1 100
烟气中来源于燃料中的及空气中的氮
V0 N2
N
2
1 100
Va0
79 100
理论烟气量:
Vl0
[CO
CO2
H2
H 2O
3CH 4
(m
n 2 )Cm H n
高
3.2.2空气需要量、烟气生成量及成分 及密度的计算
3.2.2.1分析计算法
分析计算法 据燃料的成分分析进行计算。 (一)固体和液体燃料 1.理论空气和实际空气量的计算 (1)理论空气量: 燃料完全燃烧时所需的最低空气量(Bm3/Kg)。 基准:1Kg收到基燃料,其组成为 :
Car H ar Oar N ar Sar Aar M ar 100% 可燃成分:Car,H ar,Sar
燃料中可燃成分与空气中氧起化学反应 生成不再可燃的产物(CO2、H2O、SO2)
不完全燃烧
燃料中可燃成分与空气中氧化合不完全 生成的产物中有可燃成分(CO、H2)
化学不完全燃烧
由于空气不足或燃料与空气 混合不好而造成部分燃料未 参加燃烧反应或燃烧不好
机械不完全燃烧
由于机械设备原因而使燃料 未参加燃烧反应即被排走
Aar ) 100
Va
1.2 9 3
VL
(二)气体燃料 1 . 理论空气量和实际空气量: (1) 理论空气量
基准:1Bm3燃料 其组成为体积百分比含量,其中可燃成分为 CO、H 2、CH 4、Cm H n、及H 2 S等
理论需氧量:
V0 O2
[0.5CO 0.5H2O 2CH 4
(m
n 4)Cm H n
3 2
H2S
O2
]
1 100
理论空气量:
Va0
VO2 0
100 21
(2)实际空气量:
Va Va0
2 .烟气量及烟气组成的计算 (1)理论烟气量
烟气中CO2含量来源于燃料中CO、CH4、CmHn 中碳的燃烧及气体燃料原有的CO2 :
V0 CO2
CO2
CO CH 4
mCm
H
n
1 100
烟气中H 2O含量来源于燃料中H 2,CH 4,Cm H n,H 2S 中的氢氧化物及燃料中原有的H 2O
C O2 CO2
x1
Car 12
22.4 100
H2
1 2
O2
H 2O
x2
H ar 4
22.4 100
S O2 SO2
x3
Sar 32
22.4 100
共需氧量:
x1
x2
x3
22.4 Car 100 12
H ar 4
Sar 32
需从空气中获得的氧 :
V0 O2
22.4 Car 100 12
提高燃烧温度
3.2.1.2基本概念
1.几个假设 (1)气体的体积都用标准状态(0℃、1atm) (2)计算涉及的气体都是理想气体(22.4Bm3/Kmol) (3)计算温度的基准点是0℃ (4)空气看成由氧气和氮气组成 体积比:O2:N2 =21:79
2、几个基本概念 (1)完全燃烧与不完全燃烧
完全燃烧
不完全燃烧 造成燃料损失 的危害 降低燃烧温度、影响炉内气氛、影响产品质量
(2)过剩空气系数
实际空气量Va与理论空气量Va0 的比值:
Va Va 0
或Va
Va 0
影响过剩空气系数 的因素:
①燃料的种类 气体燃料 α=1.05~1.10
液体燃料 α=1.08~1.20
固体燃料 煤粉α=1.1~1.25
3.2燃料燃烧计算
3.2.1计算的内容及基本概念 3.2.1.1计算内容
目的:为了设计窑炉的需要;为了操作窑炉的需要。 内容: (1)空气量的计算:鼓风机选型计算的依据 (2)烟气量的计算:排风机选型、烟囱计算的依据 (3)烟气成分的计算:通过空气系数判断燃烧操作情况 (4)燃烧温度的计算:分析影响因素,改进燃烧条件,
Nar 28
22.4 100
VO2
0
79 21
SO2量:VSO2
Sar 32
22.4 100
3、烟气组成及密度计算 组成:
CO2
VCO2 Vl
100%,
H
2O
VH 2O Vl
100%
密度:
44CO2 18H 2O 64SO2 28N 2 32O2
22.4 100
或:
(1
(Car 12
H ar 2
M 18
Sar 32
N ar 28
)
22.4
VO02
79 21
(2)实际烟气量
A、当 1,实际烟气量为:
Vl Vl 0 1Va0
烟气各组成为 : VCO2、VH2O ,VSO2 , 计算方法与理论烟气中的计算相同
氮气和氧气的组成计算如下:
VN2
N ar 28
22.4 100
Va
79 100
VO2 1 VO2
B、当 1,实际烟气量
Vl
Vl 0
1 Va0
79 100
烟气中CO量:VCO 21 VO2 0
CO2量:VCO2
Car 12
22.4 100
21 VO2 0
H 2O量:VH 2O
Har 12
M ar 18
.22.4 100
N2量:VN2
H ar 4
Sar 32
Oar 32
22.4 100
理论空气量:
Va0
V0 O2
100 22.4
(2)实际空气量: Va Va 0
2.烟气生成量的计算
(1)理论烟气量:
指单位燃料与理论空气进行完全燃烧生成的烟气(Bm3/Kg)。
CO2来源于碳燃烧,即VCO2 0
Car 12
22.4 100
H 2O来源于氢的燃烧和燃料中水分的蒸发
V0 H 2O
Har 2
M ar 18
22.4 100
SO2来源于硫的燃烧 N 2来源于燃料和空气,
V 0 S ar 22.4 SO2 32 100
V0 S O2
Nar 28
22.4 100
VO02
79 21
理论烟气量:
Vl 0 VCO2 0 VH2O 0 VSO2 0 VN2 0
