化学平衡图像题目
(完整版)化学平衡图像题专题试题
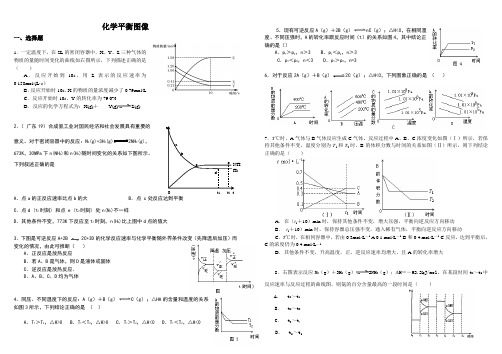
化学平衡图像一、选择题1.一定温度下,在2L 的密闭容器中,X 、Y 、Z 三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是( )A .反应开始到10s ,用Z 表示的反应速率为0.158mol/(L·s )B .反应开始时10s ,X 的物质的量浓度减少了0.79mol/LC .反应开始时10s ,Y 的转化率为79.0%D .反应的化学方程式为:X(g)+ Y(g)Z(g)2.( 广东19)合成氨工业对国民经济和社会发展具有重要的 意义。
对于密闭容器中的反应:N 2(g)+3H 2(g)2NH 3(g),673K ,30MPa 下n(NH 3)和n(H 2)随时间变化的关系如下图所示。
下列叙述正确的是A .点a 的正反应速率比点b 的大B .点 c 处反应达到平衡C .点d (t 1时刻) 和点 e (t 2时刻) 处n(N 2)不一样D .其他条件不变,773K 下反应至t 1时刻,n(H 2)比上图中d 点的值大3.下图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )A .正反应是放热反应B .若A 、B 是气体,则D 是液体或固体C .逆反应是放热反应.D .A 、B 、C 、D 均为气体4.同压、不同温度下的反应:A (g )+B (g )C (g );△HA 的含量和温度的关系如图3所示,下列结论正确的是 ( )A .T 1>T 2,△H>0B .T 1<T 2,△H>0C .T 1>T 2,△H<0D .T 1<T 2,△H<05.现有可逆反应A (g )+2B (g )nC (g );△H<0,在相同温度、不同压强时,A 的转化率跟反应时间(t )的关系如图4,其中结论正确的是()A .p 1>p 2,n >3B .p 1<p 2,n >3C .p 1<p 2,n <3D .p 1>p 2,n=36.对于反应2A (g )+B (g )2C (g );△H<0,下列图象正确的是 ( )7.T ℃时,A 气体与B 气体反应生成C 气体。
(完整word版)化学平衡图像专项练习题

化学平衡图像一、选择题(本题包括35小题,每小题2分,共70分。
每小题有一个或两个选项符合题意。
)1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是()A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)2.T℃时,A气体与B气体反应生成C气体。
反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动B.t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大3.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到过化学平衡B.该反应在T2温度时达到过化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动4.右图表示反应N 2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是()A.t0~t1B. t2~t3C. t3~t4D. t5~t65.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是()A .10~15 min 可能是加入了正催化剂B .10~15 min 可能是降低了温度C .20 min 时可能是缩小了容器体积D .20 min 时可能是增加了B 的量6.在一定条件下,将X 和Y 两种物质按不同的比例放入密闭容器中反应,平衡后测得X ,Y 的转化率与起始时两物质的物质的量之比n x /n y 的关系如图所示,则X ,Y 的反应方程式可表示为( )A . 2X +Y 3ZB . 3X +2Y 2ZC . X +3Y ZD . 3X +Y Z7.可逆反应aX (g )+bY (g )cZ (g )在一定温度下的一密闭容器内达到平衡后,t 0时改变某一外界条件,化学反应速率(v )-时间(t )图象如右图。
知识点21化学平衡图像习题

知识点21 化学平衡图像习题1.对达到平衡的可逆反应X+Y W+Z ,增大压强则正、逆反应速率(v )的变化如下图,分析可知X ,Y ,Z ,W的聚集状态可能是( )A .Z ,W 为气体,X ,Y 中之一为气体B .Z ,W 中之一为气体,X ,Y 为非气体C .X ,Y ,Z 皆为气体,W 为非气体D .X ,Y 为气体,Z ,W 中之一为气体2.由某可逆反应测绘出图象如下图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )A.反应物中一定有气体B.生成物中一定有气体C.正反应一定是放热反应D.正反应一定是吸热反应 3.右图表示外界条件(T, P )的变化对下列反应的影响: L(s)+G(g)2R(g)(正反应为吸热反应),则纵座标可以表示的是( ) A .平衡时,混合气体中R 的百分含量 B .平衡时,混合气体中G 的百分含量 C .G 的转化率 D .L 的转化率4.下图Ⅰ、Ⅱ、Ⅲ分别代表①③、②、④反应,则Y 轴是指( ) ① N 2(g)+3H 2(g) 2NH 3(g);△H=-Q ② H 2(g)+I 2(g) 2HI(g); △H=+Q ③ CO(g)+2H 2(g) CH 3OH(g); △H=-Q④ 2SO 3(g)2SO 2(g)+O 2(g); △H=+QA .平衡混合气中一种生成物的百分含量B .平衡混合气中一种反应物的百分含量C .平衡混合气中一种生成物的转化率D .平衡混合气中一种反应物的转化率 5.反应mA(固)+nB(气)eC(气)+fD(气),反应过程中,当其它条件不变时,C 的百分含量(C%)与温度(T )和压强(P )的关系如下图,下列叙述正确的是( )A . 达平衡后,加入催化剂,则C%增大B .达到平衡后,若升温,平衡向左移动C .化学方程式中n>e+fD .达到平衡后,增加A 的量有利于平衡向右移动7.若反应:L (s )+aG (g ) bR (g )达到平衡时,温度和压强对该反应的影响如右图所示,图中:压强p 1>p 2,x 轴表示温度,y 轴表示平衡混和气中G 的体积分 YP 1P 2数。
化学平衡图像例题
例3:在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L,在不同条件下R的百分含量R% 的变化情况如下图,下列叙述正确的是( ) A、正反应吸热,L是气体 B、正反应吸热,L是固体 C、正反应放热,L是气体 D、正反应放热,L是固体或液体
例4:25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量 金属锡(Sn),发生反应: Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s), 体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。 下列判断正确的是( ) A.往平衡体系中加入金属铅后,c(Pb2+)增大 B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 D.25℃时,该反应的平衡常数K=2.2
例5:如图曲线是其它条件不变时某反应物的 最大转化率(α)与 温度(T)的关系曲线 ,图中标出 的1、2、3、4,四个点, 表示V正=V逆的点是 V正>V逆的点是 。
例6.对于可逆反应: A2(g)+3B2(g) 2AB3(g) △H<0,下列图像中正确的是( )
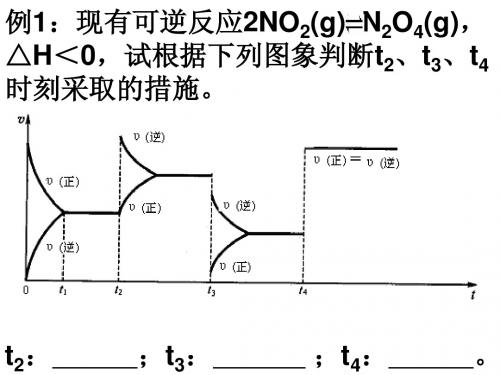
练习:(2014.1)一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1L的密闭容器 中发生反应:X(g)+3Y(g) 2Z(g),下 逆反应2NO2(g) N2O4(g), △H<0,试根据下列图象判断t2、t3、t4 时刻采取的措施。
t2 :
; t3 :
;t4:
。
例2:对于反应mA(g) + nB(g) pC(g)+qD(g) △H=QkJ/mol,分析 下列图像:
P一定,△H T一定,m+n T一定,m+n
0 p+q p+q
选修四《化学平衡图像分析》专题练习
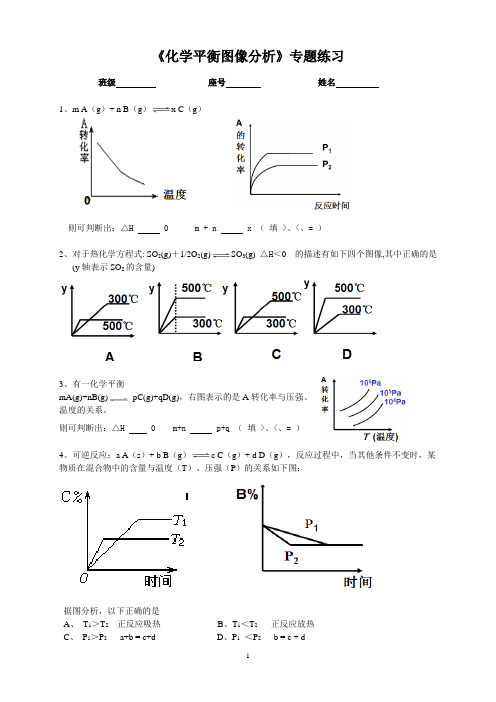
《化学平衡图像分析》专题练习班级座号姓名1、m A(g)+ n B(g)x C(g)则可判断出:△H 0 m + n x (填 >、<、= )2、对于热化学方程式: SO2(g)+1/2O2(g)SO3(g) △H<0 的描述有如下四个图像,其中正确的是(y轴表示SO2的含量)3、有一化学平衡mA(g)+nB(g)pC(g)+qD(g),右图表示的是A转化率与压强、温度的关系。
则可判断出:△H 0 m+n p+q (填 >、<、= )4、可逆反应:a A(s)+ b B(g) c C(g)+ d D(g),反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(P)的关系如下图:据图分析,以下正确的是A、T1>T2正反应吸热B、T1<T2正反应放热C、P1>P2a+b = c+dD、P1<P2 b = c + d5、在容积固定的密闭容器中存在如下反应:A(g) +3B(g)2C(g) △H <0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图所示,下列判断一定错误的是A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高B.图II研究的是压强对反应的影响,且甲的压强较高C.图II研究的是温度对反应的影响,且甲的温度较高D.图III研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高6、对于反应2A(g)+B(g)2C(g)△H<0,下列图象正确的是7、在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L 此反应符合右面图像,下列叙述是正确的是A 正反应吸热,L是气体B 正反应吸热,L是固体C 正反应放热,L是气体D 正反应放热,L是固体或液体8、对于2A(g)+B(g) 2C(g) △H <0,下列图象符合该反应的是。
化学平衡图像随堂练习
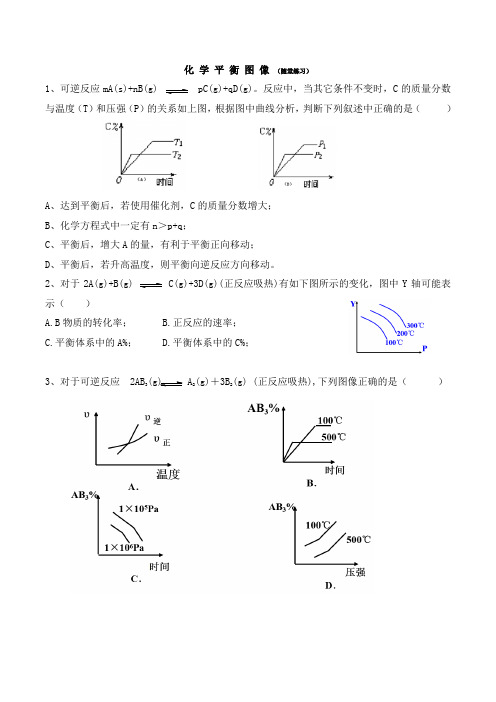
化 学 平 衡 图 像 (随堂练习)1、可逆反应mA(s)+nB(g) pC(g)+qD(g)。
反应中,当其它条件不变时,C 的质量分数与温度(T )和压强(P )的关系如上图,根据图中曲线分析,判断下列叙述中正确的是( )A 、达到平衡后,若使用催化剂,C 的质量分数增大;B 、化学方程式中一定有n >p+q ;C 、平衡后,增大A 的量,有利于平衡正向移动;D 、平衡后,若升高温度,则平衡向逆反应方向移动。
2、对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y 轴可能表示( )A.B 物质的转化率;B.正反应的速率;C.平衡体系中的A%;D.平衡体系中的C%;3、对于可逆反应 2AB 3(g) A 2(g)+3B 2(g) (正反应吸热),下列图像正确的是( )4、在密闭容器中进行下列反应:M (g )+N (g ) R (g )+2L,在不同条件下R 的百分含量R%的变化情况如下图,下列叙述正确的是( )A 、正反应吸热,L 是气体;B 、正反应吸热,L 是固体;C 、正反应放热,L 是气体;D 、正反应放热,L 是固体或液体;5、今有反应x(g) + y(g) 2z(g) △H<0 ,若反应开始经t1秒后达到平衡,又经t2秒后由于反应条件的 改变使平衡破坏到t 3时又过平衡(如图所示),试分析,从t 2到t 3曲线 变化的原因是( )A .增大了x 或y 的浓度B .使用了催化剂C .增加反应体系压强D .升高反应的温度6、图中a 曲线表示一定条件下的可逆反应: X(g) + Y(g) 2Z(g) + W(s) ;△H =QkJ/mol 的反应过程。
若使a 曲线变为b 曲线,可采取的措施是( )A 、加入催化剂B 、增大Y 的浓度C 、降低温度D 、增大体系压强7、某逆反应为:A(g)+B(g) nC(g),下图中的甲、乙、丙分别表示在不同条件下,生成物C 在反 应混合物中的体积分数 C %与反应时间t 的关系。
化学反应速率与化学平衡——图像专题(共52张)
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
化学平衡图像题_含答案

化学反应速率化学平衡之图像题一、选择题1.(2012.武汉模拟)如图为某化学反应的速率与时间的关系示意图。
在t 1时刻升高温度或者增大压强。
速率的变化都符合的示意图的反应是()A. 4NH 3(g) + 5O 2(g)——4NO(g) + 6H 2O(g)B. 2SO 2(g) + O 2(g)——2SO 3(g) A H <0C. H 2(g) + I 2(g):—2HI(g) A H >0D. C(s)+H 2O(g)^—CO(g)+H 2(g) A H >02 .可逆反应m A(g) n B(g)+ p C(s) A H = Q ,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是()A . m >n, Q >0B . m >n + p , Q >0C . m >n , Q <0D . m <n + p , Q <03 .在密闭容器中进行如下反应:H 2(g)+I 2(g)十^2印值),在温度T 1和T 2时,产物的量与反应时间的关系如下图所示,符合图示的正确判断是() A . T 1>T 2,A H >0B . T 1>T 2, A H <0C . T 1V T 2, A H >0D . T 1V T 2, A H <04 . (2011•陕西四校联考)在一密闭容器中有如下反应:L(s) + a G(g)=士皿值),温度和压强对该反应的影响如图所示,其中压强p 1V p 2,由此可判断()A .正反应为放热反应B .化学方程式中的计量数a >bC . G 的转化率随温度升高而减小D .增大压强,容器内气体质量不变A H <0 碘化氢的量C . 4NH 3(g) + 5O 2(g) 4NO(g) + 6H 2O(g) A H <05 .下图是表示外界条件(温度和压强)变化对反应的影响,L (s ) +G (g ) ==2R (g ), △H >0,在图中y 轴是指A.平衡混合物中R 的质量分数B.平衡混合物中G 的质量分数6 .在一定条件下,固定容积的密闭容器中反应:2NO 2 (g ) O 2 (g ) + 2NO (g );△H >0,达到平衡。
高考化学小题精练系列专题34化学平衡图像(含解析)

专题34 化学平衡图像(满分42分时间20分钟)姓名:班级:得分:1.在密闭容器中,反应2X(g)+ Y 2(g) 2XY(g)△H<0,达到甲平衡。
在仅改变某一条件后,达到乙平衡,下列分析正确的是A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低C.图Ⅱ中,t时间是增大了压强D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲【答案】D考点:考查化学平衡图像分析。
2.如图是关于反应A2(g)+B2(g) 2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是A .温度、压强不变,充入一些A 2(g)B .压强不变,降低温度C .压强、温度不变,充入一些与之不反应的惰性气体D .升高温度,同时加压 【答案】A【考点定位】考查化学反应速率与化学平衡【名师点晴】该题的难点是压强对平衡状态的影响,特别是“惰性气体”对化学平衡的影响:①恒温、恒容条件:原平衡体系−−−−→−充入惰性气体体系总压强增大→体系中各组分的浓度不变→平衡不移动。
②恒温、恒压条件:原平衡体系−−−−→−充入惰性气体容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
3.在某容积一定的密闭容器中,有下列的可逆反应:A (g)+B (g)xC (g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数)A .P 3>P 4,y 轴表示B 的转化率 B .P 3<P 4,y 轴表示B 的体积分数C .P 3<P 4,y 轴表示混合气体的密度D .P 3<P 4,y 轴表示混合气体的平均摩尔质量 【答案】A【考点定位】考查化学平衡图象【名师点晴】本题旨在考查学生对化学平衡图象的理解.解答这类图象题,首先要“译”出其化学含义。
化学平衡图像分析经典例题与习题附答案
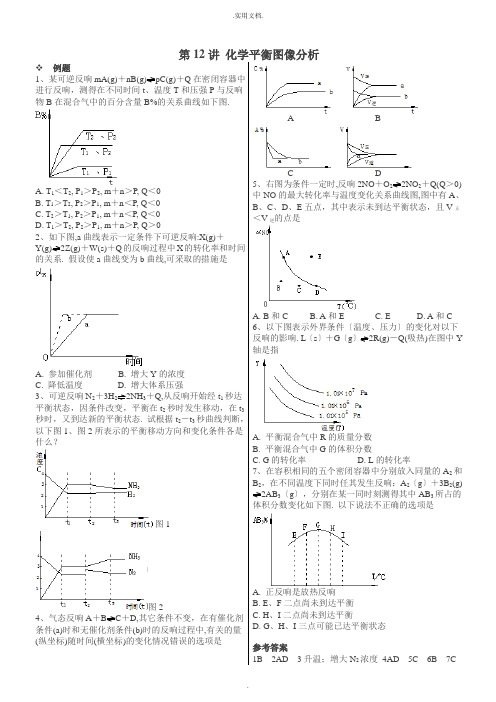
第12讲化学平衡图像分析❖例题1、某可逆反响mA(g)+nB(g)pC(g)+Q在密闭容器中进行反响,测得在不同时间t、温度T和压强P与反响物B在混合气中的百分含量B%的关系曲线如下图.A. T1<T2, P1>P2, m+n>P, Q<0B. T1>T2, P2>P1, m+n<P, Q<0C. T2>T1, P2>P1, m+n<P, Q<0D. T1>T2, P2>P1, m+n>P, Q>02、如下图,a曲线表示一定条件下可逆反响:X(g)+Y(g)2Z(g)+W(s)+Q的反响过程中X的转化率和时间的关系. 假设使a曲线变为b曲线,可采取的措施是A. 参加催化剂B. 增大Y的浓度C. 降低温度D. 增大体系压强3、可逆反响N2+3H22NH3+Q,从反响开始经t1秒达平衡状态,因条件改变,平衡在t2秒时发生移动,在t3秒时,又到达新的平衡状态. 试根据t2-t3秒曲线判断,以下图1、图2所表示的平衡移动方向和变化条件各是什么?图1图24、气态反响A+B C+D,其它条件不变,在有催化剂条件(a)时和无催化剂条件(b)时的反响过程中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的选项是A BC D5、右图为条件一定时,反响2NO+O22NO2+Q(Q>0)中NO的最大转化率与温度变化关系曲线图,图中有A、B、C、D、E五点,其中表示未到达平衡状态,且V正<V逆的点是A. B和CB. A和EC. ED. A和C6、以下图表示外界条件〔温度、压力〕的变化对以下反响的影响. L〔s〕+G〔g〕2R(g)-Q(吸热)在图中Y 轴是指A. 平衡混合气中R的质量分数B. 平衡混合气中G的体积分数C. G的转化率D. L的转化率7、在容积相同的五个密闭容器中分别放入同量的A2和B2,在不同温度下同时任其发生反响:A2〔g〕+3B2(g) 2AB3〔g〕,分别在某一同时刻测得其中AB3所占的体积分数变化如下图. 以下说法不正确的选项是A. 正反响是放热反响B. E、F二点尚未到达平衡C. H、I二点尚未到达平衡D. G、H、I三点可能已达平衡状态参考答案1B 2AD 3升温;增大N2浓度4AD 5C 6B 7C.❖习题1、如右图所示表示平衡混合物中x的百分含量在不同的压强下,随温度变化的情况,在以下平衡体系中,x 可以代表用下横线标明的物质〔反响中各物质为气态〕的是A.N2+2H22NH3 △H<0B.H2+I22HI △H<0C.2SO32SO2+O2 △H>0D.4NH3+5O24NO+6H2O △H<02、在溶积固定的4L密闭容顺中,进行可逆反响:X〔气〕+2Y〔气〕2Z〔气〕并到达平衡,在此过程中,以Y 的浓度改变表示的反响速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影局部面积表示A.X的浓度的减少B.Y的物质的量的减少C.Z的浓度的增加D.X的物质的量的减少3、今有反响X(g)+Y(g)2Z(g)+ △H<0假设反响开始经t1秒后到达平衡,又经t2秒后,由于反响条件的改变使平衡破坏,那么t3时又到达平衡,如图表示,试分析,以t2到t3秒曲线变化的原因是A.增大了X和Y的浓度B.使用了催化剂C.增加了反就体系的压强D.升高了反响的温度4、对到达平衡状态的可逆反响X+Y Z+W,在其他条件不变的情况下,增大压强,反响速率变化图象如右图所示,那么图象中关于X、Y、Z、W四种物质的聚集状态为A.Z、W均为气体,X、Y中有一种是气体B.Z、W中有一种是气体,X、Y皆非气体C.X、Y、Z、W皆非气体D.X、Y均为气体,Z、W中有一种为气体5、可逆反响aA+bB cC中,物质的含量A%和C%随温度的变化曲线如下图,以下说法正确的选项是A.该反响在T1、T3温度时到达过化学平衡B.该反响在T2温度时到达过化学平衡C.该反响的逆反响是放热反响D.升高温度,平衡会向正反响方向移动6、右图表示反响N2〔g〕+3H2〔g〕2NH3〔g〕;ΔH=-92. 2kJ/mol。
完整化学平衡移动图像专题

0
A
B
C
E
D
T
NO转化率
3 、图表示反应N2(g)+3H2(g) 2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( ) A t0~t1 B t2~t3 C t3~t4 D t5~t6
AB
练习:
D
下列图象中,不能表示反应A2(g)+3B2(g) 2AB3(g)(△H<0)平衡体系的是…( )
练习:
2、下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。
二、速度-时间图:
v逆
t1
t
v
v正
由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。
t
v
v正
增大
逆
<
•若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的 v – t 图。
t1 t2
t
v
v逆
v正
二、速度-时间图:
v逆
t1 t2
t
v
v正
•对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
高考化学专题复习:化学平衡图像专题

高(Gao)考化学专题复习:化学平衡图像专题1.对反(Fan)应2A(g)+2B(g)3C(g)+D(?),下列图象的描述(Shu)正确的是A. 依(Yi)据图①,若(Ruo)t1时升高温度,则ΔH<0B. 依据图①,若t1时增大压强,则D是固体或液体C. 依据图②,P1>P2D. 依据图②,物质D是固体或液体【答案】B2.下列图示与对应的叙述相符的是A. 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化B. 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液C. 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOHD. 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大【答案】B3.—定条(Tiao)件下,CO2(g)+3H2(g)CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往(Wang) 2L 恒容密(Mi)闭容器中充入 1 mol CO2和(He)3 mol H2,在不同催化剂作(Zuo)用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是A. a 点 v(正)>v(逆)B. b点反应放热53.7 kJC. 催化剂效果最佳的反应是③D. c点时该反应的平衡常数K=4/3(mol-2.L-2)【答案】A4.如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A. 正反应是放热反应B. A、B一定都是气体C. D一定不是气体D. C可能是气体【答案】B5.下图是恒温下H2(g)+I2(g)2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是A. 升高温(Wen)度B. 增大(Da)压强C. 增大反应(Ying)物浓度D. 加入(Ru)催化剂【答(Da)案】C6.汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。
高中化学平衡图像练习题

高中化学平衡图像练习题一、化学平衡常数与图像1. 已知反应:N2(g) + 3H2(g) ⇌ 2NH3(g),在某温度下,平衡常数K为50。
若反应物和物的初始浓度分别为0.1 mol/L和0.2 mol/L,请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:2SO2(g) + O2(g) ⇌ 2SO3(g),在不同温度下,平衡常数K分别为200和400。
请分别画出两个温度下,SO2和SO3的浓度随时间变化的图像。
二、勒夏特列原理与图像1. 对于反应:H2(g) + I2(g) ⇌ 2HI(g),在体积固定的条件下,向体系中加入一定量的H2。
请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:N2O4(g) ⇌ 2NO2(g),在温度固定的条件下,增大体系的压强。
请画出反应物和物的浓度随时间变化的图像。
三、化学平衡移动与图像1. 对于反应:CaCO3(s) ⇌ CaO(s) + CO2(g),在温度固定的条件下,向体系中通入一定量的CO2。
请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:Fe3O4(s) + 4H2(g) ⇌ 3Fe(s) + 4H2O(g),在温度和压强固定的条件下,移除部分Fe。
请画出反应物和物的浓度随时间变化的图像。
四、化学平衡与反应速率1. 对于反应:2NO(g) + O2(g) ⇌ 2NO2(g),在温度固定的条件下,改变反应物的初始浓度。
请画出反应物和物的浓度随时间变化的图像。
2. 对于反应:A(g) + 2B(g) ⇌ 3C(g),在温度和压强固定的条件下,加入催化剂。
请画出反应物和物的浓度随时间变化的图像。
五、化学平衡计算与图像1. 对于反应:2FeCl3(aq) + H2S(g) ⇌ 2FeCl2(aq) + 2HCl(aq)+ S(s),平衡常数K为100。
已知初始浓度为FeCl3 0.1 mol/L,H2S 0.2 mol/L,请画出反应物和物的浓度随时间变化的图像。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学平衡和速率图像1.速率-时间(v-t )图像方法:A. 首先分清图像的“突变”和“渐变”,出现渐变的为改变浓度。
如下图甲乙甲图中v 正突然变大、v 逆在t1渐变,可见改变的为增加反应物的浓度。
乙图中v 正突然变小、v 逆在t1渐变,可见改变的为减少反应物的浓度。
B.如果图像都为突变,则改变的可能是温度、压强、催化剂等,以及同时改变反应物和生成物的浓度。
这类图像要先看速率,再看平衡。
首先分析速率较之前的大小变化,如果变大,为增大温度、增大压强、加催化剂,再分析此时v 正、v 逆的相对大小,如果v 正>v 逆,表示平衡正向移动,再从上述条件里选择使平衡正向移动的条件。
例1,N 2+ 3H 22NH 3,△H<0建立平衡后加热对速率的影响如图1。
123图1υ图2如图1所示,t 2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 逆>v 正,平衡逆向移动,上述可以使此反应逆向移动的为升温。
如图2所示,t 2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 正>v 逆,平衡正向移动,上述可以使此反应正向移动的为升压。
如图3所示,t2时刻后,图像突变,速率较之前都变小,为降温降压,又因为v 逆>v 正,平衡逆向移动,上述可以使此反应逆向移动的为降温。
图3练习1.下列图像为反应H 2(g)+I 2(g)2HI(g);△H>0 的速率-时间图像,分析下列三个图像改变的条件图1中,t2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 正>v逆,平衡正向移动,上述可以使此反应正向移动的为升温。
图2中,t1时刻后,图像渐变,v逆突然变小,V正渐渐变小,为减少生成物即HI的浓度。
图3中,t0时刻后,图像突变,速率都变大,为升温、升压、加催化剂,又因为v正=v逆,平衡不移动,根据此反应,为升压或者加催化剂。
练习2一密封体系中发生下列反应:N+3H2 2NH3 +Q,下图是某一时间段中反应速率2与反应进程的曲线关系图:回答下列问题:(1)处于平衡状态的时间段是______.(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?、、(3)下列各时间段时,氨的百分含量最高的是______.A.t0~t1B.t2~t3C.t3~t4D.t5~t6【答案】(1)t0~t1、t2~t4、t5~t6(2)升高温度,加了催化剂,降低压强(3)t0~t1练习3一定温度下可逆反应aX(g)+bY(g)cZ(g)在一密闭容器内达到平衡后,t0时刻改变某一外界条件,化学反应速率()随时间(t)变化如图所示。
则下列说法正确的是()A.若a+b=c,则t0时刻只能是增大了容器的压强B.若a+b=c,则t0时刻只能是加入了催化剂C.若a+b≠c,则t0时刻只能是增大了容器的压强D.若a+b≠c,则t0时刻只能是加入了催化剂2.百分含量(转化率)--时间—温度(压强)图像原则:先拐先平,数值大。
先出现拐点的反应先达到平衡,速率较快,曲线表示温度较高、压强较大、或使用催化剂。
C%指产物百分数;B%指某反应物百分数。
在其他条件不变时,改变任一条件如:使用催化剂或温度升高或压强增大,都能缩短到达平衡的时间生成物(反应物)百分含量不变,说明平衡不移动,但反应速率a>b,则a使用催化剂;或是反应前后气体系数不变的可逆反应如H2(g)+I2(g)2HI(g);△H>0,a可能为增大压强下列四个图像为反应A(g)+B(g)C(g)的图像,分析此反应为吸热反应还是放热反应。
T2先拐点,则T2>T1,温度越高,生成物越多,证明温度越高,平衡正向移动,此反应为△H>0下列四个图像为A(g)+2B2C(g),根据图像分析B的状态。
P1>P2,压强越大,生成物越多,压强越大,平衡正向移动,则B为气体如纵坐标为转化率,分析方法一样,反应物转化率越高,为平衡正向移动。
练习4 可逆反应A+aB C+2D(a为化学计量数),已知B、C、D为气态物质.反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是()A.T2>T1,p2>p1B.该反应为放热反应C.若a=2,则A为液态或固态物质D.恒温恒容,增加B的物质的量,B的转化率增大答案:D练习5有mA(g)+nB(g)3C(g)平衡体系,在不同条件下,反应混合物中A、B、C 的体积分数和时间t的关系如图所示:(1)若图A的a和b两条曲线分别表示有无催化剂的情形,曲线表示有催化剂的情形.(2)若图B中c、d两条曲线分别表示不同温度的情形,则曲线表示高温时的情形,该反应正反应方向为(放热、吸热)反应.(3)若图C中e、f表示不同压强时的情形,则曲线表示压强较大时的情形,则方程式中A、B两种物质的系数m、n分别为、答案:bd吸热f11练习6 在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g)ΔH<0,下列分析中不正确的是( )A .图Ⅰ研究的是t0时升高温度对反应速率的影响B .图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响C .图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂D .图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 【答案】 C练习7一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是()A .CO 2(g)+2NH 3CO(NH 2)2(s)+H 2O(g)ΔH <0B .CO 2(g)+H 2(g)CO(g)+H 2O(g) ΔH >0 C .CH 3CH 2CH 2===CH 2(g)+H 2O(g) ΔH >0D .2C 6H 5CH 2CH 3(g)+O 2(g)2C 6H 5CH===CH 2(g)+2H 2O(g) ΔH <0答案:A3.百分含量(转化率)-压强-温度图像(恒压/恒温图)A (g )+2B2C (g )图1 图2P这类图像定一看二,即若化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个变量,分析方法是确定其中一个变量,讨论另外两个变量之间的关系。
图1,先确定压强为106Pa,则反应物的转化率随温度升高而逐渐减小,说明正反应为放热反应,△H<0;再确定温度T不变,作横坐标的垂线,与压强线出现三个交点,分析反应物的转化率随压强的变化可以看出,压强越大,反应物的转化率越高,证明正反应是气体总体积减小的反应,即B为气体。
练习分析图2练习8如图是温度和压强对X+Y⇌2Z 反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是()A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态C.X和Y中只有一种是气态,Z为气态D.上述反应的正反应的△H>0答案:C3.百分含量(转化率)-压强-温度图像(恒压/恒温图)4.其他类型图像①浓度-时间图此类图像能说明各平衡体系组分(或某一成分)在反应过程中的变化情况。
例如:A+B AB反应情况如下图,此类图像要注意各物质曲线的折点(达平衡)时刻相同,各物质浓度变化的内在联系及其比例符合化学方程式中的系数关系。
②速率——温度(压强)图这类图有两种情况,一是不隐含时间因素的速率——时间图,二是隐含时间变化的速率——时间图。
例如:以2SO2(g)+O2(g) 2SO3(g);△H<0为例,v-t(P)图如下图。
③在一定条件下,将X 、Y 按不同的物质的量比放入密闭容器中反应,平衡后测得X 和Y 的转化率(α)与起始两物质的物质的量之比[n(X)/n(Y)]的关系如下图,据此可推知X 、Y 的反应式系数比为3:1。
④曲线是其它条件不变时,某反应物的最大转化率 (α)与温度(T)的关系曲线,图中标出的1、2、3、4四个点,表示v(正)>v(逆)的点是3,表示v(正)<v(逆)的点是1,而2,4点表示v(正)=v(逆)。
综合练习1.在容积不变的密闭容器中存在如下反应:⇌,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )A. 图Ⅰ研究的是时刻增大的浓度对反应速率的影响B. 图Ⅱ研究的是时刻加入催化剂后对反应速率的影响C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低 答案:B2.在容积恒定的密闭容器中进行反应2NO(g)+O 2(g)2NO 2(g).ΔH >0该反应的反应速率(v)随时间(t)变化的关系如图1所示.若t 2、t 4时刻只改变一个条件,下列说法正确的是(填选项序号).A.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态B.在t2时,采取的措施一定是升高温度C.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态D.在t0~t5时,容器内NO2的体积分数在t3时值的最大答案:AD3.T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B、C物质的量变化如图(Ⅰ)所示.若保持其它条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如图(Ⅱ)所示.下列叙述正确的是()A.2 min内A的化学反应速率为0.1 mol/(L•min)B.在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动C.在反应达平衡时,其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大D.在T℃时,若A的浓度减少了1 mol/L,则B的浓度会减少3 mol/L,C的浓度会增加2 mol/L 4.4NH3(g)+5O2(g)===4NO(g)+6H2O(g)ΔH=-1025 kJ/mol,该反应是一个可逆反应.若反应物起始物质的量相同,下列关于该反应的示意图不正确的是(c )5.甲醇是一种可再生能源,具有广泛的开发和应用前景。
在容积为2 L的密闭容器中充入1mol CO与2 mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)CH3OH(g),CO平衡转化率与温度、压强的关系如图所示:(1)p1________p2(填“大于”、“小于”或“等于”)。
(2)若p1为1标准大气压,反应温度为100 ℃,此条件下反应达到平衡:①达到平衡所需的时间为5 min,用H2表示的平均反应速率为____________。
②反应的平衡常数K=_______。
③平衡时,测得其放出热量为a kJ,则该反应的热化学方程式是(3)恒容恒温情况下,再增加1 mol CO与2 mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”),平衡常数________(填“增大”、“减小”或“不变”)。
