化学平衡图像题汇总
(完整版)化学平衡图像题专题试题
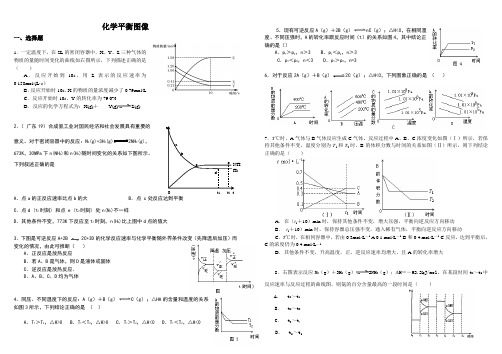
化学平衡图像一、选择题1.一定温度下,在2L 的密闭容器中,X 、Y 、Z 三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是( )A .反应开始到10s ,用Z 表示的反应速率为0.158mol/(L·s )B .反应开始时10s ,X 的物质的量浓度减少了0.79mol/LC .反应开始时10s ,Y 的转化率为79.0%D .反应的化学方程式为:X(g)+ Y(g)Z(g)2.( 广东19)合成氨工业对国民经济和社会发展具有重要的 意义。
对于密闭容器中的反应:N 2(g)+3H 2(g)2NH 3(g),673K ,30MPa 下n(NH 3)和n(H 2)随时间变化的关系如下图所示。
下列叙述正确的是A .点a 的正反应速率比点b 的大B .点 c 处反应达到平衡C .点d (t 1时刻) 和点 e (t 2时刻) 处n(N 2)不一样D .其他条件不变,773K 下反应至t 1时刻,n(H 2)比上图中d 点的值大3.下图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )A .正反应是放热反应B .若A 、B 是气体,则D 是液体或固体C .逆反应是放热反应.D .A 、B 、C 、D 均为气体4.同压、不同温度下的反应:A (g )+B (g )C (g );△HA 的含量和温度的关系如图3所示,下列结论正确的是 ( )A .T 1>T 2,△H>0B .T 1<T 2,△H>0C .T 1>T 2,△H<0D .T 1<T 2,△H<05.现有可逆反应A (g )+2B (g )nC (g );△H<0,在相同温度、不同压强时,A 的转化率跟反应时间(t )的关系如图4,其中结论正确的是()A .p 1>p 2,n >3B .p 1<p 2,n >3C .p 1<p 2,n <3D .p 1>p 2,n=36.对于反应2A (g )+B (g )2C (g );△H<0,下列图象正确的是 ( )7.T ℃时,A 气体与B 气体反应生成C 气体。
化学平衡图像题汇总

专题强化训练巧解化学反应速率和化学平衡的图象题(45分钟 100分)一、选择题(本题包括7小题,每题6分,共42分)1. 一定条件下,溶液的酸碱性对 TiO 2光催化染料R 降解反应的影响如图所示下列判断正确的是( )A. 在0〜50 min 之间,pH=2和pH=7时R 的降解百分率相等B. 溶液酸性越强,R 的降解速率越小C. R 的起始浓度越小,降解速率越大D. 在20〜25 min 之间,pH=10时的平均降解速率为0.04 mol • L -1 • min -1【解析】选A 。
在0〜50 min 内,pH=2和pH=7时反应物R 都完全反应,降解率 都为100% A 正确;R 的降解速率与溶液的酸碱性及起始浓度均有关系,因此根 据图中曲线所示,由于起始浓度不同,故不能判断 R 的降解速率与溶液酸碱性 的直接关系,B C 错误;pH=10时,在20〜25 min 之间,R 的平均降解速率为 -4 - 1 - 4 0.6 x 10 mol L - 04 x 10 mobL5min=0.04 x 10-4mol • L -1 • min 1 , D 错0 10 20 30 4() 50 f/min2. (2015 •武汉模拟)有一化学平衡mA(g)+nB(g)—pC(g)+qD(g),如图所示的是A的转化率与压强、温度的关系。
下列叙述正确的是()A. 正反应是放热反应;m+n >p+qB. 正反应是吸热反应;m+n<p+qC. 正反应是放热反应;m+n<p+qD. 正反应是吸热反应;m+n>p+q【解析】选D。
图象中有三个量,应定一个量来分别讨论另外两个量之间的关系。
定压强,讨论T与A的转化率的关系:同一压强下,温度越高,A的转化率越高,说明正反应是吸热反应;定温度,讨论压强与A的转化率的关系:同一温度下,压强越大,A的转化率越高,说明正反应是气体体积减小的反应,即m+n >p+q 【加固训练】如图是温度和压强对反应X+J2Z影响的示意图。
(完整word版)化学平衡图像专项练习题

化学平衡图像一、选择题(本题包括35小题,每小题2分,共70分。
每小题有一个或两个选项符合题意。
)1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是()A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)2.T℃时,A气体与B气体反应生成C气体。
反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动B.t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大3.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到过化学平衡B.该反应在T2温度时达到过化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动4.右图表示反应N 2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是()A.t0~t1B. t2~t3C. t3~t4D. t5~t65.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是()A .10~15 min 可能是加入了正催化剂B .10~15 min 可能是降低了温度C .20 min 时可能是缩小了容器体积D .20 min 时可能是增加了B 的量6.在一定条件下,将X 和Y 两种物质按不同的比例放入密闭容器中反应,平衡后测得X ,Y 的转化率与起始时两物质的物质的量之比n x /n y 的关系如图所示,则X ,Y 的反应方程式可表示为( )A . 2X +Y 3ZB . 3X +2Y 2ZC . X +3Y ZD . 3X +Y Z7.可逆反应aX (g )+bY (g )cZ (g )在一定温度下的一密闭容器内达到平衡后,t 0时改变某一外界条件,化学反应速率(v )-时间(t )图象如右图。
化学平衡图像专题

化学平衡图像题[专题解读]1.图像类型与解题策略(1)速率-时间图像(vt图像)[解题策略]分清正反应、逆反应及二者反应速率的相对大小,分清“突变”和“渐变”;正确判断化学平衡的移动方向;熟记浓度、压强、温度、催化剂等对化学平衡移动的影响规律。
Ⅰ.v′正突变,v′逆渐变,且v′正>v′逆,说明是增大了反应物的浓度,使v′正突变,且平衡正向移动。
Ⅱ.v′正、v′逆都突然减小,且v′正>v′逆,说明平衡正向移动,该反应的正反应可能是放热反应或气体体积增大的反应。
Ⅲ.v′正、v′逆都突然增大,且增大程度相同,说明该化学平衡没有发生移动,可能是使用了催化剂,也可能是对反应前后气体分子数不变的反应压缩体积(即增大压强)。
(2)百分含量(或转化率)-时间-温度(或压强)图像[解题策略]“先拐先平数值大”。
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图Ⅰ中T2>T1)、压强较大(如图Ⅱ中p2>p1)或使用了催化剂(如图Ⅲ中a使用了催化剂)。
Ⅰ.表示T2>T1,正反应是放热反应,升高温度,平衡逆向移动。
Ⅱ.表示p2>p1,反应物A的转化率减小,说明正反应是气体体积增大的反应,增大压强,平衡逆向移动。
Ⅲ.生成物C的百分含量不变,说明平衡不发生移动,但反应速率a>b,故a使用了催化剂;也可能该反应是反应前后气体体积不变的可逆反应,a增大了压强(压缩体积)。
(3)百分含量(或转化率)-温度(压强)图像[解题策略]“定一议二”。
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个变量,分析方法是确定其中一个变量,讨论另外两个变量之间的关系。
如图Ⅰ中确定压强为105Pa或107Pa,则生成物C的百分含量随温度T的升高而逐渐减小,说明正反应是放热反应;再确定温度T不变,做横轴的垂线,与压强线出现两个交点,分析生成物C的百分含量随压强p的变化可以发现,增大压强,生成物C的百分含量增大,说明正反应是气体体积减小的反应。
化学平衡图像专题(超详细版)

A. P1>P2,n<3 C. P1<P2,n>3
B. P1< P2,n= 3 D. P1>P2,n>3
C%
a
P1
b
P2
时间
精选课件
17
08高考理Ⅰ—11
已知:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g),
△H = —1025kJ/mol,该反应是一个可逆反应,若反
应物起始的物质的量相同,下列关于该反应的示意图不正 确的是( C )
t1
t2 t 高温度 b. 增大压强。根
根据反应方程式,升高温度平衡向逆反应方
向移动,与图示相符;增大压强平衡向正反
应方向移动,与图示不相符。故此题中引起
平衡移动的因素是升精高选课件温度。
9
对于反应mA(g)+nB(g) pC(g)+qD(g) 有如下图所示的变化,请分析t1时的改变 因素可能是什么?并说明理由。
△H >0的反应过程。若使a曲线变为b曲线,可采取 的措施是( A D )
A、加入催化剂 B、增大Y的浓度 C、降低温度 D、增大体系压强
精选课件
16
例4 在同一温度时,压强分别为P1、P2的条件下, A(g)+2B(g) nC(g)的反应体系中,C的百分含量与时
间t,压强P1、P2的关系如下图所示,则下列结论正确的 是( C )
2、该反应正向是:啊
(吸、放)热反应。
啊气体物质的量
(增大、减小)的反应。
精选课件
11
三、某物质的转化率(或百分含量)时间-温度(或压强)图:
对于反应mA(g)+nB(g)
pC(g)+qD(g)
A
化学平衡图像例题
例3:在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L,在不同条件下R的百分含量R% 的变化情况如下图,下列叙述正确的是( ) A、正反应吸热,L是气体 B、正反应吸热,L是固体 C、正反应放热,L是气体 D、正反应放热,L是固体或液体
例4:25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量 金属锡(Sn),发生反应: Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s), 体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。 下列判断正确的是( ) A.往平衡体系中加入金属铅后,c(Pb2+)增大 B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 D.25℃时,该反应的平衡常数K=2.2
例5:如图曲线是其它条件不变时某反应物的 最大转化率(α)与 温度(T)的关系曲线 ,图中标出 的1、2、3、4,四个点, 表示V正=V逆的点是 V正>V逆的点是 。
例6.对于可逆反应: A2(g)+3B2(g) 2AB3(g) △H<0,下列图像中正确的是( )
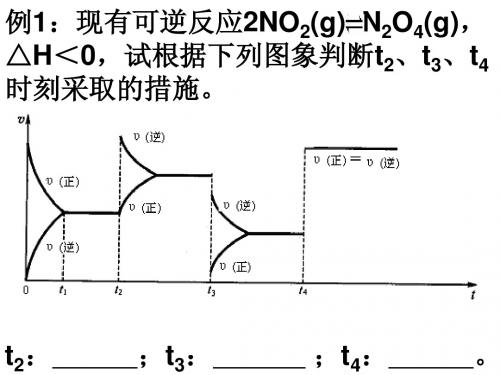
练习:(2014.1)一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1L的密闭容器 中发生反应:X(g)+3Y(g) 2Z(g),下 逆反应2NO2(g) N2O4(g), △H<0,试根据下列图象判断t2、t3、t4 时刻采取的措施。
t2 :
; t3 :
;t4:
。
例2:对于反应mA(g) + nB(g) pC(g)+qD(g) △H=QkJ/mol,分析 下列图像:
P一定,△H T一定,m+n T一定,m+n
0 p+q p+q
化学反应速率与化学平衡——图像专题(共52张)
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
化学平衡图像专题

P·
压强
看图技巧:可逆反应的最大程度即化学平衡状态
解化学平衡图像题的技巧
(1). 看图象:
①.看面(如:纵坐标与横坐标的意义)
②.看线(如:线的走向和变化趋势、斜率)
③.看点(如:起点、拐点、交点、终点)
④.做辅助线(如:等温线、等压线、平衡线等)
(2). 想规律:
联想外界条件的改变对化学反应速率和化学平衡 的影响规律,得出图像中的隐含信息。
七、其他图像举例
[例]对于反应 xA(g)+B(s)
yC(g)+ D(s)
A的百分含量与外压强有如下图的关系, (温度不变)则: (1) P点左面曲线表示为_________ (2) X(<、=、>)_____Y,其理由是: A% (1) 达平衡前的情况 (2) <;达到平衡点P后加压, A%增加,说明平衡向左移动了 0
A、m+n<q B、n>q C、X点时的状态,V正>V逆 D、X点比Y点混和物的正 反应速率慢
2NO+O2
2NO2 ΔH=Q (Q<0)
图中的曲线是表示其他条件一 定时,反应中NO的转化率与温度 的关系曲线,图中标有a、b、c、 d四点,其中表示未达到平衡状态, 且v(正)>v(逆)的是( C ) A. a点 B. b点 C. c点 D. d点
三.百分含量(转化率或产率)—压强—温度曲线
m A(g)+nB(g)
A 转
pC(g)+qD(g) ΔH=Q
化
率
m+n > p+q ΔH <0 7Pa 1.0110
1.01106Pa 1.01105Pa
看图技巧:图象中有三 温度 个量时,“定一议二”
0
化学平衡图像分析经典例题与习题附答案
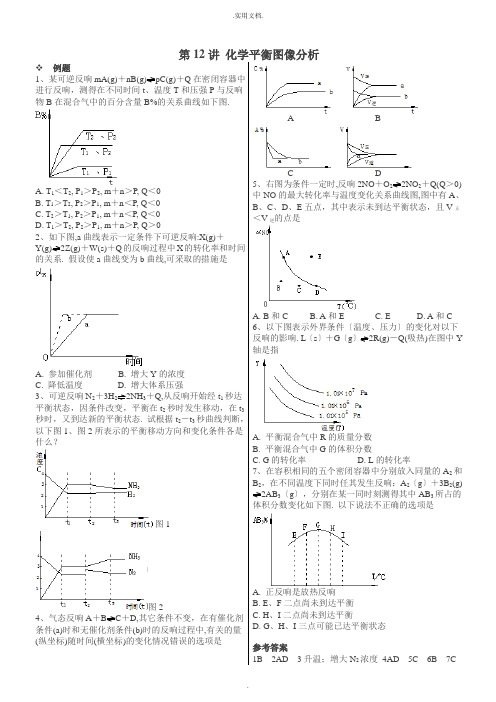
第12讲化学平衡图像分析❖例题1、某可逆反响mA(g)+nB(g)pC(g)+Q在密闭容器中进行反响,测得在不同时间t、温度T和压强P与反响物B在混合气中的百分含量B%的关系曲线如下图.A. T1<T2, P1>P2, m+n>P, Q<0B. T1>T2, P2>P1, m+n<P, Q<0C. T2>T1, P2>P1, m+n<P, Q<0D. T1>T2, P2>P1, m+n>P, Q>02、如下图,a曲线表示一定条件下可逆反响:X(g)+Y(g)2Z(g)+W(s)+Q的反响过程中X的转化率和时间的关系. 假设使a曲线变为b曲线,可采取的措施是A. 参加催化剂B. 增大Y的浓度C. 降低温度D. 增大体系压强3、可逆反响N2+3H22NH3+Q,从反响开始经t1秒达平衡状态,因条件改变,平衡在t2秒时发生移动,在t3秒时,又到达新的平衡状态. 试根据t2-t3秒曲线判断,以下图1、图2所表示的平衡移动方向和变化条件各是什么?图1图24、气态反响A+B C+D,其它条件不变,在有催化剂条件(a)时和无催化剂条件(b)时的反响过程中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的选项是A BC D5、右图为条件一定时,反响2NO+O22NO2+Q(Q>0)中NO的最大转化率与温度变化关系曲线图,图中有A、B、C、D、E五点,其中表示未到达平衡状态,且V正<V逆的点是A. B和CB. A和EC. ED. A和C6、以下图表示外界条件〔温度、压力〕的变化对以下反响的影响. L〔s〕+G〔g〕2R(g)-Q(吸热)在图中Y 轴是指A. 平衡混合气中R的质量分数B. 平衡混合气中G的体积分数C. G的转化率D. L的转化率7、在容积相同的五个密闭容器中分别放入同量的A2和B2,在不同温度下同时任其发生反响:A2〔g〕+3B2(g) 2AB3〔g〕,分别在某一同时刻测得其中AB3所占的体积分数变化如下图. 以下说法不正确的选项是A. 正反响是放热反响B. E、F二点尚未到达平衡C. H、I二点尚未到达平衡D. G、H、I三点可能已达平衡状态参考答案1B 2AD 3升温;增大N2浓度4AD 5C 6B 7C.❖习题1、如右图所示表示平衡混合物中x的百分含量在不同的压强下,随温度变化的情况,在以下平衡体系中,x 可以代表用下横线标明的物质〔反响中各物质为气态〕的是A.N2+2H22NH3 △H<0B.H2+I22HI △H<0C.2SO32SO2+O2 △H>0D.4NH3+5O24NO+6H2O △H<02、在溶积固定的4L密闭容顺中,进行可逆反响:X〔气〕+2Y〔气〕2Z〔气〕并到达平衡,在此过程中,以Y 的浓度改变表示的反响速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影局部面积表示A.X的浓度的减少B.Y的物质的量的减少C.Z的浓度的增加D.X的物质的量的减少3、今有反响X(g)+Y(g)2Z(g)+ △H<0假设反响开始经t1秒后到达平衡,又经t2秒后,由于反响条件的改变使平衡破坏,那么t3时又到达平衡,如图表示,试分析,以t2到t3秒曲线变化的原因是A.增大了X和Y的浓度B.使用了催化剂C.增加了反就体系的压强D.升高了反响的温度4、对到达平衡状态的可逆反响X+Y Z+W,在其他条件不变的情况下,增大压强,反响速率变化图象如右图所示,那么图象中关于X、Y、Z、W四种物质的聚集状态为A.Z、W均为气体,X、Y中有一种是气体B.Z、W中有一种是气体,X、Y皆非气体C.X、Y、Z、W皆非气体D.X、Y均为气体,Z、W中有一种为气体5、可逆反响aA+bB cC中,物质的含量A%和C%随温度的变化曲线如下图,以下说法正确的选项是A.该反响在T1、T3温度时到达过化学平衡B.该反响在T2温度时到达过化学平衡C.该反响的逆反响是放热反响D.升高温度,平衡会向正反响方向移动6、右图表示反响N2〔g〕+3H2〔g〕2NH3〔g〕;ΔH=-92. 2kJ/mol。
化学平衡图像专题共24页

(P)的关系如上图,根据图中曲线分析,判断下列叙
述中正确的是(B )
(A)达到平衡后,若使用催化剂,C的质量分数增大 (B)平衡后,若升高温度,则平衡向逆反应方向移动 (C)平衡后,增大A的量,有利于平衡正向移动 (D)化学方程式中一定有n>p+q
练习 在密闭容器中进行下列反应: M(g)+N(g) R(g)+2L(?),在不同条件下R的百
Y的体积分数变——大——,
平衡向
逆反应
————
方向移动,则
化学方程式中左右两边的系数
积 分 数
Y的
转
化 率
P2
P1
t
练习:可逆反应:aX(s) + bY(g) cZ(g) +dW(g)达
到平衡,混合物中Y的体积分数随压强(P)与温度T
(T2>T1)的变化关系如图示。
1、当压强不变时,升高温度,
Y的体积分数变
小,
平衡向 正反应方向移动,则 Y
正反应是 吸 热反应。 的
2、当温度不变时,增大压强, 体
T1
T2
•正反应放热 t
P1
P2
•m+n=p+q t
三、某物质的转化率(或百分含量)-时间-
温度(或压强)图:
Байду номын сангаас
•对于反应mA(g)+nB(g)
B%
pC(g)+qD(g)
T2P2 T1P2 T1P1
t
•m+n<p+q •正反应吸热
练习可逆反应mA(s)+nB(g)
pC(g)+qD(g)。反应中,
当其它条件不变时,C的质量分数与温度(T)和压强
完整化学平衡移动图像专题

0
A
B
C
E
D
T
NO转化率
3 、图表示反应N2(g)+3H2(g) 2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( ) A t0~t1 B t2~t3 C t3~t4 D t5~t6
AB
练习:
D
下列图象中,不能表示反应A2(g)+3B2(g) 2AB3(g)(△H<0)平衡体系的是…( )
练习:
2、下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
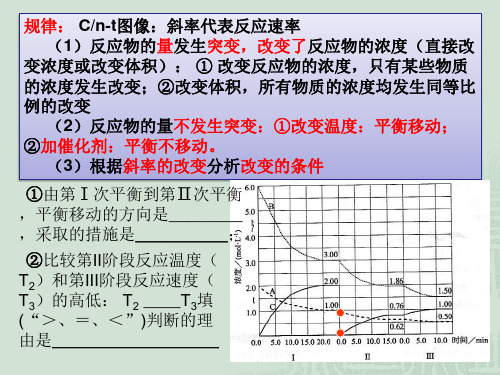
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。
二、速度-时间图:
v逆
t1
t
v
v正
由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。
t
v
v正
增大
逆
<
•若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的 v – t 图。
t1 t2
t
v
v逆
v正
二、速度-时间图:
v逆
t1 t2
t
v
v正
•对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
化学平衡图像专题(超详细版)

化学平衡图像专题(超详细版)化学平衡是化学反应中一个非常重要的概念,它描述了在封闭系统中,反应物和物之间的动态平衡状态。
在化学平衡状态下,反应物和物的浓度保持不变,尽管反应仍在进行。
为了更好地理解和应用化学平衡原理,我们可以通过图像来直观地展示和解释这一概念。
一、化学平衡图像概述1. 反应物和物浓度随时间变化的曲线图2. 反应速率随时间变化的曲线图3. 平衡常数与温度、压力等条件的关系图二、反应物和物浓度随时间变化的曲线图在化学平衡图像中,反应物和物浓度随时间变化的曲线图是最常见的一种。
这种图像可以清晰地展示出反应物和物在反应过程中的浓度变化趋势,以及它们何时达到平衡状态。
1. 反应物浓度随时间变化的曲线图:在反应初期,反应物浓度较高,随着反应的进行,反应物浓度逐渐降低。
当反应达到平衡状态时,反应物浓度不再变化,形成一条水平直线。
2. 物浓度随时间变化的曲线图:在反应初期,物浓度较低,随着反应的进行,物浓度逐渐升高。
当反应达到平衡状态时,物浓度不再变化,形成一条水平直线。
3. 反应物和物浓度随时间变化的曲线图:将反应物和物浓度随时间变化的曲线图叠加在一起,可以更直观地展示它们之间的浓度关系。
在平衡状态下,两条曲线会相交,形成一个平衡点。
三、反应速率随时间变化的曲线图反应速率随时间变化的曲线图可以展示出反应速率在反应过程中的变化趋势,以及它如何受到反应物浓度、温度、压力等条件的影响。
1. 反应速率随时间变化的曲线图:在反应初期,反应速率较快,随着反应的进行,反应速率逐渐降低。
当反应达到平衡状态时,反应速率不再变化,形成一条水平直线。
2. 反应速率与反应物浓度的关系图:反应速率通常与反应物浓度成正比,即反应物浓度越高,反应速率越快。
当反应物浓度达到一定值时,反应速率达到最大值,不再随反应物浓度变化。
3. 反应速率与温度的关系图:反应速率通常与温度成正比,即温度越高,反应速率越快。
这是因为温度升高,反应物分子运动加快,碰撞频率增加,从而提高反应速率。
化学平衡图像专题整理

化学平衡图像专题1、某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图1所示,则该反应的化学方程式为_________ ,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。
2、把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1~t2速率变化的主要原因是_________;t2~t3速率变化的主要原因是_________ 。
3、某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2+O22SO3(正反应放热)的正、逆反应速率的影响如图3所示。
① 加催化剂对速率影响的图象是( )。
②增大O2的浓度对速率影响的图象是( )③增大反应容器体积对速率影响的图象是( )。
④升温对速率影响的图象是( ) 4、符合右图图象的反应为( )。
A.N2O3(g)NO2(g)+NO(g)B.3NO2(g)+H2O(l )2HNO3(l )+NO(g)C.4NH3(g)+5O2(g)4NO(g)+6H2O(g)D.CO2(g)+C(s)2CO(g)5、FeCl 3溶液与KSCN 溶液混合时存在下列平衡:Fe 3+(aq)+SCN -(aq)Fe(SCN)2+(aq),已知某一条件下,反应达平衡时,Fe(SCN)2+的物质的量浓度与温度的关系如图所示,下列说法正确的是:( ) A.该反应为吸热反应 B .T 1、T 2时反应的平衡常数分别为K 1、K 2,则K 1>K 2C .反应处于D 点时,一定有v 正大于v 逆 D .A 点的c(Fe 3+)比B 点的c(Fe 3+)大6、mA(s)+nB(g)qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B 的体积分数(B%)与压强(p )的关系如图所示,有关叙述正确的是( )。
A.n<q B.n>qC.X点,v正<v逆;Y点,v正>v逆 D.X点比Y点反应速率快 7、图7表示mA(g)+nB(g)pC(g)+qD(g)ΔH = Q,在不同温度下经过一定时间混合体系中C 的质量分数与温度T的关系;图8表示在一定条件下达到平衡后t时刻(温度不变)改变影响平衡的另一个条件重新建立新平衡的反应过程,判断该反应是( )。
整理版----化学平衡图像专题
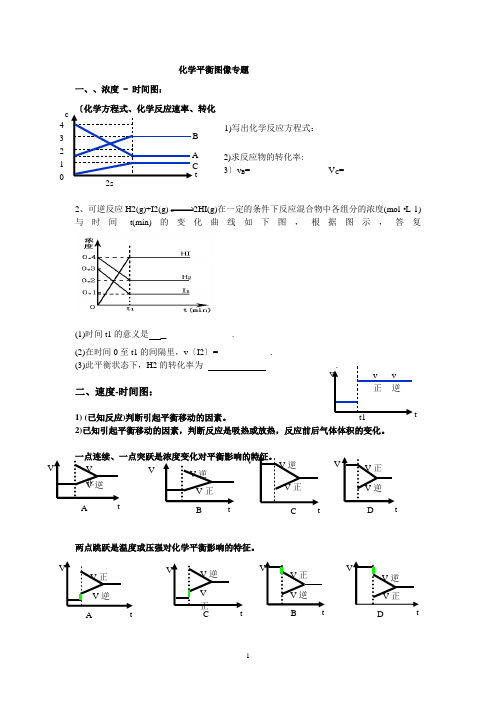
化学平衡图像专题一、、浓度 - 时间图:1)写出化学反应方程式:2)求反应物的转化率:3〕v B = V C =2、可逆反应H2(g)+I2(g)2HI(g)在一定的条件下反应混合物中各组分的浓度(mol ·L-1)与时间t(min)的变化曲线如下图,根据图示,答复(1)时间t1的意义是_ .(2)在时间0至t1的间隔里,v 〔I2〕= .(3)此平衡状态下,H2的转化率为 .二、速度-时间图:1) (已知反应)判断引起平衡移动的因素。
2)已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
一点连续、一点突跃是浓度变化对平衡影响的特征。
两点跳跃是温度或压强对化学平衡影响的特征。
A t 4 3 210A V 正 V 逆 VB V 逆V 正 V CV 正 V 逆 V D V 正 V 逆 V V 正 V 逆 A V V 逆 V 正 V V 正V 逆 CV V 逆V 正 D V v 逆t1 vv正例:右图表示在密闭容器中反应:2SO2+O22SO3+Q 到达平衡时 ,由于条件改变起反应速度和化学平衡的变化情况,ab 过程中改变的条件可能是 _;bc 过程中改变的条件可能是 _; 假设增大压强,反应速度变化情况画在c —d处.在密闭容器,一定条件下进行反应,mA(g)+nB(g)pC(g)+qD(g);假设增大压强或升高温度,重新到达平衡,变化过程均如下图,则对该反应表达正确的选项是〔 A .正反应是吸热反应B .逆反应是吸热反应C .m+n>p+qD .m+n<p+q三、某物质的转化率(或百分含量)-时间-温度/压强)图 解题思路:1、先从拐点向横轴作垂线:先拐先平,温度、压强均高。
2、再从拐点向纵轴作垂线: ①分析温度、压强升高时,转化率或含量的变化 ② 判断平衡移动的方向例:对于反应mA(g)+nB(g) pC(g)+qD(g)P1 P2; m+n p+qT1 T2;正反应 热v 逆t1t2 t v v 正 t A 的转化率 T1T2tT1 T2 t B% T2P2 T1P2T1P11、在密闭容器中进行以下反应:M(g)+ N(g) R(g)+2L此反应符合右图,以下表达正确的选项是( )A.正反应吸热,L是气体B.正反应吸热,L是固体C.正反应放热,L是气体D.正反应放热,L是固体或液体2、反应2X(g)+Y(g)2Z(g)(正反应为放热反应)在不同(T1和T2)温度及不同压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间t的关系如下图。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题强化训练巧解化学反应速率和化学平衡的图象题(45分钟100分)一、选择题(本题包括7小题,每题6分,共42分)1.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。
下列判断正确的是( )A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等B.溶液酸性越强,R的降解速率越小C.R的起始浓度越小,降解速率越大D.在20~25 min之间,pH=10时的平均降解速率为0.04 mol·L-1·min-1【解析】选A。
在0~50 min内,pH=2和pH=7时反应物R都完全反应,降解率都为100%,A正确;R的降解速率与溶液的酸碱性及起始浓度均有关系,因此根据图中曲线所示,由于起始浓度不同,故不能判断R的降解速率与溶液酸碱性的直接关系,B、C错误;pH=10时,在20~25 min之间,R的平均降解速率为=0.04×10-4mol·L-1·min-1,D错误。
2.(2015·武汉模拟)有一化学平衡mA(g)+nB(g)pC(g)+qD(g),如图所示的是A的转化率与压强、温度的关系。
下列叙述正确的是( )A.正反应是放热反应;m+n>p+qB.正反应是吸热反应;m+n<p+qC.正反应是放热反应;m+n<p+qD.正反应是吸热反应;m+n>p+q【解析】选D。
图象中有三个量,应定一个量来分别讨论另外两个量之间的关系。
定压强,讨论T与A的转化率的关系:同一压强下,温度越高,A的转化率越高,说明正反应是吸热反应;定温度,讨论压强与A的转化率的关系:同一温度下,压强越大,A的转化率越高,说明正反应是气体体积减小的反应,即m+n>p+q。
【加固训练】如图是温度和压强对反应X+Y2Z影响的示意图。
图中纵坐标表示平衡混合气体中Z的体积分数。
下列叙述正确的是( )A.X、Y、Z均为气态B.恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据C.升高温度时,v(正)增大,v(逆)减小,平衡向右移动D.使用催化剂,Z的产率提高【解析】选B。
由题图可知,在温度不变时增大压强,Z的体积分数减小,即平衡逆向移动,所以X、Y中至多有一种是气体,A错误;因反应物中有非气体物质存在,所以恒容时只要平衡发生移动,混合气体的质量就会发生变化,则密度必然改变,所以混合气体的密度可作为此反应是否达到化学平衡状态的判断依据,B正确;升高温度,v(正)、v(逆)都增大,C错误;催化剂对平衡移动无影响,不能提高Z的产率,D错误。
3.向绝热恒容密闭容器中通入SO 2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。
由图可得出的正确结论是( )A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段【解析】选D。
A项,c点v(正)最大,但不一定达到平衡;B项,a点反应物的浓度大于b点的反应物浓度;C项,反应初始阶段,随着反应的不断进行,反应速率逐渐加快,说明该反应为放热反应,即反应物的总能量大于生成物的总能量;D项,由于b~c段v(正)大于a~b段,故b~c段SO2的转化率大于a~b段。
4.(2015·武汉模拟)在密闭容器中进行反应:X(g)+3Y(g)2Z(g),有关下列图象的说法正确的是( )A.依据图a可判断正反应为吸热反应B.在图b中,虚线可表示压强增大C.若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0【解析】选C。
A项,依据图a可知:当反应达到平衡后,由于升高温度,v(逆)>v(正),平衡逆向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,因此可判断正反应为放热反应,错误;B项,在图b中,平衡未移动,但是达到平衡所需要的时间缩短,由于该反应是气体体积减小的反应,所以虚线不可表示压强增大,只能表示是加入了催化剂,错误;C项,若正反应的ΔH<0,升高温度,根据平衡移动原理,平衡逆向移动,故可以用图c表示升高温度使平衡向逆反应方向移动,正确;D项,由于升高温度,气体的平均相对分子质量增大,则根据平衡移动原理,升高温度,平衡向吸热反应方向移动,平衡逆向移动,可推知正反应的ΔH<0,错误。
5.(2015·肃南模拟)可逆反应2M(g)+N(g)2X(g),根据表中的数据可判断选项中图象错误的是( )【解析】选C。
根据表中数据可知同一压强下,温度越高,M的转化率越低,则正反应为放热反应;根据反应方程式可知同一温度下,压强越大,M的转化率越高,则A、B正确;增大压强平衡将向正反应方向移动,有v(正)>v(逆),C 错误;升高温度平衡将向逆反应方向移动,D正确。
【方法规律】化学反应速率和化学平衡图象题的解题技巧(1)先拐先平:在含量(转化率)-时间曲线中,先出现拐点的则先达到平衡,说明该曲线反应速率快,表示温度较高或有催化剂或压强较大等。
(2)定一议二:当图象中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线。
(3)三步分析法:一看反应速率是增大还是减小;二看v(正)、v(逆)的相对大小;三看化学平衡移动的方向。
【加固训练】(2015·太原模拟)下列研究目的和示意图相符的是( )A B CD研究目的定容密闭容器中,压强对反应:2SO2(g)+O2(g)2SO3(g)的影响定容密闭容器中,温度对反应:N2(g)+3H2(g)2NH3(g) ΔH< 0的影响定容密闭容器中,增大CO2浓度,对已达平衡的反应:CO(g)+H2O(g)CO2(g)+H2(g)的影响等质量Na、K分别与足量水反应【解析】选D。
A项,p1时反应速率大,所以p1>p2,因为该反应正反应方向是气体体积减小的方向,所以p1平衡时SO3的物质的量更大,图象不符,错误;B项,该反应为放热反应,温度升高,平衡向逆反应方向移动,NH3的物质的量减小,图象不符,错误;C项,固定容积的密闭容器中,增大CO2浓度,逆反应速率突变,随着平衡的移动,正反应速率逐渐增大,图象不符,错误;D 项,K的活泼性大于Na,则反应速率大于Na,K的摩尔质量大于Na的摩尔质量,则等质量的Na、K,K完全反应生成H2的量少,正确。
6.反应aM(g)+bN(g)cP(g)+d Q(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示。
其中z表示反应开始时N的物质的量与M的物质的量之比。
下列说法正确的是( )A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加B.同压同z时,升高温度,平衡时Q的体积分数增加C.同温同z时,增加压强,平衡时Q的体积分数增加D.同温同压时,增加z,平衡时Q的体积分数增加【解析】选B。
可逆反应中,催化剂只能改变化学反应速率,A错;由两个图象可知,M的体积分数随着温度升高而降低,即温度升高,平衡右移,故平衡时Q的体积分数增加,B正确;同为650℃、z=2.0,压强为1.4 MPa时,y(M)=30%,而压强为2.1 MPa时,y(M)=35%,即增大压强,平衡左移,故平衡时Q的体积分数减小,C错;由图象可知,同温、同压时,若N的物质的量增加,而M 的物质的量不变,则z增加,y(M)减小,平衡右移,但Q增加的物质的量远小于加入的N的物质的量,此时Q的体积分数减小,D错。
【易错警示】本题易错选D。
片面地认为只要增加反应物,平衡即右移,Q的物质的量增加,而不考虑所增加物质的剩余量而导致错误。
7.在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)zC(g),图Ⅰ表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C 的体积分数随起始时n(A)∶n(B)的变化关系。
则下列结论正确的是( )A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1B.由图Ⅱ所知反应xA(g)+yB(g)zC(g)的ΔH<0,且a=2C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)D.200℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5【解析】选D。
由图Ⅰ可得该反应的化学方程式为2A(g)+B(g)C(g)。
A项,v(B)==0.02 mol·L-1·min-1,错误;B项,升温,C的体积分数增大,说明平衡右移,正反应为吸热反应,ΔH>0,n(A)∶n(B)=a时,C的体积分数最大,则a=2,错误;C项,由于体积不变,He与反应无关,所以平衡不移动,v(正)仍等于v(逆),错误;D项,原平衡时,A的体积分数为=0.5,再充入2 mol A、1 mol B,相当于增大压强,平衡右移,A的体积分数小于0.5,正确。
二、非选择题(本题包括4小题,共58分)8.(14分)(2015·成都模拟)可逆反应N2+3H22NH3是工业上合成氨的重要反应。
(1)根据图1请写出合成氨的热化学方程式______________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的______条件,该条件的改变与图2中哪一时刻条件的改变相同________(用“t1…t6”表示)。
(3)图2中t3时刻改变的条件是________________________________________,t5时刻改变的条件是______________________________________________。
【解析】(1)根据图1可知,N2和H2反应生成1 mol NH3过程中放出的热量为(E3-E1)kJ,所以N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-2(E3-E1)kJ·mol-1。
(2)图1中虚线部分表示由反应物到达过渡态的过程中,所需能量减少,说明使用了催化剂,降低了活化能。
因为反应N2+3H22NH3为反应前后气体体积不相等的反应,在图2中,t2时刻改变条件,正、逆反应速率的改变相同,说明改变的外界条件只能是使用了催化剂。
(3)t3时刻改变条件,v(正)、v(逆)同时减小,且v(正)<v(逆),平衡向逆反应方向移动,改变的条件为减小压强;t5时刻改变条件,v(正)、v(逆)同时增大,且v(逆)>v(正),平衡向逆反应方向移动,只能是升高温度。
