课题1生活中常见的盐
课题1 生活中常见的盐1

其它盐类水下沉。
这些物质间
5、H2SO4 + BaCl2-------6、Ba(OH)2+ KCl -------7、CuSO4 + NH4NO3----8、HNO3 + NaOH -------
能否反应
【思考】
1、AgNO3 + HCl -------2、 K2CO3+ Ca(OH)2--3、Na2CO3+ CaCl2 ----4、Na2SO4 + HCl ------5、H2SO4 + BaCl2------6、Ba(OH)2+ KCl -----7、CuSO4 + NH4NO3--8、HNO3 + NaOH -----
附录 1 部分酸、碱和盐的溶解性表(20摄氏度) P111
盐类溶水性顺口溜: 【思考】1、AgNO3 + HCl ----------
钾钠硝铵盐溶水快,
2、 K2CO3+ Ca(OH)2-----
硫酸盐除了钡银钙,
3、Na2CO3+ CaCl2 --------
氯化物只有氯化银,
4、Na2SO4 + HCl ----------
课题 1 生活中常见的盐 课题2 化学肥料
食盐
常见的盐
食盐 明矾晶体
五水硫酸铜晶体
用钡餐观察 肠内情况
石盐标本
一、氯化钠
氯化钠日常生活用于调味和腌菜、肉,医 药上的生理盐水0.9%的氯化钠溶液,工业上是 化工原料,制取氯气、盐酸、纯碱。
我国食盐产地
我国食盐的产地分布很广,出产着种类繁多的 盐:海盐、井盐、岩盐、池盐等。其中辽宁、 山东、两淮、长芦各盐场盛产海盐,自古闻名。 井盐则以四川自贡市的自流井最为有名,岩盐 产于四川、云南、等地。在青海、新疆、内蒙 古等地有很多咸水湖,盛产池盐,其中最大的 是柴达木盆地的察尔汗盐池,据统计,仅这一 盐池开采出来的池盐,足够我国十二亿人口食 用四千多年。
课题1、生活中常见的盐

课题1 生活中常见的盐一、氯化钠(NaCl)1、俗名:食盐2、存在:海水、盐湖、盐井、盐矿3、制取:晾晒——海水煮——盐井、盐湖水开采——盐矿4、用途(1)调味、腌渍食品(2)生理盐水(3)化工原料5、粗盐提纯(1)称量(2)溶解(3)过滤(4)蒸发二、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、碳酸钙(CaCO3)(一)碳酸钠(Na2CO3)1、俗名:纯碱,苏打2、性质:白色粉末,易溶于水,水溶液显碱性3、用途:生产玻璃,造纸,纺织,洗涤剂等。
(二)碳酸氢钠(NaHCO3)1、俗名:小苏打2、性质:白色粉末,易溶于水,水溶液显碱性3、用途:食品添加剂、制药品等。
(三)碳酸钙(CaCO3)——大理石、石灰石的主要成分1、性质:白色固体,难溶于水。
2、用途:(1)建筑材料(2)补钙剂3、CO32-的鉴别(1)取样品滴加稀盐酸,(2)将产生的气体通入澄清石灰水,(3)澄清石灰水变浑浊,则含有CO32-例:Na2CO3 +2HCl= 2NaCl + H2O + CO2↑CaCO3 + 2HCl = CaCl2 + H2O + CO2↑CO2 + Ca(OH)2 = CaCO3↓+ H2O三、盐溶液相似的化学性质1、盐+金属→另一种金属+另一种盐条件:在金属活动顺序中,只有排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来。
Fe + CuSO4 = FeSO4 + Cu硫酸铜硫酸亚铁Cu + Hg(NO3)2 = Cu(NO3)2 + Hg 硝酸汞硝酸铜2、盐+酸→另一种盐+另一种酸HCl + AgNO3 = AgCl ↓+ HNO3硝酸银氯化银2HCl + BaCO3 = BaCl2 + H2O + CO2↑碳酸钡氯化钡H2SO4 + BaCl2 = BaSO4↓+ 2HCl3、盐+碱→另一种盐+另一种碱2NaOH + CuSO4 = Cu(OH)2 ↓+ Na2SO4硫酸铜氢氧化铜硫酸钠Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓3NaOH + FeCl3 = Fe(OH)3 ↓+ 3NaCl氯化铁氢氧化铁4、盐+盐→另外两种盐AgNO3 + NaCl = AgCl↓+ NaNO3硝酸银氯化银硝酸钠BaCl2 + Na2SO4 = BaSO4 ↓+ 2NaCl氯化钡硫酸钠硫酸钡四、复分解反应1、复分解反应——由两种化合物互相交换成分,生成两种新的化合物的反应。
课题1 生活中常见的盐

四、复分解反应
2.条件/原因/理由 ①酸+碱/盐/金属氧化物:生成物中有沉淀或者气体或者 水;HCl + NaOH ;HCl + Na2CO3 ;HCl + Fe2O3 能反应 的原因; ②碱+盐、盐+盐:生成物中有沉淀或者气体或者水且反应 物都能溶于水;Na2CO3 + Ca(OH)2 ;NaCl + AgNO3 能反 应的原因;
Fe + CuSO4 = Cu + FeSO4 ②Cu和AgNO3溶液的反应:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
三、盐的化学性质
2.盐 + 酸 → 新盐 + 新酸 (复分解反应 ) ①实验室制取CO2:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ ②小苏打用于治疗胃酸过多:
②请找出生成KCl的方法; ③请找出生成NaOH的方法:
四、复分解反应
3.书写:相交换,价不变。
根据下列反应物写出生成物
HCl + NaOH ; Fe2O3 + HCl ; NaCl + AgNO3 ;
HCl + Na2CO3 ; Na2CO3 + Ca(OH)2 ;
四、复分解反应
4.复分解反应中生成物的特点 ①AB + CD → AD + CB;
生成物中阳离子来自于一种物质,阴离子来自于另一种 物质;
一、常见的盐
3.碳酸氢钠(NaHCO3) 俗称:小苏打; 用途:制糕点所用的发酵粉;治疗胃酸过多;
课题1 生活中常见的盐
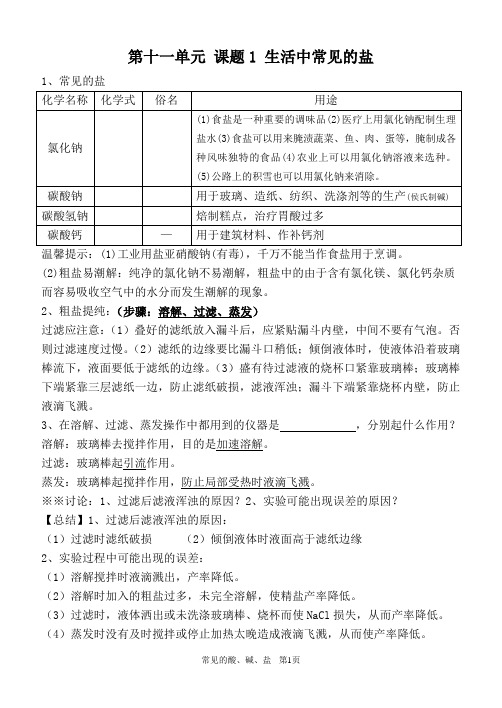
第十一单元课题1 生活中常见的盐1、常见的盐温馨提示:(1)工业用盐亚硝酸钠(有毒),千万不能当作食盐用于烹调。
(2)粗盐易潮解:纯净的氯化钠不易潮解,粗盐中的由于含有氯化镁、氯化钙杂质而容易吸收空气中的水分而发生潮解的现象。
2、粗盐提纯:(步骤:溶解、过滤、蒸发)过滤应注意:(1)叠好的滤纸放入漏斗后,应紧贴漏斗内壁,中间不要有气泡。
否则过滤速度过慢。
(2)滤纸的边缘要比漏斗口稍低;倾倒液体时,使液体沿着玻璃棒流下,液面要低于滤纸的边缘。
(3)盛有待过滤液的烧杯口紧靠玻璃棒;玻璃棒下端紧靠三层滤纸一边,防止滤纸破损,滤液浑浊;漏斗下端紧靠烧杯内壁,防止液滴飞溅。
3、在溶解、过滤、蒸发操作中都用到的仪器是,分别起什么作用?溶解:玻璃棒去搅拌作用,目的是加速溶解。
过滤:玻璃棒起引流作用。
蒸发:玻璃棒起搅拌作用,防止局部受热时液滴飞溅。
※※讨论:1、过滤后滤液浑浊的原因?2、实验可能出现误差的原因?【总结】1、过滤后滤液浑浊的原因:(1)过滤时滤纸破损(2)倾倒液体时液面高于滤纸边缘2、实验过程中可能出现的误差:(1)溶解搅拌时液滴溅出,产率降低。
(2)溶解时加入的粗盐过多,未完全溶解,使精盐产率降低。
(3)过滤时,液体洒出或未洗涤玻璃棒、烧杯而使NaCl损失,从而产率降低。
(4)蒸发时没有及时搅拌或停止加热太晚造成液滴飞溅,从而使产率降低。
4、盐的化学性质:【务必掌握】(1)盐+金属→新盐+新金属(置换反应) 如:Fe + CuSO4——Cu + AgNO3——(2)盐+酸→新盐+新酸(复分解反应)如:HCl + BaCO3——H 2SO4+ BaCl2——Na2CO3+ H2SO4——HCl + AgNO3——H 2SO4+ MgCO3——(3)盐+碱→新盐+新碱(复分解反应) (前提:反应物均可溶)如:K2CO3+ Ca(OH)2——MgSO4 + Ba(OH)2——FeCl3+ NaOH ——Cu(NO3)2+ KOH ——Al2(SO4)3+ NaOH ——(NH4)2SO4+ Ca(OH)2——(4)盐+盐→另两种盐(复分解反应) (前提:反应物均可溶)如:Na2CO3+ Ca(NO3)2——BaCl2 + AgNO3——Ba(NO3)2+ K2SO4——K 2CO3+ Fe(NO3)2——MgSO4 + Na2CO3——判断下列反应能否发生,能反应的完成化学方程式:① Zn + FeSO4——② Cu + AgCl ——③ NaCl + CuSO4——④ Na2CO3+ Ca(OH)2——⑤ BaCl2 + Na2CO3——⑥ CuCl2 + H2SO4——⑦ CaCO3 + BaCl2——⑧ BaSO4+ HCl ——⑨ Na2CO3+ Cu(OH)2——⑩Na2CO3+ BaCl2——5、复分解反应(1)定义:由________________互相交换成分,生成_________________的反应。
课题1_生活中常见的盐
H2SO4 Ba(NO3)
2
NaOH
H2SO4
Ba(NO3 √)2
NaOH √
K2CO3 √
白色沉淀 无现象 生成气体
无现象 √ 白色沉淀
无现象
K2CO3
我来归纳 盐的化学性质
(1) 盐 + 金属 = 新盐 + 新金属 置换反应
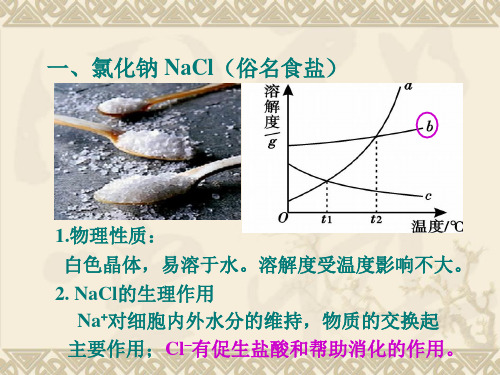
一、氯化钠 NaCl(俗名食盐)
1.物理性质: 白色晶体,易溶于水。溶解度受温度影响不大。 2. NaCl的生理作用
Na+对细胞内外水分的维持,物质的交换起 主要作用;Cl–有促生盐酸和帮助消化的作用。
氯化钠的用途
3. NaCl的用途
调味、腌制食品
配制生理盐水
选种
化工原料
消除积雪
4. 氯化钠的分布
(1)蒸发滤液析出的食盐未完全干燥即进行称量 (2)过滤后液体尚浑浊时,就进行蒸发水份 (3)称量或计算错误。
2、导致粗盐提纯后产率偏低的原因有哪些?
(1)粗盐没有完全溶解就进行过滤操作 (2)在过滤、蒸发过程中没有用玻璃棒引流或 搅拌不当造成液体溅失 (3)在蒸发皿、玻璃棒等处留有食盐等。
二、碳酸钠、碳酸氢钠和碳酸钙
Na2CO3能否与盐酸反应生成CO2?
Na2CO3++22HHCCl l==22NNaaCCl+l H+ 2HC2OO3 +CO2 ↑
⑶ 与澄清石灰水反应
CO2↑+H2O
现
产生白色沉淀
象 碳酸钠与氢氧化钙反应生成碳酸钙
Na分析2CO3+Ca(OH)2= CaCO3 +2NaOH
初中化学第十一单元课题1 课题1生活中常见的盐

是复分解反应,都有气体产生
复分解反应发生的条件
酸、碱、盐之间并不是 都能发生复分解反应。只有 当两种化合物互相交换成分, 生成物中有沉淀或有气体或 有水生成时,复分解反应才 可能发生。
酸、碱、盐之间的反应是复分解反应, 酸跟一些金属氧化物的反应也是复分解反应。
CuO + H2SO4 = CuSO4 + H2O CuO + 2HCl = CuCl2 + H2O Na2O + H2SO4 = Na2SO4 + H2O Na2O + 2HCl = 2NaCl + H2O Fe2O3 + 6 HCl =2 FeCl3 + 3 H2O Fe2O3 + 3 H2SO4 = Fe2(SO4)3 + 3 H2O
除食盐外,生活中你们还见过哪些盐?
碳酸钠(Na2CO3,俗称纯碱、苏打)
高锰酸钾(KMnO4)
虽然叫纯碱,溶液显
碱性,但不是碱是盐
碳酸氢钠(NaHCO3,又叫小苏打)
石灰石和大理石的主 要成分(CaCO3)
一、氯化钠( NaCl) 食盐的用途
调味品
医疗上的生理盐水是用 氯化钠配制的(100mL 生理盐水中含有0.9g医用 氯化钠)。
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水, “挥”表示挥发性,“—”表示那种物质不存在或者遇到水就分解了。
一些不溶性碱的制取
2NaOH+MgCl2 =Mg(OH)2↓+2NaCl 3NaOH+AlCl3=Al(OH)3↓+3NaCl 2NaOH+FeSO4=Fe(OH)2↓+Na2SO4
碳酸氢钠是焙制糕点所用 的发酵粉的主要成分之一
课题1生活中常见的盐(第一课时)

盐的种类
总结词
盐的种类繁多,根据阳离子和酸根的不同,可以分为不同的 盐类。
详细描述
盐的种类繁多,根据阳离子和酸根的不同,可以分为不同的 盐类。例如,食盐(氯化钠)、硫酸钠(芒硝)、碳酸钠( 纯碱)等。这些盐类在化学性质、用途和工业生产等方面都 有所不同。
盐的来源与分布
总结词
盐的来源主要有天然形成和人工合成两种方式,分布广泛。
为独特。
食盐的用途与作用
调味品
食盐是最常用的调味品之 一,能够增加食品的味道 和口感,提升食欲。
防腐剂
食盐具有防腐作用,能够 抑制细菌生长,延长食品 的保存期。
生理需求
食盐是人体必需的微量元 素钠的主要来源,对维持 人体正常生理功能具有重 要作用。
04
盐与健康
食盐摄入量与健康
适量摄入
食盐是人体必需的矿物质之一,适量摄入对维持人体正常 生理功能至关重要。
课题1 生活中常见的盐(第 一课时)
• 盐的概述 • 盐的化学性质 • 生活中的盐 • 盐与健康 • 盐的其他应用
01
盐的概述
盐的定义
总结词
盐是由金属阳离子(如钠、钾)与酸根阴离子(如氯、硫酸根)结合而成的化合 物。
详细描述
盐是生活中常见的物质,通常是指由金属阳离子(如钠、钾、镁等)与酸根阴离 子(如氯、硫酸根、硝酸根等)结合而成的化合物。这些离子结合后,形成结晶 状的物质,通常为白色或无色,具有特定的化学性质和用途。
食盐的性状
食盐为白色或略带灰色,有光泽, 易溶于水,味咸。
食用盐的种类与区别
精制盐
经过加工提纯,杂质含 量较低的食盐,纯度高, 适用于烹饪和食品加工。
海盐
直接从海水中提取的食 盐,含有较多的杂质和 微量元素,味道较为原
高一化学生活中常见的盐
3、仪器不干净等
过滤操作要点:
一贴:将滤纸折叠成圆锥形,用水湿 润使其紧贴在漏斗内壁上,中间不要 留有气泡。 二低:滤纸要低于漏斗的边缘、漏斗 里的液面应低于滤纸的边缘。 三靠:过滤时玻璃棒的末端要轻轻靠 在三层滤纸的一边;盛过滤液的烧杯 口要紧靠在玻璃棒的中上端,漏斗的 最下端要紧贴在烧杯内壁上,以免滤 液飞溅。
NaHCO3 白色固体
溶解度 较大(易溶)
较小(易溶)
用途 去油污、玻璃工业 制发酵粉、治 疗胃酸过多
固体与同 量、同浓 度盐酸反 应
溶液与盐 酸反应现 象与滴加 顺序的关 系
碳酸钠
快,产生大量气 泡,产生的气体 使澄清石灰水 变浑浊
碳酸钠溶液中 逐滴滴加盐酸 时,先没有明显 现象,随着盐酸 的加入,慢慢出 现大量气泡
思考:在溶解、过滤、蒸发和转移 氯化钠中,四次用到玻璃棒,各起 什么作用?
答:溶解粗盐时用玻璃棒,其作用是
_加_快__溶__解__速__度_;
过滤粗盐水溶液时用玻璃棒,其作用
是_引__流__;
用蒸发皿蒸发滤液时用玻璃棒,其作
用_以__免_ 滤液浓缩时因局部过热; 而使液滴飞溅
第四次_转__移__固__体__
碳酸氢钠
更快,产生更多气 泡,产生的气体使 澄清石灰水变浑 浊
首先就有大量的 气泡,随着盐酸 的加入,产生的 气泡越来越少。
a.碳酸钠、碳酸氢钠遇酸产生 二氧化碳
Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
b.碳酸钠溶液显碱性。 在碳酸钠溶液中滴加酚酞试液。 试液变红色.
课题1生活中常见的盐xutian

二、盐的溶解性口诀: 溶解性口诀:
钾钠铵盐水中溶, 钾钠铵盐水中溶, 硝酸盐入水无影踪, 硝酸盐入水无影踪, 盐酸盐除银、亚汞, 盐酸盐除银、亚汞, 硫酸钡、 硫酸钡、铅水不溶。
练习
1.判断下列物质是否溶于水: 判断下列物质是否溶于水: 判断下列物质是否溶于水
Na2CO3 BaCO3 BaSO 4 (NH4)2S Mg(OH)2 Na 3PO4
碳酸氢钠(小苏打) 碳酸氢钠(小苏打) NaHCO3和 HCl反应 HCl反应
NaHCO3+HCl===NaCl+H2O+CO2↑
碳酸盐的用途
碳酸氢钠(NaHCO3 ) 碳酸氢钠
【碳酸钠(Na2CO3 ) 碳酸钠 碳酸钙(CaCO3)】 碳酸钙 】
名 称 碳酸钠 碳酸氢钠 碳酸钙
主 要 用 途 用于生产玻璃、造纸、纺织、 用于生产玻璃、造纸、纺织、 洗涤剂 发酵粉的主要成分、治疗胃 发酵粉的主要成分、 酸过多的药剂 可作作补钙剂。石灰石、 可作作补钙剂。石灰石、大 建筑材料、 理石作作建筑材料 理石作作建筑材料、也用于 实验室制取二氧化碳
一、酸碱盐的溶解性口诀: 酸碱盐的溶解性口诀: 的溶解性口诀 酸都溶,碱中有钾, 钡可溶。 1、酸都溶,碱中有钾,钠,铵,钙,钡可溶。 硝酸盐都可溶。 2、钾,钠,铵,硝酸盐都可溶。 盐酸盐只有氯化银不可溶。 盐酸盐只有氯化银不可溶。 硫酸盐只有硫酸钡不可溶。 硫酸盐只有硫酸钡不可溶。 碳酸盐只溶钾, 碳酸盐只溶钾,钠,铵,剩下都不溶
AgCl MgSO4 Cu(OH)2 Ba(OH)2 AgNO3
课题1 生活中常见的盐

课题 1
盐
化肥
生活中常见的盐( 生活中常见的盐(一)
【问题】1、同学们在家有没有做过饭烧过菜?烧菜过程中 问题】 同学们在家有没有做过饭烧过菜? 应加那中主要调味品? 应加那中主要调味品? 最主要的是加一些盐,厨房中的盐通常指食盐( 最主要的是加一些盐,厨房中的盐通常指食盐(主要 成分是NaCl)。 成分是 )。 2、盐是什么? 、盐是什么? 盐是指组成里含有金属离子和酸根离子的一类化合物, 盐是指组成里含有金属离子和酸根离子的一类化合物, 不仅仅指食盐,而且有些盐是有毒的, 不仅仅指食盐,而且有些盐是有毒的,如我国曾发生过多 起因误将工业用盐亚硝酸钠( 起因误将工业用盐亚硝酸钠(NaNO2)当作食盐用于烹调 ) 而引起的中毒事件。 而引起的中毒事件。 生活中常见的盐还有碳酸钠( 生活中常见的盐还有碳酸钠(Na2CO3,俗称纯碱、苏 ,俗称纯碱、 )、碳酸氢钠 碳酸氢钠( )、高锰酸钾 打)、碳酸氢钠(NaHCO3,俗称小苏打)、高锰酸钾 ,俗称小苏打)、 (KMnO4)和大理石(主要成分为 )和大理石(主要成分为CaCO3)等 )
问题:这些粗盐中含有较多的可溶性杂质和不溶性杂质( 问题:这些粗盐中含有较多的可溶性杂质和不溶性杂质(如泥 ),可以通过什么方法除去泥沙等不溶性的杂质得 沙 等),可以通过什么方法除去泥沙等不溶性的杂质得 到精制的食盐? 到精制的食盐?
[活动与探究 :粗盐提纯(P69---P70) 活动与探究]:盐提纯( 活动与探究 )
一、氯化钠
观看:有关食盐的录象并阅读课本 观看:有关食盐的录象并阅读课本68-69页内容 页内容
交流: 交流:
1、现在你对氯化钠有了哪些进一步了解? 、现在你对氯化钠有了哪些进一步了解? 2、你所知道的氯化钠的组成如何?人体每天对氯化钠 、你所知道的氯化钠的组成如何? 的摄入量大约是多少?为什么?能否过多地食用食盐? 的摄入量大约是多少?为什么?能否过多地食用食盐? 3、氯化钠有那些重要的用途?它在自然界的分布情况 、氯化钠有那些重要的用途? 怎样? 怎样? 氯化钠的组成: 氯化钠的组成:NaCl 氯化钠的用途:用于医疗、农业、生活、交通、工业等。 氯化钠的用途:用于医疗、农业、生活、交通、工业等。 氯化钠的分布:海水、盐湖(盐池)、盐井和盐矿等。 )、盐井和盐矿等 氯化钠的分布:海水、盐湖(盐池)、盐井和盐矿等。 将海水、盐井水、盐湖水蒸发除去水份, 将海水、盐井水、盐湖水蒸发除去水份,可得到含杂质 较多的氯化钠晶体---粗盐 较多的氯化钠晶体 粗盐
课题1生活中常见的盐

名称 碳酸钠
碳酸氢钠
碳酸钙
俗名 苏打、纯碱 小苏打 大理石、石灰石
物理 易溶于水的 易溶于水的
性质 白色粉末
白色粉末
难溶于水的白色 固体
主要 用途
用于生产玻璃、发酵粉的主
造纸、纺织、 要成分、治
洗涤剂
疗胃酸过多
的药剂
可作作补钙剂。石灰石、 大理石作作建筑材料、 也用于实验室制取二氧 化碳
碳酸钠(Na2CO3 ) 碳酸氢钠(NaHCO3 ) 碳酸钙(CaCO3)
见书中73页
盐的分类
①正盐 酸跟碱完全反应的产物
②酸式盐 酸中的氢离子部分被中和的产物
③碱式盐 碱中的氢氧根离子部分被中和的产物
此外,对于含有相同酸根离子或相 同金属离子的盐,常给一个统称。
2.盐的化学性质
①金属+盐→ 新盐+新金属
在金属活动性顺序表中,只有位于前面的金 属才能把 位于后面的金属从它的 盐溶液中置 换出来,与氢的位置 无关;盐必须是 可溶性 盐。
• 溶解:加适量的水 • 过滤 :过滤的要点(一贴二低三靠) • 蒸发:(是否需要把水全部蒸干再熄灭酒精灯?) • 计算产率: 操作中4次用到玻璃棒,它的作用分别是什么?
溶解:搅拌,加速食盐溶解 过滤:引流,防止液体外溅 蒸发:搅拌,防止液滴飞溅 计算产率:转移固体
某兴趣小组进行粗盐提纯并配制NaCl溶液,请回答下列问题:
㈤ 碱性氧化物 +酸 =盐 + 水
反应条件:生成物中有水、气体或沉淀出现。
练习:⑴CuO +H2SO4─ ⑵Fe2O3 + HCl─ ⑶Na2O + HNO3─ ⑷CaO + HCl─
正确答案:
课题1 生活中常见的盐

NaHCO3+HCl=NaCl+ CO2 ↑ +H2O
实验11-2
实验11-2 碳酸钠溶液+澄清石灰水 现象 出现白色沉淀 二者发生反应,生成一种难溶物
分析
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ca(OH)2=CaCO3 ↓ +2NaOH Na2CO3+2HCl=2NaCl+ CO2↑ +H2O
讨论
迄今为止,在初中化学中,我们已经学习 了关于空气、氧气、水、碳、二氧化碳、氧化 铜、铁、铝、硫酸、氢氧化钠和氯化钠等一系 列物质的知识。为方便记忆和进一步学习,可 按组成和性质对学过的物质进行整理和分类, 例如: 1.根据物质组成是否单一,可以把物质分 成几类? 两类。混合物和纯净物。 2.在纯净物中,根据组成元素的异同,可 以把它们分成几类? 两类。单质和化合物。
金属 氧化物
①
酸
②
一 般 ①金属氧化物+酸→盐+水 不 需 ②酸+碱→盐+水(中和反应) 判 断
③酸+盐→新酸+新盐 需 要 判 断
碱
④
③
④碱+盐→新碱+新盐
盐
⑤
⑤盐+盐→两种新盐
课堂练习
1.判断下列反应能否发生,能发生反应的完 成化学方程式。
(1)氧化铜和盐酸 CuO+2HCl=CuCl2+H2O (2)氢氧化铜和硫酸Cu(OH)2+H2SO4=CuSO4+2H2O (3)盐酸和碳酸钙CaCO3+2HCl=CaCl2+H2O+CO2↑ (4)盐酸和硫酸钠 (5)硫酸和碳酸钾K2CO3+H2SO4=K2SO4+H2O+CO2↑ (6)硝酸钙和盐酸
课题1 生活中常见的盐

氯化钠的分布: 海水、盐湖、盐井和岩矿
பைடு நூலகம்盐场
海盐
粗盐中含有的较多的可溶性杂质(如:MgCl2、 CaCl2)和不溶性杂质(如:泥沙等)
怎样由粗盐转化成精盐呢??
【思考】要将粗盐初步提纯(即除去粗盐中的 不溶性杂质─泥沙)应采用什么方法?
除去粗盐中泥沙的方法主要是:过滤法
防止液滴飞溅
烧杯
漏斗
低
搅拌,加速溶解
使溶液受热均匀, 出现较多固体
坩埚钳
【作业】
P 75 T 1、2、3
(一)溶解
用托盘天平称量2.2g粗盐,用量筒 取7ml水,倒入烧杯中,并将粗盐倒入 烧杯中,用玻璃棒不断搅拌。
(二)过滤
一贴:滤纸紧贴漏斗内壁
二低: 滤纸边缘低于漏斗边缘 液面低于滤纸边缘 三靠: 烧杯口紧靠玻璃棒 玻璃棒斜靠三层滤纸一边 漏斗颈紧靠烧杯内壁
(三)蒸发 仪器:铁架台(带铁圈)、酒精灯、 蒸发皿、玻璃棒、坩埚钳、
蒸发应注意: 1.停止加热时,不能把蒸发皿立即直接 放在实验台上。
2.加热过程中,用玻璃棒不断搅动
3.当蒸发皿中出现较多量固体时,停止 加热,利用余热使滤液蒸干。
1.下列说法正确的是 A.盐都能食用,故称食盐 B.盐就是食盐,易溶于水 C.盐都有咸味,都是白色晶体 D.盐是一类物质的总称
(D)
【例】
第十一单元 盐 化肥
课题1氯化钠及粗盐的初步提纯
盐是什么?
?
金属阳离子(或铵根离子NH4+)和酸根离子组 成的化合物
氯化钠(NaCl)——俗名:食盐 用途:
生活方面:重要的调味品;可用来腌制食品;
医疗方面:用于配制生理盐水
课题1-1 生活中常见的盐

一、氯化钠(NaCl)
①主要用途:调味品、腌渍食品、消毒,化工原 料。 ②制法:蒸发海水、盐湖水,井盐水。
二、碳酸钠、碳酸氢钠和碳酸钙
(1)Na2CO3:白色粉末,俗名:苏打、纯碱 (纯碱不是碱,它是盐) (2)NaHCO3:白色粉末, 俗名:小苏打。 (3)CaCO3:白色固体,石灰石、大理石主要成 分。 主要用途: (1)Na2CO3:玻璃、造纸、纺织和洗涤剂等。 (2)NaHCO3:糕点发酵粉,治疗胃酸过多等。 (3)CaCO3:建筑材料,补钙剂等。
第十一元 盐
化肥
课题1 生活中常见的盐
提到盐,同学们可能马上会想到食盐,其实,在化 学中,盐是指的一类化合物,即组成里含有金属离 子和酸根离子的化合物。如氯化钠、硫酸铜、碳酸 钠等。我国曾发生多次将工业用盐如亚硝酸钠误作 食盐用于烹饪而引起的中毒事件。原因就是混淆了 盐和食盐的概念。除食盐外,生活中常见的碳酸钠、 碳酸氢钠、高锰酸钾、大理石等都属于盐。
含有碳酸根离子或碳酸氢根离子的盐都能与盐酸反 应,生成二氧化碳气体。
未知物,加入少量稀盐酸,看能否 生成使澄清石灰水变浑浊的气体。
滴加 盐酸 通入澄清 石灰水中
未知物
产生气体
看澄清石 灰水是否 变浑浊
一、盐的分类
1.按盐中是否含有氧元素划分 无氧酸盐:NaCl、CaCl2 、MgCl2、 KCl 、Na2S 由后往前读作:“某”化“某” 含氧酸盐:Na2SO4 、KNO 3 、CaCO3、 K2SO4、 K3PO4 根据中心元素读作:“某”酸 “某” 2.另外根据盐的组成里所含阴、阳离子的特点, 可将盐分类并称为某盐
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
①观察:反应①②③有什么共同特点? ②讨论:由此你发现了什么? ③归纳:含有碳酸根离子(或碳酸氢根离 子)的盐的鉴定方法。 ④举例:填写下表
被鉴定的物质
加入的试剂
现象
小结:
2-(或HCO -)离子 组成里含有CO3 3
的盐,都能和HCl反应生成使澄 清石灰水变浑浊的气体CO2 ,利 用此反应可以检验盐的组成中是 2-(或HCO -)离子。所 否含有CO3 3 用试剂为稀盐酸和澄清石灰水。
包 含 的 化 学 原 理 是 什 么
?
要留清白在人间。
CaCO3 ====== CaO
高温
+
CO2 ↑
【回顾】 请书写出实验室制取CO2的方程式。 CaCO3 + 2 HCl === CaCl2 + H2CO3 CO2↑+H2O
盐酸腐蚀含CaCO3的建材
思考:
将一个新鲜的鸡蛋放在盛有足量稀盐酸 的玻璃杯中,可观察到鸡蛋一边冒气泡一边沉 到杯底,一会儿又慢慢上浮,到接近液面时又 下沉。为什么会出现这个现象?
市场上的功能饮料
由于新陈代谢,人体内每天都有一定量 的Na+、Cl- 和K+从各种途径排出体外,因 此需要膳食给予补充,正常成人每天氯化 钠的需要量大约为3 g~5g。 此外,常用淡盐水漱口,不仅对咽喉疼 痛、牙龈肿疼等口腔疾病有治疗和预防作 用,还具有预防感冒的作用。
小常识:
碳酸钠+ 盐酸
碳酸氢钠+盐酸
现象 分析
白色固体溶解,放出使澄清 石灰水变浑浊的无色气体 碳酸钠(或碳酸氢钠)与盐 酸反应生成了CO2气体
【演示实验11-1】
【练习】请写出上述有关化学方程式。 【设问】碳酸钠能否与碱反应?
俗称 名 称
(或主要 成分)
主 要 用 途
用于生产玻璃、造纸、纺 织、洗涤剂 发酵粉的主要成分之一, 治疗胃酸过多症的药剂
1、清晨起来喝一杯淡盐开水,可治大便不通。 2、用盐水洗头可减少头发脱落。 3、茄子根加点盐水洗脚,可治脚气病。 4、皮肤被热水烫了,用盐水洗一下可以减轻疼痛。 5、演讲、作报告、唱歌前喝点淡盐水,可避免喉干 嗓哑。 6、洗衣服时加点盐,能有效防止褪色。 7、把胡萝卜咂成糊状,拌上盐,可以擦衣服上的血 迹。 8、炸东西时,在油里放点盐,油不外溅
资料:石笋和钟乳石的形成
CaCO3+H2O+CO2==Ca(HCO3)2 Ca(HCO3) 2==CaCO3↓+H2O+CO2↑
氯化镁----苦的, 碳酸钠----涩的, 硫酸亚铁----酸的, 谷氨酸钠-----味精,鲜美!
亚硝酸钠 (NaNO2)
亚硝酸钠是工业用盐, 它是一种白色不透明晶体, 形状很像食盐。亚硝酸盐 不仅是致癌物质,而且摄 入0.2~0.5 g即可引起食 物中毒,3 g可致死。而亚 硝酸盐是食品添加剂的一 种,起着色、防腐作用, 广泛用于熟肉类、灌肠类 和罐头等动物性食品。现 在世界各国仍允许用它来 腌制肉类,但用量严加限 制。
变浑浊
观察与思考(一):
①碳酸钙与盐酸反应的化学方程式:
CaCO3+2HCl=CaCl2+H2O+CO2↑ 试着书写下列反应的化学方程式: ②碳酸钠与盐酸: Na2CO3+2HCl=2NaCl+H2O+CO2↑
③碳酸氢钠与盐酸:
NaHCO3+HCl=NaCl+H2O+CO2↑
两种著名的制碱技术
(1)氨碱法制纯碱(索尔维制碱法)
(2)联合制碱法(侯氏制碱法)
几种常见离子的检验
1.氯离子的检验
①滴加硝酸银,现象: 生成白色沉淀 ②滴加稀硝酸,现象: 沉淀不溶解 2.硫酸根离子的检验
①滴加硝酸钡,现象: 生成白色沉淀 ②滴加稀硝酸,现象: 沉淀不溶解
复分解反应 1.概念 由两种化合物互相交换成分, 生成另外两种化合物的反应。 酸+金属氧化物→盐+水 酸+碱→盐+水 酸+盐→新酸+新盐 碱+盐→新碱+新盐 盐+盐→新盐+新盐
碳酸钠
纯碱 苏打 小苏打 大理石 石灰石
碳酸氢钠
碳酸钙
可作补钙剂,用于实验室制 取二氧化碳,石灰石、大理 石用作建筑材料
钙 片
(盐酸腐蚀含碳酸钙的建材) 写出此反应的化学方程式。
生活中还有哪些盐能与盐酸反应产生二氧 化碳气体?
三、碳酸钠、碳酸氢钠、碳酸钙的化学性质
1.与酸反应
实验现象: 产生大量气泡,澄清石灰水
我国食盐产地
我国食盐的产地分布很广,出产着种类繁 多的盐:海盐、井盐、岩盐、池盐等。其中辽 宁、山东、两淮、长芦各盐场盛产海盐,自古 闻名。井盐则以四川自贡市的自流井最为有名, 岩盐产于四川、云南、等地。在青海、新疆、 内蒙古等地有很多咸水湖,盛产池盐,其中最 大的是柴达木盆地的察尔汗盐池,据统计,仅 这一盐池开采出来的池盐,足够我国十二亿人 口食用四千多年。
4、Na2SO4 + HCl ------5、H2SO4 + BaCl2-------
6、Ba(OH)2+ KCl -----7、CuSO4 + NH4NO3--8、HNO3 + NaOH ----NaNO3 + H2O
我国制碱工业的先驱——侯德榜
在中国化学工业史上,有 一位杰出的科学家,他为祖国 的化学工业事业奋斗终生,并 以独创的制碱工艺闻名于世界, 他就像一块坚硬的基石,托起 了中国现代化学工业的大厦, 这位先驱者就是被称为“国宝” 的侯德榜。 侯德榜一生在化工技术上有三 大贡献。第一,揭开了苏尔维 法的秘密。第二,创立了中国 人自己的制碱工艺——侯氏制 碱法。第三,就是他为发展小 化肥工业所做的贡献。
食盐
海南省东方盐 场晒盐一景
海水里含有3%的食盐,把海 水引进晒盐池,经过风吹日晒、水 份蒸发,白花花的食盐就析出来了。 其它还有用盐井水,盐湖水熬盐, 使食盐溶液达到饱和,再继续蒸发, 食盐就成晶体析出,得到精盐。
重要的建筑材料
咏石灰 于谦
千锤万凿出深山,
烈火焚烧若等闲。 粉骨碎身浑不怕,
氯化钠日常生活用于调味和腌菜、肉,医 药上的生理盐水0.9%的氯化钠溶液,工业上是 化工原料,制取氯气、盐酸、纯碱。
氯化钠与人体健康
如运动过度,出汗太多时, 体内的Na+、Cl- 和K+大为
降低,就会使肌肉和神经 反应受到影响,导致恶心、 呕吐、衰竭和肌肉痉挛等 现象。因此,运动员在训 练或比赛前后,需喝特别 配制的饮料,以补充失去 的盐分。
第十一单元 盐 化肥
原从水中来, 不敢水中行。 人人都要我, 无我食不成。
(打一物质)
食盐
盐:(金属离子 + 酸根离子 ) 电离时生成金属离子(包括NH4+) 和酸根离子的化合物叫做盐。
常见的盐
五水硫酸铜晶体 食盐 用钡餐观察 肠内情况 硝酸钾晶体
明矾晶体
“盐”都是 咸的吗?
醋酸铅----甜的(有毒不能食用),
2.条件 只有当两种化合物交换成分, 生成物中有沉淀或有气体或有水生 成时,复分解反应才可以发生。 当碱和盐,盐和盐均可溶时, 复分解反应才可以发生。
பைடு நூலகம்
【思考】 1、AgNO3 + HCl -------2、 K2CO3+ Ca(OH)2--3、Na2CO3+ CaCl2 ----AgCl↓+HNO3 CaCO3↓+ KOH CaCO3↓+ NaCl BaSO4↓+ HCl
古罗马货币
在古罗马表示富有与贫穷,不看拥有 黄金的多少,而是比藏有盐粒的数量,被 历史上称为食盐货币时代。 我国的西藏过去也使用过盐巴货币。为 了换取生活必需的一小块盐巴,需要付出 昂贵的代价。贵州解放前只有少数人家吃 得起吊盐(吃完饭以后,用舌头在吊挂着 的盐块上舔一下)可见食盐的贵重。
食盐的用途
