pH的计算
pH计算

例如:H+)=1×10-7 mol/L的中性溶液: pH=-lg c(H+) =-lg10-7 = 7
c(H+)=1×10-5 mol/L的酸性溶液: pH=-lg c(H+) =-lg10-5=5
c(H+)=1×10-9 mol/L的碱性溶液: pH=-lg c(H+) =-lg10-9=9
4、计算常温下等体积混合0.1mol/L盐酸和0.06mol/L 氢氧化钡溶液后的pH值。
5、常温下,1体积pH=13的某强碱与9体积pH=2的某 强酸混合,求混合液的pH。
C
B
CD
11.8
1
9:2
pH的有关计算
类型一:单一溶液 强酸:
pH=-lg c(H+)
1. 10-5mol/L、0.1mol/L 、1mol/L HCl溶液的pH为多少? 0.005mol/L的H2SO4溶液
强碱: 2 常温 : 10-5mol/L、0.1mol/L 、1mol/L 的NaOH溶液
呢?
0.005mol/L的Ba(OH)2溶液
。
(4)pH=3的盐酸跟pH=11的氨水等体积混合后的pH ________ ﹥7
类型三: 稀释后溶液的pH的计算
1. 酸的稀释: 25℃下,10-5mol/L的盐酸溶液中, C(H+) = _____mol/L 。 10-5 将上述盐酸稀释10倍,溶液中 C(H+)= ______ 10-6 mol/L 将上述溶液稀释10000倍,溶液中C(H+) = ____ 10-7 mol/L 2. 碱的稀释 在25℃时,pH=9的NaOH溶液稀释到10倍, pH值等于多少? 8 在25℃时,pH=9的NaOH溶液稀释到10000倍后, pH值为多少? 7
关于PH值的计算

关于PH值的计算关于PH值的计算⼀、应知应会:1.pH=-lg[H+],pOH=-lg[OH-],pH+pOH=142.pH值的适⽤范围是溶液的[H+]⼩于或等于1mol/L。
3.[H+]是电解质已电离出的H+离⼦的物质的量浓度。
4.5.不同体积不同pH值溶液混合,若⼆者为强酸,则求出混合溶液的[H+],求pH值;若⼆者为强碱,则必须求出混合后溶液的[OH-]值再化为pH值。
若⼀强酸与⼀强碱,则求出H+离⼦或OH-离⼦后,求得[H+]化为pH值或求[OH-]再化为pH值。
⼆、范例解析[例1]稀释下列溶液时,pH值怎样变化?(1)10mLpH=4的盐酸,稀释10倍到100mL时,pH=?(2)pH=6的稀盐酸稀释⾄1000倍,pH=?[分析](1)p=4,即[H+]=1×10-4mol/L,稀释10倍,即[H+]=1×10-5mol/L,所以pH=5。
⼩结:强酸每稀释10倍,pH值增⼤1,强碱每稀释10倍,pH值减⼩1。
(2)当强酸、强碱溶液的H+离⼦浓度接近⽔电离出的H+离浓度(1×10-7mol/L)时,⽔的H+离⼦浓度就不能忽略不计。
所以pH=6的稀盐酸,稀释1000倍时:[H+]=(1×10-6+999×10-7)/1000=1.009×10-7pH=6.99由此可知溶液接近中性⽽不会是pH=9。
[例2]求强酸间混合或强碱间混合溶后液的pH值。
(1)pH=12,pH=10的强酸溶液按等体积混合后溶液的pH值。
(2)pH=5和pH=3的强酸溶液接等体积混合后溶液的pH值。
[分析](1)碱溶液的混合,溶液以OH-为主,所以应选确定[OH-][OH-]=(1×10-2+1×10-4)/2=5.05×10-3(mol/L)得:pOH=2.3,pH=14-2.3=11.7也可根据⽔的离⼦积常数,在先确定出溶液中[OH-]为5.05×10-3mol/L后,再求[H+]pH值。
PH的计算

类型5:强酸与强碱混合溶液
解题方法:
先判断混合后溶液酸碱性-
酸性: 计算混合后c(H+),再计算PH
碱性:先计算混合后c(OH-),再计算c(H+) 最后计算PH
例2:将PH=6的HCl和PH=10的NaOH溶液等体积混 合,求该混合溶液的PH值。
解: C(H+)=1×10-6mol/L n(H+)=1×10-6Vmol n(OH-)=1×10-4 V mol 故余约n(OH-)=1×10-4 V mol C(OH-)=5×10-5mol/L
A.硫酸溶液中放出的氢气的量最多 B.醋酸溶液中放出的氢气的量最多 C.盐酸和硫酸中放出的氢气的量相等 D.盐酸比硫酸放出的氢气的量多
例1、计算常温下,0.5mol/L硫酸溶液PH。
解:C(H+)=0.5mol/Lx2=1mol/L. PH=-lgc(H+)=-lg1=-lg100=0
练习
将PH=5的稀盐酸,加水稀释1000倍,所 得溶液PH为多少? 约为7
类型2:单一碱溶液
解题方法:先计算c(OH-),再据Kw计算c(H+),最后计算PH。
若室温时,VaLpH=a的CH3COOH溶液与
VbLpH=b的NaOH溶液混合,恰好完全反应,
则该CH3COOH的电离度
(1)当
Va Vb
=1时,a
=______;
(2)当
Va Vb
=10时,a=
______;
(3)当
Va Vb
=1/10
时,a
=______。
提示:醋酸与氢氧化钠溶液恰好完全反应,说明物质的量相等。 设醋酸浓度为c(CH3COOH),则Vax c(CH3COOH),
pH计算

pH计算我们知道c(H+)和pH的关系:pH=-lg c(H+),c(H+)=10-pH。
但在计算溶液pH时,往往稍有不慎就会出现错误,原因大多是没有掌握计算的关键。
在计算溶液pH时,关键是要抓住“问题的主要方面”—--酸性溶液一定要用溶液中的c(H+)来计算;碱性溶液一定要先求出溶液中的c(OH-),再用kw转化求出溶液中的c(H+)来计算。
即口诀为:酸按酸(H+),碱按碱(OH-),同强相混直接算,异强相混看过量(谁多显谁性),无限稀释“7”为限。
下面结合例题来阐述pH计算:一、单一强酸或强碱溶液的pH计算【例1】0.01mol/L的HCl溶液的pH=__2___。
0.05mol/L的Ba(OH)2溶液的pH=__13____。
解析:0.01mol/L的HCl溶液中c(H+)=0.01mol/L,pH=-lgc(H+)=2;0.05mol/L的Ba(OH)2溶液中c(OH-)=0.1mol/L,c(H+)=1×10-14/0.1=1×10-13 mol/L,pH=-lgc(H+)=13 二、单一酸或碱稀释后的pH计算原理:稀释前后酸或碱的物质的量不变。
一般计算公式:C1V1=C2V2,据此求出稀释后酸或碱的物质的量的浓度。
【例2】(1)常温下,取10mL pH=2的HCl溶液稀释成1000mL的溶液,稀释后溶液的pH=____5____。
(稀释后溶液中c(H+)=10-5mol/L)(2)把1ml0.05mol/L的H2SO4溶液加水稀释制成100ml溶液,稀释后溶液的pH=__3___。
(稀释后溶液中c(H+)=10-3mol/L)(3)常温下,0.01mol/L的NaOH溶液稀释1000倍,稀释后溶液的pH= ____9_。
(稀释后溶液中c(O H-)=1×10-5mol/L,此时溶液中c(H+)=10-9mol/L)(4)将pH=14的NaOH溶液稀释1000倍,则稀释后溶液的pH=_11_____。
PH的计算

=1 ×10-4mol/L
C(H+) =
=
=1 ×10-10mol/L
pH=-lgC(H+) =10
关键:抓住氢氧根离子离子进行计算!
溶液的稀释 PH=3的稀盐酸加水稀释100倍
稀释后所得 溶液的PH
5
PH=2的稀硫酸加水稀释100倍
4
PH=11的NaOH溶液加水稀释100倍
9
PH=12的Ba(OH)2溶液加水稀释100倍
关键:酸过量抓住氢离子进行计算!
pH值计算6—— 强酸与强碱混合
例题:在25℃时,100mlO.4mol/L的盐酸与等体积 0.6mol/L的氢氧化钠溶液混合后,溶液的pH值等于多少?
解:NaOH+HCl=NaCl+H2O 0.06 0.04 C(OH—)=(0.06-0.04)/0.2=0.1 C(H+)=10-14/c(OH—)= 10-14/0.1
_1_1__<_p_H_<_1_2__。
知识小结:溶液稀释的PH计算有关规律
1、c(H+)或c(OH-)相差(改变)10倍,PH 相差(改变)一个单位。 2、强酸(碱)溶液每稀释10倍,PH增大 (减小)一个单位。弱酸(碱)每稀释10倍,
pH值向7靠拢不到一个单位。
3、酸(碱)溶液无限稀释时,PH均约等 于7(均要考虑水的电离)。 4、酸(碱)溶液稀释时,OH-(H+)的
PH混
(酸)= PH小 + 0.3 (碱)= PH大 - 0.3
总结论:两种强酸(碱)溶液等体积混合, 溶液的pH值以原浓溶液的pH向7靠拢0.3个单 位。
混合溶液的PH计算
两溶液等体积混合
甲溶液
乙溶液
PH计算

PH一知识讲解:溶液PH计算的整体思路是:1、根据pH的定义pH=-lgc(H+),溶液PH计算的核心是确定溶液中的c(H+)相对大小。
2、根据pH定义pH=-lgc(H+)的引申,溶液的pOH=-lgc(OH-),溶液pOH计算的核心是确定溶液中的c(OH-)相对大小,再根据pH+pOH=-lgK w得出pH3、在溶液pH的计算时,当两种溶液的浓度相差100及其以上,浓度相差悬殊,浓度较小的pH可以忽略不计。
一、单一溶液pH的计算若该溶液是酸性溶液,必先确定c(H+),再进行pH的计算;若该溶液是碱性溶液,必先确定c(OH-),可根据c(H+)·c(OH-)=K w换算成c(H+),再求pH,或由引用pH定义,由c(OH-)直接求pOH,再根据pH+pOH=-lgK w,换算出pH。
等物质的量浓度的下列物质,求其pH或pOH例1:求室温条件下 0.005mol/L的H2SO4溶液的pH值解: ∵ C(H2SO4) = 0.005mol/L∴ [H+] = 0.005×2 = 0.01 mol/LpH = -lg[H+] = -lg0.01 = 2例2:求室温条件下 0.005mol/L的Ba(OH)2溶液的pH值解: ∵ C(Ba(OH)2) = 0.005mol/L∴ [OH-] = 0.005×2 = 0.01mol/L[H+] = Kw/[OH-] = 10-14/0.01 = 10-12mol/L∴ PH = -lg[H+] = -lg10-12 = 12例3:已知室温条件下,某溶液的pH = 4,求此溶液中H+和OH-的浓度.解: ∵PH =4=-lg[H+]= 4∴[H+] = 10-4mol/L[OH-] = Kw/[H+] = 10-14/10-4= 10-10mol/L例4:25℃时,0.1mol/L某一元弱酸的电离度为1%,求此溶液的pH值.解: [H+] = cα= 0.1mol/L ×1% = 10-3 mol/LpH = 3例5:25℃时,0.1mol/L某一元弱碱的电离度为1%,求此溶液的PH值.解: [OH-] = cα= 0.1mol/L ×1% = 10-3 mol/L[H+] = Kw/[OH-] = 10-14/10-3= 10-11mol/LpH = 11二、溶液混合后pH的计算(1) 两强酸混合,先求混合后的c(H+)混,再直接求pH值:c(H+)混==[c(H+)1·V1+c(H+)2·V2]/(V1+V2)速算规律: pH相差2个单位以上的强酸等体积混合,混合后的pH混= pH小 + 0.3例6、pH=4的盐酸和pH=2的盐酸等体积混合后,溶液的pH为多少?解析:由题意pH=4的盐酸,c(H+)1=1.0×10-4mol/L;pH=2的盐酸,c(H+)2=1.0×10-2mol/L。
计算一元弱酸或弱碱溶液ph值的新公式

计算一元弱酸或弱碱溶液ph值的新公式PH值计算公式
1. 对于强酸:
PH = -log[H^+]
2. 对于弱酸:
PH = -log[(H^{+})(A^{-})^{Ka}]
3. 对于强碱:
PH = 14 - log[OH^-]
4. 对于弱碱:
PH = 14 + log[(OH^{-}) (B^{+})^{Kb}]
以上是确定一元弱酸或弱碱溶液PH值所用的公式。
弱酸的pH值,需要使用此公式:
PH = -log[(H^{+})(A^{-})^{Ka}], 其中Ka是弱酸的平衡常数;
而弱碱溶液的PH值,需要使用另一个公式:
PH = 14 + log[(OH^{-}) (B^{+})^{Kb}], 其中Kb是弱碱的平衡常数。
为了计算一元弱酸或弱碱溶液的PH值,需要先知晓相应分子式、以及这些分子式形成不同有机物时,酸性和碱性的反应强度(即用平衡常数K表示,如Ka和Kb),才能使用以上公式正确的计算出PH值。
例如一种典型的弱碱,乙醇氮基聚磷酸盐(EDTP),它的平衡常数
Kb为7.4×10-9,此时,我们可以使用公式14 + log[(OH^{-}) (B^{+})^{Kb}]计算,其PH值为9.225。
酸碱中的pH值计算与酸度常数

酸碱中的pH值计算与酸度常数在化学领域中,酸碱溶液的酸度常数及其对应的pH值是重要的概念。
本文将介绍酸碱中的pH值计算方法以及酸度常数的定义和计算。
通过对这些概念的了解,我们可以更好地理解酸碱溶液的性质和行为。
一、酸碱溶液的pH值计算方法pH值是表示溶液酸碱性强弱的指标,它用数值表示溶液中氢离子(H+)的浓度。
pH值的计算公式如下:pH = -log[H+]其中[H+]表示氢离子的浓度。
酸碱溶液的pH值通常在0到14之间,pH=7表示中性溶液,pH<7表示酸性溶液,pH>7表示碱性溶液。
需要注意的是,pH值反映的是溶液中酸碱性强弱的程度,而非溶液的浓度。
不同浓度的酸碱溶液可能具有相同的pH值。
二、酸度常数的定义和计算酸度常数是表示酸性溶液中酸的强弱程度的指标。
在化学中,酸度常数由酸解离常数(Ka)来表示。
酸解离常数定义为酸溶液中酸解离生成氢离子(H+)的浓度与未解离的酸浓度的比值。
酸解离常数的计算公式如下:Ka = ([H+][A-])/[HA]其中[A-]表示酸解离得到的阴离子的浓度,[HA]表示未解离酸的浓度。
酸度常数(Ka)值越大,说明酸的解离程度越高,酸性越强。
三、pH值与酸度常数的关系pH值和酸度常数之间存在一定的关系。
对于弱酸来说,酸度常数(Ka)越小,pH值越大。
而对于强酸来说,酸度常数(Ka)越大,pH值越小。
例如,对于HCl(盐酸)这个强酸来说,其酸度常数非常大,几乎完全解离成氢离子和氯离子,因此pH值为1左右。
而对于乙酸这个弱酸来说,其酸度常数相对较小,所以乙酸的pH值约为4.8。
四、酸碱反应中pH值的变化在酸碱反应中,当强酸与强碱反应时,产生的盐会使溶液中的氢离子浓度降低,从而提高了溶液的pH值,使其接近中性。
当强酸与弱碱反应时,由于强酸的酸度常数较大,酸的解离程度高,使得溶液中的氢离子浓度增加,pH值降低。
当弱酸与强碱反应时,由于弱酸的酸度常数较小,酸的解离程度低,使得溶液中的氢离子浓度不变或轻微增加,pH值变化不大。
pH的计算

如:将pH=1的HCl和pH=9的NaOH溶液等体积 混合,所得溶液的pH=?
答案:pH=1.3
4.溶液稀释后的pH
如:A.取1mLpH=3的H2SO4溶液加水稀释到100mL 后,溶液的pH是多少? 解:稀释后溶液中 c(H+)=n (H+)/v (H2SO4(aq)) =(10-3mol/L×10-3L)/10-1 =10-5mol/L pH=-lg c(H+) =-lg 10-5=5 答:稀释后溶液的pH为5。
小结:计算过程中最关键的是先确定溶液的 性质——即酸性还是碱性。
作业:课本P52 (4.5.6.7) 练习册P112(10.15)
B.把1mL0.1mol/L的Ba (OH-)2溶液加水稀释成2L 溶液,在此溶液中,其OH-浓度接近于( A). A.1×10-4mol/L B. 1×10-8mol/L
C.1×10-11mol/L
D.1×10-10mol/L
规律:常温下 对于强酸溶液(pH=a),稀释10n倍, pH将 变大,且变大n个单位,即pH=a+n 。无 限稀释后, pH接近7. 对于强碱溶液(pH=b),稀释10n倍, pH将 变小,且变小n个单位,即pH=b-n 。无限 稀释后, pH接近7.
关于pH的简单计算
回顾:
常温下:
中性溶液:c(H+) = c(OH-) =1×10-7mol/L 酸性溶液: c(H+) > c(OH-) , c(H+)>1×10-7 mol/L, c(OH-) < 1×10-7 mol/L
碱性溶液: c(H+) < c(OH-) , c(H+)<1×10-7 mol/L ,
PH的计算

4、强酸与强酸、强碱与强碱的混合
例5:将pH=1和pH=2的盐酸等体积混合,求混 合后溶液的pH值。 例6:将pH=12的氢氧化钠溶液和pH=13的 Ba(OH)2溶液等体积相混合,求混合后溶液的 pH值。
解题关键: 把各自溶液中占主导地位的H+或OH-的物质 的量相加除以混合后总体积,可得混合溶液 的c(H+)或c(OH-),即可求出pH值。
例7. pH=2和pH=4的两种盐酸溶液等体积混合,求混 合溶液的pH值 pH=2.3 例8. pH=10和pH=8的两种NaOH溶液等体积混合,求 pH=9.7 混合溶液的pH值。
结论:两种强酸溶液pH相差2或2以上且等体积 混合,溶液的pH值等于浓溶液的pH加0.3 结论:两种强碱溶液pH相差2或2以上且等体积 混合,溶液的pH值等于浓溶液的pH减0.3
弱酸、弱碱稀释后溶液pH的变化比强酸、强碱小。
4、强酸与强酸、强碱与强碱的混合
(1)、两强酸混合后的pH计算
先求出混合后的c(H+) ,再直接求出pH。
即: c(H+) = [c(H+) 1 ×V1+ c(H+) 2 ×V2]÷(V1+V2)
(2)、两强碱混合后的pH计算
先求出混合后的c(OH-) ,根据溶液的KW 再求出溶液中的c(H+) ,然后再求出pH。
3、弱酸、弱碱的稀释
例4. pH=3醋酸加水稀释到原来 10倍,溶液的 pH值范 围_______________________ pH=12 氨水加水稀释到原来 10 倍,溶液的 pH 值范围 ________________________ 结论:弱酸(碱)每稀释10倍,pH值向7靠拢不到一个单位
pH 值 的 计 算
pH值的计算
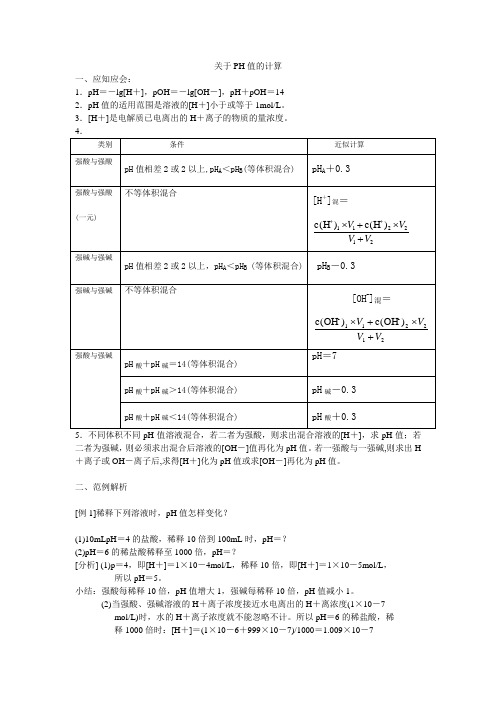
关于PH值的计算一、应知应会:1.pH=-lg[H+],pOH=-lg[OH-],pH+pOH=142.pH值的适用范围是溶液的[H+]小于或等于1mol/L。
3.[H+]是电解质已电离出的H+离子的物质的量浓度。
二者为强碱,则必须求出混合后溶液的[OH-]值再化为pH值。
若一强酸与一强碱,则求出H +离子或OH-离子后,求得[H+]化为pH值或求[OH-]再化为pH值。
二、范例解析[例1]稀释下列溶液时,pH值怎样变化?(1)10mLpH=4的盐酸,稀释10倍到100mL时,pH=?(2)pH=6的稀盐酸稀释至1000倍,pH=?[分析] (1)p=4,即[H+]=1×10-4mol/L,稀释10倍,即[H+]=1×10-5mol/L,所以pH=5。
小结:强酸每稀释10倍,pH值增大1,强碱每稀释10倍,pH值减小1。
(2)当强酸、强碱溶液的H+离子浓度接近水电离出的H+离浓度(1×10-7mol/L)时,水的H+离子浓度就不能忽略不计。
所以pH=6的稀盐酸,稀释1000倍时:[H+]=(1×10-6+999×10-7)/1000=1.009×10-7pH=6.99由此可知溶液接近中性而不会是pH=9。
[例2]求强酸间混合或强碱间混合溶后液的pH值。
(1)pH=12,pH=10的强酸溶液按等体积混合后溶液的pH值。
(2)pH=5和pH=3的强酸溶液接等体积混合后溶液的pH值。
[分析](1)碱溶液的混合,溶液以OH-为主,所以应选确定[OH-][OH-]=(1×10-2+1×10-4)/2=5.05×10-3(mol/L)得:pOH=2.3,pH=14-2.3=11.7也可根据水的离子积常数,在先确定出溶液中[OH-]为5.05×10-3mol/L后,再求[H+]pH值。
[H+]=kw/[OH-]=(1×10-14)/(5.05×10-3)=1.98×10-12(mol/L)∴PH=11.7(2)强酸溶液的混合,溶液中[H+]是主要的。
PH的计算

pH值计算五—— 强酸与强碱混(1)
例题:在25℃时,100mlO.6mol/L的盐酸与 等体积0.4mol/L的氢氧化钠溶液混合后,溶液 的pH值等于多少?
解: NaOH+HCl=NaCl+H2O
0.04 0.06 pH=-lg[H+] =-lg0.02/(0.1+0.1) =-lg10—1 =1
(2008年全国Ⅱ卷)取浓度相同的NaOH和 HCl溶液,以3∶2体积比相混合,所得溶液 的pH等于12,则该原溶液的浓度为( C )
• • • • A.0.01mol· L-1 B.0.017mol· L-1 C.0.05mol· L-1 D.0.50mol· L-1
解析:由题意可得:(3×c--2×c)/5 = 0.01, c=0.05mol· L-1。
稀释后所得 溶液的PH
3.3 2.3 10.7 11.7
7
3.3 10.7
知识小结:混合溶液PH计算的有关规律
1、强酸或强碱溶液的等体积混合,当PH相 差两个或两个以上的单位时,
(碱)= PH大 - 0.3 2、强酸和强碱的等体积混合 若PH酸 + PH碱=14,则PH混= 7
若PH酸 + PH碱<14,则PH混= PH酸 +0.3
pH值计算—— 强酸与强酸混合
例题:在25℃时,pH值等于1的盐酸溶液1L 和pH值等于4的硫酸溶液1000L混合pH值等 于多少? 解: pH=-lg[H+] =-lg(1×10—1+1000×10-4)/(1+1000) =-lg2×10—4 =4-lg2 =3.7
关键:抓住氢离子进行计算!
pH值计算四—— 强碱与强碱混合
• (08年高考上海卷)常温下,某溶液中由水电离 出来的c(H+)=1.0×10-13mol· L-1,该溶液可能 是( A ) • ①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液 • A.①④ B.①② C.②③ D.③④ • 解析:某溶液中由水电离出来的c(H+)= 1.0×10-13mol· L-1,说明溶液既可能呈酸性, 也有可能呈碱性。①SO2+H2O≒H2SO3, H2SO3≒HSO3-+H+,HSO3-≒SO32-+H+, 溶液呈酸性;④NaOH===Na++OH-,溶液呈 碱性。
PH计算公式

关于PH值的计算一、应知应会:1.pH=-lg[H+],pOH=-lg[OH-],pH+pOH=142. pH值的适用范围是溶液的[H+]小于或等于1mol/L。
3.2.[H+]是电解质已电离出的H+离子的物质的量浓度。
4.3.4.不同体积不同pH值溶液混合,若二者为强酸,则求出混合溶液的[H+],求pH 值;若二者为强碱,则必须求出混合后溶液的[OH-]值再化为pH值。
若一强酸与一强碱,则求出H+离子或OH-离子后,求得[H+]化为pH值或求[OH-]再化为pH 值。
二、范例解析[例1]稀释下列溶液时,pH值怎样变化?(1)10mLpH=4的盐酸,稀释10倍到100mL时,pH=?(2)pH=6的稀盐酸稀释至1000倍,pH=?[分析](1)p=4,即[H+]=1×10-4mol/L,稀释10倍,即[H+]=1×10-5mol/L,所以pH=5.小结:强酸每稀释10倍,pH值增大1,强碱每稀释10倍,pH值减小1。
(2)当强酸、强碱溶液的H+离子浓度接近水电离出的H+离浓度(1×10-7 mol/L)时,水的H+离子浓度就不能忽略不计.所以pH=6的稀盐酸,稀释1000倍时:[H+]=(1×10-6+999×10-7)/1000=1。
009×10-7pH=6。
99由此可知溶液接近中性而不会是pH=9。
[例2]求强酸间混合或强碱间混合溶后液的pH值.(1)pH=12,pH=10的强酸溶液按等体积混合后溶液的pH值.(2)pH=5和pH=3的强酸溶液接等体积混合后溶液的pH值。
[分析](1)碱溶液的混合,溶液以OH-为主,所以应选确定[OH-][OH-]=(1×10-2+1×10-4)/2=5.05×10-3(mol/L)得:pOH=2.3,pH=14-2。
3=11。
7也可根据水的离子积常数,在先确定出溶液中[OH-]为5.05×10-3mol/L后,再求[H+]pH值。
酸碱ph计算公式

酸碱ph计算公式
酸碱ph计算是一种重要的化学计算,它可以帮助我们了解溶液的酸碱性。
酸碱ph计算公式是:ph= -log[H+],其中[H+]表示溶液中的氢离子浓度。
酸碱ph计算公式可以用来计算溶液的酸碱性,它可以帮助我们了解溶液的酸碱性。
酸碱ph计算公式的基本原理是:当溶液中的氢离子浓度越高,溶液的酸性就越强,反之,溶液的碱性就越强。
酸碱ph计算公式可以用来计算各种溶液的酸碱性,如水溶液、植物汁液、血液等。
它可以帮助我们了解溶液的酸碱性,从而更好地控制和管理溶液的酸碱性。
此外,酸碱ph计算公式还可以用来计算溶液的稳定性。
当溶液的酸碱性发生变化时,溶液的稳定性也会发生变化,因此,酸碱ph计算公式可以帮助我们更好地控制溶液的稳定性。
总之,酸碱ph计算公式是一种重要的化学计算,它可以帮助我们了解溶液的酸碱性,从而更好地控制和管理溶液的酸碱性和稳定性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
巩固练习
例、 0.1L pH=1 盐酸和 0.1L pH=14 的 NaOH 溶 液相混合,求混合后溶液的pH值。 pH=13.7
例、0.1L pH=14盐酸和0.1L pH=12的NaOH 溶液相混合,求混合后溶液的pH值。
pH=11.7
方法: 1.先反应 2.按过量的计算,若酸过量,求c(H+),再算pH值。 若碱过量,求c(OH-),求c(H+),再算pH值 结论:1. pH1+ pH2<14的强酸强碱等体积混合后, pH混= pH酸+0.3 2. pH1+ pH2=14的强酸强碱等体积混合后,pH混= 7 3. pH1+ pH2>14的强酸强碱等体积混合后, pH混= pH碱-0.3
pH
V水
pH值计算4——弱酸、弱碱的稀释
弱碱稀释 11 例:pH=12的NaOH溶液稀释10倍后pH=? > 11 pH=12的氨水稀释10倍后pH= ? 结论:稀释10倍pH变化(减小)<1.
稀释相同倍数时
pH: 氨水>NaOH
pH 12 11 NaOH 氨水
稀释到相同pH时
稀释的倍数:
V水
10倍
2
mol· L-1
B、
2
mol· L-1
C、(10-8+10-10)mol· L-1
D、2×10-10 mol· L-1
巩固练习
1、pH=13 的Ba(OH)2 溶液与pH=10的NaOH溶液 体积比按1∶3混合后的pH值______。 2、pH=13 的Ba(OH)2 溶液与pH=10的NaOH溶液 体积比按1∶1混合后的pH值______。 3、pH=13 的NaOH溶液与pH=12的NaOH溶液体积 比按1∶1混合后的pH值______。 两种pH值不同的强碱等体积混合时 △pH≥2 时, pH混=pH大- 0.3
例2、pH=3的盐酸 pH增大1, c(H+)差多少倍?盐酸浓度 差多少倍? c(H+)相差10倍;物质的量浓度强酸相差10倍 pH=3的醋酸 pH增大1, c(H+)差多少倍?醋酸浓度差多 少倍? c(H+)相差10倍;物质的量浓度弱酸相差>10倍 pH相差a, c(H+)相差10a
巩固练习
例3:下列溶液在常温下酸性最强的是( C ) A. pH=4的溶液 B. 1L 溶液里溶有22.4mL(STP)HCl的溶液 C. c(OH-)=10-12mol/L的溶液 D. c(H+)=10-3mol/L的溶液 例4:pH=0的溶液,下列叙述正确的是 ( B) A、是酸性最强的溶液 B、与0.5mol/L H2SO4溶液中c(H+)相同 C、 c(H+) =0的溶液 D、与1mol/L CH3COOH溶液中c(H+)同
巩固练习
1、某酸溶液的pH为2,某碱溶液的pH为12,两者等体 积相混合后,有关pH值的变化正确的是 D
A、大于7 能 B、小于7 C、等于 7 D、都有可
2、常温下一种pH为2 的酸溶液与一种pH为12 的碱溶 液等体积相混合,对溶液的酸碱性的说法正确的是 A、若是二元强酸和一元强碱,混合液为酸性 B、若是浓的强酸和稀的强碱,混合液中呈酸性 D C、若是浓的弱酸和稀的强碱,混合液呈碱性 D、若是强酸和强碱相混合,溶液反应后呈中性
pH值计算4——溶液的混合
1、强酸与强酸混合 (1)酸I+酸II C (H +)
n I ( H ) n II ( H ) = V I V II
例题:在25℃时,pH=1的盐酸溶液1L与pH=4的盐酸 溶液1000L混合,混合后溶液的pH值等于多少? pH=-lgc(H+) =-lg[(1×10—1+1000×10—4)/(1+1000)] =-lg[2×10—4 ] =4-lg2
NaOH+HCl=NaCl+H2O 0.04 0.06
pH=3
在25℃时,100ml 0.4mol/L的盐酸与等体积 0.6mol/L的NaOH溶液混合后,溶液的pH值等于多少?
NaOH+HCl=NaCl+H2O 0.06 0.04
pH=11
关键:酸过量抓住氢离子进行计算! 碱过量抓住氢氧跟离子进行计算!
pH值计算2—— 强酸的稀释
例:取1mL pH=3的硫酸溶液加水稀释到100mL,溶液的 pH变为多少? 解:
+) n (H c(H+) = V[H2SO4(aq)]
102
=
10-3 mol/L×10-3 L 10-1 L
=10-5 mol/L
pH = - lgc(H+) = - lg10-5 = 5
A.强酸稀释10n倍后pH=pH原+n<7,无论 稀释多少倍,溶液总是显酸性;
将pH=5的醋酸溶液稀释。
① 稀释10倍,求pH值(范围) pH值、V相同的不同酸, 稀释相同的倍数pH弱 <pH强 ② 要使醋酸的pH值由5 变到 6,加水稀释____10倍 (填< 、> 、=) >,因为稀释10倍,pH小于6,所以如pH=6,要大于 10倍
当相加、减的两个量相差100倍以上时,小得可忽略
巩固练习 pH=2的盐酸和 pH=4的盐酸溶液等体积混合后,所 得溶液的pH= 2.3 。 pH=2的盐酸和 pH=5的硫酸溶液等体积混合后,所 得溶液的pH= 2.3 。
pH=3的盐酸和pH=4的硫酸溶液体积比按1∶1混合 后溶液的pH= 3.3 。
pH值计算4——溶液的混合
3、pH值计算5——强酸、强碱的混合 +)V - c(OH-)V c (H 1 2 (1)酸过量:则c(H+)= V1+V2
-)V - c(H+)V c (OH 2 1 (2)碱过量:则c(OH-)= V1+V2
c(H+)= Kw/ c(OH-)
例1:在25℃时,100ml 0.6mol/L的盐酸与等体积 0.4mol/L的NaOH溶液混合后,溶液的pH值等于多少?
pH = 6
[H+]. [OH-]水=10-14 [H+]=[H+]水+10-8 [H+]水=[OH-]水 ([H+]水+10-8). [OH-]水=10-14 ([H+]水+10-8). [H+]水=10-14 [H+]=[H+]水+10-8 =1.4×10-7 pH≈7 关键: 1、抓住氢离子进行计算! 2、当酸提供的[H+]很小时,不能忽略水电离出的[H+]
c(H+) = c(OH-) = 0.05moL/L
பைடு நூலகம்考链接
(2004年全国) 若1体积硫酸恰好与10体积pH=11的 氢氧化钠溶液完全反应,则二者物质的量浓度之 比应为 ( B ) A.10:1 C.1:1 B.5:1 D.1:10
高考链接
(08全国Ⅱ卷)实验室现有3种酸碱指示剂,其pH的变 色范围如下:甲基橙:3.1~4.4 石蕊:50~8.0 酚酞:8.2~10.0 用0.1000 mol/L NaOH溶液滴定未 知浓度的CH3COOH溶液,反应恰好完全时,下列叙述 正确的是( D ) 提示: CH COONa显碱性
pH值计算4——溶液的混合
4、弱酸强碱或强酸弱碱混合
例: (1)pH为12的NaOH溶液和pH为2的醋酸溶液等体积 酸 性 相混合,则混合液呈_____ (2)pH为12的氨水和pH为2 的盐酸等体积相混合, 碱 性 则混合液呈 ____ (3)pH为2的盐酸和pH为12 的某碱等体积相混合, ≥7 则混合液pH_______ (4)pH为12的NaOH溶液和pH为2的某酸溶液等体积 ≤7 相混合,则混合液pH _____ (5)pH为12的氨水和pH=2的醋酸溶液等体积混合, 比较α大小 则混合液的pH_____ 。
巩固练习
例、 0.1L pH=2 盐酸和 0.1L pH=11 的 NaOH 溶液相混合,求混合后溶液的pH值。 pH=2.3
例、0.1L pH=1盐酸和0.1L pH=11的NaOH 溶液相混合,求混合后溶液的pH值。 pH=1.3
例、pH=2盐酸和pH=12的Ba(OH)2溶液等体 积相混合,求混合后溶液的pH值。 pH=7
巩固练习
取80 mL NaOH溶液加入到120 mL盐酸中,所得溶液的
pH为2。如果混合前NaOH溶液和盐酸的物质的量浓度相
同,则它们的浓度是多少?
+)V - c(OH-)V c (H 1 2 解:(1)酸过量:则c(H+)= V1+V2 +) – 0.08c(OH-) 0.12 c (H 10-2 = 0.12+0.08
B、弱酸稀释10n倍后溶液pH < pH原+n,变 化比强酸小。
pH值计算3——强碱的稀释
A.强碱稀释 10n倍后 pH=pH > 7,无论 例:取 pH=11的NaOH 溶液与水按 1:99 的体积比混合后 , 原+n 2 原来的 10 稀释多少倍,溶液总是显碱性; 溶液的pH变为多少?
解: 稀释前c(OH-) = 10-3 mol/L
-3mol/L 10 = =10-5 mol/L 1+99 Kw + -9 mol/L c(H )= =1 × 10 c(OH-)
稀释后c(OH-)
稀释后溶液的pH = 9 若上述溶液加水稀释到体积为原来的1000倍, 11 则溶液的pH变为多少? pH = 8 若稀释到体积为原来的105倍,则溶液的pH 7 变为多少? pH = 6 pH 接近于7
两种pH值不同的强酸等体积混合时 △pH≥2时, pH混=pH小+0.3
pH值计算4——溶液的混合
2、强碱与强碱混合 (2)碱I+碱II C(OH-)
