理想气体任意准静态过程的热容量
热力学统计物理 课后习题 答案

第一章 热力学的基本规律1.1 试求理想气体的体胀系数α,压强系数β和等温压缩系数κT 。
解:已知理想气体的物态方程为nRT pV =由此得到 体胀系数TpV nR T V V p 11==⎪⎭⎫ ⎝⎛∂∂=α, 压强系数T pV nR T P P V 11==⎪⎭⎫ ⎝⎛∂∂=β 等温压缩系数p p nRT V p V V T 1)(112=-⎪⎭⎫ ⎝⎛=⎪⎪⎭⎫ ⎝⎛∂∂-=κ 1.2证明任何一种具有两个独立参量T ,P 的物质,其物态方程可由实验测量的体胀系数和等温压缩系数,根据下述积分求得()⎰-=dp dT V T καln ,如果P T T 1,1==κα,试求物态方程。
解: 体胀系数 pT V V ⎪⎭⎫ ⎝⎛∂∂=1α 等温压缩系数 TT p V V ⎪⎪⎭⎫ ⎝⎛∂∂-=1κ 以T ,P 为自变量,物质的物态方程为 ()p T V V ,=其全微分为 dp V dT V dp p V dT T V dV T Tp κα-=⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂= dp dT VdV T κα-= 这是以T ,P 为自变量的完整微分,沿一任意的积分路线积分,得()⎰-=dp dT V T καln 根据题设 , 若 pT T 1,1==κα ⎰⎪⎪⎭⎫ ⎝⎛-=dp p dT T V 11ln 则有 C pT V +=ln ln , PV=CT 要确定常数C ,需要进一步的实验数据。
1.4描述金属丝的几何参量是长度L ,力学参量是张力£,物态方程是(£,L,T)=0,实验通常在大气压下进行,其体积变化可以忽略。
线胀系数定义为FT L L ⎪⎭⎫ ⎝⎛∂∂=1α ,等温杨氏模量定义为TL F A L Y ⎪⎭⎫ ⎝⎛∂∂= ,其中A 是金属丝的截面。
一般来说,α和Y 是T 的函数,对£仅有微弱的依赖关系。
如果温度变化范围不大,可以看作常数。
假设金属丝两端固定。
热力学第一定律

§3.4 热容量,热力学第一定律对理想气体的应用
一.等容摩尔热容量
摩尔热容量:一摩尔物质(温度T时)升高1度所吸收的热量,即
Cm
1
dQ dT
单位:J/mol•K
一般C与温度有关,也与过程有关,可以测量。
原平衡态
非平衡态
新平衡态
热力学中研究过程时,为了在理论上能利用系 统处于平衡态时的性质,引入准静态过程的概念.
二.准静态过程: 1.在过程中的任意时刻,系统都无限的接近平衡 状态,准静态过程是由无数个平衡态组成的过程.
2.准静态过程是实际过程的理想化模型. (无限缓慢)有理论意义,也有实际意义. 3
对于理想气体的等容过程,
dQ dE i RdT
2
1 dQ i
CV .m
dT
R 2
dA 0
C v.m i R 2
T2
E E2 - E1 CV.m dT
T1
E
C V.m
T
14
注意:对于理想气体,公式 E = Cv T 不仅适用于等容过程,而且适用于任何过程。
如图,作一个辅助过(等容+等温) 连接始末两点 E辅 EV + ET
系统 ( T1 )直接与 热源 ( T2 )有限温差
T2 热传导为非准静态过程
系统 T1
T1+△T T1+2△T T1+3△T T2
保持系统与外界无穷小温差, 每一无穷小传热过程为等温过程, 过程“无限缓慢”即可看成准静态传热过程.
10
三.热力学第一定律
对于任一过程
大学物理热力学基础.

11.01310522.4103
22.7102(J)
Qacb Acb
V(l)
7-3 气体的摩尔热容量
一、热容与摩尔热容的定义: 热容量:系统在某一无限小过程中吸收热量dQ与温
度变化dT的比值称为系统在该过程的热容量(C)
dQ
C dT
表示升高1K所吸收的热量
J K1
单位质量的热容量叫比热容。 CMC比 JK1kg1
摩尔热容量:1 mol 物质的热容量(Cm)
M C Mmol Cm
1mol 物质温度升高1K时所吸收的热量。
JK1mo1
二、理想气体的摩尔热容量
1、理想气体的定容摩尔热容:
dQ CV ( dT )V
( dE dT
)V
理想气体 dE i RdT
2 3
单原子理想气体 CV 2 R
双原子理想气体
1、理想气体的绝热准静态过程的过程方程
dA PdV dE M M moC lVdT (1)
理想气体状态方程
PV M RT Mmol
对其微分得:
M
PdVVdP RdT Mmol
(2)
联立(1)(2)得:
dP dV0 PV
PV con. s(3t)
(泊松公式)
将 PV cons.与t PV M RT联立得:
准静态过程是一种理想的极限。
三、准静态过程的功和热量
1、体积功的计算
dl
➢当活塞移动微小位移dl 时, 系统对外界所作的元功为:
p F S
➢系统体积由V1变为V2,系统对外界作总功为:
A dA V2pdV V1
dV0, 系统对外作正功;
dV0, 系统对外作负功;
例:有1mol理想气体 (1)a b等温,
热力学与统计物理课后习题答案第一章

1.1 试求理想气体的体胀系数α,压强系数β和等温压缩系数κT 。
解:已知理想气体的物态方程为,pV nRT = (1)由此易得11,p V nR V T pV Tα∂⎛⎫=== ⎪∂⎝⎭ (2) 11,V p nR p T pV Tβ∂⎛⎫=== ⎪∂⎝⎭ (3) 2111.T T V nRT V p V p pκ⎛⎫⎛⎫∂⎛⎫=-=--= ⎪ ⎪ ⎪∂⎝⎭⎝⎭⎝⎭ (4)1.2 证明任何一种具有两个独立参量,T p 的物质,其物态方程可由实验测得的体胀系数α及等温压缩系数κT ,根据下述积分求得:()ln T V =αdT κdp -⎰如果11,T T pακ==,试求物态方程。
解:以,T p 为自变量,物质的物态方程为(),,V V T p =其全微分为.p TV V dV dT dp T p ⎛⎫∂∂⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭ (1) 全式除以V ,有11.p TdV V V dT dp V V T V p ⎛⎫∂∂⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭根据体胀系数α和等温压缩系数T κ的定义,可将上式改写为.T dVdT dp Vακ=- (2) 上式是以,T p 为自变量的完整微分,沿一任意的积分路线积分,有()ln .T V dT dp ακ=-⎰ (3)若11,T T pακ==,式(3)可表为11ln .V dT dp Tp ⎛⎫=- ⎪⎝⎭⎰ (4)选择图示的积分路线,从00(,)T p 积分到()0,T p ,再积分到(,T p ),相应地体积由0V 最终变到V ,有000ln=ln ln ,V T pV T p - 即000p V pV C T T ==(常量), 或.pV CT = (5)式(5)就是由所给11,T T pακ==求得的物态方程。
确定常量C 需要进一步的实验数据。
1.3 在0C 和1n p 下,测得一铜块的体胀系数和等温压缩系数分别为51714.8510K 7.810.n p ακ----=⨯=⨯T 和T ακ和可近似看作常量,今使铜块加热至10C 。
第17章 热力学第一定律

举例2:系统(初始温度 T1)从 外界吸热
从 T1 系统T1 T2 是准静态过程
系统 温度 T1 直接与 热源 T2接触,最终达到热平衡, 不是 准静态过程。
等温过程
P
T1+△T T1+2△T T1+3△T T2
等容过程
等压过程
因为状态图中任何一点都表示
系统的一个平衡态,故准静态 过程可以用系统的状态图,如 P-V图(或P-T图,V-T图)中 一例3 容器内贮有刚性多原子分子理想气体,经准静态绝热 膨胀过程后,压强减小为初压强的一半,求始末状态气体 内能之比E1:E2=? 解:设初末状态
( P1 , T1 ) ( P2 , T2 ) P1 T1 P2 P 1
1
P2
解:由泊松公式得
pV
pV
1
1
,p
p V /V
1 1
求得功为
V A 2 pdV V1 1 pV 1 1 1
V
V 2 dV p1V 1 V 1 V
1 2
V 1
1
V1 p V 1 1 1 1 V 2
Q
循环效率为
2
CV ,m T 4 T 1
2
Q 1 Q
1
T T 1 T T
4 3
1 2
a b是绝热过程, 1 V 1 T2 T1 V 2
同理
所以
V 1 T T V 2 T T T T T T T T
循环过程
V
§ 17.2 功、热、热力学第一定律
10-1 准静态过程 功 内能和热量

总热量:
Q Q
10-1 准静态过程 功 内能和热量
10.2
热力学第一定律
第10章 热力学定律
10.2.1 热力学第一定律 某一过程,系统从外界吸热 Q,对外 界做功 A,系统内能从初始态 E1变为 E2,则由能量守恒:
A ΔE Q
内能是状态量, A、 Q是过程量
对微元过程:
Q dE A
热一律的另一种表述: 第一类永动机制不成 对准静态过程: Q E2 E1
V2
V1
pdV
10.2.2 热容
C
Q
dT
单位:J/mol· K
• 摩尔热容量 C ,
• 比热容 c , 单位:J/kg· K
Q 为过程量
C为过程量
经常用到1摩尔物质在等体过程以及在等压过程中的热 容量,称为摩尔定体热容和摩尔定压热容,分别定义 为:
CV ,m
i R 2
C P ,m
i2 R 2
2i i
i=3
单原子气体:
双原子气体: 多原子气体:
1.67
i=5
i=6
1.40
1.33
用 C
V ,m
CP,mγ值和实验比较,常温下符合很好
t 200 C
CV ,m R 2
P 1.01105 pa
CP ,m R 2
P
A
(PB,VB,TB)
V2
V1
pdV
O
VA
dV
VB
V
说明 δA>0:系统对外做功 系统所作的功在数值上 等于P-V 图上过程曲线 以下的面积。
作功与过程有关 。
p 下,气体准静态地由体积 V1 例 计算在等压 的过程系统对外界所做的功。
热学(李椿+章立源+钱尚武)习题解答-第五章---热力学第一定律

$第五章热力学第一定律5-1.0.020Kg的氦气温度由升为,若在升温过程中:(1)体积保持不变;(2)压强保持不变;(3)不与外界交换热量,试分别求出气体内能的改变,吸收的热量,外界对气体所作的功,设氦气可看作理想气体,且,解:理想气体内能是温度的单值函数,一过程中气体温度的改变相同,所以内能的改变也相同,为:热量和功因过程而异,分别求之如下:(1)等容过程:V=常量 A=0由热力学第一定律,((2)等压过程:由热力学第一定律,负号表示气体对外作功,(3)绝热过程Q=0由热力学第一定律—5-2.分别通过下列过程把标准状态下的0.014Kg氮气压缩为原体积的一半;(1)等温过程;(2)绝热过程;(3)等压过程,试分别求出在这些过程中气体内能的改变,传递的热量和外界对气体所作的功,设氮气可看作理想气体,且,解:把上述三过程分别表示在P-V图上,(1)等温过程理想气体内能是温度的单值函数,过程中温度不变,故由热一、%负号表示系统向外界放热(2)绝热过程由或得由热力学第一定律另外,也可以由·及先求得A(3)等压过程,有或而所以===>由热力学第一定律,也可以由求之另外,由计算结果可见,等压压缩过程,外界作功,系统放热,内能减少,数量关系为,系统放的热等于其内能的减少和外界作的功。
{5-3 在标准状态下的0.016Kg的氧气,分别经过下列过程从外界吸收了80cal的热量。
(1)若为等温过程,求终态体积。
(2)若为等容过程,求终态压强。
(3)若为等压过程,求气体内能的变化。
设氧气可看作理想气体,且解:(1)等温过程则故(2)等容过程《-(3)等压过程5-4 为确定多方过程方程中的指数n,通常取为纵坐标,为横坐标作图。
试讨论在这种图中多方过程曲线的形状,并说明如何确定n。
解:将两边取对数,或比较知在本题图中多方过程曲线的形状为一直线,如图所示。
直线的斜率为可由直线的斜率求n。
或即n可由两截距之比求出。
热统习题解答(全)

热统习题解答(全)第⼀章热⼒学的基本规律1.1 试求理想⽓体的体胀系数α,压强系数β和等温压缩系数κ。
解:理想⽓体的物态⽅程为RT pV =,由此可算得: PP V V k T T P P T T V V T V P 1)(1;1)(1,1)(1=??-==??==??=βα1.2 证明任何⼀种具有两个独⽴参量T ,P 的物质,其物态⽅程可由实验测得的体胀系数α及等温压缩系数κ,根据下述积分求得: ?-=)(ln kdP adT V ,如果Pk T a 1,1==,试求物态⽅程。
证明:dp p VdT T V p T dV T P )()(),(??+??= 两边除以V,得dp dT dp p VV dT T V V V dV T P κα-=??+??=)(1)(1积分后得 ?-=)(ln kdP adT V 如果,1,1p T ==κα代⼊上式,得C P T PdP T dT V ln ln ln )(ln +-=-=?所以物态⽅程为:CT PV =与1mol 理想⽓体得物态⽅程PV=RT 相⽐较,可知所要求的物态⽅程即为理想⽓体物态⽅程。
1.3在00C 和1atm 下,测得⼀块铜的体胀系数和压缩系数为a=4.185×10-5K -1,k=7.8×10-7atm -1。
a 和k 可以近似看作常数。
今使铜加热⾄100C ,问(1)压⼒要增加多少⼤⽓压才能使铜块的体积维持不变?(2)若压⼒增加100atm ,铜块的体积改变多少?解:(a )由上题dp dT dp p VV dT T V V V dV T P κα-=??+??=)(1)(1体积不变,即0=dV所以dT kadP = 即atm T k a P 62210108.71085.475==?=?-- (b)475121211211007.4100108.7101085.4)()(---?=??-??=---=-=?p p T T V V V V V κα可见,体积增加万分之4.07。
范德瓦尔斯气体在任意准静态过程中热容量的研究

() 显然该 过程热 容量不 为常量 ,故 不是 多方过 程 ,如 1 . 2
果该气 体为理想 气 体,则有 a=b=0,此 时
( .) 1 3
c +p R = + 尺 ,
p—i +
+ 一D ( J
由范 德瓦 尔斯气 体状 态方程 得 :
收 稿 日期 :2 l— 0 — 2 00 7 2
点 ,则过 P点 的 曲线 斜率可 表示 为
k= = 厂 . (
’
R
+ —D 八 J J
7 )
可见,只需知道 P点斜率就可得到该点附近任意微
元过 程摩尔 热容量 C的大 小 , 例如 l l mo 范德 瓦尔 斯 气 体 经 历 一 直 线 型 准 静 态 过 程 ,其 过 程 方 程 为 P=七 , 则有 V=七,将 结果 代 入 ( .)式 + d 1 7
作 者简 介: 付清荣 ( 98 ) ,副教授 ,研 究方向 :热力学、热力学统计 . 16一 ,女
第4 期
付清荣等:范德 瓦尔斯气体在任意准静态过程 中热容量的研 究
2 5
可 知 ,对 理 想气 体 该过 程热 容 量亦 不为 常量 , 也不 是 多方 过程 .
另 外 , 利 热 力 学 第 一 定 律 的 微 分 形 式
在任 意 过程 中 ,范德瓦 尔斯气 体都满 足热 力学 第 ~ 定律 ,即 d Q d U+P V d (.) 11 范德 瓦尔斯 气 体 的内能微分 表达 式为 :
得 该过程 热容量 为 :
p + a R
’
d=v+ UCT吾 d
由 ( .) 1 )式得 : 1 、( . 1 2 C T=C d d v T+( ) P+
大学物理习题解答第三章热力学

第三章热力学本章提要1.准静态过程系统连续经过得每个中间态都无限接近平衡态得一种理想过程。
准静态过程可以用状态图上得曲线表示。
2.内能系统内所有分子热运动动能与分子之间相互作用势能得与,其数学关系式为内能就是态函数。
3.功功就是过程量。
微分形式:积分形式:4.热量两个物体之间或物体内各部分之间由于温度不同而交换得热运动能量。
热量也就是过程量。
5.热力学第一定律热力学第一定律得数学表达式:热力学第一定律得微分表达式:由热力学第一定律可知,第一类永动机就是不可能造成得。
6.理想气体得热功转换(1)等体过程:热量增量为或(2)等压过程:热量增量为因则(3)等温过程:热量增量为因则(4)绝热过程:根据热力学第一定路可得则或在绝热过程中理想气体得p、V、T三个状态参量之间满足如下关系:7.热容量等体摩尔热容量:等压摩尔热容量:对于理想气体,若分子自由度为i,则迈耶公式:比热容比:8.焓在等压过程中,由热力学第一定律可得由于,上式可写为如果令焓就是一个态函数。
9.循环过程正循环得热机效率逆循环得致冷系数10.卡诺循环由两个等温过程与两个绝热过程构成得循环。
正循环得效率逆循环得效率11.热力学第二定律开尔文表述:不可能制成一种循环动作得热机,只从单一热源吸收热量,使之全部转变为有用得功,而其她物体不发生任何变化。
克劳修斯表述:热量不可能自动地从低温物体传向高温物体,而不引起其她得变化。
统计意义:一个不受外界影响得孤立系统,其内部所发生得过程总就是由热力学概率小得宏观状态向热力学概率大得宏观状态进行,即从有序向无序得状态发展。
12.克劳修斯熵克劳修斯熵表达式熵增加原理:在孤立系统内,当热力学系统从一个平衡态到达另一个平衡态时,它得熵永远不减少。
如果过程不可逆,系统得熵增加;如果过程可逆,系统得熵不变。
13.玻耳兹曼熵玻耳兹曼熵表达式熵得微观本质:熵得多少就是系统微观状态数目多寡得标志。
思考题3-1 (1)热平衡态与热平衡有何不同?(2)热平衡与力学中得平衡有何不同?答:(1)一个孤立系统得各种宏观性质(如温度、压强、密度等)在长时间内不发生任何变化,这样得状态称为热平衡态。
大学物理第三章 热力学第一定律

§ 2.1 准静态过程 § 2.2 功、热、内能 § 2.3 热力学第一定律 § 2.4 热容量 § 2.5 理想气体的绝热过程 § 2.6 循环过程 § 2.7 卡诺循环 § 2.8 致冷循环
本章讨论热力学系统的状态发生 变化时在能量上所遵循的规律- ---热力学第一定律
§2.1 准静态过程
i i 解: E1 RT1 P 1V1 2 2
i i E2 RT2 P2V2 2 2
V1 1 V2 2
1
E1 P 1 V1 E2 P2 V2
2 7
P 1 2 P2
对双原子分子 7/5
E1 2 1.22 E2
例 2: 温度为 25C、压强为 1 atm 的
m QV E CV ,m (T2 T1 ) M
等容过程:
二、 定压摩尔热容
C p ,m dQ dT p
理想气体等压过程:
dQ dE PdV
i dV dE pdV dE dQ RR p 2 dT dT dT dT P
功、热 都能改变 系统状态
dQ<0表示系统向外界放热
总热量:
Q 1 dQ
2
积分与过程有关 。
三、系统的内能E
对理想气体、处于温度为T的平衡态:
i E RT 2
i i E RT pV 2 2
系统的内能是状态量,如同
P、V、T等量
小结
1)改变系统状态的方式有两种
作功 传热
2)作功、传热是相同性质的物理量均是 过程量 系统的内能是状态量
C p ,m Cv,m
Cv,m R Cv,m
i2 R 2
理想气体任意准静态过程的温度变化规律
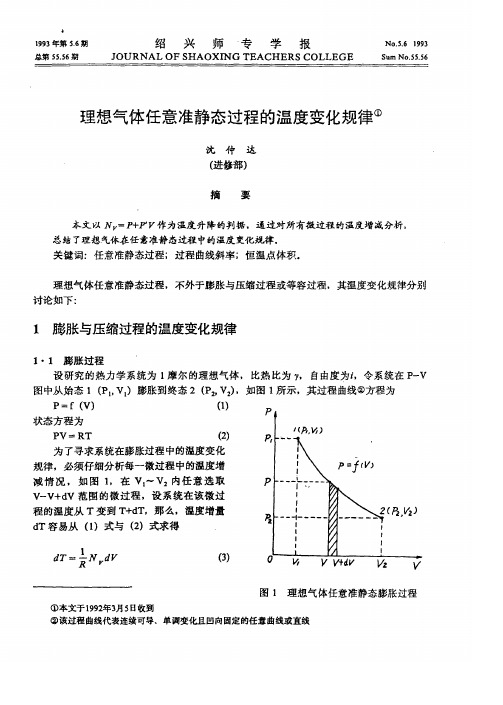
,
总 结 了理 想 气 体在任 意 准静 态 过程 中 的温 度 变 化 规律
关 键 词 : 任 意准静 态过 程 ; 过 程 曲线斜率 ; 恒 温点 体积
,
理 想气 体 任意 准静 态过 程 讨论 如 下 1
:
不外 于 膨胀 与压缩 过 程 或等 容 过程
,
其 温度变 化 规律 分别
膨胀 与 压 缩 过程的 温 度变化规律
第
期
沈仲 边 理想气体任意 准 静态过程 的温度变化规律
一
一
(4 )
其中
,
=
p +
p
,
y
,
从 以 上两 式可 以看 出
1 1 1
. .
系统在 微过 程 中是 升温 还 是 降温
,
,
N
v
值起 着关 键 性 的 作 用
,
,
而过
v 程 曲线 的斜率 又影 响着 N 值 变化
因此 则
,
,
各微 过程 中的温 度升 降
dT
容 易 从 ( l ) 式 与 ( 2 ) 式 求得
.
_
1
_
_
` 1 ”
万刀
;
d 厂
(3 )
仪 )
一目 一
.
“
2 (几 岭 )
口
“
认 沁介
八
节
图
①本文于
19 9 2
1
理 想气 体 任意 准静态 膨胀过 程
年 3 月 5 日 收到
、
② 该过程 曲线代表连续可导
单 调变 化且 凹 向 固定 的任 意曲线或直线
1
1
膨胀 过 程 设 研 究 的热 力 学 系统 为
理想气体准静态过程方程与过程曲线

(
T
n 丙)
二
一
`
=
常数
。
v
即犷
二
_
.
T
=
常数
。 卜 _ 了厂 * 。 山 , 、 二 、 、 二 犷 不 笼 夕 人 田 怨气 件 认芯 刀 汪
,
_
二
王
P犷
了
F IT
=
t l
=
,
J
=
万
、
则得
`
二
一
,
.
些华 缪 式 式
梦 梦
,
常数
夕
因为 ,
,
R 为常 数
,
即尸 尸
·
二
常数
·
·
·
……
( 。 )
( 9 ) 式 即 为 多 方 过 程 方程
则有
一
,
c
,
为 定 容摩 尔热 容 量
。
由 ( 3 ) 式得 到
( 4 )
1
-
R
d厂
厂
C
一
C
v
c
,
与 温度 T 有关
式 得到
p T d P 一 T d 一
一 一
dV
一
犷
把 (
6 )
代入 (
d T
5 )
n 一
式得
) 1
十
一
,
n 故 一 般 不 是常 数 而 是 温 度 T 的 函 数
。
此时
,
) 内(2
滩坊 教 育李院 学报 ( 自 然科 学版
一 九 八 八 年 第一 期 ( 总 第
期
理 想 气体 准 静 态 过 程 方 程 与过程曲 线
热力学中的热容量计算

热力学中的热容量计算热容量(heat capacity)是描述物质对于吸收或释放热量的能力的物理量。
在热力学中,热容量是用来衡量物质在温度变化下吸收或释放的热量的大小。
本文将重点介绍如何计算热容量,并探讨热容量在热力学中的重要性。
热容量可分为定压热容量和定容热容量两种。
定压热容量是指一个物质在恒定压力下吸收或释放热量的能力。
定容热容量是指一个物质在恒定体积下吸收或释放热量的能力。
这两种热容量计算方法略有不同,请继续阅读下文以了解更多详情。
首先,我们来计算定压热容量。
定压热容量的计算使用的是物质的摩尔热容量(molar heat capacity)。
摩尔热容量是单位摩尔物质吸收或释放的热量。
单位通常是焦耳/摩尔•开尔文(J/mol•K)或卡路里/摩尔•开尔文(cal/mol•K)。
计算定压热容量的方法之一是通过实验测定。
在实验室中,可以用恒压热量计(bomb calorimeter)等设备测定物质在恒定压力下吸收或释放的热量。
根据实验测得的数据,可以计算出定压热容量。
另一种计算定压热容量的方法是利用热力学理论和已知的物质性质数据。
例如,对于理想气体,可以使用理想气体状态方程PV=nRT(P 为压强,V为体积,n为物质的摩尔数,R为气体常数,T为温度)来计算定压热容量。
根据理想气体状态方程可以得出摩尔热容量与气体的自由度(degrees of freedom)和摩尔数的关系。
对于一些复杂的物质,比如固体和液体,可以使用热力学性质数据库中已有的数据来计算摩尔热容量。
这些数据通常来自实验测定和理论推导。
根据已知的摩尔热容量数据,可以通过插值和外推的方法计算出特定温度和压力下的定压热容量。
接下来,我们来计算定容热容量。
对于定容热容量的计算,需要使用比热容(specific heat capacity)。
比热容是单位质量物质吸收或释放的热量。
单位通常是焦耳/克•开尔文(J/g•K)或卡路里/克•开尔文(cal/g•K)。
热力学

d Q (可逆) > ∫ T _____ T1
T2
d Q ( 不可逆 ) ∫ T T1
固体: 可逆) 固体:∆Ε(可逆) = 固体: (可逆) 固体: ∆S(可逆) = 填上>,=,< >,=,<号 (填上>,=,<号)
∆E(不可逆), (不可逆), ∆ S(不可逆). (不可逆).
19
20
16. PV γ = 常量的方程(式中γ 为比热容比)是否可 常量的方程( 为比热容比) 用于理想气体自由膨胀的过程?为什么? 用于理想气体自由膨胀的过程?为什么? 答:pVγ = 常量 的方程不适用于理想气体自由膨 胀的过程. 胀的过程. 这是因为:该方程只适用于准静态绝热过程, 这是因为:该方程只适用于准静态绝热过程, 准静态绝热过程 而理想气体的自由膨胀过程虽然是绝热的, 而理想气体的自由膨胀过程虽然是绝热的,但并非 准静态的. 准静态的.
1 dQ i CV = ( )V = R 2 ν dT
Q=0
CP =
1 dQ i ( )P = R + R 2 ν dT
3
CP i + 2 γ = = CV i
3.热力学过程 热力学过程 (1) 理想气体的等值过程,绝热过程 理想气体的等值过程, 准静态绝热过程
pV γ = C1
TV γ −1 = C 2
5
5. 熵 (1)玻尔兹曼熵 玻尔兹曼熵 (2)克劳修斯熵 克劳修斯熵
S = k ln Ω
SB − S A = ∫ dS = ∫
A B
dQ可逆 A T
B
微小的可逆过程有
dQ可逆 dS = T
(3) 熵增加原理 对孤立系 ∆S≥0 ≥ ∆S>0:对孤立系的各种自然过程; > :对孤立系的各种自然过程; ∆S=0: 对孤立系的可逆过程。 : 对孤立系的可逆过程。 这是一条统计规律。 这是一条统计规律。
雷德利克-邝气体在任意准静态过程中的摩尔热容

雷德利克-邝气体在任意准静态过程中的摩尔热容罗兴垅;张琦【摘要】利用热容量与状态参量的热力学关系式,导出了雷德利克-邝气体摩尔定体热容、定压热客;运用热力学第一定律和内能与状态参量的热力学关系式,导出了雷德利克-邝气体在任意准静态过程中的摩尔热客.【期刊名称】《赣南师范学院学报》【年(卷),期】2009(030)003【总页数】3页(P112-114)【关键词】雷德利克-邝气体;准静态过程;摩尔热容【作者】罗兴垅;张琦【作者单位】赣南师范学院,物理与电子信息学院,江西,赣州,341000;赣南师范学院,物理与电子信息学院,江西,赣州,341000【正文语种】中文【中图分类】O414.12热学教材[1-2]介绍非理想气体的物态方程时,通常都以范德瓦尔斯方程为例.其实,在现有的许多包含两个常量的气体物态方程中,精确度最高的是雷德利克-邝方程,它是1949年被提出来的.文献[3]讨论了气体的压强以及气体的临界参量与雷德利克-邝常量的关系,本文进一步探讨雷德利克-邝气体在任意准静态过程中的摩尔热容.1 雷德利克-邝气体摩尔定体热容1 mol雷德利克-邝气体的状态方程[3]的具体形式为(1)式中p、T、V分别为气体的压强、热力学温度、摩尔体积,a和b都是依赖于气体性质的雷德利克-邝常量,R是普适气体常量.摩尔定体热容与状态参量的关系式[4]为(2)根据式(2)与雷德利克-邝气体的状态方程可以导出摩尔定体热容CV,m. 由式(1)有(3)式(3)代入式(2)并分离变量,有积分得(4)式中为积分常量且为理想气体的摩尔定体热容; 当V≫b时,,于是式(4)中的第二项为零,雷德利克-邝气体回到理想气体.2 雷德利克-邝气体摩尔定压热容根据摩尔定压热容与状态参量的关系式[4](5)由雷德利克-邝气体的状态方程式(1)得于是,有(6)而(7)式(3)、(7)代入式(5)得即(8)式中为理想气体的摩尔定体热容量;当a=0,b=0时,则,雷德利克-邝气体回到理想气体.3 雷德利克-邝气体在任意准静态过程中的摩尔热容为了简便起见,我们讨论1 mol雷德利克-邝气体在任意准静态过程中的摩尔热容.在任意准静态过程中, 雷德利克-邝气体满足热力学第一定律dQ=dU+pdV摩尔热容的定义式为dQ=Ci,mdT联立上述两式解得摩尔热容的一般计算公式(9)令U为雷德利克-邝气体的摩尔内能,它不仅是温度的函数,也是体积的函数.即,U=U(T,V).对内能微分,得(10)式中为摩尔定体热容.由热力学第二定律可以导出关系式[4](11)式(3)、式(4)以及式(11)代入式(10),得·(12)设1 mol雷德利克-邝气体在任意准静态过程的方程形式为p=p(V)(13)式(12)、(13)代入式(9),有(14)将气体过程方程代入雷德利克-邝状态方程并微分,可得式中/dV.上式代入式(14),得(15)式(15)是雷德利克-邝气体在任意准静态过程中摩尔热容的计算公式. 当a=b=0及V≫b时,式(15)为··R(16)上式为理想气体在任意准静态过程中摩尔热容的计算公式[5],雷德利克-邝气体回到理想气体.综上所述,本文运用热力学第一定律以及热容量、内能分别与气体状态参量的热力学关系式,导出了雷德利克-邝气体摩尔定体热容、定压热容和任意准静态过程中的摩尔热容量. 只要令本文中的雷德利克-邝常量a=0,b=0及V≫b,就可以得到理想气体在准静态过程中的有关结论.参考文献:【相关文献】[1] 秦允豪.热学[M].北京:高等教育出版社,2004:180-199.[2] 李洪芳.热学[M].北京:高等教育出版社,2001:87-102.[3] 高崇伊,朱琴.雷德利克-邝方程[J].大学物理,2006,25(5):26-27.[4] 汪志诚.热力学·统计物理[M] .北京:高等教育出版社,2003:71-106.[5] 罗兴垅,罗颖.关于理想气体任意准静态过程热容量的研究[J].赣南师范学院学报,2003(6):14-17.。
课件:4理想气体摩尔热容量和绝热过程

解:初状态p1=1atm=1.01x105pa,T1=273k, V1=11.2x10-3m3,V2=5.6x10-3m3。
1)绝热过程:A E CV T
TV 1 C T1V1 1 T2V2 1
T2 T1 A
(V1 ) 1 20.4 V2
CV T 0.5
5
2
T2 20.4 273 360K 8.31 87 903.7J
气体 真空
3、绝热过程的方程
dQ 0
pdV CV dT
pV RT pdV Vdp RdT
dT P dV
dT pdVCVVdp
R
联立消去dT ( CV R ) pdV CVVdp
CP CV R dP dV 0
CV
CV
P
V
积分:
dP P
dV V
恒量
ln P lnV c'
A pdV RT1 l nV2 V1 0.5 8.31 273 l n0.5
786J
外界所作的功 A’=-A=786J
例2:某理想气体的p-V关系如图所示,
由初态a经准静态过程直线ab变到
pb
终态b。已知该理想气体的定体摩
a
尔热容量CV=3R,求该理想气体在
ab过程中的摩尔热容量。
o
V
解:ab过程方程为 P kV 其中k=tan
2、理想气体的定压摩尔热容量
1mol理想气体在等压过程中温度每升高1K所吸收
的热量
Cp
( dQm dT
)p
dE dT
p
dV dT
dE CV dT pdV RdT
i2 C p CV R 2 R
迈耶公式
单原子理想气体
化学热容计算

化学热容计算热容是指物质在吸热或放热过程中所需要或释放的热量与温度变化之间的关系。
它是描述物质热力学性质的重要参数,广泛应用于化学、物理等领域中的热力学研究和实验。
化学热容的计算方法主要有两种:定容热容和定压热容。
定容热容是指物质在恒容条件下(体积不变)吸热或放热的能力;定压热容是指物质在恒压条件下(压强不变)吸热或放热的能力。
一、定容热容的计算方法定容热容的计算方法可以通过测定物质的焓变和温度变化来得到。
在恒容条件下,焓变(ΔH)等于吸热或放热的热量。
而热容(Cv)定义为单位质量物质的焓变与温度变化之比。
热容的计算公式为:Cv = ΔH / ΔT其中,ΔT为温度的变化量(单位为K),ΔH为焓变的热量变化(单位为J)。
二、定压热容的计算方法定压热容的计算方法可以通过测定物质的热容比和理想气体恒压热容之间的关系来得到。
热容比(γ)为单位质量物质的定压热容与定容热容的比值。
热容比的计算公式为:γ = Cp / Cv其中,Cp为单位质量物质的定压热容,Cv为单位质量物质的定容热容。
根据理想气体状态方程和热容比的定义,可以得到定容热容和定压热容之间的关系:Cp - Cv = R其中,R为理想气体常数。
因此,可以通过定容热容和已知的理想气体常数计算得到定压热容。
三、热容的应用热容是物质热力学性质的重要参数,在化学、物理等领域中有着广泛的应用。
1. 在热化学反应中,根据定容热容的计算方法可以计算反应过程中的热效应,进而了解反应的热力学性质。
2. 在材料科学中,热容的计算可以用于设计合适的材料,提高材料的热稳定性和耐高温性能。
3. 在能源领域中,热容的计算可以用于优化燃料的热值,提高能源利用效率。
4. 在环境科学中,热容的计算可以用于分析和评估化学物质的热分解和燃烧过程,有助于环境保护和减少污染物的排放。
总结:化学热容的计算涉及到定容热容和定压热容两种方法。
通过测定物质的焓变和温度变化,或者通过测定热容比和理想气体恒压热容之间的关系,可以计算得到热容的数值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热容量的计算公式 设系统处在p − V图上A点状态,现讨论A点附近任意准静态微元过程摩尔热容Ci 的大小。令过A点的任意过程为p = p(V), � dQ = CV dT + pdV dQ = dU + pdV → � pV = RT pdV + Vdp = RdT dQ = Ci dT → Ci = CV + � pdV � dT i (3) (1) (2)
得
γ−n C 1−n V 这说明多方过程的摩尔热容量为一常量, 即随体积单调增大时, 要么一致吸热, 要么一致放热, 不存在吸放热的转变点。 Q = � dQ = � Cn dT = � (γ − n) Cn dp γ − n CV Cn p p (pdV + Vdp) = � � + � � � VdV = � [1 − n] VdV = � pdV R R V dV i 1−n R V γ−1
例题:在给一摩尔单原子理想气体加热时,得到压强与绝对温度的关系T = a + bp,求该过程的摩尔热容量 解答:联立热力学状态方程和过程方程 � dp p pV = RT → (a + bp)R = pV → bRdp = pdV + Vdp → � � = T = a + bp dV i bR − V p bR� − 1 1 bR − V aR V V ∙ R = CV + = CV + = CV + = CV − 1 p dp bR� bR bP 1+ +� � V bR� − 1 V dV i V CV = aR bP
的摩尔热容量Cn
pV n = 常量
摩尔热容量
Cn = CV + 引入热容比
p p (CV + R) − nCV Cp − nCV R V ∙ R = CV + p V p R = CV + = = dp p 1 − n 1−n 1−n − n +� � V V V dV i γ = Cp ⁄CV ,Cp − CV = R → γ − 1 = Cn = R CV
讨论:要考虑吸热过程(非单调过程,存在吸热转变点) ,即要求Ci > 0,这时
p 3−V 5 21 − 12V V V = + = p dp 2 3−V−1 6 − 4V +� � V V dV i
热量 Q 吸热 = � dQ = ��
7⁄4
21 − 12V 7 3 >0且V<2→V< , <V<2 6 − 4V 4 2
总结:只要知道p − V图上A点的热力学运动轨迹p = p(V),则准静态过程的热容量和热量计算极为方便
dQ = Ci dT =
Ci Ci p dp (pdV + Vdp) = � + � � � VdV R R V dV i
例题: (200 道物理学难题第 135 题)一个高为152cm的下半部封闭的直玻璃管中充满了空气。它的上半部是水银并且 玻璃管的顶部是敞开的。气体被缓慢地加热,到所有的水银被推出管子外面时传递给气体的热量是多少?(大气压是 760mm 汞柱)
于是摩尔热容量
Ci = CV +
吸放热的转变点Ci = 0,即
解答:考虑系统处在p − V图上状态,设任意中间状态是:水银面距玻璃管敞口的距离为760x(mm),这时气体压强 p= 760 + 760x 760 + 760x = = 1 + x(标准大气压) p0 760 V V ≡ =2−x 760S D V0
气体体积
于是在单位(p0 , V0 , T0 )
在任意过程中,单位摩尔理想气体都满足热力学第一定律和状态方程
单位摩尔理想气体在这个准静态微元过程的摩尔热容的定义
将(1), (2)代入(3)得
Ci = CV + � 热量的计算公式
p pdV V � R = CV + ∙R dp p pdV + Vdp i +� � V dV i
(4)
利用(3)式可知任意准静态微元过程的净热量
7⁄4 2 p dp 21 − V 3 − V � Ci � + � � � VdV = �� + � � ∙� − 1� VdV V dV V i 3⁄2 1 3⁄2 6 − 4V 2
1பைடு நூலகம்
+�
例题:多方过程
= ��
1
7⁄4
+� �
3⁄2
2
21 − 12V 27 dV = 2 16
解答:多方过程 pV n = 常量 → V n dp + npV n −1 dV = 0 → � dp p � = −n dV n V
V = (1520 − 760x)S → v ≡D p=3−V
单位摩尔封闭气体压强单位为p0 = 1 标准大气压,体积单位为V0 = 760S,简便计,由初始条件得到初始温度为2个温度 单位T0 PV = RT → 2RT0 = 2 ∙ 1 → T0 = 1 R
即在单位(p0 , V0 , T0 )摩尔热容量(双原子分子CV = 5⁄2) Ci = CV +
