根据化学式计算1
化学计算题1,2,3

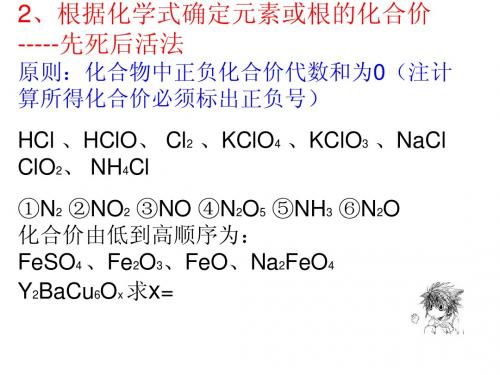
化学计算(一)根据化学式计算1.化学式:用元素符号来表示物质组成的式子. 相对原子质量: C-12 O-16 H-1 S-322.化学式(分子式)表示的含义: N-14 Fe-56 Zn-65 Cu-64 (1)表示该物质的一个分子. Mg-24 Cl-35.5 Al-27 Ca-40(2)表示构成一个分子的各种原子的原子个数. K-39 P-15 Na-23 I-127 (3)表示一种物质及组成该物质的各种元素. 3.常用的计算关系式(以化合物A m B n 为例):(1)相对分子质量=A 的相对原子质量×m+B 的相对原子质量×n(2)A 的质量分数(3)A 、B 元素的质量比(4)A 元素的质量=化合物质量×A 的质量分数 (5)在混合物中,某物质的质量分数(纯度)(杂质不含该元素时)4.两种物质的质量比等于相对分子质量×分子个数之比.5.两种元素的原子个数比等于它们的质量比除以相对原子质量之比.1.练习1.最近,在我国各大城市举办以“珍爱生命,拒绝毒品”为主题的全国禁毒展览,从大麻叶中提取的一种毒品,叫大麻酚,它的化学式为C 21H 26O 2 在空气中焚烧生成二氧化碳和水。
(1)则该物质的相对分子质量为 。
(2)该物质中碳、氢、氧三种元素的质量比为 。
2.卟啉铁(C 34H 32ClFeN 4O 4)对人体缺铁性贫血有显著疗效。
以下说法正确的是( )A .卟啉铁中含有5种元素B .1个卟啉铁分子中含有34个碳原子C .人体补铁的唯一方法是服用卟啉铁D .“缺铁性贫血”中的“铁”指单质铁 3:某铁的氧化物中,铁元素与氧元素的质量比为7:2,试确定该氧化物的化学式.4.人体缺乏维生素C (简写“VC ”)就会患坏血病,哥伦布探险时的许多船员就因此而死亡。
右图所示为某种“维生素C ”说明书的一部分。
请你回答:(1)“VC ”中含有 种元素。
(2)若正常成人每天对“VC ”的最低需要量为60mg 。
利用化学方程式计算、1、?

ρ=m/V ; m= ρV
[例题]:3克镁在氧气中充分燃烧,可以生成多少克氧化镁? 解:设可生成氧化镁的质量为X 点燃 2 Mg + O 2 ====== 2 Mg O 48 80 3g X 48 3g ------ = -----80 X 80×3g X = -----------48 = 5 g (1)设未知数 ….... …….….设
九年级化学
第五单元
化学方程式
课题3
利用化学方程式的 简单计算
复习提问: 以镁在空气中燃烧为例说明化学方程式的意义 2Mg + O2 ======
点燃
2 Mg O
48 : 32 : 若: 48g (32 )g 若: (24 )g
若 ( )g
80 80 ( )g ( 4 0)g
( )g
(16 )g
7.95g
5、实验室加热5g高锰酸钾使部分高锰酸钾分解,称得剩 余物质量为4.68g,此时有多少克二氧化锰生成?K:39; Mn:55; O:16; (2010县统考题)
6、在某些牙膏中常用纯净的轻质碳酸钙粉末作摩擦剂。 其生产流程是:煅烧石灰石得到生石灰,再将生石灰水洗 得到石灰乳,然后向纯净的石灰乳中通入二氧化碳得到轻 质碳酸钙粉末。某工厂现有含氢氧化钙14.8g的石灰乳, 至少通入多少千克二氧化碳气体才能使氢氧化钙全部转化 为碳酸钙沉淀?C:12;O:16;Ca:40(2011县统考 题)
C:12 O :16
2、氯酸钾和二氧化锰的混合物15.5g,充分加热反应后,
称得剩余物质量为10.7g,求 ①制得O2多少克? ②剩余物是什么?各多少克? ③原混合物中含KClO3多少克?
K:39 Cl:35.5 O :16 Mn:55
(完整版)有关化学式的计算

有关化学式的计算根据化学式可进行以下计算:(1)计算物质的相对分子质量;(2)计算化合物中各元素的质量比;(3)计算化合物中某一元素的质量分数。
一、化学式计算的依据任何纯净物的组成是一定的,其组成可由化学式来表示.化学式的意义是化学式计算的依据.二、化学式计算的类型1. 计算相对分子质量相对分子质量等于化学式中各原子相对原子质量的总和.其中结晶水合物的相对分子质量等于无水物的相对分子质量与结晶水相对分子质量的总和.要求正向能根据化学式求相对分子质量,反向通过相对分子质量求化学式或相对原子质量.例1 求Na 2CO 3·10H 2O 的相对分子质量解 Na 2CO 3·10H 2O 的相对分子质量=23×2+12×1+16×3+10×(1×2+16×1)=286再如:计算2CuSO 4·5H 2O 的总相对分子质量2CuSO 4·5H 2O 的总相对分子质量=2×[64+32+16×4+5×(1×2+16)]=2×250=5002.计算化合物中各元素的质量比化合物中各元素的质量比,等于化学式中各元素原子的相对原子质量总和之比.两种元素组成的化合物中两个元素质量比也等于两元素相对原子质量之比乘以原子个数比,其关系如下: ×相对原子质量之比原子个数比 元素质量比相对原子质量÷例2 求葡萄糖(C 6H 12O 6)中各元素的质量比解 m ( C ):m(H):m (O)=12×6:1×12:16×6=6:1:8再如:计算NH 4NO 3中各元素的质量比分析:首先根据化学式弄清该物质是由哪几种元素组成的。
由上式可知硝酸铵是由氮,氢、氧三种元素组成,各元素的质量比为该元素的相对原子质量乘以它在化学式中的原子个数之比,最后约简成最简整数比。
初三化学化学式计算题练习题__1

初三化学化学式计算题练习题_初三化学化学式计算题练习题初三化学化学式计算题练习题根据化学式计算基础知识:①相对分子质量=分子中含有各原子的原子质量〔原子个数×相对原子质量〕之和;②元素质量比=元素的质量分数比=原子个数比×相对原子质量比;③元素的质量分数=该元素的相对原子质量×原子个数÷相对分子质量。
考察题型:①计算分子中各元素的原子个数比②计算分子的相对分子质量③计算分子中各元素的质量比④计算分子中某元素的质量分数⑤给出物质质量,计算含某元素的质量一、基础练笔:1.计算下列化学式的相对分子质量(1)氧气(O2)(2)水(H2O)(3)氧化铜(CuO)(4)氧化铁(Fe2O3)(5)氯酸钠(NaClO3)(6)硝酸(HNO3)(7)二个五氧化二磷(8)硫酸铁[Fe2(SO4)3];(9)胆矾[CuSO4·5H2O]。
(10).某元素R的氧化物RxOy,相对分子质量为M,则R元素的相对原子质量是多少?2、计算分子中各元素的质量比(1)污染的融雪剂的主要成份是醋酸钾(CH3COOK)。
请回答:醋酸钾中C、H、O元素的质量比;(2)从大麻叶中提取的一种毒品,叫大麻酚,它的化学式为C21H26O2在空气中燃烧生成二氧化碳和水。
(a)则该物质的相对分子质量;初三化学化学式计算题练习题初三化学化学式计算题练习题(b)该物质中碳、氢、氧三种元素的质量比;(3)化肥硝酸铵的化学式为(NH4NO3)。
试求:硝酸铵中N、H、O三种元素的质量比;(4)根据莽草酸的化学式(C7H10O5)计算:莽草酸中氢元素和氧元素的质量比为;(5)硫酸钾中各元素的质量比;14.计算下列化合物中元素间的质量比(6)硫酸(H2SO4)中氢元素、硫元素、氧元素的质量比多少?(7)四氧化三铁(Fe3O4)中铁元素与氧元素的质量比多少?3、计算分子中某元素的质量分数(1)计算硝酸铵(NH4NO3)中氮元素质量分数(2)醋酸钾中钾元素的质量分数为(保留一位小数);(CH3COOK)(3)皮鞋生产中所用的胶水含有正已烷(C6H14),求正已烷中碳元素的质量分数;(4)氯酸钾中氧元素的质量分数是多少?初三化学化学式计算题练习题初三化学化学式计算题练习题四、给出物质质量求元素的质量1、计算四氧化三铁的相对分子质量2、计算四氧化三铁中铁、氧元素质量比3、计算四氧化三铁中铁元素的质量分数4、计算10克四氧化三铁中铁元素的质量5、80克氧化镁中氧元素的质量6多少克氧化镁中氧元素的质量与64克二氧化硫中氧元素质量相等7.多少g硝酸铵(NH4NO3)含氮5.6g。
化学式计算1
KMnO4 K2MnO4 NH4NO3 Cu2(OH)2C
39+55+16×4=158 39×2+55+16×4=197 14+1×4+14+16×3=80 64×2+(16+1)×2+12+16×3 =222
练习:已知化合物R2O3 的相对分子质量是160,
求 R的相对原子质量。 解:设R的相对原子质量为X
元素质量比 = (相对原子质量×原子个数)之比 例如:
二氧化碳(CO2) 中C:O=
碳元素质量︰氧元素质量 = 12 ︰(16×2)
= 3 ︰8
例2:计算硝酸铵( NH4NO3 )中各元素的质量比 解: 在NH4NO3中 N : H : O = 14×2 : 1×4 : 16×3
= 28 : 4 : 48 = 7 : 1 : 12
X×2+16×3=160 X=56
答: R的相对原子质量为56
来源于:苏科全科网
根据化学式计算组成物质的各元素的原子 的个数比。元素符号右下角数字比(相同的
元素的原子个数要合并)
例题1:求炭疽热杆菌C17H18N3O3 中各元素原子的个数比。 解:nc︰nH︰nN︰nO=17︰18 ︰ 3︰3
解析:设SO2的质量为m,SO3的质量均为n,则: ×2×100% SO2中O的质量= m× 16 64 SO3中O的质量=n× 16×3 ×100% 80 ∵SO2和SO3中的O的质量相等 m×16×2×100% = n× 16×3 ×100% 64 80 m :n = 6:5
• 要使CO、CO2含有相等质量的氧元素,则
K : Cl : O = 39 : 35.5 : 16×3 = 39 : 35.5 : 48 2.碳酸钠中各元素的质量比
解 :在Na2CO3中
混合物平均相对分子质量的计算与应用

混合物平均相对分子质量的计算与应用陕西省扶风高中郭轩林对于纯净物...来说,其相对分子质量的计算一般有如下几种方法:1、根据化学式求相对分子质量。
2、根据气体的标况密度法求相对分子质量,即M=22.4·ρ g/mol。
3、根据气体的相对密度法求相对分子质量,即M A=M B·D,式中的D为气体A对气体B的相对密度(D=ρA/ρB)。
4、在非标准状况下,根据理想气体状态方程PV=mRT/M求相对分子质量,即M=mRT/PV。
5、根据摩尔质量定义法求相对分子质量,即M=m/n。
6、根据化学方程式求相对分子质量。
对于混合物...来说,虽然它是由多种纯净物组成,但如果是气体混合物,上面的第2、3、4三种方法仍可用于求平均相对分子质量。
如果是固体或液体混合物,则可用上面的第5种方法求平均相对分子质量。
除此之外,混合物的平均相对分子质量还可用下式计算:M(混)=M1·a%+ M2·b%+ M3·c%+……式中M1、M2、M3 分别表示混合物中各组分的相对分子质量,a%、b%、c%分别表示混合物中各组分的体积分数(仅限于气体)或物质的量分数。
在中学的化学计算中,时常遇到需要运用混合物平均相对分子质量来计算的习题,这里结合各种实例加以说明。
例1.在标准状况下,将CH4和CO以3∶1的体积比混合充入容积为10L的密闭容器里。
试求:(1)10L混合气体的质量;(2)混合气体的密度是H2密度的多少倍?【分析与解答】第(2)问可根据阿伏加德罗定律的推论ρ1/ρ2= M1 /M2求解。
(1)10L混合气体的质量为:(2)M(混)=16╳0.75+28╳0.25=19,则混合气体对H2密度的倍数为:ρ(混)/ρ(H2)= M (混)/M(H2)=19g·mol-1/2g·mol-1=9.5,即相同条件下,混合气体的密度是H2的9.5倍。
例2.有A、B、C三种一元碱,它们的相对分子质量之比为3∶5∶7。
初三化学乐乐课堂全集化学式的计算

初三化学乐乐课堂全集化学式的计算化学式的计算是化学中非常重要的一部分,它能够帮助我们确定化学物质的组成和反应过程中的物质变化。
在初三化学乐乐课堂中,我们学习了化学式的计算方法,下面我将为大家详细介绍。
化学式的计算主要涉及化学元素的符号、化合价以及化合物的配比关系。
化学元素是构成化学物质的基本单位,它们可以用化学符号来表示。
化学符号是由拉丁文或英文中的第一个字母大写,如果有第二个字母,则写小写字母。
例如,氢元素的符号为H,氧元素的符号为O。
化学元素的化合价是指化学元素与其他元素结合时所具有的价态。
化合价的确定需要遵循化合物的稳定性原则和电子配置的规律。
在化合物中,阳离子的化合价为正数,阴离子的化合价为负数。
例如,氯化钠的化合价为+1和-1,即Na+和Cl-。
化学式的计算还需要考虑化合物的配比关系。
化合物的配比关系可以通过化学式中的下标来表示。
化学式中的下标表示该元素在化合物中的个数。
例如,水的化学式为H2O,其中H表示氢元素,2表示氢元素的个数,O表示氧元素,1表示氧元素的个数。
化学式的计算可以通过已知条件来推导得出。
例如,已知化合物中含有两种元素,且元素A的化合价为+2,元素B的化合价为-1,根据化合价的互补性原则,可以得出化合物的化学式为A2B。
再例如,已知化合物中含有氢和氧两种元素,根据化合物的稳定性原则,氢元素的化合价为+1,氧元素的化合价为-2,可以得出化合物的化学式为H2O。
化学式的计算还可以通过化合物的化学名称来推导得出。
化合物的化学名称可以通过元素的化合价和化合物的配比关系来确定。
例如,化合物中含有钠和氯两种元素,根据化合价的互补性原则,钠的化合价为+1,氯的化合价为-1,化合物的化学名称为氯化钠。
再例如,化合物中含有氢和氧两种元素,根据化合物的化学式,化合物的化学名称为水。
化学式的计算在化学实验和化学反应中具有重要的应用价值。
通过化学式的计算,我们可以预测化学反应的产物,分析反应的过程和结果。
初三化学计算专题复习

3、计算物质中某元素的质量分数
化合物中某元 素的质量分数
=
×100%
4、已知某化合物的质量,求某元素的质量 某元素的质量=化合物的质量×化合物中 某元素的质量分数
走进中考
(2011泰安中考)(4分)无土栽培是一种农业高 新技术,它可以显著提高农作物的产量和质量。某 品种茄子的无土栽培营养液中含有6%的KNO3。
;
(3)苯甲酸中碳元素与氧元素的质量比为
。
2、(2011.内江市)某研究性学习小组为测定铜锌合 金中铜的质量分数,进行如下实验:取合金10g,向其 中不断加入稀硫酸,产生的气体与所加稀硫酸的质量 关系如图所示。求: ①稀硫酸中溶质的质量分数。 ②合金中铜的质量分数。
大显身手
反应时间t/s t0 t1 t2 t3 t4 t5 t6
化学计算专题复习
单击此处添加您的正文
中考要求
一.能利用相对原子质量、相对分子 质量进行物质组成的简单计算
二.能进行溶质质量分数的计算 三.能进行化学方程式的简单计算
○ 分值:计算题 约占15分
一、根据化学式的计算
1、计算相对分子质量
2、计算物质中各元素的质量比 点拨:①计算时一定要写清楚各元素质量比顺序,因 顺序不同,比值也不同。 ②计算时的结果约成最简整数比。
第一次 第二次 第三次
连续加入盐酸的体积/mL 生成氢气的质量/g
10 0.08
10 0.08
10 0.04
(1)从上表数据分析,小华用10 g合金粉末总共收集到氢 气_______g; (2)求该合金中铜的质量分数。
4、图像型计算题
例3:向盛有12.60克NaHCO3固体的烧杯中加入100.5克硫酸溶液 恰好完全反应,反应过程中测得烧杯连同药品的质量(m)与反应时间
物质的量、根据化学方程式的计算 (1)

第8讲 化学方程式的综合计算知识点睛一、物质的量 1. 物质的量表示物质所含微粒数目的多少的一种物理量,它的符号为n 。
物质的量是国际单位制中7个基本量中的1个。
单位:摩尔,简称摩,符号 mol 。
1摩尔任何物质约含有236.0210⨯个微粒,其中236.0210⨯称为阿伏加德罗常数,符号N A ,即N A =236.0210⨯。
注意:(1)物质的量是指以大量微粒集合体来表示物质所含微粒多少的种物理量,这里的微粒指分子或原子等微观粒子,不能指宏观的物质,摩尔只适用于微观粒子。
(2)1Mol 物质中约含有236.0210⨯个相应微粒,是一个近似值,“约”不可漏写。
(3)使用摩尔作单位时,必须指明相应物质结构微粒的名称或符号:如1mol 氧分子或1mol 氧原子等。
物质的量与微粒个数之间的关系:2. 摩尔质量1mol 物质的质量,叫做该物质的摩尔质量,它的符号为M 。
单位是克/摩尔,读作“克每摩尔”,符号g/mol 。
数值上,某物质的摩尔质量等于该物质的式量或相对原子质量。
注意:(1)物质的摩尔质量与式量的区别:两者在数值上相等,但摩尔质量有单位,式量无单位。
(2)物质的摩尔质量与物质的质量区别:摩尔质量特指1摩尔物质的质量,它的单位是g/mol ,而物质的质量是实际质量,单位是g 。
物质的量与物质的质量之间的转换关系:()()()()23A 23A6.02106.0210N N N n ⨯⨯÷⨯−−−−−→←−−−−−物质的量微粒个数3. 物质的量、物质的质量、微粒个数之间的转换关系:二、根据化学方程式的简单计算 ⒈解题步骤及格式: 一般分为以下七步:⑴解设未知量,一般情况下,求什么设什么; ⑵写出相应的正确的化学方程式;⑶根据化学方程式找出相关物质的相对分子质量,列在相应的化学式下面; ⑷标出已知量和未知量; ⑸列比例式; ⑹求解; ⑺答题。
2.计算中常用的关系式 ⑴m= ρv⑵单位换算:1L=1000mL ,1mL=1cm 3⑶物质的纯度=纯物质的质量/不纯物质的质量×100% 变形:纯物质的质量=不纯物质的质量×物质的纯度 不纯物质的质量=纯物质的质量÷物质的纯度⑷物质的纯度(纯物质的质量分数)=1-杂质的质量分数 3.常见的计算类型⑴利用化学方程式的简单计算; ⑵有关含杂质物质的化学方程式的计算; ⑶质量守恒定律结合化学方程式的综合计算。
根据化学式的计算_练习题[1]_2剖析
![根据化学式的计算_练习题[1]_2剖析](https://img.taocdn.com/s3/m/b54ae70359eef8c75fbfb34c.png)
(二)质量守恒定律的应用:第一组. 应用元素种类和原子个数守恒1.植物的光合作用:,则淀粉中一定含有元素,可能含有元素。
2.某物质在O2中燃烧,生成CO2和H2O,则该物质中一定含有元素,可能含有元素。
3.根据质量守恒定律,电解食盐水不可能得到的物质是()A.H2 B. Cl2 C. NaOH D. Na2SO44.已知反应:4NH3+5O2=4X+6H2O,则可确定X的分子式为。
第二组. 应用质量守恒5.现有m克氯酸钾和2克二氧化锰的混合物,充分反应后,得到n克固体,则生成氧气的质量为克。
6.现有a克A物质与b克B物质充分反应后,生成C物质,则生成C的质量为() A.等于(a+b)克 B. 小于(a+b)克C.大于(a+b)克 D. 不大于(a+b)克7.根据质量守恒定律,在反应:2Cu+O2=2CuO中,下列各组数据正确的是()A. Cu:3克 O2:2克 CuO:5克B. Cu:2克 O2:3克 CuO:5克C. Cu:1克 O2:4克 CuO:5克D. Cu:4克 O2:1克 CuO:5克8.已知反应:A+B=C+D中,参加反应的A与B的质量比为5﹕2,若反应后生成C和D物质的质量为21克,则参加反应的A物质质量为克。
﹡9.已知54克金属M与48克氧气恰好完全反应生成M的氧化物,又知M的相对分子质量为27,则M 的化合价为。
﹡10.现有23克某物质在氧气中完全燃烧后,生成44克CO2和27克H2O,则该物质的分子式为。
第三组. 应用反应的质量比11.在反应:2X+Y2=2M中,已知X的相对原子质量为24,Y2的相对分子质量为32,则M 的相对分子质量为。
12.在反应:X+2Y=R+2M中,已知R和M的相对分子质量之比为22﹕9,当1.6克X与一定量Y完全反应后,生成4.4克R,则在此反应中Y与M的质量比为。
13.在反应:X+Y=Z+M中,已知25克X和10克Y恰好完全反应,生成5克Z。
化学式的计算方法总结

化学式的计算方法总结第一种方法,观察法。
1。
举例: BaO2+NaOH===BaCl2。
2。
化合价升降,根据化合价的代数和为零的原则判断元素的化合价。
(1)2S+4O2===4SO2,根据化合价升降规律判断元素的化合价。
(2)SO42-+2H2O===(NH4)2SO4。
3。
根据金属活动顺序表判断元素的化合价。
(1)Al+3Fe===Fe3Al。
4。
根据电子式计算出元素的化合价。
(1)C+NaOH===HCl。
(2)Al3++3NH4OH===Al(OH)3↓。
5。
根据结构简式求元素的化合价。
(1)2H2O+H2===H2O。
(2)Al2O3+3H2O===Al(OH)3↓。
2Na+H2===2NaH2,根据电子式计算出元素的化合价。
Al3++3NH4OH===Al(OH)3↓。
6。
根据性质和用途推断出元素的化合价。
(1)Fe+CuSO4===FeSO4+Cu。
(2)Zn+AgNO3===AgNO3+Zn。
7。
利用氧化物还原性推断元素的化合价。
(1)BaO+BaCl2===BaCl3。
(2)Al2O3+H2O===Al(OH)3↓+2H2O。
8。
利用氢化物和水反应推断元素的化合价。
(1)H2O+AlH3===Al(OH)3↓+2H2O(2)H2H4+2H2O===H2CO32-+2H2↑(3)2H2H4+2H2O===2H2O。
9。
利用强酸制弱酸原理进行推断。
(1)4HCl+2H2O===2H2SO4+Cl2(2)2H2SO4+Al(OH)3===Al(OH)3↓+2H2O(3)H2SO4+2H2O===H2SO4+Cl2。
10。
由实验现象得出结论。
(1)NaOH(aq)===Na2HPO4。
(2)2H2SO4(aq)===2H2SO4。
Na2O3=4Na+O2。
3Na2O3=2Na+O2,根据化合价的代数和为零的原则判断元素的化合价。
2Na2O3===2Na+O2。
4。
初三化学化学式、化学方程式的综合计算

化学式、化学方程式的综合计算一、化学式的计算:1、有关概念1)、化学式用元素符号和数字的组合来表示物质组成的式子2)、相对原子质量以12C原子质量的1/12为标准,其他原子的实际质量与其作比的比值单位:“1”,忽略不写符号:Ar3)、相对分子质量化学式中各原子的相对原子质量的总和符号:Mr以化合物A m B n为例:Mr=Ar(A)×m+Ar(b)×n注:计算结晶水合物的相对分子质量时,化学式中的“·”表示相加,而不表示相乘。
2、有关的简单计算(以化合物A m B n为例)1)、计算化合物组成元素的质量比化合物中各元素的质量比是该元素的相对原子质量和原子个数的乘积之比,即各元素原子的相对原子质量和之比.=注:计算时一定要写清楚各元素质量比顺序,因顺序不同,比值也不同。
2)、计算化合物中某元素的质量分数化合物中某元素的质量分数=×100%3)、计算化合物中某元素的质量化合物中某元素的质量=Mr(A m B n)×该元素在该化合物中所占的质量分数3、有关的复杂计算(以化合物A m B n为例)1)、计算纯净物中某元素的质量分数纯净物中某元素的质量分数=纯净物的质量的实际质量A ×100%=2)、计算混合物中A m B n 的质量分数 混合物中A m B n 的质量分数=混合物的质量的实际质量AmBn ×100%3)、计算混合物中A 元素的质量分数混合物中A 元素的质量分数=混合物的质量的实际质量A ×100%=混合物的质量的质量分数的实际质量A AmBn ⨯×100%二、化学方程式的计算:1、有关反应物和生成物关系的计算例如:将一氧化碳在空气中点燃后生成二氧化碳2222CO O CO =+微粒比: 质量比: 质量守恒:化合物中各元素的质量比,等于化学式中各元素原子的相对原子质量乘以原子个数之比。
化学方程式中各种物质的质量比,等于各种物质的相对分子质量乘以分子个数之比。
初中化学计算题四种题型

①某纯净物的质量分数= ×100%初中化学计算题四种题型一、根据化学式的计算1、计算相对分子质量相对分子质量=化学式中各原子的相对原子质量的总和。
点拨:①计算物质的相对分子质量时,同种元素的相对原子质量与其原子个数是相乘的关系,不同种元素相对质量是相加的关系。
②计算结晶水合物的相对分子质量时,化学式中的“·”表示相加,而不表示相乘。
③化学式中原子团(或根)右下角的数字表示的是原子团(或根)的个数。
计算时先求一个原子团或根的总相对原子质量,再乘以原子团(或根)的个数,即得出几个原子团的总相对原子质量。
2、计算物质中各元素的质量比组成化合物的各元素的质量比=化合物中各元素的相对原子质量总和(即相对原子质量与原子个数乘积)之比。
点拨:①计算时一定要写清楚各元素质量比顺序,因顺序不同,比值也不同。
②计算时的结果约成最简整数比。
3、计算物质中某元素的质量分数4、已知某化合物的质量,求某元素的质量 化合物里某元素的质量=化合物的质量×化合物中某元素的质量分数 化合物的质量=化合物中已知元素的质量÷化合物中已知元素的质量分数5、求化学式 点拨:求物质化学式的主要类型: ①由元素的相对原子质量和化合物的相对分子质量,确定化学式。
②根据化合物中某元素质量分数确定化合物的化学式。
③已知化合物中元素的质量比和相对原子质量,确定化学式。
原子个数比=元素的质量比:相对原子质量比 ④根据质量守恒定律确定化学式。
6、计算不纯物中某元素(或某纯净物)的质量分数 计算公式: ②不纯物中某元素的质量分数=不纯物中纯净物的质量分数×该纯净物中某元素的质量分数。
③某纯净物的质量分数=实际上某元素的质量分数÷化学式中该元素的质量分数×100% 二、根据化学方程式的计算 根据化学方程式的计算就是从量的方面来研究物质变化的一种重要的方法,其计算步骤和方法,一般分为以下几步: ①设未知量,未知量不带单位,常用X 表示. ②根据题意确定反应物与生成物,写出并配平反应的化学方程式. ③在有关物质化学式下面写出相对分子质量并代入已知量和所设未知量.化合物中某元素的质量×100%④列比例式求解,写出答案.在初中阶段,根据化学方程式的计算,主要有以下几种基本类型.(1)根据化学方程式计算反应物、生成物间的质量比反应物、生成物间的质量比,就是各反应物、生成物相对分子质量×计量数之比.(2)根据化学方程式计算反应物或生成物的质量反应物或生成物质量的计算,一般是根据化学方程式中各反应物、生成物间的质量比来求算的,对某些反应,可直接依据质量守恒定律进行计算.(3)根据化学方程式进行含有一定且杂质的反应物或生成物的计算根据化学方程式的计算,其反应物或生成物的质量必须是纯物质的质量.含有一定量杂质的反应物或生成物的质量,必须换算成纯物质的质量,才能按根据化学方程式的计算步骤和方法进行计算.纯物质质量=含有一定量杂质的物质质量×该物质质量分数三、有要溶液组成的计算1.用溶质所占溶液的质量分数表示溶液的组成,其关系如下:溶质的质量分数= 溶质质量溶质+溶剂 × 100%=溶液质量溶质质量× 100%在饱和溶液中:溶质的质量分数=+溶解度溶解度g 100 × 100%2、有关溶液加水稀释的计算在溶液加水稀释过程中,溶质的质量分数将随溶液的稀释而改变,溶质质量分数一定的溶液加水稀释,稀释前后溶质的总质量不会发生改变.溶液加水稀释的计算,根据的就是这个道理. M 浓溶液×浓溶液的溶质质量分数=M 稀溶液×稀溶液的溶质质量分数 =(M 浓溶液+M 水)×稀溶液的溶质质量分数 3、溶质的质量分数在化学方程式的应用 反应后溶液的质量=反应物的总质量(包含溶液的质量)-生成气体或沉淀的质量 四、综合计算题分类解析 从近几年全国各地的中考化学试题来看,化学计算已经走出了“为计算而计算”的考查误区,考题所涉及的内容更加注重与日常生活、工农业生产的联系;更加注重对同学们图表、数据、信息、实验综合分析能力的考查。
化学方程式计算的几种常用方法

化学方程式计算的几种常用方法化学方程式计算的几种常用方法化学方程式(Chemical Equation),也称为化学反应方程式,是用化学式表示化学反应的式子,接下来就由店铺带来化学方程式计算的几种常用方法,希望对你有所帮助!一、质量守恒法化学反应遵循质量守恒定律,各元素的质量在反应前后是守恒的。
抓住守恒这个中心,准确建立已知量与待求量的等量关系,是用质量守恒法解题的关键。
此法在化学计算中应用广泛。
例1. 向5g铜粉和氧化铜的混合物中不断通入氢气,并加热。
充分反应后停止加热,冷却后称量残留固体的质量为4.2g。
求原混合物中含氧化铜和铜粉各多少克?分析:由题意可知,反应前后铜元素的质量在固体中是没有变化的,根据铜元素质量守恒,即可建立方程,求出混合物中氧化铜和铜粉的质量。
解:设混合物中含CuO的质量为x g,则含Cu的质量为(5-x)g,由反应前后铜元素的质量相等,得:x·Cu/CuO+(5-x)=4.2即:x·64/80+(5-x)=4.2x=4原混合物中含Cu的质量为5-4=1(g)答:原混合物中含氧化铜4g;含铜1g。
二、差量法根据化学反应前后某一状态的物质之间的质量差与反应物或生成物的质量成正比例的关系进行计算的方法称为差量法。
在化学反应中,虽然从整体上看存在着质量守恒的关系,但某一状态的物质(例如固态物质或液态物质)的质量在反应前后会发生反应(增加或减少),这一差值称为差量。
差量与反应物或生成物之间有着正比例关系,通过这种比例关系可以计算出与之相关的待求量。
因此,寻找差量,正确建立差量与待求量的比例关系,是用差量法解题的关键。
在有沉淀或气体生成的化学反应中,常用差量法进行计算。
例2. 某学生将16g氧化铜装入试管中,通入氢气并加热。
反应一段时间后,停止加热,待试管冷却后,称得试管中剩余固体的质量是14.4g。
问有多少克氧化铜被还原?分析:从化学方程式可以看出,反应后固体减少的质量就是参加反应的氧化铜失去氧的质量。
初中化学化学式、化合价(包括化学式相关计算1).doc

初中化学化学式、化合价(包括化学式相关计算1)姓名:_____________ 年级:____________ 学号:______________一、选择题(共40题)1.Na2FeO3是一种绿色、无污染的净水剂。
则其中铁元素的化合价为A.+2B.+3C. +4D.+6【答案】C难度:中等知识点:化学式与化合价2.封开县境内新发现了大型的“钼矿”,金属钼可用于制造火箭、导弹等耐高温材料。
如果钼铅矿(PbMoO4)中的铅元素为+2价,则钼元素的化合价为()A.+2 B.+3 C. +4D.+6【答案】C难度:中等知识点:化学式与化合价3.2009年某日,南昌某厂发生双乙烯酮(C4H4O2)泄漏。
有关双乙烯酮的说法不正确的是A.它的一个分子含有10个原子B.其碳元素与氧元素质量比为3︰2C.其氢元素质量分数约为4.76%D.它的相对分子质量为84g【答案】D难度:中等知识点:化学式与化合价4.金属钒被誉为“合金的维生素”。
五氧化二钒(V2O5)中钒元素的化合价为A.一3B.+ 1C.+ 3D.+5【答案】D难度:容易知识点:化学式与化合价5.薄荷醇(化学式为C10H20O)可用于糖果、饮料的加香。
下列有关薄荷醇的说法正确的是A.薄荷醇属于有机化合物B.薄荷醇由10个碳原子、20个氢原子和1个氧原子构成C.薄荷醇中碳元素、氢元素和氧元素的质量比为10:20:1D.薄荷醇中碳元素的质量分数约为76.9%.【答案】A难度:中等知识点:化学式与化合价6.大蒜是常见的调味品之一,大蒜中主要成分大蒜素具有消毒杀菌作用。
大蒜素的化学式为C6H10S3,下列说法不正确的是A.大蒜素的一个分子由6个碳原子、10个氢原子和3个硫原子构成B.大蒜素由碳、氢、硫三种元素组成C.大蒜素中碳、氢、硫三种元素的质量比为6:10:3D.大蒜素属于有机化合物【答案】C难度:中等知识点:化学式与化合价7.为防止灾后疫情出现,防疫人员用过氧乙酸( C2H4O3 )、次氯酸钠(NaClO)进行消毒。
根据化学式计算1

根据化学式计算㈠班级__________姓名__________学号__________1.计算下列物质的相对分子质量(列式):Ca(OH)2_____________________ 2Na2CO3 ___ ___ ____ BaSO4___________________ ____ AgNO3__________________________ KClO3____________________ ___ NH4Cl_________________________ 2.计算下列化合物中各元素的质量比:SO2____________________ NH4HCO3____________________(NH4)2SO4__________ ______ C2H5OH____________________Fe2O3________________ ____ 2H2O____________________3.计算下列各化合物中元素的质量分数(列式):Fe2O3中Fe%=_____________________________ _____NH4NO3中N%=_____________________________ _______CO(NH2)2中N%=______________________________ ______4.计算:⑴1吨(NH4)2SO4中氮元素的质量⑵质量相同的CO和CO2中所含分子个数比和氧原子个数比。
⑶1吨NH4NO3中所含氮元素的质量和多少吨(NH4)2SO4中氮元素的质量相等。
⑷质量相同的CO和CO2中所含氧元素的质量比。
5.某硝铵(NH4NO3)化肥样品,经测定含氮量为33%,求该样品含NH4NO3的质量分数。
6.某不纯的MnO2粉末,已测知其氧的质量分数为38.5%,且只含一种杂质,则这种杂质可能是:①Fe粉;②Cu粉;③SiO2;④CuO,通过计算说明。
化学式计算1课时

化学式计算1.填写下列分子式中数字2的意义:H2O ;2Ca ;2H2;2N ;CaCl2;SO42-;23..重水的主要用途是在核反应堆中做减速剂,一个重水分子有2个重氢原子和一个氧原子构成。
重氢原子核电荷数为1,相对原子质量为2,下列说法中正确的是 ( )A.重水的相对分子质量为20 B.重氢原子核外有2个电子C.重氢分子的相对分子质量为2 D.重氢离子核内有2个质子4.某元素的相对原子质量为27,化合价为+3,则其氧化物中含氧的质量分数为()A.47.1% B.26.5% C.77.1% D.72%5.核糖是人类生命活动中不可缺少的物质,已知核糖的相对分子质量是150,其中含碳40%,含氢6.7%,其余的是氧,则核糖的化学式是。
6.“达菲”是治疗甲型H1N1流感的一种特效药。
该药物的主要成分是一种化学式为C16H31N2PO8的物质。
关于该物质的说法不正确的是()A.由C、H、N、P、O五种元素组成B.碳、氧元素的质量之比是2:1C.相对分子质量为410 D.一个分子中含有58个原子7.今年春季以来,甲型H1N1流感疫情在一些国家持续蔓延,用于治疗流感的抗病毒药物“达菲”可以有效地预防和治疗甲型H1N1流感。
从烹调香料八角中提取到的莽草酸(化学式为:C7H10O5)是制取“达菲”的基本原料。
下列有关莽草酸的说法正确的是()A.莽草酸属于单质样B.莽草酸中C、H、O三种元素的质量比为7∶10∶5 C.莽草酸的相对分子质量为174、D.该物质中含有22个原子8.水果中含有柠檬酸,可促进消化。
柠檬酸的化学式为C6H8O7.⑴柠檬酸的相对分子质量为;⑵柠檬酸中的碳、氢、氧三种元素的质量比为(化成最简整数比)⑶柠檬酸中碳元素的质量分数是(保留一位小数)9.熟食制品包装中常加入防腐剂,丙酸钠是一种食品防腐剂,化学式为C3H5O2Na ,丙酸钠中C、H、O、Na四种元素的质量比为,其相对分子质量为,碳元素的质量分数为。
1mol氧化钠中中含有的原子数

1mol氧化钠中中含有的原子数1mol氧化钠中含有的原子数氧化钠是一种常见的无机化合物,化学式为Na2O。
在化学中,mol 是一个重要的计量单位,表示物质的量。
那么,1mol氧化钠中到底含有多少个原子呢?要回答这个问题,我们首先需要了解氧化钠的化学式中的含义。
化学式Na2O表示氧化钠分子中含有2个钠原子和1个氧原子。
这意味着每个氧化钠分子中有3个原子。
接下来,我们需要知道1mol氧化钠中的物质量。
mol是物质的量的单位,表示物质中含有的基本单位数量。
对于氧化钠,其摩尔质量为22.99g/mol(钠的摩尔质量为22.99g/mol)+ 16.00g/mol(氧的摩尔质量为16.00g/mol),即每摩尔氧化钠的质量为38.99g。
根据化学计量关系,1mol氧化钠中含有的原子数可以通过摩尔质量和每个分子中的原子数来计算。
根据前面的分析,每个氧化钠分子中含有3个原子,所以1mol氧化钠中含有3个原子。
因此,1mol氧化钠中含有3个原子。
这个结果可以进一步解释为,1mol氧化钠中含有2个钠原子和1个氧原子。
钠原子和氧原子的数量加起来正好是3个。
总结起来,1mol氧化钠中含有3个原子,其中包括2个钠原子和1个氧原子。
这个结果是通过化学式和摩尔质量计算得出的。
了解这个数量对于理解化学反应和计量物质的量非常重要。
在化学中,我们经常使用mol这个单位来计量物质的量。
通过了解每个物质分子中的原子数和摩尔质量,我们可以计算出1mol物质中含有的原子数。
这对于研究物质的性质和进行化学计算非常有帮助。
总之,1mol氧化钠中含有3个原子,其中包括2个钠原子和1个氧原子。
这个结果是通过化学式和摩尔质量计算得出的。
了解这个数量对于理解化学反应和计量物质的量非常重要。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
►
类型二
求某元素的质量
例2 赤铁矿石是炼铁的重要原料,其主要成分为氧化铁 (Fe2O3) 。 请 计 算 : 80 g 氧 化 铁 中 含 有 的 铁 元 素 的 质 量 为 __________g。 变式题 某种含硫酸亚铁的药物可用于治疗缺铁性贫血。某 贫血患者每天需服用这种含铁元素10%的药物112 mg,则每天 他服用的这种药物中含硫酸亚铁(FeSO4)的质量是(该药物中其 他成分不含铁元素) ( ) A.30.4 mg B.15.2 mg C.22.4 mg D.22.6 mg
我国从1994年开始强制食盐加碘,即在食盐中加入 碘酸钾(KIO3),以防止碘缺乏病的发生。今年将适当下 调现行食盐加碘量:将原来每千克食盐含碘量下调至25 mg。(提示:碘相对原子质量为127) 请为我市某企业计算:售往盐城的加碘食盐每袋 (500 g)应比调整前少加碘酸钾多少毫克。
碘盐 配料:氯化钠、碘酸钾(KIO3) 含碘量:40mg/kg 保质期:18个月 食用方法:勿长时间炖炒 贮藏指南:避光、避热、密封防潮
考点2 有关混合物中物质组成的计算[以石灰石中C元素 的质量分数为例(杂质不含C元素)]
石 灰 石 中 CaCO3 的 纯 度 ( 即 CaCO3 的 质 量 分 数 ) = CaCO3的质量 石灰石中C元素的质量分数 ×100%= ×100% 石灰石的质量 CaCO3中C元素的质量分数 据此可得常用的公式: 石灰石中 C 元素的质量分数=石灰石中 CaCO3 的纯度 ×CaCO3 中 C 元素的质量分数
混合物中某元素的质量分数=混合物中纯净物的纯度×纯 净物中该元素的质量分数。
►
类型四
有关混合物组成的计算
图17-3是兴农化肥厂包装袋标签上的部分文字。请你 通过计算填空: 尿素:[CONH22] 净重:50 kg 含氮量:42% 兴农化肥厂 图17-3 3∶4∶7∶1 (1)尿素中碳、氧、氮、氢元素的质量比是_____________。 90% (2)这种化肥实际含尿素的质量分数为________(结果精确 到1%)。
►
类型三
标签中化学式的计算
上图是已破损的维生素C(简写Vc)说明书部分信息。已知维 生素C由碳、氢、氧三种元素组成。请回答: (1)Vc中碳、氢元素的质量比为______; (2)Vc的化学式为______; (3)小辉妈妈每天服用该Vc片剂,小辉建议妈妈可食用西红 柿来代替Vc片,若100 g西红柿含Vc30 mg,则小辉妈妈每天食 用西红柿______g即可达到服用上述Vc片的效果。
►
类型一
根据化学式的简单计算
例1 媒体近日报道:市面上部分方便面遭到塑化剂污染,长 期接触塑化剂可引起血液系统、生殖系统损害,其中,塑化剂 (DMP)化学式为C10H10O4。求: 194 (1)DMP的相对分子质量为________; 60∶5∶32 (2)DMP中C、H、O三种元素的质量比为_______________; 32.99% (3)DMP中氧元素的质量分数为(结果精确到0.01%)_______。
已知NH4NO3 和KH2PO4 固体混合物中氮元素的质量 分数为28%,则混合物中KH2PO4的质量分数为( ) A.20% B.25% C.85% D.80%
九质量的计算 物质组成的 有关化合物里各元素的质量比的计算 简单计算 有关化合物里元素的质量分数的计算 有关混合物中物质组成的计算
考点聚焦
考点1 有关化学式的简单计算(以AaBb为例)
AaBb 的相对分子质量=a×A 的相对原子质量+b×B 的相 对原子质量 A元素的质量 a×A的相对原子质量 = B元素的质量 b×B的相对原子质量 a×A的相对原子质量 A 元素的质量分数= ×100% AaBb的相对分子质量 A 元素的质量=物质 AaBb 的质量×A 元素的质量分数
