关于气体摩尔体积的计算
气体摩尔体积的计算共17页

3、掌握阿伏加德罗定律及其简单的推论
1同温同 V1 压 N1 n1
V2 N2 n2
2同温同 1 2压 M M1 2 D相对密
3同温同P1体 N积 1 n1
P2 N2 n2(二)Fra bibliotek型❖1、标准状况下气体体积、气体质量、气体物 质的量、气体分子数之间的相互换算。
2、求气体的相对分子质量
• 例1、 在标准状况下,测得1.92g某气 体的体积为672mL。计算此气体的相对 分子质量。
• (2)求混合气体中各组分的体积分数 及质量分数
• 例6、0.5molH2和0.5molO2在标准状况 下混合,求混合气中H2和O2所占的体积 分数及质量分数。
课堂练习
• 1. 150℃时碳酸铵完全分解产
• 生的气体混合物,其密度是相
• 同条件下氢气密度的( )
〖(NH4)2CO3=2NH3+CO2+H2O〗
• 生成9.6g C和7.2g D及另一气体E,已
• 知E的密度是H2密度的15.5倍,则气体 • E在标准状况下的体积是( )
• A. 2.24L
B. 4.48L
• C. 5.6L
D. 11.2L
• 4. 同温同压下,x g的甲气体与y g的乙气体占有相同 的体积,则x:y的值可以表示( )
• A. 甲与乙的相对分子质量之比
• 物质的量、气体体积、气体摩尔体积 之间的关系
n=V/Vm
1关系图
m M n NA
M
NA
N
Vm Vm
V(状况 )
2标准状 nV V 况 m2下 .4 2L V m o 1 l
关于气体摩尔体积的计算
(一)依据
1、准确理解物质的量、摩尔、摩尔质 量、气体摩尔体积等概念。
气体摩尔体积

气体摩尔体积
气体摩尔体积通常用Vm表示,计算公式n=V/Vm,Vm表示气体摩尔体积,V表示体积,n表示物质的量。
1、定义:单位物质的量的气体所占的体积叫做气体摩尔体积。
2、公式:Vn=V/n,摩尔体积等于体积除以摩尔质量,但是注意在标准状况(0℃、101kPa)下,气体摩尔体积(Vm)约为22.4L/mol。
对1mol任何气体所占的体积都约是22.4 L的理解:
(1)标准状况(简称标况):指气体在0℃、100 kPa下的状态。
温度越高,体积越大;压强越大,体积越小。
故在非标况下,其值不一定就是“22.4 L”。
但若同时增大压强,升高温度,或是降低压强和温度,1摩尔任何气体所占的体积有可能为22.4升。
(2)1mol气体在非标准状况下,其体积可能为22.4 L,也可能不为22.4 L。
如在室温(20℃,一个大气压)的情况下气体的体积是24L。
(3)气体分子间的平均距离比分子的直径大得多,因而气体体积主要决定于分子间的平均距离。
在标准状况下,不同气体的分子间的平均距离几乎是相等的,所以任何气体在标准状况下气体摩尔体积都约是22.4 L/mol。
(4)此概念应注意:气态物质;物质的量为1mol;气体状态为0℃和100 kPa(标况);22.4 L体积是近似值;Vm的单位为L/mol和m3/mol。
(5)适用对象:纯净气体与混合气体均可。
气体摩尔体积计算

气体摩尔体积计算
气体摩尔体积是指在标准大气压和常温下,一摩尔气体所占据的体积大小。
其计算式为:
V_m = V/n
其中,V_m表示气体摩尔体积,V表示气体的体积,n表示气体的摩尔数(单位为mol)。
在标准大气压和常温下,每摩尔气体所占据的体积大小为22.4 L,因此,可以通过以下公式计算气体的摩尔数:
n = V/22.4
例如,如果一个气体占据的体积大小为44.8 L,则其所含摩尔数为:
n = 44.8/22.4 = 2 mol
因此,该气体的摩尔体积为:
V_m = V/n = 44.8/2 = 22.4 L/mol
需要注意的是,气体摩尔体积的计算式仅适用于标准大气压和常温下的气体。
如果气体的温度或压力发生变化,则其摩尔体积也会发生变化,需要使用相应的公式进行计算。
高中化学气体的摩尔体积计算技巧解析

高中化学气体的摩尔体积计算技巧解析在高中化学学习中,计算气体的摩尔体积是一个常见的考点。
掌握好摩尔体积的计算技巧,不仅可以帮助我们解题,还能加深对气体性质的理解。
本文将介绍一些常见的摩尔体积计算技巧,并通过具体例子进行说明,帮助高中学生和他们的父母更好地理解和应用。
一、摩尔体积计算的基本原理摩尔体积是指在标准状态下,1摩尔气体所占的体积。
标准状态是指气体温度为273K(0℃)和压强为101.3kPa(1atm)的状态。
根据理想气体状态方程PV=nRT,其中P为气体压强,V为气体体积,n为摩尔数,R为气体常数,T为气体的绝对温度。
可以得出摩尔体积的计算公式为 V = (nRT)/P。
二、摩尔体积计算的常见题型1. 已知气体的摩尔数、温度和压强,求气体的体积。
例题:有0.5摩尔的氧气,温度为27℃,压强为100kPa,求氧气的体积。
解析:根据摩尔体积的计算公式 V = (nRT)/P,代入已知数据得 V = (0.5mol ×8.31J/(mol·K) × (27+273)K)/(100kPa × 1000Pa/kPa) = 11.85L。
2. 已知气体的体积、温度和压强,求气体的摩尔数。
例题:某气体的体积为10L,温度为300K,压强为150kPa,求气体的摩尔数。
解析:根据摩尔体积的计算公式 V = (nRT)/P,将已知数据代入得 10L = (n ×8.31J/(mol·K) × 300K)/(150kPa × 1000Pa/kPa)。
整理得到 n = (10L × 150kPa ×1000Pa/kPa)/(8.31J/(mol·K) × 300K) ≈ 60.24mol。
3. 已知气体的体积、摩尔数和压强,求气体的温度。
例题:某气体的体积为5L,摩尔数为2mol,压强为200kPa,求气体的温度。
气体摩尔体积的计算
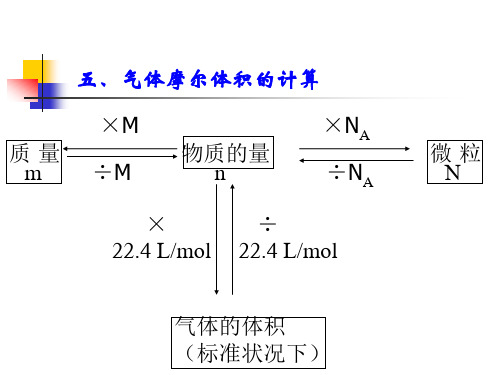
质量 m
×M ÷M
物质的量 n
×NA ÷NA
×
÷
22.4 L/mol 22.4 L/mol
微粒 N
气体的体积 (标准状况下)
五、气体摩尔体积的计算
(一氨在标准状态时的体积是多少升?
五、气体摩尔体积的计算
(二)、求式量
五、气体摩尔体积的计算
(三)、有关化学方程式的计算
△ MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
质量比:87 146
126 71
36
被氧化HCl
73
分子数比:1 4
11
2
2
物质的量比:1 4
11
2
2
体积关系:1mol 4mol
1mol 22.4L 2mol (标准状况)
2mol
五、气体摩尔体积的计算
五、气体摩尔体积的计算
将10.6gNa2CO3加入到足量盐酸 中,并将生成的气体全部通入溶有
0.50mol Ca(OH)2的溶液中,
充分反应后可得到沉淀
g。
作业
1、实验室利用MnO2与浓HCl反应制取 Cl2,若制取标准状况下的Cl23.36升,则 被氧化的盐酸的物质的量为多少摩尔,需 MnO2多少克?
A.11.2L B.5.6L C.22.4L D.16.8L
五、气体摩尔体积的计算
取50mLNa2CO3和Na2SO4的混合溶液, 加入过量的BaCl2溶液后得到14.51g白色 沉 淀 , 用 过 量 稀 HNO3 处 理 后 沉 淀 量 减 少到4.66g,并有气体放出。试计算: (1)原混合溶液中Na2CO3和Na2SO4的 物质的量。 (2)产生的气体在标准状况下的体积。
气体摩尔体积及阿伏伽德罗定律和物质的量浓度计算

单位:L/mol 定义:1摩尔任何气体在标准状况下的体积都约为22.4升 符号:Vₘ 适用范围:适用于气体,不适用于液体、固体
计算公式:V=n×Vm 解释:V表示气体的摩尔体积,n表示物质的量,Vm表示摩尔体积常数 适用范围:适用于标准状况下的气体,不适用于非气体物质 注意事项:计算时需注意单位换算,如体积单位为升,物质的量单位为摩尔
物质的量浓度与阿伏伽德罗定律之间存在 密切关系,可以通过阿伏伽德罗定律推导 出来。
阿伏伽德罗定律表明,在等温、等压条 件下,气体的体积与物质的量成正比, 因此物质的量浓度与阿伏伽德罗定律之 间存在反比关系。
汇报人:XX
之间的距离。
添加标题
计算气体分子的平 均摩尔质量:利用 阿伏伽德罗定律可 以计算气体的平均 摩尔质量,这对于 确定气体的化学性 质和物理性质非常
重要。
添加标题
PART THREE
物质的量浓度是指单位体积溶 液中所含溶质的物质的量
常用单位为mol/L或mol/m³
计算公式为:c = n/V,其中n 为溶质的物质的量,V为溶液 的体积
添加标题
添加标题
添加标题
添加标题
适用于理想气体,不适用于真实气 体。
适用于温度和压强不变的情况。
物质的量与微粒数的关系:n = N/NA
物质的量与质量的关系:m = n*M
物质的量浓度与物质的量之间 的关系:c = n/V
气体摩尔体积与阿伏伽德罗定 律的关系:V = n*Vm
计算气体分子数: 利用阿伏伽德罗 定律可以计算一 定体积的气体所 含的分子数。
适用于标准状况下的气体
适用于气体物质,不适用于液体或 固体
添加标题
添加标题
适用于气体混合物
化学气体的摩尔体积计算练习题及

化学气体的摩尔体积计算练习题及答案解析化学中,气体的物理性质是非常重要的研究内容之一。
其中之一就是气体的摩尔体积计算。
摩尔体积是指1摩尔气体所占据的体积。
在理想气体状态下,摩尔体积可以根据气体的物质量和气体分子的摩尔质量来计算。
下面是几道常见的摩尔体积计算练习题及答案解析。
练习题一:某种气体在标准状态下,物质量为20g,摩尔质量为40g/mol。
求该气体的摩尔体积。
解析:首先,我们需要知道在标准状态下,气体的摩尔体积为22.4 L/mol。
根据这个信息,我们可以得到以下计算公式:摩尔体积 = 标准摩尔体积 * (物质量 / 摩尔质量)代入题目中的数值,可以得到:摩尔体积 = 22.4 L/mol * (20g / 40g/mol)摩尔体积 = 11.2 L答案:该气体的摩尔体积为11.2 L。
练习题二:某气体占据了100 mL的体积,在标准状态下,该气体的摩尔质量为32g/mol。
求该气体的物质量。
解析:根据题目中给出的信息,我们可以使用以下计算公式来计算物质量:物质量 = 摩尔质量 * (摩尔体积 / 标准摩尔体积)代入题目中的数值,可以得到:物质量 = 32g/mol * (100 mL / 22.4 L/mol)物质量 = 14.29g答案:该气体的物质量为14.29g。
练习题三:某种气体在标准状态下的摩尔体积为15 L,摩尔质量为36g/mol。
求该气体的物质量。
解析:与练习题二类似,我们可以使用以下计算公式来计算物质量:物质量 = 摩尔质量 * (摩尔体积 / 标准摩尔体积)代入题目中的数值,可以得到:物质量 = 36g/mol * (15 L / 22.4 L/mol)物质量 = 24.11g答案:该气体的物质量为24.11g。
练习题四:某种气体在标准状态下,物质量为50g,摩尔质量为28g/mol。
求该气体的摩尔体积。
解析:根据题目中给出的信息,我们可以使用以下计算公式来计算摩尔体积:摩尔体积 = 标准摩尔体积 * (物质量 / 摩尔质量)代入题目中的数值,可以得到:摩尔体积 = 22.4 L/mol * (50g / 28g/mol)摩尔体积 = 40 L答案:该气体的摩尔体积为40 L。
第二次课气体摩尔体积的计算

气体摩尔体积(V m)①定义:在标准状况下(0℃,101kPa时),1摩尔气体所占的体积叫做气体摩尔体积。
②定义公式为:③数值:气体的摩尔体积约为22.4升/摩(L/mol)。
④注意:对于气体摩尔体积,在使用时一定注意如下几个方面:一个条件(标准状况,符号SPT),一个对象(只限于气体,不管是纯净气体还是混合气体都可),两个数据(“1摩”、“约22.4升”)。
如“1mol氧气为22.4升”、“标准状况下1摩水的体积约为22.4升”、“标准状况下NO2的体积约为22.4升”都是不正确的。
⑤理解:我们可以认为22.4升/摩是特定温度和压强(0℃,101kPa)下的气体摩尔体积。
当温度和压强发生变化时,气体摩尔体积的数值一般也会发生相应的变化,如273℃,101kPa时,气体的摩尔体积为44.8升/摩。
5.阿伏加德罗定律①决定物质体积的三因素:物质的体积由物质的微粒数、微粒本身体积、微粒间的距离三者决定。
气体体积主要取决于分子数的多少和分子间的距离;同温同压下气体分子间距离基本相等,故有阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
反之也成立。
②阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
③阿伏加德罗定律及推论适用的前提和对象:可适用于同温、同压的任何气体。
6.阿伏加德罗定律的有关推论:(其中V、n 、p、ρ、M分别代表气体的体积、物质的量、压强、密度和摩尔质量。
)①同温同压下:;②同温同体积:。
标准状况下气体密度的计算根据初中所学知识,密度=质量÷体积,下面我们取标准状况下1mol某气体,则该气体的质量在数值上等于摩尔质量,体积在数值上等于摩尔体积,所以可得如下计算公式:标况下气体的密度(g·L-1)=气体的摩尔质量(g·mol-1)÷标况下气体的摩尔体积(L·mol-1)。
气体摩尔体积练习一、填空1.决定一定量气体体积大小的主要因素是()A.气体分子的质量B.气体分子的大小C.气体所含原子数的多少D.气体分子间平均距离大小2.下列说法正确的()A.任何情况下,气体摩尔体积都是22.4Lmol-1B.非标准状况下,1mol任何气体的体积不可能为22.4LC.22.4L任何气体中都约含有6.02×1023个分子D.0.1molH2、0.2molO2、0.3moN2和0.4molCO2组成的混合气体在标准状况下所占体积,也约为22.4L3.下列说法中正确的是()A.含0.1 mol BaCl2的溶液中Cl-数为0.2 N AB.22 g CO2所含有的分子数为0.5 N AC.11.2L CO2所含有的分子数为0.5 N AD.常温下N A个Cl2分子所占有的体积为22.4L4.标准状况下,32g某气体的分子数目与22 g CO2的分子数目相同,该气体M为( )A.32B.32 g/ molC.64g/ molD.645.下列物质中,所含分子数相等的是()A.等体积的H2和O2B.14gCO和0.5molO2C.22.4LH2和32gO2D.0.25molO2和5.6LH2S气体6.有一真空储气瓶,净重500g,在同温同压下,充满氧气后重508g,装满另一种气体A时重511g,则A的相对分子质量为()A .44B .48C .64D .717.在相同条件下,两个体积相等的容器,一个充满一氧化氮气体,另一个充满氧气和氮气的混合气体,这两个容器内一定具有相同的()A.原子总数B.质子总数C.分子总数D.质量8.在相同温度下,相同质量的下列气体分别通入相同容积的容器中,容器内压强最小的是()A.HF B.Ar C.SO2D.Cl2在标准状况下,下列四种气体的关系中,从大到小的是()9.①6.72LCH4②3.01×1023个HC1 分子③13.6gH2S ④0.2molNH3,A.体积④>①>②>③B.密度②>③>④>①C.质量②>③>①>④D.氢原子数①>②>③>④10.含有H2和CO(体积比为1:2)的混合气体VL,当其完全燃烧时,需相同条件下O2的体积为()A.3VL B.2VL C.VL D.0.5VL11.下列关于agH2和bgHe 的说法正确的是()A.同温同压下,H2和He的体积比是a:2bB.同温同压下,若a=b,则H2与He的物质的量之比是1:1C.体积相同时,He 的质量一定大于H2的质量D.同温同压下,若二者的物质的量相等,其体积也相等12.设N A代表阿伏加德罗常数,下列说法正确的是()A.2.3g金属钠变为钠离子时失去的电子数目为0.1N AB.常温常压下,11.2L氯气所含的原子数目为N AC.32g氧气的体积为22.4LD.体积相同的H2和O2含有相同的分子数13.有N2、CO、CO2三种气体,它们的质量比为1:2:2,在同温同压下它们的体积比()A.1:2:2 B.2:2:1 C.11:14:14D.7:14:1114.如果a g某气体中所含有的分子数为b,则c g该气体在标准状况下的体积是(式中N A为阿伏加德罗常数)()A.22.4bc/aN A LB. 22.4ab/cN A LC.22.4ac/ bN A LD. 22.4b/acN A L二、填空1.下列数量的各物质:(1)0.5molNH3 (2)标准状况下22.4L氦(He),(3)4。
气体的摩尔体积与分压计算

气体的摩尔体积与分压计算在化学和物理学领域中,气体的摩尔体积与分压是两个重要的概念。
摩尔体积指的是单位摩尔气体所占据的体积,而分压则是指在混合气体中每种气体所产生的压力。
在本文中,我们将详细讨论气体摩尔体积与分压的计算方法和相关理论。
一、摩尔体积的计算气体的摩尔体积可以通过摩尔体积公式进行计算。
根据理想气体状态方程,摩尔体积公式可以表示为V = V_0/n,其中V表示气体的体积,V_0表示标准摩尔体积,n表示气体的摩尔数。
标准摩尔体积是指在标准条件下,1摩尔气体所占据的体积,通常情况下为22.4升。
因此,如果我们知道气体的摩尔数,就可以通过将所给的气体体积除以摩尔数来计算摩尔体积。
需要注意的是,以上摩尔体积计算方法仅适用于理想气体的情况。
对于实际气体,由于气体分子之间存在相互作用力,摩尔体积会受到修正。
实际气体的摩尔体积可以通过实验方法获得,例如通过温度、压力和气体间距离的测量来计算。
二、分压的计算在混合气体中,每种气体所产生的压力称为分压。
分压可以通过分压公式来计算。
分压公式可以表示为P_i = P * X_i,其中P_i表示气体i的分压,P表示总压力,X_i表示气体i的摩尔分数。
摩尔分数是指气体i的摩尔数与混合气体总摩尔数之比。
如果我们知道每种气体的摩尔数和总压力,就可以通过将气体i的摩尔数除以总摩尔数,再乘以总压力来计算分压。
需要注意的是,以上分压计算方法同样适用于理想气体的情况。
对于实际气体,同样需要考虑气体分子之间的相互作用力,分压会受到修正。
三、摩尔体积与分压的关系摩尔体积与分压之间存在着一定的关系。
根据道尔顿分压定律和理想气体状态方程,可以得到P_iV_i = n_iRT,其中P_i表示气体i的分压,V_i表示气体i的摩尔体积,n_i表示气体i的摩尔数,R为气体常数,T表示温度。
由于摩尔体积V_i = V_0/n_i,将摩尔体积代入上述公式中,可以得到P_iV_0 = RT。
这个公式说明,在相同的温度和压力下,不同气体的摩尔体积是相等的。
气体摩尔体积计算

气体摩尔体积计算在气体的状态方程中,理想气体状态方程是最常用的一种,它可以用来计算气体的摩尔体积。
理想气体状态方程为:PV=nRT其中,P为气体的压强,单位为帕斯卡(Pa);V为气体的体积,单位为立方米(m^3);n为气体的摩尔数,单位为摩尔(mol);R为气体常数,其值取决于所使用的气体方程,单位为焦耳每摩尔·开尔文(J/(mol·K));T为气体的温度,单位为开尔文(K)。
为了计算摩尔体积,我们需要知道除体积以外的其他三个参数,即气体的压强、摩尔数和温度。
首先,让我们来看一个例子:假设有 2 摩尔的理想气体在 298 K 的温度下,所处的压强是 1 atm。
现在我们来计算这个气体的摩尔体积。
我们可将给定的数值代入理想气体状态方程中进行计算:PV=nRT(1 atm) * V = (2 mol) * (8.314 J/(mol·K)) * (298 K)从上面的计算过程可得到气体的摩尔体积V=0.049m^3这个例子说明了如何根据给定的压强、摩尔数和温度计算气体的摩尔体积。
但是,需要注意的是,在实际的气体状态中,气体往往不是完全符合理想气体状态方程,因此在计算摩尔体积时需要考虑修正因素。
修正因素包括压缩因子、偏离理想气体状态的修正项等。
这些修正因素使得气体在压强较高、温度较低或浓度较高时,其摩尔体积与理论计算值有所差别。
在实际应用中,我们可以根据实验数据和所研究气体的特性对摩尔体积进行修正。
摩尔体积在化学和物理学中有广泛的应用。
例如,可以通过气体摩尔体积计算气体的密度。
摩尔体积还可以用于计算气体的化学反应中的摩尔比例,例如气体溶液反应的比例关系等。
总之,摩尔体积的计算方法是根据气体的状态方程和给定的条件计算气体的摩尔体积。
在实际应用中需要考虑气体的修正因素,以便获得更精确的摩尔体积值。
摩尔体积在化学和物理学中有广泛的应用,可以用于计算气体的密度、摩尔比例等。
高一化学气体摩尔体积知识点讲解

高一化学气体摩尔体积知识点讲解在高一化学中,我们学习了很多关于气体的知识,其中涉及到摩尔体积的概念与计算方法。
摩尔体积是指在相同条件下,1摩尔气体所占有的体积。
本文将为大家详细介绍气体摩尔体积的概念、计算方法以及与其他气体性质的关系。
一、摩尔体积的概念摩尔体积是指在相同条件下,相同物质的气体具有相同的体积。
根据化学气体的理想气体状态方程PV=nRT(其中P为气体压强,V为气体体积,n为气体物质的摩尔数,R为气体常数,T为气体的绝对温度),当温度、压强和气体物质的数量都相同时,气体的体积也是相同的。
这就是摩尔体积的概念。
二、摩尔体积的计算方法气体摩尔体积的计算方法可以通过气体的摩尔数与体积之间的关系来进行计算。
当已知气体的摩尔数时,可以利用以下公式来计算气体的摩尔体积:摩尔体积(V)= 气体体积(V)/ 气体摩尔数(n)举个例子,假设有1 mol氧气,其体积为22.4 L,那么这1 mol 氧气的摩尔体积就等于22.4 L/mol。
需要注意的是,在计算摩尔体积时要注意单位的换算。
通常情况下,气体的摩尔体积的单位是L/mol,而气体的体积一般使用L 作为单位。
三、摩尔体积与其他气体性质的关系摩尔体积与其他气体性质之间存在一定的关系。
下面我们将介绍摩尔体积与气体温度、压强以及气体状态之间的关系。
1. 摩尔体积与温度的关系:根据热力学理论,摩尔体积与气体的温度成正比。
当温度升高时,气体分子的平均动能增加,分子之间的相互作用力减弱,气体的体积也会增大。
2. 摩尔体积与压强的关系:根据理想气体状态方程PV=nRT可以得出,摩尔体积与气体的压强成反比。
在常温下,当压强增大时,气体分子之间的相互作用力增大,气体分子间的距离减小,从而使得气体的体积减小。
3. 摩尔体积与气体状态的关系:不同气体的摩尔体积在相同条件下是相等的。
这是由于不同气体的摩尔体积与气体状态方程PV=nRT中的气体常数R有关。
根据理想气体状态方程可知,气体常数R与摩尔体积呈正比,因此不同气体的摩尔体积相同。
化学标准状况下气体摩尔体积公式

化学标准状况下气体摩尔体积公式下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!化学标准状况下气体摩尔体积公式详解引言在化学领域,气体的性质是研究的重点之一。
重难点八气体摩尔体积及相关计算

重难点八气体摩尔体积及相关计算【要点解读】1.气体摩尔体积的正确理解2.气体摩尔体积的适用范围气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混杂气体,如0.2 mol H2 与 0.8 mol O2 的混杂气体在标准状况下的体积约为22. 4 L 。
3.气体摩尔体积相关计算V①气体的物质的量n=V m②气体的摩尔质量M=V m·ρ=22. 4ρ(标准状况下)V③气体的分子数N=n·N A=·N AV mV④气体的质量m=n·M= ·MV m【特别提示】( 1)气体摩尔体积与温度、压强相关,标准状况下的气体摩尔体积为L·mol -1,非标准状况下的气体摩尔体积也有可能是22. 4 L ·mol-1。
(2)使用 22. 4 L ·mol- 1 时的注意事项①条件:必定为标准状况,因此使用时,必定要看清气体所处的状况。
②物质状态:必定为气体。
如水、酒精、四氯化碳等物质在标准状况下不是气体。
③数值: 22. 4 L ·mol -1是近似值。
【重难点考向一】气体摩尔体积看法理解【例 1】以下说法中正确的选项是()A. 1 mol O 2和 1 mol N 2所占的体积约为22.4 LB.标准状况下, H2的气体摩尔体积约为22.4 LC.在标准状况下, 1 mol H 2和 1 mol H 2O所占的体积都约为22.4 LD.在标准状况下, 22.4 L 由 N2、N2O组成的混杂气体中所含有的N 原子的物质的量约为 2 mol【重难点点睛】气体摩尔体积使用时注意(1)1 个条件:必定指明条件。
非标准状况下, 1 mol 气体的体积不用然是 22.4 L。
(2)1 种状态:必定为气态。
如水、酒精、SO3、CCl4等物质在标准状况下不是气体。
( 3)1 个单位:气体摩尔体积单位是L·mol-1,而不是 L。
理想气体的摩尔体积和摩尔浓度的计算方法

理想气体的摩尔体积和摩尔浓度的计算方法摩尔体积和摩尔浓度是研究理想气体性质时所用到的两个重要参数。
摩尔体积是指一个摩尔气体所占据的体积,摩尔浓度则是指单位体积内所含有的摩尔数。
对于理想气体来说,可以利用一些简单的计算方法来求解。
一、理想气体的摩尔体积计算方法理想气体的状态方程为PV=RT,其中P表示气体的压强,V表示气体的体积,R是气体常数,T表示气体的温度。
根据理想气体的状态方程,我们可以将其变形得到摩尔体积的计算公式。
首先,我们知道摩尔数n与气体的质量m和气体的摩尔质量M之间存在如下关系:n = m / M,其中m表示气体的质量,M表示气体的摩尔质量。
将这个关系式代入状态方程中,可以得到以下计算摩尔体积的公式:V = (RT) / (Pn)其中,V表示摩尔体积,R为气体常数,T为气体的温度,P为气体的压强,n为气体的摩尔数。
通过这个公式,我们可以根据给定的气体参数,计算出理想气体的摩尔体积。
二、理想气体的摩尔浓度计算方法摩尔浓度是指单位体积内所含有的摩尔数。
对于理想气体来说,摩尔浓度可以通过气体的摩尔数n和气体体积V之间的关系来计算。
摩尔浓度的计算公式如下:C = n / V其中,C表示摩尔浓度,n为气体的摩尔数,V为气体的体积。
通过这个公式,我们可以计算得到理想气体的摩尔浓度。
需要注意的是,摩尔浓度的单位通常是mol/L,摩尔体积的单位通常是L/mol。
在实际计算中,我们需要将压强、温度以及其他参量的单位统一,以保证计算结果的准确性。
总结:理想气体的摩尔体积和摩尔浓度是研究气体性质时常用的参数。
摩尔体积表示一个摩尔气体所占据的体积,摩尔浓度表示单位体积内所含有的摩尔数。
对于理想气体,可以通过状态方程来计算摩尔体积,通过摩尔数和体积之间的关系来计算摩尔浓度。
在实际计算中,需注意单位的统一以及参量的准确取值,以确保计算结果的精确性。
化学反应中的气体的摩尔比与摩尔体积的计算方法

化学反应中的气体的摩尔比与摩尔体积的计算方法在化学反应中,气体参与反应的摩尔比和摩尔体积的计算是非常重要的。
正确计算气体的摩尔比和摩尔体积可以帮助我们了解反应的化学计量关系,预测产物的生成量,并进行反应条件的优化。
本文将介绍计算气体摩尔比和摩尔体积的方法。
一、气体反应的摩尔比计算方法气体反应的摩尔比是指在反应方程式中各个气体组分之间的比例关系。
在计算气体的摩尔比时,首先需要根据反应方程式确定各个气体组分的摩尔系数。
摩尔系数是反应方程式中各分子式前面的数值,它代表了该物质参与反应时的摩尔比。
以反应A + B → C + D为例,其中A、B、C和D分别表示不同的气体物质。
反应方程式中的摩尔系数分别为a、b、c和d。
摩尔系数可以表示成整数,也可以表示成分数或小数。
计算摩尔比的方法如下:1. 根据反应方程式确定摩尔系数:根据反应方程式的平衡状态,确定A、B、C和D的摩尔系数a、b、c和d。
这些系数表示了各个气体在反应中的摩尔比。
2. 比较摩尔系数,得出摩尔比:比较反应方程式中各个气体的摩尔系数,得出它们之间的比例关系。
例如,如果a:b:c:d = 1:2:3:4,则气体A、B、C和D的摩尔比为1:2:3:4。
通过计算摩尔比,我们可以了解不同气体物质在反应过程中的摩尔比例,从而预测产物的生成量并优化反应条件。
二、气体反应的摩尔体积计算方法在气体反应中,摩尔体积是指气体分子数的比例关系。
通过计算摩尔体积,我们可以推断气体在反应中的摩尔比。
计算气体摩尔体积的方法如下:1. 根据理想气体状态方程确定气体的体积:根据理想气体状态方程PV = nRT,我们可以利用该方程确定气体的体积。
在计算摩尔体积时,需要确定气体的压力P、温度T和摩尔数n。
同时,我们需要知道气体的物理性质,例如气体的摩尔质量、密度等。
2. 根据反应方程式确定摩尔体积的比例关系:根据反应方程式中气体的摩尔系数,比较它们之间的比例关系,得出气体的摩尔体积的比例关系。
标况气体摩尔体积公式

标况气体摩尔体积公式在咱们学习化学的过程中,有一个特别重要的概念,那就是标况气体摩尔体积公式。
这玩意儿可是帮咱们理解气体世界的一把关键钥匙。
先来说说什么是标况。
标况就是标准状况,指的是温度为 0 摄氏度(273.15K),压强为 101.325kPa 时的情况。
在这种特定的条件下,1摩尔任何理想气体所占的体积约为 22.4 升。
这个数值,也就是咱们要说的标况气体摩尔体积啦。
那标况气体摩尔体积公式是啥呢?其实就是 Vm = V/n ,这里的 Vm 就表示标况气体摩尔体积,V 表示气体的体积,n 表示气体的物质的量。
我还记得之前给学生们讲这个知识点的时候,有个小家伙瞪着大眼睛一脸懵地问我:“老师,这到底有啥用啊?”我笑着跟他说:“这用处可大啦!比如说,咱们想知道一个气球里到底有多少气体分子,就得靠这个公式来帮忙呢!”为了让大家更好地理解这个公式,咱们来举个例子。
假设咱们有一个大罐子,里面装了 44.8 升的氧气,那这氧气的物质的量是多少呢?咱们就可以用公式来算啦。
先把体积 44.8 升除以标况气体摩尔体积22.4 升/摩尔,就能得出氧气的物质的量是 2 摩尔。
是不是一下子就清晰明了啦?在实际生活中,标况气体摩尔体积公式也有很多用处呢。
就像咱们给轮胎打气的时候,要知道打进去多少气体,就可以用这个公式来估算一下。
还有工厂里生产气体产品,也得靠它来控制产量和质量。
而且啊,这个公式还能帮助咱们理解一些神奇的现象。
比如说,为什么同样是 1 摩尔的气体,在不同的条件下体积会不一样呢?这就是因为温度和压强的变化会影响气体分子之间的距离,从而改变气体的体积。
学习标况气体摩尔体积公式可不能死记硬背,得真正理解它背后的原理,多做几道练习题,这样才能在遇到问题的时候轻松应对。
总之,标况气体摩尔体积公式虽然看起来有点复杂,但只要咱们用心去学,多思考多练习,就能掌握它,让它成为咱们探索化学世界的有力工具!希望大家都能跟这个公式成为好朋友,在化学的海洋里畅游无阻!。
理想气体的摩尔体积和摩尔浓度的计算

理想气体的摩尔体积和摩尔浓度的计算理想气体是指在高温和低压下,分子之间几乎没有相互作用力,其行为可以用理想气体方程描述的气体。
在研究理想气体时,摩尔体积和摩尔浓度是两个重要的物理量。
本文将介绍理想气体的摩尔体积和摩尔浓度的计算方法。
一、摩尔体积的定义与计算公式摩尔体积是指摩尔物质所占的体积,常用单位是升/摩尔。
摩尔体积可以通过计算气体的体积和物质的摩尔数的比值来获得。
对于理想气体,摩尔体积可以用理想气体方程来计算。
理想气体方程可以表示为:PV = nRT其中,P是气体的压强,V是气体的体积,n是气体的摩尔数,R是气体常数,T是气体的温度。
对于给定的气体样品,如果知道其压强、温度和摩尔数,就可以通过理想气体方程计算出摩尔体积。
例如,假设一个气体样品的压强为2 atm,体积为10 L,温度为273 K,摩尔数为2 mol。
代入理想气体方程,可以得到:(2 atm) * (10 L) = (2 mol) * (0.0821 L·atm/(mol·K)) * (273 K)从中解出体积V,即可得到摩尔体积。
二、摩尔浓度的定义与计算公式摩尔浓度是指摩尔物质在溶液或气体中的单位体积或体积分数,常用单位是mol/L。
在研究气体反应的速率、平衡等方面,摩尔浓度是一个重要的参数。
摩尔浓度可以通过计算溶液或气体中摩尔物质的摩尔数与体积的比值得到。
对于气体的摩尔浓度,可以通过摩尔体积来计算。
假设一个气体样品的体积为20 L,摩尔数为4 mol,那么其摩尔浓度可以计算如下:摩尔浓度 = 摩尔数 / 体积摩尔浓度 = 4 mol / 20 L = 0.2 mol/L同样地,对于溶液的摩尔浓度,也可以通过摩尔物质的摩尔数与溶液体积的比值来计算。
三、摩尔体积和摩尔浓度在化学反应中的应用摩尔体积和摩尔浓度在化学反应中具有重要的应用价值。
通过控制反应物的摩尔体积和摩尔浓度,可以实现反应速率的调控,促进化学反应的进行。
气体标准体积换算公式

气体标准体积换算公式气体是物质存在的一种状态,其特点是无固定形状和体积,能自由流动。
在实际生活和工业生产中,我们经常需要对气体的体积进行换算和计算。
而气体的标准体积换算公式就是我们进行这些计算的重要工具之一。
首先,让我们来了解一下气体的标准状态。
在标准大气压下,0摄氏度的温度,1摩尔的气体体积为22.4升,这就是气体的标准状态。
而在实际情况中,气体的温度、压力和体积都会随着环境的变化而变化,因此需要进行换算。
对于气体的标准体积换算,我们可以利用以下公式进行计算:V = nRT/P。
在这个公式中,V代表气体的体积,n代表气体的摩尔数,R代表气体常数,T代表气体的温度(单位为开尔文),P代表气体的压力。
首先,我们来看一下气体的摩尔数。
摩尔数是指单位物质的量,通常用n来表示,单位为摩尔。
在进行气体体积换算时,我们需要先确定气体的摩尔数,这通常可以通过化学方程式中的系数来确定。
接下来是气体常数R。
气体常数是一个物理常数,通常用R来表示。
在不同的单位制下,气体常数的数值也会有所不同。
在国际单位制下,气体常数的数值约为8.31 J/(mol·K)。
温度T是气体体积换算中的重要参数。
在进行计算时,需要将温度转换为开尔文(K)单位,公式为K=℃+273.15。
最后是气体的压力P。
压力是气体体积换算中另一个重要的参数。
在实际应用中,常常需要将不同压力下的气体体积进行换算,这就需要利用气体的状态方程进行计算。
通过以上公式,我们可以对气体的体积进行换算。
在实际应用中,我们常常需要根据具体情况来确定气体的摩尔数、温度、压力等参数,然后利用气体体积换算公式进行计算。
需要注意的是,在进行气体体积换算时,我们需要保证所使用的参数单位是一致的。
比如,在使用气体常数时,需要保证摩尔数的单位是摩尔,温度的单位是开尔文,压力的单位是帕斯卡,体积的单位是升。
只有在保证参数单位一致的情况下,我们才能得到准确的换算结果。
总之,气体的标准体积换算公式是进行气体体积换算的重要工具,通过合理地利用这个公式,我们可以准确地进行气体体积的换算和计算。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
作业:127页 作业127页:4. 5. 6.
4. 5. 6.
关于气体摩尔体积的计算
关于气体摩尔体积的计算
关系: m
×M ÷M
n
×Vm ÷Vm
V
÷NA ×NA
N
例1. 在标准状况下,2.24L氧气的质量是多少? 在标准状况下,2.24L氧气的质量是多少 氧气的质量是多少?
•解: 2的相对分子质量是32, O 的相对分子质量是32,
O2的摩尔质量是32g/mol, 的摩尔质量是32g/mol, n = V/Vm = 2.24L / 22.4 L.mol-1 = 0.1mol m = M .n = 32g/mol × 0.1mol = 3.2g 在标准状况下, 氧气的质量是3.2g。 答:在标准状况下,2.24L 氧气的质量是 。
即 1 / 1 = 0.2mol / n( H2 )
n( H2 )=1 × 0.2 mol =0.2 mol V( H2 )= n( H2 ) × n(
Vm =0.2mol × 22.4 L/mol =4.48 L
答:在标准状况下,还原15.9g 氧化铜,需要 在标准状况下,还原15.9g 氧化铜, 氢气4.48L 氢气4.48L
•解: 的相对分子质量是79.5g, CuO的相对分子质量是 CuO的相对分子质量是79.5g,
CuO的摩尔质量 CuO的摩尔质量
是79.5g/mol。 79.5g/mol。 n(CuO)= m ( CuO )/M(CuO) CuO) = 15.9g / 79.5 g.mol-1
=0.2 mol
CuO + H2 = Cu + H2O 1 1 0.2mol n( H2 ) n( n( v(CuO)/v(H2)= n( CuO )/n ( H2 ) CuO)/v(
例2. 在标准状况下,7.2L 氨气的质量是 在标准状况下,
5.5g,计算氨气的相对分子质量。 5.5g,计算氨气的相对分子质量。
•解:标准状况下,气体的密度等于气体的摩尔质量 标准状况下,
除以气体摩尔体积。 除以气体摩尔体积。
ρ M ρ=M / Vm M = ρ. Vm =(m/V ) . Vm
= (5.5g/7.2L) × 22.4 L/mol ) =17 g/mol
则氨气的相对分子质量是17. 则氨气的相对分子质量是 氨气的相对分子质量是17. 答:氨气的相对分子质量是
例3.在实验室中还原15.9g氧化铜,在标准状况下, 在实验室中还原15.9g氧化铜 在标准状况下, 氧化铜,
需要氢气的体积是多少? 需要氢气的体积是多少?
