过渡金属的习题
大学无机化学第20章 过渡金属元素习题答案 20120319

第20章d区过渡金属元素习题解答1.为什么过渡元素中,同族元素从上到下高氧化态物质的稳定性升高,而过渡后的p区元素同族自上而下低氧化态的物质趋于稳定?2.自ⅣB族到ⅦB族元素的最高氧化态在溶液中为什么不存在简单的离子M4+、M5+、M6+?3.为什么d区金属的密度、硬度、熔点、沸点一般较高?4.过渡元素的氧化态分布有何特点?5.由MnO2制备锰酸盐应在酸性介质还是碱性介质中进行?欲把Mn2+ 离子氧化为MnO4–离子应选用何种氧化剂?6.Cr3+与Al3+在生成化合物方面有何异同?7.根据下列实验现象,写出相应的化学反应方程式:(1)在酸性K2Cr2O7溶液中加入Na2SO3溶液,颜色由橙红变蓝绿色,此时加入乙醚,并用HNO3酸化,溶液变为深蓝色。
(2)黄色的BaCrO4溶在浓盐酸中,得到的是绿色溶液,写出化学方程式,说明颜色变化。
(3)Fe2(SO4)3溶液与Na2CO3溶液作用,得不到Fe2(CO3)3。
(4)在水溶液中用Fe3+与KI作用,不能制得FeI3。
(5)向Fe3+溶液中加入KSCN后出现红色,若再向溶液中加入Fe粉或NH4F晶体,红色又消失;(6)向CoCl2溶液中加入NaOH溶液,先析出粉红色沉淀,沉淀很快又转为灰绿色至褐色。
8.写出下列反应的化学方程式:(1)TiO2(s) + BaCO3(s) → ;(2)V2O5(s) + HCl(aq) → ;(3)Cr2O72–(aq) + Ag+(aq) + H2O(l) → ;(4)[Cr(OH)4]–(aq) + H2O2(l) + OH–(aq) → ;(5)MnO4–(aq) + Fe2+(aq) + H+(aq) → ;(6)MnO2(s) + HCl(aq,浓) → ;(7)Cr3+(aq) + MnO4–(aq) + H2O(l) → ;(8)Co2O3(s)+ HCl (aq,浓) → ;(9)K3[Fe(CN)6] (aq) + Fe2+(aq) → ;(10)PO43–(aq) + (NH4)2MoO4(aq) + H+(aq) → ;(11)PdCl2(aq) + CO(g) + H2O(l) → ;(12)Pt(s) + HNO3(aq) + HCl(aq) → 。
高考复习(化学)专项练习:非选择题专项练【含答案及解析】(一)

非选择题专项练(一)1.过渡金属及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价层电子轨道表示式为;与钛同周期的过渡元素中,基态原子的成对电子数与钛相同的有种;金属钛是一种新兴的结构材料,其硬度比金属镁和铝大的原因是。
(2)在浓的TiCl3的盐酸中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为2∶4,则由该配合离子组成的晶体化学式还可以写为。
(3)航母螺旋桨主要用铜合金制造。
含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
①M所含元素的第一电离能最大的是(用元素符号表示)。
②X化合物中中心原子铜的配位数是,上述反应中断裂和形成的化学键有。
(4)金红石(TiO2)是含钛的主要矿物之一,其晶胞结构(晶胞中相同位置的原子相同)如图所示。
①A、B、C、D 4种粒子,其中钛原子是(填字母)。
②若A、B、C的原子坐标参数分别为A(0,0,0)、B(0.69,0.69,1)、C(1,1,1),则D的原子坐标参数为D(0.19,,);该化合物的密度为 g·cm-3(用含a、c、N A的代数式表示)。
2.钛铁矿(FeTiO3)中往往含有Fe2O3、MgO、CaO、Al2O3、SiO2等杂质。
一种硫酸法制取白色颜料钛白粉(TiO2)的生产工艺如图所示:已知:Ⅰ.酸浸后,钛主要以TiOSO4形式存在。
Ⅱ.强电解质TiOSO4在溶液中仅能电离出S O42-和一种阳离子。
Ⅲ.H2TiO3不溶于水和稀酸。
(1)为提高酸浸速率,一般采取的措施是。
(写两条)(2)滤渣①的主要成分是。
(3)酸浸过程中,写出含钛化合物发生反应的化学方程式:。
(4)加入铁粉的目的是还原体系中的Fe3+。
为探究最佳反应条件,某实验室做如下尝试。
图1图2①在其他条件不变的情况下,体系中Fe(Ⅲ)含量随pH的变化如图1所示,试分析在pH介于4~6之间时,Fe(Ⅲ)含量基本保持不变的原因:。
过渡金属的习题

交作业时间说明:第13周周五20160520:过渡的第一、二部分和稀有气体;第15周周五20160603:过渡的第三部分过渡的第四部分(不交)过渡金属的习题第一部分:元素通性1. 第一过渡周期的二价金属离子的半径如下,写出他们在正八面体弱场中的d电子排布并2. 试从结构的观点予以解释:(1)第一过渡系金属水合离子颜色及含氧酸根颜色产生的原因;(2)同族的过渡金属元素的金属性、氧化还原稳定性变化规律,与碱金属、碱土金属的区别;(ⅢB-ⅤB)第二部分:IIIB-VIIB族为主1.根据以下连续性实验事实说明发生了什么反应,试用反应方程式解释。
(1)打开装有TiCl4的瓶塞,立即冒白雾;(2)向TiCl4溶液中加入浓盐酸和Zn,溶液显紫色;(3)缓慢加入NaOH使溶液呈碱性,析出紫色沉淀;(4)沉淀经过滤分离后,用硝酸溶解,再用稀碱溶液处理,得白色沉淀;(5)将白色沉淀过滤并灼烧后,与等物质的量的MgO共熔。
2.回答下列问题:(1)为什么TiO2+(aq)无色,而TiI4为暗棕色晶体。
(2)如何鉴别TiO2+离子和Ti3+离子?(3)从热力学角度看,[Ti(H2O)6]2+、[Ti(H2O)6]3+、[Ti(H2O)6]4+离子中,哪个或哪几个不能稳定存在?为什么?3. Sc2O3在哪些性质上与Al2O3相似,为什么?最近有一篇很火的Science的论文,主要是Al 电池的研究,预测一下是否可以进行Sc电池的研究?4.微观角度解释现象:(1)向V2+(aq)中逐滴加入KMnO4溶液,观察颜色变化。
(2)浓氨水逐滴加入含NH4Cl的CrCl3溶液中,颜色变化:紫红→浅红→橙红→橙黄→黄色的变化。
(3)Mn2+的半径为80pm,Mg2+为66pm,但MnCO3的分解温度低于MgCO3。
(4)溶液中含有NH4+时,更利于Mn和水的反应。
5. 结合反应式解释现象:(1)酸性钒酸盐溶液中通入SO2时生成一深蓝色溶液。
金属有机化学习题
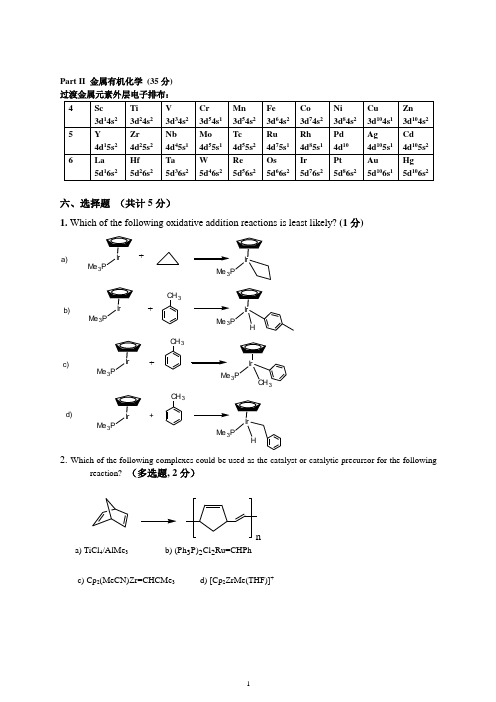
Part II 金属有机化学 (35分) 过渡金属元素外层电子排布:六、选择题 (共计5分)1. Which of the following oxidative addition reactions is least likely? (1分)Me 3PMe 3PMe 3PHMe 3PCH 3Me 3PMe 3PMe 3PIr Me 3PH+a)b)c)d)+++CH 3CH 3CH 32. Which of the following complexes could be used as the catalyst or catalytic precursor for the followingreaction? (多选题, 2分)na) TiCl 4/AlMe 3b) (Ph 3P)2Cl 2Ru=CHPhc) Cp 2(MeCN)Zr=CHCMe 3d) [Cp 2ZrMe(THF)]+3. Which of the following species could be used as the catalyst or catalytic precursor for the following reaction? (多选题, 2分)+H2a) IrCl(PPh3)3b) IrH3(PPh3)3c) RuHCl(PPh3)3d) NaH七、推导计算题(共计10分)1. On the basis of the 18 electron rule, identify the first-row transition metal for each ofthe following: (6 points)a) [M(CO)7]+; b) H3CM(CO)5; c) M(CO)2(CS)(PPh3)Br; d) [(η3-C3H5)(η3-C5H5)M(CO)]-; e) (OC)5M=C(OCH3)(C6H5); f) [(η4-C4H4)(η5-C5H5)M]+; g) [M(CO)4I(dppe)]-例e) 18 – 5x2 – 4 = 4, M(II), d4, Cr;2. On the basis of the 18 electron rule, determine the expected charge on the following: (4 points)a) [Co(CO)3]z; b) [Ni(CO)3(NO)]z (contains linear NO); c) [Ru(CO)4(CMe3)]z; d) (η3-C3H5)V(CNCH3)5]z; e) [(η5-Cp)Fe(CO)3]z例b) 18 – 3x2 – 2 = 10, Ni(0), d10, z = 0八、Provide a mechanism for the following transformation. (每题4分,共计16分)a) When A is treated with a Pd(0) catalyst and methyl acrylate, B is formed. When C is treated with a Pd(0) catalyst and methyl acrylate, D is formed. Please provide a mechanism for each reaction and explain the difference in the reaction pathways.b)ICOOH OO+34o 52%23.3c)R+PhArI+ArRPh34NaHCO3d)e)f) The Pd-catalyzed reaction of aryl halides with alcohols under an atmosphere of CO affords esters:Sketch a catalytic cycle for this reaction. You may assume the formation of small but usefulequilibrium concentrations of Et 3NHOMe.九、Predict the metal-containing products of the following reactions. (每题1分,共计4分)例,Ph 3P PtPh 3P+?IPh 3PPt PPh 3Ia)PCy 3RuPCy 3Cl OCH+Ph( )b)Mo NO CO++MeLi( )c)+IrPh 3PPPh 3PhBr( )d)NPPh 2PPh 2Pt +PhNH 22+BF 4-( )。
化学自主招生专题习题8 铜锌 铁系 过渡金属元素

宁乡一中自主招生培训专题训练8铜锌铁系过渡金属元素一:简答题1:(09北大)Ag为什么能置换出HI(aq)和H2S(aq)中的氢?2:用反应方程式说明下列现象:(1)铜器在潮湿空气中会慢慢生成一层铜绿;(2)金溶于王水中;(3)在CuCl2(4)当SO2通入CuSO4与NaCl的浓溶液时析出白色沉淀;(5)往AgNO3溶液滴加KCN溶液时,先生成白色沉淀而后溶解,再加入但加入少许Na2S溶液时却析出黑色Ag2S沉淀。
3:1:焊接铁皮时,常先用浓ZnCl2溶液处理铁皮表面;2:HgS不溶于HCl,HNO3和(NH4)2S中而能溶于王水或Na2S中,4:解释下列问题:(1)在Fe3+离子的溶液中加入KSCN(2)为什么Fe3+盐是稳定的?而Ni3+盐尚未制得?(3)为什么不能在水溶液中由Fe3+盐和KI制得FeI3?(4)变色硅胶含有什么成分?为什么在干燥的时候呈蓝色,吸水后变成粉红色?5:自来水厂用绿矾和氯气一起净水,写出有关反应的离子方程式:6:根据《本草纲目》有关记载:“水银乃至阴之毒物,因火煅丹砂而出,加以盐、以硫磺升而为银朱”。
写出主要化学反应方程式。
4)2CO3CaCO3和CaSO3都是难溶的电解质,试说明原因。
五、将锌粒投入CuSO4溶液后,常常可以观察到这样的现象.锌粒表面有黑色粉物生成,并出现少量气泡。
静止2~3小时,黑色粉状物大量增加。
经过滤后得到的部分黑色粉状物用蒸馏水洗涤5~6次,至少量洗液中滴入过量氨水无颜色变化止。
凉干黑色粉状物后进一步实验;取少量黑色粉状物于试管中,滴加适量的稀盐酸即出现紫红色粉状物,并伴有极少量的气泡,溶液显淡黄绿色。
吸取淡黄绿色溶液少许至另一洁净试管中,加入过量氨水,生成蓝色溶液。
1.黑色粉状物的组成是什么?2.生成黑色粉状物的原因是什么?3.如欲在锌拉与CuSO4溶液的反应中观察到表面析出的紫红色铜,应采取什么措施?六:高铁(Ⅵ)酸盐是新一代水处理剂,其制备方法有:①次氯酸盐氧化法(湿法);②高温过氧化物法(干法);等。
第二十三章_过渡金属(一)课后习题参考答案

第二十三章过渡金属(一)课后习题参考答案4解:(1) 因TiCl4吸水后强烈水解产生HCl,导致冒白烟. TiCl4 + H2O == H4TiO4↓+ 4HCl ↑(2) 因Ti(Ⅳ)被Zn还原成Ti3+而显紫色. 2TiCl4 + Zn == 2TiCl3 + ZnCl2(3) 因Ti3+与OH-形成紫色沉淀Ti(OH)3. TiCl3 + 3NaOH == Ti(OH)3↓+ 3NaCl(4) Ti(OH)3溶于硝酸后被氧化为Ti(Ⅳ),遇碱生成TiO2·xH2O的白色胶状沉淀.3Ti(OH)3 + 7HNO3 == 3TiO(NO3)2 + NO↑+8H2O TiO2+ + 2OH- + H2O == H4TiO4↓5解:(1) Ti + 6HF == H2TiF6 + 2H2↑ (2) TiCl62- + NH4+ == (NH4)2TiCl6↓(黄色)(3) TiO2 + BaCO3BaTiO3 + CO2(4) V2O5 + 2NaCl + 1/2O22NaVO3 + Cl2 2NaVO3 + 2H+ == 2Na+ + V2O5 + H2O(5) V2O5 + 6HCl == 2VOCl2 + Cl2 + 3H2O V2O5 + 6NaOH == 2Na3VO4 + 3H2O(6) 2NH4VO3 V2O5 + 2NH3 + H2O7解:2VO2+ + SO2 == 2VO2+ + SO42- 2VO2+ + 3Zn + 8H+ == 2V2+ + 3Zn2+ + 4H2O VO2+ + V2+ + 2H+ == 2V3+ + H2O9解:(1) (NH4)2Cr2O7Cr2O3+N2+4H2O(2) Cr2(SO4)3 + 6NaOH == 2Cr(OH)3↓+ 3Na2SO4 Cr(OH)3 + OH- == CrO2- + 2H2O2CrO2- + 3Br2 + 8OH- == 2CrO42- + 6Br- + 4H2O(3) Cr2O72- +3Zn + 14H+ == 2Cr3+ + 3Zn2+ + 7H2O 2Cr3+ + Zn ==2Cr2+ + Zn2+4Cr2+ + O2 + 4H+ == 4Cr3+ + 2H2O(4)Cr2O72- + 8H+ + 3H2S == 2Cr3+ + 3S + 7H2O(5)Cr2O72-+2Ba2+ + H2O == 2BaCrO4 + 2H+(6)2BaCrO4 + 16HCl(浓) == 2BaCl2 + 2CrCl3 + 8H2O + 3Cl2(7)K2Cr2O7 + S K2SO4 + Cr2O310解:A:K2Cr2O7 B:Cl2 C:Cr3+ 溶液D:Cr(OH)3 E:CrO2- F:CrO42-Cr2O72- + 8H+ + 6HCl==2Cr3+ + 3Cl2 + 7H2O Cr3+ + 3OH-==Cr(OH)3Cr(OH)3 + OH-==CrO2- + 2H2O 2CrO2- + 3H2O2 + 2OH-==2CrO42- + 4H2O2CrO42- + 2H+ ==Cr2O72- + H2O11解:已知Ag2CrO4的Ksp=×10-12,AgCl的Ksp=×10-10.Ag2CrO4刚沉淀时[Ag+]=(Ksp/[CrO42-])=×10-12/×10-3)=×10-5AgCl刚沉淀时[Ag+]=Ksp/[Cl-]=×10-10/×10-3=×10-7.∵×10-7<×10-5, 说明AgCl先沉淀析出,而Ag2CrO4后析出.当Ag2CrO4刚析出时,溶液中[Ag+]=×10-5, 这时[Cl-]= Ksp/[Ag+]=×10-10/×10-5=×10-6 <10-5, 说明此时AgCl已经沉淀完全,即两者是可以分离的.12解:(1) 对于平衡: 2CrO42- + 2H+ == Cr2O72- + H2O平衡浓度: 1×90% x 1/2×代入平衡常数表达式: ×(1×2×x2=×1014∴ x=×10-8(mol/L) pH=当Cr2O72-占90%时: 1××y2=×1014∴ y=×10-7(mol/L) pH=18解:A:MnO2; B:Mn2+(溶液); C:O2; D:Mn(OH)2; E:MnO(OH)2; F:K2MnO4; G:MnO4-MnO2+2H2SO4(浓)==2MnSO4+2H2O+O2 MnSO4+2OH-==Mn(OH)2↓(白)+SO42-2Mn(OH)2+O2==2MnO(OH)2(棕色) 3MnO2+6KOH+KClO3==3K2MnO4+KCl+3H2O3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO319解:该溶液中含有Cl-,MnO4-和Cr2O72-(或者CrO42-)Ag+ + Cl- == AgCl↓ Cr2O72- + 4Ag+ + H2O == 2Ag2CrO4(砖红)↓ + 2H+2Ag+ + CrO42- == Ag2CrO4 2Ag2CrO4 + 2H+ == Cr2O72- + 4Ag+ + H2O2MnO4- + 5SO32- + 6H+ == 2Mn2+ + 5SO42- + 3H2O20解:(1) 已知电势图: MnO4- MnO42- MnO2∵ψθ(右)>ψθ(左) ∴反应: 3MnO42- + 4H+ == 2MnO4- + MnO2 + 2H2O 可自发向右进行,即MnO42-在标态下是不能稳定存在的.要使其稳定,则上述反应的△E<0,即△Eθ[MnO4-]2/[MnO42-]3[H+]4<0 令 [MnO4-]=[MnO42-]=Lψθ(MnO42-/ MnO2)-ψθ(MnO4-/ MnO42-)[H+]-4<0[H+]<×10-15 pH> [OH-]>(mol/L)(2) a. 从生成焓的数据来看: △f Hθ(Mn2+,aq)= mol; △f Hθ(Fe3+,aq)= mol;生成Mn2+(aq)时放出的热量远大于Fe3+(aq),说明Mn2+比Fe3+更稳定.b. 从电极电势数据看: ψθ(Mn2+/ Mn)= ; ψθ(MnO2/ Mn2+)=; ψθ(Fe3+/ Fe2+)=; ψθ(Fe2+/电极电势值△rGθψθ(Mn2+/ Mn)= Mn2+的△rGθ= kJ/molψθ(MnO2/ Mn)=MnO2的△rGθ= + kJ/molψθ(Fe2+/ Fe)= Fe2+的△rGθ= kJ/molψθ(Fe3+/ Fe)= Fe3+的△rGθ= kJ/mol由△rG= -nFE= nFψ得△rG,见上表.以△rGθ对氧化态作图得到如图所示结果.由此图可看出,Mn2+的稳定性高于Fe3+(和Fe2+).c. 从电离能数据看:Mn元素: I1=717kJ/mol; I2=1509kJ/mol;I3=3248kJ/mol;Fe元素: I1=759kJ/mol; I2=1561kJ/mol;I3=2957kJ/mol;Mn失去两个电子形成Mn2+后,再失去第三个电子是较困难的(因I3远大于I2),而Fe的I3和I2相差不如Mn的大,即Fe2+容易再失去1个电子变为Fe3+,Fe3+也较易得到1个电子变为Fe2+,所以Fe3+不如Mn2+稳当.(3) 首先NaBiO3把Mn2+氧化到MnO4-,则溶液显紫色.而紫色消失是由于产物MnO4-与反应物Mn2+继续反应生成MnO2沉淀.2Mn2++5BiO3-+14H+==2MnO4-+5Bi3++7H2O 2MnO4-+3Mn2++2H2O==5MnO2+4H+(4) 因MnO4-不稳定,在水溶液中会发生分解而析出MnO2沉淀4MnO4- + 2H2O == 4MnO2 + 4OH- + 3O221解:(1) Fe2+ + 2OH- == Fe(OH)2↓(白) 4Fe(OH)2 + O2 +2H2O == 4Fe(OH)3↓(棕)(2) Fe(OH)3 + 3HCl == FeCl3 + 3H2O(3)Fe3+ + nSCN- == [Fe(SCN)n]3-n(血红色)(4)2[Fe(SCN)n]3-n + SO2 + 2H2O == 2Fe2+ + 2nSCN- + SO42- + 4H+(5)5Fe2+ + MnO4- + 8H+ == 5Fe3+ + Mn2+ + 4H2O(6)4Fe3+ + 3Fe(CN)64- == Fe4[Fe(CN)6]322解:(1) 对于水合离子[Co(H2O)6]2+和[Co(H2O)6]3+,在八面体弱场中,两者均存在3个成单电子,但由于稳定化能的绝对值[Co(H2O)6]2+的大于[Co(H2O)6]3+的,所以[Co(H2O)6]3+不能稳定存在,而[Co(H2O)6]2+可以。
过渡元素(课后基础习题)

过渡元素1、钛的主要矿物是什么?简述从钛铁矿制取钛白得反应原理。
2、完成并配平下列反应方程式。
(1)Ti + HF →(2)TiO2 + H2SO4→(3)TiCl4 + H2O →(4)FeTiO3 + H2SO4→(5)TiO2 + BaCO3→(6)TiO2 + C + Cl2→3、完成下列反应(1)TiI4在真空中强热;(2)FeTiO3和碳得混合物在氯气中加热;得水溶液加入过量得氨;(3)向含有TiCl-26(4)向VCl3的水溶液加入过量的氨;(5)将VCl2的固体加到HgCl2水溶液中。
4、根据下列实验写出有关的反应方程式:将一瓶TiCl4打开瓶塞时立即冒白烟。
向瓶中加入浓HCl溶液和金属锌时生成紫色溶液,缓慢地加入NaOH溶液直至溶液呈碱性,于是出现紫色沉淀。
沉淀过滤后,先用HNO3处理,然后用稀碱溶液处理,生成白色沉淀。
5、完成并配平下列反应方程式−(1)V2O5 + NaOH−→−(2)V2O5 + HCl−→−(3)VO43- + H+(过量) −→−(4)VO2+ + Fe2+ + H+−→−(5)VO2+ + H2C2O4 + H+−→6、新生成的氢氧化物沉淀为什么会发生下列变化(1)Mn(OH)2几乎是白色的,在空气中变为暗褐色?(2)白色的Hg(OH)2立即变为黄色?(3)蓝色的Cu(OH)2,加热时为什么变黑?7、根据下述各实验现象,写出相应的化学反应方程式(1)往Cr2(SO4)3溶液中滴加NaOH溶液,先析出葱绿色絮状沉淀,后又溶解,此时加入溴水,溶液就由绿色变为黄色。
用H2O2代替溴水,也得到同样结果。
(2)当黄色BaCrO4沉淀溶解在浓HCl溶液中时得到一种绿色溶液。
(3)在酸性介质中,用锌还原Cr2O-2时,溶液颜色由橙色经绿色而变成蓝色。
放置时又变回绿色。
7(4)把H2S通入已用H2SO4酸化的K2Cr2O7溶液中时,溶液颜色由橙变绿,同时析出乳白色沉淀。
第19章-过渡元素(一)习题

第19章 过渡元素(一)习题1.选择题19-1下列配离子属于反磁性的是……………………………………………( )(A) [Mn(CN)6]4-(B) [Cu(en)2]2+ (C) [Fe(CN)6]3- (D) [Co(CN)6]3-19-2下列氧化物与浓H 2SO 4共热,没有O 2生成的是……………………( ) (A) CrO 3 (B) MnO 2 (C) PbO 2(D) V 2O 5 19-3下列离子中磁性最大的是………………………………………………( )(A) V 2+ (B) Cr 3+ (C) Mn 2+ (D) Fe 2+19-4 在某种酸化的黄色溶液中,加入锌粒,溶液颜色从黄经过蓝、绿直到变为紫色,该溶液中含有……………………………………………………………( )(A) Fe 3+ (B) +2VO (C)-24CrO (D) Fe (CN)-4619-5在碱性溶液中氧化能力最强的是………………………………………( )(A) -4MnO (B) NaBiO 3 (C) Co 2O 3 (D)-272O Cr19-6过渡金属和许多非金属的共同点是……………………………………( )(A) 有高的电负性 (B) 许多化合物有颜色(C) 有多种氧化态 (D) 许多化合物具有顺磁性 19-7 CrO 5中Cr 的氧化数为 …………………………………………………( )(A) 4 (B) 6 (C) 8 (D) 10 19-8在酸性介质中加入过氧化氢(H 2O 2)时不生成过氧化物的化合物是…( )(A) 钛酸盐 (B) 重铬酸盐 (C) 钒酸盐 (D) 高锰酸盐 19-9根据铬在酸性溶液中的元素电势图可知, ϕ(Cr 2+/Cr)为…………… ( )Cr 3+──── Cr 2+ ───── Cr(A) -0.58 V (B) -0.91 V(C) -1.32 V (D) -1.81 V19-10 已知V 3+ / V 2+ 的 ϕ= -0.26 V ,O 2/H 2O 的 ϕ= 1.23 V ,V 2+离子在下述溶液中能放出氢的是………………………………………………………………( )(A) pH = 0的水溶液 (B) 无氧的pH = 7的水溶液 -0.41 V -0.74 V(C) pH = 10的水溶液 (D) 无氧的pH = 0的水溶液19-11对第四周期的过渡元素,不具备的性质是…………………………( )(A) 形成多种氧化态 (B) 形成配位化合物(C) 配位数为4或6 (D) 形成的离子必具有4s 23d n 的电子排布19-12根据价层电子的排布,预料下列化合物中为无色的是………………( )(A) TiCl 3 (B) ScF 3 (C) MnF 3 (D) CrF 319-13由铬在酸性溶液中的元素电势图,可确定能自发进行的反应是……( ) Cr 3+ ───── Cr 2+ ───── Cr(A) 3Cr 2+ → 2Cr 3+ + Cr(B) Cr + Cr 2+ → 2Cr 3+(C) 2Cr → Cr 2+ + Cr 3+(D) 2Cr 3+ + Cr → 3Cr 2+19-14用 Nernst 方程式 ϕ =][][lg 0592.0还原剂氧化剂n + ϕ,计算MnO 4-/Mn 2+的电极电势 ϕ ,下列叙述不正确的是…………………………………………………( )(A) 温度应为298 K (B) Mn 2+ 浓度增大则ϕ 减小(C) H + 浓度的变化对ϕ 无影响 (D) MnO -4浓度增大,则ϕ 增大19-15下列各组自由离子的磁矩从小到大变化顺序,正确的是………( )(A) Cu 2+ < Ni 2+ < Co 2+ (B) Cr 2+ < Fe 2+ <Fe 3+(C) Cr 2+ < Mn 2+ < V 2+ (D) Ti 2+ < V 3+ < Cr 2+19-16在强碱性介质中,钒(Ⅴ)存在的形式是………………………………( )(A) VO (B) VO 3+(C) V 2O 5·n H 2O(D)-34VO 19-17已知某黄色固体是一种简单化合物,它不溶于热水而溶于热的稀盐酸,生成一种橙红色溶液。
过渡金属元素习题及答案

本部分内容集中出现在选修三物质的结构与性质,主要考察的知识点有:1、原子或离子的电子排布式;2、分子的结构(特别是配合物结构的考察);3、中心离子的配位数;4、含有过渡元素晶体的密度和化学式的考察。
1.[物质结构与性质]K4[Fe(CN)6]强热可发生反应:3 K4[Fe(CN)6]2 (CN)2↑+12 KCN +N2↑+ Fe3C + C(1)K4[Fe(CN)6]中Fe2+的配位数为(填数字);Fe2+基态外围电子排布式为。
(2)(CN)2分子中碳原子杂化轨道类型为;1molK4[Fe (CN)6]分子中含有键的数目为。
(3)O与CN互为等电子体,则O的电子式为。
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为。
2.芦笋中的天冬酰胺(结构如右图)和微量元素硒、铬锰等,具有提高身体免疫力的功效。
(1)天冬酰胺所含元素中, (填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有种。
(3)H2S和H2Se的参数对比见下表。
①H2Se的晶体类型为,含有的共价键类型为。
②H2S的键角大于H2Se的原因可能为。
(4)已知铝(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示A是 (填元素符号),B的价电子排布式为。
3.由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe3+的基态核外电子排布式。
(2)HCHO分子中碳原子轨道的杂化轨道类型为;1mol HCN 分子中含有σ键的数目为__________mol。
(3)N2O的空间构型为,与N2O互分等电子体的一种离子为。
(4)TiO2的天然晶体中,最稳定的一种晶体结构如下图,则黑球表示原子。
4.我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。
高考化学二轮复习第20讲-重要的过渡金属元素及其化合物(题组训练)

第20讲-适度拓展:重要的过渡元素及其化合物1.(2021年全国乙卷第26题)磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。
为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表回答下列问题:(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,写出Al2O3转化为NH4Al(SO4)2的化学方程式______________________。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是_____________________。
(3)“母液①”中Mg2+浓度为_______mol/L。
(4)“水浸渣”在160℃“酸溶”最适合的酸是_______。
“酸溶渣”的成分是_______、_______。
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·x H2O沉淀,该反应的离子方程式是_____________________________。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得_______,循环利用。
2.(2017年全国℃卷第27题)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。
制备流程如图所示:回答下列问题:(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。
该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
无机化学练习题过渡金属元素的化学性质

无机化学练习题过渡金属元素的化学性质无机化学练习题:过渡金属元素的化学性质过渡金属元素是周期表中位于主族元素与内过渡元素之间的一组元素。
它们具有独特的化学性质,广泛应用于无机化学、有机化学、生物化学等领域。
本文将围绕过渡金属元素的化学性质展开探讨,并试图回答以下问题:过渡金属元素为什么具有多种氧化态?其复合物的特征及反应行为如何?过渡金属元素在催化反应中的应用有哪些?一、多种氧化态的原因过渡金属元素具有多种氧化态的主要原因在于其d轨道的电子结构。
与主族元素不同,过渡金属元素的d轨道不稳定,容易发生电子转移。
这种电子转移使得d轨道的能级发生变化,从而出现不同的氧化态。
以铁为例,其原子结构为[Ar] 3d^6 4s^2。
当铁失去两个电子,即形成Fe^2+离子时,电子结构变为[Ar] 3d^6。
当铁失去三个电子,形成Fe^3+离子时,其电子结构变为[Ar] 3d^5。
由于过渡金属元素具有不同的氧化态,因此可以展现出多样的化学性质和反应行为。
二、过渡金属元素的复合物1. 特征过渡金属元素与配体形成的复合物具有一系列独特的特点。
首先,复合物通常呈现出比单质金属更高的稳定性。
其次,复合物的形成导致了配体与金属中心之间的电荷转移,从而改变了金属的电子结构。
此外,复合物还表现出各种颜色,这是由于d轨道的电子跃迁所引起的。
2. 反应行为过渡金属元素复合物在溶液中具有广泛的反应行为。
典型的反应包括配位还原反应、配位置换反应和配位加成反应。
在配位还原反应中,配体能够接受或释放电子,从而改变金属离子的氧化态。
在配位置换反应中,配体与金属离子之间发生交换,形成新的配合物。
在配位加成反应中,新的配体与金属离子形成更稳定的络合物。
三、过渡金属元素在催化反应中的应用过渡金属元素由于其多种氧化态和复合物的特点,在催化反应中具有重要应用价值。
过渡金属可以提供活性位点,促进催化反应发生。
此外,金属的氧化态也可以调节催化反应的速率和选择性。
过渡元素习题一

过 渡 元 素 (I)氧化态的过渡元素相当少?试列出一些含+1氧化态的过渡元素并解释为 2. 用下列结果确定下面反应的x 、y 、z 。
x Ti 3+ + y NH 3OH + + z H + ⎯→ 产物在5.00cm 3、58.2mol ⋅m -3 的(NH 3OH)2SO 4溶液中,加入25cm 3、105.0mol ⋅m -3TiCl 3溶液,没有反应的Ti 3+ 需要12.80cm 3 57.2 mol ⋅m -3的Fe 2(SO 4)3溶液恰好完全氧化,问产物是什么?3. 完成下列反应并注明条件:(1) TiCl 4 + Zn + HCl ⎯→(2) TiO 2+ + H 2O 2 ⎯→(3) BaTiO 3 ⎯→4. 金属钛、锆、铪有何宝贵的特性,基于这些特性,它们有何用途?5. 为什么TiO 2作涂料比铅白好?为什么Ti 金属用来制造飞行器?6. 讨论从钛铁矿生产钛白过程中的下列问题:(1) 为什么酸解和浸取过程,溶液要保持足够的酸度?(2) 为什么不采用Fe(OH)3沉淀法除去铁?Fe(OH)3的K sp = 3.8×10-38,若溶液中含Fe55.84 g ⋅dm -3,计算开始析出Fe(OH)3沉淀时的pH 。
7. Zr 和Hf 的化学性质非常相似,在自然界总是共生的,很难把它们分离,试解释Zr 和Hf 化合物性质相似的原因。
8. 钒分族元素的特性和用途如何?9. 写出下列钒化合物或酸根中钒的氧化数?VO 2+ ; VOCl 2 ; VO 43- ; V 3O 93- ; [VOF 4]2-; [V(NH 3)6]Cl 3 ; K 2V 4O 9(H 2O)7 。
10. 完成下列反应方程式:(1) V 2O 5 + HCl (浓)⎯→(2) VO 2+ + H 2C 2O 4 ⎯→(3) V 2O 5 + NaOH ⎯→(4) VO 43- + H 2O 2 + H + ⎯→ (5) NH 4VO 3 ⎯→ (6) NbCl 5 + H 2O ⎯→ (7) Nb 2O 5 + H 2 ⎯→ (8) Ta 2O 5 + Mg ⎯→11. 试回答下列问题:(1) 从V 5+ 到V 6+ 电离能显著增大,这说明什么问题?(2) 原子序数为23、41、73的钒、铌、钽的原子半径分别为1.22Å 、1.34Å 、1.34Å 。
化学元素周期表中的过渡元素练习题

化学元素周期表中的过渡元素练习题1. 请列出元素周期表中的过渡元素。
元素周期表中的过渡元素包括:第4周期:钒(V)、铬(Cr)、锰(Mn)、铁(Fe)、钴(Co)、镍(Ni)、铜(Cu)第5周期:铝(Al)、锌(Zn)、镓(Ga)、镉(Cd)、铟(In)、锡(Sn)、锑(Sb)、铊(Tl)第6周期:铱(Ir)、铂(Pt)、金(Au)第7周期:汞(Hg)2. 过渡元素的电子排布如何?过渡元素的电子排布遵循以下规则:- 相对于主族元素,过渡元素的d轨道开始填充电子。
这导致过渡元素具有更多可能的氧化态,因为它们可以丢失或获得不仅仅是最外层的电子,而是d轨道中的电子。
- 过渡元素的电子排布一般遵循(Ar)4s^2 3d^n的模式,其中n为d轨道中的电子数。
这个模式保证了过渡元素中d轨道的填充顺序。
3. 过渡元素的化学性质有哪些特点?过渡元素具有以下化学性质的特点:- 过渡元素可以形成多种氧化态。
这是由于过渡元素的d轨道相对较稳定,允许容纳不同数量的电子。
因此,过渡元素可以形成不同的离子,具有不同的氧化态。
- 过渡元素可以形成配合物。
过渡元素的d轨道提供了额外的空间,可以与其他分子或离子形成配位化合物。
这些配位化合物具有独特的性质和应用。
- 过渡元素具有良好的催化性能。
过渡元素的d轨道和可变的氧化态使其在许多催化反应中起到关键作用。
许多工业催化反应和生物催化反应都涉及过渡元素。
4. 过渡元素在生活中的应用有哪些?过渡元素在生活中有广泛的应用,包括:- 铁(Fe)是人类最早使用的金属之一,广泛用于建筑、制造、工业等领域。
- 铜(Cu)被用于制作导线、管道和各种电子设备,因为它是良好的导电材料。
- 锌(Zn)常用于锌-碳电池和热镀锌等领域。
- 铬(Cr)用于制作不锈钢,使其具有抗腐蚀性能。
- 钼(Mo)广泛应用于合金制造、催化剂和电子器件中。
- 钛(Ti)因其强度和耐腐蚀性,被广泛应用于航空航天、医疗器械等高科技领域。
过渡金属化合物合成考核试卷

B. Fe2O3
C. CoO
D. Al2O3
11. 以下哪些性质与过渡金属硅化物有关?( )
A. 高硬度
B. 良好的热稳定性
C. 优异的电导性
D. 特殊的光学性质
12. 以下哪些方法可以用于过渡金属氮化物的合成?( )
A. 碳热还原法
B. 氨气直接合成法
C. 激光烧蚀法
D. 化学气相沉积
17. 以下哪种方法适用于合成过渡金属氯化物?( )
A. 直接氯化法
B. 热分解法
C. 溶胶-凝胶法
D. 以上都是
18. 关于过渡金属的催化作用,以下哪个说法是正确的?( )
A. 过渡金属的催化作用主要来自于其氧化态
B. 过渡金属的催化作用与配位数无关
C. 过渡金属的催化作用与配体种类无关
D. 过渡金属的催化作用与其提供的空轨道和孤电子对有关
7. A
8. D
9. D
10. C
11. D
12. D
13. A
14. D
15. C
16. A
17. D
18. D
19. C
20. D
二、多选题
1. ABCD
2. ABCD
3. ABCD
4. ABCD
5. ABCD
6. ABC
7. ABCD
8. ABCD
9. ABC
10. ABC
11. ABC
12. ABCD
5. 以下哪些方法可以用于过渡金属化合物的合成?( )
A. 水热法
B. 化学气相沉积
C. 焙烧法
D. 溶胶-凝胶法
6. 过渡金属配合物在生物医药领域的应用包括哪些?( )
稀土元素和过渡金属元素的对比练习题

稀土元素和过渡金属元素的对比练习题稀土元素和过渡金属元素是化学中两个重要的元素系列。
它们在自然界中的存在和化学性质有很多相似之处,但也存在一些显著的差异。
本练习题将以对比的方式,详细讨论稀土元素和过渡金属元素的特点。
1. 元素周期表位置稀土元素是指周期表中镧系(57-71号)和铈系(89-103号)两个系列的元素。
它们位于周期表的最底部,分布在f区。
过渡金属元素则分布在d区,包括3-12号的元素。
2. 电子结构稀土元素的电子结构具有一定的特殊性。
它们的f电子层填充规律复杂,电子结构比较复杂稳定。
过渡金属元素则以d电子层为主,电子结构相对简单。
3. 反应性稀土元素和过渡金属元素在反应性上也有一些差异。
稀土元素具有较强的还原性和氧化性,能够参与多种氧化还原反应。
过渡金属元素也具有一定的还原性和氧化性,但相对较弱。
稀土元素常以+3化合态存在,而过渡金属元素常以+2或+3的价态存在。
4. 物理性质稀土元素和过渡金属元素在物理性质上也存在一些差异。
稀土元素具有较高的密度和熔点,且大部分稀土元素呈银白色。
过渡金属元素的密度和熔点相对较低,且具有多种颜色。
5. 常见应用稀土元素和过渡金属元素在实际应用中也有明显的差异。
稀土元素广泛应用于光学、电子、材料等领域。
它们在制备发光材料、永磁材料、触摸屏等方面具有重要作用。
过渡金属元素则常用于催化剂、合金、电池等领域。
综上所述,稀土元素和过渡金属元素在周期表位置、电子结构、反应性、物理性质和应用方面存在相似和差异之处。
对于深入理解这两类元素,我们需要进一步研究它们的性质和应用。
过渡金属元素习题及答案

本部分内容集中出现在选修三物质的结构与性质,主要考察的知识点有:一、原子或离子的电子排布式;二、分子的结构(特别是配合物结构的考察);三、中心离子的配位数;四、含有过渡元素晶体的密度和化学式的考察。
1.[物质结构与性质]K4[Fe(CN)6]强热可发生反应:3 K4[Fe(CN)6] 2 (CN)2↑+12 KCN +N2↑+ Fe3C + C(1)K4[Fe(CN)6]中Fe2+的配位数为(填数字);Fe2+基态外围电子排布式为。
(2)(CN)2分子中碳原子杂化轨道类型为;1molK4[Fe(CN)6]分子中含有σ键的数目为。
(3)O+22与CN-互为等电子体,则O+22的电子式为。
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为。
2.芦笋中的天冬酰胺(结构如右图)和微量元素硒、铬锰等,具有提高身体免疫力的功效。
(1)天冬酰胺所含元素中,(填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有种。
(3)H2S和H2Se的参数对比见下表。
化学式键长/nm键角沸点/℃H2S 1.34 92.3º -60.75H2Se 1.47 91.0º -41.50①H2Se的晶体类型为,含有的共价键类型为。
②H2S的键角大于H2Se的原因可能为。
(4)已知铝(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示编号I5/KJ·mol-1I6/KJ·mol-1I7/KJ·mol-1I8/KJ·mol-1A 6990 9220 11500 18770B 6702 8745 15455 17820C 5257 6641 12125 13860A是(填元素符号),B的价电子排布式为。
3.由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
过渡元素习题

过渡元素习题过渡元素习题1.周期表d区第Ⅷ族元素共有:A、9个B、10个C、11个D、12个2.CoCl2.6H2O是常⽤的钴盐,常温下它的颜⾊为:A、粉红B、紫红C、篮紫D、蓝⾊3.氨和配离⼦稳定性按Fe2+---Co2+---Ni2+顺序依次:A、增强B、不变C、减弱4.铁、钴、镍是中等活泼的⾦属,它们:A.都有磁性B、只铁有磁性C、在外加磁场下钴镍也有磁性5.“氢脆”是指钢铁和氢作⽤后形成氢化物,它使钢铁的哪种性能下降:A、延展性B、密度C、体积6.下列哪种⾦属可形成⾼强度的、在建筑⼯业中⼴泛⽤作结构⽀撑的合⾦:A、铁B、铝C、铜D、铅7.下列哪种化合物是黄⾎盐:A、K4[Fe(CN)6]B、K3[Fe(CN)6]C、[KFe(CN)6Fe]8.铁是公认的⽣命必须微量元素,它在⼈体内通常以哪种状态存在:A、Fe(II)B、Fe(III)C、Fe9.下列哪种性质是过渡⾦属的典型特征:A.过渡⾦属通常只有⼀个正氧化态B.外层电⼦层构型具有(n-1)d x ns2形式C.形成的化合物通常⽆⾊、D.原⼦实电荷通常⼩于+310.下列哪种⾦属基态只有⼀个4s电⼦:A.钴B.镍C.铜D.锌11.下列哪种过渡⾦属在它的某些化合物中以+5氧化态存在:A.钛B.钒C.镍D.锌12.下列哪个分⼦式配合物:A.C6H4CI2B.Na2S2O3 C.K2O2D.Ni (CO)413.氯化汞的分⼦式是什么:A.HgCI B.Hg2CI2C.HgCI2D.Hg2CI414.下列哪个元素的第⼀电离能最低:A.钒B.铬C.铌D.钼15.下列哪种化合物是共价化合物:A.TiCI4B.FeCI3C.NiCI2D.CuCI16.下列哪种过镀⾦属最不可能形成多于⼀种氧化态的化合物:A.⽔银B.钛C.钪D.铬17.下列哪个过渡⾦属具有低密度、⾼熔点、抗腐蚀、强度⾼且⽤于军⽤飞机的性质A.钛B.钪C.⽔银D.锌18.作为还原剂的钛Ti (II),为什么不可能有Ti+2的⽔溶液?A.钛⾦属只有⼀个3d电⼦,不能形成+2氧化态B.T i+2⽔溶液在⽔中岐化,形成⾦属钛和Ti+4C.T i+2化合物是共价的⽽且不溶于⽔D.Ti+2被⽔氧化形成Ti+419.TiCI4和潮湿空⽓反应的产物是什么A.TiO2 (s) + HCI(g)B.T i (H2O)+4 + CI- (aq)C.H2TiO3 (s) + HCI (g)D.Ti (s) + CI2 (g)20.铬的最稳定氧化态是什么:A.0 B.+2C.+3D.+621.将Cr2O72-放⼊浓酸溶液中得到的含铬⽣成物是什么:A.CrO42-B.CrO3C.Cr2O3D.Cr+222.下列哪个⾦属形成的盐,在⼤⽓氧存在时其淡蓝⾊溶液会变成深紫⾊A.铁B.铬C.镍D.钴23.下列哪个化合物在接触法⽣产硫酸时⽤做催化剂A.V2O5B.Fe2O3C.Cr2O3D.KMnO424.下列哪种化合物⽤于制作⼲电池A.V2O5B.Fe2O3C.Cr2O3D.MnO225.下列哪个固体氢氧化物是绿⾊的A.Co (OH)2B.Ni (OH)2C.Zn (OH)2D.Cu (OH)226.下列哪个固体氢氧化物是粉红⾊的A.Co (OH)2B.Ni (OH)2C.Zn (OH)2D.Cu (OH)227.下列哪个固体氢氧化物是⽩⾊的A.Co (OH)2B.Ni (OH)2C.Zn (OH)2D.Cu (OH)228.下列哪个固体氢氧化物是蓝⾊的A.Co (OH)2B.Ni (OH)2C.Zn (OH)2D.Cu (OH)229.当分⼦式为CoCI3. 4NH3的化合物与AgNO3 (aq)反应,沉淀出1Mol AgCI,有多少氯原⼦直接与钴成键A.0 B.1 C.2D.330.下列哪种⾦属不易与汞形成合⾦A.Fe B.Zn C.Pb D.Na31.Fe (H2O)63-中的O-Fe-O的键⾓是多少:A.180o,120oB.180o,90oC.120o,90oD.120o,109.5o32.在⾦属银的表⾯形成什么化合物,通常称作“失去光泽”A.Ag2O B.Ag2S C.Ag2CO3D.Ag3N33.下列反应的含铬⽣成物是什么:2CrO42- + 2H3O+A.Cr2O72-B.CrO3C.Cr2O3D.Cr2+34.下列反应的含钒⽣成物是什么:VO2+(aq) + Fe2+(aq)A.VO43-B.V2O5C.V (H2O)6+D.VO (H2O)52+35.下列反应的含钒⽣成物是什么:V2O5 (s) + 2H3O+(aq)A.VO43-B.VO2+C.V (H2O)6+D.VO (H2O)52+36.下列反应的含钒⽣成物是什么:V2O5 (s) +6OH- (aq)A.VO43-B.VO2+C.V (H2O)6+D.VO (H2O)52+37.下列离⼦哪个是配离⼦:A.NH4+B.S2O32-C.Zn (OH)42-D.Fe3+38.下列分⼦哪个是配合物:A.C6H4CI2B.Na2S2O3C.K2O2D.Ni (CO)439.下列哪种物质的基态价电⼦构型是3d34s2:A.V B.Cr3+C.Fe D.Co40.锰的基态价电⼦构型是3d54s2,粒⼦Mn2+的基态电⼦构型是什么:A.3d24s3B.3d34s2C.3d44s1D.3d54s0 41.下列哪种性质是过渡⾦属的典型特征:A.过渡⾦属通常只有⼀个正氧化态B.外层电⼦层构型具有(n-1)d10 ns2np x形式C.形成的化合物通常⽆⾊D.原⼦实电荷通常⼤于+342.下列哪种性质是过渡⾦属的典型特征:A.过渡⾦属通常只有⼀个正氧化态B.外层电⼦层构型具有(n-1)d x ns2形式C.形成的化合物通常有颜⾊D.原⼦实电荷通常⼩于+343.下列哪种性质是过渡⾦属的典型特征:A.过渡⾦属可以形成具有不同氧化态的化合物B.外层电⼦层构型具有nd10ns2形式C.形成的化合物通常⽆⾊D.原⼦实电荷通常⼩于+344.下⾯哪种⾦属的性质不是⾦属键中电⼦流动性的结果:A.导热性B.延展性C.密度D.光泽46.下列哪种元素最可能形成共价化合物⼜形成离⼦化合物:A.铝B.铁C.铜D.铅47.为了检验酒精中可能存在少量⽔,可使⽤下⾯哪种⽆⽔盐做⽬测试验:A.硫酸铝B.硫酸亚铁C.硫酸铜D.硫酸铅48.黄铜是下⾯哪两种⾦属的合⾦:A.铜和锌B.铜和锡C.铜和铁D.铜和镍49.下列哪种⾦属在⾃然界可以⾮化和态状态存在A.铝B.铁C.铜D.铅50.下列哪种⾦属由于所带有的毒性给社会带来的危害最⼤:A.铝B.铁C.铜D.铅51.下⾯哪个不是过渡元素的特征:A.过渡元素均为⾦属元素B.外观多呈银⽩⾊或灰⽩⾊C.过渡元素熔、沸点⾼;硬度⼤D.同⼀周期⾦属单质从左向右⾦属性逐渐减弱52.过渡元素氧化值从左向右变化趋势为:A.升⾼B.先降低再升⾼C.降低D.先升⾼再降低53.下⾯哪个不是过渡元素的特征:A.长式周期表中位于s区和p区之间的元素B.元素氧化值从上到下⾼氧化态趋于稳定C.易形成配合物,且有配位催化作⽤,配离⼦⼤多显⾊D.少数过渡元素原⼦或离⼦具有磁性54.下⾯关于TiO2的描述哪个是不正确的A.⽩⾊难溶固体,⽆毒,⼯业上称作钛⽩粉,⽤作⾼级颜料。
2024年高考化学过渡金属的化学性质历年真题精选

2024年高考化学过渡金属的化学性质历年真题精选过渡金属是化学元素周期表中位于d区的元素,其具有独特的化学性质。
对于高考化学考试来说,过渡金属是一个重要的考察内容。
本文将为大家整理2024年高考化学真题中与过渡金属化学性质相关的题目,并提供详细解析。
一、选择题题目1:下列元素中,属于过渡金属的是A. 硒B. 氮C. 铜D. 锂解析:选择题一般通过排除法解答,根据题意,我们需要找出属于过渡金属的元素。
根据周期表,过渡金属位于d区,因此选项A、B不符合条件,剩下选项C和D。
铜为过渡金属,而锂为主族金属,因此答案选C。
题目2:以下关于过渡金属化合物的说法正确的是A. 过渡金属化合物多为气体B. 过渡金属化合物的颜色取决于其物理状态C. 过渡金属化合物一般具有高电离能D. 过渡金属化合物的化学性质只与其原子核有关解析:选项A错误,大部分过渡金属化合物为固体。
选项B正确,过渡金属化合物的颜色与其电子跃迁有关。
选项C错误,过渡金属具有相对较低的电离能。
选项D错误,过渡金属的化学性质与电子排布有关。
因此答案选B。
二、填空题题目1:过渡金属的电子结构一般为__________。
解析:过渡金属是指d区的元素,其电子排布一般为(n-1)d^n。
因此答案为(n-1)d^n。
题目2:过渡金属的氧化态较稳定的原因是__________。
解析:过渡金属具有较宽的能带,其电子容易失去或获得电子形成氧化态。
因此答案为电子容易失去或获得。
三、解答题题目:某过渡金属离子在不同氧化态下对酚酞指示剂呈现不同颜色,请写出该过渡金属离子的氧化态和颜色变化的原因。
解析:该题目要求根据所给信息,写出过渡金属离子的氧化态和颜色变化原因。
这类题目可以通过查阅有关资料或者综合知识进行回答。
以锰离子为例,锰在不同氧化态下呈现不同的颜色。
在+2氧化态下,锰离子呈现粉红色;在+7氧化态下,锰离子呈现紫色。
这是由于锰离子的电子跃迁引起的,+2氧化态下电子转移到不同的d轨道能级,吸收绿光,所以呈现粉红色;而+7氧化态下电子转移到更高的d轨道能级,吸收黄光,呈现紫色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
交作业时间说明:
第13周周五20160520:过渡的第一、二部分和稀有气体;
第15周周五20160603:过渡的第三部分
过渡的第四部分(不交)
过渡金属的习题
第一部分:元素通性
1. 第一过渡周期的二价金属离子的半径如下,写出他们在正八面体弱场中的d电子排布并
2. 试从结构的观点予以解释:
(1)第一过渡系金属水合离子颜色及含氧酸根颜色产生的原因;
(2)同族的过渡金属元素的金属性、氧化还原稳定性变化规律,与碱金属、碱土金属的区别;(ⅢB-ⅤB)
第二部分:IIIB-VIIB族为主
1.根据以下连续性实验事实说明发生了什么反应,试用反应方程式解释。
(1)打开装有TiCl4的瓶塞,立即冒白雾;
(2)向TiCl4溶液中加入浓盐酸和Zn,溶液显紫色;
(3)缓慢加入NaOH使溶液呈碱性,析出紫色沉淀;
(4)沉淀经过滤分离后,用硝酸溶解,再用稀碱溶液处理,得白色沉淀;
(5)将白色沉淀过滤并灼烧后,与等物质的量的MgO共熔。
2.回答下列问题:
(1)为什么TiO2+(aq)无色,而TiI4为暗棕色晶体。
(2)如何鉴别TiO2+离子和Ti3+离子?
(3)从热力学角度看,[Ti(H2O)6]2+、[Ti(H2O)6]3+、[Ti(H2O)6]4+离子中,哪个或哪几个不能稳定存在?为什么?
3. Sc2O3在哪些性质上与Al2O3相似,为什么?最近有一篇很火的Science的论文,主要是Al 电池的研究,预测一下是否可以进行Sc电池的研究?
4.微观角度解释现象:
(1)向V2+(aq)中逐滴加入KMnO4溶液,观察颜色变化。
(2)浓氨水逐滴加入含NH4Cl的CrCl3溶液中,颜色变化:紫红→浅红→橙红→橙黄→黄色
的变化。
(3)Mn2+的半径为80pm,Mg2+为66pm,但MnCO3的分解温度低于MgCO3。
(4)溶液中含有NH4+时,更利于Mn和水的反应。
5. 结合反应式解释现象:
(1)酸性钒酸盐溶液中通入SO2时生成一深蓝色溶液。
相同量的钒酸盐溶液用锌汞齐还原时得到紫色溶液。
将此两溶液混合,得到绿色溶液。
(2)在酸性介质中,用锌还原Cr2O72-时,溶液的颜色变化是:橙色-绿色-蓝色,反应完成后又变为绿色。
(3)往硫酸铬溶液中,逐渐加入氢氧化钠溶液,开始生成灰蓝色沉淀,继续加碱,沉淀又溶解,再向所得溶液中滴加溴水,直到溶液的绿色转变为黄色。
6. 关于锰,讨论下列问题:
(1)根据锰的电势图和有关理论,讨论MnO42-离子稳定存在的pH最低应为多少?
(2)试从生成焓、电极电势、电离能数据,讨论锰(II)不如铁(II)稳定的原因。
7. 二氧化钛在现代社会里有广泛的用途,其产量是一个国家国民经济发展程度的标志,试画出硫酸法生产二氧化钛的简化流程框图并回答下列问题:
(1)指出流程框图中何处发生了化学反应,写出相应的反应方程式;
(2)氯化法生产二氧化钛是以金红石为原料,氯气可以回收、循环利用,试写出相关化学反应方程式;
(3)请对比硫酸法和氯化法的优缺点。
8. 在实验室中如何配制铬酸洗液?其去污原理是什么?
12.教材作业:p223-224页,1(1)-(7)、3、8、10、13、14
第三部分:第VIII族和贵金属为主
1.设计简单的实验方案,在不引入杂质的前提下,完成下列目标:
(1)除去FeCl2溶液中的FeCl3。
(2)除去FeCl3溶液中的FeCl2。
(3)除去Fe2(SO4)3溶液中的FeSO4。
2.试解释:
(1)为何[Co(CN)6]4-容易被氧化。
(2)在标准状态下,Fe3+可氧化I-而[Fe(CN)6]3-不能。
3.在用NH4SCN试剂鉴定CO2+时,为什么要用NH4SCN浓溶液或固体,并加丙酮萃取?溶液中存在何种常见离子时会干扰此鉴定?如何消除此种干扰?
5.化合物Li+[Co3(CO)10]-在2080-2000、1850、1600cm-1区出现3个不同类型的羰基带,
试对此阴离子提出一种合理的结构。
5. 蔡斯盐K[Pt(C2H4)Cl3]在金属有机化学发展史上占有重要的地位。
(1)写出制备蔡斯盐的化学反应方程式;
(2)讨论蔡斯盐的结构和化学键,它是否符合18电子规则?此盐阴离子的结构可用什么方法来确定?
(3)用乙醚萃取蔡斯盐的水溶液,可得化学式为Pt(C2H4)Cl2的中性化合物,试写出此化合物的可能的分子式和结构式。
6. 配合物Ni (CO)4和[Ni(CN)4] 2-具有不同的结构,但二者都是反磁性的,用价键理论予以解释。
7. 关于铂,回答下列问题:
(1)写出Pt溶于王水的反应方程式,并说明原因;
(2)将Pt粉与固体NaOH和Na2O2共熔后,再将熔体溶于浓盐酸。
在此溶液中铂形成了什么化合物?
(3)写出Pt(OH)4与KOH作用的反应方程式;
(4)写出氯铂酸钾与SO2作用的反应方程式;
(5)说明在实验室中使用铂丝、坩埚钳、铂蒸发皿等器皿时,必须严格遵守哪些规定?试联系铂的化学性质说明原因。
8. 有两种配合物,都具有Rh(NH3)4Br2Cl化学式,其中一种化合物为黄色,另一种化合物为橙色,它们都能与硝酸银溶液反应,1mol上述2种配合物都生成1molAgCl沉淀,但都不会有AgBr沉淀,问这2种配合物含什么配离子?结构式分别是怎样的?互为何种异构体?如何命名这2种配合物?哪一种结构是黄色的?为什么?
9. 从铂出发如何制备下述一系列的铂化合物?填写下面的反应条件、反应产物的颜色
10.教材作业:p224页,1(8)-(13)、5、17、19、33
第四部分:IB、IIB和镧系为主
1.比较Ti和Zn的活泼性。
结合反应式说明Ti,Zn与稀盐酸,稀硫酸,氢氟酸及NaOH的作用的异同。
2.已知氯化亚铜和氯化亚汞均为逆磁性物质。
请问应该用CuCl还是Cu2Cl2来表示氯化亚铜?应该用HgCl还是Hg2Cl2表示氯化亚汞?为什么?另外,作为跟Hg同族的Zn和Cd能形成这一类的化合物吗?他们在性质上有何差异?
3.区分并鉴定:
(1)CuCl,AgCl,Hg2Cl2三种难溶于水的白色固体。
(2)含有Ag+、Cu2+、Zn2+、Hg2+、Hg22+、Mg2+和Cd2+的混合溶液;
4.关于铜,试简要回答下列问题:
(1)用铜粉还原Cu2+盐溶液制备CuCl时,为什么要加入过量的浓盐酸?简述CuCl的性质。
(2)试说明在CuSO4⋅5H2O晶体中Cu2+为6配位。
(3)解释CuSO4⋅5H2O呈蓝色、[Cu(NH3)4]2+呈深蓝色、CuCl2的浓溶液呈绿色,很浓的溶液呈黄绿色,而稀的CuCl2则呈蓝色。
(4)铜的导电性仅次于银,但价格较低,为啥在航空仪表中不采用铜,而是用价格较昂贵的Au、Pt、Pd合金作为触点?
5. 结合反应式解释现象和回答问题:
(1)Cu2+与铜片在浓盐酸中煮沸,生成墨绿色溶液;
(2)将上述溶液加水稀释,生成白色沉淀;
(3)在第一步制备过程中需要加入一定量的NaCl溶液,其作用是什么?为啥不能一步制备出白色沉淀?
6. 含汞废水的处理是环保工作的重要任务之一,化学沉淀法是在含汞废水中先加入一定量的硫化钠,然后再加入FeSO4,试就以上过程进行说明。
7. 何谓稀土元素?许多稀土矿物通常都缺少铕,而在含钙的矿物中常常发现高浓度的铕化合物,试解释之。
8.结合实例说明从非镧系元素中分离镧系元素的方法和原理。
9.教材作业,p225页21、24、25、29;p237页2,4,7
稀有气体思考题
1.阅读书p67,4.3.2 分离方法,设计一个框图表示出稀有气体的分离过程和方法,写出反
应方程式,并用各种数据说明其道理。
2.稀有气体第一个化合物是氙的化合物,他的制得是化学原理的完美的应用,写出过程,
给了你什么启示。
3.教材作业,p78 第一题。
