常见元素与原子团的化合价
原子团及其化合价的说明

原子团及其化合价的说明:1、氢氧根OH -1价由名称倒过来写其化合价:(-2)×1+(+1)×1= -1价元素的化合价乘以原子团中该元素原子的个数,然后加起来,就是该原子团的化合价2、含氮元素的原子团铵根NH4+1价(-3) ×1 + (+1) ×4 = +1硝酸根NO3-1价,(+5) ×1 + (-2) ×3 = -1亚硝酸根NO2-1价(+3) ×1 + (-2) ×2 = -1氮元素化合价低的,前面有一个亚字3、含碳元素的原子团碳酸根CO3-2价,(+4) ×1 + (-2) ×3 = -2碳酸氢根HCO3 -1价(+1)×1 + (+4) ×1 + (-2) ×3 = - 14、含硫元素的原子团硫酸根SO4-2价,( +6 ) ×1 + (-2) ×4 = - 2亚硫酸根SO3 -2价( +4 ) ×1 + ( -2 ) ×3 = - 25、含氯元素的原子团次氯酸根ClO –1价,( +1) ×1 + ( -2 ) ×1 = - 1亚氯酸根ClO2 –1价,( +3) ×1 + ( -2 ) ×2= - 1氯酸根ClO3 –1价,( +5) ×1 + ( -2 ) ×3= - 1高氯酸根ClO4–1价( +5) ×1 + ( -2 ) ×4= - 1注意:氯元素的化合价和原子团名称之间的关联,原子团中氧原子的个数的变化,这些含氯原子团的化合价都是-1价6、含锰元素的原子团锰酸根MnO4-2价,( +6) ×1 + ( -2 ) ×4= - 2高锰酸根MnO4-1价( +7) ×1 + ( -2 ) ×4= - 1高锰酸根里的锰元素是最高价态+7价,锰酸根里锰元素的化合价是+6价,这两个原子团的形式相同,化合价不同7、含磷元素的原子团磷酸根PO4 -3价( +5) ×1 + ( -2 ) ×4= - 3。
常见的原子团化合价

常见的原子团化合价【最新版】目录1.原子团的概念及化合价的定义2.常见原子团的化合价规律3.特殊原子团和常见原子团化合价举例4.初中常见原子团化合价口诀5.常见原子团的化合价及其应用正文一、原子团的概念及化合价的定义在化学反应中,作为一个整体参加反应的原子集团称为原子团。
原子团内各原子的化合价的代数和等于原子团所带的电荷数。
化合价是元素在化合物中的价态,表示元素与其他元素结合时所表现出的化学价值。
二、常见原子团的化合价规律1.氢氧根:氢的化合价为 +1,氧的化合价为 -2,氢氧根的化合价为-1。
2.硫酸根:硫的化合价为 +6,氧的化合价为 -2,硫酸根的化合价为-2。
3.亚硫酸根:硫的化合价为 +4,氧的化合价为 -2,亚硫酸根的化合价为 -2。
4.硝酸根:氮的化合价为 +5,氧的化合价为 -2,硝酸根的化合价为-1。
5.碳酸根:碳的化合价为 +4,氧的化合价为 -2,碳酸根的化合价为-2。
6.碳酸氢根:碳的化合价为 +4,氢的化合价为 +1,氧的化合价为 -2,碳酸氢根的化合价为 -1。
7.高锰酸根:锰的化合价为 +7,氧的化合价为 -2,高锰酸根的化合价为 -1。
8.锰酸根:锰的化合价为 +6,氧的化合价为 -2,锰酸根的化合价为-2。
9.磷酸根:磷的化合价为 +5,氧的化合价为 -2,磷酸根的化合价为-3。
10.乙酸根:碳的化合价为 +2,氧的化合价为 -2,乙酸根的化合价为 -1。
三、特殊原子团和常见原子团化合价举例1.scn:硫氰根,化合价为 -1。
:氰根,化合价为 -1。
3.mno4:高锰酸根,化合价为 -1。
4.mn:锰酸根,化合价为 -2。
5.po4:磷酸根,化合价为 -3。
四、初中常见原子团化合价口诀“一价元素用最频,氯溴碘氢钠钾银;记住二价别怕累,氧镁铜铁钙锌钡;三价元素很好写,氮硼铝磷铁;四价元素很少见,锰硫硅碳氮;五价元素更少见,常见只有氯磷氮;二三铁,二四碳,二四六硫锰常见;铁有二三要分清,毋忘单质都是零;负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根。
常见的元素化合价 化学式

亚
亚
FeSO4
碳酸 铜
CuCO3
碳酸 银
Ag2CO3
铁
铁
硝 AgNO3 硫 K2SO4 高锰 KMnO4 锰酸 K2MnO4
第6页
酸
酸
酸钾
钾
银
钾
常见的元素符合、化合价、离子符合、化学式
一、常见元素名称与符号:
原子 元素 元素 原子 元素 元素 原子 元素 元素
序数 名称 符号 序数 名称 符号 序数 名称 符号
1.单质
名称
化学 式
名称
化学 式
名称
化学
化学
名称
式
式
氦气
氖气
氩气
锰
氪气
氙气
氡气
铅
第8页
氟气
氯气
液溴
汞
碘
氧气
氢气
铂
氮气
臭氧
石墨、金 金
刚石
单晶
红磷、白
硫磺
钨
硅
磷
钙
钾
镁
银
铝
钠
铁
锌
铜
2.氯化物〔盐〕
名称
化学 式
名称
化学
化学
名称
式
式
名称
化学 式
氯化 氢
氯化钾
氯化 钠
氯化亚 铁
氯化 银
氯化钡
氯化 铜
氯化铁
氯化 钙
H2O2
一氧 化碳
二氧化
二氧化
二氧化
CO
CO2
SO2
NO2
碳
硫
氮
三氧
五氧化
一氧化
四氧化
SO3
P2O5
常见物质及原子团的化合价表

常见物质及原子团的化合价表
以下是一份常见物质及其原子团的化合价表,供参考。
化合价是指原子在化合物中所展示的化学反应能力,它决定了元素之间如何结合形成化合物。
这只是一部分常见物质及其化合价的表格,记住化合价是可以根据具体情况变化的,这里只提供了一些典型的情况。
在具体的化学反应中,需要根据反应物的性质和化学反应方程式来确定物质的化合价。
希望这份化合价表对你有所帮助!如需进一步了解,请参考化学教科书或咨询化学专业人士。
常见元素化合价

一价氢、氯、钾、钠、银二价氧、钙、钡、镁、锌
三铝四硅五价磷二、三铁二、四碳
2、四、六硫价齐全铜、汞二价最常见
单质化合价为零
常见原子团化合价
一价铵根、硝酸根、外加一个氢氧根碳酸氢根为负一
二价硫酸、碳酸根
负三还有磷酸根
常见元素符号
氢氦锂铍硼碳氮氧氟氖
钠镁铝硅磷硫氯氩钾钙
铁铜锌银金汞
地壳中元素含量由多到少:
海洋中元素含量由多到少:
生物体内元素含量由多到少:
常见物质的化学式:水二氧化碳氢气氧气一氧化碳
五氧化二磷高锰酸钾锰酸钾氯酸钾过氧化氢四氧化三铁
三氧化二铁二氧化硫二氧化氮氯气氧化镁氧化铝
澄清石灰水(主要成分)盐酸硫酸硝酸碳酸氢氧化钠
氢氧化钡氢氧化镁氢氧化钙氢氧化钾氢氧化铜
氯化钠氯化钙氯化钾氯化钡硫酸钠酸铝硫酸钾
硝酸镁硝酸钙硝酸钠硝酸钾硝酸钡碳酸钙碳酸镁
常见化学元素化合价

精品文档。
1欢迎下载化学元素的化合价助记口诀一价氢氯钠钾银, 二价氧钙钡镁锌, 三铝四硅五价磷, 二三铁,二四碳, 二四六硫都齐全, 铜汞二价最常见。
正一 钾钠银氢铵 正二 钙镁钡和锌 三铝 四硅 氧负二 一二铜 二三铁 二四碳 氟氯负一 磷正五氢氧根 -1 硝酸根 -1 硫酸根 -2 碳酸根 -2一价氢氯(负)钾钠银 二价氧(负)钡钙镁锌三铝四硅五价磷 二三铁,二四碳二四六硫都齐全(-2、+4、+6)铜汞二价最常见 莫忘单质价为零最常见的有:氢正一,氧负二常见元素及原子团的化合价表。
2欢迎下载锂离子:Li+钾离子:K+钠离子:Na+钙离子:Ca2+镁离子:Mg2+钡离子:Ba2+铝离子:Al3+锌离子:Zn2+铁离子:Fe3+亚铁离子:Fe2+铜离子:Cu2+亚铜离子:Cu+银离子:Ag+常见的非金属离子:氟离子:F—氯离子:Cl—溴离子:Br—碘离子:I—硫离子:S2—氧离子 O2—氢离子:H+常见的离子团:碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32—硝酸根离子:NO3—氢氧根离子:OH—氯酸根离子 ClO3—磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4—锰酸根离子:MnO42—铵根离子:NH4+说明:1、离子不可单独存在,有阴离子存在必然有阳离子,由阴阳离子构成的物质是离子化合物。
2、离子所带的电荷数与其在化合物中元素表现的化合价数值和正负均一致。
例如,硫离子S2—中S的化合价为—23、离子团所带的电荷数与其整体表现化合价数值和正负一致,其整体化合价是其组成元素所表现化合价的代数和。
例如,铵根离子NH4+的整体化合价是+1,这是由于其中N显—3价,H显+1价决定的。
3欢迎下载常用化合价口诀:一价氢氯(-1)钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零。
负一硝酸氢氧根,负二硫酸碳酸根,负三只有磷酸根,正一价的是铵根。
初中常见元素或原子团化合价口诀汇总

初中常见元素或原子团化合价口诀汇总
1、常见元素的主要化合价化合价口诀一:
氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
非金属有正也有负;碳的二四要牢记。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
化合价口诀二
一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫都齐全;铜以二价最常见。
化合价口诀三:
钾钠氢银正一价,钙镁锌钡正二价,氟氯溴碘负一价,通常氧是负二价,铜正一二铝正三,铁有正二和正三,碳有正二和正四,硫有负二正四六。
化合价口诀四:
一价氯氢钾钠银;二价氧镁钙钡锌(~~羊没盖背心);三铝四硅五价磷;二三铁,二四碳;二四六硫应记全。
化合价口诀五:
氢钠钾银正一价,钙钡镁锌正二价,一二铜,二三铁,二四六硫二四碳,三铝四硅三五磷,变价还有锰氯氮。
化合价口诀六:
一价氯氢钾钠银,二价氧钡钙镁锌,三铝四硅五氮磷,二三铁,二四碳,二四六硫价齐全,铜汞二价最常见。
化合价要记清,莫忘单质价为零!
2、常见原子团的化合价化合价口诀一:
一价铵根硝酸根;二价硫酸碳酸根。
暂记铵根为正价;负三有个磷酸根。
化合价口诀二:
负一硝酸氢氧根,负二硫酸碳酸根。
负三记住磷酸根;正一价的是铵根。
元素符号 化合价口诀

元素名称
氢
氦
锂
铍
硼
碳
氮
氧
氟
氖
钠
镁
铝
硅
磷
核电荷数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
元素符号
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
元素名称
硫
氯
氩
钾
钙
锰
铁
铜
锌
金
银
碘
钡
汞
铅
核电荷数
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
元素符号
S
Cl
Ar
K
Ca
Mn
Fe
Cu
Zn
Au
硫
S
-2、+4、+6
铁
Fe
+2、+3
碳
C
-4、+2、+4
锰
Mn
+2、+4
+6、+7
硅
Si
-4、+4
口诀:
氢钠钾银正一价,钙镁锌钡正二价
氟氯溴碘负一价,通常氧是负二价
二三铁,二四碳
三铝四硅,五价磷
一三五七正价氯,二四六硫锰四七
铜汞二价最常见,单质化合价为零
原子团的化合价
常见元素及原子团的化合价及对应物质

常见元素及原子团的化合价及对应物质下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!第一部分:常见元素及其化合价。
1. 碱金属元素:1.1 钾(K)的化合价为+1,常见化合物有氯化钾(KCl)。
常见元素的化合价

常见元素的化合价
纳钾银氢正一价,氟氯溴碘负一价;镁钙锌钡正二价,氧为负二最常见;铝价常显正三价,以上价态需记牢。
碳硅正二和正四,负三正五氮和磷;硫有正价二四六,氯有正价一五七;锰有正价二四六,最高价态也是七;亚铜正一铜正二,亚铁正二铁正三;过氧化物氧负一,单质为零永不变。
常见原子团的化合价
负一硝酸氢氧根,高锰酸根氯酸根;负二硫酸碳酸根,还有负二锰酸根;负三常见磷酸根,正一价的是铵根;最后记住化合物,正负价态和为零。
常见元素及原子团的化合价

常见元素及原子团的化合价摘要:1.常见元素的化合价2.常见原子团的化合价正文:在日常生活中,化学元素和原子团的化合价是我们需要了解的基本知识。
化合价是元素在化合物中所表现出的化学性质,它决定了元素的化学反应能力和化学性质。
在本篇文章中,我们将介绍一些常见元素和原子团的化合价,以帮助大家更好地理解和应用化学知识。
一、常见元素的化合价1.钾(K):通常显+1价。
2.钠(Na):通常显+1价。
3.银(Ag):通常显+1价。
4.氢(H):通常显+1价。
5.钙(Ca):通常显+2价。
6.镁(Mg):通常显+2价。
7.钡(Ba):通常显+2价。
8.锌(Zn):通常显+2价。
9.铝(Al):通常显+3价。
10.铜(Cu):通常显+1或+2价。
11.铁(Fe):通常显+2或+3价。
12.硫(S):通常显+4或+6价。
13.碳(C):通常显+2或+4价。
二、常见原子团的化合价1.氨根(NH4):通常显+1价。
2.氢氧根(OH):通常显-1价。
3.碳酸氢根(HCO3):通常显-1价。
4.亚硫酸氢根(HSO3):通常显-1价。
5.硝酸根(NO3):通常显-1价。
6.硫酸根(SO4):通常显-2价。
7.碳酸根(CO3):通常显-2价。
8.亚硫酸根(SO3):通常显-2价。
9.锰酸根(MnO4):通常显-1价。
10.磷酸根(PO4):通常显-3价。
了解常见元素和原子团的化合价,对我们掌握化学知识和进行化学实验具有重要意义。
在实际应用中,我们还需根据具体化合物的情况,灵活运用这些化合价进行计算和分析,以得出准确的化学性质和反应规律。
化合价

一、化合价掌握元素的化合价,请注意以下几点:(1)记住常见元素的化合价,掌握元素化合价的一些规律,如:①在化合物中,通常氢显+1价;氧显-2价;②单质里元素的化合价为零;③一些元素有变价,其化合价的确定,可以通过不变价元素按化合价规则求得。
(2)使用化合价的规则是:在化合物里,元素正负化合价的代数和为零。
(3)掌握常见原子团的化合价。
原子团是在化学反应中相对稳定的原子集团,又叫做根。
(4)常见的化合价:一价钾钠氯氢银,二价氧钙钡镁锌.三铝四硅五价磷,二三铁,二四碳.二四六硫都齐全,铜汞二价最常见.氢一氧二为标准,看见单质即为零!负一硝酸氢氧根,负二硫酸碳酸根。
负三只有磷酸根,正一价的是铵根。
下表是一些常见原子团的化合价:根的名称根的符号化合价根的名称根的符号化合价氢氧根OH -1碳酸根CO3-2硝酸根NO3-1硫酸根SO4-2碳酸氢根HCO3-1铵根NH4+1氯酸根ClO3-1二、化学式的意义和书写1.化学式的意义①表示一种物质;②表示该物质的组成元素;③由分子构成的物质的化学式可以表示该物质的一个分子及该分子的构成。
2.化学式的书写①单质化学式书写一般用元素符号表示,但像氢气、氧气、氮气、氯气等非金属单质是双原子分子,要在其元素符号的右下角加2;②化合物化学式书写时,正价元素写在左边,负价元素写在右边;正负价总数的代数和为0;③含有原子团的物质,可将原子团看成是一个原子来书写化学式,如氢氧化镁〔Mg(OH)2〕。
三、关于化学式的计算1、利用化学式可进行下列各种计算:①相对分子质量(化学式中各原子的相对原子质量的总和)②物质组成元素的质量比(化学式中个院子的相对原子质量之比)③物质中某元素的质量分数。
公式为例:1.写出下列物质的化学式或名称:高锰酸钾;硫酸钾;碳酸钠;氯化钾;氯气;铁;氢气;氧化铜;水;二氧化碳;氩;四氧化三铁;氢氧化钙;硝酸铵;氯化镁;碳酸氢铵。
2.写出下列物质的名称Cu H2O Ne SiO2P2O5K2O AgCl ZnO NaCl K2MnO4Al2O3SO2NH4Cl CaCO3Mg(NO3)23.用化学符号表示:两个碳原子三个水分子四个氮分子一个二氧化硫分子三个氢原子一个钠原子两个铁原子两个氖分子四、根据化合价写化学式正价在左,负价在右1、交叉法:在元素上方标上化合价,先化简再交叉,如P为+5价,氧为-2价,交叉后为P2O52、最小公倍数法,选求出几种元素化合价的最小公倍数,再根据最小公倍数求各元素的原子数。
常见元素及原子团的化合价表
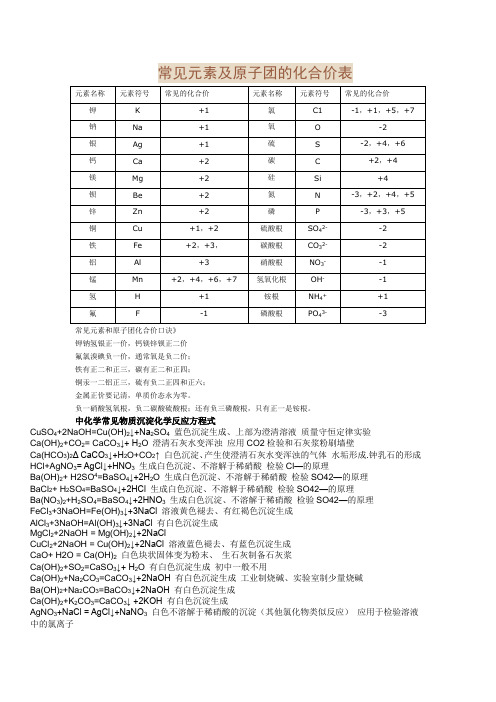
常见元素及原子团的化合价表CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成HCl+AgNO3= AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成AgNO3+NaCl = AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子初中常见物质俗称1、氯化钠(NaCl):食盐2、碳酸钠(Na2CO3) :纯碱,苏打,口碱3、氢氧化钠(NaOH):火碱,烧碱,苛性钠4、氧化钙(CaO):生石灰5、氢氧化钙(Ca(OH)2):熟石灰,消石灰 6 、二氧化碳固体(CO2):干冰7、氢氯酸(HCl):盐酸8、碱式碳酸铜(Cu2(OH)2CO3):铜绿9、硫酸铜晶体(CuSO4 .5H2O):蓝矾,胆矾10、甲烷(CH4):沼气11、乙醇(C2H5OH):酒精12、乙酸(CH3COOH):醋酸13、过氧化氢(H2O2):双氧水14、汞(Hg):水银15、碳酸氢钠(NaHCO3):小苏打中化学常见物质的颜色(一)、固体的颜色1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉2、红色固体:铜——紫红色,氧化铁Fe2O3——红(棕)色3、蓝色晶体:硫酸铜晶体CuSO4·5H2O4、蓝色沉淀:氢氧化铜5、红褐色沉淀:氢氧化铁6、白色沉淀(6种):碳酸钙,碳酸钡,碳酸银;氢氧化镁;硫酸钡,氯化银。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见元素与原子团的化
合价
标准化管理部编码-[99968T-6889628-J68568-1689N]
常见元素与原子团的化合价
常见元素的化合价
化合价是由一定元素的原子构成的化学键的数量。
一个原子是由原子核和外围的电子组成的,电子在原子核外围是分层运动的,不管是那种元素的原子最外层的电子数总是趋向达到2个或8个,这是最稳定的状态。
但自然界中除了惰性气体外,没有一种元素的原子最外层电子数是2个或8个,所以如果最外层电子数少则趋向于丧失,多则趋向于夺取,以达到2个或8个。
为达到2或8原子需要夺取或丧失的电子数就是化合价。
化合物的各个原子是以和化合价同样多的化合键互相连接在一起的。
化合键有两种:
【离子键】如钠原子和氯原子互相结合成氯化钠(食盐),就是钠原子失去一个电子,使最外层电子数达到8,但也因此带一个正电荷,氯原子夺取一个电子,使最外层电子数达到8,但也因此带一个负电荷,两个带电荷的原子依靠电荷力联系在一起,形成新物质。
所以氯是负1价,钠是正1价。
这种键的结合力较弱,在电解质中,如水中,两种原子就会分离成离子,在水中溶解。
【共价键】有机化合物中碳原子和氢原子就是依靠这种方式连接的,碳原子分出一个电子和一个氢原子最外层的电子组成两个电子的稳定结构,围绕两个原子核运动,也就是它们分享这两个电子。
氢原子最外层达到2个电子。
和四个氢原子分享,碳原子的最外层也达到了8个电子,所以氢是1价,碳是4价。
这种键的结合力较强,不容易分离成离子。
共价键中还包括一种特例,即配位键,它是由一个原子单方面提供电子对而跟另一个原子共用的化学键。
铵根、硫酸根等酸根离子都有配位键。
因为惰性气体最外层电子数已经达到了2个或8个,所以惰性气体一般不能和其他物质化合。
