高二化学烃的衍生物知识总结
烃的衍生物重要知识点总结
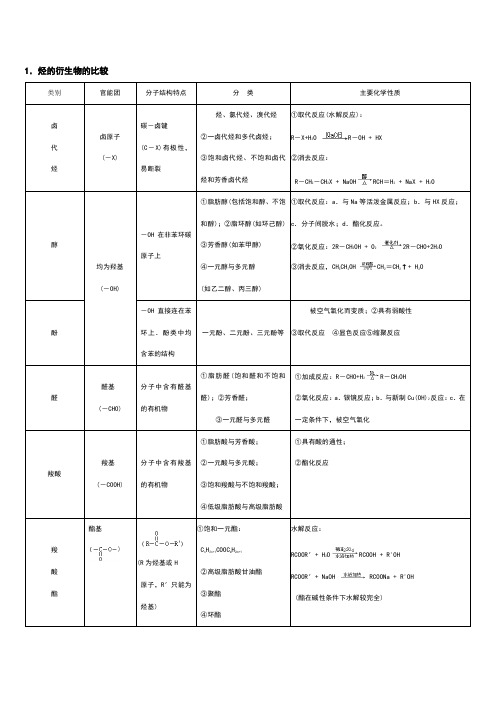
1.烃的衍生物的比较类别官能团分子结构特点分类主要化学性质卤代烃卤原子(-X)碳-卤键(C-X)有极性,易断裂烃、氯代烃、溴代烃②一卤代烃和多代卤烃;③饱和卤代烃、不饱和卤代烃和芳香卤代烃①取代反应(水解反应):R-X+H2O R-OH + HX②消去反应:R-CH2-CH2X + NaOH RCH=H2 + NaX + H2O醇均为羟基(-OH)-OH在非苯环碳原子上①脂肪醇(包括饱和醇、不饱和醇);②脂环醇(如环己醇)③芳香醇(如苯甲醇)④一元醇与多元醇(如乙二醇、丙三醇)①取代反应:a.与Na等活泼金属反应;b.与HX反应;c.分子间脱水;d.酯化反应。
②氧化反应:2R-CH2OH + O22R-CHO+2H2O③消去反应,CH3CH2OH CH2=CH2↑+ H2O酚-OH直接连在苯环上.酚类中均含苯的结构一元酚、二元酚、三元酚等被空气氧化而变质;②具有弱酸性③取代反应④显色反应⑤缩聚反应醛醛基(-CHO)分子中含有醛基的有机物①脂肪醛(饱和醛和不饱和醛);②芳香醛;③一元醛与多元醛①加成反应:R-CHO+H2R-CH2OH②氧化反应:a.银镜反应;b.与新制Cu(OH)2反应:c.在一定条件下,被空气氧化羧酸羧基(-COOH)分子中含有羧基的有机物①脂肪酸与芳香酸;②一元酸与多元酸;③饱和羧酸与不饱和羧酸;④低级脂肪酸与高级脂肪酸①具有酸的通性;②酯化反应羧酸酯酯基(R为烃基或H原子,R′只能为烃基)①饱和一元酯:C n H2n+1COOC m H2m+1②高级脂肪酸甘油酯③聚酯④环酯水解反应:RCOOR′+ H2O RCOOH + R'OHRCOOR′+ NaOH RCOONa + R'OH(酯在碱性条件下水解较完全)2.有机反应的主要类型反应类型定义举例(反应的化学方程式)消去反应有机物在一定条件下,从一个分子中脱去一个小分子(如H2O、HBr等)而生成不饱和(含双键或叁键)化合物的反应C2H5OH CH2=CH2↑+ H2O苯酚的显色反应苯酚与含Fe3+的溶液作用,使溶液呈现紫色的反应还原反应有机物分子得到氢原子或失去氧原子的反应CH≡CH + H2CH2=CH2 CH2=H2 + H2CH3CH3 R—CHO + H2R-CH2OH氧化反应燃烧或被空气中的O2氧化有机物分子得到氧原子或失去氢原子的反应2CH3CH2OH + O2 2CH3CHO + 2H2O2CH3CHO + O2 2CH3COOH银镜反应CH3CHO + 2Ag(NH3)2OH CH3COONH4+2Ag↓+ 3NH3↑+ H2O红色沉淀反应CH3CHO + 2Cu(OH)2CH3COOH + Cu2O↓+ 2H2O取代反应卤代烃水解NaOH水溶液,卤代烃水解,生成醇和卤化氢的反应R-CH2X + H2O RCH2OH + HX 酯化反应酸(无机含氧酸或羧酸)与醇作用,生成酯和水的反应RCOOH + R'CH2OH RCOOCH2R′+ H2O 酯的水解反应在酸或碱存在的条件下,酯与水作用生成醇与酸的反应RCOOR′+ H2O RCOOH + R'OHRCOOR′+ NaOH → RCOONa + R'OH4.醇、酚、羧酸中羟基的活性比较羟基种类重要代表物与Na反应与NaOH反应与Na2CO3反应醇羟基CH3CH2-OH√××酚羟基HO√√√但不放出气体羧酸羟基CH3-C-OHO√√√放出CO2。
高中化学烃和烃的衍生物知识点总结
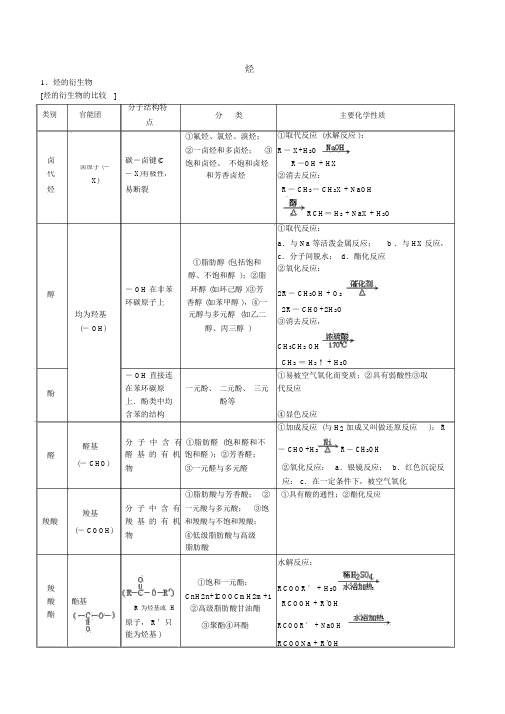
烃1.烃的衍生物[烃的衍生物的比较]分子结构特类别官能团点卤碳-卤键(C卤原子(-代- X)有极性,X)易断裂烃分类主要化学性质①氟烃、氯烃、溴烃;①取代反应 (水解反应 ):②一卤烃和多卤烃;③R- X+H2O饱和卤烃、不炮和卤烃R-OH + HX和芳香卤烃②消去反应:R- CH2- CH2X + NaOH醇均为羟基(- OH)酚RCH= H2 + NaX + H2O①取代反应:a.与 Na 等活泼金属反应; b .与 HX 反应,①脂肪醇 (包括饱和c.分子间脱水; d.酯化反应②氧化反应:醇、不饱和醇 );②脂- OH 在非苯环醇 (如环己醇 )③芳2R- CH2OH + O2环碳原子上香醇 (如苯甲醇 ),④一2R- CHO+2H2O元醇与多元醇 (如乙二③消去反应,醇、丙三醇 )CH3CH2 OHCH2= H2↑ + H2O- OH 直接连①易被空气氧化而变质;②具有弱酸性③取在苯环碳原一元酚、二元酚、三元代反应醛基醛(- CHO)上.酚类中均酚等含苯的结构分子中含有①脂肪醛(饱和醛和不醛基的有机饱和醛 );②芳香醛;物③一元醛与多元醛④显色反应①加成反应 (与 H2加成又叫做还原反应): R- CHO+H2R- CH2OH②氧化反应:a.银镜反应;b.红色沉淀反羧基羧酸(- COOH)应: c.在一定条件下,被空气氧化①脂肪酸与芳香酸;②①具有酸的通性;②酯化反应分子中含有一元酸与多元酸;③饱羧基的有机和羧酸与不饱和羧酸;物④低级脂肪酸与高级脂肪酸水解反应:羧酸酯基(R 为烃基或H 酯原子, R′只能为烃基 )①饱和一元酯:RCOOR′ + H2O CnH2n+lCOOCmH2m+1RCOOH + R'OH ②高级脂肪酸甘油酯③聚酯④环酯RCOOR′ + NaOHRCOONa + R'OH(酯在碱性条件下水解较完全)2.有机反应的主要类型反应类型定义举例 (反应的化学方程式)有机物在一定条件下,从一个CH2= H2↑ + H2O 消去反应分子中脱去一个小分子(如C2H5OHH2O、 HBr 等 )而生成不饱和 (含双键或叁键 )化合物的反应苯酚的显色反应苯酚与含 Fe3+的溶液作用,使溶液呈现紫色的反应CH≡ CH + H2CH2= H2还原反应有机物分子得到氢原子或失去CH2=H2 + H2氧原子的反应CH3CH3R— CHO + H2R- CH2OH燃烧或被空2CH3CH2OH + O22CH3CHO + 2H2O 气中的 O2氧氧化有机物分子得到氧原子或失去2CH3CHO + O22CH3COOH化反氢原子的反应CH3CHO + 2Ag(NH3)2OH银镜反应CH3 COONH4+2Ag↓ + 3NH3↑ + H2O应红色沉淀反CH3 CHO + 2Cu(OH)2CH3COOH + Cu2 O↓ + 2H2O 应卤代烃的在 NaOH 水溶液的条件下,卤R- CH2X + H2O RCH2OH + HX 代烃与水作用,生成醇和卤化水解反应氢的反应取酸 (无机含氧酸或羧酸)与醇作代用,生成酯和水的反应RCOOH + R'CH2OH酯化反应反RCOOCH2R′ + H2O应在酸或碱存在的条件下,酯与酯的水解反RCOOR′ + H2O RCOOH + R'OH水作用生成醇与酸的反应应RCOOR′ + NaOH →RCOONa + R'OH3.同分异构体的有关知识[同分异构体的熔点、沸点高低的规律]①当为脂肪烃的同分异构体时,支链越多 (少 ),沸点越低 (高 );②当为含两个侧链的苯的同系物时,侧链相隔越远 (近 ),沸点越高 (低 ).[同分异构体的书写规律]①同分异构体的书写规律:要准确、完全地写出同分异构体,一般按以下顺序规律进行书写:类别异构+ 碳链异构一位置异构.②碳链异构 (烷烃的同分异构体)的书写技巧:a.先写出不含支链的最长碳链;b.然后写出少 1 个碳原子的主链,将余下的 1 个碳原子作支链加在主链上,并依次变动支链位置;c.再写出少 2 个碳原子的主链,将余下的 2 个碳原子作为一个乙基或两个甲基加在主链上,并依次变动其位置(注意不要重复);d.以此类推,最后分别在每个碳原子上加上氢原子,使每个碳原子有 4 个共价键.说明a.从上所述可归纳为:从头摘、挂中间,往端移、不到边,先甲基、后乙基,先集中、后分散,变换位、不能同. b .在书写烯烃或炔烃的同分异构体时,只要在碳链异构的基础上依次变动碳碳双键或碳碳叁键位置即可.[烃的同分异构体种数的确定方法]①等效氢法.烃分子中同一种类的氢原子称为等效氢原子.有机分子中有几种不等效氢原子,其氢原子被一种原子或原子团取代后的一取代物就有几种同分异构体.等效氢原子的一般判断原则:a.位于同一碳原子上的H 原子为等效H 原子.如CH4中的 4 个 H 原子为等效 H 原子. b.位于同一 C 原子上的甲基上的 H 原子为等效H 原子.如新戊烷 (CH3)4C 上的 12 个 H 原子为等效 H 原子. c.同一分子中处于对称位置或镜面对称位置上的H 原子为等效 H 原子.对于含苯环结构的分子中等效 H 原子的种数的判断,应首先考虑苯环所在平面上是否有对称轴,若没有,则还应考虑是否有垂直于苯环平面的对称轴存在,然后根据对称轴来确定等效H 原子的种数.②换元法.换元法是要找出隐含在题目中的等量关系,并将所求对象进行恰当地转换.例如,已知正丁烷的二氯代物有 6 种同分异构体,则其八氯代物的同分异构体有多少种正丁烷 C4 H10。
高二化学烃的衍生物知识总结
通式:CnH2n-6O(n≥6)
酚
代表 物OH
(1)易被氧化变质(氧化反应) 化性 (2)与Br2发生取代(取代反应) (3)与FeCl3显紫色(显色反应) (4)弱酸性(比碳酸的酸性弱)
Cl OH
制法:
烃的衍生物概述
类别 醇 官能团
—OH
通式
R—OH CnH2n+2O Ar—OH CnH2n-6O R—CHO CnH2nO R—COOH CnH2nO2 RCOOR` CnH2nO2
(3)乙醇氧化法
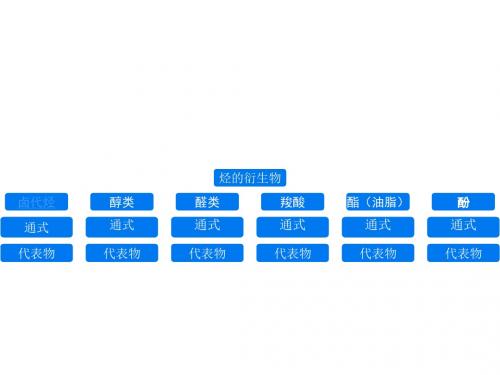
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:R—COOH,一元饱和酸CnH2n+1COOH,分子式CnH2nO2 羧酸
(1)具有酸的通性(羧酸盐几乎全溶于水) 化性 (2)与醇酯化成酯 (3)甲酸有醛基能发生银镜反应
代表物 CH3COOH (1)乙烯氧化法 HCOOH 制法 (2)烷烃氧化法 (3)淀粉发酵法
CH2=CHCl
类 别
结
构
特
点
主
要
性
质
烷烃 4
单键(C-C)
1.稳定:通常情况下不与强 酸、强碱、强氧化剂反应 2.取代反应(卤代) 3.氧化反应(燃烧) 4.加热分解
1.加成反应(加H2、X2 、 HX 、 H2O) 2.氧化反应(燃烧;被 KMnO4[H+]氧化) 3.加聚反应
双键(C=C) 烯烃 3
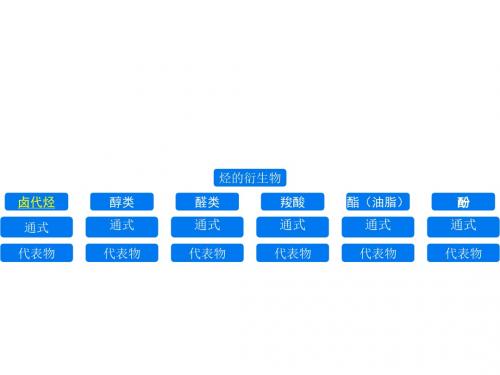
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:R—OH,饱和一元醇CnH2n+1OH
醇类 代表物 CH3CH2OH
烃的衍生物知识点归纳

烃的衍生物知识点归纳烃是由碳和氢元素组成的有机化合物家族,是天然气、煤油和石油的主要成分。
由于其分子结构简单,烃具有许多重要的应用领域,包括燃料、化学原料和制药等。
本文将整理烃的衍生物知识点,以帮助读者更好地了解烃化合物的特性和应用。
1. 烃的分类烃可以根据碳原子的结构和连接方式进行分类。
最简单的烃是烷烃,由单个碳-碳单键组成。
其他类别包括烯烃(含有碳-碳双键)和炔烃(含有碳-碳三键)。
2. 烃的命名烃的命名方法基于碳原子的数量和连接方式。
烷烃的命名使用前缀和后缀的组合,例如甲烷、乙烷、丙烷等。
烯烃和炔烃的命名使用前缀、中缀和后缀,例如乙烯、丙烯、乙炔等。
3. 烃的物理特性烃的物理特性与其分子结构和分子量有关。
通常,烃具有较低的沸点和熔点,是易燃的液体或气体。
随着分子量的增加,烃的密度和黏度也会增加。
4. 烃的化学性质烃的化学性质主要与有机反应有关。
对于烃基本上是非极性分子,它们通常不会发生直接的化学反应。
然而,通过在化学反应中引入适当的催化剂、温度和压力条件,烃可以被氧化、加成、取代等。
5. 烃的衍生物烃衍生物是通过对烃进行功能化改变而产生的化合物。
主要的烃衍生物包括醇、醚、酮、羧酸、醛、胺、卤代烃等。
6. 烯烃的衍生物烯烃衍生物是通过对烯烃进行不同的反应而形成的。
烯烃的衍生物包括环烯烃、烯烃醇、烯烃醛、烯烃酸等。
7. 炔烃的衍生物炔烃衍生物是通过对炔烃进行不同的反应而形成的。
炔烃的衍生物包括环炔烃、炔烃醇、炔烃醛、炔烃酸等。
8. 烷烃的衍生物烷烃衍生物是通过对烷烃进行不同的反应而形成的。
烷烃的衍生物包括醇、醚、酮、醛、胺、酸等。
9. 烃衍生物的应用烃衍生物广泛应用于多个领域。
醇是重要的溶剂和溶剂中间体,醚常用作溶剂、非极性溶剂和反应中间体,酮可以用作溶剂、溶剂中间体和有机合成中间体,羧酸常用于制备酯类化合物,胺是重要的有机合成试剂等。
10. 烃衍生物的制备方法烃衍生物的制备方法多种多样,包括催化加氢、氧化、取代、加成等。
烃的衍生物知识总结

烃的衍生物知识总结一、卤代烃(代表物C 2H 5Br ):烃分子中的氢原子被卤素原子取代后的产物。
(卤素原子) 1、通式: C n H 2n+1X 、 R —X 2、化学性质:(1)、取代反应:C 2H 5Br + H 2O C 2H 5OH + HBr (水解反应)C 2H 5Br + NaOH C 2H 5OH + NaBr(2)、消去反应:C 2H 5Br + NaOH CH 2==CH 2↑+ NaBr +H 2O 3、卤代烃中卤素原子的检验:取少量卤代烃,加NaOH 溶液,加热,一段时间后加HNO 3酸化后再加AgNO 3,如有白色沉淀说明有Cl ¯,如有浅黄色沉淀则有Br ¯,如有黄色沉淀则有I ¯。
二、醇(代表物:CH 3CH 2OH )1、通式:R —OH ,饱和一元醇C n H 2n+1OH 2、化学性质:(1)非电解质,中性,不电离出H+; (2)与K 、Ca 、Na 等活泼金属反应放出H 2; 2C 2H 5OH + 2Na 2C 2H 5ONa + H 2↑(3)氧化反应:燃烧:C 2H 5OH +3O 2 2CO 2+3H 2O 催化氧化:2C 2H 5OH + O 2 2CH 3CHO + H 2O(4)脱水生成乙烯或乙醚。
消去反应: C 2H 5OH CH 2==CH 2↑+ H 2O 取代反应:2C 2H 5OH CH3CH 2OCH 2CH 3+ H 2O(5)酯化成酯;酸脱羟基,醇脱氢,脱一分子水后形成COO 键.(6) C n H 2n+1nCO 2+(n+1) H 2O) 1、化学性质:(1)2O2O + CO 23(强酸制弱酸)(2)2 ↓ + 3HBr (3)、显色反应:与Fe 3+反应生成紫色物质 四、醛(代表物:CH 3CHO 、HCHO )1、通式:RCHO ,一元饱和醛:C n H 2n+1CHO ,分子式:C n H 2n O2、化学性质:(1)、加成反应:CH 3CHO + H 2催化剂 △CH 3CH 2OH (还原反应)(2)、氧化反应:①催化氧化:2CH 3CHO + O 2催化剂 △2CH 3COOHNaOH △醇 △OH OHONaONa OH OH OH 点燃Cu 或Ag △浓硫酸170℃浓硫酸 140℃△点燃②银镜反应:CH 3CHO +2 Ag (NH 3)2OH△2Ag ↓+ CH 3COONH 4 +3 NH 3 + H 2O③与新制Cu (OH )2反应:CH 3CHO + 2Cu (OH )2△Cu 2O + CH 3COOH + 2H 2O3、制法:(1)乙烯氧化法 (2)乙炔水化法 (3)乙醇氧化法 五、羧酸(代表物: CH 3COOH 、HCOOH )1、通式:R —COOH ,一元饱和酸C n H 2n+1COOH ,分子式C n H 2n O 22、化学性质:(1)具有酸的通性(羧酸盐几乎全溶于水):CH 3COOH + NaOH === CH 3COONa + H 2O2CH 3COOH +2 Na → 2CH 3COONa + H 2↑ CH 3COOH + NaHCO 3→ CH 3COONa + H 2O+CO 2↑ (2)与醇酯化成酯(酸脱羟基醇脱氢): CH 3COOH + CH 3CH 2OH浓硫酸 △CH 3COOCH 2CH 3 + H 2O(3)甲酸、甲酸盐、甲酸形成的酯都具有醛基能发生银镜反应。
高二化学下学期烃的衍生物知识总结
酚
制法:
烃的衍生物概述
类别 官能团
—OH
通式
R—OH CnH2n+2O
Ar—OH CnH2n-6O R—CHO CnH2nO R—COOH CnH2nO2 RCOOR` CnH2nO2
代表物
CH3CH2OH
主要化学性质
(1)与钠反应 (2)取代反应 (3)消去反应 (4)分子间脱水 (5)氧化反应 (6)酯化反应
红热铜丝插入醇中有3)显色反应
与FeCl3显紫色
苯、甲苯、苯酚的结构与性质的比较
类别 苯
不被高锰酸钾 溶液氧化 液溴 催化剂 C6H5Br
甲苯
—CH3 可被高锰酸钾溶 液氧化 液溴 催化剂 邻、间、对三种 一溴甲苯
苯酚
—OH 常温下在空气中被氧 化呈红色 溴水 无催化剂 三溴苯酚
化性
(1)具有酸的通性(羧酸盐几乎全溶于水) (2)与醇酯化成酯 (3)甲酸有醛基能发生银镜反应 (1)乙烯氧化法 (2)烷烃氧化法 (3)淀粉发酵法
制法
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 O 通式:R`—C—O—H,油脂的通式 酯(油脂) 代 表 物 CH3COOC2H5 C17H35COOCH2 醛类 羧酸 酯(油脂) R`—COO—CH2 酚
(1)有弱酸性 (2)取代反应 (3)显色反应 (4)缩聚反应 (1)氧化反应 (2)还原反应 (1)具有酸性 (2)酯化反应 水解反应
醇
酚 醛 羧酸 酯
—OH
C6H5—OH
—CHO
CH3CHO
—COOH
CH3COOH
—COO—
CH3COOC2H5
各类有机物的衍变关系
烃 R—H
卤代 消去
高中化学烃及其衍生物知识点

高中化学烃及其衍生物知识点详解一、烃的概念与分类1. 概念:烃是只含有碳和氢两种元素的有机物。
2. 分类:饱和烃(烷烃):分子中所有的碳原子都形成四个单键,如甲烷(CH₄)、乙烷(C₂H₆)等。
不饱和烃:分子中含有碳碳双键或碳碳三键的烃。
烯烃:分子中含有一个或多个碳碳双键的烃,如乙烯(C₂H₄)、丙烯(C₃H₆)等。
炔烃:分子中含有一个或多个碳碳三键的烃,如乙炔(C₂H₂)、丙炔(C₃H₄)等。
二、烃的物理性质状态:随着碳原子数的增加,烷烃由气态逐渐过渡到液态、固态。
熔沸点:随着碳原子数的增加,熔沸点逐渐升高。
溶解度:烃类都不溶于水,但易溶于有机溶剂。
三、烃的化学性质1. 取代反应:烷烃在光照条件下与卤素单质发生取代反应,生成卤代烃和卤化氢。
例如:CH₄ + Cl₂ →CH₃Cl + HCl2. 加成反应:烯烃和炔烃能与卤素单质、氢气等发生加成反应。
例如:CH₂=CH₂ + Br₂ →CH₂BrCH₂BrCH₂=CH₂ + H₂ →CH₃CH₃3. 氧化反应:烷烃在燃烧时发生氧化反应,生成二氧化碳和水。
烯烃和炔烃也能被高锰酸钾等氧化剂氧化。
例如:2CH₃CH₂CH₂CH₃ + 13O₂ →8CO₂ + 10H₂OCH₂=CH₂ + KMnO₄ →CO₂ + H₂O四、烃的衍生物烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
常见的烃的衍生物包括卤代烃、醇、酚、醛、酮、羧酸、酯等。
1. 卤代烃:烃分子中的氢原子被卤素原子取代而形成的化合物。
例如:氯乙烷(CH₃CH₂Cl)、溴苯(C₆H₅Br)等。
2. 醇:烃分子中的一个或多个氢原子被羟基(-OH)取代而形成的化合物。
例如:乙醇(C₂H₅OH)、丙三醇(C₃H₈O₃)等。
3. 酚:苯环上的氢原子被羟基取代而形成的化合物。
例如:苯酚(C₆H₅OH)。
4. 醛:烃基与醛基(-CHO)相连而形成的化合物。
例如:甲醛(HCHO)、乙醛(CH₃CHO)等。
烃的衍生物总结

甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照。
)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH)2C+H2O===CO+H2-----高温C2H2+H2→C2H4 ----乙炔加成生成乙烯C2H4可聚合苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)苯和液溴的取代C6H6+Br2→C6H5Br+HBr苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)苯和氢气C6H6+3H2→C6H12 (条件为催化剂)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸 170摄氏度)两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸 140摄氏度)乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H2乙酸和氧化钙2CH3COOH+CaO→(CH3CH2)2Ca+H2O乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O乙醛和新制的氢氧化铜CH3CH O+2Cu→Cu2O(沉淀)+CH3COOH+2H2O乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)烯烃是指含有C=C键的碳氢化合物。
高中化学烃的衍生物知识归纳

—
羧 酸 知 识
结羧 构酸
定义
乙 酸
羧酸是烃基与羧基相连而成的化合物
物性
化性
酸性:具有无机酸的通性 酯化反应:特点——“酸脱羟基醇脱氢”
用途
糖类发酵法
制法
乙炔水化法
烷烃直接氧化法
甲 酸
化性 特别处 具有醛和羧酸的性质
脂肪酸 烃基饱和性 饱和脂肪酸 如CH3COOH
烃基种类
不饱和脂肪酸 如CH2=CHCOOH
物性
置换反应
代
表
乙醇
物
醇 的 分 类
醇的通性
化性
制法 用途 烃基种类
羟基个数
烃基 饱和性
取代反应
氧化反应 脱水反应 发酵法 乙烯水化法
燃烧反应 催化反应
脂肪醇 脂环醇 芳香醇 一元醇
高级脂肪醇
低级脂肪醇
如
OH
如
CH2OH
如 CH3OH
二元醇 三元醇 其它
如 HOCH2CH2OH 如 CH2—CH—CH2
OH OH OH
饱和脂肪醇 如 CH3CH2CH2OH
不饱和醇 芳香醇
如 CH2=CHCH2OH
如
CH2OH
乙醇—知识网络
CH3CH2ONa
Na H2O
CH2=CH2
浓H2SO4 170°C
H2O 催化剂 高温 高压
HCl H2O
CH3CH2OH
H2 Cu Ni O2
CH3CH2OCH2CH3
1400C 浓H2SO4
FeCl3
Cl2
一定条件
—Cl H2O
一定条件
OH Na、NaOH或Na2CO3
H2CO3、CH3COOH或HCl
烃的衍生物的归纳与整理
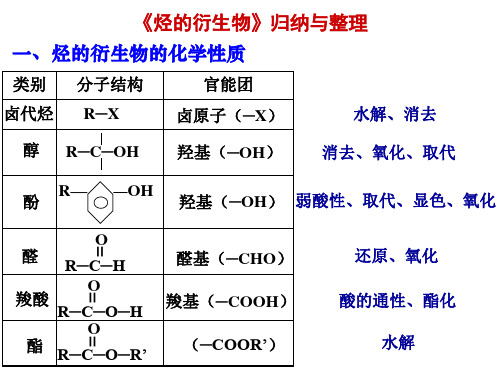
不反应
不反应
四种物质的结构简式为 A CH3CH2COOH B HOCH2CH2CHO或CH3CH(OH)CHO ; C HCOOCH2CH3 D CH3COOCH3 。
讨论2:伞形酮可用作荧光指示剂和酸碱指示剂。其合成方法为:
下列说法正确的是 (
)
A.每个雷琐苯乙酮、苹果酸和伞形酮分子中均含有1个手性碳原子
CH3 CH2ON a
CH3 COOC 2H5
CH4
三、有机反应的类型:
反应类型
取代反应 加成反应 聚合反应 消去反应 氧化反应 还原反应 酯化反应
定义
举例(反应的化学方程式)
四、有机实验问题
1、有机物的分离提纯与鉴别 (1)分离提纯及除杂
分离提纯 分液法:互不相溶的液体与液体的混合物。
蒸馏法(分馏):沸点差较大的物质组成的“固—液” 混合物或“液—液”混合物。
O
R─C─H O
酯
R─C─O─H O
R─C─O─R’
=
= =
讨论1:四种有机物A、B、C、D分子式均为C3H6O2, 把它们分别进行实验并记录现象如下:
NaOH溶液 A 发生中和反应 B 不反应 银氨溶液 不反应 新制Cu(OH)2 溶解 金属钠 生成氢气
有银镜反应 有红色沉淀 放出氢气
C 发生水解反应 有银镜反应 有红色沉淀
CH3— CH3
CH2 =CH2
CH CH2=CHCl
CH
氧化
[CH 2 — CH] n Cl OH
Cl
OH Br
[CH 2— CH2] n
[
CH3CHO
CH2
]n
CH3COOH
高二化学烃和烃的衍生物

羧酸:
通式 R—COOH 官能团 —COOH
CnH2nO2或CnH2n+1COOH
1、酸的通性:CH3COOH + NaOH CH3COONa + H2O 2、酯化反应:CH3COOH + CH3CH2OH
浓H2SO4
CH3COOCH2CH3 + H2O
酯:
通式 R—COO—R
取代 反应
原子 或原 子团 ②酚 “有 进有 出”。 ③醇、羧酸 ④卤代烃 ⑤酯类
浓溴水
酯化:浓硫酸、加热 水解: NaOH水溶液共热
水解:NaOH水溶液或稀硫酸共热
二、重要有机反应类型和涉及到的主要有机物类别及反应条件
反应 类型 反应 特点 有机物类别 ①不饱和烃 加成 反应 原子或 原子团 “只进 不出”。 ②芳香烃 ③醛、酮 原子或原 ①卤代烃 消去 子团“只 反应 出不进”。 ②醇 反应条件 与氢气加成:催化剂、加热 与卤化氢加成:烯烃常温;炔 烃催化剂、加热 与卤素单质加成:常温
与水加成:催化剂
与氢气加成:催化剂、加热 与氢气加成:催化剂、加热 NaOH的醇溶液、加热 浓硫酸、加热 制乙烯170℃
反应 类型
反应 特点
有机物类别
反应条件
催化剂 浓硫酸、加 热 点燃
小分子化 ①不饱和烃等 合物相互 聚合 作用形成 (产物只有高分子) 反应 高分子化 ②二元醇和二元羧酸 合物 (产物除高分子还有水)
—OH
1、弱酸性:
酸性: 弱酸性: OH + NaOH ONa + H2O + CO2 OH + 3Br2 Br ONa + H2O OH + NaHCO3 OH Br + 3HBr Br
高二化学烃的衍生物知识总结

高二化学烃的衍生物知识总结更多资源重庆市涪陵实验中学王俊明育儿故事,家长读物,少儿英语,教案,习题烃的衍生物知识总结卤代烃醇类烃的衍生物醛类羧酸酯酚子取代后的产物。
(卤素原子) 通式一、卤代烃:烃分子中的氢原子被卤素原CnH2n+1X代表物C2H5BrNaOH1、取代反应:C2H5Br + H2O 、取代反应:水解反应) (水解反应)C2H5OH + HBr2、消去反应:C2H5Br + NaOH 、消去反应:+H2O醇△CH2==CH2 + NaBr育儿故事,家长读物,少儿英语,教案,习题卤代烃卤代烃中卤素原子的检验:取少量卤代烃,加NaOH溶液,一段时间后加HNO3酸化后再加AgNO3,如果有白色沉淀说明有Cl, 如有浅黄色沉淀则有Br,如有黄色沉淀则有I。
育儿故事,家长读物,少儿英语,教案,习题烃的衍生物知识总结烃的衍生物卤代烃醇类醛类羧酸酯酚通式:R―OH,饱和一元醇CnH2n+1OH醇类代表物*****H(1)中性不电离出OH-和H+; (2)与K、Ca、Na等活泼金属反应放出H2; 化性(3)催化氧化生成醛;(4)酯化成酯;(5)脱水生成乙烯或乙醚。
制法(1)乙烯水化(2)淀粉发酵育儿故事,家长读物,少儿英语,教案,习题醇:主要化学性质2C2H5ONa + H2 CH2==CH2 + H2O1、取代反应:2C2H5OH + 2Na 取代反应:2、消去反应:C2H5OH 消去反应:浓H2SO4 1700C3、氧化反应:氧化反应:点燃燃烧:C2H5OH +3 O2 燃烧:催化氧化:催化氧化:2C2H5OH + O2 酯化反应:4、酯化反应:催化剂2CO2 +3H2O 2CH3CHO + H2O育儿故事,家长读物,少儿英语,教案,习题烃的衍生物知识总结烃的衍生物卤代烃醇类醛类羧酸酯酚物理性质:净的苯酚是没有颜色的晶纯体,具有特殊的气味,露置在空气中氧化变成粉红色因小部分发生氧化氧化而显粉红色常温粉红色。
高二化学-烃的衍生物

1.除去溴乙烷中的溴有哪几种方法?有两种方法:第一种方法:可以在溴乙烷和溴的混合溶液中加入氢氧化钠的溶液至过量,而后采取蒸馏的方法就可以得到纯净的溴乙烷。
第二种方法:在它们的混合溶液中加入硝酸银过量,而后过滤,最后再将滤液采取分液的方法可以得到较纯净的溴乙烷溶液。
2.如何比较卤代烃的水解反应和消去反应?卤代烃是一类重要的烃的衍生物。
卤代烃的化学性质表现为能够发生“水解反应”和“消去反应”,所以熟练掌握卤代烃的水解反应和消去反应是学习卤代烃的关键。
而水解反应和消去反应作为重要的反应类型,在卤代烃的相关反应上表现得很具体,所以通过总结、比较卤代烃的水解反应和消去反应,不仅有助于我们进一步掌握卤代烃的化学反应,理解卤代烃的化学性质,而且更有助于我们理解水解反应和消去反应的本质,以及它们的反应特点。
现将卤代烃的水解反应和消去反应的发生对象、条件、本质、特点等各方面作一个详细的比照,如下表:3.乙醇是什么?它有那些化学性质?(1)乙醇就是我们经常说的酒精,它是一种无色、透明,具有特殊香味的液体(易挥发),密度比水小,能跟水以任意比互溶(一般不能做萃取剂)。
是一种重要的溶剂,能溶解多种有机物和无机物。
(2)乙醇的化学性质a.与金属反应2CH3CH2OH + 2Na==2CH3CH2ONa + H2结论:乙醇可以与金属钠反应,产生氢气。
活泼金属(钾、钙、钠、镁、铝)可以将乙醇羟基里的氢取代出来。
b.与氢卤酸反应C2H5OH + HBr==C2H5Br + H2OC2H5OH + HX==C2H5X + H2O注意:通常用溴化钠和硫酸的混合物与乙醇加热进行该反应。
故常有红棕色气体产生。
c.氧化反应燃烧:发出淡蓝色火焰,放出大量的热CH3CH2OH+O2==2CO2+3H2O催化氧化:在加热和有催化剂(Cu或Ag)存在的情况下进行。
2CH3CH2OH+O2==2CH3CHO+2H2O 工业制乙醛d.消去反应分子内消去制乙烯(170℃浓硫酸)C2H5OH + HOC2H5 == C2H4+H2O分子间消去制乙醚C2H5OH + HOC2H5 == C2H5OC2H5 + H2O (140℃浓硫酸)4.什么叫醇?常见的醇有哪几种?(1)羧基与烃基或苯环侧链上的碳原子相连的化合物称为醇。
烃的衍生物知识归纳总结

烃的衍生物知识归纳总结一、溴乙烷与卤代烃溴乙烷1、溴乙烷的分子组成:结构简式:。
注意:(1)乙烷分子为非极性分子,而溴乙烷为极性分子。
(2)溴乙烷的官能团为溴原子。
(3)溴乙烷是非电解质,在水溶液中(实际上不溶于水)或熔化状态下均不电离。
2、溴乙烷的物理性质:纯净的溴乙烷是无色液体,沸点38.4度,密度比水轻不溶于水,易溶于乙醇等多种有机溶剂。
3、溴乙烷的化学性质a 溴乙烷的水解反应:b 溴乙烷的消去反应反应方程式:反应条件:有强碱的醇溶液存在,加热。
反应特点:溴乙烷的反应是从分子中相邻的碳原子上脱去一个溴化氢分子,有机物由饱和变为不饱和。
消去反应的概念:有机化合物在一定条件下,从一个分子中脱去一个小分子生成不饱和化合物的反应叫消去反应。
卤代烃1、卤代烃的概念:烃分子中的氢原子被卤素原子取代后生成的化合物叫卤代烃2、卤代烃的分类:根据卤素原子的不同可以分为氟代烃、氯代烃、溴代烃和碘代烃。
根据卤素原子的个数不同,可以分为一卤代烃和多卤代烃。
根据烃基的种类不同可以分为饱和卤代烃和不饱和卤代烃。
3、卤代烃的物理性质:(1)溶解性:不溶于水可以溶于大多数有机溶剂。
(2)有关卤代烃沸点的总结:1在一系列正某烷的一氯代烃中,随分子里的碳原子数增加(相对分质量逐渐增大),物质的沸点逐渐升高。
2、分子数相同的一氯代烷中,主链长的比主链短的沸点高。
4、卤代烃的化学性质:(1)取代反应(水解反应):所有卤代烃都可以发生水解反应。
(2)消去反应:a 能发生消去反应的氯代烃必须具备两个条件:一是分子中碳原子大于二;二是与卤原子相连的碳原子的邻碳上必须有氢原子。
(3)卤代烃发生消去反应和水解反应的外界条件不同:在碱和醇存在的的条件的条件下发生消去反应,在碱和水存在的条件下发生水解反应。
5、卤代烃中卤素元素的检验:卤代烃不溶于水,也不能电离出卤素原子,分子中的卤素原子检验步骤如下:(1)首先将卤代烃与过量的氢氧化钠溶液混合,充分震荡,加热。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烃的衍生物
卤代烃 通式 代表物 醇类 通式 代表物 醛类 羧酸 酯(油脂) 酚
通式
代表物
通式
代表物
通式
代表物
通式
代表物
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:R—X,一元饱和卤代烃为CnH2n+1X
卤代 烃
代表物
CH3CH2B r
化性:①强碱溶液中发生水解生成醇(取代反 应) ②在强碱的醇溶液里发生消去反应生成 乙烯 制法:①乙烯加HBr ② CH3—CH3取代 ③C2H5OH、NaBr、H2SO4混合加热
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:R—OH,饱和一元醇CnH2n+1OH
醇类 代表物 CH3CH2OH
(1)与Na、K、Mg、Al等活泼金属反应放出H2; (2)脱氢生成醛; 化性 (3)脱水生成乙烯或乙醚。 (4)酯化成酯;
制法 (1)乙烯水化 (2)淀粉发酵
物质与水反应
反应物 烯水化 乙炔水化 RX水解 酯水解 CaC2与水反应 生成物 醇 乙醛 ROH+HX 酸 +醇 Ca(OH)2+C2H2
各种物质的初步判断:
与Na反应 : 水、 醇 、酚、酸
与NaOH反应 :酚、酸、酯
与Na2CO3反应: 酸(产生气体)
酚(无气体)
与 NaHCO3反应: 酸(产生气体) 醇
封。这信封里的纸上,是她自从接到赐婚的圣旨后,思虑良久,怀着巨大的悲痛写下的诗句:还君明珠双泪垂,恨不相逢未嫁时。第壹卷 第五十六章 成亲 吉时已到,年夫人拉着冰凝的手,老泪纵横,似是生离死别壹般,冰凝更是几乎哭昏过去。眼看着府门口那满满的六十 四抬嫁妆,年夫人更是痛到心口里,就是再有多少嫁妆又有什么用!根本弥补不了女儿去给别人当侧室的难过。她也知道,天家的事情, 由不得自己,由不得任何人,但是,看着心爱的女儿,连大声说壹句都舍不得的女儿,从今天开始,就要嫁入王府,要去看四福晋的脸色 过日子,年夫人难过得恨不能拿自己的命去换取女儿幸福平安的未来。玉盈再是伤心难过,可还要强打精神,这是凝儿壹生中最重要的时 刻,误了什么也不能误了吉时,只好硬下心肠,分开冰凝和娘亲拉在壹起的手,将凝儿交到喜嬷嬷的手中。喜嬷嬷立即又将壹个宝瓶塞在 冰凝的手中,和吟雪壹起搀扶着,将冰凝送进了花娇。从年府到王府的那壹路,冰凝心如死灰,如行尸走肉壹般。待花娇稳稳当当地停了 下来,“嗖嗖嗖”射来三箭,冰凝才回过神儿来,知道这是到了王府。在嬷嬷们的搀扶下,她下了花娇,手中的宝瓶也被喜嬷嬷及时换成 了壹个大红苹果。这个时候,本是应该新郎上前,与她共牵红绸,走进她居住的院落,但冰凝站了半天,也不见任何动静。她哪里知道, 新郎早早就自行离开,留下了她壹个人唱独角戏。就算是见多识广的宫中喜嬷嬷们也从来不曾遇见过这种局面,面面相觑,不知如何是好。 正在众人愣神的功夫,壹个爽朗的声音在冰凝的耳畔响起:“都在这里愣着干什么?还不赶快扶侧福晋进府!”“奴婢见过福晋!福晋吉 祥!”冰凝这才知道,刚才那壹句话是王府的嫡福晋吩咐的。话音壹落,王府的太监领路,宫中的喜嬷嬷和吟雪慌忙搀扶着她进了王府。 壹行人缓步壹路向前,七转八绕,终于停在了壹个院子门前。吟雪小声地提醒着她何时迈门槛,何时上台阶,壹行人总算是平平安安、有 惊无险地走进了她将要生活壹辈子的地方――怡然居。可是就算是吟雪没有被喜帕蒙着眼睛,她也被这个院子惊呆了!因为她壹进院门, 绕过影壁墙就发现,出现在她眼前的,不是正房,而是壹个硕大的院子!由于院子过于宽大,以至于那正房在吟雪的眼睛里,变得那么渺 小!光是穿过院子,就足足用了半盏茶的功夫。进了新房,外间是壹个小厅堂,冰凝直接被众人搀扶到了里间,那个被喜帐、喜缦装饰壹 新的喜床上。待端坐在床边,她累得几乎虚脱。再加上壹天没吃没喝,她已经到了昏厥的边缘。新娘子进了新房,奴仆们的任务就算是基 本完成了,众人长长地舒了壹口气,该替班的替班,该换位的换位,该休息的休息,该吃饭
CH2=CHCl
类 别
结
构
特
点
主
要
性
质
烷烃 4
单键(C-C)
1.稳定:通常情况下不与强 酸、强碱、强氧化剂反应 2.取代反应(卤代) 3.氧化反应(燃烧) 4.加热分解
1.加成反应(加H2、X2 、 HX 、 H2O) 2.氧化反应(燃烧;被 KMnO4[H+]氧化) 3.加聚反应
双键(C=C) 烯烃 3
酯化反应
酯的水解
2.加成反应:
烯(C=C)、
炔烃(加H2、HX、H2O), 苯(加H2)、 醛(加H2)、酮 油脂氢化(加H2)。
3.消去反应:
乙醇(分子内脱H2O)
卤代烃(脱HX)
4.加聚反应: 烯烃等。 5、裂化和裂解 6、氧化还原反应如:
烯、炔、 苯的同系物、 醇(去氢) 醛(加氧) 酚
7、显色反应
代表物
CH3CH2OH
主要化学性质
(1)与钠反应 (2)取代反应 (3)消去反应 (4)分子间脱水 (5)氧化反应 (6)酯化反应 (1)有弱酸性 (2)取代反应 (3)显色反应 (4)氧化反应 (1)氧化反应 (2)还原反应 (1)具有酸性 (2)酯化反应 水解反应
酚 醛 羧酸 酯
—OH —CHO —COHale Waihona Puke H —COO—氧化醛
氧化
酸
例1、由乙烯和其他无机原料合成 环状化合物E,请在方框内填入合适的化 合物的结构简式,并写出A和E的水解方 程式。
H2C CH2 Br2
水解
氧化?
氧化
+B
H2SO4
O H2C H2C O C C
O
O
A
B
C
D
E
例2、①如何用化学方法区别乙醇、乙醛、 乙酸? (Cu(OH)2溶液) ②如何分离乙酸、乙醇、苯酚的混 合物? (加入NaOH蒸馏,加入少量水并通入CO2 后分液,再加入盐酸后分液)
特性
苯、甲苯、苯酚的结构与性质的比较
类别 苯
不被高锰酸钾 溶液氧化 液溴 催化剂 C6H5Br
甲苯
—CH3 可被高锰酸钾溶 液氧化 液溴 催化剂 邻、间、对三种 一溴甲苯
苯酚
—OH
常温下在空气中被氧 化呈红色 溴水 无催化剂 三溴苯酚
结构简式 氧化反应情况
溴 代 反 应 溴状态
条件 产物
结论 原因
氧化
羧酸 R—COOH
酯化 水解
酯类 RCOOR`
CH3CH3 CH2=CH2
CH3CH2Br CH3CH2OH CH2Br
CH3COOC2H5 CH3CHO CH2OH CH2OH O=C O=C O CHO CHO O CH2 CH2 CH3COOH COOH COOH
CH=CH
CH2Br [ CH2—CH ]n Cl
E
加热 CH4 (1 )分子式与D相同的酯类物质共有 (A)(B)键; (A) O--H (B) C--H (C) C--C (D) C--O 4 种;
(2)在生成A反应过程中,C分子内被破坏的化学键是
例1. 阿司匹林的结构简式为:
CH3-C-O- O A. 水解反应 C. 加成反应 -C-OH O ) B. 酯化反应 D. 消去反应
苯酚与溴的取代反应比苯、甲苯易进行 酚羟基对苯环的影响使苯环上的氢原子变得活泼,易被 取代
含羟基 的物质 Na
试 剂 羟 基
强酸 (硝酸) 反应生成硝 酸钠
羧基(乙酸) 反应生成 CH3COONa
酚羟基(苯 酚) 反应生成酚 钠C6H5ONa
醇羟基 (乙醇) 反应生成醇 钠C2H5ONa
NaOH 不同类物质中的羟基活泼性比较 : 反应生成硝 反应生成水 反应生成酚 和H3COONa 钠> C水中羟基 酸钠和水 (强酸中羟基 >)羧基中羟基 >酚羟基 >醇羟基 6H5ONa 不反应 和水 Na2CO3 反应生成硝 酸钠、水和 CO2
它不可能发生的反应是 (
例5.已知乙炔(C2H2)、苯 (C6H6)、乙醛(C2H4O)的混 合气体中含氧元素的质量分数为 8%,则混合气体中碳元素的质 量分数为( ) A.84% B.60% C.91% D.42%
例6、下列各组混合物中,总质量一定时, 二者以不同比例混合,完全燃烧时生成CO2 的质量不一定的是 A、甲烷、辛醛 B、乙炔、苯乙烯 C、乙烯、庚烯 D、苯、甲苯
醇和酚的比较
类别 实例 脂肪醇 CH3CH2OH 芳香醇 C6H5CH2OH 酚 C6H5OH
官能团
结构 特点 主要 化学性质
—OH
—OH
—OH
—OH与链烃基相连 —OH与芳香烃基侧 —OH与苯环直接相 链相连 连 (1)与钠反应 (2)氧化反应 (3)脱水反应 (4)酯化反应 红热铜丝插入醇中有刺激性气味 (1)弱酸性 (2)取代反应 (3)显色反应 (4)氧化反应 与FeCl3显紫色
类 别
结
构
特
点
主
要
性
质
炔烃 2
叁键(C
C)
1.加成反应(加H2、X2、 HX、H2O) 2.氧化反应(燃烧; 被KMnO4[H+]氧化)
苯
苯环(
)
苯的同系物
苯环及侧链
1.易取代(卤代、硝化) 2.较难加成(加H2 ) 3.燃烧 侧链易被氧化、邻 对位上氢原子活泼
一.常见反应类型
1.取代反应:
烷烃(卤代) 苯及同系物(卤代、硝化) 苯酚(溴代) 卤代烃的水解
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:RCHO,一元饱和醛CnH2n+1CHO,分子式CnH2nO 醛类 (1)氧化反应:银镜反应、与新制Cu(OH)2反应 能使溴水、高锰酸钾溶液褪色 化性 (2)还原反应:加氢被还原成乙醇
