盐酸莫西沙星理化性质与质量指标
莫西沙星

莫西沙星莫西沙星是人工合成抗菌药的一种,是由德国Bayer公司研制的第四代氟喹诺酮类广谱抗菌药物,为DNA拓扑异构酶抑制剂;本文主要从产品简介、药理学特点和临床应用研究进展、以及市场分析等方面来做介绍:一、简介1、发展历程莫西沙星为人工合成抗菌药喹诺酮类(喹诺酮类,又称吡酮酸类或吡啶酮酸类,是一类较新的合成抗菌药。
喹诺酮类以细菌的脱氧核糖核酸(DNA)为靶。
妨碍DNA回旋酶,进一步造成细菌DNA的不可逆损害,达到抗菌效果。
本类药物与许多抗菌药物间无交叉耐药性,是理想的抗菌药)的一种,具体发展如下:第一代: 1962年萘啶酸(nalidixic acid),抗菌谱窄,对大多数G-菌有效,但对铜绿假单胞菌无效,抗菌力弱,口服吸收差,血药浓度低,AR多,现已淘汰;第二代:1974年吡哌酸(pipemidic acid),抗菌活性>萘啶酸, 抗菌谱由G-菌扩大到部分G+菌,对铜绿假单胞菌有效,但血药浓度低,主要用于尿道或肠道感染;第三代:1979年诺氟沙星(norfloxacin)、环丙沙星等口服易吸收,血药浓度大为提高,分布广,扩大和增强了抗菌活性:G+球菌、衣原体、支原体、军团菌及分枝杆菌;第四代:1999年莫西沙星(moxifloxacin),加替沙星等吸收快,体内分布广,抗菌作用进一步增强:既保留了钱三代抗G-菌的活性,又明显增强了G+菌的活性,特别是增加了对厌氧菌的抗菌活性;临床既用于需氧菌感染,也用于厌氧菌感染,还可用于混合感染,对绝大多数致病菌的综合临床疗效已经达到或超过了β-内酰胺类抗生素;2、基本情况(莫西沙星)通用名:Moxifloxacin商品名:Actira(Bayer)CAS登录号:151096-09-2CAS登录号(盐酸盐):186826-86-8化学名:1-环丙基-6-氟-1,4-二氢-8-甲氧基-7-[(4a S,7a S)-八氢-6H-吡咯并[3,4-b]吡啶-6-基]-4-氧代-3-喹啉羧酸1-Cyclopropyl-6-fluoro-1,4-dihydro-8-methoxy-7-[(4a S,7a S)-octahydro-6H-pyrrolo[3,4-b]pyridin-6-yl]-4-oxo-3-quinolinecarboxylic acid结构式:分子式(相对分子量):C21H24FN3O4(401.43)理化性质(盐酸盐):白色至淡黄色结晶性粉末,熔点324-325℃上市情况:1999年在德国首次上市,同年12月在美国上市;2002年在我国上市;适应症:细菌感染用法与用量:拜复乐片,一日1次,每次400mg。
欧洲药典6.0和7.0盐酸莫西沙星检测项对比

最大4.5%,测定0.200g 最大0.1%,在铂坩埚中测定1.0g
对比盐酸莫西沙星CRS 溶解50mg在5mL水中,加入1mL稀硝酸,混匀5min,过滤,滤液与氯化物反应 溶解1.0g于20mL稀NaOH溶液中 3.9到4.6,溶解0.1g于50mL不含二氧化碳的水中 -125到-138(干燥品)溶解0.200g于20.0mL乙腈:水中(1:1) LC检测,避光测定,溶剂A:溶解0.50g四丁基硫酸氢铵、1.0gKH2PO4、2mL磷酸和 0.50g无水亚硫酸钠,用水定容到1L。测定溶液a:溶解50.0mg有关物质于溶剂A中,并 用A定容到50.0mL。测定溶液b:取2.0mL溶液a用溶剂A定容到20.0mL。对照溶液a:溶 解50.0mg盐酸莫西沙星CRS于溶剂A中,并用A稀释到50mL,取2.0mL用A稀释到20mL。 对照溶液b:溶解5mg盐酸莫西沙星进行峰鉴别CPS(包括杂质ABCDE)于溶剂A中,并用 A定容到5.0mL。参比溶液c:稀释1.0mL测定溶液a,用溶剂A定容到100.0mL,稀释 1.0mL此溶液,用溶剂A定容到10mL。色谱柱:柱长0.25m, 内径4.6mm;固定相:封端苯 基柱(粒径5μm)。流动相:28:72(甲醇:溶剂A)。流速:1.3mL/min。检测波长: 293nm。进样:10μL检测溶液a和对照溶液b。运行时间:2.5倍的莫西沙星的保留时间 。 用莫西沙星的色谱图鉴别CPS峰,用对照溶液b的色谱峰来鉴别杂质A、B、C、D、E。 莫西沙星的保留时间大约14min,杂质A大约1.1;杂质B大约1.3;杂质C大约1.4;杂质 D大约1.6;杂质E大约1.7) 对照溶液b:分离度:莫西沙星和杂质A之间最小1.5 下面的杂质峰面积与相应的校正因子的乘积:杂质B=1.4;杂质E=3.5 由对照溶液c的色谱得到,每个杂质峰的峰面积不能大于主峰(0.1%) 由对照溶液c的色谱得到,每个杂质峰的峰面积不能大于主峰(0.10%) 总面积不能超过主峰面积的3倍(0.3%) 由对照溶液c的色谱得到,0.5倍的主峰峰面积
盐酸莫西沙星片 说明书

【 药品名称 】 通用名:盐酸莫西沙星片 商品名:拜复乐 英文名:Moxifloxacin Hydrochloride Tablets 汉语拼音:Yansuan Moxishaxing Pian 本品主要成份:盐酸莫西沙星,化学名为1-环丙基-7-{S,S-2,8-重氮二环[4.3.0] non-8-yl}-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物 结构式为: 厌氧卟啉单胞菌 不解糖卟啉单胞菌 magnus卟啉单胞菌 普雷沃菌属 疮疱丙酸杆菌 产气荚膜梭菌 多枝梭菌 敏 感 中 度 敏 感 其他 肺炎衣原体* 肺炎支原体* 嗜肺军团菌 伯氏柯克斯体 * 已经证实对敏感菌导致的临床适应症有效 耐 药
对于任何细菌的获得性耐药可能随地理和时间而改变,但目前莫西沙星尚 无这方面的资料. 局部耐药是可能出现的,特别是治疗严重感染时.上述体外敏感试验结果 可用来指导判断微生物是否对莫西沙星敏感. 分子式:C21H24FN3O4HCl 分子量:437.9 【 性状 】 本品为暗红色薄膜衣片. 【 药理毒理 】 1,药理作用 (1)作用机制 莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药.莫西沙星 在体外显示出对革兰阳性菌,革兰阴性菌,厌氧菌,抗酸菌,和非典型微生物 如支原体,衣原体和军团菌有广谱抗菌活性. 抗菌作用机制为干扰Ⅱ,Ⅳ拓扑异构酶.拓扑异构酶是控制DNA拓扑和在 DNA复制,修复和转录中的关键酶. 其杀菌曲线表明,莫西沙星是具有浓度依赖性的杀菌活性.最低杀菌浓度和 最低抑菌浓度基本一致. 莫西沙星对β-内酰胺类和大环内酯类抗生素耐药的细菌亦有效.通过感染 的实验动物模型证实,莫西沙星体内活性高. (2)耐药 导致对青霉素类,头孢菌素类,糖肽类,大环内酯类和四环素类耐药的耐药 机制不影响莫西沙星的抗菌活性.莫西沙星和这些抗菌药无交叉耐药性.至今未 发现质粒介导的耐药性的出现. 莫西沙星的8-甲氧基部分与8-氢部分相比具有对革兰阳性菌高活性和耐药突 变的低选择性.7位的二氮杂环取代能阻止活性流出,该活性流出为氟喹诺酮耐药 机制.体外试验显示经过多步变异才能缓慢的出现对莫西沙星的耐药性.总之其 耐药率很低(10-7-10-10).序列的将细菌暴露在低于莫西沙星MIC浓度时只能使MIC 值有少量的增加.其它喹诺酮类之间存在交叉耐药.但是,一些对其它喹诺酮类 耐药的革兰阳性菌和厌氧菌对莫西沙星敏感. (3)对人类肠道菌群的作用 通过对两名志愿者服用莫西沙星后的研究观察到下列变化:大肠杆菌,芽孢 杆菌,普通拟杆菌,肠球菌,克雷白杆菌和厌氧菌如:双歧杆菌,真杆菌和消化 链球菌等减少.这些变化在两周内可以恢复正常,未发现艰难梭菌毒素. (4)体外试验敏感数据 敏 感 中 度 敏 感 耐 药 革兰阳性菌 肺炎球菌(包括青霉素和 大环内酯类耐药菌株)* A组化脓链球菌* 米氏链球菌 轻型链球菌 无乳链球菌 停乳链球菌 金黄色葡萄球菌(包括 金黄色葡萄球菌(甲氧西林/氧氟沙星 甲氧西林敏感菌)* 耐药菌株)+ 科氏葡萄球菌 表皮葡萄球菌(包括 表皮葡萄球菌(甲氧西林/氧氟沙星 甲氧西林敏感菌株) 耐药菌株)+ 溶血葡萄球菌 人葡萄球菌 腐生葡萄球菌 模仿葡萄球菌 白喉棒状杆菌 * 已经证实对敏感菌导致的临床适应症有效 + 莫西沙星对除了由MecA基因介导的以外的甲氧西林耐药葡萄球菌的体外MIC 值在其敏感范围内,因此,如果发现MecA基因介导的甲氧西林耐药菌不应使用 莫西沙星. 敏 感 革兰阴性菌 流感嗜血杆菌(包括产生和不 产生β-内酰胺酶的菌株)* 副流感嗜血杆菌* 卡他莫拉菌(包括产生和不产 生β-内酰胺酶的菌株)* 百日咳博德特氏菌 大肠埃希氏杆菌* 肺炎克雷白菌* 产酸克雷白杆菌 产气肠杆菌 聚团肠杆菌 阴沟肠杆菌* 中间肠杆菌 阪崎肠杆菌 中 度 敏 感 耐 药 单剂量静脉和口服给予400mg莫西沙星的PK/PD比较.需住院病人的 AUC/MIC90值大于125并Cmax/MIC90为8-10为临床有效治疗期望值. 门诊病人的参数值通常要低,AUC/MIC90大于30-40. 下表为单剂量静脉和口服给予400mg莫西沙星的PK/PD的计算值比较: 给药方式 静 脉 口 服 a) 参数(中数) AUIC[h] Cmax/MIC90 AUIC[h] Cmax/MIC90 MIC90 0.125mg/L 313 32.5 279 23.6 156 16.2 140 11.8 MIC90 0.25mg/L MIC90 0.5mg/L 78 8.1 70 5.9 a) 1h输液 2,毒理 致癌,致突变 虽然有关莫西沙星致癌作用的常规长期研究尚未完成,但该药进行了基因 毒性体内和体外试验. 此外,在大鼠身上进行了对于人类的致癌作用加速试验(诱发和促进测定).5 株Ames试验中4次为阴性,中国苍鼠卵巢HPRT的突变试验和大鼠原发肝细胞的 UDS试验也均为阴性,而其它喹诺酮类TA102的Ames试验为阳性.体外试验显示 大剂量(33mg/ml)的其它喹诺酮类药物可致中国苍鼠的V79细胞出现染色体异常, 然而,小鼠体内试验核仁测定为阴性结果.此外,体内试验测定其对小鼠的显 性致死测定为阴性.总之,体内试验的结果充分反映了其体内的基因毒性.在 大鼠的诱导和促进测定中未发现莫西沙星致癌的证据. 光毒性 莫西沙星对光稳定且潜在光毒性很低.体外试验和动物试验显示莫西沙星 的光毒性较其它喹诺酮类药物小.让小鼠口服一些喹诺酮类药物并同时照射紫 外线,显示出可增加紫外线的光致癌作用. 莫西沙星的光致癌作用的研究尚未进行,在志愿者的Ⅰ期试验中证实莫西 沙星的光毒性较小. 心电图 高浓度的莫西沙星对延迟调整心脏钾离子流有抑制作用,因此导致QT间期延 长.给狗口服大于90mg/kg莫西沙星进行毒理研究,导致血药浓度大于16mg/L, 引起QT间期延长,但未发现有心律失常出现.但是累积静脉给药高于50倍人的 给药剂量(>300mg/kg),可导致血药浓度≥200mg/L(高于静脉给药治疗浓度的 30倍),并观察到可逆转,非严重的室性心律失常. 关节毒性 众所周知,喹诺酮类可以造成未成年试验动物的承重关节软骨的病变.可 造成幼年狗的关节毒性的最小口服莫西沙星剂量是推荐最大治疗剂量(400mg/50kg 人体重)的4倍,其血药浓度为推荐治疗剂量时血药浓度的2-3倍. 生殖毒性 用大鼠,兔和猴子进行的生殖研究表明,莫西沙星可以通过胎盘.对大鼠 (os和iv)和猴子(os)的试验表明,给予莫西沙星后没有致畸作用和对生殖力的影响 证据.兔静脉给药200mg/kg可观察到骨骼畸形.该研究结果与已知的喹诺酮对 骨骼发育的影响一致.血浆药物浓度在治疗浓度范围内,猴子和兔的流产发生 率增多.在大鼠身上,当口服剂量为按千克体重计算使血药浓度在人治疗剂量 范围内所推荐的最大药物剂量的63倍时,会出现幼鼠体重减少,出生前体重减轻 增加,轻度延长孕期和增加一些雌性和雄性大鼠的生殖能力等现象.
盐酸莫西沙星片说明书

盐酸莫西沙星片说明书【药品名称】【通用名】盐酸莫西沙星片【英文名】Moxifloxacin Hydrochloride Tablets【汉语拼音】Yansuan Moxishaxing Pian【成份】本品主要成份:盐酸莫西沙星,化学名为1-环丙基-7-(S,S-2,8-重氮-二环[4.3.0] non-8-yl)-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物。
分子式:C21H24FN3O4•HCI,分子量:437.9。
【性状】本品为暗红色薄膜衣片。
【药理作用】作用机制莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。
莫西沙星在体外显示出对革兰阳性细菌,革兰阴性菌,厌氧菌、抗酸菌和非典型微生物如支原体、衣原体和军团菌有广谱抗菌活性。
抗菌作用机制为干扰II、IV拓扑异构酶。
拓扑异构酶是控制DNA拓扑和在DNA复制、修复和转录中关键的酶。
其杀菌曲线表明,莫西沙星具有浓度依赖性的杀菌活性。
最低杀菌浓度和最低抑菌浓度基本一致。
莫西沙星对β-内酰胺类和大环内酯类抗生素耐药的细菌亦有效。
通过感染的实验动物模型证实,莫西沙星体内活性高。
耐药:导致对青霉素类、头孢菌素类、糖肽类、大环内酯类和四环素类耐药的耐药机制不影响莫西沙星的抗菌活性。
莫西沙星和这些抗菌药无交叉耐药性。
至今未发现质粒介导的耐药性的出现。
莫西沙星的8-甲氧基部分与8-氢部分相比具有对革兰阳性菌高活性和耐药突变的低选择性。
7位的二氮杂环取代能阻止活性流出,该活性流出为氟喹诺酮耐药机制。
体外试验显示经过多步变异才能缓慢的出现对莫西沙星的耐药性。
总之其耐药率很低(10-7-10-10)。
序列地将细菌暴露在低于莫西沙星MIC浓度时只能使MIC值有少量的增加。
与其他喹诺酮类之间存在部分交叉耐药。
但是,一些对其他喹诺酮类耐药的革兰阳性菌和厌氧菌对莫西沙星仍然敏感。
对人类肠道菌群的作用:通过对两名志愿者服用莫西沙星后的研究观察到下列的变化:大肠杆菌、芽孢杆菌、普通拟杆菌、肠球菌、克雷白杆菌和厌氧菌如:双歧杆菌、真杆菌和消化链球菌等的减少。
盐酸莫西沙星质量标准

Moxifloxacin HydrochlorideGeneral Notices(Ph Eur monograph 2254)IDENTIFICATIONA. Specific optical rotation (see Tests).B. Infrared absorption spectrophotometry (2.2.24).Comparison moxifloxacin hydrochloride CRS.C. Dissolve 50 mg in 5 ml of water R, add 1 ml of dilute nitric acid R, mix, allow to stand for5 min and filter. The filtrate gives reaction (a) of chlorides (2.3.1).TESTSAppearance of solutionThe solution is not more opalescent than reference suspension II (2.2.1) and not more intensely coloured than reference solution GY2(2.2.2, Method II). If intended for use in the manufacture of parenteral dosage forms, the solution is clear (2.2.1) and not more intensely coloured than reference solution GY2(2.2.2, Method II).Dissolve 1.0 g in 20 ml of dilute sodium hydroxide solution R.pH (2.2.3)3.9 to4.6.Dissolve 0.10 g in 50 ml of carbon dioxide-free water R.Specific optical rotation (2.2.7)- 125 to - 138 (anhydrous substance).Dissolve 0.200 g in 20.0 ml of a mixture of equal volumes of acetonitrile R and water R. Related substancesLiquid chromatography (2.2.29). Carry out the test protected from light.Solution A Dissolve 0.50 g of tetrabutylammonium hydrogen sulphate R and 1.0 g of potassium dihydrogen phosphate R in about 500 ml of water R. Add 2 ml of phosphoric acid R and 0.050 g of anhydrous sodium sulphite R, then dilute to 1000.0 ml with water R.Test solution (a)Dissolve 50.0 mg of the substance to be examined in solution A and dilute to 50.0 ml with the same solution.Test solution (b)Dilute 2.0 ml of test solution (a) to 20.0 ml with solution A.Reference solution (a)Dissolve 50.0 mg of moxifloxacin hydrochloride CRS in solution A and dilute to 50.0 ml with the same solution. Dilute 2.0 ml of this solution to 20.0 ml with solution A.Reference solution (b)Dissolve 5 mg of moxifloxacin for peak identification CRS (containing impurities A, B, C, D and E) in solution A and dilute to 5.0 ml with the same solution. Reference solution (c)Dilute 1.0 ml of test solution (a) to 100.0 ml with solution A. Dilute 1.0 ml of this solution to 10.0 ml with solution A.Column:— size: l = 0.25 m, Ø = 4.6 mm;— stationary phase: end-capped phenylsilyl silica gel for chromatography R (5 µm);— temperature: 45 °C.— temperature: 45 °C.Mobile phase Mix 28 volumes of methanol R and 72 volumes of a solution containing 0.5 g/l of tetrabutylammonium hydrogen sulphate R, 1.0 g/l of potassium dihydrogen phosphate R and 3.4 g/l of phosphoric acid R.Flow rate 1.3 ml/min.Detection Spectrophotometer at 293 nm.Injection10 µl of test solution (a) and reference solutions (b) and (c).Run time 2.5 times the retention time of moxifloxacin.Identification of impurities Use the chromatogram supplied with moxifloxacin for peak identification CRS and the chromatogram obtained with reference solution (b) to identify the peaks due to impurities A, B, C, D and E.Relative retention With reference to moxifloxacin (retention time = about 14 min): impurity A = about 1.1; impurity B = about 1.3; impurity C = about 1.4; impurity D = about 1.6; impurity E = about 1.7.System suitability Reference solution (b):— resolution: minimum 1.5 between the peaks due to moxifloxacin and impurity A;— the chromatogram obtained is similar to the chromatogram supplied with moxifloxacin for peak identification CRS.Limits:— correction factors: for the calculation of content, multiply the peak areas of the following impurities by the corresponding correction factor: impurity B = 1.4; impurity E = 3.5;— impurities A, B, C, D, E: for each impurity, not more than the area of the principal peak in the chromatogram obtained with reference solution (c) (0.1 per cent);— unspecified impurities: for each impurity, not more than the area of the principal peak in the chromatogram obtained with reference solution (c) (0.10 per cent);— total: not more than 3 times the area of the principal peak in the chromatogram obtained with reference solution (c) (0.3 per cent);— disregard limit: 0.5 times the area of the principal peak in the chromatogram obtained with reference solution (c) (0.05 per cent).Water (2.5.12)Maximum 4.5 per cent, determined on 0.200 g.Sulphated ash (2.4.14)Maximum 0.1 per cent, determined on 1.0 g in a platinum crucible.ASSAYLiquid chromatography (2.2.29) as described in the test for related substances with the following modification.Injection Test solution (b) and reference solution (a).Calculate the percentage content of C21H25ClFN3O4 from the declared content of moxifloxacin hydrochloride CRS.STORAGEIn an airtight container, protected from light.LABELLINGThe label states, where applicable, that the substance is suitable for use in the manufacture of parenteral dosage forms.IMPURITIESSpecified impurities A, B, C, D, E.Moxisylyte HydrochlorideGeneral NoticesC16H25NO3,HCl 315.8 964-52-3Action and useAlpha-adrenoceptor antagonist.PreparationMoxisylyte TabletsDEFINITIONMoxisylyte Hydrochloride is 4-(2-dimethylaminoethoxy)-5-isopropyl-2-methylphenyl acetate hydrochloride. It contains not less than 99.0% and not more than 101.0% of C16H25NO3,HCl, calculated with reference to the dried substance.CHARACTERISTICSA white, crystalline powder.Freely soluble in water and in chloroform; soluble in ethanol (96%); practically insoluble in ether and in petroleum spirit.IDENTIFICATIONA. The infrared absorption spectrum, Appendix II A, is concordant with the reference spectrum of moxisylyte hydrochloride (RS 238).B. Yields reaction A characteristic of chlorides, Appendix VI.TESTSAciditypH of a 5% w/v solution, 4.5 to 5.5, Appendix V L.。
盐酸莫西沙星的合成及结构解析

盐酸莫西沙星的合成及结构解析摘要】盐酸莫西沙星属于广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药,通过对药物合成以及结构解析的分析,进一步对盐酸莫西沙星的药理和毒理作用进行分析。
本文主要分析的是盐酸莫西沙星的合成及结构解析,全文通过实验过程以及实验分析进行相关分析。
【关键词】盐酸莫西沙星;合成;结构解析【中图分类号】R917 【文献标识码】A 【文章编号】2095-1752(2017)20-0176-02盐酸莫西沙星属于临床常用的抗生素药物,除了用于治疗革兰氏阴性菌外,对于革兰氏阳性菌同样具有抗菌作用,同时抗菌谱较大,比如对于肺炎患者的衣原体、军团菌以及支原体同样具有较好的抑制效果。
长期合成过程中工业较为复杂,一定程度上限制了大规模的批量生产,本文通过实验就简化后就盐酸莫西沙星的合成及结构解析分析如下。
1.实验过程1.1盐酸莫西沙星合成1.1.1母核硼酸化物(Ⅱ)的合成加入将150g 1.47mol醋酐加入到反应瓶中,温度控制在70摄氏度,充分搅拌,同时加入30.0g 0.485mol的硼酸,此时将反应温度控制在90摄氏度以下,在此温度下连续搅拌2h,之后将100g 0.309mol的莫西沙星母核喹啉羧酸乙酯(Ⅰ)加入到上述反应物中,i,反应温度应达到90摄氏度,反应时间为3h,反应完成后将反应体系冷却,完成搅拌,抽滤,得到的滤饼使用大量清水洗涤,洗涤后使其自然干燥,此时可得到淡黄色固体母核硼酸化物(Ⅱ),质量为124g,收率为94.5%。
1.1.2盐酸莫西沙星(Ⅳ)的合成将上述得到的124g 0.293mol母核硼酸化物(Ⅱ)加入到反应瓶中,同时加入37g 0.293mol莫西沙星侧链(Ⅲ)、35.6g 0.352mol的三乙胺、600ml乙腈加入到反应体系中,回流反应90min,并使其自然冷却,并达到室温条件,将浓盐酸加入使其pH值达到1,在0~5摄氏度条件小充分搅拌1h,之后抽滤,使用少量乙腈对滤饼进行洗涤,自然干燥,可得到盐酸莫西沙星粗品98g,收率达到96.4%。
莫西沙星原料药质量标准(20140429译)
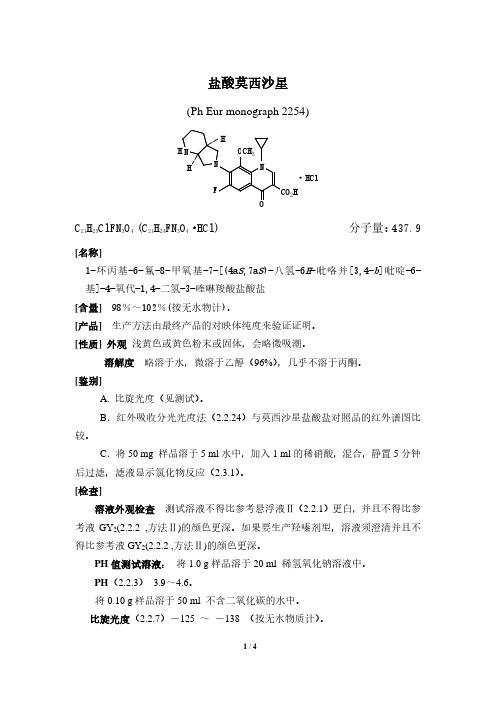
盐酸莫西沙星(Ph Eur monograph 2254) NHH F2CO HNH HCl ·N O O 3CHC 21H 25ClFN 3O 4(C 21H 24FN 3O 4·HCl) 分子量:437.9 [名称]1-环丙基-6-氟-8-甲氧基-7-[(4a S ,7a S )-八氢-6H -吡咯并[3,4-b ]吡啶-6-基]-4-氧代-1,4-二氢-3-喹啉羧酸盐酸盐[含量] 98%~102%(按无水物计)。
[产品] 生产方法由最终产品的对映体纯度来验证证明。
[性质] 外观 浅黄色或黄色粉末或固体,会略微吸潮。
溶解度 略溶于水,微溶于乙醇(96%),几乎不溶于丙酮。
[鉴别]A. 比旋光度(见测试)。
B .红外吸收分光光度法(2.2.24)与莫西沙星盐酸盐对照品的红外谱图比较。
C .将50 mg 样品溶于5 ml 水中,加入1 ml 的稀硝酸,混合,静置5分钟后过滤,滤液显示氯化物反应(2.3.1)。
[检查]溶液外观检查 测试溶液不得比参考悬浮液Ⅱ(2.2.1)更白,并且不得比参考液GY 2(2.2.2 ,方法Ⅱ)的颜色更深。
如果要生产羟嗪剂型,溶液须澄清并且不得比参考液GY 2(2.2.2 ,方法Ⅱ)的颜色更深。
PH 值测试溶液: 将1.0 g 样品溶于20 ml 稀氢氧化钠溶液中。
PH (2.2.3) 3.9~4.6。
将0.10 g 样品溶于50 ml 不含二氧化碳的水中。
比旋光度(2.2.7)-125 ~ -138 (按无水物质计)。
将0.200 g样品溶于20.0 ml 乙腈与水的混合溶液(体积相等)中。
有关物质液相色谱法(2.2.29),避光测试。
溶液A:将0.50 g四丁基硫酸氢铵和1.0 g、磷酸氢二钾溶于500ml水中,再加2ml磷酸和0.050g无水亚硫酸钠,然后用水稀释至1000ml。
供试溶液(a):精确称取50.0mg样品溶于溶液A中,并用溶液A稀释至50ml。
盐酸莫西沙星的性质及合成路线
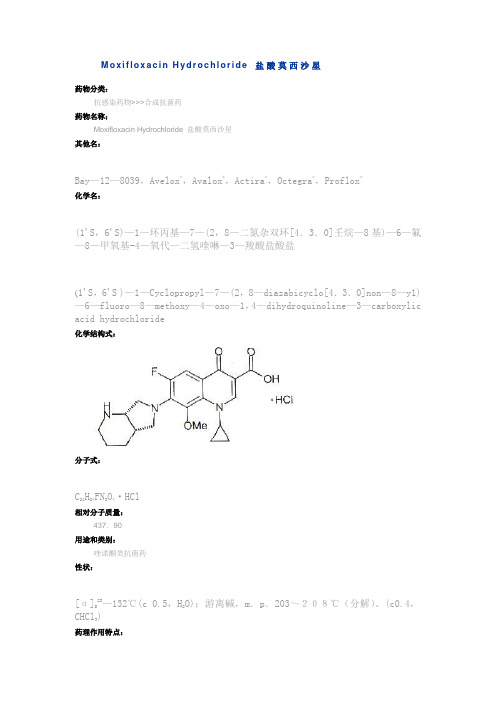
M o x i f l o x a c i n H y d r o c h l o r i d e 盐酸莫西沙星药物分类:抗感染药物>>>合成抗菌药药物名称: Moxifloxacin Hydrochloride 盐酸莫西沙星其他名:Bay —12—8039,Avelox ®,Avalox ®,Actira ®,Octegra ®,Proflox ®化学名:(1'S ,6'S)—1—环丙基—7—(2,8—二氮杂双环[4.3.0]壬烷—8基)—6—氟—8—甲氧基-4—氧代—二氢喹啉—3—羧酸盐酸盐(1'S ,6'S )—1—Cyclopropyl —7—(2,8—diazabicyclo[4.3.0]non —8—y1)—6—fluoro —8—methoxy —4—oxo —1,4—dihydroquinoline —3—carboxylic acid hydrochloride化学结构式:分子式:C 21H 24FN 3O 4·HCl相对分子质量:437.90用途和类别:喹诺酮类抗菌药性状:[α]D 23—132℃(c 0.5,H 2O);游离碱,m .p .203~208℃(分解)。
(c0.4,CHCl 3)药理作用特点:本品抗菌谱广,对于大多数需氧及厌氧菌均有抑制作用,对革兰阳性及阴性菌均有抑制作用,尤其是对革兰阴性菌效果明显,另外对支原体、衣原体、分支杆菌、嗜血杆菌、莫拉菌属等均有抑制作用,其作用强于环丙沙星不良反应:头晕、头痛、恶心、局部荨麻疹等。
药动学:t1/2约12-15h,口服生物利用度高,血药浓度与用药剂量成正比,药物从肾及胆汁中排出,药物从血液中以高结合率及高分布率分布到各器官组织,尤其在胃肠道、膀胱、肾、肝、肺等处浓度较高,极少数药物通过血脑屏障。
适应症:各种呼吸道感染,如支气管炎、肺炎、鼻窦炎等剂型:用法与用量:400mg/d,口服。
盐酸莫西沙星氯化钠注射液说明书产品手册

核准日期:修改日期:盐酸莫西沙星氯化钠注射液说明书请仔细阅读说明书并在医师指导下使用。
【药品名称】通用名称:盐酸莫西沙星氯化钠注射液商品名称:拜复乐Avelox 英文名称:Moxifloxacin Hydrochloride and Sodium Chloride Injection 汉语拼音:Yansuan Moxishaxing Lühuana Zhusheye【成份】化学名称:1-环丙基-7-(S,S)-2,8-重氮-二环4.3.0壬-8-基-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸盐酸盐。
化学结构式:O F COOH H H N N N O H3C H x HCl 分子式:C21H24FN3O4HCl 分子量:437.9 辅料:氯化钠、盐酸、氢氧化钠、注射用水。
【性状】本品为黄色的澄清液体。
【适应症】成人≥18岁上呼吸道和下呼吸道感染,如:急性窦炎,慢性支气管炎急性发作,社区获得性肺炎;以及皮肤和软组织感染。
【规格】250ml : 莫西沙星0.4g与氯化钠2.0g。
【用法用量】给药方法:根据中国健康受试者心脏所能耐受的输液速率以及国内I、II、III期临床研究的结果,推荐本品的输液时间应为90分钟。
国外推荐0.4g莫西沙星静脉给药的输液时间应大于60分钟。
剂量范围成人:推荐剂量为一次0.4g,一日一次一次1瓶,一日一次。
疗程:根据症状的严重程度或临床反应决定疗程。
治疗上呼吸道和下呼吸道感染时通常可按照下列疗程:慢性支气管炎急性发作:5天社区获得性肺炎:序贯给药静脉给药后继续口服用药推荐的总疗程为7~14天。
急性窦炎:7天治疗皮肤和软组织感染的推荐疗程为7天。
莫西沙星可以在开始治疗时静脉给药,之后再根据患者情况口服片剂给药。
0.4g莫西沙星注射液在临床试验中最多用过14天。
给药方法:静脉给药0.4g的时间应为90分钟。
莫西沙星既可以单独给药也可以与一些相容的溶液一同滴注。
HPLC法测定盐酸莫西沙星含量及其有关物质

HPLC法测定盐酸莫西沙星含量及其有关物质马好斌【摘要】通过HPLC法检测盐酸莫西沙星的含量与和它有关的物质,色谱柱是Sepax BR-C18 (250 mm × 4.6 mm,5 μm),流动相是甲醇-四丁基硫酸氢铵磷酸缓冲液(28:72),检测流速是1.3 ml/min,波长是293 nm,柱温是45℃.在已建立的色谱状况中,盐酸莫西沙星能很好的和各杂质分离开来,当盐酸莫西沙星的浓度处在38.55~57.82μg/ml的范围里时,其和峰面积可以保持一个良好的线性关系(r=0.9998),检测的最低限是0.006 25μg/ml,定量限是0.025 μg/ml.经研究发现,建立起的方法有较好的专属性,极易操作,能够在测定盐酸莫西沙星的含量和相关物质含量时使用.【期刊名称】《中国现代药物应用》【年(卷),期】2012(006)023【总页数】2页(P119-120)【关键词】HPLC法测定;盐酸莫西沙星;物质【作者】马好斌【作者单位】454000,焦作煤业(集团)有限责任公司中央医院【正文语种】中文莫西沙星(moxifloxacin)是德国的拜耳公司研发出来的第四代的氟喹诺酮类超广谱抗生素,第三代的抗革兰阴性菌的活性被它保留了下来,它的8-甲氧基部分使抗革兰阳性菌的活性得到了显著提高,尤其是使对厌氧菌的抗菌活性得到了改善[1]。
在1999年的时候德国首次上市,在2002年的时候在我国得以上市,拜复乐是其商品名[2]。
因为其能快速吸收,且在体内的分布非常的广,较之于β-内酰胺类抗生素,在临床上治疗相当一部分的致病菌时莫西沙星的的疗效要更好一些[3]。
2009年被英国药典收载的关于莫西沙星的质量标准里需要逐一的控制多个相关物质,结构图详见下图1,一般使用的是HPLC的分析方法,然而根据其标准借助于苯基硅烷键合硅胶柱来测定,在对峰定位对照品里的五个杂质进行分离时,分离度并不理想,所以笔者构建了通过常用的十八烷基硅烷键合硅胶作填充剂的HPLC的分析方法,该方法有较好的专属性,极易操作,能够在测定盐酸莫西沙星的含量和相关物质含量时使用[4]。
盐酸莫西沙星理化性质及质量指标

盐酸莫西沙星理化性质与质量指标1.1 盐酸莫西沙星的概况盐酸莫西沙星通用名:盐酸莫西沙星片;商品名:拜复乐(Avelox);其他名:Bay-12-8039、Avelox®、Avalox®、Actira®、Octegra®、Proflox;英文名:Moxifloxacin Hydrochloride Tablets;Moxifloxacin Hydrochloride;(1'S,6'S )-1-Cyclopropyl-7-(2,8-diazabicyclo[4.3.0]non-8-y1)-6-fluoro-8-methoxy-4-oxo-1,4 -dihydroquinoline-3-carboxylic acid hydrochloride;化学名:1-环丙基-7-{S,S-2,8-重氮-二环[4.3.0] non-8-yl}-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物;(1'S,6'S)-1-环丙基-7-(2,8-二氮杂双环[4.3.0]壬烷-8基)-6-氟-8-甲氧基-4-氧代-二氢喹啉-3-羧酸盐酸盐;分子式:C21H24FN3O4·HCl;分子量:437.9;CAS:186826-86-8;图1.1 盐酸莫西沙星结构式盐酸莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。
用于治疗社区获得性肺炎、慢性支气管炎急性发作、泌尿生殖系感染、急性鼻窦炎。
疗效显着,不良反应小。
适应症为治疗患有上呼吸道和下呼吸道感染的成人。
盐酸莫西沙星是德国拜耳公司研制的超广谱喹诺酮类药物,商品名为“拜复乐”,1999年9月在德国上市,同年12月在美国获 FDA批准上市。
2002年销售额达到3.33亿美元,进入了2002年世界十大畅销抗生素药物,列第8位。
德国拜耳公司和美国先灵葆雅公司的产品在2006年的世界市场销售额高达8.22 亿美元,在全球畅销处方药排名第129位;2007年世界市场销售额高达 10.34亿美元,比上年增长 25.8%;2008年上半年为5.75亿美元。
(整理)盐酸莫西沙星理化性质与质量指标

盐酸莫西沙星理化性质与质量指标1.1 盐酸莫西沙星的概况盐酸莫西沙星通用名:盐酸莫西沙星片;商品名:拜复乐(Avelox);其他名:Bay-12-8039、Avelox®、Avalox®、Actira®、Octegra®、Proflox;英文名:Moxifloxacin Hydrochloride Tablets;Moxifloxacin Hydrochloride;(1'S,6'S )-1-Cyclopropyl-7-(2,8-diazabicyclo[4.3.0]non-8-y1)-6-fluoro-8-methoxy-4-oxo-1,4 -dihydroquinoline-3-carboxylic acid hydrochloride;化学名:1-环丙基-7-{S,S-2,8-重氮-二环[4.3.0] non-8-yl}-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物;(1'S,6'S)-1-环丙基-7-(2,8-二氮杂双环[4.3.0]壬烷-8基)-6-氟-8-甲氧基-4-氧代-二氢喹啉-3-羧酸盐酸盐;分子式:C21H24FN3O4·HCl;分子量:437.9;CAS:186826-86-8;图1.1 盐酸莫西沙星结构式盐酸莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。
用于治疗社区获得性肺炎、慢性支气管炎急性发作、泌尿生殖系感染、急性鼻窦炎。
疗效显着,不良反应小。
适应症为治疗患有上呼吸道和下呼吸道感染的成人。
盐酸莫西沙星是德国拜耳公司研制的超广谱喹诺酮类药物,商品名为“拜复乐”,1999年9月在德国上市,同年12月在美国获 FDA批准上市。
2002年销售额达到3.33亿美元,进入了2002年世界十大畅销抗生素药物,列第8位。
德国拜耳公司和美国先灵葆雅公司的产品在2006年的世界市场销售额高达8.22 亿美元,在全球畅销处方药排名第129位;2007年世界市场销售额高达 10.34亿美元,比上年增长 25.8%;2008年上半年为5.75亿美元。
莫西沙星说明书

莫西沙星说明书莫西沙星,主要剂型有片剂、注射剂。
本品对革兰阴性菌、革兰阳性菌、支原体、衣原体及脊髓炎病毒等均具有良好的抗菌活性。
莫西沙星说明书是怎样的呢?本文是店铺整理的莫西沙星说明书资料,仅供参考。
莫西沙星信息介绍中文别名编辑1-环丙基-7-﹛(S,S)-2,8-重氮-二环[4.3.0]壬-8-基﹜-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸[1]英文别名编辑4-dihydroquinoline-3-carboxylic acid(1'S,6'S)-1-Cyclopropyl-7-(2,8-diazabicyclo[4.3.0]non-8-yl)-6-fluoro-8-methoxy-4-oxo-1,分子式编辑C21H24FN3O4分子量编辑401.4314CAS号编辑151096-09-2性状编辑浅黄色至黄色粉末或晶体功能编辑莫西沙星为人工合成的喹诺酮类抗菌药,是一类较新的合成抗菌药。
具有抗菌性强、抗菌谱广、不易产生耐药并对常见耐药菌有效、半衰期长、不良反应少等优点。
药品编辑英文名 Moxifloxacin成品剂型:片剂、水针剂其他名称:莫昔沙星、拜复乐原料产地:印度总代理商:拜耳医药保健有限公司【适应症】治疗患有上呼吸道和下呼吸道感染的成人。
如急性窦炎、慢性支气管炎急性发作、社区获得性肺炎、以及皮肤和软组织感染。
【药理毒性】本品为第四代喹诺酮类广谱抗菌药,是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。
莫西沙星在体外显示出对革兰阳性菌、革兰阴性菌、厌氧菌、抗酸菌和非典型微生物如支原体、衣原体和军团菌有广谱抗菌活性。
抗菌机制为干扰Ⅱ、Ⅳ拓扑异构酶。
拓扑异构酶是控制DNA拓扑和DNA复制、修复和转录中的关键酶。
莫西沙星在体内活性高。
【药代动力学】莫西沙星口服后吸收良好,生物利用度约90%。
[2] 达峰时0.5~4小时。
莫西沙星给药不受进食影响。
半衰期达12小时。
同服二、三价阳离子抗酸药可明显减少吸收。
盐酸莫西沙星片说明书

精心整理盐酸莫西沙星片说明书【药品名称】通用名:盐酸莫西沙星片商品名:拜复乐?英文名:MoxifloxacinHydrochlorideTablets汉语拼音:YansuanMoxishaxingPian本品主要成份:盐酸莫西沙星,化学名为1-环丙基-7-{S,S-2,8-重氮-二环氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物0.4g老年人老年人不必调整用药剂量儿童儿童和青少年禁用肝损伤肝功能损伤的患者不必调整莫西沙星的剂量。
肾功能异常任何程度的肾功能受损的病人均不必调整莫西沙星的剂量(包括肌酐清除率≤30ml/min/1.73m2)。
目前缺乏透析病人的药代动力学数据。
种族间差别不同种族间不必调整药物剂量。
【不良反应】在莫西沙星的临床试验中,绝大多数的不良反应为轻中度(大于90%),由于不良反应导致不能使用莫西沙星治疗的病人为3.6%。
根据莫西沙星的临床试验总结出的常见不良反应(其相关程度分为很可能、可能和无法评估)列表如下:发生率≥1%且<10%全身症状:腹痛、头痛消化系统:恶心、腹泻、呕吐、消化不良、肝功能化验异常特殊感官:味觉倒错神经系统:眩晕心血管系统:合并低钾血症的患者QT间期延长功能)失语症、情绪不稳定、睡眠失调、语言障碍、思维异常、感觉减退、多梦、惊厥、精神错乱、抑郁呼吸系统:哮喘皮肤和附件:皮疹(斑丘疹、紫癜、脓泡)特殊感官:耳鸣、视觉异常、失味、嗅觉异常(包括嗅觉倒错、嗅觉减弱及嗅觉缺失)、弱视泌尿生殖系统:肾功能异常未在上述不良反应中列出的与药物无关的最常见的实验室参数异常为:红细胞压积增加或减少、白细胞增加、红细胞增加或减少、血糖下降、血红蛋白减少、碱性磷酸酶升高、SGOT/AST升高、SGPT/ALT升高、胆红素升高、尿素升高、肌酐升高、尿素氮升高,上述异常是否由该药或治疗时患者状况导致尚属未知。
上市后报告的不良反应:发生率<0.01%过敏反应:过敏性的反应、过敏性休克(可能威胁生命)消化系统:伪膜性肠炎肌肉骨骼系统:肌腱断裂【禁忌】已知对该片剂的任何成份或其它喹诺酮类高度过敏者。
盐酸莫西沙星滴眼液工艺验证方案

盐酸莫西沙星滴眼液工艺验证方案审核和批准目录1、概述 (4)1.1产品简介 (4)1.2验证原因及目的 (4)1.3验证类型 (4)1.4风险评估 (4)1.5计划验证时间 (4)1.6验证依据 (4)2、验证人员及职责 (5)3、生产工艺与设备 (6)3.1生产工艺处方 (6)3.2生产工艺流程图 (8)3.3生产操作过程及工艺条件 (9)3.4主要设备一览表 (11)3.5检验方法清单 (12)3.6关健质量属性、关健工艺参数及可接受标准 (12)3.7产品质量标准 (13)4、验证条件 (14)a)验证条件 (14)b)培训 (15)5、工艺验证过程 (15)5.1无菌低密度聚乙烯药用滴眼剂瓶外包装的灭菌和转运 (16)5.2工器具清洗、灭菌与转运 (17)5.3配液 (18)5.4灌装 (20)5.5灯检 (21)6、偏差和OOS (22)7、执行的审核和批准 (22)8、验证实施过程中的方案变更管理 (22)9、再验证周期 (23)10、取样计划表 (23)11、验证结论 (25)1、概述1.1产品简介本品为黄绿色澄明液体,主要成分是盐酸莫西沙星。
本品用于治疗由敏感菌引起的细菌性结膜炎。
1.2验证原因及目的盐酸莫西沙星滴眼液是本公司与*****有限公司合作开发的新品种,合作方以及本公司已对该品种的处方及工艺进行了研究,初步确定了各工序的工艺参数。
车间生产由于生产环境(生产场地、生产设备)的改变,可能导致工艺参数有所调整。
本次验证通过对溶液的配制、pH调节、过滤、灌装、灯检各关键工序参数进行三批连续生产的前验证,从而进一步确定该品种各工序的工艺参数,并证明在现有的生产环境下,按产品的工艺规程进行生产,能生产出具有安全性、有效性、稳定性的药品,符合其注册标准要求。
1.3验证类型本次验证采用前验证的方式进行验证。
1.4风险评估为确定本次验证的范围与程度,在本次验证之前进行风险评估,风险评估详见:编号为QR-PT-GF201501-01《滴眼液车间工艺验证质量风险管理报告》。
莫西沙星物理化学性质和规格

物理化学性质和规格,以及试验方法的相关资料。
1.配方设计本品为莫西沙星盐酸盐,在水中的溶解度为24mg/ml(25℃),溶解度与pH值有关,在磷酸盐缓冲液(pH3)中为27mg/mL(25℃),磷酸盐缓冲液(pH9)46mg/mL(25℃),溶解度具有随着pH值的增加而升高的特性。
因本品在生理pH条件下在水中有充分的溶解度,可以调整获得稳定的配方,本品被在配方开发中使用等渗生理盐水,硼酸作为缓冲剂,并使用盐酸或氢氧化钠作为pH调节剂调节pH值(?)的滴眼液。
此外,按照日本药典的详细防腐剂药效试验,即使未添加防腐剂,本品也未出现药物过期失效。
2.制剂规格和试验方法包括:含量、性状(颜色形状)、确认测试(薄层色谱法)、渗透压比,pH值,纯度试验(分解生成物(HPLC法))、不溶性异物检查、不溶性微粒检查、无菌试验(滤膜法)、含量(高效液相色谱法)。
安定性试验如下:●长期保存试验室温保存条件下(25±2℃/40±5%/避光/低密度聚乙烯容器·直立或侧放/168周);冷藏条件下(4±2℃/35±5%/避光/低密度聚乙烯容器·直立或侧放/168周)●加速试验①(40±2℃/15±5%/避光/低密度聚乙烯容器/26周)●加速試験②(30±2℃/40±5%/避光/低密度聚乙烯容器/117周)●压力测试光稳定性(25±2℃/40±5%/可见光1.2×106lux・hrs或紫外线200W・h/m2以上/低密度聚乙烯容器/有纸盒或无纸盒/4周)冻融稳定性(-20℃1周,30℃1周冻融循环3次/避光/低密度聚乙烯容器/6周)压力测试(光稳定性和冻融稳定性)结果为,本品不受光影响,短期内的温度变化下也表现稳定。
加速试验①的结果为:降解产物总量在26周时的最高比测试开始时增加?%,制剂重量约减少?%,但未见有效性和安全性以及药物质量的改变。
盐酸莫西沙星的溶解度曲线

盐酸莫西沙星的溶解度曲线盐酸莫西沙星是一种广谱抗生素,常用于治疗呼吸道、泌尿道、消化道等感染疾病。
溶解度曲线是指在不同温度下,溶液中盐酸莫西沙星的溶解度随着溶液浓度的变化而变化的曲线。
下面我们将详细介绍盐酸莫西沙星的溶解度曲线。
首先,先了解一下溶解度的概念。
溶解度是指在一定温度下,溶质在溶剂中达到饱和状态时,单位体积溶液中最多可以溶解的溶质的质量。
溶解度与温度、压力、溶质和溶剂性质有关。
盐酸莫西沙星是一种弱酸性物质,其盐酸盐在水中溶解度随温度的升高而增加。
通常情况下,溶解度曲线是通过实验得出的,记录了不同温度下溶液中盐酸莫西沙星的溶解度。
实验中,一般采用恒温槽和恒温电热板来控制溶液温度,利用酸碱滴定法、紫外分光光度法、体积分析等方法测定溶质在溶剂中的溶解度。
通过测定不同温度下的溶解度,可以得到溶解度曲线。
溶解度曲线通常是以温度为横轴,溶解度为纵轴进行绘制的。
在绘制曲线的过程中,需要进行多组实验,将实验测得的溶质质量与溶液体积的数据进行计算、统计和分析,然后绘制曲线图。
溶解度曲线的形状取决于溶质和溶剂的性质。
对于盐酸莫西沙星溶解度曲线来说,一般呈现出正相关的趋势,即随着温度的升高,溶解度也会增大。
这是因为在较高温度下,溶剂分子的动能较大,分子间相互作用力较小,有利于溶质分子进入溶剂中并与溶剂分子相互作用。
然而,溶解度曲线并非总是呈现单调递增的趋势。
在某些特殊情况下,可能会出现饱和溶解度或溶解度饱和的现象。
这是因为随着温度的升高,溶剂分子的动能达到一定程度后,分子间相互作用力开始增大,溶剂分子将不再与溶质分子相互作用,从而达到溶解度饱和。
除了温度,其他因素如压力、PH值等也会对溶解度曲线产生影响。
此外,还有一些其他因素,如溶剂选择、溶质浓度、表面活性剂等也会对溶解度曲线造成一定的影响。
总结来说,盐酸莫西沙星的溶解度曲线是通过实验测定不同温度下溶液中盐酸莫西沙星的溶解度得出的。
通常情况下,溶解度随温度的升高而增加。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盐酸莫西沙星理化性质与质量指标1.1 盐酸莫西沙星的概况盐酸莫西沙星通用名:盐酸莫西沙星片;商品名:拜复乐(Avelox);其他名:Bay-12-8039、Avelox®、Avalox®、Actira®、Octegra®、Proflox;英文名:Moxifloxacin Hydrochloride Tablets;Moxifloxacin Hydrochloride;(1'S,6'S )-1-Cyclopropyl-7-(2,8-diazabicyclo[4.3.0]non-8-y1)-6-fluoro-8-methoxy-4-oxo-1,4 -dihydroquinoline-3-carboxylic acid hydrochloride;化学名:1-环丙基-7-{S,S-2,8-重氮-二环[4.3.0] non-8-yl}-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物;(1'S,6'S)-1-环丙基-7-(2,8-二氮杂双环[4.3.0]壬烷-8基)-6-氟-8-甲氧基-4-氧代-二氢喹啉-3-羧酸盐酸盐;分子式:C21H24FN3O4·HCl;分子量:437.9;CAS:186826-86-8;图1.1 盐酸莫西沙星结构式盐酸莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。
用于治疗社区获得性肺炎、慢性支气管炎急性发作、泌尿生殖系感染、急性鼻窦炎。
疗效显着,不良反应小。
适应症为治疗患有上呼吸道和下呼吸道感染的成人。
盐酸莫西沙星是德国拜耳公司研制的超广谱喹诺酮类药物,商品名为“拜复乐”,1999年9月在德国上市,同年12月在美国获 FDA批准上市。
2002年销售额达到3.33亿美元,进入了2002年世界十大畅销抗生素药物,列第8位。
德国拜耳公司和美国先灵葆雅公司的产品在2006年的世界市场销售额高达8.22 亿美元,在全球畅销处方药排名第129位;2007年世界市场销售额高达 10.34亿美元,比上年增长 25.8%;2008年上半年为5.75亿美元。
2002年下半年,莫西沙星在我国上市,由拜耳及北京拜耳医药保健有限公司进行销售,重点市场是我国大中城市的主要医院。
该药 2004年进入国家医保目录后,连续3年出现惊人的增长率:2003年到 2007年的复合增长率为116%, 2007年城市样本医院购药金额为2.16亿元,比上年增长了75.1%;2008 年上半年为1.62亿元。
1.2 盐酸莫西沙星的药理作用(1)作用机制莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。
莫西沙星在体外显示出对革兰阳性菌,革兰阴性菌,厌氧菌,抗酸菌,和非典型微生物如支原体,衣原体和军团菌有广谱抗菌活性。
抗菌作用机制为干扰Ⅱ、Ⅳ拓扑异构酶。
拓扑异构酶是控制DNA拓扑和在DNA复制、修复和转录中的关键酶。
其杀菌曲线表明,莫西沙星是具有浓度依赖性的杀菌活性。
最低杀菌浓度和最低抑菌浓度基本一致。
莫西沙星对β-内酰胺类和大环内酯类抗生素耐药的细菌亦有效。
通过感染的实验动物模型证实,莫西沙星体内活性高。
(2)耐药导致对青霉素类、头孢菌素类、糖肽类、大环内酯类和四环素类耐药的耐药机制不影响莫西沙星的抗菌活性。
莫西沙星和这些抗菌药无交叉耐药性。
至今未发现质粒介导的耐药性的出现。
莫西沙星的8-甲氧基部分与8-氢部分相比具有对革兰阳性菌高活性和耐药突变的低选择性。
7位的二氮杂环取代能阻止活性流出,该活性流出为氟喹诺酮耐药机制。
体外试验显示经过多步变异才能缓慢的出现对莫西沙星的耐药性。
总之其耐药率很低(10-7-10-10)。
序列的将细菌暴露在低于莫西沙星MIC浓度时只能使MIC值有少量的增加。
其它喹诺酮类之间存在交叉耐药。
但是,一些对其它喹诺酮类耐药的革兰阳性菌和厌氧菌对莫西沙星敏感。
(3)对人类肠道菌群的作用通过对两名志愿者服用莫西沙星后的研究观察到下列变化:大肠杆菌,芽孢杆菌,普通拟杆菌,肠球菌,克雷白杆菌和厌氧菌如:双歧杆菌,真杆菌和消化链球菌等减少。
这些变化在两周内可以恢复正常,未发现艰难梭菌毒素。
1.3 盐酸莫西沙星的毒理作用(1)致癌、致突变虽然有关莫西沙星致癌作用的常规长期研究尚未完成,但该药进行了基因毒性体内和体外试验。
此外,在大鼠身上进行了对于人类的致癌作用加速试验(诱发和促进测定)。
5株Ames试验中4次为阴性,中国苍鼠卵巢HPRT的突变试验和大鼠原发肝细胞的UDS试验也均为阴性,而其它喹诺酮类TA102的Ames试验为阳性。
体外试验显示大剂量(33mg/ml)的其它喹诺酮类药物可致中国苍鼠的V79细胞出现染色体异常,然而,小鼠体内试验核仁测定为阴性结果。
此外,体内试验测定其对小鼠的显性致死测定为阴性。
总之,体内试验的结果充分反映了其体内的基因毒性。
在大鼠的诱导和促进测定中未发现莫西沙星致癌的证据。
(2)光毒性莫西沙星对光稳定且潜在光毒性很低。
体外试验和动物试验显示莫西沙星的光毒性较其它喹诺酮类药物小。
让小鼠口服一些喹诺酮类药物并同时照射紫外线,显示出可增加紫外线的光致癌作用。
莫西沙星的光致癌作用的研究尚未进行,在志愿者的Ⅰ期试验中证实莫西沙星的光毒性较小。
(3)心电图高浓度的莫西沙星对延迟调整心脏钾离子流有抑制作用,因此导致QT间期延长。
给狗口服大于90mg/kg莫西沙星进行毒理研究,导致血药浓度大于16mg/L,引起QT间期延长,但未发现有心律失常出现。
但是累积静脉给药高于50倍人的给药剂量(>300mg/kg),可导致血药浓度≥200mg/L(高于静脉给药治疗浓度的30倍),并观察到可逆转、非严重的室性心律失常。
(4)关节毒性众所周知,喹诺酮类可以造成未成年试验动物的承重关节软骨的病变。
可造成幼年狗的关节毒性的最小口服莫西沙星剂量是推荐最大治疗剂量(400mg/50kg 人体重)的4倍,其血药浓度为推荐治疗剂量时血药浓度的2~3倍。
(5)生殖毒性用大鼠、兔和猴子进行的生殖研究表明,莫西沙星可以通过胎盘。
对大鼠(os 和iv)和猴子(os)的试验表明,给予莫西沙星后没有致畸作用和对生殖力的影响证据。
兔静脉给药200mg/kg可观察到骨骼畸形。
该研究结果与已知的喹诺酮对骨骼发育的影响一致。
血浆药物浓度在治疗浓度范围内,猴子和兔的流产发生率增多。
在大鼠身上,当口服剂量为按千克体重计算使血药浓度在人治疗剂量范围内所推荐的最大药物剂量的63倍时,会出现幼鼠体重减少、出生前体重减轻增加、轻度延长孕期和增加一些雌性和雄性大鼠的生殖能力等现象。
1.4 盐酸莫西沙星的药代动力学莫西沙星口服后可以很快被几乎完全吸收。
绝对生物利用度总计约91%。
在50~1200mg单次剂量和每日600mg连服10天的药代动力学显示出呈线性关系。
3天内达稳态。
口服400mg后0.5~4小时达到峰值3.1mg/L。
每日一次400mg 口服后达到稳态时其峰浓度和谷浓度分别为3.2mg/L和0.6mg/L。
给予莫西沙星同时进食能稍延长达峰时间约2小时并减少峰浓度约16%。
吸收范围不变。
由于AUC/MIC主要是预测喹诺酮的抗菌效果,该影响与临床无关,因此,莫西沙星给药不受进食影响。
单剂量静脉给药400mg,1小时后血药浓度达峰约为4.1mg/L,与口服相比平均增加26%。
药物暴露的药时曲线下面积约为39mgh/L,与绝对生物利用度约为91%的口服(35mgh/L)相比略高。
多剂量静脉给药(1小时输液),每日400mg给药稳态波峰波谷浓度分别为4.1至5.9及0.43至0.84mg/L。
在给药间隔内稳态药物暴露比首剂约高30%。
输液1小时后观测到病人稳态浓度为4.4mg/L。
(1)分布莫西沙星可以很快分布到血管外间隙。
该药的药时曲线下面积(AUC)高(6mgh/L),稳态时表观分布容积Vss接近21/kg。
唾液中药物浓度比血药浓度高。
在0.02-2mg/L范围的体外和体内试验表明,无论药物浓度如何,蛋白结合率约为45%,莫西沙星主要与血浆白蛋白结合,由于蛋白结合率低,游离峰浓度>10倍MIC。
莫西沙星在下列组织中达到高浓度:如肺(肺泡液,肺泡巨噬细胞,支气管组织),窦(筛窦,上颌窦,鼻息肉)和炎症损伤(斑蝥疱疹液),其药物浓度超过血药浓度。
组织间液的有很高的游离药物浓度(唾液、肌肉内、皮下)。
(2)代谢莫西沙星经过第二阶段的生物转化后通过肾脏和胆汁/粪便以原形和硫化物(M1)和葡萄糖醛酸盐(M2)的形式排出。
M1和M2只是在人体内的相关代谢产物,均无微生物活性。
在体外试验及I期临床试验中显示,莫西沙星在第一阶段生物转化包括细胞色素P450酶的代谢产物与其它药物无相互作用。
代谢产物M1和M2的血浆浓度比母药低,并与给药途径无关。
对代谢物进行了充分的临床前研究,排除了代谢物与安全、耐受的关系。
(3)排出莫西沙星从血浆和唾液中被排出的平均半衰期为12小时。
口服400mg药物后的平均总体表现清除率为179~246ml/min。
肾清除率为24~53ml/min,提示肾脏通过肾小管能部分重吸收该药。
同时服用雷尼替丁和普鲁苯辛不影响药物通过肾脏排泄。
莫西沙星的原形和第二阶段的代谢产物在达到平衡后几乎能完全回收,回收率为96~98%,且与给药途径无关,没有发生氧化代谢的迹象。
(4)老年莫西沙星的药代动力学不受年龄影响。
(5)性别男性和女性受试者莫西沙星的药代动力学参数(AUC,Cmax)相差33%。
该AUC 及Cmax的差别可归因于体重不同而不是性别。
因此药物吸收不受性别影响,该差别无临床意义。
(6)种族差异对高加索人种、日本人、黑人及其它种族进行了可能存在的种族差异实验。
药代动力学实验表明无临床相关的各族差异。
(7)儿童未对儿童患者进行莫西沙星药代动力学研究。
(8)肾损害肾功能受损的病人的莫西沙星药代动力学无明显改变(包括肌酐清除率<30ml/min/1.73m2),尚无肾透析病人的经验。
(9)肝损害肝功能受损的病人(Child Pugh A to C)与健康志愿者或肝功能正常的患者血浆药物浓度在临床上无明显差别。
1.5 盐酸莫西沙星的适应症与用法用量莫西沙星的适应症为治疗患有上呼吸道和下呼吸道感染的成人(≥18岁),如:急性窦炎、慢性支气管炎急性发作、社区获得性肺炎,以及皮肤和软组织感染。
剂量范围:任何适应症均推荐一次400mg(1片),一日1次。
(1)成年人服用方法片剂用一杯水送下,服用时间不受饮食影响。
治疗时间:治疗时间应根据症状的严重程度或临床反应决定。
治疗上呼吸道和下呼吸道感染时可按照下列方法:慢性气管炎急性发作:5天;社区获得性肺炎:10天;急性窦炎:7天;治疗皮肤和软组织感染的推荐治疗时间为7天。
