CCAP的微藻人工海水培养基MASM (Modified Artificial Seawater Medium)
微藻能源规模化制备的科学基础

项目名称:微藻能源规模化制备的科学基础首席科学家:李元广华东理工大学起止年限:2011.1至2015.8依托部门:上海市科委二、预期目标1. 总体目标实现微藻能源规模化制备中的关键科学问题的重大突破,挖掘能源微藻优良藻种(株)选育原理,建立能源微藻藻种综合评价体系及适合于我国国情的可规模化培养的能源微藻藻种资源库;揭示能源微藻光能转化、光合固碳及油脂高效合成的机制;阐明光生物反应器设计、优化与放大原理,以及能源微藻光自养培养工艺优化及放大原理;阐明能源微藻细胞特性对能源微藻加工过程的影响规律以及加工工艺优化原理;构建微藻能源规模化制备的集成系统,并对其进行系统优化,明晰微藻能源规模化过程中的关键环节和具体的技术瓶颈,同时为技术瓶颈的突破提供创新的源泉,推进我国微藻能源的规模化进程。
2. 五年预期目标(1)阐明优良种(株)的选育原理;建立可在户外进行规模化光自养培养的能源微藻藻种的综合评价体系;建立适合于我国不同地域、不同季节以及不同CO2气源与氮磷废水资源光自养培养且具有我国自主知识产权的能源微藻种(株)库和共享信息平台。
(2)以可规模化培养的典型能源微藻为对象,阐明光合作用、固碳、油脂合成与积累的主要机制及其调控原理,建立能源微藻全基因组代谢网络模型;实现能源微藻光合、固碳油脂合成与积累网络的改造,提高能源微藻光合、固碳和油脂积累效率;发掘3-5个关键调控因子,获得5-10个生长快、高产油脂的转基因株系。
(3)建立不同类型光生物反应器的混合特性及光分布特性参数的CFD模拟方法;确定能源微藻在光生物反应器中培养的混合特性及光分布特性方面的敏感性参数;建立不同类型光生物反应器的评价方法,确定适合于能源微藻规模培养的光生物反应器类型;建立基于光照方向混合及光衰减特性的光生物反应器优化方法以及光生物反应器的放大准则。
(4)揭示环境因子诱导微藻中油脂过量积累与环境响应机制;建立基于重构全基因组代谢网络模型与多尺度分析方法相结合的能源微藻光自养培养过程优化与放大方法。
藻类培养基
一.编号
铜绿微囊藻(FACHB-912)、水华微囊藻(FACHB-1028)、螺旋藻(FACHB-901)
小球藻(FACHB-1028)
二.培养基及培养条件
(1)螺旋藻采用Zarrouk培养基,
藻种纯化:在Zarrouk 培养基中加入 1.5%琼脂粉,制成固体培养基平板,再将待分离纯化的藻液通过划线方法接种在平板上,置于培养箱中,29℃、光照强度2000 Lux下培养7 d。
从平板上挑取单藻落接入250 mL三角瓶中(含100 mL Z氏培养基),于光照培养箱中静置培养,每天摇3 次,7 d 后作为实验备用藻种.
培养条件:温度30℃,光照4000 Lux,光暗比12:12。
(2)铜绿微囊藻、水华微囊藻、小球藻(绿藻)培养采用BG11培养基
培养条件:温度25℃,光照2000 Lux,光暗比12:12。
外源DMSO和ASA对微囊藻毒素胁迫下烟草细胞ROS生成和抗氧化系统的影响

收稿日期:2005 12 05;修订日期:2007 01 22基金项目:973项目2002CB412300;863项目2005A A601010;淡水生态与生物技术国家重点实验室资助作者简介:黄文敏(1982 ),女,湖北天门人;在读博士研究生;主要从事微囊藻毒素与植物相互作用关系的研究。
E mai l:huangwm@ihb.ac.c n 通讯作者:刘永定,E mail:liuyd@外源DMSO 和ASA 对微囊藻毒素胁迫下烟草细胞ROS 生成和抗氧化系统的影响黄文敏1,2邢 伟3 李敦海1 刘永定1(1.中国科学院水生生物研究所,武汉 430072;2.中国科学院研究生院,北京 100039;3 中国科学院武汉植物园,武汉 430074)摘要:采用2 g/mL 微囊藻毒素 RR(MC RR)、2 g/mL MC RR +0 5%二甲基亚砜(D MSO)和2 g/mL MC RR +2mmol/L 抗坏血酸(ASA)分别处理烟草悬浮细胞,研究上述各处理对烟草悬浮细胞活性氧(ROS)产生和抗氧化系统的影响。
结果表明,与对照相比,MC RR 单独处理后烟草悬浮细胞中ROS 、膜脂过氧化产物丙二醛(MDA)和细胞内源ASA 的含量及超氧化物歧化酶(SOD)和过氧化物酶(POD)的活性明显升高,还原型谷胱甘肽(GSH)的含量有一个先降后升的变化过程。
在分别加入外源抗氧化剂DMSO 或ASA 后,细胞内ROS 和MDA 含量下降,ASA 、GSH 含量和SOD 、POD 酶活性基本可恢复到对照水平。
以上结果说明,微囊藻毒素单独处理细胞可造成氧化胁迫,其所诱导的ROS 的大量积累很有可能是其产生细胞毒害的关键因子,外源抗氧化剂ASA 和DMSO 可缓解MC RR 对细胞的毒害作用,对细胞起一定保护作用。
关键词:微囊藻毒素 RR;烟草悬浮细胞;活性氧;抗氧化系统;AS A ;DMSO 中图分类号:Q26 文献标识码:A文章编号:1000 3207(2007)06 0869 05近年来水体富营养化已成为一个备受关注的环境问题,过量的氮、磷营养使藻类过度增殖而形成水华。
微藻工厂化培养经验附单胞藻的培养配方

微藻工厂化培养经验附单胞藻的培养配方微藻工厂化培养是指将微藻作为生物资源,进行大规模、连续、稳定的培养,以满足生物能源、食品、饲料、化学品等多个领域的需求。
在实际的微藻工厂化培养过程中,除了培养设备和条件的优化外,培养配方的设计也是至关重要的一环。
单胞藻是微藻中最常见的一类,其具有高生长速度、高含油量等特点,是工厂化培养的理想微藻种。
下面是一个适用于单胞藻的培养配方示例,供参考:基础培养液配方:1.碳源:以葡萄糖为主要碳源,添加适量的有机酸(如琥珀酸、柠檬酸等)作为补充,能提供碳源供给。
2.氮源:添加适量的无机氮源,如硝酸盐(如硝酸钠、硝酸钾)或氨盐(如硫酸铵、尿素)等,能满足微藻生长所需的氮元素。
3.磷源:添加适量的磷酸盐(如磷酸二氢钠、磷酸氢二铵等)作为磷源供给,能满足微藻生长所需的磷元素。
4.钾源:添加适量的钾盐(如硫酸钾、氯化钾等)作为钾源供给,能满足微藻生长所需的钾元素。
5.镁源:添加适量的镁盐(如硫酸镁、氯化镁等)作为镁源供给,能满足微藻生长所需的镁元素。
6.钙源:添加适量的钙盐(如氯化钙、冰片石等)作为钙源供给,能满足微藻生长所需的钙元素。
7.微量元素:添加适量的微量元素(如硼、锌、铁、锰等),能满足微藻生长所需的微量元素。
8.pH调节剂:根据微藻的适宜pH范围,添加适量的pH调节剂(如氢氧化钠、氢氯酸等)使培养液维持稳定的pH值。
此外,在基础培养液的基础上,可以根据微藻的特点和培养目的添加其他的辅助添加物,如调节剂、增酶剂、抗氧化剂、胺基酸等,以进一步优化培养液的成分。
需要注意的是,在进行微藻工厂化培养时,培养液的配方需要根据具体的微藻种类、生长条件、培养目的等因素进行调整,并进行适当的优化和改进。
同时,培养过程中的控制条件如温度、光照强度、光照周期、培养容器等也需要根据实际情况进行合理调整,以达到最佳的生长效果。
总而言之,微藻工厂化培养是一项复杂而关键的工序,其成功与否离不开培养配方的合理设计和整体优化。
spme与gcms联用分析缢蛏中的风味物质

6
• 采用组织学和电镜技术对曼氏无针乌贼的缠卵腺及其腺体细胞进行了研究。结果表明: 缠卵腺是由缠卵腺壁(包括外膜层及肌肉层)、分泌叶瓣两部分构成。分泌叶瓣由结 缔组织和两类细胞组成(Ⅰ型细胞和Ⅱ型细胞),其中Ⅰ型细胞起分泌功能,其中以糖 蛋白为主;Ⅱ型细胞没有分泌功能,可能对Ⅰ型细胞起支持作用。在Ⅰ型细胞中,分 泌颗粒在高尔基体上合成后,分散在细胞质中,向细胞膜移动,最后细胞以胞吐的形 式将糖蛋白释放到细胞外。为实现桁拖网渔具的渔获分离,在吕四渔场进行了2个航 次的网片分隔试验。试验中,在不同网囊中安装网目尺寸分别为60mm、75mm和 90mm的菱形网目网片,将网囊分为上下2层(下层称为鱼囊、上层称为虾囊)以实现 渔获分离。试验结果显示,随着分隔网片网目尺寸的增大,鱼囊中鱼类(短吻舌鳎( Cynoglossus abbreviatu)、小黄鱼(Pseudosciaena polyactis)和棘头梅童鱼( Collichthys lucida))渔获重量占鱼类总渔获重量比例逐渐下降;利用分隔装置效率分 析模型对不同鱼类的渔获体长分布数据进行拟合,结果表明:(1)同一种类接触不 同网目尺寸分隔网片的概率没有显著的差异;(2)短吻舌鳎和小黄鱼(包括棘头梅 童鱼)接触分隔网片的概率曲线有着明显的区别,表明上述2种鱼类在网囊中的行为 差异很大;(3)随着分隔网片网目尺寸的增大,分隔网片对鱼类个体的尺寸选择性 也逐渐增大,导致了分隔效率降低;(4)多囊桁拖网各网囊的鱼类渔获重量不存在 显著性差异,各网囊的作业强度相等;(5)分隔网片与相同网目尺寸的网囊网目选 择性具有明显的差异,并对产生这一差异的原因进行了探讨。
在水温胁迫下长蛸血细胞密度显著降低三种血细胞数量和百分比发生显著变化在血清肝和胃组织中三种保护酶活力均显著降低后又显著升高一种呼吸酶ldh活力显著降低后又显著升高acp和akp酶活力均显著降低两种消化酶蛋白酶和脂肪酶活力均发生显著变化
二、常用微藻培养液配方

二、常用微藻培养液配方微藻种类不同,培养液的配制方法也不同,即使同一种类,个人的惯用方法也不同。
现将硅藻、金藻、绿藻、黄藻和蓝藻常用的培养液配方介绍如下:(一)硅藻类培养液1、三角褐指藻、新月菱形藻培养液(1)人尿5毫升海泥抽取液20-50毫升海水1000毫升2、三角褐指藻、新月菱形藻培养液(2)硫酸铵[(NH4)2SO4]或硝酸铵(NH4NO3)30毫克过磷酸钙发酵尿液3毫升柠檬酸铁(FeC6H5O7) 0.5毫克海水1000毫升过磷酸钙发酵尿液是将1%的过磷酸钙加入尿中发酵而成,可补充尿液中的磷肥不足和保持氮肥。
3、三角褐指藻、新月菱形藻培养液(3)人尿1.5-2毫升硝酸钠(NaNO3) 50毫克磷酸二氢钾(KH2PO4)5毫克硫酸铁[Fe2(SO4)3](1%溶液)5滴柠檬酸钠(2Na3C6H507·11H2O) 10毫克硅酸钠(Na2SiO3) 10毫克维生素B12 0.2微克海水1000毫升适于小型和中继培养,加入10-20毫升海泥抽取液效果更好。
4、三角褐指藻、新月菱形藻培养液(4)硝酸铵(NH4NO3)30-50毫克磷酸二氢钾(KH2PO4)3-5毫克柠檬酸铁铵[Fe(NH4)3(C6H5O7)] 0.5-1.0毫克硅酸钾(K2SiO3) 20毫克海水1000毫升5、厄尔德-施赖伯培养液硝酸钠(NaNO3) 100毫克磷酸氢二钠(Na2HPO4·12H2O)20毫克海水1000毫克是最简单的配方,适应于硅藻的培养。
6、黄海所角毛藻培养液硝酸铵(NH4NO3) 5-20毫克磷酸二氢钾(KH2PO4)0.5-1.0毫克柠檬酸铁(FeC6H5O7) 0.5-2.0毫克海水1000毫升加入少量人尿,效果更好。
7、生产上用硅藻培养液硝酸钠60克(或15克硝酸钠+20尿素)磷酸二氢钾(KH2PO4)4克硅酸钠(Na2SiO3) 4.5克柠檬酸铁(FeC6H5O7) 0.045克消毒海水1米3适合生产上培养三角指藻、新月菱形藻和角毛藻。
≥菌2藻相互作用下胞外酶活性变化研究

最初分离出 株菌落特征差异较大的细菌 进行预
备实验 ∀经过预备实验筛选出 株形态特征和生理生
化反应特性具代表性的细菌 暂称之为
分
别对这 种细菌进行形态学和分子生物学的鉴定 ∀
胞外酶活性的测定
实验选用 Β2 葡萄糖苷酶作为测定对象 ∀ 用定量移液器移取 水样至预先经灭菌处理
的培养瓶中 ∀ 每个样品包括 个空白组和 个平行
菌 2 藻相互作用下胞外酶活性变化研究
研究报告 Ρ ΕΠΟΡ ΤΣ
郑天凌 徐美珠 俞志明 宋秀贤
厦门大学生命科学学院应用与环境微生物研究所 中国科学院海洋研究所 青岛
提要 报道了在实验室培养条件下塔马亚历山大藻 Αλεξανδριυµ ταµαρενσε 与几株海洋细菌
之间的生态关系 ∀ 实验表明 在培养前期 培养液中的营养成分尚足以维持藻类和细菌的生
另一方面细菌也可通过直接或间接的作用抑制藻细 胞的生长 甚至裂解藻细胞 从而表现为杀藻效应 ∀微 生物的这种抑藻 !杀藻及有效降解藻毒的作用具有种 间特异性 ∀所以 利用微生物的种间特异性 抑杀有害 藻类而不损害其它优良浮游微藻繁殖生长 将成为防 治有害藻类的重要手段≈ ∀
胞外酶是指那些在细胞内合成后穿过细胞质膜 的酶 ∀胞外酶水平在水体中被认为是衡量细菌和微型 生物生物量的重要指标≈ ∀Β2 葡萄糖苷酶是最为常见 的一种胞外酶 它广泛存在于海水 !半咸水 !海洋沉积 物中 可以水解多糖类物质中的 Β2 葡萄糖苷键 ∀
升 ∀ 本实验的结果与此符合 ∀
分析原因 研究者认为 在藻类生长的前期即赤
潮发生阶段 初级生产力高 水体中存在大量小分子
的六元糖 葡萄糖 !半乳糖等 抑制了 Β2 葡萄糖苷酶 的活性及其合成 ∀ 而当藻类生长后期即赤潮衰败阶
以污泥提取液为生长介质的纤细角毛藻培养与CO2生物固定

以污泥提取液为生长介质的纤细角毛藻培养与CO2生物固定孟范平;李祥蕾;谢爽;于腾;程凤莲【期刊名称】《中国海洋大学学报(自然科学版)》【年(卷),期】2013(043)009【摘要】污水污泥(MSS)中含有大量的氮磷营养盐,以其替代传统培养基作为微藻的营养来源,将显著降低微藻吸收固定CO2的成本,增强微藻在工业碳减排中的应用潜力.本研究以污水污泥提取液与海水的混合液作为纤细角毛藻(Chaetoceros gracilis)的生长介质,同时通入高浓度(5%~20%)CO2,在优化培养条件的基础上,将微藻接种到螺旋管式光生物反应器中进行动态试验,并逐日测定相应的藻生物量和固碳能力.结果表明,在污泥提取液和海水的混合体系中,纤细角毛藻的最适生长条件为:通入10% CO气体,污泥提取液和海水按照1∶29比例混合,温度为30℃,光照强度为6 000 1x.当保持10%CO2的通入速度为20 mL·min-1时,生物反应器的适宜运行条件为:藻接种量1×106cells·mL-1,循环流量1 200 mL·h-1.在上述优化条件下,最大藻生物量产率(0.36g· L-1 ·d-1)和最高固碳速率(0.67 g·L-1·d-1)出现在循环培养第5d;此外,培养液中氮、磷营养盐的利用程度较高,NO3--N、NH4+-N、NO2--N、PO43-P的去除率分别达到96.9%、93.3%、78.0%和88.5%.【总页数】7页(P89-95)【作者】孟范平;李祥蕾;谢爽;于腾;程凤莲【作者单位】中国海洋大学海洋环境与生态教育部重点实验室,山东青岛,266100;中国海洋大学海洋环境与生态教育部重点实验室,山东青岛,266100;中国海洋大学海洋环境与生态教育部重点实验室,山东青岛,266100;中国海洋大学海洋环境与生态教育部重点实验室,山东青岛,266100;中国海洋大学海洋环境与生态教育部重点实验室,山东青岛,266100【正文语种】中文【中图分类】X171【相关文献】1.CO2浓度升高对三角褐指藻和旋链角毛藻种群生长的影响 [J], 毛雪微;刘光兴;王为民;陈洪举2.不同培养基对纤细角毛藻生长的影响 [J], 梁英;麦康森;孙世春;周华财;潘敬洪3.纤细角毛藻的光生物反应器培养 [J], 田治立;王长海4.硅浓度对纤细角毛藻和三角褐指藻生长及叶绿素荧光特性的影响 [J], 梁英;尹翠玲;江新琴;于云芝5.氮、磷供给水平对纤细角毛藻生长及细胞物质组成的影响 [J], 周泽鹏;周晓见;宋雨晴;刘青;靳翠丽因版权原因,仅展示原文概要,查看原文内容请购买。
富含DHA微藻作为新型饲料添加剂在水产养殖业的应用

将 富 含 D A 的生物 原 料作 为 添加 剂 加人 到 H
1 D A 概 述 H 11 . DHA 的 概 念
饲 料 中具 有 重要 的意义 。 目前 国 内外 已有 几家 生 物 技 术公 司从 海 藻 中提 取 富 含 一 3多不 饱 和
D HA 是 二 十 二 碳 六 烯 酸 (ooa e an i d csh xe oc
脂 肪 酸 的海藻 油 .这 种海 藻 油 的 D A含 量 高达 H 4 %。用 干燥 海藻作 动物 饲料 , 0 可获 得 富含 D A H 的动物制 品
1 . 其他 行业 .4 2
o i) 简称 。 称脑 黄 金 . 系多 不 饱 和 脂 肪 酸 cd 的 俗 属
( 3p lustr e t c s 3 s 。由 w- o2naua d at ai , P t f y d 一 )
水 产 养 殖
3 6
料 卤2 1 年第 1 期 { 00 9
Aq1 e l d l ( i
富含 D HA微藻作为新型饲料添加剂 在水产养殖业的应用
纪 志有 彭 晓芳 马金余
随着 水产 饲 养技 术水 平 的提 高 . 型 营 养强 新
化 剂也 得到 了越来 越广 泛 的应用 D A是鱼 类和 H
要 组 分 D A对 动 物 营养 及药 理作 用 的研 究 已取 H 得 显著 进展 。研究 表 明 . 在水 产 方面 . 它在 提高 鱼 虾 活 力及 防治 某 些 异常 疾病 方 面 . 有 十分 重要 具
1 . 营养强 化剂及 食 品添加 剂 .1 2 在 食 品 中 添 加 D A 有 助 于 提 升 食 品 的 营 H 养 , 化产 品质量 。 目前 , 内外 已将 D A作 为 强 国 H
C、N、P对杜氏盐藻突变藻株Zeal生长和积累玉米黄素的影响

杜 氏盐藻( uai asl a 是一类在食 品 、 D n lU i ) e an 饲料 、
胡萝 卜 的混合物 。玉米 黄素具有较强 的清除脂质 素 过氧化 自由基 的能力 , 可作为 自由基清 除剂 。大量 研究表 明, 米黄 素具 有 预 防老年 性 黄斑 病变 、 玉 白内
Abt c: il exnhnpouig t t Z a )o nl l l aw s ba e sh ujc t og t eei b Vad s a t A hg aa t rd c a ( e1 f ail s i a ti da e beth uhmu gns yU n r l z i n mu n Du e a a n o n t s r a s
m o L( H )S a rpiu aati acm lin T t pt hl cnio , m o L N 4 2o a e et m l N 4 2 O w spoiosI z xnh cu ua o . osm u ew o o dtn 1 m l ( H )s ,w sh s / t oe n t u h e i / t b .
化合物 , 常与隐黄素 、 萝 卜 、 胡 素 叶黄素等共存 , 组成类
收 稿 日期 :0 0— 5—1 ; 回 日期 :00— 6—1 21 0 3修 21 0 8
项 目基金: 安徽省教育厅 自然基金项 目(0 6 J7 B 2 0j15 ) 2 0 K 1 3 , 7 02 0 q
作者简介: 昌俊 (94一) 男, 武 18 , 硕士研究生 , 主要从事微型藻类生理学研究 ;
式 C 是 一 种 天然 类 胡 萝 卜 , 萜 烯 类 不 饱 和 H O ) 素 属
障, 预防心血管疾病 , 癌等功 效 。另 外 , 抗 玉米 黄素本 身也具 有很高 的营养 价值 , 食用 后可在人 体肝 脏 内转
海水小球藻培养基配方

海水小球藻培养基配方
海水小球藻是一种常见的海洋微型藻类,具有重要的生态和经济价值。
为了研究海水小球藻的生长和代谢特性,需要制备适合其生长的培养基。
以下是一种常用的海水小球藻培养基配方:
1. 海水:1000mL
2. 硝酸铵:0.2g
3. 磷酸二氢钾:0.031g
4. 硫酸镁:0.1g
5. 硫酸钾:0.03g
6. 三氯乙酸:0.3mL
7. 硼酸:0.02g
8. 锰硫酸:0.0025g
9. 锌硫酸:0.001g
10. 铜硫酸:0.0005g
11. 钼酸铵:0.0001g
以上配方中,硝酸铵、磷酸二氢钾、硫酸镁、硫酸钾和其他微量元素是海水小球藻生长所必需的基本营养素,而三氯乙酸可以阻止其他细菌和微生物的生长。
此外,钼酸铵是一种重要的微量元素,可以促进海水小球藻的生长和代谢。
通过调整培养基配方中各种营养物质的浓度,可以实现对海水小球藻生长和代谢的精细调控。
- 1 -。
人工海水组合物、其培养的海洋希瓦氏菌和应用[发明专利]
![人工海水组合物、其培养的海洋希瓦氏菌和应用[发明专利]](https://img.taocdn.com/s3/m/89c8db8f7e21af45b207a872.png)
专利名称:人工海水组合物、其培养的海洋希瓦氏菌和应用专利类型:发明专利
发明人:梁萧,常睿珩,彭莉华,杨金龙
申请号:CN201911356218.X
申请日:20191225
公开号:CN110982747A
公开日:
20200410
专利内容由知识产权出版社提供
摘要:本发明公开了人工海水组合物、其培养的海洋希瓦氏菌和应用,该组合物以蒸馏水
1000mL来计算,还包含:氯化钠28g、七水硫酸镁7g、六水氯化镁4g、氯化钾0.70g、氯化钙1.11g、硝酸钠0.10g、磷酸钾0.01g、β‑五水甘油磷酸二钠盐0.014g、九水硅酸钠0.15g、2μg/mL 的维生素B12 0.10mL、1μg/mL的维生素B7 1mL、100μg/mL维生素B1 1mL、pⅡMetals
10mL、S2Metals 10mL、Tris 1g和氨基三乙酸0.10g,由其培养的海洋希瓦氏菌形成的生物被膜诱导厚壳贻贝稚贝附着效果与自然海水相近,对厚壳贻贝培育与养殖具有指导作用。
申请人:上海海洋大学
地址:201306 上海市浦东新区沪城环路999号
国籍:CN
代理机构:上海伯瑞杰知识产权代理有限公司
代理人:周一新
更多信息请下载全文后查看。
两种培养基下3种藻类的生长情况比较

两种培养基下3种藻类的生长情况比较
吕爱芃;马文林
【期刊名称】《安徽农业科学》
【年(卷),期】2012(040)033
【摘要】[目的]比较两种培养基下铜绿微囊藻、蛋白核小球藻和四尾栅藻的生长情况.[方法]选用两种培养基(M11和水生四号)对藻铜绿微囊藻、蛋白核小球藻和四尾栅藻进行培养,观察并计算培养期间的藻密度和比增长率.[结果]在温度26℃、光强3 000 lux、光暗比12 h∶12 h条件下,使用M11培养基培养3种藻所得最大藻细胞浓度均大于水生四号培养基的.铜绿微囊藻的μmax和μave在水生四号培养基中更大,蛋白核小球藻和四尾栅藻的μmsax和μave均在M11培养基更大.[结论]总体来讲,M11培养基比水生四号培养基更适合这3种藻的实验室培养.
【总页数】3页(P16333-16335)
【作者】吕爱芃;马文林
【作者单位】北京市应对气候变化研究与人才培养基地,城市雨水与水环境省部共建教育部重点实验室,北京建筑工程学院,北京100044;北京市应对气候变化研究与人才培养基地,城市雨水与水环境省部共建教育部重点实验室,北京建筑工程学院,北京100044
【正文语种】中文
【中图分类】S271
【相关文献】
1.结核分枝杆菌在两种培养基上生长情况的观察比较 [J], 成爱金;
2.结核分枝杆菌在两种培养基上生长情况的观察比较 [J], 咸爱金
3.溶组织内阿米巴在两种培养基中生长情况的观察 [J], 李长缨
4.淋球菌在卵黄培养基与巧克力色培养基上生长情况的比较 [J], 郑钟洁
5.两种KCN培养基生长试验的效果比较 [J], 张宏宾;徐瑞良;张国平
因版权原因,仅展示原文概要,查看原文内容请购买。
微藻养殖培养基介绍
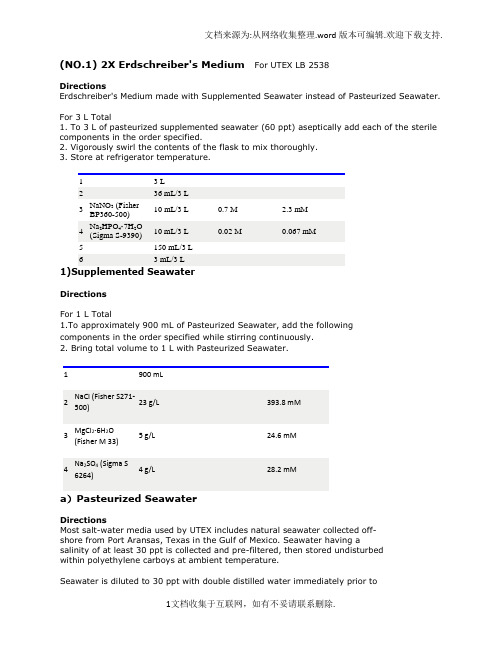
(NO.1) 2X Erdschreiber's Medium For UTEX LB 2538DirectionsErdschreiber's Medium made with Supplemented Seawater instead of Pasteurized Seawater. For 3 L Total1. To 3 L of pasteurized supplemented seawater (60 ppt) aseptically add each of the sterile components in the order specified.2. Vigorously swirl the contents of the flask to mix thoroughly.3. Store at refrigerator temperature.1 3 L2 36 mL/3 L3 NaNO3 (FisherBP360-500)10 mL/3 L 0.7 M 2.3 mM4 Na2HPO4·7H2O(Sigma S-9390)10 mL/3 L 0.02 M 0.067 mM5 150 mL/3 L6 3 mL/3 L1)Supplemented SeawaterDirectionsFor 1 L Total1.To approximately 900 mL of Pasteurized Seawater, add the following components in the order specified while stirring continuously.2. Bring total volume to 1 L with Pasteurized Seawater.1 900 mL2 NaCl (Fisher S271-500)23 g/L 393.8 mM3 MgCl2·6H2O(Fisher M 33)5 g/L 24.6 mM4 Na2SO4 (Sigma S6264)4 g/L 28.2 mMa)Pasteurized SeawaterDirectionsMost salt-water media used by UTEX includes natural seawater collected off-shore from Port Aransas, Texas in the Gulf of Mexico. Seawater having a salinity of at least 30 ppt is collected and pre-filtered, then stored undisturbed within polyethylene carboys at ambient temperature.Seawater is diluted to 30 ppt with double distilled water immediately prior topasteurization. A three-liter batch of seawater at 30 ppt in a 4-liter Erlenmeyer flask is covered with a small inverted glass petri plate and an inverted 250-ml beaker, then "pasteurized" in a steamer for 45 minutes. The pasteurized content of the flask is allowed to cool and left undisturbed at ambient temperature for approximately 24 hr. It is then again steam-pasteurized for 45 min., as on the previous day. After the flask cools the second time, the inverted-petri-plate lid is sealed in place with Parafilm and the flask is stored at refrigerator temperature until it is used to prepare culture medium. This pasteurized seawater may used immediately or may be stored for several months prior to use.Procedure:In various laboratories marine algae are cultured in media prepared from "pasteurized" seawater that is assumed to be heated to exactly 73 degrees C. The procedure described here heats 3-L batches of seawater to over 95 degrees C for two consecutive days, although it does not reach boiling temperature.This procedure generally does not cause precipitation of seawater, although excessive agitation of flasks, the use of scratched or etched flasks, or pasteurization of seawater at higher salinity may result in salt precipitation during heating.Pasteurized seawater prepared as described above appears to be nearly sterile, although it is not used to culture axenic UTEX cultures without further heating in agar. Liquid unialgal cultures grown in media prepared from seawater that has been pasteurized by this method can be sub-cultured for many years without the introduction of invasive contamination.2) P-IV Metal SolutionDirectionsFor 1 L TotalNote final concentration listed is for the stock solution.1.To approximately 950 mL of dH2O, add the nutrients in the order listed while stirring continuously.Note: The Na2EDTA should be fully dissolved before adding other components.2. Bring total volume to 1 L with dH2O.3. Store at refrigerator temperature.1 Na2EDTA·2H2O(Sigma ED255)0.75 g/L 2 mM2 FeCl3·6H2O(Sigma F-1513)0.097 g/L 0.36 mM3 MnCl2·4H2O(Baker 2540)0.041 g/L 0.21 mM4 ZnCl2 (Sigma Z-0152)0.005 g/L 0.037 mM5 CoCl2·6H2O(Sigma C-3169)0.002 g/L 0.0084 mM6 Na2MoO4·2H2O 0.004 g/L 0.018 mMconsiderations are probably important, including the following:1. The soil should be a loam, with a mixture of particle sizes(sand, silt, clay).2. It should contain a moderate amount (15 - 20%) of very-well-decomposed organic matter.3. It must not contain pesticides, especially herbicides.4. It should be soil that has been aged (preferably for 6 monthsor more) under moist conditions and not, for example, freshpotting soil, soil that contains fresh manure, or soil to which acommercial fertilizer was recently applied.5. A slightly acidic soil derived from granite or other igneousrock is preferable to soil obtained from calcareous soils. Calcium carbonate can be added to the soilwater medium when it isprepared if a slightly alkaline medium is required.6. Particulate matter in the soil such as gravel, Perlite, orvermiculite are not necessarily damaging but can be ofconsiderable nuisance when wishing to quantitate the amount ofsoil used in the medium or when handling algae that arephysically associated with the soil. Particulate organic matter,such as compost that is only partially degraded, should beavoided altogether.4) Vitamin B12DirectionsFor 200 mL Total1. Prepare 200 mL of HEPES buffer (50 mM).2. Adjust the pH to 7.8.3. Add Vitamin B12 (0.1 mM) wait until fully dissolved.4. Sterilize by 0.45 µm Millipore filter. Store in dark at freezer temperature. ** The amount of vitamins added can vary from medium to medium so the final concentration is not listed.1 HEPES buffer pH7.8 (Sigma H-3375)2.4 g/200 mLdH2O2 Vitamin B12 (cyanocobalamin,(Sigma V-6629)0.027 g/200 mLdH2O(NO.2)Proteose Medium UTEX 32DirectionsGeneral purpose freshwater medium suitable for axenic cultures. Modified bristol's medium.For 1 L Total pH ~6.81. Add proteose peptone to Bristol Medium.*For 1.5% agar medium add 15 g of agar into the flask; do not mix.2. Cover and autoclave medium.1 1 L2 Proteose Peptone(BD 211684)1 g/L1)Bristol MediumDirectionsH.C. Bold's modification of Bristol's recipe (Bold 1949). General purpose freshwater medium and as bristol's solution, an essential component of other media--see Bold 1NV, Bold 3N, Bristol-NaCl, LDM, Proteose, Soil extract, and Trebouxia.For 1 L Total1. To approximately 900 mL of dH2O add each of the components in the order specified while stirring continuously.2. Bring total volume to 1 L with dH2O.*For 1.5% agar medium add 15 g of agar into the flask; do not mix.3. Cover and autoclave medium.4. Store at refrigerator temperature.1 NaNO3 (FisherBP360-500)10 mL/L10 g/400mLdH2O2.94 mM2 CaCl2·2H2O(Sigma C-3881)10 mL/L 1 g/400mL dH2O 0.17 mM3 MgSO4·7H2O(Sigma 230391)10 mL/L 3 g/400mL dH2O 0.3 mM4 K2HPO4 (Sigma P3786)10 mL/L 3 g/400mL dH2O 0.43 mM5 KH2PO4 (Sigma P0662)10 mL/L 7 g/400mL dH2O 1.29 mM6 NaCl (FisherS271-500)10 mL/L 1 g/400mL dH2O 0.43 mM(NO.3) MES-volvox Medium UTEX 2505DirectionsGeneral purpose medium for freshwater strains, especially those requiring ammonium. Suitable for xenic and axenic cultures. Modified volvox medium. For 1 L Total1. To approximately 950 mL of dH2O, add each of the components in the order specified (except vitamins) while stirring continuously.2. Adjust the pH to 6.7.3. Bring the total volume to 1 L with dH2O.*For 1.5% agar medium add 15 g of agar into the flask; do not mix.4. Cover and autoclave medium.5. When cooled add vitamins.*For agar medium add vitamins, mix, and dispense before agar solidifies.6. Store at refrigerator temperature.1 Ca(NO3)2·4H2O (Sigma C5676)1 mL/L11.8 g/100 mLdH200.5 mM2 MgSO4·7H2O (Sigma 1 mL/L 4 g/100 mL 0.16 mM230391) dH203 Na2glycerophosphate.5H2O(Sigma G 6501 )1 mL/L5 g/100 mLdH200.16 mM4 KCl (Fisher P 217) 1 mL/L5 g/100 mLdH200.67 mM5 MES (Sigma M-8250) 1.95 g/L 10 mM6 6 mL/L7 NH4Cl (Fisher A 649-500) 1 mL/L 2.67 g/100 mLdH200.5 mM8 1 mL/L9 1 mL/La)Biotin Vitamin SolutionDirectionsFor 200 mL Total1. Prepare 200 mL of HEPES buffer (50 mM).2. Adjust the pH to 7.8.3. Add biotin (0.1 mM) wait until fully dissolved.4. Sterilize by 0.45 µm Millipore filter. Store in dark at freezer temperature. ** The amount of vitamins added can vary from medium to medium so the final concentration is not listed.1 HEPES buffer pH7.8 (Sigma H-3375)2.4 g/200 mLdH2O2 Biotin(Sigma B-4639)0.005 g/200 mLdH2O(NO.4)Enriched Seawater Medium UTEX LB 1926DirectionsModification of L. Provasoli's ES-enrichment for seawater PES (Bold & Wynne 1978). General purpose marine medium for xenic cultures.1. Aseptically add 20 mL of sterile ES Enrichment Solution per liter of Pasteurized Seawater (30 ppt).2. Store at refrigerator temperature.1 1 L2 20 mL/L1)Enrichment Solution for Seawater MediumDirectionsFor 2 L Total1. To approximately 1 L of dH2O, add each of the components in the order specified (except vitamins) while stirring continuously.2. Adjust the pH to 7.8.3. Bring the total volume to 2 L with dH2O.4. Cover and autoclave medium.5. When cooled add vitamins.6. Store at refrigerator temperature.1 NaNO3 (Fisher BP360-500) 4.7 g/2 L 27.65 mM2 Na2glycerophosphate.5H2O(Sigma G 6501 )0.7 g/2 L 1.6 mM3 325 mL/2 L4 325 mL/2 L5 HEPES buffer (Sigma H-3375)6.5 g/2 L 14 mM6 3 mL/2 L7 3 mL/2 L8 3 mL/2 La)ES Fe SolutionDirectionsFor 2 L Total1. To approximately 1.5 L of dH2O, add the following components in the order listed while stirring continuously.2. Bring total volume to 2 L with dH2O.3. Store at refrigerator temperature.1 Fe(NH4)2(SO4)2·6H2O(Sigma F-1513)1.4 g/2 L 1.8 mM2 Na2EDTA·2H2O(Sigma ED255)1.2 g/2 L 1.6 mMb)P-II Metal SolutionDirectionsFor 100 mL Total1. To approximately 70 mL of dH2O, add each of the components in the order specified while stirring continuously.2. Bring total volume to 100 mL with dH2O.3. Store at refrigerator temperature.Note: CoCL2 can be interchancable with CoSO4.1 Na2EDTA·2H2O(Sigma ED255)0.1 g/100 mL 0.27 mM2 H3BO3 (Baker 0.114 g/100 mL 1.8 mM0084)3 FeCl3·6H2O(Sigma F-1513)4.9 mg/100 mL 0.018 mM4 MnSO4·H2O(Sigma M8179)16.4 mg/100 mL 0.097 mM5 ZnSO4·7H2O(Sigma Z 0251)2.2 mg/100 mL 0.007 mM6 CoCl2·6H2O(Sigma C-3169)0.48 mg/100 mL 0.002 mMc)Thiamine Vitamin SolutionDirectionsFor 50 mL Total1. Prepare 50 mL of HEPES buffer (50 mM).2. Adjust the pH to 7.8.3. Add Thiamine (6.5 mM) wait until fully dissolved.4. Sterilize by 0.45 µm Millipore filter. Store in dark at freezer temperature. ** The amount of vitamins added can vary from medium to medium so the final concentration is not listed.1 HEPES buffer pH7.8 (Sigma H-3375)1.2 g/100 mLdH202 Thiamine (SigmaT-1270)0.11 g/100 mLdH20(NO.5)Soil Extract + Sodium Metasilicate UTEX 640DirectionsModification of Soil Extract Medium for diatoms.For 1 L Total1. Prepare 1 L of Bristol Medium and thoroughly mix.2. Discard 40 mL of the Bristol Medium.3. Add 40 mL of previously prepared GR+ Medium [Note: The GR+ should be filtered to remove soil particles].* or For 1.5% agar medium add 15 g of agar into the flask; do not mix.4. Cover and autoclave medium.5. When cooled, add filter sterilized sodium metasilicate.*For agar medium, add sodium metasilicate, mix, and dispense before agar solidifies.6. Store at refrigerator temperature.1 960 mL2 40 mL of supernatant3 Sodium Metasilicate 1 mL 200 mM 200 µM (NO.6)Erdschreiber'sMedium UTEX LB 1002and 2307DirectionsModified from the original Plymouth seawater recipe. General purpose marine medium for xenic cultures [for bacteria-free cultures see reprints in Rosowski & Parker (1971)].For 3 L Total1. To 3 L of pasteurized filtered seawater (30 ppt) aseptically add each of the sterile components in the order specified.2. Vigorously swirl the contents of the flask to mix thoroughly.3. Store at refrigerator temperature.1 3 L2 36 mL/3 L3 NaNO3(autoclave beforeadding) (FisherBP360-500)10 mL/3 L 0.7 M 2.3 mM4 Na2HPO4·7H2O(autoclave beforeadding) (Sigma S-9390)10 mL/3 L 0.02 M 0.067 mM5 150 mL/3 L6 3 mL/3 L(NO.7)TAP medium (original )from Gorman, D.S., and R.P. Levine (1965) Proc. Natl. Acad. Sci. USA54, 1665-1669. This is probably the most widely-used medium at present for experimental work.Make the following stock solutions:1. TAP saltsNH4Cl 15.0 gMgSO4 . 7H2O 4.0 gCaCl2 . 2H2O 2.0 gwater to 1 liter2. phosphate solutionK2HPO428.8 gKH2PO414.4 gwater to 100 ml3. Hutner's trace elements (follow this )To make the final medium, mix the following:2.42 g Tris25 ml solution #1 (salts)0.375 ml solution #2 (phosphate)1.0 ml solution #3 (trace elements)1.0 ml glacial acetic acidwater to 1 literFor solid medium, add 15 g agar per literAutoclave.For Tris-minimal medium omit the acetic acid and titrate the final solution to pH 7.0 with HCl(1)Hutner's trace elementsHutner et al. (1950) Proc. Am. Philos. Soc.94, 152-170This mixture is used both in and in the medium.For a detailed analysis of how well this trace elements solution meets the nutritional requirements of C. reinhardtii, see Merchant et al. (2006) Biochim. Biophys. Acta1763, 578-594.For 1 liter final mix, dissolve each compound in the volume of water indicated.文档来源为:从网络收集整理.word版本可编辑.欢迎下载支持.The EDTA should be dissolved in boiling water, and the FeSO4 should be prepared last to avoid oxidation.compound amount waterEDTA disodium salt 50 g 250 mlZnSO4 . 7 H2O 22 g 100 mlH3BO311.4 g 200 mlMnCl2 . 4 H2O 5.06 g 50 mlCoCl2. 6 H2O 1.61 g 50 mlCuSO4 . 5 H2O 1.57 g 50 ml(NH4)6Mo7O24. 4 H2O 1.10 g 50 mlFeSO4. 7 H2O 4.99 g 50 mlMix all solutions except EDTA. Bring to boil, thenadd EDTA solution. The mixture should turn green.When everything is dissolved, cool to 70 degrees C.Keeping temperature at 70, add 85 ml hot 20% KOHsolution (20 grams / 100 ml final volume). Do NOTuse NaOH to adjust the pH.Bring the final solution to 1 liter total volume. Itshould be clear green initially. Stopper the flask witha cotton plug and let it stand for 1-2 weeks, shaking itonce a day. The solution should eventually turnpurple and leave a rust-brown precipitate, which canbe removed by filtering through two layers ofWhatman#1 filter paper, repeating the filtration ifnecessary until the solution is clear. Storerefrigerated or frozen convenient aliquots. Somepeople shorten the time for formation of theprecipiate by bubbling the solution with filtered air.If no precipitate forms, the solution is still usable.However, you might want to check the pH in thiscase and adjust it to around 7.0 using either KOH orHCl as needed.To prepare sulfur-free trace elements for hydrogengeneration, the sulfate salts can be replaced withequimolar chloride salts (ZnCl2 10.0 g; CuCl2 . 2H2O 1.00 g; FeCl2 . 4 H2O, 3.60 g). .11文档收集于互联网,如有不妥请联系删除.。
适合海洋微藻活体染色的方法评价

适合海洋微藻活体染色的方法评价王帅;张波;赵昔龙;程明娇;曹为;徐希媛;郑立【摘要】To evaluate a rapid and simple technique for determining viability of 11 strains of marine mi-croalgae (10~50 μm)in the ballast water,three staining dyes (Neutral Red (NR),Fluorescein Diacetate (FDA)and 5-Chloromethylfluorescein Diacetate (CMFDA))were applied to the living cells and heat killed cells of microalgae.The result showed that NR was the best dye for determning the living cells of all ma-rine microalgae species tested in the study.The optimum staining concentration was 1/10000,and the staining time was 30 min.CMFDA,FDA and CMFDA+FDA were also available with short staining time, obvions staining effect,but limited application in this study,only suitble for cells of P latymonas helgo-landica var.tsingtaoensis ,Dunaliella salina ,Prorocentrum donghaiense ,Karenia mikimotoi ,Proro-centrum minimum ,Alexandrium catenella ,Alexandrium tamarense ,and Prorocentrum lima .The opti-mum staining concentration was FDA (5 μmol/L)+ CMFDA (2.5 μmol/L),and the stai ning time was 10 min.Based on the results,NR staining method is more suitable for detecting the microalgae cell viability in ballast water.%为了评估一种快速简单用以确定海洋微藻细胞活性的技术,针对船舶压载水中常见的3个门类中11种10~50μm 单细胞微藻用中性红(NR)、5-氯甲基荧光素二乙酸酯(CMFDA)、荧光素二乙酸酯(FDA)三种染料进行染色,通过光镜和荧光显微镜对染色结果进行测定.结果表明,NR(中性红)是检测本实验中全部海洋微藻藻株细胞活性的最佳染料,染色最佳浓度为1/10000,染色时间为30 min;5-氯甲基荧光素二乙酸酯(CMFDA)、荧光素二乙酸酯(FDA)和双荧光染色对海洋微藻藻株活细胞着色时间短,染色效果明显,但其应用具有局限性,适用于检测本实验中甲藻门(塔玛亚历山大藻、链状亚历山大藻、微小原甲藻、利玛原甲藻、东海原甲藻、米氏凯伦藻)和绿藻门(青岛大扁藻和杜氏盐藻)的活性,染色最佳浓度为5μmol/L FDA+2.5μmol/L CMFDA,染色时间为10 min,但不适用于检测硅藻门的细胞活性.因此,中性红更适合检测船舶压载水中微藻活细胞,根据光镜下微藻细胞着色情况而判断细胞活性.【期刊名称】《海洋科学进展》【年(卷),期】2018(036)002【总页数】10页(P321-330)【关键词】海洋微藻;活体着色;中性红;5-氯甲基荧光素二乙酸酯;荧光素二乙酸酯;船舶压载水【作者】王帅;张波;赵昔龙;程明娇;曹为;徐希媛;郑立【作者单位】海洋活性物质与现代分析技术国家海洋局重点实验室,山东青岛266061;国家海洋局第一海洋研究所,山东青岛 266061;河北海事局,河北秦皇岛066006;海洋活性物质与现代分析技术国家海洋局重点实验室,山东青岛 266061;国家海洋局第一海洋研究所,山东青岛 266061;中国海洋大学海洋生命学院,山东青岛 266003;海洋活性物质与现代分析技术国家海洋局重点实验室,山东青岛266061;国家海洋局第一海洋研究所,山东青岛 266061;海洋活性物质与现代分析技术国家海洋局重点实验室,山东青岛 266061;国家海洋局第一海洋研究所,山东青岛 266061;海洋活性物质与现代分析技术国家海洋局重点实验室,山东青岛266061;国家海洋局第一海洋研究所,山东青岛 266061;青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,山东青岛 266071【正文语种】中文【中图分类】Q949.2船舶压载水是造成外来海洋生物物种传播的最主要途径[1-2],每年约有100亿t的压载水随着船舶在全球转移[3]。
MEL海洋微型生物保种中心(CCMBP)

3.提取或购买藻种时请填写藻种提取申请表(附件2);
4.熟悉藻种室日常运行情况。
附件1:
藻种室公共培养区使用申请表
姓名
硕/博
申请使用时间
正常
毕业时间
联系电话
及E-mail
导师签名
藻种室使用制度:
1.公共培养区实行统一分配和管理。
2.卫生制度:轮流值日,每次值日一周;值日期间每两天清扫一次,包括地板、培养架和超净台,并清理垃圾;及时收走个人使用完毕的瓶子、废液和垃圾。
需较长时间培养藻种时请填写申请表并遵循藻种室使用制度附件藻种室公共培养区使用申请表mel海洋微型生物保种中心ccmbpmel海洋微型生物保种中心ccmbp藻种室开放规定公共培养区面向国重室所有老师和学生开放
MEL海洋微型生物保种中心(CCMBP)
藻种室开放规定
1.公共培养区面向国重室所有老师和学生开放;
3.请更换拖鞋和穿白大褂通过风淋室再进入培养区内。
4.申请时间结束时,请自觉收走所有个人实验用品;如需延长时间请重新提出申请。
5.未经允许请不要进入保种区。
本人同意遵守藻种室使用制度
值日时间
注:1.填写此表时请认真阅读“藻种室使用制度”一栏。
2.统一用A4纸打印。
3.签名后交B125高越,电话:2180287
导师
签名
签名:日期:
4.培养架号数和值日时间由管理人员填写。
附件2:藻种提取申请表
编号:
姓名
单位
所需藻种名称
藻种用途:
本人同意在研究论文中写明“藻种由近海海洋国家重点实验室(厦门大学)海洋微型生物保种中心(CCMBP)Center for Collections of Marine Bacteria and Phytoplankton提供”。签名:日期:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
MASM (Modified Artificial Seawater Medium)
Add to 800 ml distilled water 1.0 g Tris, 30 g NaCl*, and the following:
Stock solutions in g / 100 ml water
for 1 litre final medium (1)
24.4 g MgSO 4.7H 2O 10.0 ml (2)
6.0 g KCl 10.0 ml (3)
10.0 g NaNO 3 10.0 ml (4)
3.0 g CaCl 2.2H 2O 10.0 ml (5)
0.5 g KH 2PO 4 10.0 ml (6)
2.67 g NH 4Cl 1.0 ml (7)
trace element solution (see below) 6.0 ml (8)
vitamin B 1 (see below)
1.0 ml (9) vitamin B 12 (see below) 1.0 ml
Soil Extract 2 (see overleaf)
30.0 ml Make up to 1 litre with distilled water and adjust to pH 8.0 with HCl. Autoclave at 15 psi for 15 minutes.
* For brackish organisms, take 15 g of NaCl instead of 30 g (BW/MASM)
Trace element solution (7)
Add to 1000 ml of distilled water 0.75 g Na 2EDTA and the minerals in exactly the following sequence:
FeCl 3.6H 2O
97.0 mg MnCl 2.4H 2O
41.0 mg ZnCl 2.6H 2O
5.0 mg CoCl 2.6H 2O
2.0 mg Na 2MoO 4.2H 2O
4.0 mg
Vitamin B 1 (8) 0.12 g Thiaminhydrochloride in 100 ml distilled water. Filter sterile. Vitamin B 12 (9) 0.1 g Cyanocobalamin in 100 ml distilled water, take 1 ml of this solution and add 99 ml distilled water. Filter sterile. m e d i a r e c i p e s
SE2 (Soil Extract 2)
Freshwater and terrestrial protozoa
Preparing the soil
Site selection for a good soil is very important and for most purposes a soil from undisturbed deciduous woodland is best. Sites to avoid are those showing obvious signs of man's activity and particular care should be taken to avoid areas where fertilizers, crop sprays or other toxic chemicals may have been used.
A rich loam with good crumb structure should be sought. Stones, roots and larger invertebrates should be removed during an initial sieving through a 1 cm mesh. The sieved soil should be spread to air dry and hand picked for smaller
invertebrates and roots. It should be turned periodically and picked over again. When dry it may be sieved through a finer mesh (24 mm) or stored as it is prior to use.
Medium
Soil is prepared as above. 105 g of airdried sieved soil and 660 ml of deionized water are placed in a 1 litre bottle and autoclaved once at 15 psi for 15 minutes, then again after 24 hours. The contents of the bottle are left to settle (usually for at least a week) and then the supernatant is decanted and filtered. The final pH should be 7.0 8.0. m e d i a r e c i p e s。
