花生种皮及籽仁DNA提取方法的研究
四种提取花生DNA的方法

氯化钠法:取3mL 精练棉子油, 加入 3 mL 正己烷,加入3mLN aCl( 1. 4 m ol # L- 1) , 继续于旋转搅拌器上振荡混合1h ; 120 00 r # min- 1离心20 m in, 使有机相和水相分离, 小心取出下层水相; 加入与水相溶液等体积的异丙醇, 轻缓颠倒混匀, 室温放置40 min后, 1 2000 r /min- 1离心20 m i n , 弃上清液, 保留沉淀; 待沉淀稍微干燥后用 1 mL T E 溶解沉淀, 加入 1 mL 异丙醇, 轻缓颠倒混匀, 室温放置10 min,后, 1 2000 r # m in- 1离心20min , 弃上清液, 保留沉淀; 待沉淀稍微干燥后加入60 L L T E, 充分溶解沉淀, 2 min 过后generay biotech 琼脂糖凝胶DNA回收试剂盒(离心柱型)GK2041 50次( 仅进行纯化部分) , 最后将离心获得的溶液( 经核酸蛋白浓度检测仪检测浓度) 取5微升进行琼脂糖凝胶电泳, 同时可作为PCR 反应的模板[ 5 - 6]。
建议一个P CR 反应使用1微升DN A 。
纯化部分:1.从琼脂糖凝胶中切下含有目的片段的凝胶,估计重量或精确称量重量。
2.每100mg 琼脂糖凝胶加入100μl Binding Solution ,于50~60℃水浴3~5min,期间每2~3min 间断轻微颠倒混匀,直至胶块完全融化。
注:为操作方便,可统一加入400μl Binding Solution。
3.将上述混合液转移至套有2ml 收集管的吸附柱GC-3u中,室温放置2min,6,000rpm 室温离心1min,取出吸附柱GC-3u,并倒掉收集管中废液。
4.将将吸附柱GC-3u 重新放回收集管中,加入500µl WASolution,于12,000rpm,室温离心1min,倒掉收集管中废液。
5.将吸附柱GC-3u 重新放回收集管中,加入500μl WashSolution,于12,000rpm,室温离心1min,倒掉收集管中废液。
植物提取dna的步骤及原理

植物提取dna的步骤及原理以植物提取DNA的步骤及原理为标题,本文将介绍植物提取DNA 的基本步骤以及相关原理。
植物提取DNA是指从植物细胞中分离出DNA分子的过程。
植物细胞中的DNA包含了植物的遗传信息,因此提取植物DNA对于遗传研究和基因工程具有重要意义。
下面是植物提取DNA的基本步骤:步骤一:准备样品需要选择一种适合的植物样品。
可以选择新鲜的叶片、茎段或种子作为样品。
样品应该尽可能新鲜,并且避免受到污染或损伤。
步骤二:打碎细胞将样品放入冰冻细胞研磨器中,加入研磨缓冲液,并用研磨器将样品研磨成细胞悬浮液。
研磨缓冲液中的盐和洗涤剂有助于破坏细胞壁,并释放细胞内的DNA。
步骤三:溶解细胞膜将研磨后的细胞悬浮液转移到离心管中,并加入含有洗涤剂的细胞裂解液。
洗涤剂能够破坏细胞膜,使DNA从细胞中释放出来。
步骤四:沉淀DNA将细胞裂解液置于高速离心机中进行离心,离心过程中,DNA会被沉淀到离心管底部形成一个白色的沉淀物。
离心后,将上清液倒掉,只保留沉淀物。
步骤五:洗涤DNA使用75%乙醇溶液洗涤DNA沉淀物,以去除离心过程中残留的盐和洗涤剂等杂质。
洗涤后,用吸管或微量移液器将乙醇溶液完全抽尽,避免干燥过程中DNA沉淀物溶解。
步骤六:溶解DNA将洗涤后的DNA沉淀物用适量的溶解液溶解,常用的溶解液包括TE缓冲液或纯净水。
溶解后的DNA溶液可以用于后续的实验操作,如PCR扩增、酶切等。
以上就是植物提取DNA的基本步骤,下面将简要介绍相关的原理。
DNA提取的原理主要基于细胞的破坏和DNA的溶解。
在打碎细胞的过程中,使用研磨缓冲液破坏细胞壁,释放细胞内的DNA。
细胞裂解液中的洗涤剂能够破坏细胞膜,使DNA从细胞中释放出来。
离心过程中,DNA分子由于其较大的分子量而沉淀到离心管底部,而其他细胞碎片和杂质则在上清液中。
洗涤过程中使用的乙醇溶液能够去除离心过程中残留的盐和洗涤剂等杂质。
最后,将DNA沉淀物溶解在适当的溶解液中,得到DNA溶液。
花生DNA提取方法比较

花生DNA提取方法比较梁雪莲;郑奕雄;陈晓玲;曾锦姬【期刊名称】《生物技术》【年(卷),期】2007(17)1【摘要】目的:旨在筛选优化花生DNA提取方法。
方法:采用SDS法、改进SDS 法;CTAB法、改进CTAB法四种方法对花生叶DNA进行提取,并从电泳结果、纯度、得率、等方面对其进行比较研究,从而确定花生DNA提取适用流程;结果:CTAB法DNA平均得率为55.0μg/g.Fw,略小于SDS的60.3,但其A260/A280平均值为1.81,比SDS的1.55更接近标准要求。
结论:综合考虑CTAB法是提取花生DNA的最佳方法,可提取到较高质量的DNA,符合分子检测要求;虽然改良CTAB 法也相对好于SDS法,但由于步骤增加反而加剧DNA降解。
【总页数】4页(P41-44)【关键词】花生;叶片DNA;SDS法;改进SDS法;CTAB法;改进CTAB法【作者】梁雪莲;郑奕雄;陈晓玲;曾锦姬【作者单位】仲恺农业技术学院【正文语种】中文【中图分类】Q781【相关文献】1.农杆菌介导花生的遗传转化研究Ⅱ.花生基因组DNA提取方法的改良与鉴定 [J], 单世华;张海平;李春娟;庄伟建2.五种DNA提取方法对酸奶及菌粉中益生菌DNA提取效果比较 [J], 肖其胜;杨捷琳;丁卓平;何宇平3.几种DNA提取方法对红树植物秋茄叶片DNA提取效果的比较 [J], 仇建标;丁文勇;陈少波4.五种DNA提取方法对鱼加工制品DNA提取效果的比较 [J], 李进波;盛婧;李想;潘良文;吕蓉;杨捷琳5.DNA提取方法对一串红不同部位DNA提取的比较 [J], 侯艳霞;汤浩茹;张勇;罗娅;董晓莉因版权原因,仅展示原文概要,查看原文内容请购买。
花生种皮及籽仁DNA提取方法的研究

花生种皮及籽仁DNA提取方法的研究石运庆;苗华荣;陈高;孙兵;陈静;胡晓辉;闫彩霞;单世华【期刊名称】《花生学报》【年(卷),期】2008(37)4【摘要】采用改良的CTAB和SDS方法对金花1012和Jll两个花生品种种子的种皮及籽仁的DNA进行了提取研究.发现CTAB法无法提取J11种皮的DNA,而改良的SDS方法能将两种花生的种皮及籽仁的DNA提取出来.另发现用苯酚对提取的DNA进行纯化效果更显著.因此,配合使用苯酚去除蛋白质的SDS方法更适宜于花生种皮DNA的提取.【总页数】3页(P37-39)【作者】石运庆;苗华荣;陈高;孙兵;陈静;胡晓辉;闫彩霞;单世华【作者单位】山东省花生研究所,山东,青岛,266100;山东省花生研究所,山东,青岛,266100;东北农业大学,黑龙江,哈尔滨,150030;东北农业大学,黑龙江,哈尔滨,150030;山东省花生研究所,山东,青岛,266100;山东省花生研究所,山东,青岛,266100;山东省花生研究所,山东,青岛,266100;山东省花生研究所,山东,青岛,266100【正文语种】中文【中图分类】S565.203;Q78【相关文献】1.农杆菌介导花生的遗传转化研究Ⅱ.花生基因组DNA提取方法的改良与鉴定 [J], 单世华;张海平;李春娟;庄伟建2.连城县文亨镇土壤及红衣花生籽仁硒含量研究 [J], 黄兆钟3.花生区组间杂种未成熟籽仁cDNA PCR库的构建与初步筛选 [J], 王传堂;杨新道;陈殿绪;王东4.花生区组间杂种未成熟籽仁cDNAPCR库的构建与初步筛选 [J], 王传堂;杨新道;陈殿绪;王东5.不同种皮色泽花生籽仁的品质性状研究 [J], 李正超;邱庆树;苗华荣;申馥玉;王传堂;胡文广;张吉民因版权原因,仅展示原文概要,查看原文内容请购买。
花生DNA快速提取方法及应用
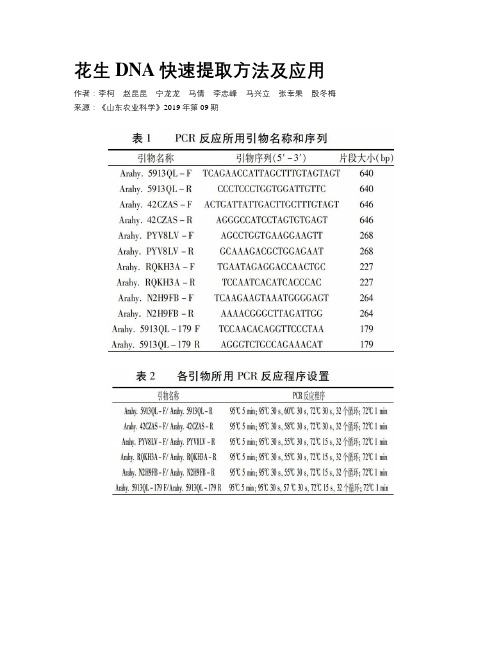
花生DNA快速提取方法及应用作者:李柯赵昆昆宁龙龙马倩李忠峰马兴立张幸果殷冬梅来源:《山东农业科学》2019年第09期摘要:为了能够高效快速提取群体花生DNA,本研究在碱裂解法的基础上进一步简化步骤,以不同浓度 NaOH溶液为提取液,采用直接吸取上清进行PCR和吸取部分上清中和后进行PCR,分析了两种方法的提取效果。
结果表明,用1.000 mol/L NaOH溶液裂解后,吸取部分上清中和后的DNA扩增效果更好,与用SLS常规法提取的DNA质量效果相同。
该方法简便快捷,在很短的时间内能够提取大量花生群体材料的DNA,并具有较高的稳定性,可在花生分子标记辅助选择育种中广泛应用,为不同基因型花生的高通量快速筛选奠定了基础。
关键词:花生;DNA快速提取;碱裂解法中图分类号:S565.2 文献标识号:A 文章编号:1001-4942(2019)09-0068-05A Rapid Extraction Method of Peanut DNA and Its ApplicationLi Ke, Zhao Kunkun, Ning Longlong, Ma Qian, Li Zhongfeng, Ma Xingli, Zhang Xingguo, Yin Dongmei(College of Agronomy, Henan Agricultural University, Zhengzhou 450002, China)Abstract In order to extract population peanut DNA efficiently and quickly, the steps were further simplified based on the alkaline lysis method. With different concentrations of NaOH solution as the extract, the extraction supernatant was used directly for PCR or partial supernatant was neutralized for PCR, and the extraction effects of the two methods were analyzed. The results showed that the DNA amplification effect was better after lysis with 1.000 mol/L NaOH solution and partial neutralization, which was the same as the DNA quality extracted by SLS conventional method. This method was simple and rapid, could extract the DNA of a large number of population materials in a short time, and had high stability, so it could be widely applied in molecular marker-assisted selection breeding of peanuts. It laid the foundation for high-throughput rapid screening of different genotypes.Keywords Peanut; Rapid DNA extraction; Alkaline lysis method花生是世界上主要油料作物之一,其出油率远远高于油菜、大豆、芝麻、向日葵等其他油料作物。
一种快速提取花生DNA的新方法

一种快速提取花生DNA的新方法
李杏瑜;朱方何;洪彦彬;陈小平;李少雄;周桂元;刘海燕;梁炫强
【期刊名称】《广东农业科学》
【年(卷),期】2011(000)0z1
【摘要】以花生为材料提取DNA的步骤繁杂且耗费时间.探讨用一步法提取花生DNA,该方法具有快速、简便、结果可信度高、重复性好等特点,可用于进行花生品种种性和纯度的鉴定,以及分子标记辅助田间育种材料的选择.
【总页数】2页(P75-76)
【作者】李杏瑜;朱方何;洪彦彬;陈小平;李少雄;周桂元;刘海燕;梁炫强
【作者单位】广东省农科院作物研究所,广东广州 510640;广东省农科院作物研究所,广东广州 510640;广东省农科院作物研究所,广东广州 510640;广东省农科院作物研究所,广东广州 510640;广东省农科院作物研究所,广东广州 510640;广东省农科院作物研究所,广东广州 510640;广东省农科院作物研究所,广东广州 510640;广东省农科院作物研究所,广东广州 510640
【正文语种】中文
【中图分类】Q781
【相关文献】
1.一种快速提取蚤蝇DNA的新方法 [J], 冯典兴;刘广纯
2.一种玉米叶片基因组DNA快速提取新方法的初步研究 [J], 雷开荣;石春焱;李明顺;李晓辉;李新海
3.一种快速提取棉花干种子基因组DNA的新方法 [J], 郎需勇;刘伟霞;杨亮;周文华;吴建功;别传述
4.一种快速提取香蕉叶片总核酸、总RNA和总DNA的新方法 [J], 柴娟;冯仁军;史后蕊;任梦云;王静毅;张银东
5.一种微量快速提取纯化细菌染色体DNA的新方法 [J], 傅继华;翟文济;关冰
因版权原因,仅展示原文概要,查看原文内容请购买。
植物基因组dna的提取实验报告

植物基因组dna的提取实验报告
实验报告:
实验目的:
本实验旨在从植物样品中提取基因组DNA,为后续的分子生物学研究打下基础。
实验原理:
基因组DNA提取是利用化学或物理方法将细胞壁和细胞膜溶解,使基因组DNA裸露并获得。
提取过程包括浸泡、分离、洗涤、溶解等步骤。
具体步骤如下:
取所需植物材料,洗净、切碎样品;
加入提取缓冲液(Tris-HCl pH 8.0,EDTA,SDS,NaCl),使样品充分混合,破坏细胞膜和核膜;
加入蛋白酶K,分解蛋白质,避免DNA被酶水解;
加入异丙醇或氯仿使蛋白质、核酸等组分分层,去除上层杂质;
加入70%乙醇将DNA沉淀,并进行清洗和干燥;
加入TE缓冲液(Tris-HCl pH 8.0, EDTA)溶解DNA。
实验步骤:
取植物样品(番茄、酸枣等)粉碎,加入4ml提取缓冲液,放入离心管中;
加入1μl蛋白酶K,轻轻颠倒离心管使样品混合均匀;
培养30分钟于65°C恒温器内;
加入1ml氯仿并振荡10次后,离心5分钟,将上层液体转移至新的离心管中;
加入1ml异丙醇,并离心5分钟,将上层液体转移至新的离心管中;
加入1ml70%乙醇,并离心5分钟,将上层液体倒掉,留下沉淀;
加入1ml去离子水,将沉淀溶解,得到DNA提取液。
实验结果:
经过以上步骤,成功从植物样品中提取到基因组DNA。
通过分光光度法检测DNA浓度为200 ng/μl,纯度可达到A260/A280=1.8。
结论:
本实验成功从植物样品中提取到基因组DNA,提取效果良好,为后续的分子生物学实验打下基础。
一种花生籽仁不同发育时期的取样方法[发明专利]
![一种花生籽仁不同发育时期的取样方法[发明专利]](https://img.taocdn.com/s3/m/2fa97688b84ae45c3a358ca3.png)
专利名称:一种花生籽仁不同发育时期的取样方法
专利类型:发明专利
发明人:张新友,吕登宇,黄冰艳,张毛宁,房元瑾,董文召,石磊,苗利娟,王娟,齐飞艳
申请号:CN202010876548.8
申请日:20200827
公开号:CN111982564A
公开日:
20201124
专利内容由知识产权出版社提供
摘要:本发明涉及一种花生籽仁不同发育时期的取样方法,包括以下步骤:将待检测的花生品种播种田间,按照常规田间管理;在花生开花下针盛期,当每株花生第2节位或第3节位出现4~6个尚未入土的果针时,选取长度大于2cm的果针进行标记;标记果针结束后,于同一时间进行统一培土,使被标记果针完全被遮盖;将统一培土的当日记为果针入土第1d,以后每隔5‑10d取花生籽仁样品一次,备用。
本发明标记时间短,最大限度地维持了荚果发育的同步性,控制了因荚果发育差异造成的取样误差,提高取样精确性和一致性,为进一步的生理生化或遗传学及分子生物学研究奠定基础。
申请人:河南省农业科学院
地址:450002 河南省郑州市金水区花园路116号
国籍:CN
代理机构:郑州市华翔专利代理事务所(普通合伙)
代理人:张爱军
更多信息请下载全文后查看。
四种提取花生DNA的方法

氯化钠法:取3mL 精练棉子油, 加入 3 mL 正己烷,加入3mLN aCl( 1. 4 m ol # L- 1) , 继续于旋转搅拌器上振荡混合1h ; 120 00 r # min- 1离心20 m in, 使有机相和水相分离, 小心取出下层水相; 加入与水相溶液等体积的异丙醇, 轻缓颠倒混匀, 室温放置40 min后, 1 2000 r /min- 1离心20 m i n , 弃上清液, 保留沉淀; 待沉淀稍微干燥后用 1 mL T E 溶解沉淀, 加入 1 mL 异丙醇, 轻缓颠倒混匀, 室温放置10 min,后, 1 2000 r # m in- 1离心20min , 弃上清液, 保留沉淀; 待沉淀稍微干燥后加入60 L L T E, 充分溶解沉淀, 2 min 过后generay biotech 琼脂糖凝胶DNA回收试剂盒(离心柱型)GK2041 50次( 仅进行纯化部分) , 最后将离心获得的溶液( 经核酸蛋白浓度检测仪检测浓度) 取5微升进行琼脂糖凝胶电泳, 同时可作为PCR 反应的模板[ 5 - 6]。
建议一个P CR 反应使用1微升DN A 。
纯化部分:1.从琼脂糖凝胶中切下含有目的片段的凝胶,估计重量或精确称量重量。
2.每100mg 琼脂糖凝胶加入100μl Binding Solution ,于50~60℃水浴3~5min,期间每2~3min 间断轻微颠倒混匀,直至胶块完全融化。
注:为操作方便,可统一加入400μl Binding Solution。
3.将上述混合液转移至套有2ml 收集管的吸附柱GC-3u中,室温放置2min,6,000rpm 室温离心1min,取出吸附柱GC-3u,并倒掉收集管中废液。
4.将将吸附柱GC-3u 重新放回收集管中,加入500µl WASolution,于12,000rpm,室温离心1min,倒掉收集管中废液。
5.将吸附柱GC-3u 重新放回收集管中,加入500μl WashSolution,于12,000rpm,室温离心1min,倒掉收集管中废液。
花生种子高纯度DNA的提取(简报)

花生种子高纯度DNA的提取(简报)
王艳
【期刊名称】《热带亚热带植物学报》
【年(卷),期】1996(4)4
【摘要】花生种子高纯度DNA的提取(简报)王艳,何军贤,傅家瑞(中山大学生命科学学院,广州50275)关键词花生;种子;DNA;十六烷基三甲基溴化铵RAPIDANDEFFICIENTPURIFICATIONOFDNAFROMPEANUT(ARACHISHYP...
【总页数】3页(P91-93)
【作者】王艳
【作者单位】中山大学生命科学学院;中山大学生命科学学院
【正文语种】中文
【中图分类】S565.201
【相关文献】
1.提取条斑紫菜高纯度总DNA及其质粒状DNA的新方法 [J], 郭宝太;夏连胜;姜国勇;毕玉平;戴继勋
2.芝麻高纯度线粒体DNA提取技术研究 [J], 黎冬华;王林海;张艳欣;吕海霞;张晓燕;刘佳;张秀荣
3.条斑紫菜高纯度总DNA及其质粒状DNA的提取 [J], 郭宝太;毕玉平;单雷;李广存;戴继勋
4.从白刺老干中提取高纯度DNA的方法 [J], 陈淑华;张玉玲;黄雪峰;谢琦;丁海燕;
冷志巍
5.粪便样本中高纯度人源DNA富集提取方法 [J], 吴帅帅;武云晖
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
文章编号:100224093(2008)0420037203花生种皮及籽仁DNA提取方法的研究3石运庆1,苗华荣1,陈高2,孙兵2,陈静1,胡晓辉1,闫彩霞1,单世华133(1.山东省花生研究所,山东青岛266100;2.东北农业大学,黑龙江哈尔滨150030)摘要:采用改良的CTAB和SDS方法对金花1012和J11两个花生品种种子的种皮及籽仁的DNA 进行了提取研究。
发现CTAB法无法提取J11种皮的DNA,而改良的SDS方法能将两种花生的种皮及籽仁的DNA提取出来。
另发现用苯酚对提取的DNA进行纯化效果更显著。
因此,配合使用苯酚去除蛋白质的SDS方法更适宜于花生种皮DNA的提取。
关键词:花生;籽仁;种皮;DNA提取;SDS法;CTAB法中图分类号:S565.203;Q78文献标识码:AStudy on D NA Extraction from Seed and Seed C apsule ofPeanut(Ar achis hy pogaea L.)S H I Yun2qing1,M IAO Hua2rong1,C H EN Gao2,SUN Bing2,C H EN Jing1,HU Xiao2hui1,YAN Cai2xia1,S HAN Shi2hua1(1.S handong Peanut Research I nstit ute,Qi ng dao266100,Chi na;2.N ort heast A g ricult ure U ni versit y,H aerbi n150030,Chi na)Abstract:Two DNA ext raction met hods,C TAB and SDS,were compared in ext racting DNA f rom seed and seed cap sule of Jinhua1012and J11.It was found t hat t he DNA f rom seed cap sule of J11 couldn’t be ext racted out using C TAB met hod;but using SDS met hod,t he DNA could be ext racted out f rom bot h seed and seed cap sule of t he two varieties.And t he p urification effect of DNA was very obvious using p henol.Result s showed,SDS met hod wit h p henol is more suitable to ext racting DNA f rom seed cap sule of peanut s.K ey w ords:peanut(A rachis hy pogaea L.);seed;seed cap sule;genome DNA;SDS met hod;C TAB met hod 花生种皮是花生抵御病毒侵染的首要屏障,也是克隆抗病基因的重要材料[1~3]。
从花生种皮中提取高质量的DNA是克隆花生种皮中抗病基因的重要前提。
植物总DNA的提取方法主要有两种:C TAB法和SDS法[4~7]。
但关于如何从花生种皮和籽仁中提取高质量DNA的研究尚未见报道。
本实验对这两种方法进行了改良和对比研究,以期在后续的花生抗病基因克隆分离及功能鉴定过程中提供高质量的试验材料。
1 材料与方法1.1 主要仪器及试剂PAC3000型稳压稳流电泳仪(B IORAD)、Bio sens SC300型凝胶成像仪、Zoom Browser 花生学报 2008,37(4):37~39 J ournal of Peanut S cience,Vol.37,No.4,20083收稿日期:2008207224基金项目:国家自然科学基金项目(30771361);山东省农科院青年基金项目(2006YQN018)作者简介:石运庆(19762),男,山东蒙阴人,山东省花生研究所助理研究员,硕士,主要从事花生遗传育种研究。
通讯作者:单世华,博士,研究员,主要从事花生种质资源与生物技术研究。
E-mail:shhshan@。
EX 凝胶成像软件、Biof uge St rato s 型高速冷冻离心机(德国贺利氏)。
ED TA 产自Sigma 公司,C TAB 产于Amresco 公司,SDS 为MD B.O 公司生产,氯仿产自莱阳化工厂,Tris 饱和酚、异戊醇、异丙醇均产自天津试剂公司。
1.2 供试材料田间分别种植花生品种J 11和金花1012,在荚果充实期取样,以两个品种的种皮及籽仁作为试验材料。
1.3 实验方法1.3.1 花生种皮及籽仁DNA 提取 采用改良的C TAB 和SDS 方法提取花生种皮及籽仁的DNA 。
1.3.2 DNA 电泳 用0.8%琼脂糖凝胶,DNA 上样量为6μL ,Marker 为1μL ,100V 电压,电泳时间为40min 。
2 结果与分析2.1 苯酚在花生DNA 纯化中的作用用改良的C TAB 法提取金花1012的种皮DNA ,经电泳发现苯酚/氯仿/异戊醇在去除蛋白质方面比氯仿/异戊醇效果更好。
如图1所示,用苯酚/氯仿/异戊醇纯化的DNA 样电泳后点样孔内基本没有蛋白质,而仅用氯仿/异戊醇纯化的DNA 样电泳后点样孔内蛋白质还较多。
2.2 改良C TAB 法提取花生种皮DNA 的效果用改良的CTAB 法提取金花1012和J11两个花生品种种子的种皮及籽仁DNA ,实验中采用苯酚/氯仿/异戊醇纯化DNA 。
如图2所示,发现CTAB 法无法提取到J 11的种皮DNA ,但能提取J11的籽仁及金花1012的种皮和籽仁的DNA。
2.3 改良SDS 法提取花生种皮DNA 的效果用改良的SDS 法提取金花1012和J 11两个花生品种种子的种皮及籽仁DNA 效果较好。
电泳结果如图3所示,利用改良的SDS 法83 花 生 学 报 37卷 图3 SDS 法提取的花生种皮及籽仁DNA 凝胶电泳图 Fig.3 Electrop horegram of DNA ext racted f rom seed and seed cap sule of Jinhua1012and J 11using SDS met hod 注:M :marker ;1:金花1012种皮DNA ;2、3:J 11种皮DNA ;4、5:金花1012籽仁DNA ;6、7:J 11籽仁DNA 。
Note :M :marker ;1,DNA f rom seed cap sule of Jinhua1012;2、3,DNA f rom seed cap sule of J 11;4、5,DNA f rom seed of Jinhua1012;6、7,DNA f ro m seed of J 11.可将两个花生品种种子的种皮及籽仁DNA 高质量提取出来。
3 讨 论分子生物学试验中所提取的DNA 中蛋白质含量多少是衡量提取物质量优劣的重要指标,如果蛋白质含量过高将会严重影响后续的酶切及相关操作的效果[4]。
因此,DNA 提取过程中最大程度去除残留的蛋白质是重要一环。
花生种皮和籽仁中含有大量脂肪、蛋白质等物质,实验发现仅用氯仿/异戊醇除净DNA 中的蛋白质比较困难,而配合使用苯酚则除去DNA 中的蛋白质相对容易,如再重复抽提一次效果会更好。
用C TAB 法提取J 11种皮DNA 的过程中,加入异丙醇后发现有类似DNA 的沉淀生成,且数量较多,但经TE 溶解后电泳未发现有任何亮带(见图2中的3、4点样孔)。
选用2006、2007年多次采集的J11样品提取DNA 结果一致,目前尚不清楚沉淀的成分,需在后续研究中进一步分析。
本试验中利用改良的SDS 方法提取J 11种皮的DNA 效果较好,说明SDS 法比C TAB 法更适合提取花生种皮的DNA 。
因此,在提取植物组织中的DNA 时,对于不同的材料或同一材料的不同组织应选用最适宜的提取方法[5,6]。
参考文献:[1]Liang X Q ,Pan R C ,Bin J H.Facto rs affecting p re 2harvest aflato xin p roduction in peanut [J ].China Oil Crop s Sci ,2000,22(4):72~78.[2]梁炫强,周桂元,潘瑞炽.花生种皮蜡质和角质层与黄曲霉侵染和产毒的关系[J ].热带亚热带植物学报,2003,11(1):11~14.[3]单世华,李春娟,严海燕,等.花生种皮抗黄曲霉差异基因表达分析[J ].植物遗传资源学报,2007,8(1):26~29.[4]王关林,方宏筠.植物基因工程(第二版)[M ].北京:科学出版社,2002.[5]李晓波,冯波,张朝晖,等.植物药材总DNA 提取[J ].中草药,2002,33(7):652~654.[6]王景雪,孙毅,高武军.一种简便实用的植物总DNA提取方法[J ].山西大学学报(自然科学版),2000,23(3):271~272.[7]Macdo nald M B ,Elliot L J ,Sweenery P M.DNA ex 2tractio n f rom dry seeds for RA PD analyses in varietal identificatio n studies[J ].Seed Science and Technolo 2gy ,1995,22:171~176.(上接第21页)[6]王才斌,成波,张礼凤.不同类型花生新品种需肥特点及优化施肥研究[J ].土壤,1999,31(6):324~327.[7]Watson D J.The physiological basis of variation in yield[J ].Advance in Agronomy ,1952,(4):101~145.[8]郭峰,万书波,王才斌,等.宽幅麦田套种田间小气候效应及对花生生长发育的影响[J ].中国农业气象,2008,29(3):285~289.[9]王在序,盖树人.山东花生[M ].上海:上海科技出版社,1999.[10]王才斌,郑亚萍,成波,等.高产花生冠层光截获和光合、呼吸特性研究[J ].作物学报,2004,30(3):274~278.93 4期 石运庆,等:花生种皮及籽仁DNA 提取方法的研究 。
