从铜制备二水合氯化铜
制取cucl的一种方法

制取cucl的一种方法CuCl是一种重要的铜氯化物,常用于催化剂、化学试剂和金属表面处理等领域。
制备高纯度、可控性强的CuCl是很多研究和工业应用的基础。
本文将介绍一种常用的制取CuCl的方法,包括原理、步骤和实验注意事项。
原理制取CuCl的常用方法是通过氯化铜(II)和还原剂反应得到。
其中,常用的还原剂有亚硫酸盐、亚砜、硫代硫酸钠等。
反应过程中,铜离子被还原成Cu(0)并与氯离子结合形成CuCl。
实验步骤1. 实验准备- 铜源:铜粉或铜片。
- 氯化剂:氯化氢或氯化铵。
- 还原剂:选择具体的还原剂根据实际需要。
- 反应溶剂:常用的溶剂有水、乙醇等。
- 实验设备:反应容器、加热设备、搅拌器等。
2. 反应过程- 准备反应容器,并在其中加入适量的反应溶剂。
- 将铜源加入反应容器中,根据需要的量进行调整。
- 按照一定比例,向反应容器中加入氯化剂。
- 加入还原剂,并调整反应条件(温度、搅拌速率等)。
- 进行反应一段时间,通常需要数小时至数天不等。
- 反应结束后,将生成的CuCl沉淀离心分离。
- 用适量的溶剂重悬得到纯净的CuCl溶液,或将沉淀干燥得到固态的CuCl。
3. 实验注意事项- 在实验过程中,要注意安全操作,避免接触有害物质。
- 反应容器要选择耐腐蚀性的材质。
- 温度和搅拌速率等操作条件需要根据具体的反应进行调整。
- 确保铜源和还原剂的质量和纯度,避免影响反应结果。
- 实验操作时应维持反应体系的干燥和无氧环境,以防止副反应的发生。
- 在沉淀分离和溶剂处理过程中,要注意溶剂选择和操作方法,避免产生其他杂质。
结论通过反应溶剂中的氯化剂和还原剂,可制备得到高纯度的CuCl。
这种方法简单、可控性强,适用于实验室和工业生产。
在具体操作过程中,需要注意实验条件的调整和操作规范,以获得满足需要的CuCl产物。
制备CuCl的方法还有其他选择,例如溶剂热法、固体反应法等。
在实际应用中,根据需要的纯度、颗粒大小和产量等,可以选择不同的方法。
氯化铜二水合物

氯化铜二水合物
氯化铜二水合物是一种常见的化学物质,其化学式为CuCl2·2H2O。
它是一种淡绿色的晶体,可以溶于水和乙醇,而不溶于醚。
氯化铜二水合物在化学实验和工业生产中都有广泛的应用。
它可以作为催化剂、防腐剂、杀菌剂等,也可以用于制备其他铜化合物。
在制备氯化铜二水合物时,可以通过将铜粉或铜箔置于盛有氢氯酸和过氧化氢(或过氧化铵)的溶液中,反应得到氯化铜二水合物。
这个反应过程中,过氧化氢(或过氧化铵)起到氧化铜的作用,使铜离子进一步被氯离子取代,形成氯化铜二水合物。
氯化铜二水合物在实验室中有着广泛的应用。
因为它具有良好的溶解度和化学稳定性,所以经常用于化学分析和制备其他铜化合物。
例如,它可以用于制备氢氧化铜、氧化铜等。
此外,氯化铜二水合物还可以用作电镀铜的原料,制备电子元件和电路板等。
氯化铜二水合物在工业生产中也有着广泛的应用。
它可以作为催化剂,用于制备有机化合物和聚合物等。
例如,它可以用于制备聚氯乙烯、聚丙烯等塑料。
此外,氯化铜二水合物还可以用作防腐剂和杀菌剂,防止木材、纸张等材料的腐烂和变质。
需要注意的是,氯化铜二水合物在使用时需要注意安全。
它具有一定的腐蚀性和毒性,接触或吸入过量可能会对人体造成危害。
因此,
在使用时需要佩戴防护手套、口罩等防护用品,并注意储存和处理时的安全操作。
氯化铜二水合物是一种常见的化学物质,在化学实验和工业生产中都有着广泛的应用。
它的制备方法简单,但在使用时需要注意安全。
一种电子级二水合氯化铜的制备方法[发明专利]
![一种电子级二水合氯化铜的制备方法[发明专利]](https://img.taocdn.com/s3/m/62cec601856a561253d36fd4.png)
专利名称:一种电子级二水合氯化铜的制备方法专利类型:发明专利
发明人:朱军强,王惠倩,刘秋奇,徐文彬,陈龙,玉增蒙申请号:CN202011592875.7
申请日:20201229
公开号:CN112607762A
公开日:
20210406
专利内容由知识产权出版社提供
摘要:本发明涉及氯化铜制备的技术领域,更具体地说,它涉及一种电子级二水合氯化铜的制备方法,其技术方案要点是,包括以下步骤:铜盐溶解于第一盐酸溶液中,获得铜盐溶液;所述铜盐溶液经两次固液分离,获得过滤液,所述两次固液分离不分先后顺序,包括粘附分离和共沉淀分离,所述粘附分离为加入废PCB板粉末并持续搅拌后固液分离,所述共沉淀分离为加入氯化锡化合物并持续搅拌后固液分离;向所述过滤液加入第二盐酸调节pH后,蒸发浓缩至过饱和溶液,加入氯化铜晶种,冷却结晶,离心分离获得电子级二水合氯化铜产品。
本发明的制备工艺操作简单,成本低,且环境污染小,适用于产业化。
申请人:东江环保股份有限公司
地址:518057 广东省深圳市南山区高新区北区朗山路9号东江环保大楼1楼、3楼、8楼北面、9-12楼
国籍:CN
代理机构:中国商标专利事务所有限公司
代理人:宋义兴
更多信息请下载全文后查看。
化学试剂 二水合氯化铜(氯化铜)-编制说明

化学试剂二水合氯化铜(氯化铜)编制说明及有关附件西陇科学股份有限公司化学试剂二水合氯化铜(氯化铜)编制说明一工作简况1、标准制定背景化学试剂二水合氯化铜是一种常见的无机铜盐,主要用作化学反应如烃的卤化、有机物的氧化等的催化剂。
食品工业用作食品添加剂。
印染工业用作媒染剂、染料着色剂、木材防腐剂。
水处理中作为净水消毒剂。
石油工业用作脱臭、脱硫和纯化剂。
农药工业用作杀虫剂。
印刷线路板(PCB)行业中,是一种适合精细线路制作、多层板内层制作的蚀刻液,具有侧蚀小、蚀率易控制和易再生等特点。
另外,还用于玻璃、陶瓷、颜料、氧化剂的制造和金属提炼等。
也可作为分析试剂。
具有十分广阔的应用前景,原来标准控制项目已经不能满足市场和对外贸易需求。
因此,极有必要重新修订原有标准,以适应市场及国际贸易增长对产品质量的需求,提高我国在对外国际贸易中的竞争力及话语权。
2、任务来源根据国家标准委《关于下达第四批推荐性国家标准计划的通知》(国标委发函「2018」83号)文件的精神,由西陇科学股份有限公司、北京化学试剂研究所有限责任公司共同承担GB/T15901-1995《化学试剂二水合氯化铜(氯化铜)》的标准修订任务,计划号:20184504-T-606,完成时间:2020年。
3、主要工作过程承担任务后公司成立了由质量管理部、技术研发部联合组成的标准起草小组,制定工作计划,工作步骤及工作进度。
然后对原标准进行了调研分析,包括各主要生产厂家的生产工艺、近三年的产量,产品用途等(见表1调研情况),再查阅国内外相关标准及技术资料,编制了化学试剂二水合氯化铜(氯化铜)国内外标准指标准对比表(见表2)、化学试剂二水合氯化铜(氯化铜)国内外标准方法对比表(见表3)、各生产厂家化学试剂二水合氯化铜(氯化铜)产品实测数据(见表4)。
2019年7月发函给各专家委员及有关生产单位、经销单位,征求各单位对原标准这些年来执行情况的意见,根据意见汇总情况(见表5)进行综合分析研究,2019年 11月完成了标准征求意见稿。
研究式实验-二水合氯化铜的制备(硝酸盐酸法)
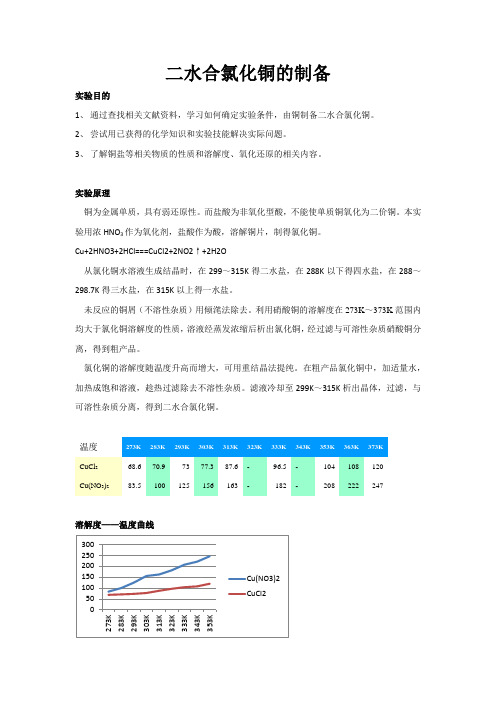
二水合氯化铜的制备实验目的1、 通过查找相关文献资料,学习如何确定实验条件,由铜制备二水合氯化铜。
2、 尝试用已获得的化学知识和实验技能解决实际问题。
3、 了解铜盐等相关物质的性质和溶解度、氧化还原的相关内容。
实验原理铜为金属单质,具有弱还原性。
而盐酸为非氧化型酸,不能使单质铜氧化为二价铜。
本实验用浓HNO 3作为氧化剂,盐酸作为酸,溶解铜片,制得氯化铜。
Cu+2HNO3+2HCl===CuCl2+2NO2↑+2H2O从氯化铜水溶液生成结晶时,在299~315K 得二水盐,在288K 以下得四水盐,在288~298.7K 得三水盐,在315K 以上得一水盐。
未反应的铜屑(不溶性杂质)用倾滗法除去。
利用硝酸铜的溶解度在273K ~373K 范围内均大于氯化铜溶解度的性质,溶液经蒸发浓缩后析出氯化铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。
氯化铜的溶解度随温度升高而增大,可用重结晶法提纯。
在粗产品氯化铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。
滤液冷却至299K ~315K 析出晶体,过滤,与可溶性杂质分离,得到二水合氯化铜。
温度CuCl 268.6 70.9 73 77.3 87.6 -96.5 - 104 108 120 Cu(NO 3)2 83.5 100 125 156 163 - 182 - 208 222 247溶解度——温度曲线实验试剂浓硝酸(14.5mol/L,65%)、盐酸(1:1,6mol/L)、纯水实验仪器表面皿、烧杯(50ml、100ml、250ml)、蒸发皿、玻璃棒、布式漏斗、胶头滴管、三脚架、石棉网、煤气灯实验步骤1、灼烧称取5g铜片,放入小烧杯中,灼烧至表面呈黑色(除去表面附着的油污),自然冷却。
2、制备在通风橱内,向其中加入50ml,6mol/L的HCl,然后缓慢、分批地加入10ml 浓HNO3。
待反应缓和后盖上表面皿,水浴加热。
在反应过程中,需补加5ml 浓HNO3(视反应情况而定,确保反应持续进行,尽量少加)。
二水合氯化铜

英文名Copper(II)Chloride Dihydrate别名氯化铜(II)二水合物氯化铜二水合物氯化铜(二水)氯化铜,二水英文别名Copper Chloride DihydrateCupric chloride dihydrateCupric ChlorideCopper(ii) chloride dihydratecopper(2+) dichloridecopper(2+) chloride hydrate (1:2:2)dichlorocopper dihydratedichlorocopper hydrateCupric(Ⅱ)chloride dihydrateCAS 10125-13-013933-17-0EINECS 215-704-5化学式H2Cl2CuO分子量152.467inchiInChI=1/2ClH.Cu.H2O/h2*1H;;1H2/q;;+2;/p-2/rCl2Cu.H2O/c1-3-2;/h;1H2熔点100℃水溶性1150 g/L物化性质性状蓝绿色斜方晶系结晶。
相对密度2.54溶解性易溶于水,溶于醇和氨水、丙酮。
产品用途用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂危险品标志Xn - 有害物品风险术语R22 - 吞食有害。
R36/37/38 - 刺激眼睛、呼吸系统和皮肤。
R50/53 - 对水生生物有极高毒性,可能对水体环境产生长期不良影响。
安全术语S26 - 不慎与眼睛接触后,请立即用大量清水冲洗并征求医生意见。
S36 - 穿戴适当的防护服。
S60 - 该物质及其容器须作为危险性废料处置。
S61 - 避免释放至环境中。
参考特别说明/安全数据说明书。
危险品运输编号UN 2802上游原料盐酸氧化铜下游产品酞菁蓝酞菁绿G 氯化铜铜铋催化剂N,N-二丁基二硫代氨基甲酸铜二水合氯化铜- 性质绿色至蓝色粉末或正交双锥体结晶。
熔点约100℃I d 2. 51。
易潮解。
过氧化氢法由铜制备二水和氯化铜论文

足够大的温差才能得到足够多 的晶体,但温度过 高会使结晶水失去产生黄褐色 的晶体,所以当晶膜产生时,需 要停止加热, 实验中由于停止加 热过早使晶体析出量过少, 因此 后来需要将滤液再结晶, 因此时 间上显得缓慢一些。 这里也涉及 到了一个提高产率的方法, 不断 结晶滤液, 可以得到足够多的产 物,使成本降低。 5.1.3 产物含量测定高于 100%: 由于反应物本身纯度足够, 因此产物本身的 纯度能达到 99%—100%, 但实验 中的测定结果平均值却为 100.08%,略高于 100%,原因可 能如下: 1. 氯化铜在 26℃到 42℃范围 内生成二水盐,而实际上结 晶过程中初始温度远大于这 个范围,因此产物中可能存 在一水盐,这样的话,含量 就会偏高; 2. 滴定终点为刚好变色,而实 际过程终点颜色过深,则滴 定稍过量,使得含量也略微 偏高; 鉴于同组同学的实验结果以及 实验中可知结晶时烧杯中水的 含量极高且测定结果只是略为 7. 参考文献
制备二水合氯化铜

CuCl2.2H2O制备及其组成、杂质含量的测定刘相李111130074 化学化工学院一、实验目的:(1)查阅资料,了解制备铜的众多方法,学习自我设计实验方案;(2)学习铜,铜的可溶性盐,难溶性盐的性质,通过比较性质之间的差别,选择规避杂质产生的最好方法;(3)根据二水合氯化铜的性质,确定实验操作,实验仪器,实验所需药物,和实验操作条。
,(4)学习归纳、对比、判断、综合考虑问题、书面表达(5)体验独立查阅资料——设计实验——独立进行实验制备——成分、杂质检测——实验总结——形成小论文,这一研究过程。
二、实验原理:1、Cu的金属性比较弱,盐酸是非氧化性酸,Cu与盐酸不能直接反应,所以要引入氧化剂,常用的氧化剂有过氧化物,硝酸,次氯酸盐,氯酸盐,高锰酸钾,二氧化锰等。
为提高二水合氯化铜的纯度,制备过程中应尽可能避免引入杂质,或引入杂质应容易去除。
因此选择的氧化剂可以是过氧化氢(绿色氧化剂,无杂质),硝酸[1](和铜反应生成硝酸铜,加热分解变为氧化铜,再加入盐酸,但反应产生氮的氧化物,有毒,污染空气),次氯酸和盐酸(混酸)(和铜反应产氯化铜Cu+HClO+HCl=CuCl2+H2O)2、带两个结晶水的生成,由氯化铜水溶液生成结晶时,关键在于水溶液的温度的控制,因为由查资料知:氯化铜水溶液生成结晶,在299~315K(26-42o C)得二水盐,在288K(15 o C)以下得四水盐,在288~298.7K(15-25.7 o C)得三水盐,在315K(42 o C以上)以上得一水盐。
因此为得到二水盐,要使用温度计控制结晶温度在26-42 o C之间,由于温度较低,水分蒸发慢,结晶可能会花大量时间,而且由于加热时容器受热不均,靠近容器底部和容器上部液体温度不一样,使用温度计时要将温度计靠近底部,保证底部温度不能超过42 o C[2]。
2、二水合氯化铜的性质:绿色菱形结晶,单斜晶系。
在潮湿空气中易潮解,在干燥空气中也易风化。
氯化铜生产工艺

氯化铜生产工艺
氯化铜生产工艺是将铜精矿经过粉碎、浸出、沉淀等步骤制得氯化铜的过程。
下面将详细介绍氯化铜生产工艺的主要步骤。
首先是铜矿石的粉碎和浸出。
首先将铜矿石经过粉碎设备进行粗细研磨,使其达到所需粒度。
然后使用溶浸槽将研磨后的矿石与稀盐酸溶液进行浸出反应,使其中的铜溶解为铜离子,并与盐酸反应生成氯化铜。
接下来是氯化铜沉淀和过滤。
将浸出溶液从溶浸槽输送到沉淀槽中,通过控制温度、PH值、搅拌等条件促使氯化铜溶液中的铜离子与氢氧化铜反应生成氯化铜沉淀。
经过一定时间的沉淀,将溶液中的浸铜砷、砷酸铜等杂质和部分铜离子与沉淀物一同沉淀下来。
然后使用过滤设备将沉淀物和液体分离,得到氯化铜沉淀。
然后是氯化铜沉淀物的洗涤和烘干。
将得到的氯化铜沉淀物送入洗涤槽中,使用水洗涤沉淀物,去除其中的溶解盐和其他杂质。
然后,将洗净的氯化铜沉淀物送入烘干机中进行烘干,使其含水量降低到一定标准。
最后是氯化铜的精制和包装。
将烘干后的氯化铜沉淀物使用反应釜进行精制处理,去除其中的杂质,提高其纯度。
经过精制后的氯化铜通过输送带送入包装机器进行包装,制成不同规格和包装形式的氯化铜产品。
总体来说,氯化铜的生产工艺主要包括原料准备、粉碎浸出、
沉淀过滤、洗涤烘干、精制和包装等步骤。
通过控制不同的条件和参数,可以实现氯化铜的高效生产和优质产品的制备。
同时,该工艺还能够循环利用原料中的铜,并有效去除其中的杂质,达到资源的最佳利用效果。
二水合氯化铜的制备

二水合氯化铜的制备一、前言本实验是以铜为基本原料来制备二水合氯化铜。
为自主探究式实验。
CuCl2·2H2O绿色菱形结晶,单斜晶系。
在潮湿空气中易潮解,在干燥空气中也易风化。
易溶于水、氯化铵、丙酮、醇及醚中。
从氯化铜水溶液生成结晶时,在299~315K 得二水盐,在288K以下得四水盐,在288~298.7K得三水盐,在315K以上得一水盐。
有毒,应密闭贮存。
CuCl2·2H2O的用途广泛,可以用于制玻璃、陶瓷、颜料、消毒剂、媒染剂、食品添加剂、催化剂(如烃的卤化以及许多有机氧化反应)。
用于金属提炼、木材防腐、照相、氧化剂、净水等二、实验与结果1、实验原理:铜为金属单质,具有弱还原性。
而盐酸为非氧化型酸,不能使单质铜氧化为二价铜。
本实验采用的氧化剂为过氧化氢(H202),以盐酸为酸性介质,直接氧化铜单质为 CuCl2。
然后通过蒸发CuCl2的溶液得到CuCl2·2H2O。
反应方程式为Cu+ H202+2H+=Cu2++2 H202、实验步骤:3、实验说明:Cu的摩尔质量为63.55,质量为5g的铜大约为0.08mol,需要HCl 0.16mol, H202 0.08mol,因此需要3mol/L 的H202 30ml,6mol/L的HCl 30ml。
由于要溶液保持酸性,因此加入6mol/L的HCl 50ml。
反应之后溶液中剩余CuCl2,水浴加热蒸发溶剂,由于这是溶剂量较多,因此保持较高的水温。
当溶液体积较少时,转移至蒸发皿中,保持303K至313K 水温继续蒸发溶剂,使溶液结晶析出CuCl2·2H2O,冷却得到晶体。
CuCl2的溶解度293K 73g/100g ,303K 77.3g/100g, 313K 87.6g/100g, 353K 104g/100g, 363K 108g/100g.4、数据整理:三、讨论四、参考文献。
一种利用含铜污泥制备高纯水合氯化铜的方法[发明专利]
![一种利用含铜污泥制备高纯水合氯化铜的方法[发明专利]](https://img.taocdn.com/s3/m/08adacd531126edb6e1a1089.png)
专利内容由知识产权出版社提供
专利名称:一种利用含铜污泥制备高纯水合氯化铜的方法 专利类型:发1189163.8 申请日:20191128 公开号:CN110817928A 公开日:20200221
摘要:本发明属于含铜污泥处理技术领域,公开了一种利用含铜污泥制备高纯水合氯化铜的方 法,将含铜污泥干燥研磨过筛后加入调控剂及盐酸溶液,在一定空气流速下进行高温焙烧,制得高纯 产物CuCl·2HO,利用本方法可回收含铜污泥中95~97%的铜,所制备的产物纯度大于95%,本发明 方法流程简单、成本低廉,“短程‑高效”制得高附加值产品,是危废资源化技术领域的一大突破,弥 补了传统的含铜污泥提铜技术的流程复杂、成本高、二次污染及回收产物价值偏低等缺陷,为高纯水 合氯化铜的制备和其他重金属废渣的重金属回收提供了新思路,其社会和经济效益十分显著。
生成氯化铜的化学方程

生成氯化铜的化学方程
Cu + 2HCl → CuCl2 + H2。
在这个方程式中,铜(Cu)与盐酸(HCl)反应生成氯化铜(CuCl2)和氢气(H2)。
这是一种典型的单质与化合物反应的化学方程式。
在这个反应中,铜原子失去了电子,氯离子接受了电子,形成了氯化铜。
这个方程式描述了化学反应的原子层面的变化,展示了反应前后原子的组合和重新排列。
化学方程式是描述化学反应的重要工具,能够清晰地显示出反应物和生成物之间的关系。
这个方程式也符合化学守恒定律,即质量守恒和电荷守恒。
希望这个回答能够满足你的要求。
一种电子级高纯二水氯化铜的制备方法[发明专利]
![一种电子级高纯二水氯化铜的制备方法[发明专利]](https://img.taocdn.com/s3/m/8cb1226aa0116c175e0e4857.png)
专利名称:一种电子级高纯二水氯化铜的制备方法专利类型:发明专利
发明人:谭泽,黄司平,张志斌,李春花
申请号:CN200910193399.9
申请日:20091028
公开号:CN101691240A
公开日:
20100407
专利内容由知识产权出版社提供
摘要:本发明公开了一种电子级高纯二水氯化铜的制备方法。
该方法包括步骤:将氯化铜用高纯盐酸溶解,至氯化铜溶解完全为止,调节pH值至4~6;加入质量体积比浓度为80g/L的硫化钡溶液,搅拌,得到硫化铜沉淀;用高纯水将硫化铜沉淀洗涤后,用10wt%盐酸溶液溶解,至硫化铜溶解完全为止,将所得溶液浓缩,在26~42℃条件下冷却结晶,离心,得到电子级高纯二水氯化铜。
本发明生产工艺简单、成本低、生产时间短、收率高和纯度好等优点,并能有效控制有毒有害物质的含量,减少对环境的污染,且反应条件温和,使用的试剂廉价易得。
申请人:广东光华化学厂有限公司,广州市金华大化学试剂有限公司
地址:515021 广东省汕头市大学路295号
国籍:CN
代理机构:广州市华学知识产权代理有限公司
更多信息请下载全文后查看。
二水合氯化铜分子量

二水合氯化铜分子量
二水合氯化铜是一种无机化合物,化学式为CuCl2·2H2O,其分子量为170.48 g/mol。
本文将对二水合氯化铜的性质、制备方法和应用进行详细介绍。
我们来了解一下二水合氯化铜的性质。
二水合氯化铜是一种淡绿色晶体,可溶于水和醇,微溶于醚。
它的水溶液呈酸性,可以与氨反应生成[Cu(NH3)4(H2O)2]2+离子。
在空气中,二水合氯化铜会逐渐失去结晶水,变成无水氯化铜。
此外,二水合氯化铜还具有较强的氧化性和腐蚀性。
接下来,我们将介绍二水合氯化铜的制备方法。
一种常用的制备方法是将氯化铜与水反应得到二水合氯化铜。
首先,将氯化铜溶解在适量的水中,搅拌均匀,得到含有氯化铜的水溶液。
然后,将水溶液慢慢蒸发,待溶液中的溶质浓度达到饱和时,冷却结晶,即可得到二水合氯化铜晶体。
另外,二水合氯化铜还可通过将无水氯化铜与水反应得到。
二水合氯化铜在很多领域都有广泛的应用。
首先,它在化学实验中常被用作氯离子的来源。
其次,二水合氯化铜还可用于制备其他铜化合物,如氯化亚铜、氯铜酸等。
此外,它还可以作为一种催化剂应用于有机合成反应中,如氯代烃的生成反应。
另外,二水合氯化铜还可用作木材防腐剂,能够有效地防止木材腐朽、发霉。
总的来说,二水合氯化铜是一种重要的无机化合物,具有较强的氧化性和腐蚀性。
它的制备方法简单,应用广泛。
在化学实验、有机合成、木材防腐等领域都有重要的应用价值。
通过对二水合氯化铜的研究,有助于深入了解其性质和应用,推动相关领域的发展和进步。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
从铜制备二水合氯化铜
鞠鹏程化院 1
摘要:通过以铜为原料,制备碱式碳酸铜为中间产物的方式,制备二水合氯化铜。
文章通过讨论分析该实验过程中的现象,提出了部分改进措施。
并通过与工业制法比较,分析了两者的优缺点。
关键词:CuCl2•H2O Cu 碱式碳酸铜制备
引言:CuCl2·2H2O 摩尔质量,为淡蓝色结晶,单斜晶系。
在潮湿空气中易潮解,在干燥空气中也易风化。
易溶于水、氯化铵、丙酮、醇及醚中。
从氯化铜水溶液生成结晶时,在299~315K得二水盐,在288K以下得四水盐,在288~得三水盐,在315K以上得一水盐。
有毒,应密闭贮存。
该物质可用于制玻璃、陶瓷、颜料、消毒剂、媒染剂、食品添加剂、催化剂(如烃的卤化以及许多有机氧化反应)。
用于金属提炼、木材防腐、照相、氧化剂、净水等。
一般工业生产方法:
1.盐酸法用盐酸溶解氧化铜或碳酸铜,再经浓缩、结晶而得。
2.合成法将氧气在填料塔中与铜粒反应,经冷却结晶而得。
将一定量的氧化铜逐渐加入盐酸中,边加边搅拌,发生下列反应:CuO + 2HCl → CuCl2 + H2O当溶液pH为2,浓度35~37°Be′时,反应完毕,静置澄清,清液中加入次氯酸钠,使二价铁氧化成三价铁,水解过滤除去。
母液浓缩至出现晶析为止,再经冷却结晶、离心分离,并于333~343K下干燥16小时左右,即得成品。
1.实验部分
主要试剂及仪器
试剂:6mol/L盐酸20ml,6mol/L HNO330ml,蒸馏水,5gCu片,100ml饱和Na2CO3溶液。
仪器:250ml、100ml烧杯,干燥箱,加热装置,蒸发皿,表面皿。
实验方法
1.2.1硝酸铜的制备
将在通风橱中,将5g铜片加入到250ml烧杯中,再向烧杯中加入30ml 6mol/LHNO3,待反应缓和后盖上表面皿,水浴加热,若反应20分钟后烧杯中仍有铜片剩余,可补加少量6mol/LHNO3硝酸,直至铜片完全溶解。
3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O
1.2.2碱式碳酸铜的制备
待溶液冷却,逐渐加入饱和Na2CO3溶液(10g/100ml)。
至沉淀完全,将所得沉淀抽滤得到浅蓝色碱式碳酸铜固体,并用蒸馏水洗涤6-7次。
Cu(NO3)2+Na2CO3+ H2O→xCuCO3·yCu(OH)2+NaNO3
1.2.3氯化铜晶体的制备
将得到的沉淀放入100ml烧杯中,加入20ml6mol/LHCl,溶解沉淀,水浴蒸发结晶。
当有晶膜出现时,停止加热,冷却结晶,将晶体抽滤,微热干燥至浅蓝色。
称重,将晶体保存在广口瓶中,贴标签。
xCuCO3·yCu(OH)2+HCl→CuCl2+CO2+H2O
1.2.4产物分析
称取0.1000g样品,溶于水,加15mlNH3-NH4Cl缓冲溶液(PH10)及0.2g红紫酸铵混合指示剂,用L EDTA标准溶液滴定至溶液呈紫蓝色。
实验结果
1.3.1制备结果
(表1 实验产物统计表)
产率较为理想。
1.3.2分析结果
(表2 产物纯度分析表)
纯度有待提高。
2.结果讨论
铜与硝酸的反应过程中,反应液为褐色
原因可能是溶液中氧化剂少了。
反应过程中,由于还有未反应的铜存在,发生了下列反
应:
Cu + Cu2+→ 2Cu+
在Cu2+和Cu+的混合液中,形成了Cu(Ⅰ)和Cu(Ⅱ)混合价态的二聚或多聚配离子,如Cl-Cu-Cl-CuCl2(H2O), 一般具有混合价态的物质的颜色比单一氧化态的物质的颜色深而重,因此溶液呈褐色。
此时加适量氧化剂后溶液变为绿色。
成本估算
(表3 实验药品用量及价格统计表)
成本耗费:+++=元
产品价格:元
利润:元
由于操作的一些问题以及用量的浪费,造成不能盈利。
关于碱式碳酸铜的制备
本实验的第二步,制备碱式碳酸铜是确保保留大量铜元素的关键步骤。
若在此步骤中残留大量铜离子在溶液中,则势必造成最终产物CuCl2·2H2O的损失。
在形成碱式碳酸铜沉淀时可通过多次分离沉淀加入饱和碳酸钠,促进Cu2+的沉淀
(表4 PH值与液体中Cu2+浓度的关系 g/L)
表4数据表明,pH值对液体中Cu2+离子浓度有重要影响,pH值过小,残余的Cu2+多,沉淀不完全,铜的回收率低;pH值过大,生成的沉淀部分溶解,铜的回收率也低。
pH值应控制在范围内最适宜。
但在具体操作时,由于加入饱和碳酸钠,无法达到该范围,因此可以在产生大量沉淀后先过滤,洗沉淀,再微微蒸发滤液,在滤液中再加饱和碳酸钠溶液,使Cu2+充分沉淀。
蒸发干燥时生成无水CuCl
2
在最后的干燥步骤中,由于部分溶液受热不均匀,结晶后易失水生成红褐色的无水CuCl2-晶体,附着在蒸发皿的边缘,可在未结晶之前,用玻棒将无水CuCl2拨进溶液中,稍微搅拌,使其溶解否则会造成最终产量的损失。
如最终产物干燥后,失水过多,也可补加少量水,重新干燥。
与工业制法的比较
工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制CuO粉(含有杂质FeO)用浓盐酸溶解,得到的氯化铜溶液中含有一定量的Fe2+。
盐酸法生产流程如图1所示。
2.5.1在工业生产中,CuO较碱式碳酸铜易制的,可直接利用空气做为氧化剂,而不需像本实验用较贵的硝酸作为氧化剂。
由于,本实验中,所用的样品较为理想,相较而言,工业制法较为成熟,成本也更加低廉。
2.5.2本实验方案生成的中间产物为较纯的碱式碳酸铜,有较高的经济价值,可用于制油漆颜料、烟火、杀虫剂、其他铜盐和固体荧光粉激活剂等,也用于种子处理及作杀菌剂等,也用作颜料。
因此改中间产物可直接作为企业产品。
当产品销售市场出现波动时,可以调节碱式碳酸铜和二水合氯化铜的生产分配,来应对市场的供需改变。
2.5.3本实验由于使用硝酸作为氧化剂,因此会产生污染物氮氧化物。
相较而言,工业制法污染较轻。
但是如果采取适当措施,也可避免污染产生,由于产生的氮氧化物易溶于水,可回收废气,用氧气氧化,重新生成硝酸,如此便可重复利用。
也有效解决了污染问题。
关于产品纯度
分析结果显示,产品纯度不到98%,为达到AP。
分析其原因,有如下几点:
2.6.1由于碳酸钠溶液饱和且过量,碱式碳酸铜表面附着大量的碳酸钠晶体,由于碱式碳酸铜固体粘稠,较难洗涤,虽经水洗多次,亦难洗净表面的碳酸钠。
因而在最终的产物中可能混有部分的氯化钠晶体。
2.6.2由于CuCl2·2H2O在潮湿空气中易潮解,在干燥空气中也易风化。
而从氯化铜水溶液生成结晶时,在299~315K得二水盐,在288K以下得四水盐,在288~得三水盐,在
315K以上得一水盐。
因为,实验条件限制,干燥时无法完全准确控制干燥温度,所以在二水合盐中,也肯定混有多水合盐或无水盐。
3.结论
经本次实验,可初步认为,将铜单质氧化制备碱式碳酸铜,再用来制备二水合氯化铜的方案基本可行。
参考文献:
【1】杭州大学化学系等合编. 分析化学手册. 第二分册,化学工业出版社,1979。
【2】 Lange's Handbook of chemistry, McGraw-Hill Book Company出版, 1999。
【3】顾庆超等编. 新编化学用表. 江苏科技出版社,1998。
【4】中国工业出版社组织编写. 中国化工产品大全. 上卷,化学工业出版社,1994。
【5】傅献彩主编. 大学化学. 下册,高等教育出版社,1999。
【6】武汉大学,吉林大学等编. 无机化学. 第3版.下册,高等教育出版社,1994。
