生理学实验:家兔呼吸运动的调节
生理学高分实验报告家兔呼吸运动的调节

肺牵张感受器位于肺泡壁和支气管 平滑肌中,可感受肺部的扩张和缩 小。
呼吸肌感受器位于呼吸肌中,可感 受呼吸肌的收缩和舒张。
中枢和外周感受器的相互作用
中枢和外周感受器之间存在复杂的相 互作用,共同维持呼吸运动的稳定性 和适应性。
02
给实验组家兔分别注射不同浓度的呼吸兴奋剂和呼 吸抑制剂。
03
观察并记录注射药物后家兔呼吸运动的变化情况, 包括呼吸频率、呼吸深度的改变。
实验步骤与操作
• 在药物作用高峰期,再次测定家兔的血气指标,以评估药物对呼吸功能的影响。
实验步骤与操作
4. 数据分析与统计
对实验数据进行整理和分析,比较对照组和实验组家兔在呼吸运动参数和 血气指标上的差异。
体液调节与神经调节的相互作用
协同作用
在某些情况下,体液调节和神经调节可协同作用,共同调节呼吸运动。例如,当机体处 于缺氧状态时,外周化学感受器和中枢化学感受器同时受到刺激,引起呼吸加深加快。
拮抗作用
在某些情况下,体液调节和神经调节可相互拮抗,共同维持呼吸运动的平衡。例如,当 机体处于过度通气状态时,动脉血氧分压升高可抑制外周化学感受器的活动,而中枢化 学感受器则继续受到刺激,引起呼吸减慢变浅。这种拮抗作用有助于防止过度通气对机
证了呼吸运动的调节机制。
04
本实验为深入研究呼吸运动的调节机制提供了有价 值的参考数据,有助于进一步揭示呼吸生理学的奥
秘。
对未来研究的展望和建议
0标1题
进••一文文步研字字究内内不容容同物种 之•间文呼吸字运内动容调节机 制•的文异同字,内以容更全面
地了解呼吸生理学的 普遍规律。
生理科学实验设计家兔呼吸运动调节

生理科学实验设计——家兔呼吸运动的调节09级31班第四小组麦华浩莫世杰刘文荣罗国华王辉赵宏伟一:实验目的:(1)熟悉家兔耳缘静脉注射法、家兔颈部手术操作、神经血管分离、气管插管技术。
(2)记录家兔呼吸曲线观察一氧化碳(CO)、纯氧,走神经对呼吸运动的调节及了解其机理。
(3)熟悉Medlab生物信号处理系统、保护电极、氧气瓶,张力换能器在实验中的作用及使用注意事项。
二:立题依据:一氧化碳中毒机理是一氧化碳与血红蛋白的亲合力比氧与血红蛋白的亲合力高200~300倍,它进入人体后会和血液中的血红蛋白结合,使血红蛋白不能与氧气结合,从而造成人体组织缺氧。
急性中毒时,轻者会出现头痛、头晕、耳鸣、心悸、恶心、呕吐、无力,重者会出现心肌损害、脑椎体系损害、昏迷、休克甚至死亡。
及时强制吸氧,置换一氧化碳,能避免死亡。
临床表现主要为缺氧,其严重程度与HbCO的饱和度呈比例关系。
轻者有头痛、无力、眩晕、劳动时呼吸困难,HbCO饱和度达10%—20%。
症状加重,患者口唇呈樱桃红色,可有恶心、呕吐、意识模糊、虚脱或昏迷,HbCO饱和度达30%—40%。
重者呈深度昏迷,伴有高热、四肢肌张力增强和阵发性或强直性痉挛,HbCO饱和度>50%。
患者多有脑水肿、肺水肿、心肌损害、心律失常和呼吸抑制,可造成死亡。
二氧化碳(CO2)是调节呼吸运动最重要的生理性化学因素。
很早就知道,在麻痹的动物或人,当动物血液Pco2降到很低水平时,可出现呼吸暂停。
因此,一定水平的Pco2对维持呼吸中枢的基本活动是必需的。
CO2刺激呼吸运动是用过两条途径实现的:一是通过刺激中枢化学感受器再兴奋呼吸中枢;二是刺激外周化学感受器,冲动经窦神经和迷走神经传入延髓,反射性地使呼吸加深﹑加快,肺通气量增加。
CO2在呼吸调节中经常起作用,动脉血Pco2在一定范围内升高,可加强对呼吸的刺激作用氧中毒机理当吸入性PO2过高时,活性氧产生增加,反可引起组织,细胞损伤,称为氧中毒。
家兔呼吸运动的调节实验报告

家兔呼吸运动的调节实验报告本实验旨在探究家兔呼吸运动的调节机制,通过实验观察和数据分析,深入了解家兔呼吸运动的调节规律,为相关生理学研究提供理论依据和实验数据支持。
实验材料与方法。
1. 实验材料,健康的家兔若干只,呼吸频率计、呼吸深度计、心率监测仪等实验设备。
2. 实验方法,将家兔置于实验箱内,记录其正常呼吸状态下的呼吸频率和呼吸深度,并监测其心率。
接着通过不同方式的刺激(如运动、音响刺激等)观察家兔呼吸频率、呼吸深度和心率的变化情况。
实验结果。
1. 正常状态下,家兔的呼吸频率约为每分钟40-60次,呼吸深度约为每次10-15毫升,心率约为每分钟120-150次。
2. 运动刺激后,家兔的呼吸频率明显增加,呼吸深度也有所增加,心率也随之加快。
3. 音响刺激后,家兔的呼吸频率和呼吸深度均有所增加,但心率的变化不明显。
实验分析。
1. 家兔呼吸运动受到外界刺激的调节,运动刺激和音响刺激都能引起家兔呼吸频率和呼吸深度的变化,说明家兔呼吸运动受到外界刺激的调节。
2. 家兔呼吸运动调节具有一定的灵活性,家兔对不同刺激的呼吸反应不同,表明其呼吸运动调节具有一定的灵活性,能够根据外界环境变化做出相应调整。
实验结论。
家兔呼吸运动的调节受到外界刺激的影响,具有一定的灵活性,这为家兔在不同环境下适应生存提供了生理基础。
同时,本实验结果也为相关呼吸生理学研究提供了重要的实验数据支持。
结语。
通过本次实验,我们对家兔呼吸运动的调节机制有了更深入的了解,同时也为今后的相关研究提供了重要的实验基础。
希望本实验结果能够为相关领域的科研工作者提供参考,推动相关领域的研究进展。
家兔呼吸运动的调节

家兔呼吸运动的调节摘要:目的观察血液中Pco2,Po2和[H+]改变对家兔呼吸运动(呼吸频率、节律、幅度)的影响,观察迷走神经在家兔呼吸运动调节中的作用,方法通过增大无效腔,增大CO2分压,快速注射2%乳酸,先后切断迷走神经以及电刺激迷走神经近心端和中枢端,观察呼吸运动的改变情况。
结果增大无效腔,增加CO2分压,快速注射乳酸后,可使家兔通气量、呼吸频率及平均呼吸深度明显增加;剪断一侧迷走神经对呼吸运动影响不大,剪断双侧迷走神经,呼吸变深变慢。
用电刺激迷走神经的中枢端则可以使深慢的呼吸重新变为浅快,并且可以接近正常的呼吸频率和深度。
结论机体通过呼吸调节血液中的O2、CO2、H+水平,动脉血中O2、CO2、H+的变化又通过化学感受器调节呼吸,迷走神经加速吸气向呼气转换,使呼吸频率增加,参与维持机体内环境的相对稳定。
【关键词】:呼吸;调节【实验材料和方法】:1.材料:1、动物:家兔2、器械:动物手术器材(手术刀、手术剪、止血钳、玻璃分针, 丝线,注射器,兔台),气管插管,体重秤,张力换能器,生理信号采集系统,医用橡皮管,纱布,20 ml 注射器,玻璃分针。
3、药品和试剂:20%氨基甲酸乙酯,0.9%生理盐水.2.方法1.麻醉固定:家兔称重后,将氨基甲酸乙酯以5ml/kg 的体重剂量由兔耳缘静脉内缓慢注入,注意观察家兔的反应。
待麻醉后,将家兔仰卧固定于兔手术台上,先后固定四肢及兔头。
2.手术:剪去家兔颈部的被毛,沿颈部正中线作一长6~7cm的切口,用止血钳钝性分离皮下组织,暴露并游离气管,并于气管下穿线备用。
在气管两侧肌肉深面颈动脉鞘内分离迷走神经,并在其下穿线备用。
在甲状软骨下第4~5个气管软骨处作一“⊥”形切口。
将T型气管插管向肺的方向插入气管内,用预留备用线线结扎固定。
手术完毕后用纸巾擦拭手术伤口部位。
3.观察准备:用皮管连接气管插管和呼吸换能器。
打开呼吸换能器,启动计算机RM6240生物信号采集系统,点击“实验”菜单,选择“呼吸运动调节”,双击一通道,调节增益、采样参数,使基线归零,令图形位于屏幕中央,便于观察。
生理学实验:家兔呼吸运动的调节
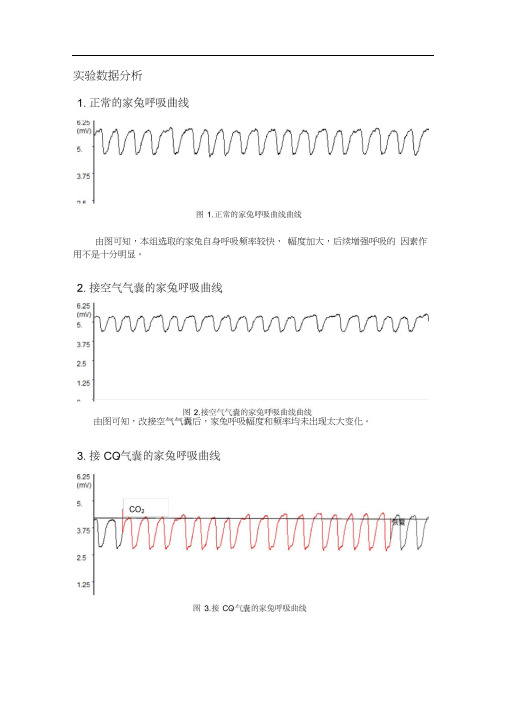
实验数据分析由图可知,本组选取的家兔自身呼吸频率较快,幅度加大,后续增强呼吸的因素作用不是十分明显。
由图可知,改接空气气囊后,家兔呼吸幅度和频率均未出现太大变化。
由图可知,接CO气囊后,家兔呼吸曲线幅度增大,频率加快。
这是因为CO2 是调节呼吸运动最重要的生理性因素,不但对呼吸有很强的刺激作用,而且对维持延髓呼吸中枢正常兴奋活动是必须的。
当呼入气体中CO浓度升高,血液中CO 浓度随之升高,CO透过血脑屏障使脑脊液的CO浓度也升高。
CO与水反应生成HCO,随后水解成HCO-;:和H,由H刺激延髓化学感受器,间接作用于呼吸中枢,通过一系列调控使得呼吸作用加强。
此外,当CO浓度增高时,还刺激主动脉体和颈动脉体的外周化学感受器,反射性地使呼吸加深加快。
时,CO浓度却基本不变(CO T散速度较快)。
随着动脉血中Q浓度下降,通过刺激主动脉体和颈动脉体外周化学感受器延髓的呼吸中枢兴奋,加强,反射性引起呼吸运动增加。
由图可知,增长解剖无效腔后,家兔呼吸幅度略有下降,而呼吸频率则稍稍上升,这是因为实验中通过插管的方式增大无效腔,也就是减小了进入肺泡的潮气量,即每次的有效气体更新变小。
结果促使Q分压下降,CO分压上升,使其反射性的调节使呼吸加深加快。
所以膈肌放电的变化幅度加大,频率有微量增大。
反映到膈肌的收缩曲线,由于收缩频率的增大,为了维持正常的肺部通气量,所以收缩强度减弱。
由图可知,接N2气囊后,家兔呼吸曲线幅度略有增大。
这是因为吸入纯N2 因吸入气体中缺乏O,肺泡气Q浓度下降,导致动脉血中Q浓度下降;而隔肌和肋间外肌活动由图可知,向肺部吹气相当于使肺部发生扩张, 这种扩张刺激了气管平滑肌 的牵张感受器,冲动由迷走神经传入延髓,抑制吸气神经元,切断吸气,引起被 动呼气。
所以如果这次实验注入气体过久,气量过大,可能会使得呼吸停止在呼 气的位置。
实验结果也显示了由于增大肺部的体积引起的膈肌收缩力的减弱和呼 吸频率的减小。
家兔呼吸运动的调节

家兔呼吸运动的调节2012级生物科学班学号:1.实验目的1.1学习家兔呼吸的测定方法1.2 观察并分析肺牵张反射以及影响呼吸运动的各种因素2.实验原理呼吸运动是呼吸肌的舒缩运动,是呼吸肌(胸壁上的肋间肌和隔肌)在神经系统控制下进行的有节律的收缩和舒张造成的。
膈肌的收缩活动受来自中枢的传出神经支配,传出冲动的节律与频率,影响膈肌的收缩节律、频率与强度. 人体及高等动物的呼吸运动所以能持续地节律性地进行,是由于体内调节机制的存在。
体内、外的各种刺激,可以直接作用于中枢或不同的感受器,反射性地影响呼吸运动,以适应机体代谢的需要。
肺牵张反射是保证呼吸运动节律的机制之一。
3.实验动物和器材家兔;兔手术台、手术刀、剪毛剪、手术剪、镊子、眼科剪、金冠剪、玻璃分针、止血钳、棉花、纱布、牙签、棉线、小弯钩、烧杯、污物缸、兔手术台、塑料绳、短橡皮管、长橡皮管(1m)、Y型气管插管、20ml注射器、5ml注射器、1ml注射器、照明灯、保护电极、滑轮、支架、PowerLab生理实验系统、气管插管、张力传感器;麻醉剂(2%戊巴比妥钠2ml/Kg)、生理盐水。
4.实验步骤4.1 家兔麻醉固定:称重,耳缘静脉注射麻醉剂。
待兔被麻醉后,将兔背位固定于手术台上,剪颈部皮毛和胸部剑突位置皮毛。
4.2 气管插管及颈部神经分离手术:钝性分离颈部肌肉等组织,暴露气管,在气管背面穿线,再用手术刀手术剪在气管上方作T形切口;用制作好的棉签将气管中的血块弄出,沿向心方向插好气管插管并用线扎紧,防止松脱;分离双侧迷走神经,分别穿2根线备用。
4.3 突软骨分离手术:切开胸骨下端剑突部位的皮肤约2cm,细心分离剑突软骨周边组织,暴露剑突软骨,剪断骨柄,保留骨柄下方膈肌与剑突相连。
4.4 连接实验装置:连接好PowerLab实验装置,用棉线上的小弯钩勾住剑突软骨中间部位,通过滑轮与张力换能器连接,调节好力度大小,设置调节通道2桥式放大器(5mV,10Hz)和刺激器(300脉冲,1V,1ms,20Hz)。
生理学实验家兔呼吸运动调节

ppt课件
17
•剪断一侧迷走神经:呼吸加
深减慢。迷走神经是肺牵张
反射的传入神经,剪断一侧
迷走神经→上传至延髓呼吸
中枢的信息减少→吸气切断
机制兴奋所需时间延长→吸
气延长,转为呼气的时间推
后→呼吸幅度加深,频率减
慢。
ppt课件
18
•剪断另一侧迷走神经:呼 吸更深更慢。完全阻断了肺 牵张反射的传入通路→吸气 切断机制兴奋所需时间更长 →吸气过程更长→呼吸更深 ,频率更慢。
(最3细条)神经p中pt课迷件走神经最粗;交感神经较细;减压神经9
5、气管插管
于气管中段约3-4气管软骨环间做一倒“T” 字形切口,由切口向心端插入气管插管并 用线结扎固定
ppt课件
10
记录呼吸运动曲线:
• 打开计算机,启动生物信号采集系统,点 击菜单“实验项目”,进入“家兔呼吸运 动调节”实验项目。
6
固定
头及四肢,一定要固定紧。麻药不够或麻 药失效后,兔子会挣扎。
ppt课件
7
颈部手术
1. 剪毛
2. 沿颈中线作纵行切口: 从甲状软骨处向下至靠近胸 骨上缘切开皮肤约5-7cm 3. 分离气管: 用止血钳钝性分离正中部的 肌肉和筋膜,暴露气管;分 离气管和食管,在气管下穿 一丝线备用
ppt课件
ppt课件
4
【实验步骤】
称重
用手抓起脊背近颈部的皮肤,另一只手托住臀部或腹部。
ppt课件
5
麻醉:1%戊巴比妥钠,3ml/kg于耳缘静脉缓 慢注射
麻醉注意事项:
1.不要过量,(前一半药快速推入;后一半缓慢, 一边注射,一边观察:a呼吸动度, b角膜反射, c肌张力)
2.从远端进针
生理学实验:家兔呼吸运动的调节
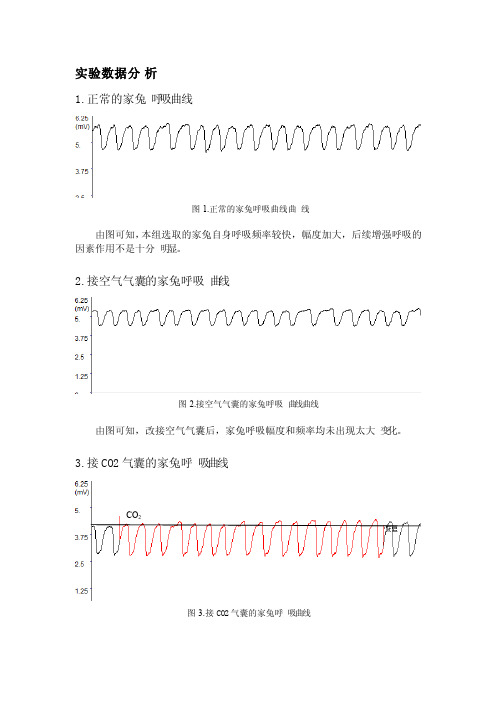
实验数据分析1.正常的家兔呼吸曲线由图可知,本组选取的家兔自身呼吸频率较快,幅度加大,后续增强呼吸的因素作用不是十分明显。
2.接空气气囊的家兔呼吸曲线图2.接空气气囊的家兔呼吸曲线曲线由图可知,改接空气气囊后,家兔呼吸幅度和频率均未出现太大变化。
3.接CO2气囊的家兔呼吸曲线CO2图3.接CO2气囊的家兔呼吸曲线由图可知,接CO2气囊后,家兔呼吸曲线幅度增大,频率加快。
这是因为CO2是调节呼吸运动最重要的生理性因素,不但对呼吸有很强的刺激作用,而且对维持延髓呼吸中枢正常兴奋活动是必须的。
当呼入气体中C O2浓度升高,血液中CO2浓度随之升高,CO2透过血脑屏障使脑脊液的CO2浓度也升高。
CO2与水反应生成H2CO3,随后水解成H C O3-和H+,由H+刺激延髓化学感受器,间接作用于呼吸中枢,通过一系列调控使得呼吸作用加强。
此外,当CO2浓度增高时,还刺激主动脉体和颈动脉体的外周化学感受器,反射性地使呼吸加深加快。
4.接N2气囊的家兔呼吸曲线N2图4.接N2气囊的家兔呼吸曲线由图可知,接N2气囊后,家兔呼吸曲线幅度略有增大。
这是因为吸入纯N2时,因吸入气体中缺乏O2,肺泡气O2浓度下降,导致动脉血中O2浓度下降;而CO2浓度却基本不变(CO2扩散速度较快)。
随着动脉血中O2浓度下降,通过刺激主动脉体和颈动脉体外周化学感受器延髓的呼吸中枢兴奋,隔肌和肋间外肌活动加强,反射性引起呼吸运动增加。
5.增长解剖无效腔的家兔呼吸曲线由图可知,增长解剖无效腔后,家兔呼吸幅度略有下降,而呼吸频率则稍稍上升,这是因为实验中通过插管的方式增大无效腔,也就是减小了进入肺泡的潮气量,即每次的有效气体更新变小。
结果促使O2分压下降,CO2分压上升,使其反射性的调节使呼吸加深加快。
家兔呼吸生理实验报告

家兔呼吸生理实验报告
实验目的:
探究家兔的呼吸生理过程,了解呼吸相关参数对于家兔生存和健康的影响。
实验材料:
家兔、呼吸频率测试仪、心率测试仪、氧气浓度检测仪、呼吸氧气浓度控制器、多功能数据采集系统、实验筒。
实验方法:
1.将家兔放置在实验筒中,使其舒适。
2.连接呼吸频率测试仪、心率测试仪、氧气浓度检测仪、呼吸氧气浓度控制器和多功能数据采集系统。
3.调节呼吸氧气浓度控制器,使家兔的呼吸氧气浓度符合常规标准。
4.记录家兔的呼吸频率、心率、氧气浓度等数据。
5.根据记录的数据,对家兔的呼吸生理过程进行分析和总结。
实验结果:
1.家兔的呼吸频率和心率比人类高很多,分别为60-150次/分钟和150-500次/分钟。
2.氧气浓度对于家兔的生存和健康影响很大,过低的氧气浓度
会使家兔窒息而死。
3.家兔的呼吸过程中会排出大量二氧化碳,如果二氧化碳排出
不及时将会对家兔造成危害。
结论:
家兔的呼吸生理过程与人类有很大不同,家兔需要更高的氧气
浓度来维持正常的生理活动。
此外,家兔的呼吸频率和心率很高,但过高的呼吸频率和心率也会影响家兔的健康。
因此,在家养兔
时应保持室内空气新鲜、氧气浓度正常,并定期监测家兔的呼吸
参数,确保家兔的健康和幸福。
呼吸运动调节实验报告(五篇)

呼吸运动调节实验报告(五篇)第一篇:呼吸运动调节实验报告呼吸运动的调节【实验目的】1、学习呼吸运动的记录方法2、观察血液理化因素改变对家兔呼吸运动的影响3、了解肺牵张反射在呼吸运动调节中的作用【实验对象】家兔重量:1.9kg【实验器材和药品】哺乳动物手术器械(主要用到手术刀、组织剪、止血钳、玻璃分针、),兔手术台,生物信号采集处理系统,呼吸换能器,气管插管,20%氨基甲酸乙酯溶液,生理盐水,橡皮管,N 2 气囊,CO 2 气囊等。
【实验方法与步骤】1.取家兔并称重,由家兔腹腔缓慢注入20%氨基甲酸乙酯溶液10ml,(因注射过程中出现差错,后补注入20%氨基甲酸乙酯溶液8ml)待家兔麻醉后,仰卧用绳子固定于手术台上。
2.剪去颈前部兔毛,颈前正中用手术刀切开皮肤5-7cm,少量出血,用纱布蘸取生理盐水擦拭。
分离气管并穿线备用。
分离颈部双侧迷走神经,穿线备用。
以倒T 型剪开气管,有少量出血,止血后用镊子清理其中异物,做气管插管。
手术完毕后,用温生理盐水纱布覆盖手术范围。
3.实验装置(1)将呼吸换能器与生物信号采集处理系统的相应通道相连接,橡皮管连接气管插管和呼吸换能器。
(2)打开计算机,启动生物信号采集处理系统,设置好参数,开始采样。
(3)采样项目①缺氧对呼吸运动的影响:方法同上,将氮气气囊管口与气管插管的通气管用手掌罩住,打开气囊,使吸入气中含较多的氮气,造成缺氧,观察呼吸运动的变化,移开气囊和手掌,待呼吸恢复正常后进行下一步实验。
②CO 2 对呼吸运动的影响:将二氧化碳气囊管口与气管插管的通气管用手掌罩住,打开气囊,使吸入气中含较多的二氧化碳,观察呼吸运动的变化,移开气囊和手掌,待呼吸恢复正常后进行下一步实验。
③增大无效腔对呼吸运动的影响:将橡皮管连接于气管插管的一个侧管上,观察此时呼吸运动的变化。
变化明显后,去掉橡皮管,观察呼吸运动的恢复过程。
④迷走神经在呼吸运动调节中的作用:先剪断一侧迷走神经,观察呼吸运动的变化,再剪断另一侧迷走神经,观察呼吸运动又有何变化。
家兔呼吸运动调节病理生理学机能实验

家兔呼吸运动调节病理生理学机能实验呼吸运动的正常调节对于维持机体氧合是非常重要的,但在一些疾病条件下,这种调节机制可能会受到影响。
为了更好地了解家兔呼吸运动调节的病理生理学机能,我们进行了一项实验。
以下是实验的详细步骤和结果。
实验材料和方法我们选择了成年健康的家兔进行实验,实验过程在动物实验伦理委员会的监督下进行,以确保符合伦理和法律要求。
1. 实验动物选择从已经适应实验环境的成年健康家兔中随机选择10只作为实验对象。
2. 实验设备准备准备好呼吸监测仪、呼吸气体混合器和呼吸阻力装置。
3. 实验组和对照组设置将10只家兔随机分为实验组和对照组,每组各5只。
4. 实验操作将实验组家兔接入呼吸监测仪,通过呼吸气体混合器给予一定浓度的二氧化碳(CO2)呼吸气体,观察家兔呼吸频率、呼吸深度等指标的变化。
对照组家兔接受相同的操作,但呼吸气体中不含CO2。
结果与讨论实验结果显示,在实验组中,家兔接受CO2刺激后,呼吸频率和呼吸深度均明显增加。
与此相比,在对照组中,家兔呼吸指标的变化没有明显的趋势。
这一结果表明,CO2对家兔呼吸运动有明显的刺激作用。
呼吸中枢感知到体内二氧化碳增加后,通过增加呼吸频率和深度来实现氧气的吸入量增加,进而改善机体氧合状况。
在病理生理学的角度来看,呼吸运动的调节机制在某些疾病状态下可能会发生改变。
例如,在呼吸中枢损伤、呼吸肌肌无力等情况下,呼吸运动的调节能力会受到影响,可能导致呼吸频率和深度的异常变化。
通过这个实验,我们可以更好地理解呼吸运动调节的病理生理学机能,并为相关疾病的治疗提供一定的理论基础。
进一步研究这些机制,有助于开发更有效的治疗方法,提高疾病患者的生存质量。
结论通过本实验,我们发现家兔呼吸运动能够受到CO2刺激的调节。
这一病理生理学机能可以帮助机体维持正常的氧合状态。
进一步的研究将有助于揭示呼吸运动调节的更多细节,并为相关疾病的治疗提供理论支持。
这对于改善呼吸系统疾病患者的生活质量具有重要意义。
家兔呼吸运动的调节

1.2.方法 1.2.1 家兔称重,按1g/kg (5 ml/kg)体重耳缘静脉20% 乌拉坦麻醉家兔,家兔麻醉后将其仰卧,固定四肢和头。 用粗剪刀剪掉颈部手术部位的兔毛,颈前正中作6~8cm 左右皮肤切口,用血管钳钝性分离离暴露气管。分离气管, 并在气管底下穿一根棉线备用。 1.2.6 气管插管 用手术剪在甲 状软骨下1cm处剪一“⊥”切口,插入气管插管,结扎固定。
实验项目
正常
增加气道长度 吸入N2 吸入CO2 注射2%乳酸
切断右侧迷走N
切断双侧迷走N 刺激右侧迷走N中枢端
5. 讨论(discussion)
5.1 增加气道长度后家兔通气量V1 ml/min 增加呼吸V11 ml/min,呼吸频率从P1次/min增加到P11次/min,增加气 道长度等于增加无效腔,增加无效腔减少了肺泡通气量, 使肺泡气体更新率下降引起血中PCO2、PO2下降,刺 激中枢和外周化学感受器引起呼吸运动会加深加快;另外, 气道加长使呼吸气道阻力增大,反射性呼吸加深加快[1] 。 5.2 吸入高浓度N2后家兔通气量从V2 ml/min 增加到V21 ml/min ,呼吸频率从P2次/min增加到P21 次/min,与正 常呼吸相比通气量增加 V22 ml/min,呼吸频率增加P22 次 /min,通气量和呼吸频率明显增加,空气中主要成分是氮 气( N2 ),吸入N2 增加等同于给家兔缺氧,刺激外周 化学感受器,引起延髓呼吸中枢兴奋,反射性引起呼吸运 动增强 [2] 。
迷走神经在呼吸中的作用
吸气肺扩张
牵张感受器+
迷走神经
延髓 吸气切断机制兴奋,抑制吸气,加 速了吸气和呼气的交替,使呼吸频 率增加。
切断双侧迷走神经后电刺激迷走神经中枢端
以中等强度电刺激一侧迷走神经中枢端,一般可导致
家兔呼吸运动的调节实验简介

思考题 (1)分别吸入 CO2、纯 N2 和注射乳酸溶液,呼吸运动有何变化? (2)比较吸人气中 CO2 浓度增加和缺氧,家兔呼吸运动的频率和幅度变化的差异,分
别说明它们各通过何种途径发挥作用。 (3)迷走神经是肺牵张反射的传入神经,对照实验结果,讨论切断迷走神经后及刺激
迷走神经中枢端呼吸运动发生变化的机理。
(2)呼吸流量换能器输出线接微机生物信号处理系统第 1 通道(亦可选择其他通道)。 (3)微机生物信号处理系统参数设置
RM6240 系统点击“实验”菜单,选择“呼吸”或“自定义实验项目”菜单中的“呼 吸运动调节”,系统进入该实验信号记录状态。仪器参数:通道时间常数为直流,滤 波频率 30Hz,灵敏度 5mv,采样频率 800Hz,扫描速度 1 s/div。 2. 手术准备(观看动物实验的基本操作、实验动物手术 VCD) (1)麻醉固定:家兔称重后,200g/L 氨基甲酸乙酯按 lg/kg 体重,耳缘静脉注射麻 醉。待兔麻醉后,将其仰卧,先后固定四肢及兔头。 (2)手术:用粗剪刀剪去颈前部兔毛于水盆中,颈前正中切开皮肤 6~8cm,直至下颌 角上 l.5~2cm,用止血钳钝性分离软组织及颈部肌肉,暴露气管及与气管平行的左、右 血管神经鞘,细心分离两侧鞘膜内的颈总动脉和迷走神经,在迷走神经下穿线备用。用 止血钳分离气管,在气管下穿两根粗棉线备用。 (3)气管插管 在环状软骨下约 1 cm 处,做“上”形剪口,用棉签将气管切口及气管 里的血液和分泌物擦净,气管插管由剪口处向肺端插入,插时应动作轻巧,避免损伤气 管黏膜引起出血,用一粗棉线将插管口结扎固定,另一棉线在切旧的头端结扎止血。用 温热生理盐水纱布覆盖手术野。 观察项目 (1)描记正常呼吸曲线 启动生物信号采集处理系统记录按钮,记录一段正常呼吸运 动曲线作为对照。辨认曲线上吸气、呼气的波形方向(呼气曲线向上.吸气曲线向下)。 (2)在气管插管一个侧管上接一根长 50cm 的胶管,观察和记录呼吸运动的变化。 (3)降低吸入气中的氧分压待呼吸曲线恢复正常,将钠石灰特制低氧瓶的导管口平行 于气管插管以降低家兔吸人气中的氧分压,观察和记录 H+对呼吸运动的变化。 (4)增加吸入气中的二氧化碳分压:打开二氧化碳发生瓶的导气管,使家兔吸入含有 较高浓度二氧化碳的空气。待家兔呼吸运动增强后立即闭合二氧化碳导管。观察呼吸曲 线变化。 (5)增加血液中的 H+:耳缘静脉缓慢注入 3%乳酸溶液 2mL,观察呼吸运动的变化。 (6)耳缘静脉缓慢注入 250g/L nikethamide 溶液 0.4mL/kg 体重(注意速度不宜过快, 以免引起惊厥),观察并记录呼吸变化。 (7)迷走神经对呼吸运动的调节作用:分别观察和记录切断一侧迷走神经和切断两侧 迷走神经以后呼吸运动的变化的一个维管束图,并注明各部分名称。
生理学实验呼吸运动的调节

生理学实验呼吸运动的调节【目的】本实验的目的是观察理化因素对呼吸的影响。
【原理】呼吸运动是呼吸中枢节律性活动的反应。
呼吸中枢通过支配呼吸肌的传出神经膈神经和肋间神经、引起呼吸肌收缩,从而产生呼吸运动。
呼吸运动能够维持其节律性,并能适应机体代谢需要的变化,是由于体内存在着完善的调节机制。
体内外的各种刺激可通过体内调节系统的作用而影响呼吸运动。
【实验对象】家兔【器材与药品】BL-420生物信号记录分析系统、哺乳动物手术器械一套、兔台、气管套、注射器(20m1、5mI各一支)、50cm长的橡皮管一条,球胆二个、支架、张力换能器、刺激器、保护电极、马利气鼓、CO2气体、CO2气囊、25%氨基甲酸乙酯、3%的乳酸溶液、钠石灰瓶、生理盐水、纱布及线等。
【方法与步骤】1.麻醉与固定:用25%的氨基甲酸乙酯4ml/kg体重、自耳缘静脉注入,动物麻醉后,取仰卧固定在手术台上。
2.手术:颈部正中切口,气管插管,将气管插管的一侧开口与玛利式气鼓的橡皮管连接,可见描笔随呼吸上下移动,分离双侧迷走神经,穿线备用。
3.连接实验仪器装置:Y型气管插管的一端与张力换能器及生物信号处理采集系统连接,按实验项目逐步进入呼吸运动调节的实验项目,并按实际情况调节相应参数。
【实验项目】1.观察正常呼吸曲线,曲线向上为呼气,向下为吸气,同时观察呼吸频率与深度。
2.增加吸入气中CO2浓度:将装有CO2球胆的皮管口移近气管插管的侧管相距1厘米,打开球胆管的皮管夹子,使CO2随吸气进入气管。
观察高浓度的CO2对呼吸运动的影响。
夹闭球胆,观察呼吸恢复正常的过程。
3.缺O2 :将气管插管的一侧管通过钠石灰瓶,与盛有一定空气的球胆相连。
之后夹闭气管插管的另一例,使兔呼吸球胆中的空气。
这时,动物呼出的CO2可被钠石灰吸收,随呼吸的进行,球囊中的O2明显减少,观察呼吸运动的变化。
4.增大无效腔:把50cm长的橡皮管连接在气管插管的一侧管上.另一侧管夹闭。
家兔呼吸运动的调节实验报告总结

家兔呼吸运动的调节实验报告总结家兔呼吸运动的调节实验报告总结1. 引言家兔呼吸运动的调节是生理学中一个重要且复杂的研究课题。
呼吸作为生命体内重要的气体交换过程,对维持正常的氧气摄取和二氧化碳排出至关重要。
本报告旨在对家兔呼吸运动的调节实验进行总结,包括实验设计、结果和结论等方面,通过探讨实验的深度和广度,使读者更全面地了解这一主题。
2. 实验设计2.1 实验目的本实验旨在探究家兔呼吸运动的调节机制,特别关注于其对环境温度和运动负荷的适应能力。
2.2 实验材料和方法2.2.1 实验材料- 安全可靠的呼吸评估装置- 健康的家兔作为实验对象- 精确可靠的温度控制设备2.2.2 实验方法- 将家兔固定在呼吸评估装置上,使其呼吸运动得到准确记录。
- 分别在正常温度和高温环境下对家兔进行呼吸运动评估。
- 给家兔施加不同运动负荷,观察其呼吸运动的变化。
3. 实验结果与讨论3.1 温度对家兔呼吸运动的影响实验结果表明,家兔在正常温度下呼吸运动稳定且规律,表现出适应性强和良好的呼吸节律。
而在高温环境下,家兔呼吸运动加速,频率增高,呼吸深度减弱。
这一结果表明家兔在高温环境下通过调节呼吸运动来适应环境的变化,以降低体温。
3.2 运动负荷对家兔呼吸运动的影响实验结果显示,给家兔施加适度的运动负荷能够增加其呼吸运动的频率和深度,提高氧气摄取量。
然而,当运动负荷过大时,家兔的呼吸运动会变得不规律,呼吸频率下降,呼吸深度减弱。
这表明家兔在面对较大的运动负荷时,其呼吸运动受到一定程度的限制。
4. 结论通过本实验的探究,我们可以得出以下结论:- 温度对家兔呼吸运动有明显的影响,高温环境下家兔呼吸运动表现出适应性调节。
- 适度的运动负荷能够增强家兔呼吸运动,提高氧气摄取能力,但过大的负荷会导致呼吸运动减弱。
5. 个人观点与理解关于家兔呼吸运动的调节,我个人认为这是一项非常重要的研究。
呼吸作为生命体内气体交换的基本过程,在维持机体正常生理功能中发挥着重要作用。
家兔呼吸运动的调节

家兔呼吸运动的调节【实验目的】:观察血液中化学因素(PCO2、PO2、和H+)改变对家兔呼吸运动(呼吸频率、节律、幅度)的影响,初步探讨其作用部位,并分析机制。
观察迷走神经在家兔呼吸运动调节中的作用,初步探讨其机制。
掌握气管插管术和神经血管分离术。
【实验材料】:家兔,CO2,氨基甲酸乙酯,乳酸,止血钳,剪刀,注射器,50厘米胶管,手术台,呼吸换能器,RM6240系统等。
【实验方法】:1、实验系统连接及参数设置用胶管连接呼吸换能器和气管插管,呼吸换能器输出线接RM6240系统,设置参数。
2、手术准备(1)麻醉固定家兔称重后按1g/Kg体重剂量耳缘静脉注射200g/L 氨基甲酸乙酯。
待兔麻醉后,将其仰卧,先后固定四肢及兔头。
(2)手术剪去颈前被毛,颈前正中切开皮肤6~7cm,直至下颌角上1.5cm,用止血钳钝性分离软组织及颈部肌肉,暴露企管及与气管平行的左、右血管神经鞘,细心分离两侧鞘膜内迷走神经,在迷走神经下穿线备用。
分离气管,在气管下穿两根粗棉线备用。
(3)气管插管在环状软骨下1cm处,做倒“T”形剪口,用棉签讲气管切口及气管里的血液和分泌物擦净,气管插管由剪口处向肺端插入,插时应动作轻巧,避免损伤气管粘膜引起出血,用一粗棉线将插管口结扎固定,另一棉线在切口的头端结扎止血。
3、实验观察(1)记录一段正常呼吸曲线,作为对照。
(2)在气管插管一个侧管上接一50cm胶管(流量法:接通气口),增大无效腔,观察和记录呼吸运动的变化。
(3)增加吸入气中二氧化碳分压打开二氧化碳气体导管,使家兔吸入含有较高浓度二氧化碳的空气,待呼吸运动加强后移除。
呼吸平稳后进行下一步实验。
(4)增加血液中H+ 耳缘静脉缓慢注射20g/L乳酸溶液2ml,观察呼吸运动的变化。
(5)迷走神经对呼吸运动的调节作用分析观察切断一侧迷走神经和切断两侧迷走神经以后呼吸运动的变化。
以2V强度、15Hz频率,2ms波宽的连续电脉冲间断刺激右侧迷走神经中枢端,观察呼吸运动较之前有何改变。
家兔的呼吸调节

实验十一家兔呼吸运动的调节一、实验目的1. 学习记录家兔呼吸运动的方法。
2. 观察多种因素对呼吸运动的影响。
二、实验原理人体及高等动物的呼吸运动所以能持续地、有节律地进行,是由于体内调节机制的存在。
体内、外的各种刺激,可以直接作用于中枢或不同部位的感受器、反射地影响呼吸运动,以适应机体代谢的需要。
肺的牵张反射参与呼吸节律的调节。
三、动物与器材1.实验动物:家兔2.实验器材:兔体手术台、手术器械、张力传感器、PowerLab信号采集系统、Y型气管插管、20ml 与1ml注射器、橡皮管(长1.5m,内径1cm)。
3.实验试剂:生理盐水、2%戊巴比妥钠、尼可刹米、1%乳酸。
四、实验方法与步骤1.家兔麻醉称重—麻醉(2%戊巴比妥钠,2ml/kg,耳缘静脉注射)—固定(仰卧位固定)2.手术分离颈部气管和神经颈部皮肤切口6-7cm——钝性分离颈部肌肉层——做“T”形切口插入气管插管——分离双侧迷走神经3.分离剑突软骨切开皮肤,分离表面组织使剑突软骨和骨柄暴露,金冠剪剪去一段剑突软骨的骨柄,使剑突软骨与胸骨完全分离,但保留下方的膈肌片。
4.打开Powerlab信息采集系统,用金属钩钩住游离的剑突软骨,连接各装置。
(1)记录正常的呼吸曲线,并识别吸气与呼气运动与曲线方向的关系。
(2)增加无效腔对呼吸的影响:插管一侧加上1.5米橡皮管,另一侧用止血钳夹闭。
(3)增加气道阻力对呼吸的影响:记录一段正常呼吸曲线后,同时夹闭气管插管两侧管。
(4)肺牵张反射对呼吸的影响:插管上连接20ml注射器,在吸气末打气,呼气末抽气。
(5)结扎双侧迷走神经,重复第4步。
(6)双节扎一侧迷走神经,剪断双侧迷走神经,分别刺激中枢端和外周端。
(7)静脉注射尼可刹米,0.5ml/只兔子。
(8)静脉注射1%乳酸,0.5~1ml/只兔子。
(9)气胸对呼吸的影响:剪断右侧肋骨,使兔子气胸。
五、实验结果1.家兔正常呼吸家兔正常呼吸时,呼吸肌有节律地收缩和舒张,其中上升支为吸气期,下降支为呼气。
家兔呼吸的调节的实训报告

一、实验目的1. 了解家兔呼吸系统的组成及功能;2. 掌握观察家兔呼吸运动的方法;3. 探讨家兔呼吸调节的生理机制;4. 分析影响家兔呼吸运动的各种因素。
二、实验原理呼吸运动是机体进行气体交换的重要过程,由呼吸中枢节律性活动控制。
家兔呼吸调节主要通过以下途径实现:1. 呼吸中枢调节:呼吸中枢位于脑干,包括延髓、脑桥和中脑。
其中,延髓是呼吸调节的基本中枢,控制呼吸节律和呼吸幅度。
2. 外周化学感受器调节:外周化学感受器主要分布在颈动脉体和主动脉体,感受血液中二氧化碳、氧气和氢离子的浓度变化,通过神经反射调节呼吸运动。
3. 肺牵张反射调节:肺牵张反射是指肺扩张时抑制吸气活动,肺缩小时抑制呼气活动的反射。
该反射通过迷走神经传入延髓,调节呼吸运动。
4. 其他调节因素:如温度、情绪、运动等。
三、实验材料与仪器1. 实验材料:家兔、生理盐水、CO2、乳酸、呼吸传感器、生理信号采集处理系统、气管插管、止血钳、注射器、棉线、纱布等。
2. 实验仪器:手术台、常用手术器械、显微镜、解剖镜、解剖剪、镊子、剪刀、针筒等。
四、实验步骤1. 家兔麻醉:取一只家兔,称重后,用20ml注射器由耳缘静脉缓慢推注25%氨基甲酸乙酯(1g/kg体重)进行麻醉。
2. 家兔呼吸运动观察:将麻醉后的家兔固定在手术台上,用气管插管插入气管,连接呼吸传感器和生理信号采集处理系统,记录家兔呼吸频率、节律和幅度。
3. 呼吸调节因素观察:(1)二氧化碳浓度对呼吸运动的影响:向家兔呼吸系统中注入CO2,观察呼吸频率、节律和幅度的变化。
(2)乳酸浓度对呼吸运动的影响:向家兔呼吸系统中注入乳酸,观察呼吸频率、节律和幅度的变化。
(3)肺牵张反射观察:剪断双侧迷走神经,观察呼吸运动的变化。
4. 实验数据记录与分析。
五、实验结果与分析1. 家兔在正常呼吸状态下,呼吸频率约为每分钟40-60次,节律规律,吸氧量约为每分钟200毫升左右。
2. 向家兔呼吸系统中注入CO2后,呼吸频率、节律和幅度明显增加,说明二氧化碳浓度升高可刺激呼吸中枢,增加呼吸运动。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验数据分析
1.
正常的家兔呼吸曲线
由图可知,本组选取的家兔自身呼吸频率较快,幅度加大,后续增强呼吸的因素作用不是十分明显。
2.接空气气囊的家兔呼吸曲线
图2.接空气气囊的家兔呼吸曲线曲线
由图可知,改接空气气囊后,家兔呼吸幅度和频率均未出现太大变化。
3.接CO2气囊的家兔呼吸曲线
CO2
图3.接CO2气囊的家兔呼吸曲线
由图可知,接CO
2
气囊后,家兔呼吸曲线幅度增大,频率加快。
这是因为CO2是调节呼吸运动最重要的生理性因素,不但对呼吸有很强的刺激作用,而且对维
持延髓呼吸中枢正常兴奋活动是必须的。
当呼入气体中CO
2浓度升高,血液中CO
2
浓度随之升高,CO
2透过血脑屏障使脑脊液的CO
2
浓度也升高。
CO
2
与水反应生成
H 2CO
3
,随后水解成HCO3-和H+,由H+刺激延髓化学感受器,间接作用于呼吸中枢,
通过一系列调控使得呼吸作用加强。
此外,当CO
2
浓度增高时,还刺激主动脉体和颈动脉体的外周化学感受器,反射性地使呼吸加深加快。
4.接N2气囊的家兔呼吸曲线
图4.接N2气囊的家兔呼吸曲线
由图可知,接N
2气囊后,家兔呼吸曲线幅度略有增大。
这是因为吸入纯N
2
时,因吸入气体中缺乏O
2,肺泡气O
2
浓度下降,导致动脉血中O
2
浓度下降;而
CO
2浓度却基本不变(CO
2
扩散速度较快)。
随着动脉血中O
2
浓度下降,通过刺激
主动脉体和颈动脉体外周化学感受器延髓的呼吸中枢兴奋,隔肌和肋间外肌活动加强,反射性引起呼吸运动增加。
5.
增长解剖无效腔的家兔呼吸曲线
图5.增长解剖无效腔的家兔呼吸曲线
由图可知,增长解剖无效腔后,家兔呼吸幅度略有下降,而呼吸频率则稍稍上升,这是因为实验中通过插管的方式增大无效腔,也就是减小了进入肺泡的潮
气量,即每次的有效气体更新变小。
结果促使O
2分压下降,CO
2
分压上升,使其
反射性的调节使呼吸加深加快。
所以膈肌放电的变化幅度加大,频率有微量增大。
反映到膈肌的收缩曲线,由于收缩频率的增大,为了维持正常的肺部通气量,所以收缩强度减弱。
N2
6.家兔肺牵张反射曲线
吸气末抽出20mL空气
呼气末注入20mL空气
图6.家兔肺牵张反射曲线
由图可知,向肺部吹气相当于使肺部发生扩张,这种扩张刺激了气管平滑肌的牵张感受器,冲动由迷走神经传入延髓,抑制吸气神经元,切断吸气,引起被动呼气。
所以如果这次实验注入气体过久,气量过大,可能会使得呼吸停止在呼气的位置。
实验结果也显示了由于增大肺部的体积引起的膈肌收缩力的减弱和呼吸频率的减小。
而从肺部吸气造成了肺部的萎缩,信号通过迷走神经传入呼吸中枢的程度减弱,对于吸气神经元的抑制程度减小,就会引起吸气神经元发生兴奋,增加呼吸的强度。
实验图中显示了从开始抽气到这种变化恢复的过程。
出现了明显的呼吸强度的增大。
7.剪断两侧迷走神经的家兔呼吸曲线
剪断另外一侧迷走神经
剪断一侧迷走神经
图7.剪断两侧迷走神经的家兔呼吸曲线
由图可知,剪断两侧侧迷走神经时,呼吸强度和呼吸频率频率未出现明显变化,这是由于迷走神经为肺牵张反射的传入神经,参与呼气和吸气之间相互转化并维持呼吸的深度和频率。
剪断两侧迷走神经后,中断了肺牵张反射的传入通路,使肺牵张反射的生理作用减弱,出现吸气过深,呼吸频率变慢。
途中由于出现张力曲线的基线下移使得显示出的收缩曲线幅度没有多少变化。
8.刺激迷走神经的家兔呼吸曲线
图8.2V刺激迷走神经的家兔呼吸曲线
图9.1V刺激迷走神经的家兔呼吸曲线
由图可知,1V强度刺激侧迷走神经时,呼吸幅度明显下降,频率略有提高,这是因为刺激迷走神经后,冲动传入延髓抑制了吸气神经元的活动,使得吸气程度部分被抑制,一定程度上引起了被动的呼气,综合起来使得呼吸的速率提高,呼吸的强度减弱。
由于迷走神经的传入神经也是复合神经干,所以在一定范围内这种变化的程度和刺激强度有关。
所以在2V刺激迷走神经的图像中并未观察到规律性的变化。
9.剪断迷走神经后家兔的肺牵张反射曲线
图10.剪断迷走神经后家兔的肺牵张反射曲线
由图可知,剪断迷走神经后,向兔子肺部注射气体或抽取气体均无明显反应,这是因为
由于迷走神经已经剪断,信号传不到中枢,也就成了无效信号,所以图中显示刺激前后没有变化。
(注:由于剪断了双侧迷走神经,机体失去了对呼吸的正常调节机制,所以呼吸速率和强度都无法回到正常水平。
)
如有侵权请联系告知删除,感谢你们的配合!。
