化学成绩分段对比-大方三中2017-2018学年度第一学期高一第二次月考
贵州省大方县2017_2018学年高一化学上学期第一次月考试题2017102703131

2017-2018学年度第一学期高一级第一次月考化学试题可能用到的相对原子质量:H:1 O:16 Na:23 S:32 C:12 Cl:35.5N:14 Ba:137一、选择题(每小题3分,共6分,每小题只有一个选项符合题意)1. 以下是一些常用的危险品标志,装运乙醇(酒精)的包装箱应贴的图标是()2. 下列实验操作和处理方法可能会引发安全事故的是()①将水沿着烧杯内壁缓慢加入浓硫酸中,并用玻璃棒不断搅拌②给试管中的液体加热时,试管口不朝向任何人③夜间厨房发生煤气泄漏时,立即开灯检查煤气泄漏原因,并打开所有门窗通风④用氢气还原氧化铜时,先加热氧化铜,再通往氢气A. ①②③B. ①③④C. ②③④D. ①②③④3. 下列表示方法,不正确的是()A. 1 mol氧B. 1 mol O2C. 1 mol OD. 1 mol O2-4. 常温常压下,2.2 g CO2气体的摩尔质量是()A. 0.05 g/molB. 0.05 molC. 44 gD. 44 g/mol5. 现在CO、CO2、O3(臭氧)三种气体,它们分别都含有1 mol氧原子,则三种气体的物质的量之比为()A. 1:1:1B. 1:2:3C. 3:2:1D. 6:3:26. 下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是()①过滤②蒸发③溶解④向容量瓶转移液体A.①和②B.①和③C.③和④D.①和④7.如图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是()- 1 -A. 蒸馏、蒸发、萃取、过滤B.蒸馏、过滤、萃取、蒸发C. 萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏8.在标准状况下,下列气体含有的分子数最多的是()A.36.5 g HCl B.22.4 L O2 C.4 g H2 D.0.5 mol SO29. 下列制取蒸馏水的实验装置与操作的说法中,不正确的是()A. 温度计的水银球应插入蒸馏烧瓶中的自来水中B. 冷凝管中的水流方向是从下口进入,上口排出C. 实验中需要在蒸馏烧瓶中加入几粒碎瓷片,防止出现暴沸现象D. 加热蒸馏烧瓶必须垫石棉网10. 下列分离混合物的方法中不正确的是()A. 从酒精和水的混合物中分离出酒精——蒸馏法B. 使浑浊的食盐水变澄清——过滤法C. 从溴水中分离出溴——分液法D. 把硝酸钾和氯化钾从溶液中分离开来——结晶法11.设N A代表阿佛加德罗常数,下列说法正确的是()A. 标准状况下,22.4LH2O含有3N A个原子B. 4.0gNaOH中含有0.1N A个Na+C. 4.48LCO2含有0.2N A个CO2分子D. 1molCl-中含有17N A个电子12.配制0.5 mol·L-1NaOH溶液250 mL,在下列仪器中①托盘天平②量筒③烧杯④玻璃棒⑤漏斗⑥500 mL容量瓶⑦药匙⑧250 mL容量瓶⑨胶头滴管⑩坩埚,需要用到的仪器有()A.①③④⑥⑨⑩B.①④⑦⑧⑨⑩C.①②③④⑦⑧⑨D.①②④⑤⑧⑨13. 有一瓶14%的KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液80mL,这80mL溶液的物质的量浓度为()- 2 -A.5 mol/L B.6 mol/L C.6.25 mol/L D.6.75 mol/L14.下列灭火方法不合理的是()A.电器着火——用水泼灭B.油锅着火——用锅盖盖灭C.身上着火——就地打滚压灭D.桌面上酒精燃烧——用湿抹布盖灭15.密度为1.84g/cm3、H2SO4的质量分数为98%的浓硫酸中H2SO4的物质的量浓度是()A.18.8mol/L B.18.4mol/L C.18.4mol D.18.816. 同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是()A. 体积比1:1B. 体积比16:11C. 密度比16:11D. 密度比11:1617. 设N A表示阿伏加德罗常数,下列物质中物质的量为1 mol的是()A. 通常状态下22.4 L氯气B. 16 g氧气C. N A个H2分子D. 标准状况下22.4 L酒精18. a mol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为()a b a bA. mol-1B. mol-1C. mol-1D. mol-14b 4a b a19.将一瓶20%的NaCl溶液和一瓶50%的NaCl溶液等体积混合后,所得溶液的溶质质量分数为()A. <35%B. =35%C. >35%D. 无法确定20. 将标准状况下的a L HCl(气体)溶于1000 g水中,得到的盐酸的密度为b g/cm3,则该盐酸的物质的量浓度是()a abA.mol/L B.mol/L22.422400ab1000abC.mol/L D.mol/L2240036.5a2240036.5a二、填空题(40分)21.(6分) 下列各组物质的分离或提纯,应选用下述方法的哪一种(填序号)A.分液B.过滤C.萃取D.蒸馏E.蒸发结晶F.加热分解(1)除去Ca(OH)2溶液中悬浮的CaCO3 ;(2)从碘水中提取碘;(3)用自来水制取蒸馏水;(4)分离植物油和水;(5)除去NaCl中所含的少量KNO3 ;- 3 -(6)除去KCl中少量的KClO3 。
2017-2018学年高一化学上学期第二次月考(11月)原创模拟卷(A卷)(考试版)

化学试题 第1页(共4页) 化学试题 第2页(共4页)………………○………………内………………○………………装………………○………………订………………○………………线………………○………………………………○………………外………………○………………装………………○………………订………………○………………线………………○………………… 学校:______________姓名:_____________班级:_______________考号:______________________2017-2018学年上学期第二次月考(11月)原创卷A 卷高一化学(考试时间:90分钟 试卷满分:100分)注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。
写在本试卷上无效。
4.测试范围:人教必修1第1章~第3章。
5.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5第Ⅰ卷(选择题 共48分)一、选择题:本题共16个小题,每小题3分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.进行化学实验必须注意安全,下列说法不正确的是A .不慎将酸液溅到眼中,应立即用大量水冲洗,边洗边眨眼睛B .不慎将碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液C .配制硫酸溶液时,可先在量筒中加入一定体积的水,再慢慢倒入浓硫酸并搅拌D .洒在桌面上的酒精燃烧,立即用湿抹布盖灭2.下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是A .蒸馏、过滤、萃取、蒸发B .蒸馏、蒸发、萃取、过滤C .萃取、过滤、蒸馏、蒸发D .过滤、蒸发、萃取、蒸馏3.下列关于物质分类的组合正确的是选项 氧化物 碱酸 盐 A CO 2 Na 2CO 3 H 2SO 4 NaCl B H 2SiO 3 NaOH HCl NaHCO 3 C SO 2 NaOH H 2CO 3 CaCl 2 DCO 2KOHNaHSO 4CaCO 34A .纳米炭粉与普通木炭的化学性质完全不同 B .相同条件下,纳米炭粉的吸附能力比木炭强 C .纳米炭粉与水形成的分散系较稳定D .纳米炭粉与水形成的分散系能产生丁达尔现象5.下列说法正确的是A .Na 2SO 4既属于钠盐又属于硫酸盐B .CO 2水溶液能导电,所以CO 2是电解质C .氯化钠溶液在电流作用下电离成钠离子和氯离子D .向硝酸溶液中加入少量氢氧化钠固体,溶液的导电能力显著降低 6.下列除杂方法正确的一组是序号 物质 杂质 除杂方法① NaCl BaCl 2 加入过量的K 2CO 3溶液,过滤,再加适量的盐酸并加热蒸发② FeSO 4溶液CuSO 4 加入过量Fe 粉,过滤③ H 2 HCl 通过盛NaHCO 3溶液洗气瓶,再通过盛H 2SO 4洗气瓶④ 自来水 植物油 蒸馏 7.纯铁的熔点为1 535 ℃,而高炉中炼铁时生铁(含碳量较高的铁合金)在1 200 ℃左右就熔化了,这是因为 A .铁的纯度越高,熔点越低B .形成了铁碳合金,所以熔点变低C .合金的熔点比其成分物质的熔点高D .在高炉中熔化的过程发生了化学反应8.下列有关物质的性质与用途具有对应关系且正确的是A .金属钠具有强还原性,可用其与TiCl 4溶液反应制取金属TiB .明矾溶于水能形成胶体,可用于自来水的杀菌消毒C .常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸D .Al 2O 3具有很高的熔点,可用于制造熔融烧碱的坩埚 9.用N A 表示阿伏加德罗常数的值,下列叙述正确的是 A .含有N A 个氦原子的氦气在标准状况下的体积约为11.2 L B .在常温常压下,11.2 L Cl 2含有的分子数为0.5N A C .25 ℃、101 KPa ,64 g SO 2中含有的原子数为3N A D .标准状况下,11.2 L H 2O 含有的分子数为0.5N A 10.下列叙述正确的是A .同温同压下,相同体积的物质,其物质的量一定相等B .任何条件下,等物质的量的甲烷和一氧化碳所含的原子数一定相等C .1 L 一氧化碳气体一定比1 L 氧气的质量小D .相同条件下的一氧化碳和氮气,若体积相等,则质量也相等 11.下列离子方程式书写正确的是A .铁跟稀硫酸反应:2Fe + 6H + ===2Fe 3+ + 3H 2 ↑B .盐酸与澄清石灰水反应:H + + OH −===H 2OC .碳酸钙与醋酸反应:CaCO 3 +2H + ===Ca 2+ + CO 2↑ + H 2OD .二氧化碳通入足量的氢氧化钠溶液:CO 2 + OH −===3HCO -12.下列各组离子在常温下一定能大量共存的是A .无色透明的溶液中:Na +、Ba 2+、2AlO -、OH − B .加入铝粉能放出H 2的溶液中:H +、K +、24SO -、 Cl − C .含有大量Fe 3+的溶液中:4NH +、Ca 2+、SCN −、Br − D .0.1 mol · L −1的 Na 2CO 3溶液:K +、Ba 2+、3NO -、Cl − 13.下列反应中水起还原剂作用的是A .CaO + H 2O===Ca(OH)2B .C+H 2O(g)高温CO+H 2C .2F 2 + 2H 2O===4HF + O 2D .3NO 2 + H 2O===2HNO 3 + NO14.下列各组中的两物质作用时,反应条件(温度、反应物用量比)改变,不会引起生成物改变的是A .Na 和O 2B .NaOH 和CO 2C .Na 2CO 3和HClD .NaHCO 3和NaOH化学试题第3页(共4页)化学试题第4页(共4页)………………○………………内………………○………………装………………○………………订………………○………………线………………○………………此卷只装订不密封………………○………………外………………○………………装………………○………………订………………○………………线………………○………………15.一定条件下,硫的某种含氧酸H2SO x(x≤4)与H2S可发生如下反应:H2S+H2SO x——S+(x−3)SO2+H2O(未配平)。
贵州省毕节市大方县三中2025届化学高一第一学期期中达标测试试题含解析

贵州省毕节市大方县三中2025届化学高一第一学期期中达标测试试题注意事项1.考生要认真填写考场号和座位序号。
2.试题所有答案必须填涂或书写在答题卡上,在试卷上作答无效。
第一部分必须用2B 铅笔作答;第二部分必须用黑色字迹的签字笔作答。
3.考试结束后,考生须将试卷和答题卡放在桌面上,待监考员收回。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、有8 g Na2O、Na2CO1、NaOH的混合物与200 g质量分数为1.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为A.8 g B.2.5 g C.3.7 g D.无法计算2、下列过程中,属于化学变化的是A.用加热法分离泥沙中的碘单质B.用蒸馏法制取蒸馏水C.干冰气化D.铁锅生锈3、如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说法正确的是()A.曲线A表示NaOH溶液中滴加稀盐酸B.曲线B表示CH3COOH溶液中滴加KOH溶液C.曲线C表示Ba(OH)2溶液中滴加稀硫酸D.曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液4、一定温度下,将少量生石灰放入一定量饱和石灰水中,搅拌并冷却到原温度,下列说法正确的是()A.溶质的质量增大B.溶质的物质的量浓度增大C.c(OH-)不变D.溶质的质量分数增大5、下列说法中,正确的是()A.1 mol任何气体的体积都约为22.4 LB.气体的摩尔体积约为22.4 L·mol-1C.0℃,101kPa时,1 mol O2和N2的混合气体的总体积约为22.4 LD.含有N A个氢原子的氢气在标准状况下的体积约为22.4 L6、下列物质分类的正确组合是()选项混合物纯净物单质电解质A 盐酸NaOH 石墨K2SO4溶液B 空气Fe(OH)3胶体铁Na2CO3C CuSO4·5H2O CaCl2水银铜D 氯水KNO3晶体O3NaClA.A B.B C.C D.D7、下列关于电解质的说法,正确的是A.氯气溶于水所形成的溶液能导电,因此氯气是电解质B.CaCO3饱和溶液导电能力很弱,所以CaCO3是弱电解质C.HClO 水溶液中既有H+、ClO-,又有大量HClO 分子,因此HClO 是弱电解质D.CO2的水溶液可以导电,所以CO2是电解质8、下列化学用语不正确的是A.中子数为20的氯原子:37Cl17B.硫酸的电离方程式:H2SO4=H++HSO4-C.核素23Na的核外电子数是11D.硫原子的结构示意图:9、下列叙述正确的是( )A.溶液是电中性的,胶体是带电的B.胶体和溶液的本质区别是能否产生丁达尔效应C.胶体是一种介稳性的分散系,而溶液是一种稳定的分散系D.向饱和FeCl3溶液中缓慢滴加稀NaOH溶液,可制得Fe(OH)3胶体10、实验室中需要配制2mol·L-1NaOH的溶液430mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是A.500mL,40g B.500mL,34.4g C.430mL,34.4g D.430mL,40g11、已知NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,下列说法正确的是A.氧气是还原产物B.还原剂与氧化剂的物质的量之比为1:1C.反应物中有水,且反应方程式中水的化学计量数为2D.若生成4.48L(标准状况下)O2,则反应转移0.8mol电子12、下列离子反应方程式错误的是A.向KHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全:H++SO42-+Ba2++OH﹣=H2O+BaSO4↓B.烧碱溶液与少量碳酸氢钙溶液混合: Ca2++HCO3﹣+OH﹣=CaCO3+H2OC.碳酸镁与稀硫酸: MgCO3+2H+=H2O+CO2↑+Mg2+D.醋酸与大理石: 2CH3COOH+CaCO3=Ca2++2CH3COO﹣+H2O+CO2↑13、下列说法正确的个数有( )①盐卤点豆腐、江河入海口处“三角洲”的形成、高压直流电除烟尘均与胶体的性质有关②氢氧化铁胶体能稳定存在的主要原因是胶体粒子做布朗运动③做氢氧化铁胶体电泳实验时,阴极周围红褐色加深,说明氢氧化铁胶体带正电④向FeCl3溶液中滴加NaOH溶液,可制得Fe(OH)3胶体⑤1mol FeCl3完全与水反应生成氢氧化铁胶体粒子数约为N A个A.1个B.2个C.3个D.4个14、以“物质的量”为中心的计算是化学计算的基础。
大方县三中2018-2019学年高二上学期第二次月考试卷数学

大方县三中2018-2019学年高二上学期第二次月考试卷数学 班级__________ 姓名__________ 分数__________一、选择题1. 椭圆=1的离心率为( ) A .B .C .D .2. 利用计算机在区间(0,1)上产生随机数a ,则不等式ln (3a ﹣1)<0成立的概率是( )A .B .C .D .3. 设,,a b c 分别是ABC ∆中,,,A B C ∠∠∠所对边的边长,则直线sin 0A x ay c ++=与sin sin 0bx B y C -+=的位置关系是( )A .平行B . 重合C . 垂直D .相交但不垂直 4. 已知函数f (x )=3cos (2x ﹣),则下列结论正确的是( )A .导函数为B .函数f (x )的图象关于直线对称C .函数f (x )在区间(﹣,)上是增函数D .函数f (x )的图象可由函数y=3co s2x 的图象向右平移个单位长度得到5. 等差数列{a n }中,a 2=3,a 3+a 4=9 则a 1a 6的值为( ) A .14 B .18C .21D .276. 设数列{a n }的前n 项和为S n ,若S n =n 2+2n (n ∈N *),则++…+=( )A .B .C .D .7. 在直三棱柱中,∠ACB=90°,AC=BC=1,侧棱AA 1=,M 为A 1B 1的中点,则AM 与平面AA 1C 1C 所成角的正切值为( )A .B .C .D .8. 已知偶函数f (x )=log a |x ﹣b|在(﹣∞,0)上单调递增,则f (a+1)与f (b+2)的大小关系是( ) A .f (a+1)≥f (b+2) B .f (a+1)>f (b+2)C .f (a+1)≤f (b+2)D .f (a+1)<f (b+2)9. 已知点P 是双曲线C :22221(0,0)x y a b a b-=>>左支上一点,1F ,2F 是双曲线的左、右两个焦点,且12PF PF ⊥,2PF 与两条渐近线相交于M ,N 两点(如图),点N 恰好平分线段2PF ,则双曲线的离心率是( )A.5B.2 D.2【命题意图】本题考查双曲线的标准方程及其性质等基础知识知识,意在考查运算求解能力. 10.已知数列{a n }是等比数列前n 项和是S n ,若a 2=2,a 3=﹣4,则S 5等于( ) A .8B .﹣8C .11D .﹣1111.已知向量=(2,﹣3,5)与向量=(3,λ,)平行,则λ=( )A .B .C .﹣D .﹣12.某高二(1)班一次阶段考试数学成绩的茎叶图和频率分布直方图可见部分如图,根据图中的信 息,可确定被抽测的人数及分数在[]90,100内的人数分别为( )A .20,2B .24,4C .25,2D .25,4二、填空题13.设MP 和OM 分别是角的正弦线和余弦线,则给出的以下不等式:①MP <OM <0;②OM <0<MP ;③OM <MP <0;④MP <0<OM , 其中正确的是 (把所有正确的序号都填上).14.抛物线y 2=6x ,过点P (4,1)引一条弦,使它恰好被P 点平分,则该弦所在的直线方程为 .15.设数列{a n }满足a 1=1,且a n+1﹣a n =n+1(n ∈N *),则数列{}的前10项的和为 .16.已知点A的坐标为(﹣1,0),点B是圆心为C的圆(x﹣1)2+y2=16上一动点,线段AB的垂直平分线交BC与点M,则动点M的轨迹方程为.17.已知(x2﹣)n)的展开式中第三项与第五项的系数之比为,则展开式中常数项是.18.若函数y=ln(﹣2x)为奇函数,则a=.三、解答题19.(1)直线l的方程为(a+1)x+y+2﹣a=0(a∈R).若l在两坐标轴上的截距相等,求a的值;(2)已知A(﹣2,4),B(4,0),且AB是圆C的直径,求圆C的标准方程.20.已知等比数列{a n}中,a1=,公比q=.(Ⅰ)S n为{a n}的前n项和,证明:S n=(Ⅱ)设b n=log3a1+log3a2+…+log3a n,求数列{b n}的通项公式.21.(本小题满分12分)某超市销售一种蔬菜,根据以往情况,得到每天销售量的频率分布直方图如下:(Ⅰ)求频率分布直方图中的a 的值,并估计每天销售量的中位数;(Ⅱ)这种蔬菜每天进货当天必须销售,否则只能作为垃圾处理.每售出1千克蔬菜获利4元,未售出的蔬菜,每千克亏损2元.假设同一组中的每个数据可用该组区间的中点值代替,估计当超市每天的进货量为75千克时获利的平均值.22.已知向量,满足||=1,||=2,与的夹角为120°.(1)求及|+|;(2)设向量+与﹣的夹角为θ,求cos θ的值.23.(本小题满分12分)0.0050.02频率组距O千克设椭圆2222:1(0)x y C a b a b+=>>的离心率12e =,圆22127x y +=与直线1x y a b +=相切,O 为坐标原点.(1)求椭圆C 的方程;(2)过点(4,0)Q -任作一直线交椭圆C 于,M N 两点,记MQ QN λ=,若在线段MN 上取一点R ,使 得MR RN λ=-,试判断当直线运动时,点R 是否在某一定直一上运动?若是,请求出该定直线的方 程;若不是,请说明理由.24.(考生注意:请在下列三题中任选一题作答,如果多做,则按所做的第一题评分)(不等式选做题)设,且,则的最小值为(几何证明选做题)如图,中,,以为直径的半圆分别交于点,若,则大方县三中2018-2019学年高二上学期第二次月考试卷数学(参考答案)一、选择题1. 【答案】D【解析】解:根据椭圆的方程=1,可得a=4,b=2,则c==2;则椭圆的离心率为e==,故选D .【点评】本题考查椭圆的基本性质:a 2=b 2+c 2,以及离心率的计算公式,注意与双曲线的对应性质的区分.2. 【答案】C【解析】解:由ln (3a ﹣1)<0得<a <,则用计算机在区间(0,1)上产生随机数a ,不等式ln (3a ﹣1)<0成立的概率是P=, 故选:C .3. 【答案】C 【解析】试题分析:由直线sin 0A x ay c ++=与sin sin 0bx B y C -+=,则sin (sin )2sin sin 2sin sin 0A b a B R A B R A B ⋅+⋅-=-=,所以两直线是垂直的,故选C. 1 考点:两条直线的位置关系. 4. 【答案】B【解析】解:对于A ,函数f ′(x )=﹣3sin (2x ﹣)•2=﹣6sin (2x ﹣),A 错误;对于B ,当x=时,f ()=3cos (2×﹣)=﹣3取得最小值,所以函数f (x )的图象关于直线对称,B 正确;对于C ,当x ∈(﹣,)时,2x ﹣∈(﹣,),函数f (x )=3cos (2x ﹣)不是单调函数,C 错误;对于D ,函数y=3co s2x 的图象向右平移个单位长度,得到函数y=3co s2(x ﹣)=3co s (2x ﹣)的图象,这不是函数f(x)的图象,D错误.故选:B.【点评】本题考查了余弦函数的图象与性质的应用问题,是基础题目.5.【答案】A【解析】解:由等差数列的通项公式可得,a3+a4=2a1+5d=9,a1+d=3解方程可得,a1=2,d=1∴a1a6=2×7=14故选:A【点评】本题主要考查了等差数列的通项公式的简单应用,属于基础试题6.【答案】D【解析】解:∵S n=n2+2n(n∈N*),∴当n=1时,a1=S1=3;当n≥2时,a n=S n﹣S n﹣1=(n2+2n)﹣[(n﹣1)2+2(n﹣1)]=2n+1.∴==,∴++…+=++…+==﹣.故选:D.【点评】本题考查了递推关系、“裂项求和”方法,考查了推理能力与计算能力,属于中档题.7.【答案】D【解析】解:双曲线(a>0,b>0)的渐近线方程为y=±x联立方程组,解得A(,),B(,﹣),设直线x=与x轴交于点D∵F为双曲线的右焦点,∴F(C,0)∵△ABF为钝角三角形,且AF=BF,∴∠AFB>90°,∴∠AFD>45°,即DF<DA∴c﹣<,b<a,c2﹣a2<a2∴c2<2a2,e2<2,e<又∵e>1∴离心率的取值范围是1<e<故选D【点评】本题主要考查双曲线的离心率的范围的求法,关键是找到含a,c的齐次式,再解不等式.8.【答案】B【解析】解:∵y=log a|x﹣b|是偶函数∴log a|x﹣b|=log a|﹣x﹣b|∴|x﹣b|=|﹣x﹣b|∴x2﹣2bx+b2=x2+2bx+b2整理得4bx=0,由于x不恒为0,故b=0由此函数变为y=log a|x|当x∈(﹣∞,0)时,由于内层函数是一个减函数,又偶函数y=log a|x﹣b|在区间(﹣∞,0)上递增故外层函数是减函数,故可得0<a<1综上得0<a<1,b=0∴a+1<b+2,而函数f(x)=log a|x﹣b|在(0,+∞)上单调递减∴f(a+1)>f(b+2)故选B.9.【答案】A.【解析】10.【答案】D【解析】解:设{a n}是等比数列的公比为q,因为a2=2,a3=﹣4,所以q===﹣2,所以a1=﹣1,根据S5==﹣11.故选:D.【点评】本题主要考查学生运用等比数列的前n项的求和公式的能力,本题较易,属于基础题.11.【答案】C【解析】解:∵向量=(2,﹣3,5)与向量=(3,λ,)平行,∴==,∴λ=﹣.故选:C.【点评】本题考查了空间向量平行(共线)的问题,解题时根据两向量平行,对应坐标成比例,即可得出答案.12.【答案】C【解析】考点:茎叶图,频率分布直方图.二、填空题13.【答案】②【解析】解:由MP,OM分别为角的正弦线、余弦线,如图,∵,∴OM<0<MP.故答案为:②.【点评】本题的考点是三角函数线,考查用作图的方法比较三角函数的大小,本题是直接比较三角函数线的大小,在大多数此种类型的题中都是用三角函数线比较三个函数值的大小.14.【答案】3x﹣y﹣11=0.【解析】解:设过点P(4,1)的直线与抛物线的交点为A(x1,y1),B(x2,y2),即有y12=6x1,y22=6x2,相减可得,(y1﹣y2)(y1+y2)=6(x1﹣x2),即有k AB====3,则直线方程为y﹣1=3(x﹣4),即为3x﹣y﹣11=0.将直线y=3x﹣11代入抛物线的方程,可得9x2﹣72x+121=0,判别式为722﹣4×9×121>0,故所求直线为3x﹣y﹣11=0.故答案为:3x﹣y﹣11=0.15.【答案】.【解析】解:∵数列{a n}满足a1=1,且a n+1﹣a n=n+1(n∈N*),∴当n≥2时,a n=(a n﹣a n﹣1)+…+(a2﹣a1)+a1=n+…+2+1=.当n=1时,上式也成立,∴a n=.∴=2.∴数列{}的前n项的和S n===.∴数列{}的前10项的和为.故答案为:.16.【答案】=1【解析】解:由题意得,圆心C(1,0),半径等于4,连接MA,则|MA|=|MB|,∴|MC|+|MA|=|MC|+|MB|=|BC|=4>|AC|=2,故点M的轨迹是:以A、C为焦点的椭圆,2a=4,即有a=2,c=1,∴b=,∴椭圆的方程为=1.故答案为:=1.【点评】本题考查用定义法求点的轨迹方程,考查学生转化问题的能力,属于中档题.17.【答案】45.【解析】解:第三项的系数为C n2,第五项的系数为C n4,由第三项与第五项的系数之比为可得n=10,则T i+1=C10i(x2)10﹣i(﹣)i=(﹣1)i C10i=,令40﹣5r=0,解得r=8,故所求的常数项为(﹣1)8C108=45,故答案为:45.18.【答案】4.【解析】解:函数y=ln(﹣2x)为奇函数,可得f(﹣x)=﹣f(x),ln(+2x)=﹣ln(﹣2x).ln(+2x)=ln()=ln().可得1+ax2﹣4x2=1,解得a=4.故答案为:4.三、解答题19.【答案】【解析】解:(1)当a=﹣1时,直线化为y+3=0,不符合条件,应舍去;当a≠﹣1时,分别令x=0,y=0,解得与坐标轴的交点(0,a﹣2),(,0).∵直线l在两坐标轴上的截距相等,∴a﹣2=,解得a=2或a=0;(2)∵A(﹣2,4),B(4,0),∴线段AB的中点C坐标为(1,2).又∵|AB|=,∴所求圆的半径r=|AB|=.因此,以线段AB为直径的圆C的标准方程为(x﹣1)2+(y﹣2)2=13.20.【答案】【解析】证明:(I)∵数列{a n}为等比数列,a1=,q=∴a n=×=,S n=又∵==S n∴S n=(II )∵a n =∴b n =log 3a 1+log 3a 2+…+log 3a n =﹣log 33+(﹣2log 33)+…+(﹣nlog 33)=﹣(1+2+…+n )=﹣∴数列{b n }的通项公式为:b n =﹣【点评】本题主要考查等比数列的通项公式、前n 项和以及对数函数的运算性质.21.【答案】(本小题满分12分)解:本题考查频率分布直方图,以及根据频率分布直方图估计中位数与平均数. (Ⅰ)由(0.0050.0150.020.025)101a ++++⨯=得0.035a = (3分)每天销售量的中位数为0.15701074.30.35+⨯=千克 (6分) (Ⅱ)若当天的销售量为[50,60),则超市获利554202180⨯-⨯=元;若当天的销售量为[60,70),则超市获利654102240⨯-⨯=元; 若当天的销售量为[70,100),则超市获利754300⨯=元, (10分) ∴获利的平均值为0.151800.22400.65300270⨯+⨯+⨯=元. (12分) 22.【答案】【解析】解:(1)=;∴=;∴;(2)同理可求得;;∴=.【点评】考查向量数量积的运算及其计算公式,根据求的方法,以及向量夹角余弦的计算公式.23.【答案】(1)22143x y +=;(2)点R 在定直线1x =-上. 【解析】试题解析:(1)由12e =,∴2214e a =,∴2234a b =7=,解得2,a b ==,所以椭圆C 的方程为22143x y +=.设点R 的坐标为00(,)x y ,则由MR RN λ=-⋅,得0120()x x x x λ-=--, 解得1121221212011224424()41()814x x x x x x x x x x x x x x x λλ++⋅-+++===+-++++又2212122226412322424()24343434k k x x x x k k k---++=⨯+⨯=+++,212223224()883434k x x k k -++=+=++,从而121201224()1()8x x x x x x x ++==-++, 故点R 在定直线1x =-上.考点:1.椭圆的标准方程与几何性质;2.直线与椭圆的位置关系. 24.【答案】【解析】AB。
贵州省毕节市大方县三中2025届化学高一第一学期期中统考模拟试题含解析

贵州省毕节市大方县三中2025届化学高一第一学期期中统考模拟试题注意事项1.考生要认真填写考场号和座位序号。
2.试题所有答案必须填涂或书写在答题卡上,在试卷上作答无效。
第一部分必须用2B 铅笔作答;第二部分必须用黑色字迹的签字笔作答。
3.考试结束后,考生须将试卷和答题卡放在桌面上,待监考员收回。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、某学习小组辨析以下说法:①粗盐和酸雨都是混合物;②非金属氧化物一定都是酸性氧化物;③冰和干冰既是纯净物又是化合物;④Na2O、Na2O2都是钠的氧化物,都是碱性氧化物;⑤磷酸和醋酸都是多元酸;⑥纯碱和烧碱都是碱。
其中正确的是()A.②③⑥B.①②④C.①③D.③⑤2、下列反应的离子方程式书写正确的是()A.钠和冷水反应Na +2H2O =Na+ +2OH-+H2↑B.金属铝溶于氢氧化钠溶液Al +2OH-=AlO2-+H2↑C.金属铝溶于盐酸中:2Al +6H+=2Al3+ +3H2↑D.铁跟稀硫酸反应:2Fe +6H+=2Fe3++3H2↑3、甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入A克的铝粉,反应结束后测得生成的气体体积为甲:乙=3:4,下列说法正确的是( )A.参加反应的H2SO4为0.2mol B.参加反应的NaOH约为0.27molC.加入铝粉的质量A=5.4 D.与硫酸反应的铝粉的质量7.2g4、下列物质中含有自由移动的Cl-的是()A.KClO3溶液B.液态HCl C.KCl固体D.MgCl2溶液5、下列关于1 mol·L-1碳酸钠溶液的说法中,不正确...的是A.1mol Na2CO3溶于1 L水中B.1 L溶液中含有106 g Na2CO3C.1 L溶液中含有1mol Na2CO3D.106g Na2CO3溶于少量水后,再加水稀释至1000 mL6、下列说法正确的是()A.食盐溶液静置会分层,上层比下层咸B.“冰水混合物”是一种分散系C.黄河入海口处三角洲的形成与胶体性质有关D.电泳现象说明胶体带电7、下列离子能大量共存的是( )A .能使无色酚酞试液呈红色的溶液中:Na +、K +、SO 42-、CO 32-B .无色透明的溶液中:Cu 2+、K +、SO 42-、NO 3-C .含有大量Ba(NO 3)2的溶液中:Mg 2+、NH 4+、SO 42-、Cl -D .能使紫色石蕊试液呈红色的溶液中:Ca 2+、K +、HCO 3-、NO 3-8、稀土资源素有“工业维生素”“新材料之母”之称,我国稀土储量世界第一。
贵州省大方县第一中学2018届高三上学期第一次月考化学试题含解析

贵州省大方县第一中学2018届高三上学期第一次月考化学试题(解析版)贵州省大方县第一中学2018届高三上学期第一次月考化学试题1.下列有关物质性质的应用正确的是( )A. 液氨汽化时要吸收大量的热,可用作制冷剂B。
二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸C。
生石灰能与水反应,可用来干燥氯气D。
氯化铝是一种电解质,可用电解法制铝【答案】A【解析】试题分析:A.液氨汽化时要吸收大量的热,,从而可以使环境的温度降低,因此可用作制冷剂,正确;B.二氧化硅不与强酸反应,但是可以与氢氟酸发生反应,而石英器皿中的含义大量的二氧化硅,因此不可用石英器皿盛放氢氟酸,错误;C.生石灰能与水反应,也可以与Cl2发生反应,因此不可用来干燥氯气,错误;D.氯化铝是一种电解质,但是由于该物质是分子晶体,无离子,因此不能用于电解制铝,错误。
考点:考查有关物质性质的应用的正误判断的知识。
2.中华民族有着光辉灿烂的发明史.下列发明创造不涉及化学反应的是( )A. 用胆矾炼铜B。
用铁矿石炼铁C. 烧结粘土制陶瓷D. 打磨磁石制指南针【答案】D【解析】试题分析:A、胆矾为硫酸铜晶体,铜为化合态,+2价,金属铜为单质,由化合态变为游离态,需加入还原剂发生反应,A不正确;B、铁矿石炼主要成份为氧化铁,铁为+3价,,由化合态变为游离态铁,需加入还原剂发生反应,B不正确;C.烧结粘土主要成份为复杂的硅酸盐,烧结粘土制陶瓷过程中会发生复杂的物理化学变化,C不正确;.D.磁石为四氧化三铁,打磨磁石制指南针的过程为物理变化过程。
D正确考点:常见物质的制备过程涉及到的化学反应知识。
3。
某学生的实验报告中有如下数据:①用托盘天平称取11。
7 g食盐;②用量筒量取21。
48 mL盐酸;③用容量瓶配制210 mL 1 mol·L-1的硫酸溶液;④用标准NaOH溶液滴定未知浓度的盐酸,用去18.20 mL NaOH溶液,其中数据合理的是( )A。
2017-2018学年度第一学期高一第一次月考成绩统计表
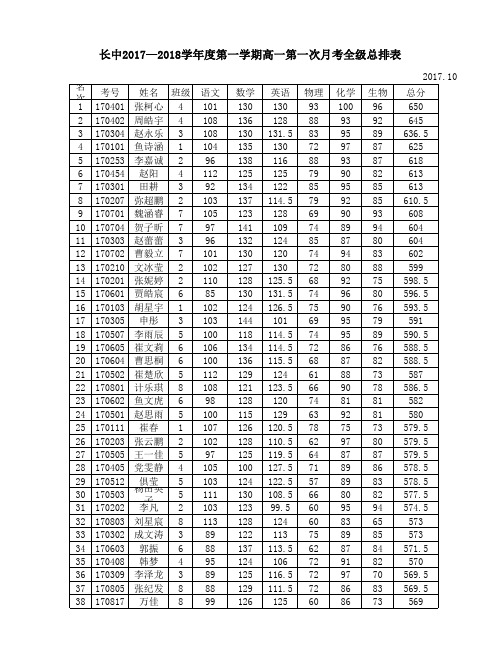
长中2017—018学年度第一学期高一第一次月考全级总排表
2017.10 名次 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 考号 170614 170104 170822 170712 170107 170834 170114 170115 170311 170708 171055 170318 170417 170815 170333 170519 170624 170217 170215 170308 170729 170514 170516 170617 170809 170811 170225 170711 170411 170610 170223 170406 170234 170108 170618 170211 170508 170616 姓名 班级 司梦晨 6 惠嘉康 1 胡叶叶 8 周逸飞 7 鱼朝阳 1 弥田 8 高金枝 1 尚甜甜 1 陈宝玲 3 李阳 7 杨广 10 杨扬 3 宇文雅 4 郭钾 8 黎佳昊 3 于莹莹 5 全宝婷 6 张晨 2 洪亦璇 2 李昭伟 3 解欣 7 陈雪彤 5 景凡 5 李一杰 6 党佳杰 8 尚国梁 8 罗睿青 2 剡心怡 7 梁娜 4 高星 6 曹亚鹏 2 曹锐洋 4 申岩 2 司帅 1 王帅 6 李煜 2 贾文丽 5 尚丁 6 语文 98 96 89 82 102 103 93 97 90 88 100 88 95 94 87 98 101 95 108 93 102 101 99 94 89 87 91 84 84 107 83 100 92 94 92 90 102 91 数学 117 126 117 119 101 126 112 109 107 120 118 101 103 119 113 115 124 92 97 108 120 116 111 113 138 118 114 123 118 125 123 98 111 102 133 113 112 110 英语 114 100 123.5 89.5 109 105.5 101.5 123 113 98.5 76 113 114.5 81.5 86.5 104 114.5 105.5 106.5 101.5 108 113 78 90.5 87 111.5 99 105 72 79.5 84.5 108.5 73 95.5 109.5 67.5 117 76 物理 57 60 67 67 70 48 66 50 58 65 64 61 63 62 80 59 42 69 47 45 56 42 62 55 44 57 65 56 74 50 62 69 80 68 56 70 52 67 化学 73 85 83 90 73 76 86 82 92 87 82 82 87 86 81 72 72 84 84 89 62 70 86 89 88 80 76 76 95 86 78 76 84 86 80 90 55 95 生物 77 68 54 86 78 74 74 71 71 72 89 83 64 84 79 78 72 79 79 85 72 78 84 78 73 65 72 73 73 68 84 62 73 67 42 82 74 73 总分 536 535 533.5 533.5 533 532.5 532.5 532 531 530.5 529 528 526.5 526.5 526.5 526 525.5 524.5 521.5 521.5 520 520 520 519.5 519 518.5 517 517 516 515.5 514.5 513.5 513 512.5 512.5 512.5 512 512
2024届贵州毕节大方县三中 高一化学第一学期期末质量跟踪监视试题含解析

2024届贵州毕节大方县三中高一化学第一学期期末质量跟踪监视试题请考生注意:1.请用2B铅笔将选择题答案涂填在答题纸相应位置上,请用0.5毫米及以上黑色字迹的钢笔或签字笔将主观题的答案写在答题纸相应的答题区内。
写在试题卷、草稿纸上均无效。
2.答题前,认真阅读答题纸上的《注意事项》,按规定答题。
一、选择题(每题只有一个选项符合题意)1、下列说法正确的是()A.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClOB.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+2、下列实验操作对应的现象符合事实的是A.将浓盐酸滴入后产生黄绿色气体B.通电一段时间后,收集b处气体,可做爆鸣实验C.出现苍白色火焰,集气瓶口有白雾D.试管中产生白色沉淀,较长时间不变色3、在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子A.Fe2+B.Fe3+ 和Fe2+C.Cu2+ 和Fe2+D.Cu2+4、关于Na2CO3与NaHCO3的性质判断正确的是()A.常温下溶解度:Na2CO3<NaHCO3B.热稳定性:Na2CO3<NaHCO3C.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3D.与澄清石灰水反应,均有白色沉淀生成5、“嫦娥飞天、玉兔登月”,实现了中华民族“九天揽月”的伟大梦想。
制造登月车太阳能电池板的半导体材料是()A.铝合金B.二氧化硅C.硅D.铁合金6、某同学设计下列实验装置进行氯气的性质实验。
玻璃管内装有分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是()①②③④A 白色先变红色后无色橙色蓝色B 无色红色橙色紫色C 无色白色橙色蓝色D 白色无色无色紫色A.A B.B C.C D.D7、下列化合物中,能通过单质之间化合反应制取的是A.FeCl3B.SO3C.NO2D.FeCl28、下列关于从碘水中萃取碘的说法正确的是:A.可以使用苯、酒精等有机溶剂完成萃取B.使用四氯化碳进行萃取后,下层呈棕色,含有较多的碘C.使用四氯化碳进行萃取后,上层呈棕色,含有较多的碘D.萃取后得到四氯化碳的碘溶液可以采用蒸馏的方法获得碘单质9、将10.6 g Na2CO3溶于水配制成1000 mL 溶液,从中取出20 mL,该溶液中Na+的物质的量浓度为()A.0.1 mol/L B.0.2 mol/L C.0.05 mol/L D.0.025 mol/L10、下列反应过程中不存在电子转移的是()A.Zn+2HCl=ZnCl2+H2↑B.Ca(ClO)2+2HCl=CaCl2+2HClOC.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2OD.3Cl2+6KOH(浓)5KCl+KClO3+3H2O11、中国-094核潜艇上的核反应堆内使用了液体钠铝合金(单质钠和单质铝熔合而成,可看作二者的混合物)做载热介质,有关说法不正确的是A.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na)C.m g 钠铝合金投入足量水中,若所得溶液只含一种溶质,则其中含有钠的质量为0.46m gD.若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则钠的质量分数越大12、类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否。
贵州毕节大方县三中2025届化学高一第一学期期中经典试题含解析

贵州毕节大方县三中2025届化学高一第一学期期中经典试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题(每题只有一个选项符合题意)1、对危险化学品要在包装标签上印有警示性标志。
氢氧化钠应选用的标志是A .B .C .D .2、如果反应4P + 3KOH + 3H2O =3KH2PO2+ PH3中转移0.6mol电子,消耗KOH的质量为()A.5.6克B.16.8克C.33.6克D.100.8克3、常温下,在溶液中可发生以下反应:①1Fe1++Br1=1Fe3++1Br-②1Br-+Cl1=Br1+1Cl-③1Fe3++1I-=1Fe1++I1.由此判断下列说法正确的是A.铁元素在反应①中被还原,在③中被氧化B.反应②中当有1mol Cl1被氧化时,有1mol Br-被还原C.氧化性强弱顺序为:Cl1>I1>Br1>Fe3+D.还原性强弱顺序为:I->Fe1+>Br->Cl-4、下列实验中,所选装置或实验设计合理的是分离碘单质和四氯化碳分离酒精和水的混合物硫酸铜溶液制取胆矾晶体用浓硫酸干燥CO2气体A B C DA.A B.B C.C D.D5、中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。
该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金"。
下列有关说法中,你认为错误的是()A.Na的还原性强于金刚石B.另一种化合物是NaClC.纳米级金刚石粉末属于胶体D.这个反应是置换反应6、下列有关氯气及含氯化合物的说法不正确的是()A.氯气能与大多数金属化合,其一般将变价金属氧化至最高价B.氯气与水反应,氯气既是氧化剂又是还原剂C.氯水呈黄绿色是因为溶液中含有氯气分子D.因为氯气有毒,所以可用于杀菌、消毒、漂白7、将4g NaOH溶于水,配成500mL溶液,其物质的量浓度为A.0.1 mol B.20﹪C.0.2 mol/L D.0.2 L/mol8、下列叙述中,正确的是A.含金属元素的离子一定都是阳离子B.金属阳离子被还原不一定得到金属单质C.某元素从化合态变为游离态时,该元素一定被还原D.在氧化还原反应中,非金属单质一定是氧化剂9、体积为1L干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082。
2017-2018学年度第二学期教职工量化考核统计表

0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
0 0 0 0 0 -2 0 0 0 -0.2 0 0 0 0 0 0 0 0 0 0 -0.2 0 0 -0.1 0 -0.1 0 0 0 0
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
全 校 名 次
31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60
1语文 1语文 1语文 1语文 1语文 1语文 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学 2数学
0 2 0 0 0 2 2 0 0 0 0 0 0 0 0 0 0 2 2 1.5 0 0 0 0 0 0 0 0 0 2
0 0 0 0 0 0 0 0 0 0 0.5 0 0 0 0 0 0 0.5 0 0 0.5 0 0 0 0 0 0 0 0 0
0.5 1 0.5 0.5 2 1.5
95.89 102.51 94.21 95.53 95.89
1
2
3
4
0.5
0.5
1 按细则 按细则 0.5 0.2 2.00 0.00 -0.75 0.25 0.00 0.00 2.50 0.00 0.00 0.75 0.00 0.00 -0.75 2.83 0.50 1.25 0.25 0.00 0.25 0.50 0.00 4.00 1.00 1.00 0.75 0.75 1.50 2.00 -1.50 -0.50 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 1 0.5
贵州省毕节市大方县三中 2017-2018学年高一上学期第一次月考物理试题

贵州省毕节市大方县三中 2017-2018学年高一上学期第一次月考物理试题一、单选题1. 质点是一个理想化模型.下列说法正确的是()A.在苹果园摘苹果,找成熟的大的苹果,可将苹果视为质点B.导弹将目标锁定敌舰的要害,如弹药舱,可将敌舰视为质点C.计算飞机在两地间的往返时间,可将飞机视为质点D.研究月球车在月球表面抓月球土壤的动作,可将月球车视为质点2. 宋代诗人陈与义乘着小船在风和日丽的春日出游时曾写下了一首诗,其中两句是“卧看漫天云不动,不知云与我俱东”,表达了他对运动相对性的理解,诗中这两句中涉及的参考系分别是()A.岸和船B.船和岸C.都是岸D.都是船3. 第一次比世界大战期间,一位法国飞行员在飞行时,用手抓住了一颗德军射出的子弹,这个飞行员能很容易地抓住子弹的原因是()A.子弹飞行的速度很小B.飞行员飞行的速度不大C.子弹相对飞行员的速度很小D.子弹相对飞行员的速度很大4. 如图所示,一个质点沿两个半径为R的半圆弧由A运动到C,规定向右方向为正方向,在此过程中,它的位移大小和路程分别为( )A.−4R,−2πR B.4R,−2πRC.−4R,2πR D.4R,2πR5. 中国运动员苏炳添在国际田联钻石联赛百米赛跑中,以9.99s的成绩成为突破10s大关的第一个亚洲人.高科技记录仪测得他冲刺时的最大速度约为11.60m/s.则他在全程的平均速度的大小约为()A.11.60m/sB.10.01m/sC.9.99m/sD.9.28m/s6. 关于时间和时刻,下列说法正确的是()A.时间很长,时刻很短B.第4s内和4s内都是一段时间间隔C.光束在一瞬间通过1毫米的距离,这一瞬间可以看成是时刻D.“天宫”一号是中国第一个目标飞行器,于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,指的是时刻二、多选题7. 下列说法中的“快”,表示加速度较大的是()A.“和谐号”动车行驶得很快B.从滕州开汽车去济南,走高速公路能很快到达C.正常行驶的汽车在紧急刹车的情况下,能很快停下来D.小轿车比大卡车启动得快三、填空题A .从运动学角度的定义,“加速度的变化率”的单位应是m/s 3B .加速度的变化率为0的运动是匀速直线运动C .若加速度与速度同方向,如图所示的a- t 图象,表示的是物体的速度在减小D .若加速度与速度同方向,如图所示的a -t 图象,已知物体在t =0时速度为5m/s ,则2s 末的速度大小为8m/s9. 如图所示甲、乙两物体运动的速度图象,由图可知乙物体运动的初速度是______m /s ,甲物体的加速度是______m /s 2.10. 如图为某汽车途径我省东线高速时乘客看到的路边交通标志(经化简),甲为路线指示标志,乙为限速标志.其中的数字具有确定的含义:甲中数字指______ (选填“路程”或“位移”),乙中数字指______ (“平均速度”或“瞬时速度”);在不违反交通规则的情况下,车辆从该处到过三亚至少需要______小时.本不变)使人感到舒服,否则人会感到不舒服,关于“加速度的变化率”,下列说法正确的是()8.运动学中有人认为引入“加速度的变化率”没有必要,然而现在有人指出“加速度的变化率”能引起人的心理效应,车辆的平稳加速(即加速度基四、实验题11. 下面各图所示均为变速运动的v t 图象,试找出下列各运动与之对应的图象,把字母填在相应的空格内.(1)汽车从静止开始加速,然后做减速运动,直至停止________;(2)汽车减速至停止,一段时间后又加速出发________;(3)小球滚上斜面后又反向滚回,由于斜面光滑,整个过程加速度不变________;(4)小球从高处由静止落到地面后又反向弹起______。
贵州省毕节市大方县三中 2024学年化学高二上期末考试模拟试题含解析

贵州省毕节市大方县三中2024学年化学高二上期末考试模拟试题注意事项1.考生要认真填写考场号和座位序号。
2.试题所有答案必须填涂或书写在答题卡上,在试卷上作答无效。
第一部分必须用2B 铅笔作答;第二部分必须用黑色字迹的签字笔作答。
3.考试结束后,考生须将试卷和答题卡放在桌面上,待监考员收回。
一、选择题(每题只有一个选项符合题意)1、有一张照片,一只可爱的小猫站在一块高分子合成材料上,下面是烈火灼烧,而小猫却若无其事。
这说明此高分子材料一定具有的性质是A.良好的导热性B.良好的绝缘性C.良好绝热性D.熔点低2、下列事实不属于盐类水解应用的是A.明矾净水B.使用热的纯碱溶液去除油污C.实验室配制FeCl3溶液时加入少量稀盐酸D.向FeCl3溶液中加入NaOH溶液产生红褐色沉淀3、已知:pAg=-lg[c(Ag+)],K sp(AgCl)=1×10-12,如图是向10mL AgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象。
根据图象所得下列结论不正确的是[提示:K sp(AgCl)>K sp(AgI)]A.原AgNO3溶液的物质的量浓度为1mol·L-1B.图中x点满足c(Ag+)·c(Cl-)= K s p(AgCl)C.相同实验条件下,把0.1mol·L-1的NaCl换成0.1mol·L-1NaI则图象在终点x的纵坐标小于6D.相同实验条件下,若改为0.2mol·L-1 NaCl溶液时,x点的横坐标小于1004、已知:常温下,0.01 mol/L MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol -1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。
则MOH在水溶液中电离的ΔH为( )A.-69.4 kJ·mol-1B.-45.2 kJ·mol-1C.+69.4 kJ·mol-1D.+45.2 kJ·mol-15、用标准HCl溶液滴定未知浓度的NaOH溶液,若测定结果偏低,产生误差的原因可能的A.锥形瓶用蒸馏水洗净后,未经干燥就装入待测液进行滴定B. 滴定前酸式滴定管尖嘴部分有气泡,滴定终点时气泡消失C.酸式滴定管未用标准HCl溶液润洗D.把NaOH待测液移入锥形瓶中时,有少量碱液溅出6、下列叙述与图象对应符合的是A.对于达到平衡状态的N2(g)+3H2(g) 2NH3(g) 在t0时刻充入了一定量的NH3,平衡逆向移动B.对于反应2A(g)+B(g)C(g)+D(g) ΔH < 0,p2 > p1,T1 > T2C.该图象表示的化学方程式为:2A===B+3CD.对于反应2X(g)+3Y(g) 2Z(g) ΔH < 0,y可以表示Y的百分含量7、燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)反应将化学能转变为电能的装置。
人教版高中化学必修二-第二学期大方实验高中高一年级第三次月考检测卷.docx

——————————新学期新成绩新目标新方向——————————高中化学学习材料2015-2016学年度第二学期大方实验高中高一年级第三次月考检测卷化学满分:100分,考试时间:90分钟注意事项:1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上第I卷(选择题)评卷人得分一、选择题(单选题)(本大题共14小题,每小题3分,共42分。
)1.下列化学用语书写正确的是()A.氯原子的结构示意图:B.作为相对原子质量测定标准的碳的核素:C.氯化镁的电子式:D.用电子式表示氯化氢分子的形成过程:2.下列反应中,属于吸热反应的是()A.木炭在空气中燃烧B.氢气在氯气中燃烧C.盐酸和氢氧化钠溶液反应D.Ba(OH)2·8H2O与NH4Cl反应3.用N A表示阿伏伽德罗常数的值,下列说法正确的是()A.1 mol OH-中含有9N A个电子B.28 g CO气体中含有N A个氧原子C.1 mol/L AlCl3溶液中含有N A个Al3+D.常温常压下,11.2 L甲烷气体中含有的分子数为0.5N A4.X、Y、W、R、T是前17号元素中的5种,X、Y位于同主族,Y原子的最外层电子数与次外层电子数相等,R原子的最外层电子数为次外层电子数的3倍,T无正价,W单质用于制造计算机芯片,下列说法不正确的是()A.气态氢化物稳定性:W<T B.离子半径:X<RC.最高价氧化物对应水化物碱性:X>Y D.Y单质能与冷水剧烈反应5.反应A(g)+3B(g) 2C(g)+2D(g)在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是()A.V(A)=0.15 mol/(L·min) B.V(B)=0.04mol/(L·s)C.V(C)=0.03 mol/(L·s) D.V(D)=0.4mol/(L·min)6.已知断开1molH-H键吸收的能量为436KJ,形成1molH-N键放出的能量为391KJ,根据化学方程式N2+3H2催化剂高温高压2NH3,反应完1molN2放出的能量为92.4KJ,则断开1molN≡N键吸收的能量是()A.431KJ B.649KJ C.869KJ D.945.6KJ7.如图所示装置,电流计的指针发生偏转,正极产生气泡,负极变细,符合这种情况的是()——————————新学期新成绩新目标新方向——————————A.正极Cu,负极Al,S为浓HNO3B.正极Ag,负极Al,S为NaOHC.正极Ag,负极Cu,S为浓HClD.正极Zn,负极Cu,S为H2SO48.下列各组物质中,互称为同分异构体的是()A.H、D与TB.O2与O3C.与HHCCH3CH3CHHCH3CH3D.C与CH3CH3CH3CH3CHCH2CH3CH3CH39.如图是常见四种有机物的比例模型示意图。
大方县第三中学校2018-2019学年上学期高二期中化学模拟题

大方县第三中学校2018-2019学年上学期高二期中化学模拟题 班级__________ 座号_____ 姓名__________ 分数__________一、选择题1. 向MgCl 2、AlCl 3的混合溶液中,开始滴加试剂X ,之后改滴试剂Y ,所得沉淀的物质的量n (mol )与试剂体积V (mL )间的关系如图所示。
以下结论错误的是( )A .X 是盐酸,Y 是NaOH 溶液,且c (Y )=2c (X )B .原混合液中,c (Al 3+)∶c (Mg 2+)∶c (Cl -)=1∶1∶5C .X 是NaOH 溶液,Y 是盐酸,且c (NaOH )∶c (HCl )=2∶1D .从7至9相应的离子方程式为H ++OH -===H 2O2. 化工生产中含Cu 2+的废水常用MnS (s )作沉淀剂,其反应原理为:Cu 2+(aq ) + MnS (s ) CuS (s )+Mn 2+(aq )。
下列有关该反应的推理不正确的是 A .该反应达到平衡时c (Cu 2+)=c (Mn 2+) B .CuS 的溶解度比MnS 的溶解度小C .往平衡体系中加入少量Cu (NO 3)2(s )后,c ( Mn 2 +)变大D .该反应平衡常数表达式:K=K sp (MnS)K sp (CuS)3. 下列有关有机物的结构说法不正确的是( ) A .溴苯中的所有原子处于同一平面中 B .氯乙烯中所有原子不可能处于同一平面中C .3-甲基戊烷的一氯代产物有4种(不考虑立体异构)D .分子式为C 3H 6Cl 2的同分异构体共有4种(不考虑立体异构) 4. 下列陈述Ⅰ、Ⅱ正确并且有因果关系的是5. 反应A+B →C (△H <0)分两步进行:①A+B →X (△H >0),②X →C (△H <0).下列示意图中,能正确表示总反应过程中能量变化的是6. 用式量是71的烃基取代乙苯苯环上的一个氢原子,能得到的有机物共有(不含立体异构)( ) A .8种 B .16种 C .24种 D .36种7. 下列有关实验现象或结论的描述不正确的是( )A .FeCl 2溶液与铁氰化钾液混合后得到特征蓝色沉淀,利用此反应可检验Fe 2+B .向饱和食盐水中加入少量浓盐酸,看到溶液振荡,溶液变浑浊C .某温度下,向AgCl 饱和溶液中加入蒸馏水,AgCl 的溶解度、Ksp 均增大D .处理含有Hg 2+离子的废水可加入硫化钠,使Hg 2+离子转化为HgS 沉淀 8. 根据下列事实得出的结论正确的是 A .试样产生银镜 结论:该试样是醛类B .某卤代烃试样最终的沉淀不是白色;结论:该卤代烃中不含氯原子C .往淀粉溶液中加入稀硫酸并且加热一段时间,再加入新制的氢氧化铜悬蚀液再加热。
2025届贵州省毕节市大方县三中化学高一上期末调研模拟试题含解析

2025届贵州省毕节市大方县三中化学高一上期末调研模拟试题注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折暴、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
一、选择题(每题只有一个选项符合题意)1、下列排序不正确的是A.单质的熔点:钾<铷<铯B.离子半径:S2->Na+>Mg2+C.热稳定性:HF>H2O>H2SD.酸性:H2SiO3<H3PO4<H2SO42、发明了“联合制碱法”的科学家是()A.侯德榜B.拉瓦锡C.门捷列夫D.张青莲3、下列装置用于实验室制氨气或验证氨气的化学性质,其中能达到实验目的的是()A.用装置甲制取氨气B.用装置乙除去氨气中的水蒸气C.用装置丙验证氨气具有还原性D.用装置丁吸收尾气4、下列有关0.2mol·L-1 BaCl2溶液的说法不正确的是( )A.500mL溶液中Cl-离子浓度为0.2mol·L-1B.500mL溶液中Ba2+离子浓度为0.2mol·L-1C.500mL溶液中Cl-离子总数为0.2N AD.500mL溶液中Ba2+和Cl-离子总数为0.3N A5、向Fe2+、I-、Br-的溶液中通入适量Cl2,溶液中各种离子的物质的量变化如图所示。
下列有关说法正确的是( )A.线段BC代表Cl-物质的量的变化情况B.原混合溶液中c(FeBr2)=6mol·L-1C.当通入2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-D.原溶液中n(Fe2+):n(I-):n(Br-)=2:2:36、鲜榨苹果汁是人们喜爱的饮料,这种饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色.若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生.对此分析正确的是A.现榨的苹果汁具有氧化性B.现榨的苹果汁具有还原性C.棕黄色为Fe2+的特征色D.维生素C具有抗还原性7、朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景本质原因是A.雾是一种胶体B.空气中的小水滴颗粒的布朗运动C.发生丁达尔现象D.空气中的小水滴颗粒直径大小约为1~100 nm8、下列离子反应方程式正确的:A.向氯化亚铁溶液中通入氯气Fe2++Cl2 = Fe3++2Cl-B.石灰石跟盐酸反应CO32-+2H+=CO2↑+ H2OC.氢氧化钡溶液与稀硫酸反应H++OH-=H2OD.用金属钠除去苯中的水:2Na+ + 2H2O =2Na++2OH-+ H2↑9、用N A表示阿伏加德罗常数的值,下列叙述正确的是()A.含有N A个原子的氢气在标准状况下的体积约为22.4LB.1molNa2O2中含有4N A个离子C.0.1molNH4+中含有的质子数为N AD.常温常压下,64gSO2中含有的原子数为3N A10、下列几种说法中正确的是()A.摩尔是化学上常用的一个物理量B.某物质含有6.02×1023个微粒,含有这个数目微粒的物质一定是1mol C.1摩尔氢气分子可以表示为1molH2D.硫酸的摩尔质量为98g11、下列反应属于非氧化还原反应的是()A.Fe2O3+3CO 高温2Fe+3CO2B.NH4NO3加热N2O↑+2H2OC.2NaHCO3加热Na2CO3+CO2↑+H2OD.CuO+CO═Cu+CO212、已知:2Fe2++Cl2===2Fe3++2Cl﹣;HClO+HCl===Cl2+H2O;2Fe3++Cu===2Fe2++Cu2+;Fe+Cu2+===Fe2++Cu,下列各组物质氧化性强弱顺序正确的是()A.Fe3+>HClO>Cl2>Fe2+>Cu2+B.HClO>Cl2>Fe3+>Cu2+>Fe2+C.Cl2>HClO>Fe3+>Cu2+>Fe2+D.HClO>Fe3+>Cl2>Cu2+>Fe2+13、需克服相同类型作用力的是( )A.碘、干冰升华B.硅、冰块熔化C.氯化氢、氯化钠溶于水D.溴、汞气化14、下列变化过程属于还原反应的是( )A.HCl→MgCl2B.Na→Na+C.CO→CO2D.Fe3+→Fe15、食盐在不同分散剂中形成不同分散系:分散系1:食盐分散在水中形成无色透明溶液分散系2:食盐分散在乙醇中形成无色透明胶体下列说法正确的是A.分散系1是纯净物B.分散系2可以用滤纸分离C.可用丁达尔效应区分两种分散系D.两种分散系中分散质粒子直径相同16、证明某溶液只含有Fe2+而不含有Fe3+的实验方法是A.先滴加氯水,再滴加KSCN溶液后显红色B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色C.滴加NaOH溶液,产生白色沉淀D.只需滴加KSCN溶液二、非选择题(本题包括5小题)17、某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单科统计--大方三中2017-2018学年度第一学期高一第二次月考 授课教师 总人数 实考人数 缺考人数 最高分 最低分 平均分 优秀率% -1437 1408 29 66 3 29.13 0 周勇 58 57 1 60.5 20 34.79 0 周勇 57 57 0 51 18 32.76 0 张云青 63 62 1 65 15 29.82 0 卢梅 64 62 2 52 12 30.51 0 陆关龙 65 64 1 55 16 30.48 0 杨燕 64 63 1 53 16 30.82 0 卢梅 64 64 0 52.5 14.5 35.01 0 陆关龙 64 64 0 47 11.5 27.1 0 陆关龙 63 61 2 50.5 12 27.93 0 张云青 64 59 5 45.5 15 26.11 0 陆关龙 63 63 0 57 17.5 29.12 0 张云青 63 59 4 54 13.5 28.95 0 张云青 63 63 0 51 3 26.05 0 张华 63 61 2 44.5 13.5 27.26 0 李露 60 59 1 66 12 26.84 0 杨燕 62 62 0 49.5 11.5 29.35 0 杨燕 62 62 0 56.5 12 28.6 0 彭焕芬 62 59 3 47 12 28.69 0 陈红艳 62 59 3 55 10 28.6 0 卢梅 62 62 0 43 12 28.08 0 卢梅 63 63 0 47 16 25.39 0 周勇 62 60 2 63 10 31.33 0 杨燕 64 63 1 48 13.5 26.91 0
及格率% 3.83 8.77 10.53 3.23 3.23 6.25 1.59 6.25 1.56 1.64 0 6.35 3.39 3.17 0 3.39 3.23 3.23 1.7 3.39 0 1.59 13.33 3.17
低分率% 标准差 63.85 8.66 38.6 8.14 43.86 8.98 59.68 8.69 58.06 8.52 62.5 8.44 52.38 7.63 28.12 8.72 71.88 7.43 60.66 8.18 79.66 6.42 66.67 8.79 64.41 8.2 77.78 8.06 70.49 7.01 77.97 8.65 61.29 8.05 64.70.97 7.74 84.13 7.01 63.33 12.92 79.36 7.52
班级 全部考生 高一年级1班 高一年级2班 高一年级3班 高一年级4班 高一年级5班 高一年级6班 高一年级7班 高一年级8班 高一年级9班 高一年级10班 高一年级11班 高一年级12班 高一年级13班 高一年级14班 高一年级15班 高一年级16班 高一年级17班 高一年级18班 高一年级19班 高一年级20班 高一年级21班 高一年级22班 高一年级23班
