§4-4 乙醛 醛类(小高考)
《乙醛》 讲义

《乙醛》讲义一、乙醛的基本信息乙醛,化学式为 C₂H₄O,结构简式为 CH₃CHO,是一种醛类有机化合物。
它在常温常压下是一种无色、易挥发、具有刺激性气味的液体。
乙醛能与水、乙醇、乙醚等多种有机溶剂混溶。
二、乙醛的物理性质1、外观与气味乙醛为无色透明液体,具有强烈的刺激性气味。
这股气味类似于水果熟透或者发酵的味道。
2、沸点和熔点乙醛的沸点约为 208℃,熔点约为-1235℃。
由于其沸点较低,所以在常温下容易挥发。
3、密度相对密度为 07834(水= 1),这意味着它比水的密度小。
4、溶解性乙醛能与水、乙醇、乙醚等有机溶剂以任意比例互溶。
三、乙醛的化学性质1、加成反应乙醛分子中的碳氧双键可以发生加成反应。
例如,在催化剂的作用下,乙醛可以与氢气发生加成反应,生成乙醇。
CH₃CHO + H₂ → CH₃CH₂OH2、氧化反应(1)乙醛可以被氧气氧化为乙酸。
2CH₃CHO + O₂ → 2CH₃COOH(2)乙醛也能被一些弱氧化剂氧化,比如银氨溶液和新制的氢氧化铜悬浊液。
与银氨溶液反应,会产生银镜现象,化学方程式为:CH₃CHO + 2Ag(NH₃)₂OH → CH₃COONH₄+2Ag↓ + 3NH₃+ H₂O与新制的氢氧化铜悬浊液反应,会产生砖红色沉淀,化学方程式为:CH₃CHO + 2Cu(OH)₂+NaOH → CH₃COONa + Cu₂O↓ +3H₂O3、缩合反应乙醛在一定条件下可以发生自身缩合反应,生成β羟基丁醛。
2CH₃CHO → CH₃CH(OH)CH₂CHO四、乙醛的制备方法1、乙醇氧化法乙醇在催化剂(如铜或银)的作用下,加热可以被氧化为乙醛。
这是工业上制备乙醛的常用方法之一。
2CH₃CH₂OH + O₂ → 2CH₃CHO + 2H₂O2、乙烯氧化法乙烯在催化剂(如钯盐)和氧气的作用下,可以被氧化为乙醛。
CH₂=CH₂+ 1/2 O₂ → CH₃CHO五、乙醛的用途1、化工原料乙醛是合成乙酸、乙酸酐、季戊四醇、丁醇、三氯乙醛等多种有机化工产品的重要原料。
乙醛 醛类

城东蜊市阳光实验学校49乙醛醛类一、乙醛的分子组成和构造分子式:C2H4O 构造式:构造简式:CH3CHO注意:官能团醛基的写法为-CHO 而不是-COH 。
二、乙醛的物理性质:乙醛是无色、具有刺激性气味的液体,密度比水小,沸点是20.8℃。
乙醛易挥发、易燃烧,能跟水、乙醇、氯仿等互溶。
三、乙醛的化学性质1、加成反响〔复原反响,表达氧化性〕:CH3CHO+H2CH3CH2OH说明:有机化学反响中,通常把有机物分子中参加氢原子或者者失去氧原子的反响叫做复原反响。
乙醛与氢气的加成反响就属于复原反响。
同理,有机物分子中失去氢原子或者者参加氧原子的反响叫做氧化反响。
这里所说的有机物的氧化反响、复原反响,是指反响整体中某一方物质(有机物)的反响,从氧化反响和复原反响的统一性上看,整个反响还是氧化复原反响,且反响的本质也是电子的转移。
2、乙醛的氧化反响〔表达复原性〕:①、乙醛的催化氧化反响2CH3CHO+O22CH3COOH说明:①在工业上,可以利用这个反响制取乙酸。
②在点燃的条件下,乙醛能在空气或者者氧气中燃烧,乙醛完全燃烧的化学方程式为:2CH3CHO+5O24CO2+4H2O②、乙醛被弱氧化剂氧化乙醛被银氨溶液氧化Ag++NH3·H2O=AgOH↓+NH4+AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2OCH3CHO+2[Ag(NH3)2]++2OH -CH3COO -+NH4++2Ag↓+3NH3+H2O注意:①银氨溶液的配制、存放(向AgNO3溶液中滴加氨水,直到沉淀恰好溶解)。
②银镜反响实验成功的条件:水浴加热,碱性环境,试管要干净,不能振荡试管。
③此反响用于醛基检验,醛基数目的测定。
④试管的清洗用稀HNO3。
⑤能发生银镜反响的有机物:凡含有-CHO 的有机物如:甲酸、甲酸酯、甲酸盐、葡萄糖、麦芽糖等。
H-C-C-H HO⑥复原生成的银附着在试管壁上,形成银镜,所以,这个反响叫做银镜反响。
高考化学考点——乙醛 醛类

考点50.乙醛 醛类1.复习重点1.乙醛的结构、物理性质和化学性质;2.银镜反应的操作要点和反应原理;3.醛类的结构及性质、相关计算。
2.难点聚焦、乙醛1.乙醛的分子组成与结构乙醛的分子式是,结构式是,简写为。
注意 对乙醛的结构简式,醛基要写为—CHO 而不能写成—COH 。
2.乙醛的物理性质乙醛是无色、具有刺激性气味的液体,密度小于水,沸点为。
乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。
注意 因为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
3.乙醛的化学性质从结构上乙醛可以看成是甲基与醛基()相连而构成的化合物。
由于醛基比较活泼,乙醛的化学性质主要由醛基决定。
例如,乙醛的加成反应和氧化反应,都发生在醛基上。
(1)乙醛的加成反应乙醛分子中的碳氧双键能够发生加成反应。
例如,使乙醛蒸气和氢气的混合气体通过热的镍催化剂,乙醛与氢气发生加成反应:说明:①在有机化学反应中,常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应。
乙醛与氢气的加成反应就属于还原反应。
②从乙醛与氢气的加成反应也属于还原反应的实例可知,还原反应的概念的外延应当扩大了。
(2)乙醛的氧化反应在有机化学反应中,通常把有机物分子中加入氧原子或失去氢原子的反应叫氧化反应。
乙醛易被氧化,如在一定温度和催化剂存在的条件下,乙醛能被空气中的氧气氧化成乙酸:O H C 42CHO CH 3C 8.20注意 ①工业上就是利用这个反应制取乙酸。
②在点燃的条件下,乙醛能在空气或氧气中燃烧。
乙醛完全燃烧的化学方程式为:乙醛不仅能被氧化,还能被弱氧化剂氧化。
实验6—7 在洁净的试管里加入1 mL 2%的溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止(此时得到的溶液叫做银氨溶液)。
再滴入3滴乙醛,振荡后把试管放在热水中温热。
实验现象 不久可以看到,试管内壁上附着一层光亮如镜的金属银。
实验结论 化合态的银被还原,乙醛被氧化。
【高中化学】乙醛、醛类PPT课件

乙醛的物理性质
乙醛是无色、有刺激性气味 的液体,密度比水小,沸点 是 20.8℃,易挥发,易燃烧, 能和水、乙醇、乙醚、 氯仿等互溶。
乙醛的化学性质
加成反应(碳氧双键上的加成)
H2
乙醛的化学性质
加成反应(碳氧双键上的加成)
H CH3 C O
+
H2
催化剂
CH3CH2OH
乙醛的化学性质
氧化反应 [O]
CH3CHO +2Cu(OH)2
CH3COOH + Cu2O↓ + 2H2O
醛类
1、不要做刺猬,能不与人结仇就不与人结仇,谁也不跟谁一辈子,有些事情没必要记在心上。 2、相遇总是猝不及防,而离别多是蓄谋已久,总有一些人会慢慢淡出你的生活,你要学会接受而不是怀念。 3、其实每个人都很清楚自己想要什么,但并不是谁都有勇气表达出来。渐渐才知道,心口如一,是一种何等的强大! 4、有些路看起来很近,可是走下去却很远的,缺少耐心的人永远走不到头。人生,一半是现实,一半是梦想。 5、你心里最崇拜谁,不必变成那个人,而是用那个人的精神和方法,去变成你自己。 6、过去的事情就让它过去,一定要放下。学会狠心,学会独立,学会微笑,学会丢弃不值得的感情。 7、成功不是让周围的人都羡慕你,称赞你,而是让周围的人都需要你,离不开你。 8、生活本来很不易,不必事事渴求别人的理解和认同,静静的过自己的生活。心若不动,风又奈何。你若不伤,岁月无恙。 9、命运要你成长的时候,总会安排一些让你不顺心的人或事刺激你。 10、你迷茫的原因往往只有一个,那就是在本该拼命去努力的年纪,想得太多,做得太少。 11、有一些人的出现,就是来给我们开眼的。所以,你一定要禁得起假话,受得住敷衍,忍得住欺骗,忘得了承诺,放得下一切。 12、不要像个落难者,告诉别人你的不幸。逢人只说三分话,不可全抛一片心。 13、人生的路,靠的是自己一步步去走,真正能保护你的,是你自己的选择。而真正能伤害你的,也是一样,自己的选择。 14、不要那么敏感,也不要那么心软,太敏感和太心软的人,肯定过得不快乐,别人随便的一句话,你都要胡思乱想一整天。 15、不要轻易去依赖一个人,它会成为你的习惯,当分别来临,你失去的不是某个人,而是你精神的支柱;无论何时何地,都要学会独立行走 ,它会让你走得更坦然些。 16、在不违背原则的情况下,对别人要宽容,能帮就帮,千万不要把人逼绝了,给人留条后路,懂得从内心欣赏别人,虽然这很多时候很难 。 17、做不了决定的时候,让时间帮你决定。如果还是无法决定,做了再说。宁愿犯错,不留遗憾! 18、不要太高估自己在集体中的力量,因为当你选择离开时,就会发现即使没有你,太阳照常升起。 19、时间不仅让你看透别人,也让你认清自己。很多时候,就是在跌跌拌拌中,我们学会了生活。 20、与其等着别人来爱你,不如自己努力爱自己,对自己好点,因为一辈子不长,对身边的人好点,因为下辈子不一定能够遇见。
乙醛与醛类PPT课件

3、字母型数据的计算题可考虑寻找界点,确定区间 (或边界)讨论
(1)溶液中得到的沉淀是卤化银吗?
(2)推导该卤化物沉淀的化学式.
差量法的应用
主要包括:质量差 、气体物质的体积差、压强差、 物质的量差、反应过程的热量差等。
例、炭和碳酸钙的混合物在空气 碳总质量等于原混合物的总质量,则混合物中炭 和碳酸钙的质量比为
乙醛的结构
乙醛的结构:
1、分子式: C2H4O 2、结构简式: CH3CHO
乙醛的物理性质
颜色、状态、气味、密度、 溶解性
小结:乙醛是一种无色、有刺激性气味的 液体,密度比水小、易挥发、易燃烧、易 溶于水及乙醇、乙醚、氯仿等溶剂
乙醛的化学性质
1加、成加,成但反不应和(可Br与2H加2、成H) CN
乙醛的工业制法
2、乙烯氧化法
2CH2
CH2+O2
催化剂 加热、加压
2CH3CHO
乙醛的工业制法
3、乙醇氧化法 2CH3CH2OH+O2 催化剂
2CH3CHO+2H2O
醛类
1、甲醛
•①结构 分子式:CH2O
•
结构式:HCHO,
相当于有两个醛基
•②化学性质:a、具有醛类通性:氧化性和 还原性;b、具有一定的特性:1molHCHO可 与4molAg(NH3)2OH反应,生成4molAg;c 、合成酚醛树脂。
乙醛-醛类

2、丙酮不能被银氨溶液、新制的氢氧化铜等弱 氧化剂氧化,但可催化加氢生成醇。
知识运用
1、判断下列哪些能使酸性KMnO4溶液褪色? 乙烯、甲烷、苯、 甲苯、乙醛、葡萄 糖、SO2、H2S、苯酚、裂化汽油 乙烯、 甲苯、乙醛、葡萄糖、SO2、 H2S、苯酚、裂化汽油
2、下列混合溶液可以用分液漏斗分离的一组是( D )
H CH
甲醛
HO HC C H
H
乙醛
HH O
O
H C C C H …… R C H
HH
丙醛
醛
(六)醛类
饱和醛、不饱和醛
R
脂肪醛
一元醛
醛 二元醛
芳香醛
多元醛
1、醛类的结构特点和通式
分子里由烃基跟醛基相连而构成的化合物
R—CHO
饱和一元醛的通式:CnH2nO ( n≥1)
CnH2n+1—CHO
2、醛的化学通性
提示:醛可看成是醛基取代了烃中的氢原 子,书写同分异构体时应把醛写在端点
科学视野 醛酮可构成类别异构体
O
O
R C H 醛 R’ 的化合物。
>C=O称羰基,是酮的 官能团,最简单的酮是R 和R’都是甲基的丙酮。
O CH3-C-CH3
1、在常温下,丙酮是无色透明的液体,易挥发, 具有令人愉快的气味,能与水、乙醇等混溶,是 一种重要的有机溶剂和化工原料。
与银氨溶液的反应
• 在管洁,净一A的边g试逐++管滴N里滴H加入3·2入H%12的mO稀L=2氨%A水的g,AOg至NHO最3溶↓初+液产N,生H然的4后+沉一淀边恰摇好动溶试解 • 或A为荡:g止后不AO(把久gHO这试可+H时管以2+得放看N2到在到HN的热,3H·溶水试H3液中·管2HO叫温内2=O做热壁=银。[上A氨附[gA溶着(Ng液一(HN)层3H)。光23]再亮)+2+滴如]OO入镜HH3的滴-++金乙22属HH醛银22,OO。振
乙醛-醛类9.28

Cu(OH)2
催化氧化(O2)
羧酸
能使高锰酸钾、溴水褪色
四、醛类
6、 醛类具有和乙醛类似的化学性质:
【方程式示例】
1、RCHO
H2
催化剂
△
RCH2OH
2、RCHO+ 2[Ag(NH3)2]+ + 2OH-
RCOO- +NH4++2Ag +3NH3+H2O
3、RCHO + 2Cu(OH)2+ OHRCOO-+Cu2O +3H2O
H
2CH3CH2OH + O2
Cu △
2CH3CHO+2H2O
一、乙醛的结构
结构简式: CH3CHO
分子式: 结构式:
C2H4O
HO
H C CH H
官能团: 醛基: CHO 或
O CH
提醒
醛基的写法,不要写成 COH
一、乙醛的结构
结构简式: CH3CHO
分子式: 结构式:
C2H4O
HO
H C CH H
思考
乙醛可以被还原成乙醇, 那么乙醛能否被氧化呢?
三、乙醛的化学性质
2、乙醛的氧化反应
(1)与氧气的反应
①燃烧
2CH3CHO + 5O2 点燃 4CO2 + 4H2O
②催化氧化
O
O
2CH3—C—H
+
O2
催化剂 △
2CH3C-O-H
【问题】乙醛能使KMnO4/H+褪色吗?能使溴水褪色吗?
可以(方程式不作要求)
在洁净的试管里加入1 mL2%的AgNO3溶液,然后 一 最 叫A边 初 做gO摇 产 银HA动生氨+g+2试的溶+NN管沉液HH3,淀)3··HH一 恰 。22OO边 好 再==逐 溶 滴[AA滴 解 入gg(O滴 为3N滴HH入 止乙3↓(2)+2醛%]这+N+,的HO时振稀4H+得-荡氨+到2水后H的2把,O溶试至液 管或放:A在gO热H水+2中N温H3热·H。2O不=久[A可g以(N看H3到)2],O试H+管2内H2壁O 上 附着一层光亮如镜的金属银。
高中化学醛类物质总结

高中化学醛类物质醛类物质是有机化合物中的一类,其分子中包含着一个或多个醛基(─CHO)。
在高中化学课程中,我们学习了关于醛类物质的性质、合成和应用等方面的知识。
本文对高中化学中常见的醛类物质进行,包括甲醛、乙醛、丙醛等常见的醛类物质。
一、甲醛(甲醛)1. 性质甲醛化学式为CH2O,是一种无色气体或液体,具有刺激性气味。
甲醛可以溶于水,可以与许多物质发生反应。
2. 合成甲醛可以通过氧化甲烷得到。
常见的制备方法是通过甲烷与氧气在触媒的存在下反应,生成甲醛和水。
CH4 + 1/2O2 -> HCHO + H2O3. 应用由于甲醛具有很强的杀菌能力,常被用作消毒剂和防腐剂。
此外,甲醛还是制备其他有机化合物的重要原料,例如甲醇、乙醛等。
二、乙醛(乙醛)1. 性质乙醛化学式为CH3CHO,是一种具有刺激性气味的液体。
乙醛具有极强的挥发性和易燃性,能与空气形成爆炸性混合物。
2. 合成乙醛可以通过乙烯的氧化得到。
在工业上,常用乙醇作为原料,通过氧化反应制备乙醛。
C2H5OH + 1/2O2 -> CH3CHO + H2O3. 应用乙醛在工业上被广泛应用,例如用作溶剂、防冻剂和染料的中间体。
此外,乙醛还是合成其他有机化合物的重要原料,例如醋酸、丙酮等。
三、丙醛(丙醛)1. 性质丙醛化学式为CH3CH2CHO,是一种具有刺激性气味的液体。
丙醛具有较高的沸点和燃点,易挥发,与空气能形成爆炸性混合物。
2. 合成丙醛可以通过丙烯的氧化得到。
在工业上,常用丙酮作为原料,通过氧化反应制备丙醛。
CH3COCH3 + 1/2O2 -> CH3CH2CHO + H2O3. 应用丙醛主要用作有机合成的中间体,在医药和染料工业中有广泛应用。
此外,丙醛还可用作抗菌剂和防腐剂。
醛类物质在高中化学中属于重要的有机化合物。
其中,甲醛、乙醛和丙醛是常见的醛类物质,它们具有各自独特的性质和应用。
深入了解这些醛类物质的性质、合成和应用对于我们理解有机化学的基本知识和应用具有重要意义。
乙醛,醛类

3、制法: 、制法: ①乙烯氧化法: 乙烯氧化法:
催化剂
2CH2=CH2 + O2
加热加压
2CH3CHO
②乙炔水合法: 乙炔水合法: CH≡CH + H2O ≡
催化剂
CH3CHO
醛 类
一、醛 1、定义:烃基和醛基相连而构成的化合物。 定义:烃基和醛基相连而构成的化合物。 2、通式:RCHO(醛基碳一定在第一个位置) 通式: (醛基碳一定在第一个位置) 饱和一元醛通式: 饱和一元醛通式:CnH2n+1CHO 或 CnH2nO 饱和一元醇通式: 饱和一元醇通式:CnH2n+1OH 或 CnH2n+2O 练习:判断下列物质的类别? 练习:判断下列物质的类别? C 2H 4O
催化剂 CH3CHO + H2 → CH3CH2OH (加成反应) 加成反应) △ 催化剂 RCHO + H2 → RCH2OH △
O 催化剂 ‖ → △ CH3-C-CH3 + H2 H - H 醛和酮都能与H 醛和酮都能与 2加成生成醇
CH3-CH-CH3 H H H OH
2、氧化反应(醛基中C—H键断开,再加氧) 、氧化反应(醛基中 键断开, 键断开 再加氧) O O 被氧化 ‖ ‖ 氧化剂 羧酸 醛 R—C—H → R—C—O—H
催化剂 + n HCHO → △
OH
[
CH2— + nH2O ]n
酚醛树脂 反应机理: 甲醛断 亮键) 反应机理:①甲醛断C=O双键 (亮键) 双键 苯酚断羟基相邻的苯环上的C—H键 ②苯酚断羟基相邻的苯环上的 键 缩聚反应有小分子生成,加聚反应没有。 缩聚反应有小分子生成,加聚反应没有。 3、甲醛应用:合成酚醛塑料 电木 、防腐剂杀菌剂 电木)、 、甲醛应用:合成酚醛塑料(电木
高二化学乙醛、醛类知识精讲

高二化学乙醛、醛类【本讲主要内容】乙醛、醛类乙醛的结构、物理性质、化学性质、制法和用途;醛类的结构、通性和检验方法;对照醛的内容简要了解其同分异构体酮的知识。
【知识掌握】 【知识点精析】一. 乙醛 1. 分子结构分子式结构式结构简式 官能团 C 2H 4OC H HHCHOH 3C C H O或CH 3CHO醛基2. 物理性质乙醛是无色、具有刺激性气味的液体,密度比水小,沸点很低(20.8℃,比乙醇低得多),易挥发,易燃烧,能跟水、乙醇、氯仿等互溶。
3. 化学性质 (1)加成反应NiOH CH 3-C+H 2CH 3CH 2OH注:① 该反应实质为加氢还原反应。
有机化学反应中,通常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应,而加氧去氢的反应称为氧化反应。
如乙醇的催化氧化。
② 醛基与H 2的加成是在分子中引入—OH 的一种方法。
但工业上并不用此法合成乙醇。
③ C =O 键和C =C 键不同,只能与H 2加成,但不能与溴水加成。
(2)氧化反应 ① 剧烈氧化——燃烧2CH 3CHO+5O 2点燃4CO 2+4H 2O② 催化氧化2CH 3CHO+O 2催化剂2CH 3COOH③ 被弱氧化剂氧化 a. 银镜反应Ag ++NH 3·H 2O =AgOH ↓+NH 4+AgOH+2NH 3·H 2O =[23)(NH Ag ]++OH -+2H 2OCH 3CHO+223)(NH Ag ]++2OH-2Ag ↓+CH 3COO -+NH 4++3NH 3+H 2O这个反应叫银镜反应。
银镜反应常被用于检验醛基的存在。
也常用于测定有机物中醛基的数目。
b. 与新制2)(OH Cu 悬浊液反应 CuSO 4+2NaOH =2)(OH Cu ↓+Na 2SO 4 22)(OH Cu +CH 3CHOCu 2O ↓+CH 3COOH+2H 2O乙醛与新制2)(OH Cu 悬浊液的反应也可用于检验醛基的存在。
乙醛、醛类讲义,教案,课件(最全版)

乙醛、醛类一、教材分析醛是连接有机合成路线中醇与羧酸的重要有机化合物。
其代表物质乙醛,涵盖了醛类概念、醛基的化学性质和醛基的检验。
特别是醛基既可以发生还原反应又可以发生氧化反应的特点,对深刻理解有机反应中氧化反应和还原反应具有重要指导意义。
二、学情分析醛基官能团性质的本质是氧化还原反应,学生对有机化学中氧化反应和还原反应理解不够深入,再加之与无机化学氧化还原反应得失电子的联系抽象模糊,学生碰到有机化合物较复杂的氧化反应与还原反应时,往往存在一定的困惑。
三、教学目标1.知识与技能:(1)了解乙醛的物理性质,理解乙醛的结构特点;(2)掌握乙醛的化学性质;(3)能够写出常见含醛基官能团的氧化和还原反应方程式;2.过程与方法:(1)通过乙醛与银氨溶液的实验,乙醛与新制氢氧化铜的实验过程,掌握醛基的化学性质;(2)培养学生合作探究、分析和解决问题的能力;(3)培养学生的观察能力、类推思维能力及归纳思维能力;3.情感态度与价值观:(1)增强同学们对化学知识与日常生活紧密联系的意识;(2)提高学习化学兴趣,达到学以致用目的。
四、教学重难点设计1.教学重点:乙醛的加成反应和氧化反应。
2.教学难点:乙醛的加成反应和氧化反应;有机化学反应中氧化反应和还原反应的概念。
五、教学方法设计教师引导、学生自主、师生共同探究学习。
六、教学过程[师]在日常生活中,你可能发现:有的人喝酒千杯万盏都不醉,而有的人沾酒就会面红耳赤容易醉。
那人的酒量到底与什么因素有关呢?……以人的酒量大小这一生活话题引起学生注意,并引出乙醛的课题。
引导学生回忆复习乙醇的催化氧化,并让学生根据乙醇催化氧化反应的本质,写出乙醛的分子式、结构式、结构简式及官能团、醛基的电子式。
[生]……学生上传答案后,请学生互评。
[师]现在我们知道了乙醛的结构,那乙醛有哪些性质呢?我们首先来看一下它的物理性质。
……让学生闻其气味,并观察其颜色、状态,请学生叙述乙醛的重要物理性质。
醛类知识点归纳总结

醛类知识点归纳总结一、醛类化合物的结构特点1. 醛基的结构:醛基的结构为-C=O和一个氢原子。
这种结构使得醛类化合物在化学反应中具有一些特殊的性质。
2. 典型醛类化合物:例如甲醛(甲醛)、乙醛、丙醛(丙酸)、戊醛等,它们是最简单的醛类化合物,其中甲醛在工业和实验室中得到了广泛应用。
3. 分子结构:醛类化合物的分子结构一般为RCHO,其中R代表有机基团。
在不同的R基团的影响下,醛类化合物也会表现出不同的性质和化学反应。
二、醛类化合物的物理化学性质1. 沸点和熔点:醛类化合物的沸点和熔点一般较低,因为它们通常是小分子量化合物。
例如,甲醛的沸点为-19℃,丙烯醛的沸点为48℃。
这使得它们在实验室合成和分离中具有一定的方便性。
2. 溶解性:醛类化合物在水中具有较好的溶解性,这是因为醛基的极性和氢键的作用。
但随着碳链长度的增加,溶解性会逐渐下降。
3. 化学稳定性:醛类化合物在室温下相对稳定,但在高温、强酸或碱条件下容易发生氧化、加成或缩合等反应。
4. 光学活性:醛类化合物中的手性碳原子可以使得一些醛类化合物具有光学活性。
三、醛类化合物的化学反应特性1. 氧化反应:醛类化合物容易发生氧化反应,生成相应的羧酸。
例如,甲醛氧化生成甲酸,乙醛氧化生成乙酸。
2. 加成反应:醛类化合物的C=O键极性很大,因此可以和亲核试剂发生加成反应,生成相应的醇、缩醛或缩酮。
3. 缩合反应:醛类化合物之间或与醛类化合物和醇类化合物之间可以发生缩合反应,生成醇、酮、羧酸或醚等化合物。
4. 还原反应:醛类化合物可以被还原成相应的醇。
常用的还原剂有金属钠、金属亚铁等。
5. 极化反应:醛类化合物可以通过极化反应生成醛醇。
6. 偶联反应:醛类化合物能与胺、硫醇和其他亲核试剂发生偶联反应。
四、醛类化合物的制备方法1. 氧化还原反应:如醇的氧化和醚的水解可以制备醛类化合物。
2. 加成反应:醛烯类和酮类化合物通过水合作用,水合醛足可以合成醛类化合物。
醛类甲醛乙醛化学性质

醛类(甲醛、乙醛)化学性质一、甲醛、乙醛一、乙醛、醛类分子组成及结构式乙醛的分子组成C2H4O,结构式官能团试探:1)乙醛的结构简式可否写成CH3CHO 。
2)醛类的通式:CnH2nO (饱和一元醛) R─CHO(结构通式)1·分子结构2、乙醛物理性质:无色、有刺激性气味的液体,密度比水小,能与水、乙醇、乙醚、氯仿等互溶,沸点:℃,易挥发,易燃3·化学性质—CHO是乙醛的官能团,对乙醛的化学性质起着决定性的作用。
分析:醛基的结构,初步得出乙醛可能具有的化学性质——氧化性和还原性。
介绍氧化(加氧去氢)和还原(加氢去氧)的概念。
(1)加成反映:CH3CHO+H2CH3CH2OH(2)氧化反映:【6-7】银镜反映【6-8】与新制的Cu(OH)2反映①银镜反映—查验醛基Ag+ + NH3·H2O = AgOH↓ + NH4+AgOH + 2NH3·H2O = Ag (NH3)2OH + 2H2O氢氧化二氨合银②与新制的Cu(OH)2反映—查验醛基写出以下反映方程式:①CH3CH2CHO 与 H2反映②RCHO 与银氨溶液反映像如此由烃基和醛基组成的化合物叫醛。
二、醛类1·概念: R-CHO2·=饱和一元醛通式:CNH2N=1-CHO或CNH2NO3·甲醛(又名蚁醛):无色、刺激性气味、气体、易溶于水,水溶液又叫福尔马林,用于制酚醛树脂和杀毒、防腐①乙醛的化学性质加成反映——还原氧化反映——氧化②银镜反映的应用查验醛基并测定醛基的个数(-CHO~2Ag),制镜或水瓶胆(用含醛基的葡萄糖)三、醛、酮与水及醇的加成教学目标:把握羰基化合物与水、醇进行亲核加成反映的规律及对反映活性阻碍因素把握酸催化下生成缩醛的反映机理教学重点:缩醛、缩酮的生成及在有机合成中的应用教学内容:醛、酮的羰基是个极性的不饱和基团,它的碳原子是高度缺电子的,亲核试剂与之发生的亲核加成反映是醛、酮化合物的重要化学特性。
高二化学乙醛 醛类2(PPT)4-4
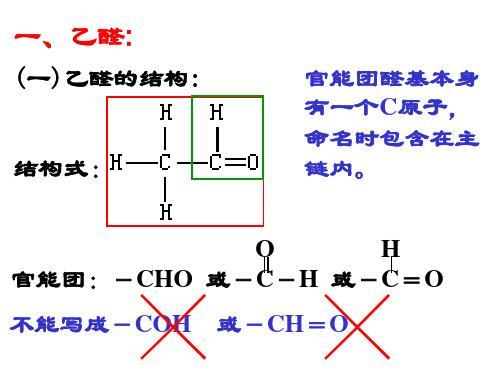
(一)乙醛的结构:
结构式:
官能团醛基本身 有一个C原子, 命名时包含在主 链内。
O
H
官能团:-CHO 或-C-H 或-C=O
╳ ╳ 不能写成-COH 或-CH=O
③拖延:他舍不得走,~到第二天才动身。 【挨板子】?被人用板子责打,比喻受到严厉的批评或处罚。 【挨批】∥ī动受到批评或批判:挨了一顿批。 【挨 宰】∥〈口〉动比喻购物或接受服务时被索取高价而遭受经济损失。 【挨整】∥动受到打击迫害:他过去挨过整。 【??】(騃)〈书〉傻:痴~|愚~。 【皑】(皚)〈书〉洁白:~如山; 杭州知识产权代理 杭州知识产权代理 ;上雪,皎若云间月。 【皑皑】’形形容霜、雪洁白:白雪~。 【癌】(旧读)名上皮组织生长出来的恶性肿瘤,常见的有胃癌、肺癌、肝癌、食管癌、肠癌、乳腺癌等。 【癌变】动组织细胞由良性病变转化为癌症病变。 【癌症】名生有恶性肿瘤的病:身患~。 【毐】用于人名,嫪度(’),战国时秦国人。 【欸】[欸乃]()〈书〉拟声①形容摇橹的声音。②划船时歌唱 的声音。 【嗳】(噯)叹表示不同意或否定:~,不是这样的|~,话可不能那么说。 【嗳气】动胃里的气体从嘴里出来,并发出声音。通称打嗝儿。 【嗳酸】动胃酸从胃里涌到嘴里。 【矮】形①身材短:~个儿|个头儿不~。②高度小的:~墙|~凳儿。③(级别、地位)低:他在学校里比我~一级。 【矮半截】(~儿)〈口〉相比之下低很多,多比喻在身份、地位、水平等方面差得远:他很自卑,觉得自己比别人~。 【矮墩墩】(~的)形状态词。形 容矮而粗壮:他长得~的。 【矮小】形又矮又小:身材~。 【矮星】ī名光度小、体积小、密度大的恒星,如天狼星的伴星。 【矮子】?名个子矮的人。 【蔼】(藹)①和气;态度好:和~|~然。②(?)名姓。 【蔼】(藹)〈书〉繁茂。 【蔼蔼】’〈书〉形①形容树木茂盛。②形容昏暗。 【蔼然】形和 气;和善:~可亲。 【霭】(靄)〈书〉云气:烟~|暮~。 【艾】名①多年生草本植物,叶子有香气,可入,内服可做止血剂,又供灸法上用。也叫艾蒿。 ②()姓。 【艾】〈书〉年老的,也指老年人:耆~。 【艾】〈书〉停止:方兴未~。 【艾】〈书〉美好;漂亮:少~(年轻漂亮的人)。 【艾蒿】名 艾?。 【艾虎】名艾鼬。 【艾虎】名用艾做成的像老虎的东西,旧俗端午节给儿童戴在头上,认为可以驱邪。 【艾绒】名把艾叶晒干捣碎而成的绒状物,中 医用来治病。参看页“灸”。 【艾窝窝】?名用熟糯米做成的球形食品,有馅儿。也作爱窝窝。 【艾叶豹】名雪豹。 【艾鼬】名哺乳动物,比黄鼬稍大,颈 较长,四肢短,背部棕黄色或淡黄色。性凶猛,昼伏夜出,捕食小动物。也叫艾虎。 【艾滋病】ī名获得性免疫缺陷综合征的通称,是一种传
高中化学《乙醛、醛类》隐性知识扫描专题辅导

高中化学《乙醛、醛类》隐性知识扫描陈世华学习“乙醛、醛类”知识,要重点挖掘下列隐性知识:一、醛类的同分异构体1. 官能团异构(1)醛与酮互为同分异构体,如丙醛与丙酮,CH CH CHO 32和CH COCH 33。
(2)醛与烯醇互为同分异构体,如CH CH CHO 32(丙醛),HOCH 2CH =CH 2(丙烯醇)。
2. 官能团位置异构由于醛基只能连在碳链的一端,所以醛的同分异构体是由烃基碳链异构所致。
如C H O 510属于醛类的同分异构体有四种,因为丁基(—C H 49)有四种同分异构体,分别为:CH CH CH CH CH CH CH CH CH CH CH CH 3222323332———,(),(),(CH 3)3C —。
二、醛基与醛类醛类有机物一定含有醛基,但含醛基的物质不一定是醛类。
除醛类外还有下列类别的物质含有醛基,具有醛类化学性质,如:O 1. 甲酸,结构简式为——H C OH|| 2. 甲酸盐,如甲酸钠、甲酸铵等。
O 323.||甲酸酯类:如甲酸乙酯,结构简式为———H C O CH CH 4. 葡萄糖和麦芽糖,如葡萄糖结构简式为HOCH 2(CHOH)4CHO 。
三、醛基检验1. 银镜反应原理R CHO Ag NH OH RCOONH NH Ag H O —+−→−++↓+23232432()∆ R CHO Ag NH OH RCOO NH NH Ag H O —++−→−+++↓++--+223232432()∆实验注意事项:(1)银氨溶液的配制方法:将稀氨水逐滴滴加到稀硝酸银溶液中,边滴边振荡,至最初产生的沉淀恰好溶解为止。
有关反应方程式:AgNO NH H O AgOH NH NO 33243+=↓+·222AgOH Ag O H O =+AgOH NH H O Ag NH OH H O +=+2232322·[()]Ag O NH H O Ag NH OH H O 2323224223+=+++-()()·(2)银氨溶液不能久置,必须现用现配;(3)实验成功的条件:水浴加热,碱性条件,试管要洁净,不能搅拌;(4)试管内壁附着的眼镜,可先用稀硝酸溶解,后用水清洗,不能用浓硝酸溶解,因为Ag HNO AgNO NO H O +=+↑+23322()浓溶解相同量的银,消耗浓硝酸是消耗稀硝酸的1.5倍,且浓硝酸生成的污染气体多些;(5)反应的量的关系:1mol—CHO可生成2mol Ag。
高二化学乙醛醛类

丙烷 C3H8
44 -42.07 不溶于水
乙醇 C2H6O
46
乙醛 C2H4O
44
78.5 与水以任 20.8 意比互溶
(C*1比原)不较子互以数为上多同数少系据来物,比的你较有得,机出在物些分,什子熔么量沸结接点论近不或时能看,由法通?
常极性强的分子间作用力强而熔沸点高。
(2)相似相溶规律。
(三)乙醛的化学性质: 乙醛分子中含有—CHO,它对乙醛的化学 性质起着决定性的作用。 1、加成反应(碳氧双键上的加成) 反应的规律: C=O的双键中 的一个键打开。
(防止生成易爆物质)
(三)乙醛的化学性质: 2、氧化反应(醛基的C-H中加O成羧基) (2)新制Cu(OH)2悬浊液:[演示]
的NaOH溶液中滴加几滴CuSO4溶液。 Cu2++2OH-= Cu(OH)2↓
CH3CHO + 2Cu(OH)2 2CH3COOH +红Cu色2O沉↓淀+ 2H2O
费林反应必须在NaOH过量 条件下才发生。
Ag++NH3·H2O = AgOH↓+NH4+ AgOH+2NH3·H2O = [Ag(NH3)2]++OH-+2H2O
氢氧化二氨合银-银氨溶液
[Ag(NH3)2]+-银氨络(合)离子
CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+2银Ag镜↓+3NH3+H2O
(三)乙醛的化学性质:
2、氧化反应(醛基的C-H中加O成羧基) -用于制镜、保温瓶胆等
CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一,乙醛的化学性质 2,加成反应 , 还原反应) (1)和H2反应 (还原反应) )
O CH3 C H +H2
催化剂 △ CH3CH2OH
酮也可以被催化加氢
O CH3 C CH3 +H2
催化剂 △
OH CH3CHCH3
加成 反应
O C H
氧化 反应
CH3
练习: 练习: 1,写出下列物质催化加氢的化学方程式 , (1)甲醛 ) O (2) CH2 CH C CH3 ) (3)苯甲醛 ) 思考: 思考: 7,乙醛中的羰基如果与不对称的分子加成 , 可能有几种生成物?举例说明. 可能有几种生成物?举例说明.
实验1 实验1 配制银氨溶液 加入乙醛 水浴加热 观察与思考2 此反应有什么现象? 观察与思考2:此反应有什么现象? 可能得到什么产物? 可能得到什么产物?
0 -O 2 [Ag(NH3)2] OH 2Ag +4NH3 +H2O -1 +1
C2H4O
O CH 3 C H
+O
0
C2H4O2 O
CH3COONH4 +3NH3
§4-4 乙醛 醛类
(Ethanal Aldehydes) )
思考: 思考: 1,将灼热的氧化铜伸进乙醇中,会 ,将灼热的氧化铜伸进乙醇中, 生成什么物质, 生成什么物质,写出这种物质的结构 简式? 简式?
O CH 3 C H
乙醛
实验1 实验1 配制银氨溶液 加入乙醛 水浴加热 观察与思考1 如何配制银氨溶液 银氨溶液, 观察与思考1,如何配制银氨溶液,写出 反应的离子方程式. 反应的离子方程式. 先加AgNO3溶液,然后滴加氨水至最 溶液, 先加 初生成的沉淀刚好溶解. 刚好溶解 初生成的沉淀刚好溶解. Ag+ + NH3H2O = AgOH↓ + NH4+ AgOH+2NH3H2O=[Ag(NH3)2]++OH-+2H2O
CH3 C O H
一,乙醛的化学性质 1,氧化反应 银镜反应 (1)与银氨溶液反应——银镜反应 ) △ CH3CHO+ 2 [Ag(NH3)2] OH CH3COONH4+ 2 Ag↓ + 3 NH3+ H2O 一水二银三氨, 一水二银三氨,乙酸铵 烯烃, 烯烃,酮类不能与银铵溶液反应
实验2 实验2 取2mLNaOH溶液 溶液 加入几滴CuSO4溶液 加入几滴 加热
�
+2
CH3CHO+ 2Cu(OH)2
△
+1
CH3COOH+Cu2O↓+ H2O 2
砖红色沉淀
烯烃,酮类不能与新制 烯烃,酮类不能与新制Cu(OH)2反应
(3)和O2反应 )
催化剂
2 CH 3 CHO + (4)使酸性 )使酸性KMnO4 溶液褪色
加几滴乙醛溶液 实验3 实验3 取2mL CuSO4溶液
加入几滴NaOH溶液 溶液 加入几滴 加热
加几滴乙醛溶液
思考: 思考: 此实验成功的关键是什么? 此实验成功的关键是什么? 必须保证NaOH过量.否则生成 过量. 必须保证 过量 黑色的CuO沉淀. 沉淀. 黑色的 沉淀
(2)与新制Cu(OH)2反应 )与新制
