国际化学奥林匹克竞赛——41stIChO Practical Answer
第28届国际化学奥林匹克竞赛试题答案

你 将 得 到 据 称 含有 扑 热 息 痛 的未 知
,
时要 极 其 小 心
,
把 电热 板 放 回 烧 瓶 下 方 并 接 通
你 的 任 务 是 通 过 实 验 来证 实 究 竟是 不 是
一 乙 酞 苯胺 的
。
电热 板 的 电源 注 意 许 多 实 验 室 里 的 电热 板 没 有 控 温 仪 需 要 把 插 头 插 到 电 源 板 上 才接 通 电 源
。
反 应方程式
。
计 算 被 测 溶 液 中铁 的 质 量 并 给 出 计 算 结果
。
・
・
化
学
教
育
年第
期
实验 一 实验 报 告 标 定 中涉 及 的 化 学 方 程 式 硫 酸 钠 的浓 度 测定
反应方程式
。 。 。
个
・
・
玻璃试管
・
玻璃漏斗 个
・
・
装 在 一个 容器 里 的
・
玻 璃 毛 细 管 两 名选 手 公 用
。 。
这 样 为此 你必 须 制备对轻 基 标 样并 进行薄层 色 谱检 测
如 果 你 不 知 道 怎 样 接通 电源 请 询 间 实 验 监
。
试剂
・
考员
一
・
接 通 电源 后 用 电热 板 加 热 混 合 物
,
分
对氨基苯酚
在锥形 瓶里
・
钟 然 后 关 掉 电 热板 拔 插 头 并 移 开 电热 板 此 时 电热 板 仍 然 很 热 移 开 电热 板 时 不 要 触 及 电
滴 定 铁 和 铜 所 消耗 的硫 代硫 酸钠 溶 液 的体 积
。
持约
国际化学奥林匹克竞赛-40thIchotheoreticalanswers

Yes, but only in quite dilute solutions can this happen. 1 pt for ticking yes
c = [HA] + [A–] = [H+]
(1 pt)
[H+] = [A–] + [OH–]
(1 pt)
This means that [HA] = [OH–]
(1 pt for reasonable guess – between 6 and 7)
A good approximation is: [H+ ] = 3 (KKw )
The full equation can be solved through iteration: [H+ ] = 3 (K + [H+ ])Kw
In equilibrium constant calculations all concentrations are referenced to a standard concentration of 1 mol/dm3. Consider all gases ideal throughout the exam.
4
Name:
Code: XXX-
c)
Could it be possible that the solution contained acetic acid?
Acetic acid: pKa = 4.76
Yes No
If yes, calculate the pH (or at least try to estimate it) and show your work.
Official English version
第36届国际化学奥林匹克竞赛竞赛试题[及答案

第1题: 热力学(24 分)为了纪念在二月份他的18岁生日, 彼得计划将他父母家的花园中的一个小屋改建为有人工沙滩的游泳池。
为了估算水和房子的供热成本, 彼得找来天然气的成分及其价格的资料。
1.1 写出表1中所给出的天然气主要成分——甲烷和乙烷完全燃烧的化学反应方程式。
假定氮在所选定的条件下是惰性的。
假定所有产物都是气态的,根据以上反应式计算在标准条件下(1.013×105Pa,25.0°C)甲烷和乙烷燃烧的反应焓、反应熵和吉布斯自由能。
天然气的成分及它们的热力学数据列于表1.1.2 由公共事务公司(PUC)所指定的天然气密度是0.740 g L-1(1.013×105Pa,25.0°C)。
a) 计算在1.00 m3的天然气中甲烷和乙烷的量(天然气、甲烷和乙烷都不是理想气体!) 。
b) 假定所有产物都是理想气体,计算在标准条件下 1.00 m3天然气燃烧过程中作为热释放的燃烧能。
(如果你没有从 1.2a中获得摩尔量,则假定1.00 m3天然气相当于40.00 mol 的天然气。
)按照PUC公司规定,如果所有产物都是气态的,天然气的燃烧能将是9.981 kWh m-3。
请问这与你从b)中所得到的值的偏差(单位:%)有多大?游泳池有3.00 m 宽、5.00 m 长、1.50 m 深(水面以下)。
自来水温度是 8.00°C,房间(尺寸示于下图)内空气的温度是10.0°C。
假定水的密度是 = 1.00 kg L-1以及空气表现出理想气体的行为。
1.3 计算加热池子中的水到22.0°C 所需要的能量(单位:MJ) 和在标准压力1.013 ×105 Pa.时加热初始空气(21.0% of O2, 79.0% of N2) 到 30.0°C所需要的能量。
在二月份,德国北部的室外温度大约是5°C。
由于房子的墙壁及房顶相当薄(20.0 cm),因此有能量损失。
第30届国际化学奥林匹克竞赛试题

第30届国际化学奥林匹克竞赛试题(实验部分)墨尔本· 澳大利亚实验一高锰酸钾法测定溶液中钙的含量实验二 Co(III)配合物的混合物分析竞赛实验报告(Answer Sheets)注意事项在实验室的所有时间内你必须戴好防护眼镜或者经允许后戴上你自己的眼镜,并且使用提供的移液管吸球。
如果你摘去眼镜或者用嘴进行移液管吸液,将会受到一次警告。
第二次犯规将不准许继续做实验,被逐出实验室,整个实验结果将按零分计。
你如果对实验室安全问题有任何疑问的话,请无拘束地向实验监考教师询问。
⑴在开始实验前要认真阅读实验题以及实验报告纸上的格式。
⑵在实验报告每页上写下你的姓名和编码。
⑶完成实验竞赛的时间是5小时,包括填写实验报告。
听到“STOP”的指令后立即停止工作。
延缓3分钟的话将取消正在做的实验并且按零分计。
⑷所有结果必须写在实验报告上的指定位置。
写在任何其他地方都不给分。
切勿在实验报告的背面写任何东西。
如果你需要更多的纸或者更换答题纸,请向实验监考人员索取。
⑸完成实验后将所有纸张装入向你提供的信封里并封好信封。
只有装入信封的答卷才被评分。
⑹未经允许请勿离开实验室。
当你离开实验室时将收到一张收条,证明你已经上交封好的装试卷的信封。
⑺只准使用向你提供的笔和计算器。
⑻一律使用蒸馏水。
废液、废弃物等必须使用适当的废液缸、废弃物容器等。
⑼以数字为答案的结果必须按实验误差的评价规则正确使用有效数字。
不能正确使用有效数字将导致扣分,即使你的实验技术完美无缺也不例外。
⑽本实验的试卷纸共6页,还有答卷纸3页。
⑾如果你打碎仪器或者试剂不够用,可以用分来“买”,每买一次扣1分。
⑿如果你希望阅读试题的英文版本,实验室予以提供。
实验一高锰酸钾法测定溶液中钙的含量本实验测定含钙和镁的溶液中钙离子的含量。
首先用草酸盐把钙离子沉淀下来,并将该沉淀通过过滤定量地分离出来:Ca2+ + C2O42- = CaC2O4(s)然后用酸将该沉淀溶解:CaC2O4(s) + 2H+ = Ca2+ + H2C2O4用标准高锰酸钾溶液滴定生成的草酸:5H2C2O4+ 2MnO4- + 6H+ = 10CO2+ 2Mn2+ + 8H2O草酸钙沉淀的生成1.用25 mL吸量管和250 mL容量瓶准确地将提供的钙镁溶液稀释10倍,分析两份稀释的钙镁溶液。
40届国际化学奥林匹克理论试题

O:9.55%。
• B 還有其他三個立體異構物。
a) A
畫 出 中 間 產 物 A 及 vinpocetine (B) 的 結 構 。
B
40th IChO 理論試題
7
姓名:
編號: TPE-
分析藥物經人體代謝後所產生的代謝物,可提供和藥物有關的資料。 Vinpocetine (B) 經 由 代 謝 後 可 產 生 四 種 不 同 的 化 合 物 :C、D、E 及 F,其 中 C 和 D 分別是經由水解或水合的產物;E 和 F 則是被氧化的產物。 提示:
2
40th IChO
理論試題
常數和公式
亞佛加厥數: 氣體常數: 法拉第常數: 普朗克常數: 光速(真空): NA = 6.022·1023 mol–1 R = 8.314 J K–1 mol–1 F = 96485 C mol–1 理想氣體定律: 自由能: pV = nRT G = H – TS
o Δr G o = −RT ln K = −nFEcell
D 1. O3
氧 化 ( C10H18 ) oxidation
450°C Pd/C, 350°C H − H2O, − 8 H G
2. Zn/H+
1. Pd/H2 2. NaBH4
F
Na2CO3, Δ − H2O E
提示:
• A 只含碳、氫兩元素,並且是常見的芳香烴化合物。 • 化合物 C 的己烷溶液可以和鈉反應,並可以觀察到氣體產生。但 C 並不會被 鉻酸氧化。 •
O COOCH3 H3C CH3
1. RS2. H+
H3C
當酸性的多孔鋁矽酸鹽當催化劑時,含有烷基取代的環氧類化合物除了先進 行 開 環 反 應 外 , 跟 著 可 進 行 雙 聚 合 的 反 應 而 產 生 1,4-dioxane 類 的 衍 生 物 (1,4dioxane 為 四 個 碳 、 八 個 氫 、 兩 個 氧 所 構 成 的 飽 和 六 員 環 , 且 1 號 及 4 號 位 置 為 氧 )。
第26届国际化学奥林匹克竞赛理论试题

以 保证 沉 淀完全
沉 淀 经 洗 涤 干 燥 后 称重 重 量 为
。
写 出 该化 合 物 的 分 子 式
写 出该 物 质 和 水 反 应 的方 程 式
若 你未 在
在自
口尸
中 写 出化 合 物 的 分子 式 请 用
,
写方程式
。
,,
名
“‘
。
‘
一
月
在 自然 界 不 存 在 氧 化 铂
。
但 可 在 实 验 中制备
。
的 混 合物 在 混 合 时 生 成 硝 酞 氯
年第
期
化
。
学
教
育
子 态氯
。
据 信后 者 是 活 性 的 溶 解 态 的组 分 酸 根 离子 能 以 六 氯 合 铂
。
六 氯合 铂
酸 二 钱 的形 式 沉 淀
。
。
后 者 热 分 解 的最 终 产 物 是 粉 大
状 的铂 和 几 种 气 态 物 质
写 出形 成 王 水 的 和 铂 溶 于 王 水 的 配 平 的反 应 方 程 式
写 出 在 高 温 下 六 氯 合铂 用六 氯 合 铂
一
酸 二 钱 热 分解 的 配 平 反 应 方 程 式
卜
,
‘
。
酸 二按 可 以 制备 和 △
,
升杏 能 以
。
洲 △
」
厂
一 一
,
盯
二 尊曰 介 川
。
户
。
一
一
△
一
两 种 方 式 存在
能 以 这 两 种 异 构 体 存 在 表 明它 的几 何 结 构 是
、乃
、
国际化学奥林匹克竞赛-36thIChOpracticalproblems

- use only the pen and calculator provided
- results
the number of significant figures in numerical answers must conform to the rules of evaluation of experimental error. Mistakes will result in penalty points even if your experimental technique is flawless.
95.94 74
W
183.84 106
Sg
263 59
Pr
140.91 91
Pa
231
25
Mn
54.94 43
Tc
98.91 75
Re
186.21 107
Bh
264 60
Nd
144.24 92
U
238
26
Fe
55.85 44
Ru
101.07 76
Os
190.23 108
Hs
265 61
Pm
144.92 93
Sn
118.71 82
Pb
207.19
67
Ho
164.93 99
Es
252
7
N
14.01 15
P
30.97 33
As
74.92 51
Sb
121.76 83
Bi
208.98
68
Er
167.26 100
Fm
257
8
O
16.00 16
国际化学奥林匹克竞赛试题

国际化学奥林匹克竞赛试题1. 试题内容,国际化学奥林匹克竞赛试题涵盖了广泛的化学知识和技能。
试题通常包括理论题和实验题两个部分。
理论题主要考察学生对基础概念、原理和化学理论的理解能力,以及解决化学问题的能力。
实验题则要求学生进行实验操作或分析实验数据,考察他们的实验技巧和实验设计能力。
2. 题型与难度,国际化学奥林匹克竞赛试题的题型多样,包括选择题、填空题、计算题、解答题等。
试题的难度较高,往往需要学生具备深厚的化学基础知识和解题能力。
试题设计注重思维的拓展和创新,考察学生的综合运用能力。
3. 考察内容,国际化学奥林匹克竞赛试题涵盖了化学的各个领域,如无机化学、有机化学、物理化学、分析化学等。
试题内容既包括基础知识的考察,也涉及到前沿科学研究的应用。
试题还注重培养学生的实验技能和实践能力,要求学生能够运用所学知识解决实际问题。
4. 解题思路,国际化学奥林匹克竞赛试题注重学生的解题思路和创新能力。
解题过程中,学生需要综合运用化学知识,进行逻辑推理和分析,提出合理的解决方案。
考生在解答问题时,需要清晰、准确地表达自己的思路和答案,同时给出充分的解释和论证。
5. 准备与参与,为了在国际化学奥林匹克竞赛中取得好成绩,学生需要进行系统的化学知识学习和实践训练。
参赛学生通常需要通过学校选拔或参加区域、国家层面的选拔赛才能获得代表国家参加国际化学奥林匹克竞赛的资格。
总结起来,国际化学奥林匹克竞赛试题涵盖了广泛的化学知识和技能,题型多样,难度较高。
试题旨在考察学生的理论理解、实验技能和解题能力,要求学生具备综合运用知识解决问题的能力。
为了取得好成绩,学生需要进行系统的准备和训练。
第28届国际化学奥林匹克竞赛试题理论试题

转化为
。
呢还是相 反
,
但 未 能 被 单 独 分 离 出来
皿
, ,
应生成
个新化合物
和
皿
其中
和
第二题 检 出 限量是 痕 量 元 素分析 的基 本 参 数 之
一
。
尔百分 比
生成化合物
环 分别 为
。
时 没有其他 副产物 生成 但
,
它 被 定 义 为 在 给 定 方 法 的精 确 度 一 定 时
假定在
若不吸 才
写出由
或
和
,
转化为 转化 为
和
,
和 和
的反 应 的反
光路长度为
‘一
、
式
。
翁和
一
写出由
光 摩 尔吸 收 系数
・
。
为
应式
,
。
。
。
的标准氧化还 原 电势 为
。
在酸存在下
应 生 成 化合 物 构式
。
都 易于 和 丙 酮 反
,
方 程 中常 用 对 数 前 的 因 子 为 在 自然 对 数 前 的 因 子 是
,
竺 争 立竺 些
一‘
写 出 加 入 嗅 水 后 发 生 的化 学 反 应 的 离子
方程式
释放 出
。
注 意 过 量 的 澳 水 可 以 跟 氢氰 酸 反 应
, ,
碘则 被氧化成
,
。
一
。
塑 二三竺 几
日
步骤
为 除去 过 量 的 嗅 向混 合 物 加 入
。
一 一
日
日
垫 全辈
国际化学奥林匹克竞赛大纲

国际化学奥林匹克竞赛大纲草案说明:☆化学论题的分类(下表各知识点后面的数字,前者是它归属的组别,后者是知识点序号) ·组1:这些论题是绝大多数中学化学大纲里有的。
·组2:这些论题是许多中学化学大纲里有的;若大纲里没有,预期各国应向参赛学生介绍。
·组3:这些论题是大多数中学化学大纲里没有的。
☆主办国出的预备题不必涉及第一和二组论题,但对第二组论题应开具细目。
所有竞赛将涉及到的第三组论题必须包括在预备题中。
译注:☆1:本大纲制订的基础是对参赛队领队的大量问卷调查与综合分析,制订工作历时8年,三度修订。
通读本大纲可得出如下认识:本大纲是采取举例的方式来明确知识点的层次,重在体现知识点的不同层次,不能说大纲里没有列入的知识点就不属于竞赛内容。
也可以有如下认识:本大纲的一级知识水平大致与Nuffield O-水平吻合,二级知识大致与Nuffield A-水平吻合,三级知识大致为大学本科低年级知识水平。
☆2:知识点的分级旨在明确竞赛前参赛选手需要记忆多少知识作为解题的基础,不等于在竞赛试题中不得出现超纲的供参赛选手现学现用的化学知识信息以及考核参赛选手把握新知识内涵的能力(学习能力)与应用新知识的能力(应用能力)以及创造性思维的能力。
☆3:本大纲是98年10月在斯洛伐克首都布拉津斯拉伐工作会议上修订的。
在该次工作会议上与会代表用6个单元时间逐字逐句地对原在华沙会议制订的大纲进行分组审核,提出修改意见,然后又用1个单元时间进行讨论,最后由指导委员会主席携回加工定稿。
第31、32届IChO预备题均将此大纲作为附件,预备题的编制以此大纲为依据。
☆4:全国化学竞赛基本要求应根据此大纲作出相应调整。
全国初赛应与本大纲一级知识水平大致吻合,决赛(冬令营)应于本大纲一、二级知识水平大致吻合,对国家集训队进行的讲座与国家队四名选手的选拔赛应依据本大纲一、二级知识和预备题中明确的三级知识,属于本大纲三级知识而预备题未涉及的不应作为国家集训队选手已经掌握的(记忆了的以及能够熟练应用的)知识来考核。
第20届国际化学奥林匹克竞赛理论试题答案
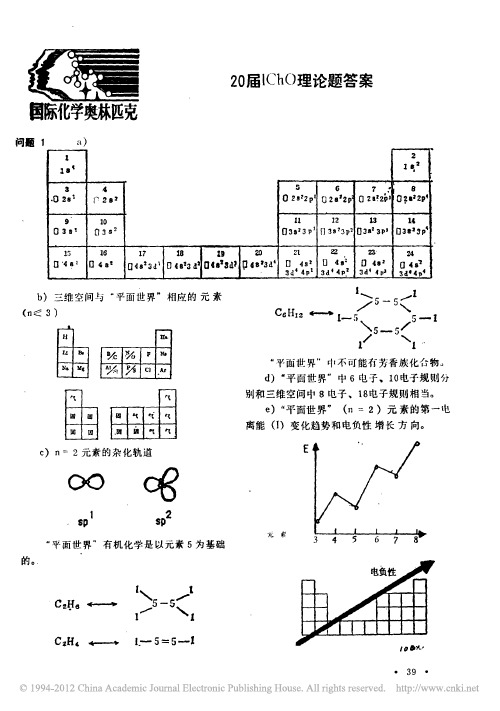
、
甘
名
。
心
一
斌卜
、勺
,
洲产
一勺
‘
、
一
口 沙 凡,
“‘
咯门
今
飞
苟定
“
气
检定
气
稳定
、
不稳定
稳定
不毯定
平面世 界
”
中
元 素 和最 轻元 素化 合 物 的 路 易 斯 结 构
。
几何 构 型 及 三 维 空 间 中 相 应
化 的 合物
“
。
’
‘
路 易 斯结 构
・
几何构型
示和
伙
一
毛
、
具
分
优
几
夕
丫
心 刁
川
二维空间
= 解 得 T 2 06o K : c ) 刚 刚 离 开 气缸 尾 气 的 温 度 . . 。 P Z = 20 o ok P a 犷 = 4 oo x
一 个气缸 释 放 出气 体 的 摩 尔
一
l o
‘ m
“
空 气的 体 积
厂 ^
。
nG
矗 . R T
二 0
. 0 1 3 5 9 m
o
l
4 x 25 x n
相 应 化 合物
俄
两图
原 子 序数 一
抓
已 知含
问皿
见第
最大 密度 密度
密度
且
。
二
原子 序数 原 子 序数 原 子 序致
‘
解得 为气
’
‘
密度
元素
‘“
的 电 子构 型
‘。
’
’
国际化学奥林匹克竞赛-36thIChOtheoreticalanswers

(1 point) (1 point)
Eloss = 1556 MJ
Final
2
13
Name: ______________________ Student code: ___________
1.5 Total energy and costs:
total energy: Etot = Ewater + Eair + Eloss = 1316 MJ + 12 MJ + 1556 MJ = 2884 MJ
(4 points) (2)
slope:
1 = 1.9 cm −3
Va,max
⇒
Va,max = 0.53 cm3
(1)
intercept:
1 = 6·102 Pa cm-3 K ⋅Va,max
⇒
K·Va,max = 1.7⋅10-3 Pa-1 cm3
(1)
2.4 Equation for reaction rate:
Final
4
22
Name: ______________________ Student code: ___________
22
2.3 d) Gas volume Va,max and product K·Va,max:
1 = 1 + 1 = Va,max
⇒
θ K⋅p
Va
1 + p =p K ⋅Va,max Va,max Va
2 CO + O2 2 NO + 2 CO 2 C8H18 + 25 O2
→ → →
2 CO2 N2 + 2 CO2 16 CO2 + 18 H2O
IChO(国际化学奥林匹克竞赛)考试大纲

SYLLABUS OF THEINTERNATIONAL CHEMISTRY OLYMPIADPart I Theoretical partLevel 1: These topics are included in the overwhelming majority of secondary school chemistry programs and need not be mentioned in the preparatory problems.Level 2: These topics are included in a substantial number of secondary school programs and maybe used without exemplification in the preparatory problems. Level 3: These topics are not included in the majority of secondary school programs and can only be used in the competition if examples are given in the preparatory problems.1. The atom1.1.Introduction1.1.1. Counting of nucleons 11.1.2. Isotopes 1 1.2.The hydrogen atom1.2.1. Concept of energy levels 11.2.2. Shape of s-orbitals 11.2.3. Shape and orientation of p-orbitals 11.2.4. Shape and orientation of d-orbitals 31.2.5. Understanding the simplest Schrodinger equation 31.2.6. Square of the wave function and probability 31.2.7. Quantum numbers (n, l, m l) 3 1.3.Radioactivity1.3.1. Types of radioactivity 11.3.2. Radioactive decay 11.3.3. Nuclear reactions 22. Chemical bonding2.1.VSEPR – Simple molecular structures with2.1.1. no more than four electron pairs about central atom 12.1.2. with central atom exceeding the “octet rule” 3 2.2.Delocalization and resonance 3 2.3.Hybrid orbital theory 3 2.4.Molecular orbital theory2.4.1. molecular orbital diagram (H2 molecule) 32.4.2. molecular orbital diagram (N2 and O2 molecules) 32.4.3. bond orders in O2, O2–, O2+ 32.4.4. unpaired electrons and paramagnetism 33. Chemical calculations3.1.1. Balancing equations 13.1.2. Stoichiometric calculations 13.1.3. Mass and volume relations (including density) 13.1.4. Empirical formula 13.1.5. Avoga dro’s number 13.1.6. Concentration calculations 14. Periodic trends4.1.Electron configuration4.1.1. Pauli exclusion principle 14.1.2. Hund’s Rule 14.1.3. Main group elements 14.1.4. Transition metal elements 14.1.5. Lanthanide and actinide metals 3 4.2.Electronegativity 1 4.3.Electron affinity 2 4.4.First ionization energy 1 4.5.Atomic size 1 4.6.Ion size 14.7.Highest oxidation number 15. Inorganic Chemistry5.1.Introduction5.1.1. Trends in physical properties of elements (Main groups)5.1.1.1. melting point 15.1.1.2. boiling point 15.1.1.3. metal character 15.1.1.4. magnetic properties 35.1.1.5. electrical conductivity 25.1.2. Oxidation number 15.1.3. Nomenclature5.1.3.1. main group compounds 15.1.3.2. transition metal compounds 15.1.3.3. simple metal complexes 3 5.2.Groups 1 and 25.2.1. Trend in reactivity of (heavy elements more reactive) 15.2.2. Products of reaction with5.2.2.1. water 15.2.2.2. halogens 15.2.2.3. oxygen 25.2.3. Basicity of oxides 15.2.4. Properties of hydrides 35.2.5. Other compounds, properties and oxidation states 3 5.3.Groups 13 – 18 and Hydrogen5.3.1. Binary molecular compounds of hydrogen5.3.1.1. Formulae 15.3.1.2. Acid-base properties of CH4, NH3, H2O, H2S 15.3.1.3. Other properties 35.3.2. P block elementsGroup 13 (Boron group)15.3.2.1 The oxidation state of boron and aluminium in theiroxides and chlorides is +35.3.2.2. The acid-base properties of aluminium2oxide/hydroxide5.3.2.3. Reaction of boron(III) oxide with water 35.3.2.4. Reaction of boron(III) chloride with water 35.3.2.5. Other compounds, properties and oxidation states 35.3.3. Group 14 (Carbon group)5.3.3.1. The oxidation state of Si in its chloride and oxide is1+425.3.3.2. The +2 and +4 oxidation states of carbon, tin andlead, the acid-base and redox properties of theoxides and chlorides5.3.3.3. Other compounds, properties and oxidation states 35.3.4. Group 15 (Nitrogen group)25.3.4.1. Phosphorus(+5) oxide and chloride, and theirreaction with water5.3.4.2. Phosphorus(+3) oxide and chloride, and their2reaction with water5.3.4.3. Oxides of nitrogena. Reaction of NO to form NO2 1b. Dimerization of NO2 1c. Reaction of NO2 with water 15.3.4.4. Redox properties ofa. HNO3 and nitrates 1b. HNO2 and NH2NH2 35.3.4.5. Bi(+5) and Bi(+3) 35.3.4.6. Other compounds, properties and oxidation states 35.3.5. Group 16 (Oxygen group)15.3.5.1. The +4 and +6 oxidation states of sulfur, reactionof their oxides with water, properties of their acids5.3.5.2. Reaction of thiosulfate anion with I2 35.3.5.3. Other compounds, properties and oxidation states 35.3.6. Group 17 (Halogens)15.3.6.1. Reactivity and oxidant strength decreases from F2to I25.3.6.2. Acid-base properties of the hydrogen halides 115.3.6.3. The oxidation state of fluorine in its compounds is–15.3.6.4. The –1, +1, +3, +5, +7 oxidation states of chlorine 15.3.6.5. Mononuclear oxoanions of chlorine 25.3.6.6. Reactions of halogens with water 35.3.6.7. Reaction of Cl2O and Cl2O7 with water 35.3.6.8. Other compounds, properties and oxidation states 35.3.7. Group 18 (Rare gases) 3 5.4. Transition elements15.4.1. Common oxidation states of common transition metals:Cr(+2), Cr(+3) Mn(+2), Mn(+4), Mn(+7) Ag(+1)Fe(+2), Fe(+3) Co(+2) Zn(+2)Hg(+1), Hg(+2) Cu(+1), Cu(+2) Ni(+2)5.4.2. Colours of ions listed above in aqueous solution 25.4.3. Insolubility of Ag, Hg and Cu in HCl 25.4.4. M2+ arising by dissolution of the other metals in HCl 25.4.5. Cr(OH)3 and Zn(OH)2 are amphoteric and the other +22 oxides/hydroxides of the metals listed above are basic5.4.6. MnO4– and Cr2O72– are strong oxidants in acid solution 15.4.7. pH dependence of products of MnO4– acting as oxidant 25.4.8. Interconversion between CrO42– and Cr2O72– 35.4.9. Other compounds, properties and oxidation states 3 nthanides and actinides 3 5.6.Coordination chemistry including stereochemistry5.6.1. Definition of coordination number 115.6.2. Writing equations for complexation reactions given allformulae5.6.3. Formulae of common complex ions5.6.3.1. Ag(NH3)2+ 15.6.3.2. Ag(S2O3)23– 35.6.3.3. FeSCN2+ 35.6.3.4. Cu(NH3)42+ 15.6.3.5. Other complex ions 35.6.4. (6.5) Ligand field theory (e g and t2g terms, high and low spin) 35.6.5. Stereochemistry5.6.5.1. (6.7) cis and trans 35.6.5.2. enantiomers 3 5.7.Selected industrial processes5.7.1. Preparation of H2SO4 15.7.2. Preparation of NH3 15.7.3. Preparation of Na2CO3 25.7.4. Preparation of Cl2 and NaOH 25.7.5. Preparation of HNO3 26. Physical chemistry6.1.Gases6.1.1. Ideal gas law 16.1.2. van der Waal’s gas law 36.1.3. definition of partial pressure 26.1.4. Dalton’s Law 3 6.2. Thermodynamics6.2.1. First Law6.2.1.1. Concept of system and surroundings 26.2.1.2. Energy, heat and work 26.2.2. Enthalpy6.2.2.1. Relationship between internal energy and enthalpy 36.2.2.2. Definition of heat capacity 26.2.2.3. Difference between C p and C v (ideal gas only) 36.2.2.4. Enthalpy is a state prop erty (Hess’s Law) 26.2.2.5. Born-Haber cycle for ionic compounds 36.2.2.6. Use of standard formation enthalpies 26.2.2.7. Enthalpies of solution and solvation 36.2.2.8. Bond enthalpies (definition and use) 26.2.3. Second Law (Entropy and Free Energy)6.2.3.1. Entropy definition (d q / T) 36.2.3.2. Entropy and disorder 36.2.3.3. Entropy definition (S = k ln W) 36.2.3.4. Gibbs energy definition (∆G = ∆H –T∆S) 36.2.3.5. Using ∆G to predict direction of natural change 36.2.3.6. Relationship between ∆G︒ and equilibrium constant K 3 6.3.Equilibrium6.3.1. Acid-base6.3.1.1. Arrhenius definitions of acids and bases 16.3.1.2. Bronsted-Lowry definitions 16.3.1.3. Conjugate acids and bases 16.3.1.4. pH definition 16.3.1.5. K w definition 16.3.1.6. K a and K b as a measure of acid and base strength 16.3.1.7. Acidity or basicity of ions 16.3.1.8. Calculation of pH from p K a(weak acid) 16.3.1.9. Calculation of pH of a simple buffer solution 26.3.2. Gas phase6.3.2.1. Equilibrium constant in partial pressures 36.3.2.2. Relating K p and K c 36.3.3. Solubility6.3.3.1. Solubility constant (product) definition (K sp) 26.3.3.2. Calculation of solubility in water from K sp 26.3.4. Compleximetric6.3.4.1. Complex formation constant (definition) 36.3.4.2. Problems involving compleximetric equilibria 36.3.4.3. Lewis acids and bases 36.3.4.4. Hard and soft Lewis acids and bases 36.3.5. Phase6.3.5.1. Temperature dependence of vapour pressure 36.3.5.2. Clausius-Clapeyron equation 36.3.5.3. Single component phase diagramsa. triple point 3b. critical point 36.3.5.4. liquid-vapour systema. ideal and nonideal systems 3b. diagram 3c. use in fractional distillation 36.3.5.5. Henry’s Law 36.3.5.6. Raoult’s Law 36.3.5.7. Deviation from Raoult’s Law 36.3.5.8. Boiling point elevation 36.3.5.9. Freezing point depression 36.3.5.10. Osmotic pressure 36.3.5.11. Partition coefficient 36.3.5.12. Solvent extraction 36.3.6. Multiple6.3.6.1. Calculation of pH for multiprotic acids 36.3.6.2. Calculation of pH for weak acid mixtures 3 6.4.Electrochemistry6.4.1. Electromotive force (definition) 16.4.2. First kind electrodes 16.4.3. Standard electrode potential 16.4.4. Nernst equation 36.4.5. Second kind electrodes 36.4.6. Relationship between G and electromotive force 37. Chemical kinetics (Homogeneous reactions)7.1.Introduction7.1.1. Factors affecting reaction rate 17.1.2. Reaction coordinates and the basic idea of a transition state 1 7.2.Rate law7.2.1. Differential rate law 27.2.2. Concept of reaction order 27.2.3. Rate constant definition 27.2.4. First order reactions7.2.4.1. Dependence of concentration on time 37.2.4.2. Concept of half life 37.2.4.3. Relationship between half life and rate constant 37.2.4.4. Calculation of first order rate constant froma. differential rate law 3b. integrated rate law 37.2.4.5. Rate constant for second and third order reactions 3 7.3.Reaction mechanisms7.3.1. Concept of molecularity 37.3.2. Rate-determining step 37.3.3. Basic concepts of collision theory 37.3.4. Opposing parallel and consecutive reactions 37.3.5. Arrhenius’s law 37.3.5.1. Definition of activation energy 37.3.5.2. Calculation of activation energy 38. Spectroscopy8.1.UV/visible8.1.1. Identification of aromatic compound 38.1.2. Identification of chromophore 38.1.3. Dyes: colour vs structure 38.1.4. Beer’s Law 3 8.2.Infrared8.2.1. Interpretation using a table of frequencies 38.2.2. Recognition of hydrogen bonds 3 8.3.x-Ray8.3.1. Bragg’s Law 38.3.2. Concept of8.3.2.1. coordination number 38.3.2.2. unit cell 38.3.3. Solid structures8.3.3.1. NaCl 38.3.3.2. CsCl 38.3.3.3. metals 3 8.4.NMR8.4.1. General Concepts8.4.1.1. chemical shift 38.4.1.2. spin-spin coupling and coupling constants 38.4.1.3. integration 38.4.2. Interpretation of a simple 1H spectrum (like ethanol) 38.4.3. Identification of o- and p-disubstituted benzene 338.4.4. Interpretation of simple spectra of 13C (proton decoupled) andother 1/2 spin nuclei8.5.Mass spectrometry8.5.1.1. Recognition of molecular ion 38.5.1.2. Recognition of fragments with the help of a table 38.5.1.3. Recognition of typical isotope distribution 39. Organic Chemistry9.1.Introduction9.1.1. (3.1.1) Alkane naming (IUPAC) 19.1.2. Trends in boiling points of9.1.2.1. (3.1.3) alkanes with structure 19.1.2.2. (3.7.1) alcohols vs ethers due to hydrogen-bonding 19.1.3. (3.3.1, 3.4.1) Geometry at singly, doubly, and triply bonded1 carbon9.1.4. Identification of common functional groups 19.1.5. Isomerism of alkenes9.1.5.1. cis-trans 19.1.5.2. E/Z 39.1.6. Enantiomers9.1.6.1. Optical activity 29.1.6.2. R/S nomenclature 3 9.2.Reactivity9.2.1. Alkanes9.2.1.1. reaction with halogensa. products 1b. free radical mechanism (initiation, termination) 29.2.1.2. Cycloalkanesa. names 2b. Strain in small rings 3c. chair/boat conformations of cyclohexane 39.2.2. Alkenes9.2.2.1. Products from Br2, HBr and H2O/H+ 19.2.2.2. Markownikoff’s rule 29.2.2.3. Mechanism involving carbocation intermediates 39.2.2.4. Relative stability of carbocations 39.2.2.5. 1,4 addition to dienes 3 9.2.3. Alkynes9.2.3.1. Acidity relative to alkenes 39.2.3.2. Differences in chemical properties from alkenes 2 9.2.4. Benzene9.2.4.1. formula 19.2.4.2. stabilization by resonance 19.2.4.3. electrophilic substitution (nitration, halogenation)a. directing effect of first substituent 3b. effect of first substituent on reactivity 3c. explanation of substituent effects 39.2.5. Halogen compounds9.2.5.1. Nomenclature of monofunctional 19.2.5.2. Substitution reactionsa. giving alcohols 3b. in which halogen is exchanged 3c. reactivityi. primary vs secondary vs tertiary 3ii. aliphatic vs aromatic 3d. S N1 and S N2 mechanisms 39.2.5.3. Elimination reactions 29.2.5.4. Competition of elimination and substitution 2 9.2.6. Alcohols9.2.6.1. Nomenclature of monofunctional 19.2.6.2. Comparison of acidity of alcohols and phenols 29.2.6.3. Dehydration to alkenes 19.2.6.4. Esters with inorganic acid 29.2.6.5. Oxidation reactions 1 9.2.7. Aldehydes and ketones9.2.7.1. Nomenclature of monofunctional 19.2.7.2. Oxidation of aldehydes 19.2.7.3. Reduction to alcohols (LiAlH4, NaBH4) 39.2.7.4. Keto/enol tautomerism 39.2.7.5. Nucleophilic addition reactions witha. HCN 3b. RNH2 (R = alkyl, HO, NH2) 3c. enolate anions (aldol condensation) 3d. alcohols to form acetals/ketals 3e. Grignard reagents 39.2.8. Carboxylic acids and their derivatives29.2.8.1. Nomenclature of carboxylic acids and theirderivatives (esters, acid halides, amides)9.2.8.2. Acidity strength related to inductive effects 39.2.8.3. Preparation of carboxylic acids by hydrolysis ofa. esters (including soaps) 1b. amides 2c. nitriles 39.2.8.4. Reaction of carboxylic acidsa. with alcohols to form esters 1b. to form acid chlorides 3c. to form anhydrides 39.2.8.5. Reaction of acid chlorides to form amides 39.2.8.6. Mechanism of esterification 39.2.8.7. Multifunctional acids (hydroxyacids, ketoacids) 39.2.8.8. Polycarboxylic acids 39.2.9. Amines9.2.9.1. Nomenclaturea. simple amines 1b. recognition of primary, secondary, tertiary 19.2.9.2. Basicitya. As a property of an amine 1b. Comparison of basicity of aliphatic and aromatic 3c. Comparison of basicity of amines and amides 3d. Preparation of aminesi. from halides 3ii. from aromatic nitro compounds 3iii. from amides (by hydrolysis) 39.2.9.3. Diazotizationa. of aliphatic amines 3b. of aromatic amines 310. Polymers10.1Synthetic.10.1.1. Addition polymers10.1.1.1. polystyrene 210.1.1.2. polyethene 110.1.1.3. chain mechanism of formation 210.1.2. Condensation polymers10.1.2.1. polyesters 210.1.2.2. polyamides 210.1.3. Silicones 310.1.4. Concept of cross-linking and its affect on properties 3 10.2.Natural10.2.1. Silicates 310.2.2. Rubber 311. Biochemistry11.1.Carbohydrates11.1.1. Glucose and fructose11.1.1.1. chain formulae 111.1.1.2. Fischer projections 211.1.1.3. Haworth formulae 311.1.2. Difference between starch and cellulose 211.1.3. Difference between α- and β- D glucose 2 11.2.Fats11.2.1. Structure of fats in relationship to properties 211.2.2. Formula of glycerol 1 11.3.Nitrogen-containing Compounds of Biological Importance11.3.1. Amino acids11.3.1.1. Ionic structure 111.3.1.2. Isoelectric point 3211.3.1.3. 20 amino acids (classification with structuresprovided)11.3.1.4. Separation by electrophoresis 311.3.1.5. The peptide linkage 111.3.2. Proteins11.3.2.1. Primary structure 111.3.2.2. –S-S- bridges 311.3.2.3. Sequence analysis 311.3.2.4. Secondary structure 311.3.2.5. Details of α-helix structure 311.3.2.6. Tertiary structure 3211.3.2.7. Denaturation (change in pH, temperature,metals, ethanol)11.3.3. Nuclei Acids and Protein Synthesis11.3.3.1. Pyrimidine and purine 311.3.3.2. Nucleosides and nucleotides 311.3.3.3. Formulae of pyrimidine and purine bases 311.3.3.4. Difference between ribose and 2-deoxyribose 311.3.3.5. Base combination CG and AT (hydrogen-bonding) 311.3.3.6. Difference between DNA and RNA 311.3.3.7. Difference between mRNA and tRNA 311.4.Enzymes11.4.1.1. General properties, active centers 311.4.1.2. Nomenclature, kinetics, coenzymes, function of ATP 312. Analytical chemistry12.1.Titrations12.1.1. acid-base12.1.1.1. Titration curve; pH (strong and weak acid) 212.1.1.2. Choice of indicators for acidimetry 212.1.2. Redox titration 3 12.2.Qualitative analysis12.2.1. Ions (Inorganic)12.2.1.1. Identification of Ag+, Ba2+, Cl–, SO42– 212.2.1.2. Identification of other anions and cations 312.2.2. Organic functional groups12.2.2.1. Lucas reagent (1-, 2-, 3-alcohols) 312.2.2.2. Iodoform reaction 3312.2.2.3. Identification of primary, secondary, tertiary,quarternary amines in the laboratory12.3.Chromatographic methods of separation 3Part I Experimental partLevel 1: is assigned to the basic experimental activities which are supposed to be mastered by competitors very wellLevel 2: is assigned to the activities which are parts of school experimental exercises in developed countries and the authors of IChO tasks mayincorporate them into the tasks without being bounded to mention it inadvanceLevel 3: is assigned to such activities which are not in the chemistry syllabus in the majority of participating countries and the authors are obliged to mentionthem in the set of preparatory tasksIf the organizer wants to apply a technique which is not mentioned in the above syllabus, this technique is set to level 3 automatically.1. Synthesis of inorganic and organic compounds1.1. Heating with burners and hotplates 1 1.2. Heating of liquids 11.3. Handling the work with inflammable substances and materials 1 1.4. Measuring of masses (analytical balance) 11 1.5. Measuring of volumes of liquids (measuring cylinder, pipette,burette)1.6. Preparation of solutions from a solid compound and solvent 1 1.7. Mixing and dilution of solutions 1 1.8. Mixing and stirring of liquids 1 1.9. Using mixer and magnetic stirrer 2 1.10. Using a dropping funnel 1 1.11. Syntheses in flat bottom vessels – general principles 1 1.12. Syntheses in round bottom vessels – general principles 1 1.13 Syntheses in a closed apparatus – general principles 1 1.14. Using microscale equipment for synthesis 3 1.15. Apparatus for heating of reaction mixture under reflux 2 1.16. Apparatus for distillation of liquids at normal pressure 2 1.17. Apparatus for distillation of liquids at reduced pressure 2 1.18. Apparatus for steam distillation 3 1.19. Filtration through flat paper filter 1 1.20. Filtration through a folded paper filter 1 1.21. Handling a water vacuum pump 1 1.22. Filtration through a Büchner funnel 1 1.23. Suction through a glass filter 1 1.24. Washing of precipitates by decantation 1 1.25. Washing of precipitates on a filter 2 1.26. Drying of precipitates on a filter with appropriate solvents 2 1.27. Recrystallization of substances from aqueous solution 1 1.28. Recrystallization of substances from a known organic solvent 2 1.29. Practical choice of an appropriate solvent for recrystallization of a3 substance1.30. Drying of substances in a drying box 2 1.31. Drying of substances in a desiccator 2 1.32. Connecting and using of a gas washing bottle 21.33. Extraction with an inmiscible solvent 12. Identification of inorganic and organic compounds:general principles2.1. Test-tube reactions 1 2.2. Technique of reactions performed in a dot dish and on a filter paper 12 2.3. Group reactions of some cations and anions specified by theorganizer2 2.4. Selective reactions of some cations and anions specified by theorganizer2.5. Specific reactions of some cations and anions specified by the organizer 32 2.6. Identification of elements by flame coloration (using a platinumwire/MgO rod, Co-glass)2.7. Using a hand spectroscope/Bunsen spectroscope 3 2.8. Melting point determination with Kofler or similar type of apparatus 3 2.9. Qualitative evidence of basic functional groups of organic2 substances specified by the organizer3 2.10. Exploitation of some specific reactions for identification of organiccompounds (specified by the organizer)3. Determination of some inorganic and organic compounds:general principles3.1. Quantitative determinations using precipitation reactions 2 3.2. Igniting of a precipitate in a crucible 1 3.3. Quantitative volumetric determinations 1 3.4. Rules at titrating 1 3.5. Use of a pipetting ball 1 3.6. Preparation of a standard solution 2 3.7. Alkalimetric and acidimetric determinations 2 3.8. Color transitions of indicators at alkalimetric and acidimetric2 determinations3.9. Direct and indirect determinations (back titration) 3 3.10. Manganometric determinations 3 3.11. Iodometric determinations 3 3.12. Other types of determinations on basis of redox reactions 3 3.13. Complexometric determinations 3 3.14. Color transitions of solutions at complexometric determinations 3 3.15. Volumetric determinations on basis of precipitation reactions 33.16. Thermometric titration 34. Special measurements and procedures4.1. Measuring with a pH-meter 2 4.2. Chromatography on thin layers 3 4.3. Column chromatography 3 4.4. Separation on ion exchanger 3 4.5. Measuring of UV-VIS absorbances with a spectral photometer 34.6. Performing of conductivity measurements 35. Evaluation of results5.1. Estimation of experimental errors (significant figures, plots scales) 1。
国际化学奥林匹克竞赛

国际化学奥林匹克竞赛活动概况国际化学奥林匹克竞赛(International Chemistry Olympiad,IChO)是国际科学奥林匹克的一种。
1968年,首届IChO举办于捷克斯洛伐克的布拉格,以后年年举办(1971年除外)。
最初的参加国大多数都是前东欧集团的成员,而且1980年第12届奥地利IChO 以前,这项竞赛都没有在一个“资本主义”的国家里举办过。
赛体和赛制每支代表队由4名学生、2名导师组成,其中1名导师任领队。
每支代表队还可以有一名嘉宾(guest)和一名科学观察员(scientific observer)。
参赛学生年龄不得超过二十岁,且不得拥有高于中等教育的正式学籍。
大赛的国际信息中心(The International Information Center)设在斯洛伐克的布拉迪斯拉发。
一个国家要想派出选手参加IChO的比赛,必须首先连续两届向大赛派出观察员。
在36届IChO中,68个国家参加了大赛,其中7个只派出了观察员。
比赛由理论和实验两部分构成。
两部分比赛时限都是五个小时,不在同一天内举行(一般实验先考)。
两个部分的成绩是独立的。
理论部分占总分的60%,实验部分占40%;两个成绩之和即为选手的总分。
导师有责任把英文版的试题翻译成他们的母语,这样学生们用的考题就是用他们的母语写成的。
考试之后,考卷将由一个举办国指定的委员会评审。
导师可以在这一轮评审之后与大会裁判商议评分标准,以保证评分的公平。
这些工作应在奖项颁发前完成。
因为导师们在比赛开始之前事先了解了题目,所以学生和导师的任何交流都是严格禁止的。
考试大纲中的知识点涵盖化学中的多个领域,包括无机化学、有机化学、物理化学、分析化学、生物化学以及光谱学。
虽然大多数知识点都属于中学范畴,但其中很多问题都考察的更加深入,有些问题还需要高于中学要求的知识程度和理解能力。
IChO的主办国在比赛之前都要发行一套预备题,而这些题目所涉猎的专业知识明显深于一般中学乃至大学课程内容。
国际化学奥林匹克竞赛-41stIChOPreparatorySolutions

k2[NH+ ] k3
=
k2 k3
k1 k2
[N+] =
k1 k3
[N+ ]
d[
NH dt
+ 3
]
=
0
=
k3[
NH
2
+
][H
2
]
−
k4
[NH
+ 3
][H
2
]
[
NH
+ 3
]
=
k3 [ NH 2 + k4
]
=
k1 k4
[N+
]
d[
NH dt
4
+
]
=
0
=
k
4
[
NH
+ 3
][H
2
]
−
k5[
NH
4
+
][e
−
]
Kp
=
a(H 2 )3 a(CO) a(H 2O) a(CH 4 )
=
( p(H 2 ))3 ( p(CO))
p°
p°
( p(H 2O))( p(CH 4 ))
p°
p°
=
(x(H2 )
ptot p°
)3
( x(CO)
ptot p°
)
( x(H 2O)
ptot p°
)(x(CH 4 )
ptot p°
)
Ea = −(R)(slope) = −8.314 x −1042.9 = 8663.118 J mol-1 = 8.66 kJ mol-1.
ln A = intercept = -23.991
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
tube
8
2
3
4
5
6
7
9
10
11
12
13
14
NaOH (mL)
Acid (mmol)
tube
15
16
17
18
19
20
NaOH (mL)
Acid (mmol)
Fig. 2-2 Amount of acid(s) in each test tube
1 读万卷书 行万里路
旗开得胜
1 读万卷书 行万里路
e) amount of AA and SA eluted (30 marks)
Wavelength (nm) 470 490 510 530 550 570 590 610 630 650
Solution R
Absorbance Solution B
Solution MD
1 读万卷书 行万里路
Fig. 1-1 Absorption spectra of dyes (9 marks)
旗开得胜
1 读万卷书 行万里路
c) Concentration of R & B (Beer-Lambert law) (25 marks)
旗开得胜
1 读万卷书 行万里路
旗开得胜
Concentration of R in solution M
MD Concentration of B in solution
mL
NaOH solution equivalent to blank acidity of 1 mL water
mL
b) standardization of the NaOH solution (10 marks) KHP used (mL) NaOH consumed (mL) concentration of NaOH (M)
Circle the Set Number of Solution MD & MA you received.
旗开得胜
12345678
1-1. Spectrophotometric Analysis of R and B in a Mixed Solution
a), b) Absorbance measurements (3 marks)
M MD
1 读万卷书 行万里路
1-2. Chromatographic Separation Followed by Spectrophotometric
Analysis
旗开得胜
e) solution F (3 marks)
Wavelength 470 490 510 530 550 570 590 610 630 650
Fraction numbers used Total amount of AA eluted (1st peak) Total amount of SA eluted (2nd peak)
旗开得胜
mmol mmol
f) mole percent of AA in Solution MA (20 marks)
U-6
U-7
test
CH3CN
ㅇ
ㅇ
ㅇ
ㅇ
ㅇ
X
ㅇ
1M HCl
X
X
ㅇ
X
X
ㅇ
ㅇ
Solubilit water
X
X
ㅇ
X
X
ㅇ
X
y
1M
X
ㅇ
X
ㅇ
ㅇ
ㅇ
X
NaOH
Test 2 (DNPH) −
−
−
−
+
−
−
Test 3 (CAN)
+
−
−
+
+
+
+
Test 4 (KMnO4) −
−
+
+
+
−
+
Test 5 (pH)
n
a
n
a
a
a
1 读万卷书 行万里路
旗开得胜 2-1. Determination of the Total Amount of AA and SA in a Mixed Solution
a) blank titration (5 marks)
Volume of NaOH solution consumed for blank titration
(nm)
absorbance
f) Calibration curve (25 marks)
Concentration (M)
Absorbance at (
)
nm
Fig. 1-2 Calibration curve
g) Concentration of R in solution MD (30 marks)
b
Test 6 (FeCl3)
−
−
−
+
+
−
−
3-2 Identity of unknown compounds (70 marks)
1 读万卷书 行万里路
旗开得胜
U-1
U-2
U-3
U-4
U-5
U-6
U-7
M
K
Q
F
V
G
A
1 读万卷书 行万里路
Concentration measured
1 读万卷书 行万里路
旗开得胜 c) total amount of AA and SA in 1.00 mL of Solution MA (10 marks)
Solution MA used (mL)
NaOH consumed (mL)
AA and SA in 1 mL MA (mol)
Total amo行万里路
2-2. Reverse-phase Separation and Titration d) Amount of acid(s) in each test tube (25 marks)
旗开得胜
tube
1
NaOH (mL)
Acid (mmol)
AA from e) AA + SA from c)
mmol mmol
1 读万卷书 行万里路
旗开得胜
%
1 读万卷书 行万里路
Circle your Set. A B C D E F G H
旗开得胜
3-1 Test Result (31.5 marks)
unknown
U-1
U-2
U-3
U-4
U-5
