水稻条纹病毒胁迫下的水稻全基因组表达谱
利用酵母双杂交系统研究水稻条纹病毒三个功能蛋白的互作

嗣键 韵 :水稻 僚 纹病 毒 :酵母 雯雒 交 ;蛋 白互作 水 稻 僚 纹 某 枯 病 是 近 年 来危 害我 圆 水 稻 生 廑 的重要 病 毒病 , 病原 属 水稻保 纹病 毒 ( ie tp 其 Rc r e si vrsR V ) 缴绌 病毒 餍 ( euvrs i , S ,是 u Tn ii )的代 表成 u
De.0 7 ou ,No1 ( ntl) c2 0 ,V lme 1 . Mo h y
J u n lo rc lu a ce c n e h oo y SS 9 9 1 5 ,US o r a fAg iut r lS in ea d T c n lg ,I N1 3 -2 0 A
白,南病 毒 的 R NA3鱼缠编 码 ,其 含量 的高 低 舆寄 主所 表现瘤 状 的崴 重程 度有 着 正相 嗣性 ,并推 测
蛋 白是致病 相 尉 蛋 白…;S P是一 獯非 耋 楫 I 白 , 吉 生蛋
南病毒的 R A 编碍 , N 4 南于兹蛋白的存在舆否及其 含量 燮化 舆寄 主 的病程 有 繁密 的聪 系 ,因而 藕之 焉 病 害 特异蛋 白[;NS c 2 1 v4蛋 白南病毒 的 R NA4负锺
利用 Wetr.lt 可 以在病 蕖和带 毒 最健 内榆 s nbo 均 e
本 研究 利用 酵母 蔓 雅交 系统 ,榆 测了 R V 的 C S P、
测到运 侗蛋 白【,因此 目前 的 研究推 测 NS c 4 J v4蛋 白
s P和 N v4 侗重要功能蛋白自身及雨雨之『 的 S c } 刁
是一往多组分R A病毒 , N 其基因组 南4 往罩键 R A N ( i l s add R s ge t n e NA,sR A )组 成 ,分 别编 码 n —r sN
(完整版)水稻病害图谱

(完整版)水稻病害图谱-CAL-FENGHAI.-(YICAI)-Company One1一、真菌性病害1、稻瘟病叶瘟大田症状,稻瘟病为害造成的白穗苗叶瘟褐点型苗叶瘟慢性型叶枕瘟苗叶瘟病斑连片枝梗瘟穗颈瘟稻瘟病又称稻热病,是水稻上为害最重的病害之一,以日照少、雾露持续时间长的山区和气候温和的沿江、沿海地区为重。
病菌以菌丝体和分生孢子在稻草和稻谷上越冬,根据发病部位不同可分为苗叶瘟、叶瘟、节瘟、叶枕瘟、穗颈瘟、枝梗瘟、谷粒瘟。
以4叶期至分蘖盛期和抽穗期最易感病。
防治方法:1、采取“狠抓两头,巧治中间”的防治措施。
即狠抓苗叶瘟和穗瘟,巧治叶瘟。
选用抗病品种是防治稻瘟病的最有效的方法。
水稻生长前期实行浅水勤灌,适时适度烤田,后期干湿交替,促进稻叶老健;2、孕穗破口期(即有5%左右穗出现时,一般2—3天)是药剂防治的关键时期。
当苗期或分蘖期,稻叶出现急性型病斑或有发病中心的稻田,或周围田块已发生叶瘟的感病品种田和生长嫩绿的稻田,或在孕穗末期叶病率在2%以上、剑叶发病率的1%以上的田块应及时进行喷药。
常发区应在秧苗3—4叶期或移栽前5天喷药预防苗瘟。
穗颈瘟的防治适期在破口期和齐穗期;3、药剂可选用75%三环唑。
叶瘟掌握在初发病期用药,防治穗颈瘟,一定要在破口初期施用。
2、纹枯病纹枯病枯孕穗纹枯病包鞘叶鞘上不规则病斑纹枯病严重为害状纹枯病前期菌核纹枯病后期蜂窝状菌核纹枯病是水稻常发且为害重的病害,具有发生面广,大发生率高,为害重,损失大的特点。
病菌主要以菌核在稻田里越冬,菌核是最主要的初次侵染源。
早稻中后期和晚稻中前期是纹枯病发生发展的盛期,尤以水稻抽穗前后最烈,以分蘖期和孕穗期最易感病。
纹枯病是高温高湿的病害,也是多肥茂盛嫩绿型病害。
水稻施肥多,生长茂盛嫩绿,天气多雨时,往往发生严重。
长期灌深水,偏施迟施氮肥,造成水稻嫩绿徒长,田间郁闭、湿度增高,都有利于纹枯病的发展蔓延。
防治方法:1、采取“在插秧前消灭菌源,插秧后加强肥水管理,并结合发病初期防治,确保水稻倒三叶完好”的防治策略;2、每季耙田后要打捞漂浮在水面上的菌核,带出田外深埋或烧毁。
水稻APY1_基因克隆及胁迫表达分析

酸酶 GDA1 / CD39 家 族 特 征 结 构 域ꎬ 特 征 序 列 为
检测水 稻 幼 叶 中 OsAPY1 基 因 表 达 水 平ꎬ 如 图 3 所
大疏水值ꎬ 最大亲水值出现在第 325 位氨基酸附近ꎻ
水淹的情况下提升最为显著ꎬ 其次是干旱胁迫下ꎬ 分
(10 0%) ꎻ 在氨基酸序列 206 ~ 221 位存在 1 个核苷磷
中分布于细胞壁 [1] 、 高尔基体 [2] 、 核膜 [3] 等不同的细
胞器上ꎬ 可 将 胁 迫、 创 伤 期 间 积 累 在 细 胞 外 膜 中 的
eATP 水解为二磷酸苷 (ADP) 和一磷酸腺苷 (AMP)ꎮ
研究表明ꎬ 植物 APY 基因调控植物抗氧化、 生
长及抗逆反应
ꎮ 拟南芥的 APY 基因家族由 7 个成
图 1 OsAPY1 基因 CDS 区 PCR 检测
2 2 OsAPY1 蛋白生物信息学分析
OsAPY1 蛋白由 489 个氨基酸组成ꎬ 理论等电点
图 2 OsAPY1 蛋白进化树分析
为 5 72ꎬ 丙 氨 酸 含 量 最 高 ( 11 2%) 、 亮 氨 酸 次 之
2 4 多种胁迫下 OsAPY1 基因表达水平分析
20μL 反应体系ꎬ 按照 SYBR Green 说明书ꎬ 重复 3 次
实验ꎬ 2
-ΔΔCt
方法统计分析结果ꎮ
表 1 引物序列
基因
引物序列 (5’ —3’ )
用途
பைடு நூலகம்
OsAPY1
F1: ATGCGCCGCTTCTCGGCCꎻ R1: CTATGATGAAGATGCAACCT
普通 PCR
OsAPY1
OseEF-1
F: CAACCAGAATGGGTTACCGTTꎻ R: CTTCTGCAACTGGAGGAGCCT
水稻低磷胁迫基因表达谱分析

水稻低磷胁迫基因表达谱分析一、本文概述本文旨在深入研究水稻在低磷胁迫下的基因表达谱,以期理解并揭示水稻在应对磷饥饿胁迫时的分子机制。
磷是植物生长的重要营养元素之一,对水稻的生长发育起着至关重要的作用。
然而,土壤中磷的有效性往往受到土壤性质、气候条件和农业管理等多重因素的影响,导致磷的供应不足,进而影响水稻的生长和产量。
因此,了解水稻在低磷胁迫下的基因表达变化,对于提高水稻的磷利用效率,增强其对低磷环境的适应性,以及优化磷肥管理具有重要的理论和实践意义。
本研究将采用先进的生物信息学方法,结合高通量测序技术,全面分析水稻在低磷胁迫下的基因表达谱。
我们期望通过这一研究,能够鉴定出一批与低磷胁迫响应相关的关键基因,并揭示这些基因在磷饥饿胁迫下的调控网络。
我们也希望通过比较不同水稻品种或基因型在低磷胁迫下的基因表达差异,为培育磷高效利用的水稻新品种提供理论支持。
二、材料与方法本研究选用具有代表性的水稻品种(具体品种根据实验需求和背景资料选择),这些品种在磷胁迫条件下表现出不同的耐性。
主要试剂包括用于提取RNA的试剂、反转录酶、PCR引物、荧光定量PCR试剂等。
主要仪器包括PCR仪、荧光定量PCR仪、凝胶成像系统等。
将水稻种子种植在含有不同磷浓度的营养液中,以模拟低磷胁迫环境。
分别设置正常磷浓度和低磷浓度两组,每组包含三个生物学重复。
在水稻生长的不同阶段(如苗期、分蘖期等)进行取样。
采用Trizol法提取水稻叶片的总RNA,并通过反转录酶合成cDNA。
确保RNA的质量和cDNA的合成效率满足后续实验要求。
利用已知的水稻基因组信息,设计特异性引物,通过荧光定量PCR技术检测低磷胁迫下相关基因的表达水平。
对结果进行统计分析,比较不同处理组之间基因表达的差异。
使用Excel和SPSS等统计软件对实验数据进行整理和分析,绘制柱状图、折线图等图表,以直观展示基因表达谱的变化趋势。
通过方差分析和显著性检验,评估各处理组之间的差异显著性。
水稻条纹叶枯病的发生与水稻品种的关系以及条纹病毒检测与控制技术研究的开题报告

水稻条纹叶枯病的发生与水稻品种的关系以及条纹病毒检测与控制技术研究的开题报告
一、选题背景
水稻是我国最主要的粮食作物之一,也是世界上人类消费最多的粮
食之一。
水稻条纹叶枯病是由水稻条纹病毒引起的一种严重病害,该病
害在我国水稻生产中普遍存在,并造成了严重的经济损失。
目前,水稻
条纹叶枯病控制的主要方法是选用抗病品种,但是在实际生产中,由于
品种的谷质量、耐熟能力、品味口感等方面的差异,抗病品种的种植率
相对较低,而非抗病品种的种植面积占据了大多数。
因此,针对水稻条纹叶枯病的研究至关重要。
通过深入研究水稻品
种和条纹病毒的关系,以及开发有效的疫苗和化学药物来控制水稻条纹
叶枯病的发生,可以提高水稻抗病能力,促进我国水稻产业的健康发展。
二、研究内容
1.水稻品种与水稻条纹叶枯病的关系研究
该研究将选择一定数量的水稻品种,采用田间试验的方式,对不同
品种的水稻进行水稻条纹叶枯病的病害率和抗病力等相关指标进行测定,并研究不同品种种植密度、肥料用量、灌溉水量等因素对水稻条纹叶枯
病的影响。
2. 水稻条纹病毒检测与控制技术研究
该研究将通过PCR技术检测不同水稻品种的条纹病毒感染情况,以
及在不同环境条件下条纹病毒的传播规律,并探索新的化学药品或疫苗
来控制水稻条纹病毒的传播,以降低水稻条纹叶枯病的病害率。
三、研究意义
该研究不仅可以深入研究水稻品种和条纹病毒的关系,为水稻选育提供参考,提高水稻的抗病能力,更可以优化水稻种植的方式,为提高水稻的生产效益和质量打下基础。
同时,研究新的化学药品和疫苗提高水稻品质将有助于控制和减轻水稻条纹叶枯病的发生,促进水稻产业的健康发展。
抗水稻条纹病毒安全表达载体的构建及遗传转化

最 高( 1 6 . 3 3 ) , 其次分别是 2 : 1 ( 1 3 . 5 6 ) 、 1 : 1 ( 9 . 0 9 %) , 以1 : 2 时最低( 5 . 9 7 %) 。通过 r r 1 代 自交分 离和抗病性 筛选,
A b s t r a c t I n t h i s s t u d y ,a m a r k e r g e n e - f r e e R N A i n t e f r e r e n c e( R N Ai )v e c t o r p C MB I A1 3 0 1 4 - / 一R W a S c o n s t r u c t e d w i t h a p a r t i a l oa c t p r o t e i n( C P ) g e n e o f R S V. T h e v e c t o r s p C MB I A1 3 0 1 +/ - R a n d p C MB I A1 3 0 1 w e r e t r a sf n o r me d i n —
Co n s t r u c t i o n o f ma r k e r g e n e - f r e e RNAi v e c t o r a n d g e n e t i c t r a n s f o r ma t i o n o f r i c e me d i a t e d r e s i s t a n c e t o Ri c e s t r i p e v i r u s
抗病转基因水稻

抗病转基因水稻抗真菌蛋白基因工水稻稻瘟病和纹枯病(Rhizoctonia solani)是最严重的真菌性病害。
稻瘟病菌生理小种多且容易变异,生产中的抗性品种一般3~5年就可能丧失抗性。
纹枯病菌是典型的土壤寄生菌,寄主范围极广,至今尚未发现很好的抗性资源。
抗病基因工程为解决这一问题开辟了新的途径,植物来源的抗真菌蛋白具有安全性和有效性等优点,现已成为主要利用的抗源基因。
Nishizawa等将水稻几丁质酶基因Cht-2和Cht-3分别转入粳稻Nippobare和Koshihikari,发现转基因植株中Cht-2的产物在细胞内积累,而Cht-3的在细胞外积累。
转Cht-2或Cht-3基因植株的R0及R1代对稻瘟菌致病小种的抗性显著提高,而且与几丁质酶的表达量相关。
Lin等和Datta等将从水稻中克隆的Ⅰ类几丁质酶基因Chi11转入籼稻获得转基因植株。
RC-7是从受R.solani侵染的水稻品种IR58中分离的一个几丁质酶基因,其氨基酸序列与已知的水稻其它几丁质酶显著不同。
将RC-7基因转入IR72等品系后,转基因植株显著提高了对纹枯病菌的抗性。
天花粉蛋白(trichosanthin)是中药植物栝楼(Trichosanthes kirilowii)根部的一种可以使核糖体失活的植物蛋白,在体外对包括稻瘟菌在内的多种真菌有抗菌活性。
转trichosanthin基因的水稻能明显延迟或降低稻瘟病发生,转基因稻的鲜重也高于对照,且该基因高水平表达对水稻没有伤害。
但该基因在水稻中应用的安全性仍有待研究。
基于植保素的抗病基因工程植保素(phytoalexin)是植物受病原物侵染后产生的低分子量抗菌化合物,在植物抗病反应中起着重要的作用。
植保素合成途径中一些相关合成酶基因已被克隆,这使得从分子水平上调节植保素合成来增强抗病性成为可能并初见成效。
将葡萄的植保素相关基因在其自身启动子驱动下转入水稻,提高了对稻瘟病的抗性和白叶枯病的抗性。
水稻病毒病
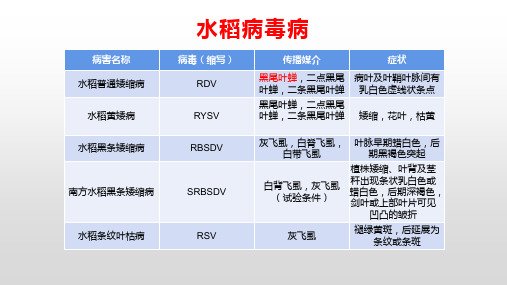
水稻黄矮病 水稻黑条矮缩病
南方水稻黑条矮缩病
水稻条纹叶枯病
水稻病毒病
病毒(缩写) RDV RYSV
传播媒介
症状
黑尾叶蝉,二点黑尾 叶蝉,二条黑尾叶蝉
黑尾叶蝉,二点黑尾 叶蝉,二条黑尾叶蝉
病叶及叶鞘叶脉间有 乳白色虚线状条点
矮缩,花叶,枯黄
RBSDV SRBSDV
RSV
灰飞虱,白脊飞虱, 叶脉早期蜡白色,后
● 南方水稻黑条矮缩病 南方水稻黑条矮缩病毒(SRBSDV) 斐济病毒属 1、形态结构 病毒粒体球状,直径70-75nm 2、寄主范围 范围较广,自然条件下可侵染水稻、玉米、薏米、白草和水莎草等。 3、生物学特性 RNA双链,共10个片段,目前基因组已经全部测定。 侵染时产生大量相当于细胞核的无明显边界的病毒基质,内含病毒粒体
● 水稻黄矮病:又称黄叶病、暂黄病,分布较广泛。在我国,1971-1982年,水稻黄矮病几度与普 通矮缩病并发,造成严重损失,其后,由于品种的更换和防治措施的加强,得到了有效的控制。 目前发生于局部地区,具有间歇性。
● 水稻黑条矮缩病:1952年于日本报道,在我国,该病在90年代以后危害上升,曾在杂交水稻上大 面积流行,部分重病田块甚至绝收。
● 水稻黄矮病 1、发生原因 发生危害主要与传毒介体在稻田吸毒传毒频率关系密切,不经卵传毒 2、越冬场所与初侵染源 带毒介体体内 3、传毒介体 黑尾叶蝉、二点黑尾叶蝉、二条黑尾叶蝉(不同地区主要介体不同) 4、再侵染源:早稻上繁殖的第一代成虫和晚稻上繁殖的第四代成虫是病毒循环中主要再侵染源 5、感病时期:水稻秧田2叶期至始穗期均可感病,分蘖期最敏感,孕穗期后一般不易感病。生育后 期感病潜育期相应较长,在一定温度范围内温度越高,潜育期越短
水稻条纹叶枯病如何防控

王立华, 张华荣, 丁晓东. 2010. 水稻条纹叶枯病 的防治技术[J]. 中国农 村科技,(10): 34-35.
07
相关链接
相关链接
发病症状
水稻条纹叶枯病是由灰飞虱传播的一种病毒病,多发生在苗期和分蘖期。发病时,叶片出 现黄绿色条纹,并逐渐扩展为黄白色长条斑。分蘖期发病会导致分蘖减少,甚至全株死亡 。
范仰东, 谢海波. 2009. 水稻条纹叶枯病的识别 与防治技术[J]. 浙江农 业科学,(6): 1289-1291.
蒋天梅, 谭宏. 2011. 水 稻条纹叶枯病的防治技 术[J]. 现代农业科技,(8): 194-195.
李明桃, 顾兴明, 张晓燕. 2009. 水稻条纹叶枯病 的诊断与防治技术[J]. 中国植保导刊,(4): 2931.
分布与危害
分布
水稻条纹叶枯病主要发生在亚洲、非洲和美洲的一些水稻种 植区。
危害
该病对水稻生产造成了严重的威胁,一旦大面积发生,会导 致水稻减产、品质下降,甚至绝收。
发生规律
01
02
03
传播途径
水稻条纹叶枯病主要通过 灰飞虱传播,灰飞虱是一 种在水稻田里活动的害虫 。
发生条件
高温、高湿、少日照等气 候条件有利于该病的发生 和传播。
在生产上,选择抗病性强的品种是预防水稻条纹叶枯病的重要措施之一。
栽培管理
肥水管理不当
过量施肥、灌水过多等不当的栽培管理措施容易导致水稻植株生长失衡,从而增加对水稻条纹叶枯病 的易感性。
做好田间卫生
及时清除田间的病残体和杂草,减少病毒的传播途径。
03
防控策略
农业防治
选用抗病品种
选择对条纹叶枯病抗性强 的水稻品种,降低感染风 险。
水稻条纹叶枯病发生规律及综合治理技术探讨

寄生在稻田;代若虫 8 4 月上中旬孵化 。 月下旬 ~9 8 月上旬 羽化为成虫; 代若虫 9 5 月上中旬孵化, 月下旬~l 月上旬 9 O 羽化为成虫。9 月下旬天气凉爽时以第 5 3 代 ~4龄若虫越 冬。灰飞虱以 1 第 代发生量最大、 最整齐, 其余各代世代重 叠现象较为明显, 世代重叠有利于灰飞虱种群繁衍。
1 2 田间病 害( . 条纹 叶枯病)
121 发病时间。条纹叶枯病病毒在水稻植株体内有一定 .. 潜伏期 , 潜伏期长短与温度和水稻生育期密切相关。温度较
高 , 稻处于分蘖期 之前 , 期较 短 , 水 潜伏 一般情 况下其潜伏 期 为 1-2d 5 0。水稻条纹 叶枯 病一般年 份 有 3 个发 病高 峰 , 第
维普资讯
上海农业科技
20 — 06 2
水稻条纹叶枯 病发生规律及综合 治理技术探讨
阚李斌 姜海平 丁兰兰 陈迎春 ( 江苏省如 东县植保植检站 2 60 ) 2 40
水稻条纹叶枯病是由灰飞虱传播 的一种病毒性病害, 近 年来呈逐年加重发生态势, 严重威胁水稻生产。该病发病之 初是在病株心叶沿叶脉出现断续的黄绿色或黄白色短条斑,
1 发病高峰 出现在 6月 中旬 ~7 初 , 1 月 由 代灰 飞虱成虫 集
中传毒所致。第 2发病高峰出现在 7月中下旬。 2 由 代灰飞 虱若虫和成虫在田间传毒所致; 3 第 发病高峰出现在 8 月中 下旬, 3 由 代灰飞虱若虫和成虫传毒所致。 122 品种抗性。条纹叶枯病发病程度在不同水稻品种间 ..
全基因组表达分析不同耐旱性水稻根系对不同强度干旱胁迫反应研究的开题报告

全基因组表达分析不同耐旱性水稻根系对不同强度干旱胁
迫反应研究的开题报告
1. 研究背景和意义
随着全球气候逐渐变暖和干燥,水稻作为全球最主要的粮食作物之一,其生产受到了日益严重的干旱胁迫。
干旱胁迫会导致水稻产量和品质的损失,进而影响全球粮食安全。
因此,研究水稻耐旱性的分子机制对于提高水稻抗旱能力、增加产量和改善粮食安全具有重要意义。
2. 研究的目的及内容
本研究旨在分析不同耐旱性水稻根系在不同强度干旱胁迫下的基因组表达特征,探讨不同强度干旱胁迫下水稻的响应机制,并为进一步研究水稻抗旱机制提供基础数据和理论支持。
具体内容包括以下几个方面:
(1)通过对不同耐旱性水稻根系的干旱胁迫处理,进行全基因组表达分析,筛选出关键的干旱应答基因和通路。
(2)对于所筛选出的干旱应答基因和通路进行功能富集分析,揭示不同基因功能在水稻耐旱中的贡献。
(3)对结果进行深入分析,进一步确定不同基因在水稻耐旱中的重要性及调节机制。
3. 研究的方法
本研究计划选取水稻中的两个耐旱性不同的品种(比如:IR64和N22),利用RNA-seq技术进行基因表达分析。
选取干旱胁迫时间和强度的组合,分别对耐旱品种和不耐旱品种进行干旱胁迫处理,分离并提取根系的RNA,分别建立转录组文库。
然后对所得到的转录组进行高通量测序,比较分析不同组样品的基因表达,筛选出差异表达基因,并进行相关通路和功能富集分析。
4. 研究的意义
通过本研究,可以深入探究水稻根系在不同强度干旱胁迫下的基因组表达特征,揭示不同干旱应答通路和机制,并为进一步研究水稻抗旱机制提供基础数据和理论支持,同时也有助于提高水稻的抗旱能力,增加水稻的产量和改善粮食安全。
水稻条纹叶枯病的发生与防治对策

加强科研与推广合作
加强科研力量的整合
鼓励科研机构、高校、企业等各方力量联合开展研究,加快科研 成果的转化和应用。
加强与农业部门的合作
与农业部门建立紧密的合作关系,共同推进水稻条纹叶枯病的防治 工作。
加强国内外的交流与合作
积极参与国际合作和交流,引进国外先进的防治技术和经验,提高 我国水稻条纹叶枯病防治的整体水平。
孤病毒科。
传播途径
病毒主要通过灰飞虱、白背飞虱等 昆虫传播,也可通过种子带毒传播 。
症状
病株叶片上出现黄绿色相间的条纹 ,叶片边缘常有紫红色或红色边缘 ,叶片变形、扭曲,严重时导致植 株死亡。
水稻条纹叶枯病的发病规律
发病条件
高温、干旱、少雨等不良气候条件有 利于病害的发生和传播。此外,稻田 管理不当、品种抗性差、病虫害防治 不及时等也会导致病害的发生。
CHAPTER 02
水稻条纹叶枯病的发生
水稻条纹叶枯病的分布与危害
分布
水稻条纹叶枯病在亚洲、非洲、 美洲等地均有分布,其中以亚洲 为主,包括中国、日本、韩国等 国家。
危害
水稻条纹叶枯病是一种严重的病 毒性病害,可导致水稻减产甚至 绝收,对农业生产造成巨大损失 。
水稻条纹叶枯病的病原特征
病原
水稻条纹叶枯病的病原是一种水 稻条纹病毒(RSV),属于呼肠
CHAPTER 06
参考文献
参考文献
赵德明,王玉安,杨文玉,等. 水稻条纹叶枯病的发生与防治对
策[J]. 安徽农学通报, 2008, 14(19): 64-65.
王晓琳,陈英,徐进,等. 水稻 条纹叶枯病的危害与防治方法
[J]. 农业科技通讯, 2010(7): 175-177.
张建华,杨红星,孟凡东,等. 水稻条纹叶枯病的诊断与防治技
水稻条纹叶枯病评价标准

水稻条纹叶枯病评价标准
1. 病程发展速度:评价标准是观察水稻叶片上的病斑扩展速度,病程发展速度较快的水稻条纹叶枯病会对水稻产量造成较大的危害。
2. 病斑颜色:评价标准是观察水稻叶片上的病斑颜色,通常水稻条纹叶枯病的病斑呈灰黑色或黄褐色,颜色较深的病斑表明病情较重。
3. 病斑形状:评价标准是观察水稻叶片上的病斑形状,通常水稻条纹叶枯病的病斑呈长条状,有时呈弧形,形状畸形的病斑表明病情较为严重。
4. 病斑数量:评价标准是观察水稻叶片上的病斑数量,病斑数量多的水稻条纹叶枯病会对水稻产量造成较大的影响。
5. 叶面感染程度:评价标准是观察水稻叶片整体上的感染程度,叶面感染程度大的水稻条纹叶枯病表明病情较重,可能会导致叶片凋萎、黄化等症状。
6. 病斑位置:评价标准是观察水稻叶片上病斑的分布位置,病斑位置多集中在叶片基部的水稻条纹叶枯病表明病情较重。
7. 病斑大小:评价标准是观察水稻叶片上病斑的大小,病斑面积大的水稻条纹叶枯病表明病情较重。
8. 抗病性:评价标准是观察水稻品种对水稻条纹叶枯病的抗病性,抗病性较强的品种会对水稻条纹叶枯病具有一定的抵抗能力。
9. 经济损失:评价标准是评估水稻条纹叶枯病对水稻产量的影响,经济损失较大的水稻条纹叶枯病对农民造成较大的经济负担。
10. 防治效果:评价标准是评估针对水稻条纹叶枯病采取的防治措施的效果,防治效果好的措施可以有效减轻病害造成的损失。
基于GEO数据库分析水稻低温胁迫关键基因

阮先乐.基于GEO数据库分析水稻低温胁迫关键基因[J].江苏农业科学,2024,52(3):61-66.doi:10.15889/j.issn.1002-1302.2024.03.009基于GEO数据库分析水稻低温胁迫关键基因阮先乐(周口师范学院生命科学与农学学院,河南周口466001) 摘要:为了筛选水稻在低温胁迫下的关键基因,从GEO数据库下载水稻4个数据集中的70个样本。
利用在线分析程序GEO2R进行共同差异表达基因分析,并对这些差异表达基因进行GO、KEGG分析,构建蛋白质互作网络,对关键基因构建热图。
结果表明,获得共同差异表达基因51个,其中上调表达基因1个,下调表达基因50个。
上述基因的GO分析结果表明,其细胞组成主要集中在细胞、细胞要素和细胞器上;在分子功能上,上述基因的功能主要集中在结合、催化活性上;在生物过程中,上述基因的功能主要集中在细胞过程、代谢过程和生物调控上。
KEGG信号通路分析结果表明,上述基因主要参与植物激素信号转导等通路。
在构建的共同差异表达基因的蛋白质网络中,有29个节点。
另外,得到10个关键基因、2个关键子网络。
研究结果为进一步研究水稻低温胁迫关键基因奠定了基础,也有利于水稻低温育种。
关键词:水稻;GEO数据库;低温胁迫;共同差异表达基因;GO功能分析;KEGG信号通路分析 中图分类号:S511.01;S126 文献标志码:A 文章编号:1002-1302(2024)03-0061-06收稿日期:2023-04-10作者简介:阮先乐(1977—),男,河南淮阳人,硕士,讲师,主要从事植物育种和生物信息学研究。
E-mail:ruanxianle@126.com。
水稻(OryzasativaL.)起源于热带与亚热带,是低温敏感型作物。
低温严重影响了水稻的产量和品质,也限制了水稻向高海拔、高纬度地区扩展[1]。
从全球范围来看,目前有24个国家约1500万hm2的水稻受到低温影响,在亚洲南部、东南部,约700万hm2的土地由于受到低温影响而无法种植水稻[2]。
转录组分析研究不同水稻品种对细菌条斑病的侵染

转录组分析研究不同水稻品种对细菌条斑病的侵染导读细菌性条斑病(BLS)是目前水稻的第四大疾病。
Dular和H359是两种对BLS有明显的水稻品种。
Dular品种抗性较高而H359品种易感。
本研究使用RNA-seq研究接种细菌性条斑菌不同时间后Dular 和H359的抗性反应的早期分子过程。
差异表达基因分析发现,在12和24小时后,Dular中有3031个DEGs和H359中有7161个DEGs。
H359中的差异表达基因明显多于Dular,下调基因明显多于上调基因。
GO和KEGG富集分析显示,Dular品种中的一些上调差异表达基因在苯基丙烷代谢通路中显著富集。
进一步比较和分析表明,两个品种中抗性相关的基因数量在感染BLS24小时后明显下降,抗性相关基因在早期阶段主要包括WRKY转录因子、受体激酶和MAPK信号通路相关基因。
本研究表明,抗性相关基因在感染早期发挥重要作用,本丙烷代谢相关基因可能响应Dular对BLS的抗性,从而为今后水稻BLS抗性的分子机制研究提供重要信息。
实验设计结果1 H359对BLS易感而Dular具有较高抗性B LS病变初期呈很小,深绿色的斑点,很快扩散到叶脉之间的深绿色到黄褐色的小斑点。
病变部位会有大量黄色液体小珠。
在感染严重下,条纹会呈现不规则的黄褐色斑点,类似于细菌性叶枯病。
Dular感染BLS后会表现出较强的抗性,会抑制病变的扩散。
BLS感染10天后,Dular病变长度一般小于0.5cm,然后H359的病变会快速扩散并达到5cm以上(图1)。
图1. Dular和H359表型。
a.两种水稻感染10天后表型。
b.病灶长度统计分析。
误差线表示重复。
2 Dular和H359接种BLS不同时间后DEGs的鉴定使用BGISEQ-500平台测序24个样本。
使用Trimmomatic对raw data进行过滤,得到clean reads。
每个样本平均数据量为6.27G,平均比对效率为90.58%(表1)。
水稻条纹叶枯病和黑条矮缩病灾变规律与绿色防控技术

水稻条纹叶枯病和黑条矮缩病灾变规律与绿色防控技术水稻条纹叶枯病和黑条矮缩病是水稻上常见的两种病害,对水稻的生长和产量有严重的影响。
本文将介绍这两种病害的灾变规律以及绿色防控技术。
一、水稻条纹叶枯病水稻条纹叶枯病是一种由病毒引起的病害。
主要特征是水稻叶片出现融合的长条形病斑,严重影响叶片的光合作用和营养物质的运输,导致水稻生长受阻、产量下降。
水稻条纹叶枯病具有以下的灾变规律:1.传播途径广泛:水稻条纹叶枯病主要通过虫媒传播,如蚜虫、叶蝉等。
这些昆虫吸食感染病毒的水稻叶片,再转移到健康的水稻上,从而迅速传播病原体。
2.季节性发生:水稻条纹叶枯病多发生在高温多湿的环境中。
在夏季和秋季,气温适宜且湿度较高,有利于病毒的繁殖和传播,因此病害会较为严重。
3.抗病品种选育效果不佳:目前没有完全抗水稻条纹叶枯病的水稻品种。
虽然通过选育耐病性较强的品种可以缓解病害的影响,但完全抵御病害的品种尚未出现。
针对水稻条纹叶枯病的绿色防控技术主要包括以下几个方面:1.病毒源斩断:通过清除病毒源,减少病毒传播的机会。
可以采取定期害虫监测和病毒检测,及时清除受感染的水稻植株或昆虫害源。
2.适宜的栽培措施:合理的田间管理措施可以增强水稻的抵御能力,减少病害发生的可能性。
比如合理施肥、保持适宜的水分和光照、加强病虫害防治等。
3.引种抗病品种:通过选育具有一定抗性的水稻品种来减轻病害的损失。
目前,研究人员正在通过杂交育种和基因编辑等方式,探索提高水稻抗病性的途径。
二、黑条矮缩病黑条矮缩病是由米拉病毒引起的一种病害。
病毒通过蚜虫等介介传播,感染水稻植株后,会引起叶片皱缩、叶鞘变黑、植株矮化等症状,严重影响水稻的生长和产量。
黑条矮缩病的灾变规律如下:1.疫情季节性:黑条矮缩病主要在春季和夏季发生。
高温潮湿的气候条件容易导致病毒的传播和繁殖,病害发生的机会更多,病情也较为严重。
2.病毒耐性演化:由于病毒有较高的遗传变异能力,不同的病毒株之间可能存在耐药性差异。
水稻条纹叶枯病

水稻条纹叶枯病日期:汇报人:•疾病概述•病原学•发病机理目录•疾病管理•案例研究•未来展望CHAPTER疾病概述01定义和症状经济重要性生态重要性疾病的重要性水稻条纹叶枯病的全球分布CHAPTER病原学02水稻条纹叶枯病的病原菌是一种病毒,属于稻飞虱传播的病毒之一。
该病毒粒子呈长条形,具有包膜,其核酸为单链RNA。
病原菌的描述病原菌的生活史病原菌的传播方式010203CHAPTER发病机理03病原菌的侵入机制030201病害发展过程潜育期随着病原菌的繁殖和扩散,水稻叶片开始出现黄化、枯斑等明显症状,严重影响水稻的光合作用和生长发育。
发病期病害加重水稻的抗病性机制物理屏障化学反应免疫反应CHAPTER疾病管理04疾病的监测和预报症状观察01病原检测02病情调查03疾病的防治策略选择具有抗病性的水稻品种进行种植,降低病害发生的风险。
种植抗病品种农业措施化学防治生物防治加强田间管理,合理施肥、灌溉和排水,提高水稻的抗病能力。
在病害发生初期,及时喷洒有效的杀菌剂进行防治,控制病害的扩散和蔓延。
利用拮抗菌、寄生性真菌等生物控制剂,对病原真菌进行生物防治,减少化学农药的使用。
抗病基因发掘抗病育种和生物技术的应用基因工程育种分子标记辅助育种生物技术在病害诊断中的应用CHAPTER案例研究05爆发情况管理措施水稻条纹叶枯病在亚洲的爆发及其管理抗病育种在抵抗水稻条纹叶枯病中的应用抗病育种意义培育具有抗病性的水稻品种是长期有效控制水稻条纹叶枯病的关键手段。
抗病育种方法利用现代生物技术手段,结合传统育种方法,挖掘和利用水稻中的抗病基因,培育出高产、优质、抗病的品种。
综合策略在控制水稻条纹叶枯病的效果评估综合策略内容效果评估CHAPTER未来展望06新型抗病育种的研究与发展基因编辑技术应用分子标记辅助育种抗病基因发掘03病害生物防治机制的深入研究生物技术在疾病管理中的应用前景01生防菌剂的研究与应用02生物农药的开发提升农户对水稻条纹叶枯病的认知与防控能力THANKS 感谢观看。
水稻条纹病毒与不同抗性水稻互作中的脱落酸调控

t e n t s i n Wu y u j i n g N o . 3 nd a K T 9 5 . 4 1 8 i n c ea r Se d b y 3 . 7 a n d 5 . 7 i t m e s r e s p e c t i v e l y . nd a he t n d e c e r a s d .R e e l- a t i m e q R T - P C R d e t e c -
he t i n t e r a c t i o n b e t we e n R S V a n d h o s t i r c e .En d o g e n o u s A BA l e v e l i n RS V. i n f e c t e d i r c e p l a n t s W S a e v lu a a t e d b y HP L C .AB A c o n .
中图分 类号 : Q 9 4 5 . 8 文献标识 码 : A 文章编号 5 - 0 4 6 6 - 0 5
T h e r o l e o f a h s d s i c a d d i n t h e i n t e r a c t i o n b e t w e e n h o s t r i c e( O r y z a s a a m)a n d/ / i c e s t r / p e俯獬
D I N G X i n — l u n , X I E L i - y a n , L I N Q i — y i n g , WU Z u - j i a n
( K e y L a b o r a t o r y o f P l a n t V i r o l o g y o f F u j i a n P r o v i n c e / I n s i t t u t e f o P l a n t V i r o l o g y , F u j i n a A g r i c u l t u r e
条纹叶枯病在不同品种水稻上自然发病情况探讨

日揭 膜 , 2天 , 立 水 层 2天 , 水 化 除 , 日再 建 水 层 至 晒 建 脱 隔
移 栽 。6月 2 4日移 栽 , 移栽 时 , 株 选 择 , 除 病 株 , 小 区 逐 剔 每
移 栽 面积 8 4平 方米 (1 × 2 米 4米) 。各小 区间 均 筑 埂 隔 离 。用
药 防 治 的 小 区 , 种 时用 吡 虫啉 W P浸 种 , 分 别 于 秧 田期 浸 并 和 大 田期 用 药 防 治灰 飞 虱 5次和 4次 。
近 年来 , 稻 条 纹 叶 枯病 已上 升 为 水 稻 的 最 主 要 病 害 之 水
一
头 、. 头 、. 头 。于 二 代 灰 飞 虱 卵孵 高 峰 期 的 6月 1 4 2万 4 4万 9 日调 查 , 育粳 3号 、 稻 3号 、 粳 93 武 徐 扬 5 8不 用 药 区 每 6 7 6 m2 灰 飞虱 分 别 为 2 . 头 、23万头 、48万 头 , 育 粳 3 有 8 6万 1. 1. 武 号 、 稻 3号 、 粳 93 徐 扬 5 8用 药 区 每 亩 有 灰 飞 虱 分 别 为 68 .万
头 、. 头 、. 头 。 66万 72万
,
病 害 一 旦 发生 , 田期 重 则 无 秧 可 栽 , 则 损 苗 1 2成 ; 秧 轻  ̄
Hale Waihona Puke 大 田期 重 则 减 少 有效 苗 3 5成 , - 轻则 减 少 1 3成 , 的达 到 - 重
5成 以上 。从 2 0 - 0 4年 田 间 为 害 的情 况来 看 。 同 品 种 0320 不
头, 均 4 平 。 , 区间 差 异 不 明显 。 5头 小
秧 田病 情 , 于移 栽 时记 数 病 健 株 , 算 病株 率 ; 田前 期 计 大 调 查 2次 病 情 , 于 灌 浆 期 分 别 进 行 测 产 , 价 其 不 同 品 种 并 评
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水稻条纹病毒胁迫下的水稻全基因组表达谱1张晓婷,谢荔岩,林奇英,吴祖建*,谢联辉*福建省植物病毒学重点实验室,福建农林大学植物病毒研究所,福建福州(350002)E-mail:zhangxiaoting921@摘要:水稻条纹叶枯病由水稻条纹病毒(Rice stripe virus,RSV)引起,对我国水稻生产危害严重。
为了明确RSV侵染对水稻基因表达谱的影响,采用Affymetrix水稻全基因组芯片对RSV接种后出现条纹症状第7天的武育粳3号水稻病叶和相应的健康叶片进行了全基因组表达谱分析,得到3517个差异基因,其中2002个表达上调,1515个表达下调。
根据TIGR数据库注释(/tdb/e2k1/osa1/)和MIPS基因功能分类标准(http://mips.gsf.de/projects/funcat)将差异基因归类为15个功能类别,多数差异基因与植物防御、信号传导及蛋白质、碳水化合物的代谢相关,一些转录因子的表达也发生了明显的变化。
代谢途径分析表明,RSV侵染后磷酸戊糖途径、类黄酮合成途径和芸苔素合成途径的相关基因表达明显增强,赤霉素合成途径相关基因的表达受到了抑制。
关键词:水稻条纹病毒,基因表达谱,代谢途径分析中图分类号:S432.1;S11+7水稻条纹病毒(Rice stripe virus,RSV)是纤细病毒属(Tenuivirus)的代表种,基因组由4条单链RNA组成,具有独特的基因组编码策略[1-3]。
其所致的水稻条纹叶枯病在我国多个省份广泛分布 [4],是当前我国水稻生产上最重要的病害之一。
该病的症状主要是心叶褪绿、捻转下垂,病叶褪绿斑驳[5]。
细胞超微结构研究表明,RSV侵染后的水稻叶肉细胞中线粒体明显增多,细胞核变大,叶绿体结构因症状严重度不同而有不同程度的破坏,并有淀粉粒的积累,叶肉细胞间及叶肉细胞与微管束细胞间胞间连丝明显增多,细胞质中出现蛋白体[6、7]。
病毒是严格的细胞内寄生生物,其侵染后不但干扰寄主的正常生长代谢,引起细胞形态的明显改变,还将利用寄主蛋白进行复制和增殖,导致其基因表达谱的巨大改变。
Senthil 等比较了苦苣菜黄脉病毒(Sonchus yellow net virus,SYNV)和凤仙花坏死斑病毒(Impatiens necrotic spot virus,INSV)侵染烟草不同时期后寄主的基因表达谱变化,发现在INSV侵染后2、4、5天分别有275、2646和4165个差异表达基因,SYNV侵染后5、11、14天分别有35、665和1458个基因差异表达 [8]。
Whitham等研究了5种RNA病毒侵染后拟南芥的基因表达谱,得到114个可能在多种RNA病毒与寄主互作中起普遍作用的基因,并将它们归类于8个功能类别 [9]。
高通量研究方法如基因芯片技术等可以为植物病毒与寄主的互作分析提供丰富的信息。
但相关研究多集中在烟草、拟南芥等双子叶植物,单子叶植物与病毒互作的基因表达谱研究相对较少。
Ventelon-Debout等通过构建cDNA文库研究水稻黄斑驳病毒(Rice yellow mottle virus, RYMV)侵染后的水稻基因表达谱,得到5549个水稻表达序列标签(EST),发现病毒侵染后能量代谢和光合作用相关的基因表达发生了变化[10]。
2007年Takumi Shimizu等首次报道了禾本科模式植物水稻与水稻矮缩病毒(Rice dwarf virus,RDV)互作的基因表达谱变化,得到686个差异表达基因 [11]。
为了明确RSV侵染后寄主的基因表达谱变化,深入了解单子叶植物寄主对多分体负单链RNA病毒的响应机制,我们选用对RSV高度敏感的水稻品种“武育粳3号”进行试验,以未经处理的健康植株为对照组,显症后一周的水稻条纹病株为实验组,分别与Affymetrix1本课题得到国家973项目(2006CB100203);国家自然科学基金项目(30671357);教育部博士点基金项目(20040389002,20050389006)的资助。
公司的水稻全基因组芯片进行杂交,系统分析其基因表达谱差异,以期为开创新的抗病策略奠定基础。
1.材料和方法1.1供试材料水稻品种是江苏省武进县稻麦育种场繁育的“武育粳3号”,RSV毒源为保存于本所的洪泽分离株,介体昆虫是采自江苏洪泽田间的无毒灰飞虱后代,水稻全基因组寡核苷酸芯片Genechip Rice genome array购自Affymetrix公司。
1.2生物学接种按常规生物学方法用生长至二叶一心期的稻苗进行病毒接种。
在出现条纹症状的第7天,分别剪取症状明显的病叶作为实验组,同时,从同一生长期的未接种健康植株上剪取相应的健康叶片作为对照组,在液氮中速冻,保存于-70℃备用。
1.3样品核酸的制备由北京博奥生物有限公司完成。
主要流程包括:用Invitrogen公司的Trizol试剂提取样品总RNA;以T7-Oligo(dT)为引物用SuperScriptII kit(Invitrogen)反转录合成双链cDNA;用Ambion公司的MessageAmp II-Biotin Enhanced Kit进行体外转录,合成生物素标记的cRNA并将其降解为35-200个碱基大小的cRNA片段,待于芯片杂交。
1.4芯片杂交、洗染和扫描本实验选用的Affymetrix Genechip Rice genome array共有探针57382套,包括了48564个粳稻和1260个籼稻序列信息,代表约46000个水稻基因,其中3’EST、mRNA转录本和全长cDNA克隆26000个,TIGR预测基因19431个。
芯片的杂交、洗脱、染色和扫描由北京博奥生物有限公司利用美国Affymetrix公司生产的“基因芯片检测工作站”专用设备完成。
1.5芯片数据分析利用Affymetrix GeneChip Operating Software Version 1.0(GCOS)软件对芯片扫描数据进行分析和处理。
首先对单张芯片进行背景校正,并采用默认参数进行归一化处理(Normalization),判断基因是否表达,然后分别比较对照组和实验组的芯片杂交信号,找出在两个材料的至少一个中表达且差异倍数大于2的探针组进行后续分析,具体方法见GCOS软件说明(https:///)。
1.6差异基因的功能分类根据Affymetrix网站NetAffy分析中心(https:///analysis/netaffx/)的基因注释和MIPS(http://mips.gsf.de/projects/funcat)[12]基因功能分类方案,将“武育粳3号”实验组和对照组表达差异在2倍以上的基因进行功能分类。
1.7代谢途径分析提取差异探针组所对应的基因位点号(Locus Identifier)(/tdb/e2k1/osa1/,TIGR)[13、14],用pathway tools软件[15]分析其所参与的水稻代谢途径。
2. 结果与分析2.1 样品RNA 纯度和完整性检测所提取总RNA 经分光光度计测定,含量均大于1µg/µl ;D260/D280比值介于1.8-2.0之间;变性凝胶电泳检测28S 、18S 两个核糖体RNA 条带清晰可见,无拖尾现象,说明RNA完整性很好。
2.2 芯片检测质量判定“武育粳3号”对照组和实验组叶片RNA 与水稻全基因组芯片杂交芯片的扫描结果显示,芯片左上角有一清晰的“GeneChip Rice”字样,周点线均匀,四角的点和中间的“+”字清晰,表明芯片质量可靠(图1)。
信号检测报告表明,两组芯片的背景值和噪音值都很低,且都很均匀,外加的阳性对照基因BIOC 、BIOB 、BIOD 及cre 均能检测到,质量控制有关数据见表1。
这些结果说明,本组基因芯片的质量和样品RNA 的提纯质量都很好,杂交和检测体系亦无问题,芯片检测结果可靠。
Fig.1 WuY un3 cRNA hybridization scanning. (a) one corner of GeneChip and “GeneChip Rice” symbol; (b)GeneChip central “+” symbol; (c) a part of hybridization scanning graph.Table 1 Expression report of hybridization with WuYun3 using Rice Whole Genome ArrayAvg Std Min Max Avg Std Min Max Backgroun 33.19 0.3 32.7 34.2 32.8 0.19 32.2 33.3Noise 1.27 0.04 1.2 1.41.17 0.04 1.1 1.3 Spike control : Probe Sig(5’) Det(5’) Sig(M’Det(M’)Sig(3’) Det(3’Sig(full) Sig(3’/5’)全AFFX-B373.6 P 701.8P 543.2 P 539.53 1.45 AFFX-B1081.7 P 1243.2 P 1162.45 1.15 AFFX-B4961 P 5569.9 P 5265.45 1.12 RSV-treate d AFFX-C17025.8 P 22242 P 19633.9 1.31 AFFX-B487.1 P 736.4P 568.9 P 597.46 1.17 AFFX-B1320 P 1459.1 P 1389.55 1.11 AFFX-B5669 P 6535.2 P 6102.10 1.15 Control AFFX-C 20123.2 P 26212.7P 23167.9 1.30BIOB, BIOC and BIOD represent genes involved in the biotin synthesis pathway of E. coli. CRE is therecombinase gene from P1 bacteriophage2.3样品检测结果利用Affymetrix GCOS软件分析“武育粳3号”对照组和实验组与水稻全基因组芯片杂交后的扫描结果,发现在所有57382套探针中40%以上的基因转录本在“武育粳3号”叶片中表达,其中对照组中共检测到25656个基因转录本的表达,占总数的44.7%,平均信号值为520.8;实验组中共检测到26073个,占总数的45.4%,平均信号值为445.4(表2)。
Table 2 Number of genes expressed in RSV-treated WuYun3 and controlRSV-treated Control Chip IDNumber Percentage Number Percentage Number present 25656 44.7 26073 45.4Number absent 31103 54.2 30663 53.4Number marginal 622 1.1 645 1.1Total probe sets 57381 100 57381 100采用默认参数(https:///)比较归一化处理后的对照组和实验组芯片,共得到差异在2倍以上的基因转录本3517个,占靶标基因总数的19.8%。
