【精品试卷】高考化学复习考点镁、铝元素单质及其重要化合物(复习必备)
高考一轮复习镁、铝及其重要化合物

3.氢氧化铝 (1)物理性质:白色胶状不溶于水的固体,有较强的吸附性。 (2)化学性质:
(3)制备:向铝盐中加入氨水 NaAlO2 溶液中通入足量 CO2, NaAlO2 溶液与 AlCl3 溶液混合:
特别提醒: 对氢氧化铝两性的理解 (1)平衡角度 (2)从化学式角度
若写成 Al(OH)3 的形式,可以理解为三元弱碱, 若写成 H3AlO3 的形式,可以理解为一元弱酸,
(4).工业炼铝的流程: 方案一 酸溶法 方案二 碱溶法
难溶于水 溶解度小于
碳酸镁
MgO+2H+===Mg2++H2O Mg(OH)2+2H+===Mg2++ 2H2O Mg2++2OH-===Mg(OH)2↓ MgCO3+H2O==△===Mg(OH)2 +CO2↑
镁及其化合物掌握要点 1.通性:从 Mg、MgO、Mg(OH)2 的物质类别分别为金属 单质、碱性氧化物、碱掌握其性质。 2.特性: (1)Mg 与 N2 反应生成 Mg3N2。 (2)Mg 在 CO2 中燃烧生成 MgO 和 C。 (3)MgO 不与水反应,熔、沸点高可作耐火材料。 (4)Mg(OH)2 为不溶于水的中强碱,加热易分解。
镁及其化合物的转化关系图
考点二 铝及其重要化合物 1.铝 (1)结构和存在 (2)物理性质 (3)化学性质
特别提醒: 1.由于氧化铝熔点高,在熔化铝时,液滴不会滴落。 2.与酸、强碱溶液的反应
3.铝热反应①现象 耀眼光芒,产生大量的热,使铁熔化成液态。 ②装置
③应用:冶炼金属和焊接铁轨。
(4)制备与用途 工业制取方法:化学方程式及电极反应式 用途:纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。 2.氧化铝
考点一 镁及其重要化合物的主要性质及应用 1.金属镁的性质
高考化学 考点汇总 考点11 镁、铝元素单质及其重要化合物

考点11 镁、铝元素单质及其重要化合物一、选择题1.(2012·天津高考·1)根据下列物质的化学性质,判断其应用错误..的是( )A.酒精能使蛋白质变性,可用于杀菌消毒B.CaO能与SO2反应,可作工业废气的脱硫剂C.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂D.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料【解题指南】解答本题要注意明矾加入水中起到净水作用而不是作漂白剂和杀菌消毒。
【解析】选C。
75%的酒精有杀菌消毒的作用,原理是使病菌的蛋白质变性而死亡,所以A正确;氧化钙和二氧化硫反应生成亚硫酸钙,起到除二氧化硫的作用,所以B正确;明矾放到自来水中,铝离子水解生成氢氧化铝胶体,吸附杂质起到净水作用,所以C错误;过渡金属的某些合金有吸附氢气的作用,所以D正确。
2.(2012·江苏高考·5)下列有关物质的性质与应用不.相对应的是( )A.明矾能水解生成Al(OH)3胶体,可用作净水剂B.FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路C.SO2具有氧化性,可用于漂白纸浆D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料【解题指南】解答本题时应牢记典型物质的性质和应用,搞清其中有关的化学原理。
【解析】选C。
A项,明矾水解生成的氢氧化铝胶体有吸附性,可作净水剂,A项正确;B项,三氯化铁溶液可以与铜反应,三氯化铁溶液用于蚀刻电路,B项正确;C项,二氧化硫的漂白是利用二氧化硫的漂白性,而不是氧化性,C项错误;D项,电池的电极应能导电,负极上发生氧化反应,D 项正确。
3.(2012·江苏高考·7)下列物质的转化在给定条件下能实现的是( )【解题指南】解答本题时应注意掌握中学化学常见物质的相互转化及相关方程式。
【解析】选A。
对于①:第一步转化Al2O3+2NaOH2NaAlO2+H2O,第二步转化2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO3或NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3;对于②:第一步转化不能一步实现,第二步转化SO3+H2O H2SO4;对于③:第一步转化NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,第二步转化 2NaHCO3Na2CO3+H2O+CO2↑对于④:第一步转化Fe2O3+6HCl2FeCl3+3H2O,第二步转化,FeCl3水解,得不到无水FeCl3;对于⑤:第一步转化Ca(OH)2+ MgCl2Mg(OH)2↓+CaCl2,第二步转化Mg(OH)2MgO+H2O;所以选A。
高考化学复习考点11 镁、铝元素单质及其重要化合物

考点11 镁、铝元素单质及其重要化合物1.(2015·安徽高考·12)某同学将光亮的镁条放入盛有NH 4Cl 溶液的试管中,有大量气泡产生。
为探究该反应原理,该同学做了以下实验并观察到相关现象,由此得出的结论不合理的是选项 实验及现象结 论 A 将湿润的红色石蕊试纸放在试管口,试纸变蓝反应中有NH 3产生 B 收集产生的气体并点燃,火焰呈淡蓝色 反应中有H 2产生 C 收集气体的同时测得溶液的pH 为8.0弱碱性溶液中Mg 也可被氧化D将光亮的镁条放入pH 为8.6的NaHCO 3溶液中,有气泡产生弱碱性溶液中OH -氧化了Mg2.(2015·福建高考·6)下列制作铅笔的材料与相应工业不对应的是 ····················· ( )A .橡皮擦——橡胶工业B .铝合金片——冶金工业C .铅笔芯——电镀工业D .铅笔漆——涂料工业3.(2015·山东高考·10)某化合物由两种单质直接反应生成,将其加入Ba(HCO 3)2溶液中同时有气体和沉淀产生。
下列化合物中符合上述条件的是 ································ ( ) A .AlCl 3B .Na 2OC .FeCl 2D .SiO 24.(2015·重庆高考·2)下列说法正确的是 ······················································ ( )A .I 的原子半径大于Br,HI 比HBr 的热稳定性强B .P 的非金属性强于Si,H 3PO 4比H 2SiO 3的酸性强C .Al 2O 3和MgO 均可与NaOH 溶液反应D .SO 2和SO 3混合气体通入Ba(NO 3)2溶液可得到BaSO 3和BaSO 45.(2015·江苏高考)在给定条件下,下列选项中所示的物质间转化均能一步实现的是 · ( )A .粗硅SiCl 4SiB .Mg(OH)2MgCl 2(aq)MgC .Fe 2O 3FeCl 3(aq)无水FeCl 3 D .AgNO 3(aq)[Ag(NH 3)2]OH(aq)Ag6.(2015·福建高考·24)无水氯化铝在生产、生活中应用广泛。
高考化学复习考点11 镁铝及其化合物.docx

高中化学学习材料鼎尚图文收集整理考点11 镁铝及其化合物1.(2013·山东理综·9)足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是A.氢氧化钠溶液B.稀硫酸C.盐酸D.稀硝酸答案:A2.(2013·上海化学·17)某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。
取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色衬垫;顾虑,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
由此可知原溶液中A.至少存在5种离子B.Cl-一定存在,且c(Cl-)≥0.4mol/LC.SO42-、NH4+、一定存在,Cl-可能不存在D.CO32-、Al3+一定不存在,K+可能存在【答案】B3.(2013·江苏化学·4)下列有关物质性质的应用正确的是A.液氨汽化时要吸收大量的热,可用作制冷剂B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸C.生石灰能与水反应,可用来干燥氯气D.氯化铝是一种电解质,可用于电解法制铝【参考答案】A4、(2013·广东理综·23)下列实验的现象与对应结论均正确的是选项操作现象结论A 将浓硫酸滴到蔗糖表面固体变黑膨胀浓硫酸有脱水性和强氧化性B 常温下将Al片放入浓硝酸中无明显变化Al与浓硝酸不反应C 将一小块Na放入无水乙醇中产生气泡Na能置换出醇羟基中的氢D 将水蒸气通过灼热的铁粉粉末变红铁与水在高温下发生反应23、答案:AC5.(2013·上海化学·23-26)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。
完成下列填空:23.铝原子核外电子云有种不同的伸展方向,有种不同运动状态的电子。
24.镓(Ga)与铝同族。
写出镓的氯化物和氨水反应的化学方程式。
高考化学铝、镁及其重要化合物一轮复习(解析版)

铝、镁及其重要化合物【考情分析】本讲内容在近五年高考新课标卷中共计考查6次,高考中一方面考查铝及其化合物的性质在日常生活、生产中的应用,另一方面以“铝三角”转化关系为载体,考查图像分析和计算能力等。
【核心素养分析】1.宏观辨识与微观探析:从微观的角度认识铝、镁的原子结构理解其性质,从宏观辨识铝、镁及其化合物的性质和应用,领悟结构决定性质。
2.科学态度与社会责任:通过观察铝、镁及其化合物的反应和反应事实,了解研究事物从个别带一般的思想方法,体验研究问题寻找规律的方法,领悟可持续发展意识和绿色化学理念。
3.科学探究与创新意识:通过比较、分析铝、镁及其化合物的性质和应用,培养归纳总结能力、分析问题能力、解决问题的能力,知道两性氧化物和两性氢氧化物的特征反应。
【网络构建】【知识梳理】知能点一铝的性质及应用1.铝的结构和存在铝位于元素周期表第3周期ⅢA族,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
3.金属铝的化学性质①4Al +3O 22Al 2O 3②2Al +Fe 2O 3=====高温2Fe +Al 2O 3 ③2Al +6H +===2Al 3++3H 2↑④2Al +2OH -+6H 2O===2[Al(OH)4]-+3H 2↑ 4.铝热反应5.铝的制备和用途 (1)制备原理电解熔融Al 2O 3:2Al 2O 3(熔融)=====电解4Al +3O 2↑。
【特别提醒】工业上冶炼Al 用电解熔融Al 2O 3而不用AlCl 3的原因是AlCl 3是共价化合物,熔融态不导电。
(2)铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
【特别提醒】铝与酸或碱反应生成H 2的量的关系 2Al +6HCl===2AlCl 3+3H 2↑2Al +2NaOH +6H 2O===2Na[Al(OH)4]+3H 2↑(1)等质量的铝与足量的盐酸、氢氧化钠溶液分别反应: ①产生H 2的物质的量相等。
高考化学一轮复习第09讲 镁、铝及其重要化合物(讲义)(解析版)

第09讲镁、铝及其重要化合物考情分析网络构建考点一镁及其化合物【夯基·必备基础知识梳理】知识点1镁的性质知识点2镁的氧化物MgO知识点3镁的氢氧化物Mg(OH)2知识点4镁的其他化合物【提升·必考题型归纳】考向1考查镁及其化合物的结构、性质及应用考向2考查镁及其化合物制备的工艺流程考点二铝及其化合物【夯基·必备基础知识梳理】知识点1铝的性质知识点2氧化铝知识点3氢氧化铝知识4常见的铝盐知识5数形结合与“铝三角”【提升·必考题型归纳】考向1考查铝及其化合物的结构、性质及其应用考向2考查铝热反应及其应用考向3考查铝及其化合物制备的工艺流程考向4考查铝及其化合物与强酸、强碱反应有关计算真题感悟考点要求考题统计考情分析镁、铝及其化合物的性质与应用2023浙江1月卷12题,2分2022浙江1月卷8题,2分2021浙江1月卷8题,2分从近三年高考试题来看,铝、镁及其化合物的性质与应用仍是高考的命题点。
高考中一方面考查铝及其化合物的性质在日常生活、生产中的应用,另一方面以“铝三角”转化关系为载体,考查图像分析和计算能力等。
预测新的一年高考可能会在选择题或化工流程图题中考查金镁、铝、氧化镁、氧化铝及氢氧化镁、镁、铝及其化合物的制备的工艺流程2023辽宁卷16题,3分2022全国卷26题,1分2021湖南卷6题,3分氢氧化铝的性质与应用或在化工流程图中考查铝及其重要考点一镁及其化合物知识点1镁的性质1.镁的原子结构及存在(1)镁的原子结构:镁元素在元素周期表中位于第三周期第ⅡA族,原子结构示意图为。
镁是较活泼的金属,在金属活动性顺序中位于铝、锌、铁的前面。
镁在化学反应中,能表现出较强的金属性,即失电子的能力强,是常用的还原剂。
(2)镁的存在:镁蕴藏量丰富,在宇宙中含量第八,在地壳中含量丰度2%。
含镁矿物主要来自白云岩[CaMg(CO3)2]、菱镁矿(MgCO3)、水镁矿[Mg(OH)2]、光卤石(KCl·MgCl2·6H2O)和橄榄石[(Mg,Fe)2SiO4]等。
高考化学复习考点11镁、铝元素单质及其重要化合物

温馨提示:此题库为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,关闭Word文档返回原板块。
考点11 镁、铝元素单质及其重要化合物一、选择题1.(2014·上海高考·8)BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。
由此可推测BeCl2( )A.熔融态不导电B.水溶液呈中性C.熔点比BeBr2高D.不与NaOH溶液反应【解题指南】解答本题时应注意以下两点:(1)注意题给物理性质;(2)熟悉AlCl3的化学性质。
【解析】选A。
根据“熔点较低,易升华,溶于醇和醚”可知BeCl2属于分子晶体,熔融态不导电,A正确;其化学性质与AlCl3相似,BeCl2水溶液也应水解显酸性,B 错误;对于组成相似的分子晶体,相对分子质量越大,熔沸点越高,故BeCl2熔点比BeBr2低,C错误;化学性质与AlCl3相似,故BeCl2能与NaOH溶液反应,D错误。
2.(双选)(2014·上海高考·22)已知:2Na[Al(OH)4]+CO22Al(OH)3↓+Na2CO3+H2O。
向含 2 mol NaOH、1 mol Ba(OH)2、2 mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是( )选项 A B C Dn(CO2)(mol) 2 3 4 6n(沉淀)(mol) 1 2 3 3【解题指南】解答本题时应注意以下两点:(1)要从离子反应的角度认识三种溶质与CO2反应的先后顺序;(2)碳酸钡、氢氧化铝与CO2反应不同。
【解析】选A、C。
原溶液中含有4 mol OH-、1 mol Ba2+、2 mol[Al(OH)4]-,1 mol CO2消耗2 mol OH-生成1 mol C,同时与1 mol Ba2+恰好反应生成1 mol BaCO3,再通入1 mol CO2又消耗2 mol OH-生成1 mol C,此时没有沉淀,A正确;再通入1 mol CO2与2 mol[Al(OH)4]-反应生成2 mol Al(OH)3,此时沉淀共3 mol,B 错误;再通入1 mol CO2与1 mol C生成2 mol HC,没有继续生成沉淀,C正确;再通入1 mol CO2与1 mol BaCO3反应,沉淀物质的量变为2 mol,再通入1 mol CO2时,CO2会与水发生反应,但沉淀质量不会发生变化,D错误。
高考化学一轮复习专题3.3镁、铝及其化合物(讲)(含解析)

专题3.3 镁、铝及其化合物1、掌握镁铝及其重要化合物的主要性质和应用。
2、掌握镁铝及其化合物之间的相互转化关系。
3、掌握镁铝及其化合物的探究性实验4、了解镁铝图像的基本原理,掌握其中的量的关系,并运用于解题。
5、掌握镁铝有关的实验问题。
一、镁铝的性质1、铝的结构和存在铝位于元素周期表第三周期ⅢA族,原子结构示意图为。
铝元素在地壳中含量丰富,仅次于硅,是地壳中含量最多的金属元素。
自然界中的铝全部以化合态存在;镁位于元素周期表中第三周期第ⅡA族。
2、金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
3、金属铝的化学性质图中有关反应的化学方程式或离子方程式: ①Al O 2⎩⎪⎨⎪⎧――——→ 常温 形成致密的氧化膜――——→ 点燃 4Al +3O 2=====点燃2Al 2O 3②2Al+3Cl 2=====点燃2AlCl 3③Al 酸⎩⎪⎨⎪⎧――――→氧化性酸遇冷的浓硫酸或浓硝酸钝化――――→非氧化性酸2Al +6HCl===2AlCl 3+3H 2↑④2Al+2NaOH +2H 2O===2NaAlO 2+3H 2↑ ⑤2Al+Fe 2O 3=====高温Al 2O 3+2Fe(铝热反应) 4、对比记忆镁的化学性质铝镁与非金属反应 能被Cl 2、O 2氧化2Mg +O 2=====点燃2MgO 3Mg +N 2=====点燃Mg 3N 2与水反应 反应很困难 能与沸水反应Mg +2H 2O=====△Mg(OH)2+H 2↑与碱反应 能溶于强碱溶液不反应与某些氧化物反应 能与Fe 2O 3、MnO 2、Cr 2O 3等金属氧化物发生铝热反应能在CO 2中燃烧: 2Mg +CO 2=====点燃2MgO +C纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
【典型例题1】【内蒙古巴彦淖尔一中2016届9月月考】将5.1g 镁铝合金,投入到500mL2.0molL 的盐酸中,金属完全溶解,再加入4.0molLNaOH 溶液,若要生成的沉淀最多,则NaOH 溶液的体积是()A.200mL B. 250ml C. 425mL D. 560mL【答案】B考点:考查镁铝反应的有关计算【点评】熟练镁铝的主要性质及应用,特别是镁铝的特性,如铝能发生铝热反应,铝能与强碱溶液反应生成氢气,镁能在二氧化碳中燃烧生成碳单质和氧化镁,为常考知识点。
考点14_镁、铝及其重要化合物-高考化学一轮复习考点全通关(解析版)
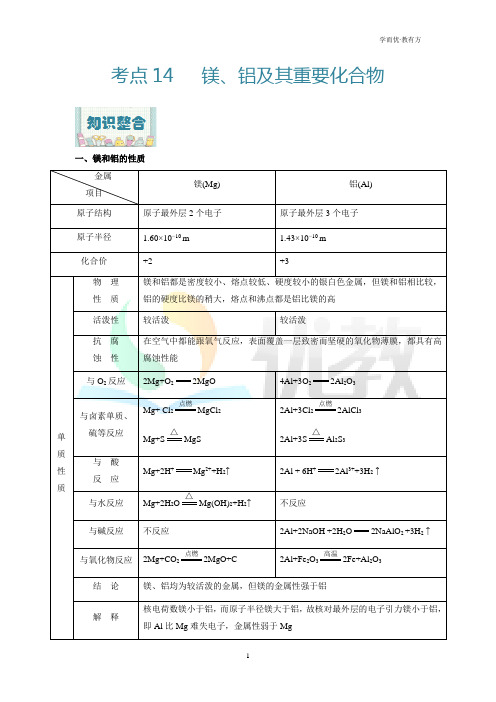
考点14 镁、铝及其重要化合物一、镁和铝的性质金属项目镁(Mg) 铝(Al)原子结构原子最外层2个电子原子最外层3个电子原子半径 1.60×10−10 m 1.43×10−10 m化合价+2 +3单质性质物理性质镁和铝都是密度较小、熔点较低、硬度较小的银白色金属,但镁和铝相比较,铝的硬度比镁的稍大,熔点和沸点都是铝比镁的高活泼性较活泼较活泼抗腐蚀性在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有高腐蚀性能与O2反应2Mg+O22MgO 4Al+3O22Al2O3与卤素单质、硫等反应Mg+ Cl2点燃MgCl2Mg+S△MgS2Al+3Cl2点燃2AlCl32Al+3S△Al2S3与酸反应Mg+2H+Mg2++H2↑2Al + 6H+2Al3++3H2↑与水反应Mg+2H2O△Mg(OH)2+H2↑不反应与碱反应不反应2Al+2NaOH +2H2O2NaAlO2 +3H2↑与氧化物反应2Mg+CO2点燃2MgO+C 2Al+Fe2O3高温2Fe+Al2O3结论镁、铝均为较活泼的金属,但镁的金属性强于铝解释核电荷数镁小于铝,而原子半径镁大于铝,故核对最外层的电子引力镁小于铝,即Al比Mg难失电子,金属性弱于Mg主要用途 镁合金汽车、飞机制造、照明弹等铝合金汽车、船舶、飞机制造、防锈 油漆、导线、电缆等二、铝及其化合物铝是“氢前”且其氧化物、氢氧化物均具有两性的金属代表,它是典型的轻金属。
学习铝的性质可类比知道铍、锌等元素的一般性质,复习时应从以下几个方面掌握: 1.树立物质转化思想 (1)理清知识主线Al→Al 2O 3←Al(OH)3→⎩⎪⎨⎪⎧NaAlO 2AlCl3Al 2SO43KAl SO42·12H 2O(2)形成网络构建2.重要反应规范书写 用方程式回答下列问题。
(1)用化学方程式表示除去铁粉中的铝粉。
2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑。
高考化学复习考点镁、铝元素单质及其重要化合物.docx

高中化学学习材料温馨提示:此题库为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,关闭Word文档返回原板块。
考点11 镁、铝元素单质及其重要化合物一、选择题1.(2013·山东高考·9)足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是( )A.氢氧化钠溶液B.稀硫酸C.盐酸D.稀硝酸【解析】选A。
稀硝酸与铝反应不会产生氢气,可排除D项;NaOH溶液、稀硫酸、稀盐酸均可与Al反应产生氢气,其对应关系分别为2NaOH~2Al,3H2SO4~2Al,6HCl~2Al,故相同质量的铝发生反应,消耗NaOH的物质的量最少,故本题答案选A。
二、非选择题2.(2013·浙江高考·26)氢能源是一种重要的清洁能源。
现有两种可产生H2的化合物甲和乙。
将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的H2(已折算成标准状况)。
甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。
化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。
请回答下列问题:(1)甲的化学式是;乙的电子式是。
(2)甲与水反应的化学方程式是。
(3)气体丙与金属镁反应的产物是(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_______________________________________________________________。
有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之_ 。
(已知:Cu2O+2H+Cu+Cu2++H2O)(5)甲与乙之间(填“可能”或“不可能”)发生反应产生H2,判断理由是_ 。
【解题指南】解答本题应注意以下两点:(1)白色沉淀可溶于NaOH溶液,该物质可能为Al(OH)3;(2)掌握根据标准状况下气体密度计算相对分子质量的方法。
2021届高考化学一轮复习学案:镁、铝及其重要化合物

镁、铝及其重要化合物考点一 镁、铝单质的性质与应用[知识梳理]一、镁及其重要化合物的性质与应用1.镁的性质(1)物理性质:银白色、具有金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电性、导热性和延展性。
(2)化学性质①与N 2反应:3Mg +N 2=====点燃Mg 3N 2;②与CO 2反应:2Mg +CO 2=====点燃2MgO +C ; ③与热水反应:Mg +2H 2O=====△Mg(OH)2+H 2↑;④与稀硫酸反应:Mg +H 2SO 4===MgSO 4+H 2↑。
Mg 在CO 2中能燃烧,所以Mg 着火时不能用二氧化碳灭火器和泡沫灭火器灭火。
2.海水提镁从MgCl 2溶液中得到无水MgCl 2固体需要两步。
第一步:将MgCl 2溶液用浓盐酸酸化,经蒸发浓缩、冷却结晶、过滤后得到MgCl 2·6H 2O ; 第二步:在干燥的HCl 气流中加热MgCl 2·6H 2O 晶体使其脱水得到无水MgCl 2。
3.镁的用途生产合金,冶金工业上用作还原剂和脱氧剂。
4.镁的重要化合物物质主要性质及反应方程式氧化镁碱性氧化物MgO+2H+===Mg2++H2O氢氧化镁中强碱Mg(OH)2+2H+===Mg2++2H2O溶解度小于碳酸镁MgCO3+H2O=====△Mg(OH)2+CO2↑氮化镁盐Mg3N2+6H2O=== 3Mg(OH)2+2NH3↑二、铝单质的性质与应用1.铝的结构和存在形式(1)铝位于元素周期表的第三周期ⅢA族,原子结构示意图为(2)铝是地壳中含量最多的金属元素,自然界中的铝全部以化合态的形式存在。
2.铝的物理性质铝是银白色、具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。
3.铝的化学性质根据上图写出以下序号对应的有关反应的方程式(能写离子方程式的写离子方程式):4.铝的用途纯铝可用作导线,铝合金可用于制造汽车、飞机、生活用品等。
[自主检测]1.判断正误(正确的打“√”,错误的打“×”)。
高三化学一轮复习镁铝知识点及练习题词(有答案)
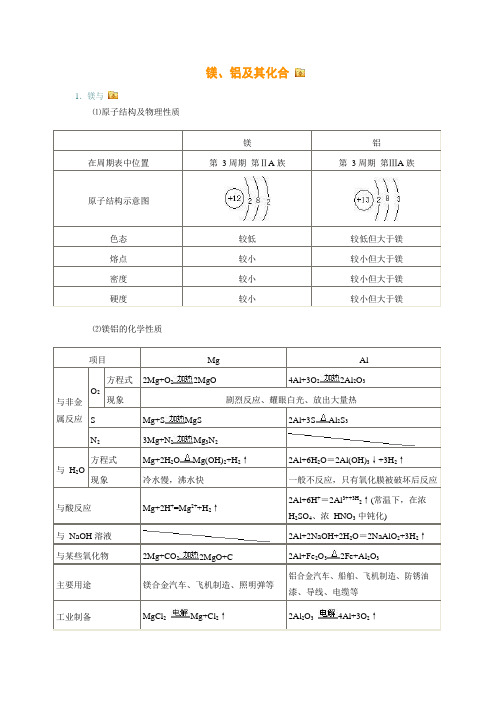
镁、铝及其化合1.镁与⑴原子结构及物理性质镁铝在周期表中位置第 3 周期 第ⅡA 族第3 周期 第ⅢA 族原子结构示意图色态 较低 较低但大于镁 熔点 较小 较小但大于镁 密度 较小 较小但大于镁 硬度较小较小但大于镁⑵镁铝的化学性质项目Mg Al与非金属反应O 2方程式 2Mg+O 2 2MgO4Al+3O 22Al 2O 3现象剧烈反应、耀眼白光、放出大量热SMg+S MgS 2Al+3SAl 2S 3N 23Mg+N 2 Mg 3N 2与 H 2O方程式 Mg+2H 2OMg(OH)2+H 2↑2Al+6H 2O =2Al(OH)3↓+3H 2↑ 现象冷水慢,沸水快一般不反应,只有氧化膜被破坏后反应与酸反应Mg+2H +=Mg 2++H 2↑2Al+6H +=2Al 3++3H 2↑(常温下,在浓 H 2SO 4、浓 HNO 3 中钝化)与 NaOH 溶液2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑ 与某些氧化物2Mg+CO 2 2MgO+C2Al+Fe 2O 32Fe+Al 2O 3主要用途镁合金汽车、飞机制造、照明弹等铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等工业制备MgCl 2Mg+Cl 2↑2Al 2O 34Al+3O 2↑2.镁和铝氧化物的对氧化物MgO Al2O3属类碱性氧化物两性氧化物色态白色粉末、熔点高白色粉末、熔点高化学性质H2O MgO+H2O=Mg(OH)2↓(反应缓慢进行)不溶解也不反应酸液MgO+2H+=Mg2++H2O Al2O3+6H+=2Al3++3H2O NaOH 溶液不溶解也不反应Al2O3+2NaOH=2NaAlO2+H2O重要用途制造耐火、耐高温材料制造耐火、耐高温器材,冶炼铝3.镁和铝的氢氧化物氢氧化物Mg(OH)2Al(OH)3属类碱两性氢氧化物色态白色固体白色固体溶解性难溶难溶电离方程式Mg(OH)2Mg2++2OH-H2O+AlO-+H+Al(OH)32Al3++3OH -与HCl 等酸溶液Mg(OH)2+2HCl=MgCl2+2H2O(可溶于NH4Cl 等强酸弱碱盐)Al(OH)3+3HCl = AlCl3+3H2O与NaOH 溶液不反应Al(OH)3+NaOH=NaAlO2+2H2O 热不稳定性Mg(OH)2MgO+H2O2Al(OH)3Al2O3+3H2O实验室制法可溶性镁盐加NaOH 溶液Mg2++2OH-=Mg(OH)2↓可溶性铝盐加氨水Al3++3NH3·H2O=Al(OH)3↓+3NH+44.铝及其化合物间相互转化、铝三角及相关图象开始无明显变化,先无明显变化,后2知识拓展:⑴Al(OH 3)的两性:H 2O+AlO -+H +Al(OH)3 Al 3++3OH -酸式电离碱式电离当向 Al(OH)3 中加入酸溶液,平衡向碱式电离方向移动,使 Al(OH)3 溶解。
高考化学总复习 第二章 第二节铝及其重要化合物试题(含解析)

目夺市安危阳光实验学校第二节铝及其重要化合物题号 1 2 3 4 5 5-1 6 6-1 7 8答案一、单项选择题1.铝是一种低毒金属元素,它并非人体需要的微量元素,不会导致急性中毒,但食品中铝的含量超过国家就会对人体造成危害。
下列关于铝元素的说法正确的是( )A.铝在空气中不易氧化是因为其性质不活泼B.氢氧化铝可与胃酸反应,常用作中和胃酸的药物C.明矾可用于饮用水的杀菌消毒D.硫酸铝铵常用作面粉膨化剂,该物质不溶于水解析:铝在空气中会与O2反应生成致密的氧化物薄膜,A错误;Al(OH)3能与盐酸反应,可做胃药(胃舒平的主要成分即为其),B正确;明矾溶于水生成Al(OH)3胶体,具有吸附杂质的性能,通常用作净水剂,但不能用于杀菌消毒,C错误;铵盐都溶于水,D错误。
答案:B2.下列有关反应现象的描述错误的是( )A.镁在空气中燃烧发出耀眼的白光B.蘸有NaCl的铂丝在酒精灯上灼烧,火焰为黄色C.铝箔在空气中加热失去光泽,但熔化的铝并不滴落D.将一小块钠投入到盛有乙醇的烧杯中,钠漂浮在液面上,熔成小球,四处游动解析:镁在空气中燃烧反应为2Mg+O2=====点燃2MgO,现象为发出耀眼的白光,A正确;钠元素的焰色反应为黄色,B正确;因为Al在加热时生成的是Al2O3,且Al2O3的熔点比Al的熔点高,所以熔化的铝并不滴落,C正确;钠密度大于乙醇,不会浮在液面上,且钠与乙醇反应不太剧烈,不能熔成小球,D错误。
答案:D3.下列关于铝的叙述中正确的是( )A.铝合金是一种混合物,它比纯铝的熔点高B.由于铝的导电性比铜、银都强,所以常用其制造电线、电缆C.由于铝具有强还原性,所以可以通过铝热反应冶炼某些高熔点金属D.常温下,由于铝与浓硫酸钝化时不反应,所以可用铝制槽车运送浓硫酸解析:合金的熔点比成分金属低,A错误;导电性Ag>Cu>Al,但从价格上考虑,一般选择Al制造电线、电缆,B错误;可用铝热反应冶炼Cr、Mn、Fe、W等高熔点,活泼性比Al弱的金属,C正确;常温下铝被浓硫酸钝化,发生了化学反应,D错误。
高考化学专题复习19镁、铝及其化合物(共80张PPT)

二、铝
1.结构和存在 铝的原子结构示意图为 。铝位于元素周期 表 第 3 周 期 第 Ⅲ A 族 ,自然界中的铝全部以 化 合 态 存在。
2.物理性质: 铝是 银 白 色、具有金属光泽的固体,硬度 较 小 ,具有
良好的 导 电 性 、导热性和延展性。
3.化学性质:
写出图中有关反应的化学方程式或离子方程式: ①__4_A_l_+__3_O_2_____2_A__l2_O__3 ___________________________。 ②__2_A_l_+__F_e_2_O_3_____2_F_e_+__A_l_2O__3______________________。 ③__2_A__l+__6_H__+_=_=__=_2_A_l_3+__+__3_H_2_↑______________________。 ④_______________________________________________。
2.物理性质: 镁是具有 银 白 色 金属光泽的固体,密度、硬度均较小,熔
点较低,有良好的导电、导热性和延展性。 3.化学性质:
①与非金属反应,如与N2、Cl2、O2的反应: 、
、
。
②与CO2反应: 。
4.制备和用途 (1)制备
(2)用途 纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
5.铝热反应
(1)本质
利用铝的还原性,将难熔金属从其氧化物中置换出来
2mAl+3MnOm
mAl2O3+3nM。
(2)反应特点
在高温下进行,反应迅速,放出大量的热。新生成的金
属单质呈液态且易与Al2O3分离。
(6)氧化铝是金属氧化物,也是碱性氧化物( × )。 (7)明矾水解时能生成具有吸附性的 Al(OH)3 胶粒,可用于 净水和消毒( × )。 (8)工业上可用电解熔融 AlCl3 制备单质 Al( × )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学学习材料
(灿若寒星**整理制作)
温馨提示:
此题库为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,关闭Word文档返回原板块。
考点11 镁、铝元素单质及其重要化合物
一、选择题
1.(2013·山东高考·9)足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是()
A.氢氧化钠溶液
B.稀硫酸
C.盐酸
D.稀硝酸
【解析】选A。
稀硝酸与铝反应不会产生氢气,可排除D项;NaOH溶液、稀硫酸、稀盐酸均可与Al反应产生氢气,其对应关系分别为
2NaOH~2Al,3H2SO4~2Al,6HCl~2Al,故相同质量的铝发生反应,消耗NaOH的物质的量最少,故本题答案选A。
二、非选择题
2.(2013·浙江高考·26)氢能源是一种重要的清洁能源。
现有两种可产生H2的化合物甲和乙。
将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的H2(已折算成标准状况)。
甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。
化合物乙在催化剂存在下可分解得到H2
和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。
请回答下列问题:
(1)甲的化学式是;乙的电子式是。
(2)甲与水反应的化学方程式是。
(3)气体丙与金属镁反应的产物是(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_______________________________________________________________。
有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之
_ 。
(已知:Cu2O+2H+Cu+Cu2++H2O)
(5)甲与乙之间(填“可能”或“不可能”)发生反应产生H2,判断理由是_ 。
【解题指南】解答本题应注意以下两点:
(1)白色沉淀可溶于NaOH溶液,该物质可能为Al(OH)3;
(2)掌握根据标准状况下气体密度计算相对分子质量的方法。
【解析】标准状况下6.72 L H2的物质的量为0.30 mol,则H2质量为0.60 g。
甲与水反应生成的白色沉淀可溶于NaOH溶液,则该白色沉淀为Al(OH)3。
甲中铝元素的质量为6.00 g-0.60 g=5.40 g,n(Al)=0.20 mol。
因此甲的化学式为AlH3。
AlH3与水反应的化学方程式为2AlH3+6H2O2Al(OH)3↓+6H2↑。
丙的相对分子质量为1.25×22.4=28,则单质丙为N2,因此乙为NH3。
NH3的电子
式为。
(4)Cu中可能混有Cu2O,根据题中信息,可向产物中加入少量稀硫酸,若反应后溶
液变蓝色,则说明含有Cu2O。
(5)甲与乙可能发生反应生成H2,因为AlH3中H为-1价,NH3中H为+1价,二者可能发生氧化还原反应生成H2。
答案:(1)AlH3
(2)2AlH3+6H2O2Al(OH)3↓+6H2↑
(3)Mg3N2
(4)2NH3+3CuO N2+3Cu+3H2O取样后加稀硫酸,如果溶液变蓝,说明产物中含有Cu2O。
反之则无Cu2O
(5)可能AlH3中H的化合价为-1价,NH3中H的化合价为+1价,因而有可能发生氧化还原反应生成H2
3.(2013·上海高考·23-26)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的应用。
完成下列填空:
(1)铝原子核外电子云有种不同的伸展方向,有种不同运动状态的电子。
(2)镓(Ga)与铝同主族。
写出镓的氯化物与氨水反应的化学方程式。
(3)硅与铝同周期。
SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。
盛放NaOH溶液的试剂瓶若用玻璃瓶塞性的硅酸盐而无法打开,发生反应的化学方程式为。
长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。
由钠长石化学式NaAlSi3O8可推知钙长石的化学式为。
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。
如:
2Al+4BaO 3Ba ↑+BaO ·Al 2O 3
常温下Al 的金属性比Ba 的金属性 (选填“强”“弱”)。
利用上述方法可制取Ba 的主要原因是 。
a.高温时Al 的活泼性大于Ba
b.高温有利于BaO 分解
c.高温时BaO ·Al 2O 3比Al 2O 3稳定
d.Ba 的沸点比Al 的低
【解题指南】解答本题应理解原子结构特点,运用元素周期律知识结合元素化合物知识推断陌生元素的性质。
【解析】(1)铝原子的核外电子排布式为1s 22s 22p 63s 23p 1,原子中存在1s 、2s 、2p 、3s 、3p 电子,1s 、2s 和3s 电子各有1个伸展方向,2p 电子有3个伸展方向,3p 只有1个电子则只有1个伸展方向,因此铝原子核外电子云共有7种不同的伸展方向。
铝原子中含有13个电子,则有13种不同运动状态的电子。
(2)镓(Ga)与铝同族,则镓的金属性比铝强,Ga(OH)3的碱性比Al(OH)3强,同样不溶于氨水,因此镓的氯化物和氨水反应的化学方程式为GaCl 3+3NH 3·H 2O Ga(OH)3↓+3NH 4Cl 。
(3)硅酸盐玻璃中含有
SiO 2,SiO 2可与NaOH 溶液反应:SiO 2+2NaOH Na 2SiO 3+H 2O 。
设钙长石中含有1个钙原子时,铝原子数为x,硅原子数为y,则氧原子数为1+1.5x+2y 。
根据题意,则有
1+1.5x+2y
1+x+y+1+1.5x+2y =813,则x=4y-6。
当y=2时,x=2,氧原子数为8,钙长石的化学式为CaAl2Si2O8。
(4)根据元素周期表,金属性Ba>Mg>Al。
利用反应2Al+4BaO3Ba↑+BaO·Al2O3制备金属Ba是因为金属钡的沸点低,容易气化,逸出反应体系,促使反应正向进行,收集钡的蒸气,可以得到金属钡。
答案:(1)713
(2)GaCl3+3NH3·H2O Ga(OH)3↓+3NH4Cl
(3)SiO2+2NaOH Na2SiO3+H2O
CaAl2Si2O8
(4)弱 d
关闭Word文档返回原板块。
