物理化学导读(刘国杰,黑恩成编著)思维导图
【中学思维导图】图解人教版高中化学选修3物质结构与性质

中考化学九阴真经免费d=0a49d28856374b059add6943c24a6b9129547aa319d24ebf 七彩教育网:(无需注册,免费下载中小学试题和课件)
中学物理化学实验免费视频课程在线看/8ko6kCR
更多思维导图(初高中各科)/blog/static/3440450120140921622359/ 中学物理化学实验免费视频课程在线看/8ko6kCR 存储+赚钱收益网盘推荐 /zQMUfzy
中考化学九阴真经免费订阅 /cgi-bin/qf_invite?id=0a49d28856374b059add6943c24a6b9129547aa319d24ebf 七彩教育网:(无需注册,免费下载中小学试题和课件)
中考化学九阴真经免费订阅 /cgi-bin/qf_invite?id=0a49d28856374b059add6943c24a6b9129547aa319d24ebf 七彩教育网:(无需注册,免费下载中小学试题和课件)
中考化学九阴真经免费订阅 /cgi-bin/qf_invite?id=0a49d28856374b059add6943c24a6b9129547aa319d24ebf 七彩教育网:(无需注册,免费下载中小学试题和课件)
中学物理化学实验免费视频课程在线看/8ko6kCR
更多思维导图(初高中各科)/blog/static/3440450120140921622359/ 中学物理化学实验免费视频课程在线看/8ko6kCR 存储+赚钱收益网盘推荐 /zQMUfzy
中学物理化学实验免费视频课程在线看/8ko6kCR
更多思维导图(初高中各科)/blog/static/3440450120140921622359/ 中学物理化学实验免费视频课程在线看/8ko6kCR 存储+赚钱收益网盘推荐 /zQMUfzy
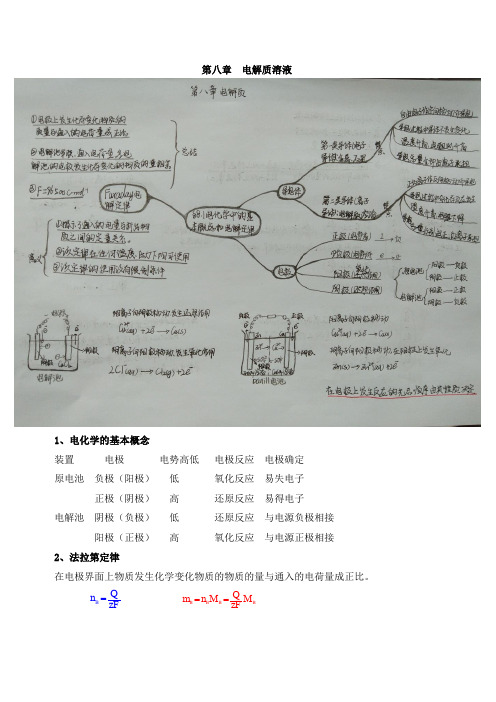
物理化学思维导图

物理思维导图1.电功(W):电流所做的功叫电功,2.电功的单位:国际单位:焦耳。
常用单位有:度(千瓦时),1度=1千瓦时=3、6×106焦耳。
3.测量电功的工具:电能表(电度表)4.电功计算公式:W=UIt(式中单位W→焦(J);U →伏(V);I→安(A);t→秒)。
5.利用W=UIt计算电功时注意:①式中的W、U、I与t就是在同一段电路;②计算时单位要统一;③已知任意的三个量都可以求出第四个量。
6、计算电功还可用以下公式:W=I2Rt ;W=Pt;W=UQ(Q就是电量);7电功率(P):电流在单位时间内做的功。
单位有:瓦特(国际);常用单位有:千瓦8、计算电功率公式:(式中单位P→瓦(w);W→焦;t→秒;U→伏(V);I→安(A)9.利用计算时单位要统一,①如果W用焦、t用秒,则P的单位就是瓦;②如果W用千瓦时、t 用小时,则P的单位就是千瓦。
10.计算电功率还可用右公式:P=I2R与P=U2/R 2、摄氏温度(℃):单位就是摄氏度。
1摄氏度的规定:把冰水混合物温度规定为0度,把一标准大气压下沸水的温度规定为100度,在0度与100度之间分成100等分,每一等分为1℃。
冰水混合为0度标准下沸水100度分成一百份每份就是一度3.作光路图注意事项:(1)、要借助工具作图;(2)就是实际光线画实线,不就是实际光线画虚线;(3)光线要带箭头,光线与光线之间要连接好,不要断开;(4)作光的反射或折射光路图时,应先在入射点作出法线(虚线),然后根据反射角与入射角或折射角与入射角的关系作出光线;(5)光发生折射时,处于空气中的那个角较大;(6)平行主光轴的光线经凹透镜发散后的光线的反向延长线一定相交在虚焦点上;(7)平面镜成像时,反射光线的反向延长线一定经过镜后的像;(8)画透镜时,一定要在透镜内画上斜线作阴影表示实心。
⑴长度的测量就是最基本的测量,最常用的工具就是刻度尺。
⑵.长度的主单位就是米,用符号:m表示,我们走两步的距离约就是 1米,课桌的高度约0、75米。
物化-教学大纲

《物理化学》教学大纲(专业指定选修课程,36学时)执笔人:孙睿一、教学思想物理化学是研究所有物质系统的化学行为的原理、规律和方法的学科,它是化学以及其他在分子层次上研究物质变化的学科领域的理论基础。
地球的演化是各种物理过程和化学过程(也包括生物过程)共同作用的结果,掌握物理化学的基本原理和方法是学习地质学相关专业课程(例如岩浆岩岩石学、变质岩岩石学、地球化学、岩石物理化学、石油地质学等)以及今后开展地球科学领域的生产和科研工作的重要基础。
在课时有限的情况下,本课程的教学思想是:遵循系统性、基础性、科学性的原则,结合地质学的特点和需求,精选教学内容,重点讲授化学热力学,兼顾表面化学,讲授做到既推理严谨、又深入浅出;充分利用现代教学手段,采用“启发式”和“讨论式”教学,调动学生的学习积极性和主观能动性;注重培养学生的逻辑思维能力和提出问题、分析问题、解决问题的能力。
通过该课程的学习,使学生掌握物理化学的基本原理和方法,为后续学习和工作打好基础。
二、学时分配与授课方式开课学期:0.5课内外总学时:36课内学时:36周学时:4学分:2授课方式:课堂讲授授课对象:地质学专业、地球化学专业、资源勘查工程专业各章学时分配:三、考试方式本课程成绩由平时成绩、期中考核成绩和期末考试成绩三部分组成。
其中平时成绩占20%,期中考核成绩占20%,期末考试成绩占60%。
平时成绩根据考勤、课堂纪律、学习态度、课堂表现和课后作业等评定,期中考核采用课堂测试、口试或研究作业的方式,期末考试(采用闭卷或开卷方式)成绩根据卷面评定。
四、教材和参考书选用教材:《物理化学简明教程》第四版,印永嘉、奚正楷、张树永等编,高等教育出版社,2007。
参考书:1. 《物理化学》第五版,傅献彩、沈文霞、姚天扬、侯文华编,高等教育出版社,2005。
2. 《物理化学》第二版,韩德刚、高执棣、高盘良编,高等教育出版社,2009。
3. 《物理化学》第五版,胡英、吕瑞东、刘国杰、黑恩成等编,高等教育出版社,2007。
相律中的其他限制条件_刘国杰

( )
( )
( )
[2 ] 其中不等式表明, 临界点代表了稳定机械平衡中的一个相 。故系统处于临界点时, 只有 1 个相, 且要 这两个等式便是强度性质 p c 和 T c 间的 2 个独 受式( 4 ) 中两个等式的制约。当物质的状态方程已知时, [3 ] 立的限制条件 。因此, 由相律可得临界点的自由度为: F = K - π + 2 - R - R' = 1 - 1 + 2 - 0 - 2 = 0 ③ 强度性质 T 与 x i 间的关系式。 这种关系式存在于二组分液液部分互溶系统中 。图 2 是这种系统的相图示意图。其中曲线为双节 c 点为会溶点( 亦称临界点) , 线, 由于 c 点是两个共轭的液相合二为一之处 , 系统在会溶点只有 1 个相。 [2 ] 但是, 由热力学扩散稳定性条件 得知, 该点必须满足如下关系: 2 3 μA μA μ A = 0, 2 = 0, 3 < 0 ( 5) x B c x B c x B c x B 为组分 B 的物质的量分数。T c 和 x B, 式中 μ A 为组分 A 的化学势, c 分别为会溶点的温度和组成 。 , ( 5 ) 2 由此可见 式 中的两个等式也是会溶点的 个独立的限制条件, 它们代表了 T c 和 x B, c 间的 2 个 [3 ] 独立的关系式 。于是, 由相律可得其自由度为: F = K - π + 1 - R - R' = 2 - 1 + 1 - 0 - 2 = 0 式中 +1 是因为这是一个凝聚系统, 压力的影响可以忽略不计。 ④ 强度性质 p 与 x i 间的关系式。 这种关系式存在于二组分混合物的气液临界点中 。以乙烷( 1 ) +正庚烷( 2 ) 二组分混合物的气液平 当混合物的组成不同时, 其临界点是不相同的, 图 3 是 2 个纯组分和 5 个不同组成混合物的气 衡为例,
《物理化学(全国中医药行业高等教育“十四五”规划教材)》读书笔记模板

第一节大分子化合 物
第三节大分子电解 质溶液
第四节凝胶 本章小结
思考题 习题
一大分子化合物的结构特征 二大分子化合物的相对摩尔质量
一大分子溶液的基本性质 二大分子化合物的溶解规律 三大分子溶液对溶胶的保护和敏化作用 四大分子溶液的渗透压 五大分子溶液的黏度 六流变性简介
一大分子电解质的定义与分类 二大分子电解质溶液的电学性质 三蛋白质水溶液的电泳 四大分子电解质溶液的稳定性 五大分子电解质溶液的黏度 六唐南平衡与渗透压
第十节化学 平衡
05
第九节化学 势在稀溶液 中的应用
附:非平衡态热力学 简介
本章小结
思考题 习题
一自发过程的共同特征 二热力学第二定律经验叙述
一卡诺循环 二卡诺定理
一可逆循环过程与可逆过程的热温商 二不可逆循环过程与不可逆过程的热温商 三熵增原理
一理想气体定温过程的熵变 二变温过程的熵变 三理想气体p、V、T均变化过程的熵变 四相变过程的熵变 五理想气体混合过程的熵变 六摩尔熵的计算
一可逆电池 二可逆电池的热力学
一生物电现象 二细胞膜电势 三生物传感器
第二节浓度对反应 速率的影响
第一节基本概念
第三节反应级数的 测定
第四节几种典型的复 杂反应
第五节温度对反应速 率的影响
第六节反应速率理论
第七节溶剂对反应速 率的影响
1
第八节催化作 用
2
第九节光化学 反应
3
本章小结
4
思考题
一生成简单低共熔混合物的系统 二形成化合物的二组分系统相图 三二组分系统部分互溶的固熔体相图
一三组分系统组成表示法 二部分互溶的三液体系统
一分配定律 二分配定律的应用——萃取
物化部分思维导图及总结
aRed aOx
对任意反应: cC dD gG hH
E
Ox|Red
()
Ox|Red
()
E
RT zF
ln
aGg aHh aCc aDd
(2)由电池电动势求反应的热力学函数
rGm zEF rGm RT ln Ka
由电动势E及其温度系数求反应的r H m和r Sm
例:习题 1 第十三章 表面物理化学
一.基本概念、基本知识
1、表面自由能 保持相应的特征变量不变,每增加单位表面积时,相应热力学函数的增
值。
U ( A )S,V,nB
H ( A )S,P,nB
F ( A )T,V,nB
G ( A )T,P,nB
表面自由能狭义定义: 保持温度、压力和组成不变,每增加单位表面积时,Gibbs 自由能
不同点:两者的物理意义不同,所用单位不同。
3、弯曲表面下的附加压力
液面水平,附加压力 Ps 等于零。
液面为凸形,附加压力 PS 大于零
液面为凹形,附加压力 PS 小于零
杨-拉普拉斯公式:
pS
2 R'
曲率半径 R’越小,附加压力越大
凸面 R’大于零,凸面下液体所受压力比平面下要大
凹面 R’小于零,凹面下液体所受压力比平面下要小 附加压力与毛细管中液面高度的关系: 2 cos gh
lg A | z z | I
离子平均质量摩尔浓度: m def (mm )1
a
m m
aB
(
m m
)
7、电导测定的应用计算
(1)计算弱电解质的解离度和解离常数
G-(ζ)图的一种错误表示

G-(ζ)图的一种错误表示黑恩成;刘国杰【摘要】指出了物理化学教材中有关G(ζ)图的一种错误表示,并阐明了错误的原因.【期刊名称】《大学化学》【年(卷),期】2015(030)001【总页数】3页(P72-74)【关键词】化学平衡;摩尔反应Gibbs自由能;G-(ζ)曲线【作者】黑恩成;刘国杰【作者单位】华东理工大学化学系上海200237;华东理工大学化学系上海200237【正文语种】中文【中图分类】O642;G64在物理化学教材中,为了判别化学反应进行的方向与限度,需要引入摩尔反应Gibbs自由能的概念,并形象地用G-ξ图来示意。
虽然在本杂志上已有学者[1]详细地讨论了这个图应该怎样画法,但此后出版的教材中,仍然可见错误的表示。
这便引发我们写此短文,试图更进一步阐明出错的原因,供大家讨论。
1 摩尔反应Gibbs自由能化学反应的方向与限度可由如下多相变组成系统的热力学基本方程[2]来描述:这里的第2个等式是因为在系统达热平衡、力平衡和相平衡时,各相的温度、压力和化学势是相等的,此时有:式中,为系统中组分i的物质的量的微变。
这就是说,式(1)能够适用于各种均相和多相化学反应[3]。
倘若系统中只发生一个化学反应,其反应计量方程为:式中,B代表反应物或产物,νB是它们的反应计量数,产物取正值,反应物取负值。
定义反应进度:用来表示反应进行的程度,式中nB0和nB分别为反应开始和任一时刻B物质的量。
由此可得:将式(6)代入式(1),得:若反应是在恒温、恒压和不做非体积功的封闭系统中进行,则有:式中(∂G/∂ξ)T,p即称摩尔反应Gibbs自由能,用ΔrGm表示;其负值亦称亲和势,以表示反应的亲和力。
不难看出,当反应正向进行时,反应进度的微变dξ>0,因此,(∂G/∂ξ)T,p的符号完全由dGT,p决定。
于是,根据Gibbs自由能减少原理,化学反应的方向和限度可由下式判别:式中不等号表示不可逆或反应的方向,等号表示可逆或反应的限度。
