ch5_aromatic
芳香烃的有机结构

CH3
CH2CH3 1-甲基-3-乙苯
或间甲乙苯
CH3
CH(CH3)2 1-甲基-4-异丙苯
或对甲异丙苯
4
三元相同烷基取代苯,有三种异构体:
CH3 CH3 CH3
(连三甲苯) 1,2,3-三甲苯
CH3 CH3
CH3 (偏三甲苯) 1,2,4-三甲苯
CH3
H3C
CH3
(均三甲苯) 1.3.5-三甲苯
苯分子结构及π电子云分布图
12
H
H H
π6 6
H H
H
13
•休克尔规则
在一个环形平面的离域体系中,当形成大л键的 л电子数符合 4n+2 (n=0,1,2,3…) 时, 该化合 物就具有芳香性,这一规则叫休克尔规则或4n+2 规则。
按此规则芳香性分子应具备三个条件: 1、分子必须为环状同平面。 2 、 构 成 环 的 原 子 必 须 都 是 SP2 杂 化 原 子 , 有 未 杂化的P轨道,能形成一个离域的π电子体系。 3、成环原子的P电子数等于4n+2(n为自然整 数)。
15
苯环上氢的亲电取代反应:苯环上 电子云密度高,易被亲电试剂进攻, 引起 C—H 键的氢被取代,称为亲 电取代反应。
16
亲电取代反应机理
苯与亲电试剂 E+ 作用时,生成 π 络合物,接着亲电试剂从苯环的 π 体系 中得到两个电子,生成 σ 络合物。此时, 这个碳原子由 sp2 杂化变成 sp3 杂化状 态,苯环中六个碳原子形成的闭合共轭
CH3 CH
CH3
异丙基苯
叔丁基苯
NO2
Cl
硝基苯
氯苯
2
二元相同烷基取代苯,有三种异构体:
芳香族烃类化合物

H
H
0.108nm
H
2.苯结构的解释: 价键法(VB) 6中心6电子的环状共轭大π键
2.1.3 单环芳烃的性质
1.物理性质 苯及同系物:无色液体,不溶于水 (非极性溶剂) 单环芳烃:比重<1,具有特殊芳香气味 单环芳烃有毒:损坏造血器官与神经系统 碳氢比较高,1:1,燃烧有黑烟。
CH3 CH3 2 , 3 _ 二甲基 _ 1 _ 苯基 _ 1 _ 己烯
苯乙烯
苯乙炔
2.多环芳烃
联苯类: 多苯代脂肪烃类:
2 CH3
1 1'
4' CH3
2 , 4' _ 二甲基联苯
(
)
3
CH
三苯甲烷
CH4 甲烷
CH=CH 1,2-二苯乙烯
3.稠环类:
α
891
7
2β
6
3
10
5
4
萘
CH3
1
5
CH3
+ 3 H2
N。i 180 ~ 210 C, 18MPa
2. 加氯反应:
+ 3 Cl2
紫外光
Cl
Cl
Cl
Cl
Cl
Cl
六氯化苯
三、 亲电取代反应: (Electrophilic Substitutional RXn)
卤代(-Cl,-Br)、 硝化(-NO2) 磺化(-SO3H) 付氏反应(烷基化或酰基化) 氯甲基化(-CH2Cl)
CH+ CH3
+ CH3CH2CH2Cl AlCl3
AlCl3
+
CH3CH2CH2
10
重排
+
第五章 芳香烃

苄基 (benzyl)
试写出(1)间-溴苯磺酸;(2)邻-硝基甲苯结构式。
SO3 H
CH3 NO2
Br
三、苯及其同系物的物理性质
不溶于水;毒性!
四、化学性质
“ 芳香性”:容易发生取代,不容易被氧化和加 成。 (一)苯的亲电取代反应
苯环π电子的高度离域形成一个富电子体系, 对亲电子试剂 能起提供电子的作用,易发生亲电取代反应。
CH CH2
苯乙烯 (phenylethene)
2-苯基丁烷 (2-phenylbutane)
CH3 H3C CHCH2 C C H
CH3
(E)-5-甲基-2-苯基-2己烯
(E)-5-methyl-2-phenyl2-hexene
芳基 “Ar”
或 C6H5 CH2 或 C6H5 CH2
苯基 (phenyl 或 Ph-)
Cl + Cl2
FeCl3
(α)
8
(α)
1 2(β) 3 (β)
(β) 7 (β) 6 (α)
5
(α)
4
(2)萘的硝化
NO2 + HNO3
H2SO4(浓)
(3)萘的磺化
SO3H
。 60C
+ H SO (浓) 2 4
165C
。
SO3H
3. 萘的加成反应
二环[4.4.0]癸烷
2 H2 Pt
四 氢 化萘
H H
120º 120o
H H H
120º
H
结构及性质特征: 所有原子共平面; 形成环状大π键 碳碳键长全相等; 环稳定、难加成、 难氧化、易取代
二、苯同系物的命名
CH(CH 3)2
有机化学-芳香烃

回美国,于1868年和1871年先后在康奈尔大学和马萨诸塞
理工学院任教授职。
1874-1891 年两人合作,1877年他们一起研究金属铝对某
克拉夫茨
些含氯有机化合物的作用时注意到,只是经过一段钝化作 James Mason Crafts
用之后反应才发生,然后生成氯化氢气体。他们发现钝化 期间生成氯化铝,而且正是氯化铝才激发了这个反应。原
H
H 1 4 0 p m 正六边形。
.H
120o
120o
H
108pm
. C-C键长: 140pm ; C-H键长: 108pm ;
H
H
.
键角120o
14
二. 苯的结构
2. 苯分子结构的近代观点
(1) 杂化轨道理论
共轭效应的结果: ①键长完全平均化 六个 C—C 键等长(0.140nm),比正常 C—C单键(0.154nm) 短,比正常C=C双键(0.134nm)长 ②体系能量降低 其氢化热(208.5 kj·mol-1)比环己烯氢化热的三倍小
H3O+ + NO2+ + 2 HSO4-
H
+ NO2
NO 2
+ H2SO4
27
亲电取代反应机理
非芳香性
第一步:
亲电进攻
E+Nu- fast
HE E+ slow
HE
E 络合物 σ -络合物
第二步:
fast + H+ 失去质子
芳香性
28
(一) 亲电取代反应 (Electrophilic Substitution) 3. 磺化
0o C 100o C
ch5_脂环烃_20081107

H2
催化剂
2. 分子内偶联
CH2Br
3,4元环:
H2C CH2Br
H
6 5 H H
HH HH 重叠式(存在扭转张力)
椅式构象占99.9%
船式构象占0.1%
影响环烷烃构象的稳定性因素
(1) 角张力 与正常键角的任何偏差都会产生角张力.
(2)扭转张力 相互连接的2个sp3杂化碳上的键与交叉 式构象的任何偏差都会引起扭转张力. (3)空间张力 非键合的原子或基团之间的距离小于Van der Waals半径之和时, 会产生排斥,即空间张力. H H H H H H H H H H H H H H H H H H H H H H H H 无角张力,存在扭 无角张力,几乎无扭 转张力和空间张力 转张力和空间张力
作业 P109 1,2,3,5,6,7,9
分子中含有碳环的烃称环烃,又称闭链烃,根 据结构和性质,又可分为: 脂环烃(alicyclic hydrocarbon) 环烃
单脂环烃 多脂环烃
——性质似脂肪烃
芳香烃(aromatic hydrocarbon) 苯型芳香烃 ——性质似苯 非苯型芳香烃
第一节 分类和命名
顺-1-甲基-4-叔丁基环己烷
CH3 (CH3)3C
C(CH3)3
取代环己烷的优势构象为: (1) e键取代基最多的构象。
大基团在e键 (优势构象)
CH3
(2) 有不同取代基时,大基团处于e键的构象。 例外: a 1,3-环己二醇
OH OH
3
2
1
H
杀虫剂六六六的最稳定构象是β-异构体而不是γ- 异构体:
二个碳环共有二个碳原子的称为稠环烃。命名可按 相应芳烃的氢化物或桥环烃的方法命名:
标准红外光谱图谱

Go to: home • ir • proton nmr • carbon nmr• mass specTable of Contents - IRI. HydrocarbonsII. Halogenated HydrocarbonsIII. Nitrogen Containing CompoundsIV. Silicon Containing Compounds (Except Si-O)V. Phosphorus Containing Compounds (Except P-O And P(=O)-O) VI. Sulfur Containing CompoundsVII. Oxygen Containing Compounds (Except -C(=O)-)VIII. Compounds Containing Carbon To Oxygen Double BondsI. HydrocarbonsA. Saturated Hydrocarbons1. Normal Alkanes2. Branched Alkanes3. Cyclic AlkanesB. Unsaturated Hydrocarbons1. Acyclic Alkenes2. Cyclic Alkenes3. AlkynesC. Aromatic Hydrocarbons1. Monocyclic (Benzenes)2. PolycyclicII. Halogenated HydrocarbonsA. Fluorinated Hydrocarbons1. Aliphatic2. AromaticB. Chlorinated Hydrocarbons1. Aliphatic2. Olefinic3. AromaticC. Brominated Hydrocarbons1. Aliphatic2. Olefinic3. AromaticD. Iodinated Hydrocarbons1. Aliphatic and Olefinic2. AromaticIII. Nitrogen Containing CompoundsA. Amines1. Primarya. Aliphatic and Olefinicb. Aromatic2. Secondarya. Aliphatic and Olefinicb. Aromatic3. Tertiarya. Aliphatic and Olefinicb. AromaticB. PyridinesC. QuinolinesD. Miscellaneous Nitrogen HeteroaromaticsE. HydrazinesF. Amine SaltsG. Oximes (-CH=N-OH)H. Hydrazones (-CH=N-NH2)I. Azines (-CH=N-N=CH-)J. Amidines (-N=CH-N)K. Hydroxamic AcidsL. Azo Compounds (-N=N-)M. Triazenes (-N=N-NH-)N. Isocyanates (-N=C=O)O. Carbodiimides (-N=C=N-)P. Isothiocyanates (-N=C=S)Q. Nitriles (-C≡N)1. Aliphatic2. Olefinic3. AromaticR. Cyanamides (=N-C≡N)S. Thiocyanates (-S-C≡N)T. Nitroso Compounds (-N=O)U. N-Nitroso Compounds (=N-N=O)V. Nitrites (-O-N=O)W. Nitro Compounds (-NO2)1. Aliphatic2. AromaticX. N-Nitro-Compounds (=N-NO2)IV. Silicon Containing Compounds (Except Si-O)V. Phosphorus Containing Compounds (Except P-O and P(=O)-O) VI. Sulfur Containing CompoundsA. Sulfides (R-S-R)1. Aliphatic2. Heterocyclic3. AromaticB. Disulfides (R-S-S-R)C. Thiols1. Aliphatic2. AromaticD. Sulfoxides (R-S(=O)-R)E. Sulfones (R-SO2-R)F. Sulfonyl Halides (R-SO2-X)G. Sulfonic Acids (R-SO2-OH)1. Sulfonic Acid Salts (R-SO2-O-M)2. Sulfonic Acid Esters (R-SO2-O-R)3. Sulfuric Acid Esters (R-O-S(=O)-O-R)H. Thioamides (R-C(=S)-NH2)I. Thioureas (R-NH-C(=S)-NH2)J. Sulfonamides (R-SO2-NH2)K. Sulfamides (R-NH-SO2-NH-R)VII. Oxygen Containing Compounds (Except -C(=O)-)A. Ethers1. Aliphatic Ethers (R-O-R)2. Acetals (R-CH-(-O-R)2)3. Alicyclic Ethers4. Aromatic Ethers5. Furans6. Silicon Ethers (R3-Si-O-R)7. Phosphorus Ethers ((R-O)3-P)8. Peroxides (R-O-O-R)B. Alcohols (R-OH)1. Primarya. Aliphatic and Alicyclicb. Olefinicc. Aromaticd. Heterocyclic2. Secondarya. Aliphatic and Alicyclicb. Olefinicc. Aromatic3. Tertiarya. Aliphaticb. Olefinicc. Aromatic4. Diols5. Carbohydrates6. PhenolsVIII. Compounds Containing Carbon To Oxygen Double BondsA. Ketones (R-C(=O)-R)1. Aliphatic and Alicyclic2. Olefinic3. Aromatic4. α-Diketones and β-DiketonesB. Aldehydes (R-C(=O)-H)C. Acid Halides (R-C(=O)-X)D. Anhydrides (R-C(=O)-O-C(=O)-R)E. Amides1. Primary (R-C(=O)-NH2)2. Secondary (R-C(=O)-NH-R)3. Tertiary (R-C(=O)-N-R2)F. Imides (R-C(=O)-NH-C(=O)-R)G. Hydrazides (R-C(=O)-NH-NH2)H. Ureas (R-NH-C(=O)-NH2)I. Hydantoins, Uracils, BarbituratesJ. Carboxylic Acids (R-C(=O)-OH)1. Aliphatic and Alicyclic2. Olefinic3. Aromatic4. Amino Acids5. Salts of Carboxylic AcidsK. Esters1. Aliphatic Esters of Aliphatic Acids2. Olefinic Esters of Aliphatic Acids3. Aliphatic Esters of Olefinic Acids4. Aromatic Esters of Aliphatic Acids5. Esters of Aromatic Acids6. Cyclic Esters (Lactones)7. Chloroformates8. Esters of Thio-Acids9. Carbamates10. Esters of Phosphorus AcidsPublished by Bio-Rad Laboratories, Inc., Informatics Division. © 1978-2004 Bio-Rad Laboratories, Inc. All Rights Reserved.Go to: home • ir • proton nmr • carbon nmr• mass specTable of Contents - Proton NMRI. HydrocarbonsII. Halogenated HydrocarbonsIII. Nitrogen Containing CompoundsIV. Silicon Containing Compounds (Except Si-O)V. Phosphorus Containing Compounds (Except P-O and P(=O)-O) VI. Sulfur Containing CompoundsVII. Oxygen Containing Compounds (Except -C(=O)-)VIII. Compounds Containing Carbon To Oxygen Double BondsI. HydrocarbonsA. Saturated Hydrocarbons1. Normal Alkanes2. Branched Alkanes3. Cyclic AlkanesB. Unsaturated Hydrocarbons1. Acyclic Alkenes2. Cyclic Alkenes3. AlkynesC. Aromatic Hydrocarbons1. Monocyclic (Benzenes)2. PolycyclicII. Halogenated HydrocarbonsA. Fluorinated Hydrocarbons1. Aliphatic2. AromaticB. Chlorinated Hydrocarbons1. Aliphatic2. AromaticC. Brominated Hydrocarbons1. Aliphatic2. AromaticD. Iodinated Hydrocarbons1. Aliphatic2. AromaticIII. Nitrogen Containing CompoundsA. Amines1. Primarya. Aliphaticb. Aromatic2. Secondarya. Aliphaticb. Aromatic3. Tertiarya. Aliphaticb. AromaticB. PyridinesC. Quaternary Ammonium SaltsD. HydrazinesE. Amine SaltsF. Ylidene Compounds (-CH=N-)G. Oximes (-CH=N-OH)H. Hydrazones (-CH=N-NH2)I. Azines (-CH=N-N=CH-)J. Amidines (-N=CH-N)K. Hydroxamic AcidsL. Azo Compounds (-N=N-)M. Isocyanates (-N=C=O)N. Carbodiimides (-N=C=N-)O. Isothiocyanates (-N=C=S)P. Nitriles (-C≡N)1. Aliphatic2. Olefinic3. AromaticQ. Cyanamides (=N-C≡N)R. Isocyanides (-N≡C )S. Thiocyanates (-S-C≡N)T. Nitroso Compounds (-N=O)U. N-Nitroso Compounds (=N-N=O)V. Nitrates (-O-NO2)W. Nitrites (-O-N=O)X. Nitro Compounds (-NO2)1. Aliphatic2. AromaticY. N-Nitro-Compounds (=N-NO2)IV. Silicon Containing Compounds (Except Si-O)V. Phosphorus Containing Compounds (Except P-O and P(=O)-O) VI. Sulfur Containing CompoundsA. Sulfides (R-S-R)1. Aliphatic2. AromaticB. Disulfides (R-S-S-R)C. Thiols1. Aliphatic2. AromaticD. Sulfoxides (R-S(=O)-R)E. Sulfones (R-SO2-R)F. Sulfonyl Halides (R-SO2-X)G. Sulfonic Acids (R-SO2-OH)1. Sulfonic Acid Salts (R-SO2-O-M)2. Sulfonic Acid Esters (R-SO2-O-R)3. Sulfuric Acid Esters (R-O-S(=O)-O-R)4. Sulfuric Acid Salts (R-O-SO2-O-M)H. Thioamides (R-C(=S)-NH2)I. Thioureas (R-NH-C(=S)-NH2)J. Sulfonamides (R-SO2-NH2)VII. Oxygen Containing Compounds (Except -C(=O)-)A. Ethers1. Aliphatic Ethers (R-O-R)2. Alicyclic Ethers3. Aromatic Ethers4. Furans5. Silicon Ethers (R3-Si-O-R)6. Phosphorus Ethers ((R-O)3-P)B. Alcohols (R-OH)1. Primarya. Aliphaticb. Olefinicc. Aromatic2. Secondarya. Aliphaticb. Aromatic3. Tertiarya. Aliphaticb. Aromatic4. Diols and Polyols5. Carbohydrates6. PhenolsVIII. Compounds Containing Carbon To Oxygen Double BondsA. Ketones (R-C(=O)-R)1. Aliphatic and Alicyclic2. Olefinic3. Aromatic4. a-Diketones and b-DiketonesB. Aldehydes (R-C(=O)-H)C. Acid Halides (R-C(=O)-X)D. Anhydrides (R-C(=O)-O-C(=O)-R)E. Amides1. Primary (R-C(=O)-NH2)2. Secondary (R-C(=O)-NH-R)3. Tertiary (R-C(=O)-N-R2)F. Imides (R-C(=O)-NH-C(=O)-R)G. Hydrazides (R-C(=O)-NH-NH2)H. Ureas (R-NH-C(=O)-NH2)I. Hydantoins, Uracils, BarbituratesJ. Carboxylic Acids (R-C(=O)-OH)1. Aliphatic and Alicyclic2. Olefinic3. Aromatic4. Amino Acids5. Salts of Carboxylic AcidsK. Esters1. Aliphatic Esters of Aliphatic Acids2. Olefinic Esters of Aliphatic Acids3. Aromatic Esters of Aliphatic Acids4. Cyclic Esters (Lactones)5. Chloroformates6. Carbamates7. Esters of Phosphorus AcidsPublished by Bio-Rad Laboratories, Inc., Informatics Division. © 1978-2004 Bio-Rad Laboratories, Inc. All Rights Reserved.Go to: home • ir • proton nmr • carbon nmr• mass specTable of Contents - Carbon NMRI. HydrocarbonsII. Halogenated HydrocarbonsIII. Nitrogen Containing CompoundsIV. Silicon Containing Compounds (Except Si-O)V. Phosphorus Containing Compounds (Except P-O And P(=O)-O) VI. Sulfur Containing CompoundsVII. Oxygen Containing Compounds (Except -C(=O)-)VIII. Compounds Containing Carbon To Oxygen Double BondsI. HydrocarbonsA. Saturated Hydrocarbons1. Normal Alkanes2. Branched Alkanes3. Cyclic AlkanesB. Unsaturated Hydrocarbons1. Acyclic Alkenes2. AlkynesC. Aromatic Hydrocarbons1. Monocyclic (Benzenes) and PolycyclicII. Halogenated HydrocarbonsA. Fluorinated Hydrocarbons1. Aliphatic2. AromaticB. Chlorinated Hydrocarbons1. Aliphatic2. AromaticC. Brominated Hydrocarbons1. Aliphatic2. AromaticD. Iodinated Hydrocarbons1. Aliphatic2. AromaticIII. Nitrogen Containing CompoundsA. Amines1. Primarya. Aliphaticb. Aromatic2. Secondarya. Aliphaticb. Aromatic3. Tertiarya. Aliphaticb. AromaticB. PyridinesC. Amine SaltsD. Oximes (-CH=N-OH)E. Quaternary Ammonium SaltsF. Nitriles (-C≡N)1. Aliphatic2. Olefinic3. AromaticG. Thiocyanates (-S-C≡N)H. Nitro Compounds (-NO2)1. Aliphatic2. AromaticIV. Silicon Containing Compounds (Except Si-O)V. Phosphorus Containing Compounds (Except P-O and P(=O)-O) VI. Sulfur Containing CompoundsA. Sulfides (R-S-R)1. Aliphatic2. AromaticB. Disulfides (R-S-S-R)C. Thiols1. Aliphatic2. AromaticD. Sulfones (R-SO2-R)VII. Oxygen Containing Compounds (Except -C(=O)-)A. Ethers1. Aliphatic Ethers (R-O-R)2. Alicyclic Ethers3. Aromatic EthersB. Alcohols (R-OH)1. Primarya. Aliphatic and Alicyclicb. Aromatic2. Secondarya. Aliphatic and Alicyclic3. Tertiarya. Aliphatic4. PhenolsVIII. Compounds Containing Carbon To Oxygen Double BondsA. Ketones (R-C(=O)-R)1. Aliphatic and Alicyclic2. AromaticB. Aldehydes (R-C(=O)-H)C. Acid Halides (R-C(=O)-X)D. Anhydrides (R-C(=O)-O-C(=O)-R)E. Amides1. Primary (R-C(=O)-NH2)2. Secondary (R-C(=O)-NH-R)3. Tertiary (R-C(=O)-N-R2)F. Carboxylic Acids (R-C(=O)-OH)1. Aliphatic and Alicyclic2. AromaticG. Esters1. Aliphatic Esters of Aliphatic Acids2. Olefinic Esters of Aliphatic Acids3. Aromatic Esters of Aliphatic AcidsPublished by Bio-Rad Laboratories, Inc., Informatics Division. © 1978-2004 Bio-Rad Laboratories, Inc. All Rights Reserved.Go to: home • ir • proton nmr • carbon nmr• mass specTable of Contents - MSComing SoonI. HydrocarbonsII. Halogenated HydrocarbonsIII. Nitrogen Containing CompoundsIV. Silicon Containing Compounds (Except Si-O)V. Phosphorus Containing Compounds (Except P-O And P(=O)-O) VI. Sulfur Containing CompoundsVII. Oxygen Containing Compounds (Except -C(=O)-)VIII. Compounds Containing Carbon To Oxygen Double BondsI. HydrocarbonsA. Saturated Hydrocarbons1. Normal Alkanes2. Branched Alkanes3. Cyclic AlkanesB. Unsaturated Hydrocarbons1. Acyclic Alkenes2. Cyclic Alkenes3. AlkynesC. Aromatic Hydrocarbons1. Monocyclic (Benzenes)2. PolycyclicII. Halogenated HydrocarbonsA. Fluorinated Hydrocarbons1. Aliphatic2. AromaticB. Chlorinated Hydrocarbons1. Aliphatic2. Olefinic3. AromaticC. Brominated Hydrocarbons1. Aliphatic2. Olefinic3. AromaticD. Iodinated Hydrocarbons1. Aliphatic and Olefinic2. AromaticIII. Nitrogen Containing CompoundsA. Amines1. Primarya. Aliphatic and Olefinicb. Aromatic2. Secondarya. Aliphatic and Olefinicb. Aromatic3. Tertiarya. Aliphatic and Olefinicb. AromaticB. PyridinesC. QuinolinesD. Miscellaneous Nitrogen HeteroaromaticsE. HydrazinesF. Amine SaltsG. Oximes (-CH=N-OH)H. Hydrazones (-CH=N-NH2)I. Azines (-CH=N-N=CH-)J. Amidines (-N=CH-N)K. Hydroxamic AcidsL. Azo Compounds (-N=N-)M. Triazenes (-N=N-NH-)N. Isocyanates (-N=C=O)O. Carbodiimides (-N=C=N-)P. Isothiocyanates (-N=C=S)Q. Nitriles (-C≡N)1. Aliphatic2. Olefinic3. AromaticR. Cyanamides (=N-C≡N)S. Thiocyanates (-S-C≡N)T. Nitroso Compounds (-N=O)U. N-Nitroso Compounds (=N-N=O)V. Nitrites (-O-N=O)W. Nitro Compounds (-NO2)1. Aliphatic2. AromaticX. N-Nitro-Compounds (=N-NO2)IV. Silicon Containing Compounds (Except Si-O)V. Phosphorus Containing Compounds (Except P-O and P(=O)-O) VI. Sulfur Containing CompoundsA. Sulfides (R-S-R)1. Aliphatic2. Heterocyclic3. AromaticB. Disulfides (R-S-S-R)C. Thiols1. Aliphatic2. AromaticD. Sulfoxides (R-S(=O)-R)E. Sulfones (R-SO2-R)F. Sulfonyl Halides (R-SO2-X)G. Sulfonic Acids (R-SO2-OH)1. Sulfonic Acid Salts (R-SO2-O-M)2. Sulfonic Acid Esters (R-SO2-O-R)3. Sulfuric Acid Esters (R-O-S(=O)-O-R)H. Thioamides (R-C(=S)-NH2)I. Thioureas (R-NH-C(=S)-NH2)J. Sulfonamides (R-SO2-NH2)K. Sulfamides (R-NH-SO2-NH-R)VII. Oxygen Containing Compounds (Except -C(=O)-)A. Ethers1. Aliphatic Ethers (R-O-R)2. Acetals (R-CH-(-O-R)2)3. Alicyclic Ethers4. Aromatic Ethers5. Furans6. Silicon Ethers (R3-Si-O-R)7. Phosphorus Ethers ((R-O)3-P)8. Peroxides (R-O-O-R)B. Alcohols (R-OH)1. Primarya. Aliphatic and Alicyclicb. Olefinicc. Aromaticd. Heterocyclic2. Secondarya. Aliphatic and Alicyclicb. Olefinicc. Aromatic3. Tertiarya. Aliphaticb. Olefinicc. Aromatic4. Diols5. Carbohydrates6. PhenolsVIII. Compounds Containing Carbon To Oxygen Double BondsA. Ketones (R-C(=O)-R)1. Aliphatic and Alicyclic2. Olefinic3. Aromatic4. α-Diketones and β-DiketonesB. Aldehydes (R-C(=O)-H)C. Acid Halides (R-C(=O)-X)D. Anhydrides (R-C(=O)-O-C(=O)-R)E. Amides1. Primary (R-C(=O)-NH2)2. Secondary (R-C(=O)-NH-R)3. Tertiary (R-C(=O)-N-R2)F. Imides (R-C(=O)-NH-C(=O)-R)G. Hydrazides (R-C(=O)-NH-NH2)H. Ureas (R-NH-C(=O)-NH2)I. Hydantoins, Uracils, BarbituratesJ. Carboxylic Acids (R-C(=O)-OH)1. Aliphatic and Alicyclic2. Olefinic3. Aromatic4. Amino Acids5. Salts of Carboxylic AcidsK. Esters1. Aliphatic Esters of Aliphatic Acids2. Olefinic Esters of Aliphatic Acids3. Aliphatic Esters of Olefinic Acids4. Aromatic Esters of Aliphatic Acids5. Esters of Aromatic Acids6. Cyclic Esters (Lactones)7. Chloroformates8. Esters of Thio-Acids9. Carbamates10. Esters of Phosphorus AcidsPublished by Bio-Rad Laboratories, Inc., Informatics Division. © 1978-2004 Bio-Rad Laboratories, Inc. All Rights Reserved.Go to: home • ir • proton nmr • carbon nmr• mass specSaturated HydrocarbonsNormal Alkanes1. C-H stretching vibration:CH3 asymmetric stretching, 2972-2952 cm-1CH3 symmetric stretching, 2882-2862 cm-1CH2 asymmetric stretching, 2936-2916 cm-1CH2 symmetric stretching, 2863-2843 cm-12. C-H bending vibration:CH3 asymmetric bending, 1470-1430 cm-1CH2 asymmetric bending, 1485-1445 cm-1(overlaps band due to CH3 asymmetricbending)3. C-H bending vibration:CH3 symmetric bending, 1380-1365 cm-1(when CH3 is attached to a C atom)4. C-H wagging vibration:CH2 out-of-plane deformations wagging, 1307-1303 cm-1 (weak) 5. CH2 rocking vibration:(CH2)2 in-plane deformations rocking, 750-740 cm-1(CH2)3 in-plane deformations rocking, 740-730 cm-1(CH2)4 in-plane deformations rocking, 730-725 cm-1(CH2) ≥ 6 in-plane deformations rocking, 722 cm-1Splitting of the absorption band occurs in most cases (730 and 720 cm-1) when the long carbon-chain alkane is in the crystalline state (orthorombic or monoclinic form).Coming Soon!Click on a vibrational mode link in the table to the leftor the spectrum above to visualize the vibrational mode here.Published by Bio-Rad Laboratories, Inc., Informatics Division. © 1978-2004 Bio-Rad Laboratories, Inc. All Rights Reserved.Saturated HydrocarbonsBranched Alkanes1. C-H stretching vibration:CH3 asymmetric stretching, 2972-2952 cm-1CH3 symmetric stretching, 2882-2862 cm-1CH2 asymmetric stretching, 2936-2916 cm-1CH2 symmetric stretching, 2863-2843 cm-12. C-H bending vibration:CH3 asymmetric bending, 1470-1430 cm-1CH2 asymmetric bending, 1485-1445 cm-1(overlaps band due to CH3 symmetric bending)3. C-H bending vibration:-C-C(CH3)-C-C- symmetric bending, 1380-1365 cm-1(when CH3 is attached to a C atom)-C-C(CH3)-C(CH3)-C-C- symmetric bending, 1380-1365 cm-1(when CH3 is attached to a C atom)(CH3)2CH- symmetric bending, 1385-1380 cm-1and 1365 cm-1(two bands of about equal intensity)-C-C(CH3)2-C- symmetric bending,1385-1380 cm-1and 1365 cm-1 (two bands of about equal intensity).(CH3)3C- symmetric bending, 1395-1385 cm-1and 1365 cm-1(two bands of unequal intensity with the 1365 cm-1 band as the much stronger component of the doublet).4. Skeletal vibration:-C-C(CH3)-C-C-,1159-1151cm-1-C-C(CH3)-C(CH3)-C-C-,1130-1116 cm-1(CH3)CH-,1175-1165 cm-1 and 1170-1140 cm-1-C-C(CH3)2-C-,1192-1185 cm-1(CH3)3C-, 1255-1245 cm-1 and 1250-1200 cm-15. C-H rocking vibration:(CH2)2 in-plane deformations rocking, 750-740 cm-1(CH2)3 in-plane deformations rocking, 740-730 cm-1(CH2)4 in-plane deformations rocking, 730-725 cm-1(CH2) ≥ 6 in-plane deformations rocking, 722 cm-1Coming Soon!Click on a vibrational mode link in the table to the left or the spectrum above to visualize the vibrational modehere.Published by Bio-Rad Laboratories, Inc., Informatics Division. © 1978-2004 Bio-Rad Laboratories, Inc. All Rights Reserved.Saturated Hydrocarbons Cyclic AlkanesCyclopropanes1. C-H stretching vibration:ring CH 2 asymmetric stretching, 3100-3072 cm -1 ring CH 2 symmetric stretching, 3030-2995 cm -12. Ring deformation vibration:ring deformation, 1050-1000 cm -13. C-H deformation vibration: CH 2 wagging, 860-790 cm -1Cyclobutanes1. C-H stretching vibration:ring CH 2 asymmetric stretching, 3000-2974 cm -1 ring CH 2 symmetric stretching, 2925-2875 cm -12. C-H deformation vibration:ring CH 2 asymmetric bending, ca 1444 cm -13. Ring deformation vibration:ring deformation, 1000-960 cm -1 888-838 cm -14. C-H deformation vibration:ring CH 2 rocking, 950-900 cm -1Cyclopentanes1. C-H stretching vibration:ring CH 2 asymmetric stretching, 2960-2952 cm -1 ring CH 2 symmetric stretching, 2866-2853 cm -1 2. C-H deformation vibration:ring CH 2 asymmetric bending, ca 1455 cm -1 3. Ring deformation vibration:ring deformation, 1000-960 cm -1 4. C-H deformation vibration:ring CH 2rocking, 930-890 cm -1Cyclohexanes1. C-H stretching vibration:ring CH 2 asymmetric stretching, ca 2927 cm -1ring CH 2 symmetric stretching, ca 2854 cm -1 2. C-H deformation vibration:ring CH 2 asymmetric bending, ca 1462 cm -1 3. C-H deformation vibration:ring CH 2 wagging, ca 1260 cm -1 4. Ring deformation vibration:ring deformation, 1055-1000 cm -1 1000- 952 cm -1 5. C-H deformation vibration:ring CH 2 rocking, 890-860 cm -16. The spectra of cyclic alkanes of five or more ring carbons show ring CH 2 stretching frequencies which overlap those of CH 3 and CH 2 groups of their alkyl substituents. These frequencies also overlap thoseof the CH 3 and CH 2 stretching frequencies of acylic alkanes. When samples of unknown composition are examined for the presence of such ring structures, the absorption bands of their spectra at the C-H stretching region should havethe best possible resolution.Coming Soon!Click on a vibrational mode link in the table to the left or the spectrum above to visualize the vibrational modehere.Numerous references cite the spectral region of 2800-2600 cm-1 for obtainingconfirmatory evidence of the presence of saturated simple ring structures. Absorptionat this region consists of a weak band or bands whose pattern and band locations arehelpful in confirming or indicating the presence of these rings. Although such absorptionfeatures have a limited diagnostic value, it is most reliable when the absorption occursin the spectra of simple saturated aliphatic hydrocarbons.Cycloalkanes (8, 9, and 10 C atoms)1 C-H stretching vibration:ring CH2 asymmetric stretching, ca 2930 cm-1ring CH2 symmetric stretching, ca 2850 cm-12. C-H deformation vibration:ring CH2 asymmetric bending, 2 or 3 absorption bands,1487-1443 cm-1Published by Bio-Rad Laboratories, Inc., Informatics Division. © 1978-2004 Bio-Rad Laboratories, Inc. All Rights Reserved.Go to: home • ir • proton nmr • carbon nmr• mass specUnsaturated HydrocarbonsAcyclic AlkenesMonosubstituted Alkenes (vinyl)1. C=C stretching vibration:C=C stretching, 1648-1638 cm-12. C-H deformation vibration:trans CH wagging, 995-985 cm-1CH2 wagging, 910-905 cm-13. C-H stretching vibration:CH2 asymmetric stretching, 3092-3077 cm-1CH2 symmetric stretching and CH stretching, 3025-3012 cm-1 4. C-H deformation vibration:CH2 asymmetric bending, 1420-1412 cm-15. C-H deformation vibration overtone:overtone of CH2 wagging, 1840-1805 cm-1Asymmetric Disubstituted Alkenes (vinylidine)1. C=C stretching vibration:C=C stretching, 1661-1639 cm-12. C-H deformation vibration:CH2 wagging, 895-885 cm-13. C-H stretching vibration:CH2 stretching asymmetric, 3100-3077 cm-14. C-H deformation vibration overtone:overtone of CH2 wagging, 1792- 1775 cm-1Symmetric Disubstituted Alkenes (cis)1. C=C stretching vibration:C=C stretching, 1662- 1631 cm-12. C-H deformation vibration:cis CH wagging, 730- 650 cm-13. C-H stretching vibration:CH stretching, 3050-3000 cm-1Symmetric Disubstituted Alkenes (trans)1. C=C stretching vibration:C=C stretching, ca 1673 cm-1, very weak or absent2. C-H deformation vibration:trans CH wagging, 980-965 cm-13. C-H stretching vibration:CH stretching, 3050-3000 cm-1Trisubstituted Alkenes1. C=C stretching vibration:C=C stretching, 1692-1667 cm-12. C—H deformation vibration:C-H wagging, 840-790 cm-13. C-H stretching vibration:C-H stretching, 3050-2990 cm-1Coming Soon!Click on a vibrational mode link in the table to the left or the spectrum above to visualize the vibrational modehere.Tetrasubstituted Alkenes1. C=C stretching vibration:C=C stretching, 1680-1665 cm-1, very weak or absentNOTES: The C=C stretching vibration of molecules which maintain acenter of symmetry absorbs very weakly, if at all, in the infrared region and,usually, is difficult to detect. This is true of the trans isomers and thetetrasubstitutedC=C linkages.When two or more olefinic groups occur in the hydrocarbon molecule, the infraredabsorption spectrum shows the additive and combined absorption of theunsaturatedgroups. However, if the unsaturated groups are subject to conjugation, the C=Cstretchingfrequency, usually, is lowered and a splitting of the C=C stretching frequencyband occurs.Conjugation also intensifies the C=C stretching frequency of trans unsaturatedgroups.Published by Bio-Rad Laboratories, Inc., Informatics Division. © 1978-2004 Bio-Rad Laboratories, Inc. All Rights Reserved.Go to: home • ir • proton nmr • carbon nmr• mass specUnsaturated Hydrocarbons Cyclic AlkenesEndocyclic C=CEndocyclic C=C corresponds to cis symmetrically disubstituted C=C of acyclic alkenes.1. C=C stretching, vibration:C=C stretching, near 1650 cm -1(except cyclobutene, 1560 cm -1 and cyclopentene, 1611 cm -1)2. C-H deformation vibration: CH wagging, 730- 650 cm -13. C-H stretching vibration:CH stretching, 3075- 3010 cm -1(usually two bands, asymmetric stretching and symmetric stretching for 4, 6, 7, and 8 membered rings)1- substituted endocyclic C=C1- substituted endocyclic C=C corresponds to trisubstituted acyclic alkenes.1. C=C stretching vibration:C=C stretching, near 1650 cm -1 (frequency raised)2. C-H deformation vibration: CH wagging, 840-790 cm -13. C-H stretching vibration:CH stretching, near 3000 cm -11.2- disubstituted endocyclic C=C1. C=C stretching vibration:C=C stretching, 1690-1670 cm -1 (4, 5, and 6 membered rings)Exocyclic C=CH 2Exocyclic C=CH 2 corresponds to the asymmetrically disubstituted C=C of acyclic alkenes (vinylidine).1. C=C stretching,1678-1650 cm -1 (4, 5, and 6 membered rings)2. C-H deformation vibration:=CH 2 wagging, 895-885 cm -13. C-H stretching vibration:=CH 2 stretching, near 3050 cm -1NOTES: The C=C stretching frequency of both the endocyclic HC=CH and the exocyclic C=CH 2 is sensitive to ring strain. As the ring size decreases from 6 to 4 members, the C=C stretching frequency of the endocyclic HC=CH is lowered. However, for the C=C stretching frequency of exocyclic C=CH 2, a gradual increase in the C=C stretching frequency occurs as the ring gets smaller. Substitution of methyl groups for the hydrogens of the endocyclic HC=CH and the exocyclic C=CH 2 cause an increase in the C=C stretching frequency.When two or more C=C groups occur in the hydrocarbon molecule, the infrared absorption spectrum shows the additive and combined absorption effects of the unsaturated groups. If such groups are subject to conjugation, the C=C stretching frequency is lowered and asplitting of the C=C stretching frequency band occurs.Coming Soon!Click on a vibrational mode link in the table to the left or the spectrum above to visualize the vibrational modehere.Published by Bio-Rad Laboratories, Inc., Informatics Division. © 1978-2004 Bio-Rad Laboratories, Inc. All Rights Reserved.Unsaturated Hydrocarbons AlkynesMonosubstituted Alkynes (RC ≡CH)1. C ≡C stretching vibration:C ≡C stretching, 2140-2100 cm -12. C-H stretching vibration:≡CH bending, ca 3300 cm -13. C-H deformation vibration: ≡CH bending, 642-615 cm -14. C-H deformation vibration overtone:overtone of ≡CH deformation, 1260-1245 cm -1Disubstituted Alkynes (RC ≡CR')1. C ≡C stretching vibration:C ≡C stretching, 2260-2190 cm -1 (unconjugated)NOTES: Although the intensity of the absorption band caused bythe C ≡C stretching vibration is variable, it is strongest when the alkyne group is monosubstituted. When this group is disubstituted in open chain compounds, the intensity of the C ≡C stretching vibration band diminishesas its position in the molecule tends to establish a pseudo center of symmetry. In some instances this band is too weak to be detected and, thus, its absence in the spectrum does not, necessarily, establish proof of the absence of this linkage.Occasionally, the spectra of disubstituted alkynes show two or more bands at the C ≡C stretching region.Conjugation with olefinic double bonds or aromatic rings tend to slightly increase the intensity of the C ≡C stretching vibration band and shift it toa lower frequency.Coming Soon!Click on a vibrational mode link in the table to the left or the spectrum above to visualize the vibrational modehere.Published by Bio-Rad Laboratories, Inc., Informatics Division . © 1978-2004 Bio-Rad Laboratories, Inc. All Rights Reserved.。
有机化合物英文系统命名法

1-戊烯-4-炔,1-penten-4-yne
六、芳烃命名(aromatic hydrocarbons)
• 1. • (1)芳香烃(arene)中少一种氢原子而形成旳基团称为
芳基(aryl)简写为(Ar-)。 • (2)苯(benzene)去掉一种氢剩余旳原子团称为苯基
phenyl,简写ph-或Φ-。 • (3)甲苯(toluene)中苯环去掉一种氢得到甲苯基,称
改为adiene,并用两个数字表达双键旳位置,如: • CH2=CH-CH=CH2 1,3-丁二烯, 1,3-butadiene
7,7-dimethyl-4-propyl-2-nonene
CH2
HC
CH
CH
CH2
环戊二烯 cyclopentadiene
五、炔烃旳系统命名(alkyne)
• 与烯烃相同,取含叁键旳最长链为主链,编号由距叁键近 来旳一端开始,结尾用yne替代烯中旳ene。
CH3
1 2
3
4
CH3
6
5
H3C(H2C)3
CH2CH3
12
CH2CH2CH3
3
4
1,3,5-三甲苯 1,3,5-trimethylbenzene
1-乙基-2-丙基-5-丁基苯 5-butyl-1-ethyl-2-propylbenzene
七.卤代烃命名(alkyl halide)
• 系统命名法以相应烃为母体,把卤原子作为取代基。命名 旳基本原则,措施与一般烃类旳相同 (字母顺序)。
4. 酸酐 –COOCO-
由相应旳酸加“酐”字构成,英文把相应酸旳acid换为anhydride
3-methylpentanoyl bromide
五元氮杂环的芳香性和稳定性

五元氮杂环的芳香性和稳定性梁艳红【摘要】自然界中许多含有五元环的有机物都具有芳香性,其中这些五元环大部分是由(CH)单元和N原子组成的.(CH)单元和N原子是等电子体,笔者对一些五元杂环及其正负离子的稳定性和芳香性的规律进行了详细的研究.选用从头算和密度泛函理论方法,用cc-pVDZ基组对五元氮杂环及其正负离子的几何结构进行了优化,同时对它们的能量和频率进行了计算,得到了一些具有稳定平面结构的氮杂环和其正负离子.并在相同的计算水平下,对这些稳定结构的核独立化学位移(NICS)和谐振子模型的芳香性(HOMA)进行了计算,利用这两个判断标准对这些结构的芳香性进行了讨论,并得到了有关这些结构的稳定性和芳香性的一些规律.【期刊名称】《河北科技师范学院学报》【年(卷),期】2014(028)004【总页数】6页(P51-55,67)【关键词】氮杂环;芳香性;稳定性;从头计算;密度泛函理论【作者】梁艳红【作者单位】河北科技师范学院物理系,河北秦皇岛,066004【正文语种】中文【中图分类】TQ252氮的五元杂环在生物学上有很重要的地位,研究它们是否具有芳香性,对于探讨其结构的稳定性和在生物学上的应用是非常重要的。
现在化学家提出了很多芳香性的判断标准,这些标准基本上从物质能量,磁性和几何结构这三个方面来判定物质的芳香性,这是由于物质的芳香性对物质这三个方面有很明显的作用[1]。
其中,核独立化学位移(NICS)被化学家认为是一个简单而有效的芳香性判据[2]。
它主要是从磁性的角度来判定芳香性。
它是由Schleyer及其合作者提出的一个判据[3],其定义是在平面环或原子簇的几何中心或中心之上计算的独立磁屏蔽系数的负值。
如果在这些位置计算的NICS值为负,表明分子具有芳香性;若这些位置的NICS值为正,表明分子是反芳香的;接近0,则是非芳香性分子[4]。
它的可靠性已经被一系列对二维和三维芳香化合物的研究所证明。
谐振子模型的芳香性(HOMA)是芳香性的另一个判断标准[5]。
芳香族烃类化合物

6中心 电子的环状共轭大 键 中心6电子的环状共轭大 中心 电子的环状共轭大π键
2.1.3
单环芳烃的性质
1.物理性质 . 苯及同系物:无色液体, 苯及同系物:无色液体,不溶于水 非极性溶剂) (非极性溶剂) 单环芳烃:比重< , 单环芳烃:比重<1,具有特殊芳香气味 单环芳烃有毒: 单环芳烃有毒:损坏造血器官与神经系统 碳氢比较高,1:1,燃烧有黑烟。 燃烧有黑烟。 碳氢比较高 燃烧有黑烟
单环芳烃的化学性质
苯 环 单 环 芳 烃 侧 链 α-H 芳 香 性 非典型反应 催化加氢等) (如:催化加氢等) 化 ) ) ) ) 典型: 典型:亲电取代 ( ( ( ( 代
一、芳环侧链反应
1、α- H自由基卤代 、 自由基卤代 自由基 Cl2
CH2CH3
光照或高温 Br2或NBS 可生成两种 自由基: 自由基:
2.1 苯系芳香烃分类与命名
2.1.1 苯系芳香烃分类
按分子所含苯环的数目与结构, 按分子所含苯环的数目与结构,可分为三类 1.单环芳烃 包括苯及其同系物 单环芳烃
2.稠环芳烃 分子中两个或两个以上苯环彼此间共用环边 稠环芳烃
萘
蒽
菲
3.多环芳烃 3.多环芳烃
包括联苯和多苯代脂肪烃
CH
联苯 三苯甲烷
2 1
CH3CH2CH2CH2
5
3 4
CH3
1-乙基 丙基 丁基苯 乙基-2-丙基 乙基 丙基-5-丁基苯
1,2-二甲基 丙基苯 二甲基-3-丙基苯 二甲基
◆取代基位置的表示方法 取代基位置的表示方法
邻(o) (1,2) , ) ortho
间(m) (1,3) , ) meta
对(p) (1,4) , ) para
国外六硝基六氮杂异伍兹烷的发展现状

( NP ) S E 在Ni sn合 成法 的基础 上通 过对 亚硝化 剂 ee l
和硝化 剂 的改进 , 1 8 于 9 9年 首次合 成 出C 一 0 现 已 L2,
HB W 的脱 苄 ; 三步 , I 第 硝解 HB W 的脱 苄产物 生成 I C 一 0 第 四 步 是 将 第 三 步 得 到 的 aHN1 或 y L2 ; — w ~ HN1 或 者两者 的混合物 转 晶为 £HN1 。 w 一 w
目前 , 国 和法 国 C 一0的研 制 已从 实 验室 合 美 L2 成 规模 放大 到 中试生 产规模 。法 国火 炸药 集 团公 司
中 图分 类 号 : J 5 T 6 T 5 ; Q5 4 文献标志码 : A 文 章 编 号 :0 77 1 (0 70 ~0 50 10 —8 2 2 0 ) 504 —4
De e o v l pm e t o e a ir he a z i o n f H x n t o x a a s wu t ia ta r a r a t ne a b o d
引 言
六硝基 六氮 杂 异伍 兹 烷 ( L 2 ) ] L 2 2 。C 一 0的合 成 路 线 经改 进 。
后, 大都 采 用 四步 合 成 法 : 一 步 , 第 苄胺 与 乙二 醛缩
合 成六 苄基 六 氮 杂 异 伍 兹 烷 ( 1 )第 二 步 , HB w ;
王 昕 , 彭翠 枝
( 国兵 器 工 业 集 团北 方 科 技 信 息 研 究 所 ,北 京 1 0 8 ) 中 0 0 9
摘 要 : 述 了 国外 合 成六 硝基 六 氮 杂 异伍 兹 烷 ( L 2 ) 法 及 美 国 、 国 、 综 C 一0方 法 日本 等 国 家 的 工 业 化 生 产 能 力 。 绍 了 介
chapter5芳烃 英文 Arenes

IbuprofeCnH3
布洛芬
5.1 Structure of Benzene
Three modern theories:
1. A resonance theory(共振论)
The structure of benzene is planar:
regular hexagon(正六边型). The bond angles: 120 °
( 硝基苯)
(甲苯)
(氯苯) Isopropylbenzene
B. Benzene as a substituent
C5H5–, Ph–: phenyl.
PhC CH
CH3
CH2
Diphenylmethane
Phenylacetylene PhC CHCH3 (苯乙炔) 2-Phenyl-2-butene
Br
1,4ppara-
Benzenes
NO2 Common name: CH3
o-Xylene
Cl
P155
(0-二甲 苯)
NO2
2-Chloro-1,4-dinitrobezene
H3C
CH3
(1,4- 二硝基-2-氯苯)
1,3,5-Trimethylbezene
( 均三甲苯)
5.3 Aromaticity and the
2. Oxidation of Alkylbenzenes 3. Addition Reaction of Alkenylbenzenes 5.4.2 Aromatic Ring as a Functional
Group: Electrophilic Aromatic Substitution 5.4.3 Halogenation of Benzene 5.4.4 Nitration of Benzene 5.4.5 Sulfonation of Benzene 5.4.5 Friedel-Crafts Alkylation of Benzene 5.4.7 Friedel-Crafts Acylation of Benzene
常用溶剂表
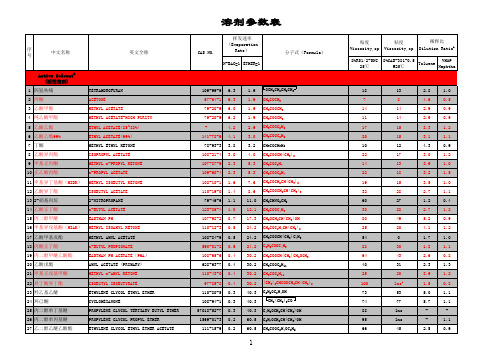
(CH3)2CHCH2COCH2CH(CH3)2 CHCON(CH3)2 C3H7OC2H4OH
71.2 Mixture
100.8 100.8 136.0 151.3 302.5 403.4
(CH3)2C(OH)CH2COCH3 C2H5O2C3H4OC2H5 C4H9OC2H4OH C4H9OCH2CH(CH3)OH C5H9NO CH3COOCH2CH(C2H5)C4H9
12100 Mixture
粘度
粘度
稀释比
Viscosity,cp Viscosity,cp Dilution Ratiob
8%RS1/2-SNC 25℃
8%CAB-381-0.5 @25℃
Toluene
VM&P Naphtha
46
lns
1.5
0.8
17
33
-
-
86
lns
4.0
2.0
48
48
1.8
1.3
TETRAHDROFURAN ACETONE METHYL ACETATE METHYL ACETATE-HIGH PURITY ETHYL ACETATE(85~88%) ETHYL ACETATE(99%) METHYL ETHYL KETONE ISOPROPYL ACETATE METHYL n-PROPYL KETONE n-PROPYL ACETATE METHYL ISOBUTYL KETONE ISOBUTYL ACETATE 2-NITROPROPANE n-BUTYL ACETATE EASTMAN PM METHYL ISOAMYL KETONE METHYL AMYL ACETATE n-BUTYL PROPIONATE EASTMAN PM ACETATE(PMA) AMYL ACETATE (PRIMARY) METHYL n-AMYL KETONE ISOBUTYL ISOBUTYRATE ETHYLENE GLYCOL ETHYL ETHER CYCLOHEXANONE PROPYLENE GLYCOL TERTIARY BUTYL ETHER PROPYLENE GLYCOL PROPYL ETHER ETHYLENE GLYCOL ETHYL ETHER ACETATE
有机化学第5章 芳烃

CHO
OCH3 OH
官能团优先次序:
CHO > OH >
4–羟基–3–甲氧基苯甲醛
OCH3
CH3CH2CCH2CHCHO O Cl
4–氧代–2–氯己醛
CH3CHCH CH2 OH
3–丁烯–2–醇
二、苯的结构
第五章 芳烃 芳香性(二、苯的结构)
由元素分析,分子量测定,苯的分子式为:C6H6 易取代,不易加成,不能使溴水和高锰酸钾溶液褪色, 不易氧化。 一取代物只有一种 邻二取代物只有一种,说明具有环状对称结构
H + Br2
Fe
△
(75%)
反应活性:F2 > Cl2 > Br2 > I2
鉴别芳烃。
Br + HBr
苯的溴化反应机理:
第五章 芳烃 芳香性(四、单环芳烃化学性质)
Br Br + FeBr3 + Br 慢
Br Br FeBr3 H Br
Br + Br FeBr3
H Br
H Br
π电子的离域产生共振杂化体:
酰基化反应
CH2Cl
氯甲基化反应
第五章 芳烃 芳香性(四、单环芳烃化学性质)
(1) 卤化(halogenation)
在卤化铁等路易斯酸作用下,苯与卤素作用生成卤化苯的 反应称作卤代反应或卤化反应。
+ X2 Fe or FeX3
X ( X = Cl, Br)
催化剂通常使用的是Lewis 酸: FeCl3, FeBr3 和 AlCl3、Fe
H3C
CH3
1,3,5–三甲苯 均三甲苯
symtrimethylbenzene
CH2CH3 1 2 CH2CH2CH3
ch化学式

ch化学式CH化学式是指由氢原子和碳原子组成的分子,是碳氢化合物的总称。
CH化学式的最常见形式是烷烃(aliphatic hydrocarbon),比如一氟乙烷(C2F5H)、乙烷(C2H6)、丁烷(C4H10)、正己烷(C6H14)等;多环烃(polycyclic hydrocarbon)比如苯(C6H6)、芳香族化合物(aromatic hydrocarbons)比如苯甲酸乙酯(C9H10O2)等。
烷烃是由相邻的碳原子与氢原子连接而成的顺烷烃(saturated hydrocarbons),其中最重要的例子就是由十三个碳原子和二十二个氢原子构成的正庚烷(C13H22);其他的烷烃还包括衍生物如烯烃(olefins)、烷醇(alkyl alcohol)、醛(aldehydes)等,它们的化学式分别为R-CH=CH-R、R-CH2OH和R-CHO。
多环烃是指有至少两个互相连接的碳原子形成的环状分子,其中最重要的例子是芳香环烃,它的定义是指碳原子在平面上排列、以芳香双核为中心的分子。
由苯一个芳香族环(benzene ring)和六个碳原子组成的苯(C6H6)就是最常见的多环烃之一。
另外,在芳香族环中还有其他类型的多环烃,比如由七个碳原子组成的环己烷(cyclopentane)、由八个碳原子组成的环萜烷(cyclopentene)、由九个碳原子组成的环戊烷(cyclohexane)等。
CH化学式不仅包括烷烃、多环烃和芳香族环,还有一些其他类型的碳氢化合物,比如脂类油脂(lipids)、脂肪酸(fatty acids)、甾醇(sterols)和脂肪烃(alkanes)等。
脂类油脂是一类有机化合物,它们由三链有机酸(triglycerides)、酰胺(phospholipids)和其他复杂类型的多碳酯(esters)组成。
脂肪酸是酰胺的重要组成部分,它是一系列有机酸,其中最重要的一种是棕榈酸(palmitic acid),其化学式为 C16H32O2 。
亲电取代反应机理

苯的共轭能
ΔH=-120kJ/mol
+3H2
ΔH=-208kJ/mol
共轭能=3×120-208=152kJ/mol
苯的氢化焓比假想的 1,3,5-环己三烯的低 152 kJ·mol-1,称作共振能、共扼能或离域能, 体现了苯的稳定性。
上页 下页 返回 退出
4.2 单环芳烃的构造异构与命名
一元取代物
上页 下页 返回 退出
凯库勒苯的结构学说的局限性 ➢凯库勒式不能解释苯为什么具有特殊稳 定性; ➢不能解释苯为什么表现出难加成、易取 代的化学特性; ➢不能解释苯的几何结构
返回
4.1.2 苯分子的离域结构
碳原子都是sp2杂化 六个碳原子和六个氢 原子都在同一平面上 六个碳原子组成一个 正六边形 碳碳键长完全相等 (0.140nm) 所有键角都是120º
例如:
CH2 CH3
1
6
2
C H3
5
3
4
2-甲基-1-乙基-4-异丙基苯
C H ( C H 3)2
返回
复杂基团或不饱基团取代时,则把侧链当 作母体,苯环当作取代基来命名。
CH3 H3C CH2 CH CH CH3
C H C H2
C CH
2-甲基-3-苯基戊烷 CH3
苯乙烯
CH3 NO 2
苯乙炔 CH3
CO O H 3-甲基苯甲酸 2-硝基甲苯
HO SO 3H 3-甲基-5-羟基苯磺酸
返回
当芳烃去掉一个氢原子后剩下的原子团叫芳基,
用Ar(Aryl)表示。最常见和最简单的一价芳基有C6H5 -(苯基),常用Ph(Phenyl)或Φ表示:
C2 H
CH3
苯基
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3 H
+
2 1 4n + 2 有 芳 香 性
4 5 6 7
• 同 正离子这种越过一个碳原子的同芳香性叫 单同芳香体系,越过二个或三个饱和碳原子 的则分别叫双同或三同芳香体系。 • 含有两个或十个电子的同芳香性化合物为已 知的。 •
H H H OTs
• 三同环丙基正离子是首先由顺-双环[3,1, 0]己-3-对甲苯磺酸酯的溶剂化性质的分 析提出的假说。
邻位和对位定向比: 1)亲电试剂的活性越高,选择性越低:
CH3
相对速率
o%
60 69
m % p%
3 2 37 29
H N O 3 H 2S O 4 + N O 2 B F 4 /C H 3 C N
17 2 .3
2) 空间效应越大,对位产物越多:
C (C H 3 ) 3 H 2S O 4 S O 3H C (C H 3 ) 3
(6) (k取代)(z产物的百分比)
y (k苯) y-位置的数目
通过每一个位置取代苯的活性与苯比较,把总的 速率乘以邻位、间位或对位产物的百分比,再除以 苯的取代速率的结果。
fo=
fm =
k P h Z /2 k P h H /6
k P h Z /2 k P h H /6
k P h Z /1 k P h H /6
间 3%
fm
(6 ) (2 3 ) × (1 ) × (0 .0 3 ) ) (2 3 ) × (1 ) × (0 .3 4 ) (1 )
4 6 .9
氯苯和苯甲醚进行硝化反应时,分速度因数分别为:
Cl
0 .0 2 9 0 .1 3 7 0 .0 0 0 9
OCH3
2 .3× 0 .2 5 10
(4)同芳香性
• 同芳香性是指越过一个或几个饱和碳原子形 成的稳定的环状共轭体系。它也服从Hü ckel 规则,但在离域的π体系中插入了另外具有饱 和中心的原子,不过其几何构型允许P轨道跨 过这个隔离的间隙而仍然能相互重叠。即在 某些环状正离子中无正统的芳香体系的σ骨架, 也无连续的P电子轨道排列,但当体系由于不 相邻碳上P轨道部分重叠且具有4n+2个π电子 的环状排列时也会呈现出一定的芳香稳定性。
4
. 5× 1 0 4 5
氯苯的三个分速度因数均小于1,卤素是致钝基团, 且 fm << fp, E+进入间位的可能性很小。 苯甲醚:
fp ≈ fo >> fm
-OCH3 对邻、对位具有+C, +I效应,+C > +I 对间位,只有+I, 而无+C效应。
2〕Hammett 方程 描述分子结构和化学活性的定量关系的表示。 Hammett 方程:
第五章 芳香性和芳环上的取代反应 ( )
• 在脂肪族碳原子上的取代反应主要为亲核取代 反应,而在芳香族主要为亲电取代反应,这是 由于芳香环上具有较高的电子云密度,进攻试 剂为正离子或偶极及诱导偶极的正的一端,而 离去的原子团不带成键电子对。 • 强吸电子基团取代的芳香化合物在一定条件下 也可以进行亲核取代反应。在亲核取代反应中, 进攻试剂是负离子或具有未共用电子对的原子 或基团,离去基团以弱碱负离子或分子的形式 离去,其实用价值不如亲电取代反应。
×
o
异构体 100
异构体 100
m ×
p
f p=
异构体 100
×
当 f > 1 时,该位置的活泼性比苯大, 否则比苯小。
例如:
在硝酸与乙酸酐的体系中 甲苯的硝化速度是苯进行硝化反应的23倍, 取代产物的百分比为: 邻 63%
fo
对 34%
(6 ) (2 3 ) × (1 ) × (0 .6 3 ) (2 ) 4 3 .5
CH CH2 H E CH CH2 H E
CH
CH2 + E
邻对位
CH
间位
CH2
CH
CH2 H E
CH
CH2 H E
共振式越多, H 正电荷分散 E 程度越大,芳正离子越稳定。
动力学控制与热力学控制
H
80
℃
S O 3H
165 ℃
+ H 2S O 4
165
℃
H S O 3H
α位取代-动力学控制产物; β位取代-热力学控制产物。
有芳香性
• [22] - 轮烯已被合成,具有芳香 性。某些[26] - 轮烯为平面的, 有芳香性,而其它[26] - 轮烯和 [30] - 轮烯是非平面的,没有芳 香性。大环难于达到充分有效的 芳香化合物那样的电子非定域。
• (3)休克尔规则只涉及单环体系,有关理论 可用于多环体系[只计算边缘的平面电子]。 • 如:前面的薁以及联亚苯等
• 在同芳香体系中,外加原子的存在将破坏 离域π体系的物理连续性却不破坏离域 体 系。同芳香化合物显示所有的芳香性,如 额外的稳定性和维持环流的本领。 • 如环辛四烯溶于浓硫酸发生质子化,生成 同芳香性正离子(homotropylium ion):
Hb
- 0 .3 p p m
Ha
5 .1 p p m
+
H 2S O 4
NO2
+ +
H 3O
2H SO 4
NO2
NO2
NO2 H
芳正离子生成的 一步是决定反应 速率的一步
卤代反应:
B r 2 + F eB r 3 Br
δ
Br
δ
F eB r3
溴分子在FeBr3的作用下发生极化
Br R Br Br F eB r R H
+
Br
+
F eB r3
生成芳正离子
Br R H R Br + H
Y
第一类定位基:
N (C H 3 ) 2 , N H 2 , O H , O C H 3 , N H C O C H 3 , O C O C H 3 , l, B r, I, C H 3 , C H 2 C O O C H 3 C
卤素对芳环有致钝作用 第一类取代基 (除卤素外)具有+I, 或是+C效应, 其作用是增大芳环的电子云密度。 第二类定位基:
2.Hü ckel 4n+2规则
• Hü ckel从简单分子轨道理论研究 入手,提出含有4n+2个π电子的 平面共轭单环化合物应具芳香性, 这就是Hü ckel规则。
3.芳香化合物的类型
(1) 含有六个π电子体系的芳香化合物 • i) 六员环 •
N O
1 2
C1 C2 C3
0 .1 3 6 n m 0 .1 4 1 5 n m
0 ppm
H H
H H
有两对氢原子会发生相互作用,共轭能不高, 芳香稳定性不明显
H
8 .6 7 - 8 .1 6 p p m - 4 .2 5 p p m
H 3C
CH3
两对氢原子的相互作用,可使其成桥 键来消除掉,有芳香性
[18] - 轮烯
- 3 .0 p p m
H H H H H H
H
9 ppm
双 键 : 0 .1 3 4 n m 单 键 : 0 .1 5 4 n m
3
C2
ii) 五员环
N H
O
S
共振能:
21
16
29
千 卡 /摩 尔
• 象这种含有杂原子的芳香化合物称为杂芳香 化合物。可分为两类:一类利用芳香π 体系 中的杂原子的未共享电子对;一类不利用此 未共享电子对。
富烯
有偶极矩,有芳香性的 非芳香化合物
Cl
Cl
Cl
Cl
t-B u
t-B u
稳定 杯烯
Ph Ph Ph Ph
Ph Ph
Ph Ph
Ph Ph Ph
Ph
6 .3 D
R
R
稳 定 R : M e , t-B u
R
R
ii) 含十个π 电子的体系
• (1)[10]-轮烯
H H
(A )
(B )
(C )
• A是全顺式,B是反,顺,顺,顺,顺式,C是反,顺, 反,顺,顺式都没有芳香性;在C中由于角张力 及环内两个氢的排斥力影响分子的稳定性,使 之不具芳香性;[10]-环共轭的不稳定性可归于 容易热环化为双环体系。
溶剂效应 螯合效应 原位取代 (Ipso attack) ( ) 3. 取代效应的定量关系 a. 分速度因数与选择性 ( ) b. Hammett 方程 ( )
二. 芳环上亲核取代反应 ( )
1. 加成-消除机理 2. SN1机理 ( ) 3. 消除-加成机理 (苯炔机理)( )
三. 芳环上的取代反应及其应用 1. Friedel - Crafts 反应 2. Rosenmund - Braun 反应
Part 1 芳香性
• 1.芳香性的定义: • 早期的定义是考虑动力学稳定性,取代反应比加成反 应更容易发生;后来的定义则依靠热力学的稳定性, 以共轭能的大小来量度;最近的定义提倡用光谱及磁 的标准,磁有向性在平面л电子体系中能受感应,并可 用质子磁共振光谱中位移到较低的场来鉴定或借反磁 性的灵敏度上升的测定。 • 另一种物理标准是整个芳香体系具有相同键长和共平 面的特性。
脱去质子
实验已经证实芳正离子的存在:
CH3 C 2 H 5 F /B F 3
-8 0 ℃
H C 2H 5 CH3 H 3C
BF4
-
H 3C
CH3 CH3
m. p: -15℃
(二) 亲电取代反应的特性与相对活性
反应活性:
致活效应:取代基的影响使芳环的反应活性提高;
致钝效应:取代基的影响使芳环的反应活性降低。
R
R‘
