高三复习 原子结构
高三化学 原子结构

某氯原子的质量是 a g,12C 原子的质量是 b g,则该氯原 子的相对原子质量为 元素周期表中各元素周围标注的相对原子质量是哪一种?
【当堂检测】
知识梳理·题型构建
1.据 2012 年 2 月 6 日中新网报道,嫦娥二号月球探测器获得了 7m 分辨率 全月球影像图,该月球探测器使用钚元素的同位素电池来提供稳定、持久 的能源。下列关于238Pu 的说法正确的是 94 A.238Pu 和240Pu 的质子数之差为 2 94 94 B.238Pu 和240Pu 是两种不同的核素 94 94 C.238Pu 的中子数与质子数之差为 144 94 D.238Pu 和240Pu 互为同素异形体 94 94 (
【问题引导下的再学习】
核素的相对原子质量:
各核素的质量与12C的质量的1/12的比值。一种元素有几种同 位素,就应有几种不同的核素的相对原子质量,如35Cl为 34.969,37Cl为36.966。
元素的相对原子质量:
是按该元素各种天然同位素原子所占的原子百分比算出的平 均值。如:Ar(Cl)=Ar(35Cl)×a%+Ar(37Cl)×b%。
【问题引导下的再学习】 22 26 1.(1)48Ti 的质子数为________、中子数为________、 22
电子数为________、质量数为________。 22 48
13 14 (2)27Al3+的质子数为________、中子数为________、 27 10 电子数为________、质量数为________。 18 17 (3)35Cl-的质子数为________、中子数为________、
【当堂检测】
2.原子的核电荷数小于 18 的某元素 X,其原子的电子层数为 n, 最外层电子数为 2n+1,原子核内质子数为 2n2-1。下列有关 X 的说法中不正确的是( A ) A.X 能形成化学式为 X(OH)3 的碱 B.X 能与某些金属元素形成化合物 C.X 原子的最外层电子数和核电荷数肯定为奇数 D.X 可能形成化学式为 KXO3 的盐
高三 化学第一讲 原子结构、元素周期律

专题复习(一)原子结构班级姓名各位同学:这份学案是我们的二轮复习,请同学们认真学习。
认真填写学案然后核对答案(答案就在旁边),本讲的例题4、5、6、9在微视频中有详解,也请在全部做完再观看。
课后作业完成后请上传至智学网。
直击考点——知识梳理一、原子结构1、下列在探索原子结构的过程中形成的主要观点有道尔顿的原子论、汤姆逊提出的原子结构的模型;卢瑟福提出的原子结构的模型。
(答案:葡萄干面包、行星)2.原子是由原子核和核外电子构成的,其中原子核是由质子和中子构成的。
元素的种类由决定,原子的种类由决定,元素化学性质主要由决定。
答案及解析:元素的定义:具有相同核电荷数(即质子数)的一类原子。
因此元素的种类取决于质子数。
例如1H、2H、3H都是氢元素,但是不同的同位素原子,因此原子的种类取决于质子数和中子数。
元素的化学性质主要由原子的最外层电子数和电子层数决定。
3、微粒之间的关系:①质子数=核电荷数=原子序数=原子的核外电子数②质量数=质子数+中子数Ts)例题1:117号新元素Ts的中子数为176,则Ts的化学符号为(答案:293117二、同位素——概念辨析:同位素:质子数相同、中子数不同的不同原子互为同位素。
注意同位素一定是原子,不能是分子。
由于同位素的质子数相同使其核外电子排布相同,则同位素之间化学性质相同。
但同位素的中子数不同使其原子质量不同,因此同位素之间物理性质不同。
另外,同位素在自然界的丰度恒定不变同素异形体:同种元素构成的不同单质。
因此同素异形体一定是单质。
同分异构体:分子式相同,结构不同的化合物之间,例如正戊烷、异戊烷、新戊烷。
同系物:结构相似、分子组成上相差一个或若干个-CH2-的化合物,例如甲醇、乙醇。
同系物具有相同的通式,例如单炔烃的通式为C n H2n-2。
例题2、据报道,科学家已成功合成了少量N4,N4与N2互为,相同质量的N4和N2所含原子个数比为。
例题3、下列互为同位素的是()A.H2和D2B.H2O和D2OC.金刚石和石墨D.2He和3He例题4、H2O、D2O、T2O三者之间_(“是”或“不是”)同位素。
高三化学一轮复习——原子结构与核素、同位素

高三化学一轮复习——原子结构与核素、同位素知识梳理1.原子结构(1)原子的构成(2)原子内的等量关系①质量数(A)=质子数(Z)+中子数(N);②质子数=原子序数=核电荷数=核外电子数;图示:③阳离子:质子数=核外电子数+电荷数;④阴离子:质子数=核外电子数-电荷数。
(3)原子符号2.元素、核素、同位素(1)“三素”概念的辨析:(2)几种重要的核素及其应用U21H31H18 8O 核素23592用途核燃料用于考古断代制氢弹示踪原子[名师点拨]①同一元素的各种核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大。
②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
3.特征电子数粒子(1)2e-微粒H2←H-←→Li+→Be2+(2)10e-微粒(3)18e-微粒[考在课外]教材延伸判断正误(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。
(√)(2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同。
(√)(3)核聚变如21H+31H―→42He+10n,因为有新微粒生成,所以该变化是化学变化。
(×)(4)中子数不同而质子数相同的微粒一定互为同位素。
(×)(5)通过化学变化可以实现16O与18O间的相互转化。
(×)(6)3517Cl与3717Cl得电子能力几乎相同。
(√)(7)21H+核外电子数为2。
(×)(8)两种粒子,若核外电子排布完全相同,则其化学性质一定相同。
(×)(9)13C与C60互为同素异形体。
(×)(10)所有的原子中都含有质子和中子。
(×)拓展应用(1)①11H、21H、31H分别是氢元素的三种________,它们互称为________。
②5626Fe2+的质子数为________,中子数为________,核外电子数为________。
高三化学总复习课时1 原子结构与性质

高三总复习专题十二 ----物质结构与性质课时1 原子结构与性质考点一原子核外电子排布原理1.能层、能级与原子轨道(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。
通常用K、L、M、N、O、P、Q……表示相应的第一、二、三、四、五、六、七……能层,能量依次升高(2)能级:同一能层里的电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:表示电子在原子核外的一个空间运动状态。
电子云轮廓图给出了电子在核外经常出现的区域,这种电子云轮廓图也就是原子轨道的形象化描述。
原子轨道轨道形状轨道个数s 球形 1p 纺缍形 3—————————[特别提醒]———————第一能层(K),只有s能级;第二能层(L),有s、p两种能级;第三能层(M),有s、p、d三种能级;s能级上只有一个原子轨道,p能级上有三个原子轨道p x、p y、p z,d能级上有五个原子轨道,各能级上的原子轨道具有相同的能量。
2.基态原子核外电子排布的三个原理(1)能量最低原理:电子尽先占有能量低的轨道,然后依次进入能量较高的轨道,使整个原子的能量处于最低状态。
即原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
如图为构造原理示意图:———————————[特别提醒]—————————————————能级交错现象:核外电子的能量并不是完全按能层序数的增加而升高,不同能层的能级之间的能量高低有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
(2)泡利原理在一个原子轨道中,最多只能容纳2个电子,并且这两个电子的自旋状态相反。
(3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,并且自旋状态相同。
高三复习物质结构元素周期律

例1.A元素原子的L层比B元素原
A
子的L层少3个电子,B元素原子
核外电子总数比A元素原子核外
电子总数多5个,则A、B两元素
形成的化合物可表示为( )
A. A3B2
B.A2B3
B
C.AB3
D. A B 2
B
C
例2.设X、Y、 Z代表三种元 素,已知:
① X+和Y-两种离子具有相同的电子层结构
c.许多元素,具有多种同位素,因此原子的种类大大超过元 素的种类。
d.天然存在的某种元素里,不论是游离态还是化合态,各种 同位素所占的原子个数百分比一般是不变的。
e.同位素的质量数不同,物理性质不同;核外电子数相同, 化学性质相同。同位素的不同原子构成的单质是化学性质几乎 相同的不同单质。(如H2、D2、HD)
R2O ROH
RO
R2O3 RO2 R2O5 RO3
R2O7
R(OH)2 R(OH)3 H4RO4 H3RO4 H2RO4 HRO4
碱性渐弱,
酸性渐强
最低负价
-4
-3
-2
-1
对应氢化物 稳定性
RH4 RH3 H2R HR 逐渐增强
溶于水酸碱性
碱性渐弱,酸性渐强
假定元素的种类是有限的,那么周期表也是有限的。 根据元素周期律作出一些假说和预测:
202X
高三化学总复 习
物质结构 基本理论 元素周期律
一、原子结构
原子组成
0
两个关系式
1
原子序数=核电荷数=质子数=原子核外电子数 (阴、阳离子=?)
质量数(A)=质子数(Z)+中子数(N)
核组成符号 AZX
高三原子物理知识点总结归纳

高三原子物理知识点总结归纳在高三物理学习中,原子物理是一个重要的知识点。
掌握原子物理的概念和理论对于理解物质的性质和相互作用有着关键作用。
本文将对高三原子物理知识点进行总结归纳,帮助同学们更好地掌握这一内容。
1. 原子结构1.1 原子模型的发展一开始,人们认为原子是不可分割的,但经过实验发现了元素周期性和放射现象,进而提出了原子是由带电粒子构成的结构。
根据电子在原子中的分布,我们有了玻尔模型和量子力学模型,进而解释了原子的稳定性和电子轨道分布。
1.2 原子的基本组成原子主要由质子、中子和电子组成。
质子带有正电荷,中子不带电,电子带有负电荷。
质子和中子集中在原子核中,而电子分布在原子核外的能级上。
2. 量子力学2.1 波粒二象性根据量子力学理论,微观粒子既表现出粒子性也表现出波动性。
根据德布罗意-布洛赫假设,具有动量的粒子也具有波动性质。
2.2 不确定关系海森堡提出了著名的不确定关系,它指出了在量子尺度下,无法同时确定粒子的位置和动量。
不确定关系对于解释微观粒子的行为和测量影响至关重要。
3. 原子光谱和能级结构3.1 原子的能级原子的能级就是原子中电子所具有的能量。
电子在不同能级间跃迁会辐射或吸收特定频率的光,产生光谱线。
3.2 光子的能量与频率根据普朗克的光量子假设,光是由一束束离散的能量等于光频的量子组成的。
光子的能量E与频率ν之间满足E = hν,其中h为普朗克常数。
4. 核物理4.1 放射性衰变核物理研究中,人们发现了放射性元素的衰变现象。
放射性衰变包括α衰变、β衰变和γ衰变,其中核反应的过程涉及质子、中子的变化。
4.2 核能的释放和利用核能是一种巨大的能量资源,核聚变和核裂变都可以释放出巨大的能量。
核能被广泛应用于发电、医学和工业等领域。
5. 原子核的物理性质5.1 原子核的结构原子核由质子和中子组成,质子数相同的原子核构成同位素,中子数相同的原子核构成同质异能素。
原子核的质量与电荷会影响元素的化学性质和核反应的过程。
高三化学一轮复习原子结构,核外电子排布

D.
S
Cl
5.元素 M 所形成的气态单质分子 M 有三种,其式量分别为 70、72、74,三种分子的物质的量之 2
比 9:6:1 时,下列说法正确的是( D)
A.M 有三种同位素
B.M 的平均式量为 72 2
C.质量数为 35 的同位素占元素 M 原子总数的 75%
(2)互为同素异形体的微粒是____________。
(3)56Fe2+的中子数为________,核外电子数为_____________。
26
(4)1H、2H 与 16O、18O 形成的 H O 的种类有________种。
11
22
解:(1)同位素 (2)16O 和16O (3)30 24 (4)10
形
等。电子云不仅有确定的形状,而且有一定的伸展方向。如 s 电子云呈球形对称,p 电子云有 3
个伸展方向,d 电子云有 5 个伸展方向,f 电子云有 7 个伸展方向。
17.核外电子的排布规则:
(1)能量最低原理:原子中的电子按照能量由低到高的顺序排布到原子轨道上,遵循能量最低原 理。例如,氢原子只有一个电子,排布在能量最低的 1s 轨道上,表示为 1s1,这里右上角的数字
德国伦琴 法国贝克勒尔
居里夫人
近代原子论 主要发现或观点
道尔顿原子论:原子是构成物质的最小微粒,不可再分
葡萄干面包模型:原子中的正电荷均匀地分布在整个原子的球形体 内,电子则均匀分布在这些正电荷之间,就像葡萄干面包一样
原子结构行星模型:原子是由带正电的、质量很集中的、很小的原 子核和核外运动着的带负电的电子组成的,就像行星绕太阳运转一
9.原子的电子式:元素的化学性质主要由原子的最外层电子数决定,我们常用小黑点或×来表示
高三一轮复习—原子结构

高三一轮复习——原子结构①道尔顿实心球体模型 ②汤姆生“葡萄干面包式”模型 ③卢瑟福“行星系”模型 ④玻尔“轨道”模型●()()()()X : : AZ Z A Z Z ⎧⎧⎪⎪⎨⎪-⎨⎪⎩⎪⎪⎩质子: 带一个单位正电荷原子核原子中子不带电核外电子带一个单位负电荷●()()()A Z N =+质量数质子数中子数 ===质子数核电荷数核外电子数原子序数离子: 离子电荷 = 质子数 – 核外电子数质子数(Z )= 阳离子的核外电子数 + 阳离子的电荷数 质子数(Z )= 阴离子的核外电子数 – 阴离子的电荷数经典例题1.从而对人体产生伤害,该同位素原子的中子数和质子数之差为()A 、136B 、50C 、86D 、222。
同位素:质子数相同而中子数不同的同一种元素的不同原子互为同位素。
如右图为氢元素 的三种同位素质子数决定元素的种类,质子数和中子数决定原子的种类。
●()()()12272712r 271211612e.g. C 1.992710 kg 1.992710 kge.g. C 1.992710 kg 12C m A ---⎧=⨯⎪⎪⨯=⎨⨯⨯-⨯⎪⎪⎩原子的质量原子的实际质量原子的实际质量原子相对原子质量一个碳原子质量原子的近似相对原子质量●⎧⎨⎩元素的平均相对原子质量元素元素的平均近似相对原子质量⏹原子的相对原子质量——指天然同位素的一个的真实质量(g)与一个碳—12原子质量(g)的1/12的比值。
⏹原子的近似相对原子质量——在数值上等于该同位素原子的质量数;如对于816O来说,它的近似相对原子质量为16。
⏹元素的相对原子质量——指该元素各同位素原子的相对原子质量与其在自然界的原子个数百分比的乘积之和。
⏹元素的近似相对原子量——指该元素各同位素原子的质量数与其在自然界的原子个数百分比的乘积之和。
经典例题1 设某元素原子的核内质子数为m,中子数为n,则下列论断正确的是A不能由此确定该元素的相对原子质量 B 该元素的相对原子质量为m+nC 若碳原子质量为w g。
2022届高三人教版化学一轮复习讲义:原子结构 核外电子排布
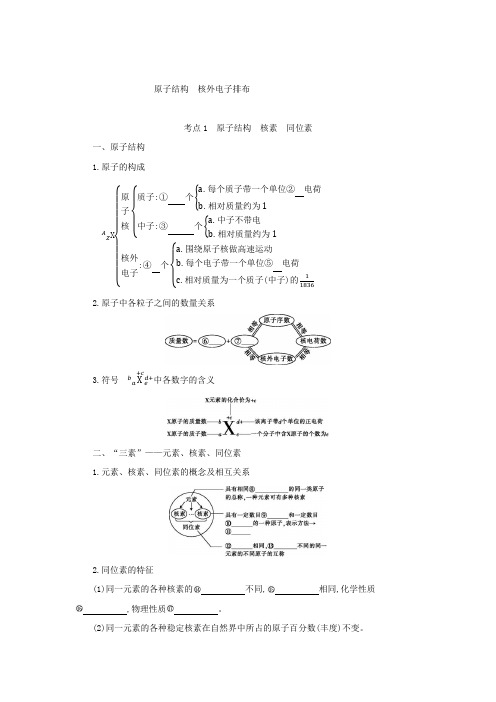
原子结构 核外电子排布考点1 原子结构 核素 同位素一、原子结构1.原子的构成A Z X {原子核{质子:① 个{a .每个质子带一个单位② 电荷b .相对质量约为1中子:③ 个{a .中子不带电b .相对质量约为1核外电子:④ 个{ a .围绕原子核做高速运动b .每个电子带一个单位⑤ 电荷c .相对质量为一个质子(中子)的118362.原子中各粒子之间的数量关系3.符号ba X +ce d+中各数字的含义二、“三素”——元素、核素、同位素1.元素、核素、同位素的概念及相互关系2.同位素的特征(1)同一元素的各种核素的不同, 相同,化学性质 ,物理性质 。
(2)同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
3.氢元素的三种核素11H:名称为,不含中子。
12H:用字母表示,名称为或重氢。
13H:用字母表示,名称为或超重氢。
4.几种重要核素的用途核素92235U614C12H、13H818O用途核燃料用于考古断代制氢弹示踪原子【答案】①Z②正③A-Z④Z⑤负⑥中子数⑦质子数⑧核电荷数⑨质子⑩中子⑪Z A X 质子数中子数中子数质子数几乎完全相同差异较大氕 D 氘T氚判断正误(正确的打“√”,错误的打“×”)。
(1)一种元素只有一种核素,有多少种核素就有多少种原子。
( )(2)1735Cl与1737Cl得电子能力几乎相同。
( )(3)1 mol重水和1 mol水中,中子数之比为2∶1。
( )(4)中子数不同而质子数相同的微粒一定互为同位素。
( )(5)1H218O的摩尔质量为20 g·mol-1。
( )(6)16O与18O间的相互转化为化学变化。
( )(7)核聚变如12H+13H He+01n,因为有新微粒生成,所以该变化是化学变化。
( )(8)H2、D2、T2是氢元素的三种不同核素。
( )(9)32S、34S的原子结构示意图均为。
( )【答案】(1)×(2)√(3)×(4)×(5)√(6)×(7)×(8)×(9)√▶能力1 “三素”“两同”概念辨析 要点提醒1.同位素的“六同和三不同”2.元素、核素和同位素之间的关系3.(1)同位素——同种元素的核素(原子)之间的关系,如 11H 、12H;(2)同素异形体——同种元素形成的不同单质之间的关系,如O 2、O 3;红磷与白磷。
高中化学物质结构与性质期末复习资料(知识点总结)

第一章原子结构与性质.一、相识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.1.电子云:原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q.原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形态的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较困难.各轨道的伸展方向个数依次为1、3、5、7.2.(构造原理)原子核外电子排布原理.①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同.洪特规则的特例:在等价轨道的全充溢(p6、d10、f14)、半充溢(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1.(3).驾驭能级交织图和1-36号元素的核外电子排布式.①依据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的依次。
②依据构造原理,可以将各能级按能量的差异分成能级组,由下而上表示七个能级组,其能量依次上升;在同一能级组内,从左到右能量依次上升。
基态原子核外电子的排布按能量由低到高的依次依次排布。
3.元素电离能和元素电负性第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所须要的能量叫做第一电离能。
常用符号I1表示,单位为kJ/mol。
(1).原子核外电子排布的周期性.随着原子序数的增加,元素原子的外围电子排布呈现周期性的改变:每隔肯定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性改变.(2).元素第一电离能的周期性改变.随着原子序数的递增,元素的第一电离能呈周期性改变:同周期从左到右,第一电离能有渐渐增大的趋势,稀有气体的第一电离能最大,碱金属的第一电离能最小;同主族从上到下,第一电离能有渐渐减小的趋势.说明:①同周期元素,从左往右第一电离能呈增大趋势。
高中化学三第一章-原子结构与性质(复习教案2)

第一章原子结构与性质第一节原子结构一、开天辟地——原子的诞生现代大爆炸宇宙学理论认为,我们所在的宇宙诞生于一次大爆炸。
大爆炸后约两小时,诞生了大量的、少量的以及极少量的锂。
其后,经过或长或短的发展过程,氢、氦等发生原子核的熔合反应,分期分批地合成其他元素.核外电子排布的一般规律(1)核外电子总是尽量先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。
(2)原子核外各电子层最多容纳个电子。
(3)原于最外层电子数目不能超过个(K层为最外层时不能超过2个电子)。
(4)次外层电子数目不能超过个(K层为次外层时不能超过2个),倒数第三层电子数目不能超过个.说明:以上规律是互相联系的,不能孤立地理解。
例如;当M层是最外层时,最多可排8个电子;当M 层不是最外层时,最多可排18个电子二、能层与能级多电子原子的核外电子的能量是不同的,由内而外可以分为:第一、二、三、四、五、六、七……能层符号表示K、L、M、N、O、P、Q……………………)能级的符号和所能容纳的最多电子数如下:能层K L M N O ……能级最多电子数…各能层电子数……(1)每个能层中,能级符号的顺序是ns、np、nd、nf……(2)任一能层,能级数=能层序数(3)s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍三、构造原理根据构造原理,只要我们知道原子序数,就可以写出几乎所有元素原子的电子排布。
电子所排的能级顺序:1. 写出17Cl(氯)、21Sc(钪)、35Br(溴)的电子排布氯钪:溴:根据构造原理只要我们知道原子序数,就可以写出元素原子的电子排布,这样的电子排布是基态原子的. 2。
写出1—36号元素的核外电子排布式。
3。
写出1—36号元素的简化核外电子排布式。
4。
画出下列原子的结构示意图:Be、N、Na、Ne、Mg回答下列问题:在这些元素的原子中,最外层电子数大于次外层电子数的有,最外层电子数与次外层电子数相等的有,最外层电子数与电子层数相等的有;L层电子数达到最多的有,K层与M层电子数相等的有.5。
原子结构与性质复习

第一章《原子结构与性质》一、单选题(共12题)1.现有三种元素的基态原子的电子排布式如下:①1s 22s 22p 63s 23p 4;②1s 22s 22p 63s 23p 3;③1s 22s 22p 3。
则下列有关比较中正确的是 A .第一电离能:③>②>① B .原子半径:③>②>① C .电负性:③>②>① D .最高正化合价:③=②>① 2.元素X 的各级电离能数据如下:1I2I3I4I5I6I()-1I/kJ mol ⋅578 1817 2745 11578 14831 18378则元素X 的常见化合价是A .+1B .+2C .+3D .+63.W 、X 、Y 、Z 、R 是五种短周期主族元素,原子序数依次增大。
W 元素的一种离子与Li +具有相同的电子层排布且半径稍大,X 原子核外L 层的电子数与Y 原子核外M 层的电子数之比为3︰2,X 与Z 同主族,Z 的价电子排布式为243s 3p 。
下列说法错误的是 A .气态氢化物的热稳定性:Z Y > B .第一电离能:R Z Y >> C .原子半径:R Z X >>D .电负性:Z R X <<4.四种元素的基态原子的电子排布式如下:下列说法中正确的是 ①1s 22s 22p 63s 23p 4;②1s 22s 22p 63s 23p 3;③1s 22s 22p 3;④1s 22s 22p 5。
A .原子半径:④>③>②>① B .最高正化合价:④>①>③=② C .电负性:④>③>②>① D .第一电离能:④>③>②>①5.下列表述中,正确的是A .最外层只有一个电子的元素,不一定是IA 族元素B .原子的价电子排布为()6~82n 1dns -的元素一定是副族元素C .已知非金属性:F Cl >,则酸性:44HFO HClO >D .在周期表里,元素所在的族序数等于原子最外层电子数6.在Na和Na+ 两种粒子中,相同..的是A.核外电子数B.核内质子数C.最外层电子数D.核外电子层数7.下列说法正确的是A.原子核外电子排布式为21s2s的原子化学性质相似1s的原子与原子核外电子排布式为22[Ar]3d4s是基态原子的电子排布式B.62C.某价电子排布为7124f5d6s的基态原子,该元素位于周期表中第六周期ⅡB族D.基态碳原子的最外层电子轨道表示式为8.下列表示不正确的是A.Cl-的结构示意图:B.氯化铵的电子式为:C.CH4的空间填充模型:D.Se的价电子排布式为3d104s24p49.下列说法正确的是()A.L电子层不包含d能级B.s电子绕核旋转,其轨迹为一个圆,而p电子是走“∞”形C.当n=1时,可能有两个原子轨道D.当n=3时,有3s、3p、3d、3f四个原子轨道10.一种离子液体的结构如图所示。
高中化学知识点复习-原子结构与元素性质

原子结构与元素性质1.基态原子的核外电子排布 (1)排布规律(2)四种表示方法(3)常见错误防范 ①电子排布式a .3d 、4s 书写顺序混乱如:⎩⎪⎨⎪⎧ Fe :1s 22s 22p 63s 23p 64s 23d 6(×)Fe :1s 22s 22p 63s 23p 63d 64s 2(√)b .违背洪特规则特例如:⎩⎪⎨⎪⎧Cr :1s 22s 22p 63s 23p 63d 44s 2(×)Cr :1s 22s 22p 63s 23p 63d 54s 1(√)⎩⎪⎨⎪⎧Cu :1s 22s 22p 63s 23p 63d 94s 2(×)Cu :1s 22s 22p 63s 23p 63d 104s 1(√)②电子排布图a.↑ ↑↑ (违背能量最低原理)b.↑↑(违背泡利原理)c.↑↓(违背洪特规则)d.↑↓(违背洪特规则)2.元素第一电离能的递变性(1)特例当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半充满(p3、d5、f7)和全充满(p6、d10、f14)的结构时,原子的能量较低,为稳定状态,该元素具有较大的第一电离能,如:第一电离能,Be>B;Mg>Al;N>O;P>S。
(2)应用①判断元素金属性的强弱电离能越小,金属越容易失去电子,金属性越强;反之越弱。
②判断元素的化合价如果某元素的I n+1≫I n,则该元素的常见化合价为+n,如钠元素I2≫I1,所以钠元素的化合价为+1价。
3.元素电负性的递变性(1)规律同周期元素,从左到右,电负性依次增大;同主族元素自上而下,电负性依次减小。
(2)应用1.原子核外电子的排布(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用________形象化描述。
在基态14C原子中,核外存在________对自旋相反的电子。
(2)基态Ni原子的电子排布式为__________________________________________,Ni2+的价层电子排布图为___________________________________________,该元素位于元素周期表中的第________族。
高三化学一轮复习——原子结构

第9讲原子结构【考纲要求】1.了解元素、核素和同位素的含义。
2.了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
了解原子、离子等概念的含义3.了解原子核外电子排布。
【课前预习区】一、原子结构1.原子的组成:Z A X指出各字母的含义_________________________________2.组成原子的各微粒的关系:(1)电性关系:质子数核电荷数原子序数核外电子数。
(2)质量关系:质量数=(3)阳离子zX m+:质子数核电荷数原子序数核外电子数电荷数。
(4)阴离子 zX n-:质子数核电荷数原子序数核外电子数电荷数。
三、原子核外电子排布电子在核外排布的规律如何?(1)能量最低原理:离核越近,能量越,电子总是先排在能量的电子层,然后在排能量的电子层。
(2)各电子层最多容纳个电子;(3)最外层最多不超过电子,K层为最外层时不超过个电子。
次外层超过个电子,倒数第三层不超过个电子。
四、有关粒子结构特点的规律(1)He型(2 e-粒子):(2)Ne型(10e-):分子,阳离子,阴离子,其中质子数相同的粒子是。
(3)Ar型(18e-):分子,阳离子,阴离子。
其中质子数相同的粒子是。
(4)其他常见特殊类型:14电子型。
【课堂互动区】一、原子结构[例题1](原子组成、同位素)(09广东化学1)我国稀土资源丰富。
下列有关稀土元素14462 Sm与15062Sm的说法正确的是()A. 14462Sm与15062Sm互为同位素 B.14462Sm与15062Sm的质量数相同C. 14462Sm与15062Sm是同一种核素 D.14462Sm与15062Sm的核外电子数和中子数均为62【规律总结】1、元素、核素、同位素之间的关系2、用质子数、中子数、核外电子数、最外层电子数、电子层数填写下列空格①原子种类由决定②元素由决定③元素有同位素由决定④同位素相对原子质量由决定⑤元素的原子半径由决定⑥元素的化合价主要由决定⑦元素的化学性质主要由决定⑧价电子数通常是指⑨核电荷数由决定⑩原子的质量数由决定[变式1]:(2010年山东)16O和18O是氧元素的两种核素,N A表示阿伏加德罗常数,下列说法正确的是()A. 16O2与18O2互为同分异构体B. 16O与18O核外电子排布方式不同C.通过化学变化可以实现16O与18O间的相互转化D.标准状况下,1.12L16O2与1.12L18O2均含0.1N A个氧原子[变式2]:(2011海南)13153I是常规核裂变产物之一,可以通过测定大气或水中13153I的含量变化来检测核电站是否发生放射性物质泄漏。
高三化学一轮复习——原子结构与元素性质

第32讲原子结构与元素性质【考纲要求】1、了解原子核外电子的运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义。
2、了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示常见元素(1-36号)原子核外电子的排布。
3、了解同一周期、同一主族元素电离能的变化规律,了解元素电离能和核外电子排布的关系。
4、了解同一周期、同一主族元素电负性的变化规律,能根据元素电负性说明2周期中元素金属性和非金属性的变化规律。
【课前预习区】一、核外电子排布(原子结构)1、描述核外电子的运动状态涉即________(即能层)、________(即能级)、________、________;核外电子的排布遵循、、。
2、写出24号元素原子的电子排布式、外围电子(价电子排布式)排布式、外围电子轨道表示式;确定其在周期表中的分区?二、元素性质★1、元素的第一电离能的周期性变化同周期从左至右________________________________________要注意什么?为什么?同主族从上至下_______________________________________★2、元素电负性的周期性变化同周期从左至右________________________________________要注意什么?同主族从上至下_______________________________________【课堂互动区】【考点1】:了解原子核外电子的能级分布,能用电子排布式表示常见元素(1-36号)原子核外电子的排布。
了解原子核外电子的运动状态。
例1:下列各组原子中,彼此化学性质一定相似的是()A、原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子B、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子C、2p轨道上有一成对电子的X原子与3p轨道上有一成对电子的Y原子D、最外层都只有一个电子的X、Y原子规律总结:变式1、请完成下列各题:①前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有_______种。
化学原子结构知识点高三

化学原子结构知识点高三化学原子结构是高三化学学科的重要内容之一。
它是建立在原子理论的基础上,通过研究原子的组成部分以及它们之间的关系和性质,揭示了物质的微观世界。
在高三学习中,我们需要掌握一些关键的原子结构知识点,下面将详细介绍这些知识点。
1. 原子的组成部分原子是物质的基本单位,由质子、中子和电子组成。
质子带正电荷,质量约为1.67×10^-27千克;中子不带电荷,质量约为1.67×10^-27千克;电子带负电荷,质量约为9.11×10^-31千克。
质子和中子位于原子的中心核中,电子则绕核运动。
2. 原子序数和质量数原子序数指的是一个原子核中所含质子的数量,通常用字母Z 来表示。
质量数指的是一个原子核中所含质子和中子的总数,通常用字母A来表示。
原子的元素符号可以表示为X=AZ,其中X 代表元素的符号。
3. 原子核的稳定性和放射性原子核的稳定性是衡量一个原子核的不稳定程度的标准。
原子核的稳定性受到核子的数目以及核子间的相互作用力的影响。
放射性是指原子核发生自发性转变放出粒子或电磁辐射的性质。
放射性可以分为α衰变、β衰变和γ射线等。
4. 原子的电子排布原子的电子以能量层次分布在不同的轨道上,其中最内层能量最低,最外层能量最高。
原子电子的排布遵循阿尔尼斯特规则,即填充顺序按照能量递增的方式进行。
通过电子的排布,我们可以确定原子的化合价、离子价以及元素的周期性属性。
5. 原子半径和原子半径趋势原子半径指的是原子核到外层电子轨道最外电子的平均距离。
原子半径的大小受到原子核的正电荷吸引力和电子之间的排斥力的双重影响。
在周期表中,原子半径随着周期数的增加而减小,随着原子序数的增加而增大。
6. 原子电离能和电离能趋势原子电离能是指从一个原子中去掉一个电子所需的能量。
原子电离能的大小与原子的核电荷和电子与核的距离有关。
在周期表中,原子电离能随着周期数的增加而增加,随着原子序数的增加而减小。
高三一轮复习原子结构元素周期表

② 主族序数 = 原子最外层电子数 ③ 元素周期表中从左至右族的顺序。 ④ 周期表中ⅢB到ⅡB族共10个纵行,称为过渡元素。 这些元素都是金属,所以又称为过渡金属元素。
从元素周期表每个方格中可以得到哪些信息?
质子数
16
S
元素符号 硫 元素名称
外围电子 层排布
3S23p432.06相 Nhomakorabea原子质量
(2)原子结构与元素性质的关系(一般规律)
(a b) A. a
X
B. ( a b ) X (a 2)
C. (a b 2) X ( a 2)
D. (a b 2) X ( a 2)
思考 【电子数相等的微粒】
2电子微粒 He、H2、Li+、Be2+、H- ①分子:CH4、NH3、H2O、HF、Ne 10电子微粒 ②阴离子:N3-、O2-、F-、OH-、NH2- ③阳离子:Na+、Mg2+、Al3+、NH4+
主族: 由短周期元素和长周期元素共同构成 (7个) (稀有气体元素除外) 副族: 由长周期元素构成 (7个)
族 由8、9、10三个纵行构成 (16个) 第Ⅷ族: (1个) 0 族: 由稀有气体元素构成 (1个)
注意:
① 主族、副族的表示方法 主族:ⅠA 、ⅡA 、ⅢA 、ⅣA 、ⅤA、 ⅥA、 ⅦA 副族:ⅠB 、ⅡB 、ⅢB 、ⅣB 、ⅤB、 ⅥB、 ⅦB
特别提醒:
1 ①有质子的微粒不一定有中子,如 H。 1 ②有质子的微粒不一定有电子,如H+。
③质子数相同的微粒不一定属于同一种元素,如Ne、 HF、H2O、NH3、CH4等。 ④任何元素都有零价,但不一定都有负价或正价。如F 无正价,Na、Mg、Al等无负价。
练习1:某元素的某种离子X2-核外共有a个电子,核内 有b个中子,表示该X原子的下列符号中正确的是( C )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在中性原子中
原子序数=核电荷数=核内质子数=核外电子数
在带电原子即离子中
核内质子数=阳离子核外电子数 +电荷数 核内质子数=阴离子核外电子数 -电荷数 离子电荷数=核内质子数-核外电子数
大家来试一试
1.某微粒用 A Rn+表示,下列关于该微粒的叙述中正确 Z 的是 B
2.硼有两种天然同位素 , 硼元素的原子质量为10.80,则对硼元素中 质量百分含量的判断正确的是( ) (A)20% (B)略大于20% (C)略小于20% (D)80%
还有一 个与元素、同位 素、核素易混淆的概念: 同素异形体
概念:由同种元素组成的不同性质的单质之 间互称为同素异形体。 注 意 1、同素异形体之间,化学性质相似, 但不相同,而物理性质通常差异较大。
2、同素异形体之间的转化属于化学变化。
思考:有人说,凡是有单质参加或生成的化学反 应一定是氧化还原反应。你认为对吗?
二、构成原子“三粒子”(质子、 中子、电子)的性质和关系
质子 带正电荷,Z个,决定元素种类
原子核
决定 核素 种类或者说 原子 种类
原子 A ZX
中子 不带电荷,(A-Z)个,决定 同位素 种类
电子层结构 决定元素性质 核外电子 带负电荷,Z个,
是否所有的原子都是由质子、中子、电子构成?
构成原子或离子的粒子间的数量关系
是根据各种天然同位素的相对原子质量和它们的原子总数中所 占的一定百分比计算出来的平均值
即:元素的(平均)相对原子质量 =Ar1a%+Ar2b%+▪▪▪ (4)元素的近似相对原子质量
是用各种同位素的质量数代替其相对原子质量按上述方法计算 出来的,同样也是一种平均值
即:元素的近似(平均)相对原子质量 =A1a%+A2b%+▪▪▪
高三复习
第五章 物质结构 元素周期律
第一节
原子结构
兰天
Hale Waihona Puke 渝水一中主要知识内容
• 元素、同位素、核素的联系与区别
• 构成原子“三粒子”(质子、中子、电子) 的性质和关系
• 核外电子运动的特点及核外电子分层排布 的规律 • 相对原子质量的概念和计算
一、元素、同位素、核素的 联系与区别
1、核素:具有一定数目的质子和 一定数目的中子的一种原子。如 1H(H)、2H(D)、3H(T)就各为一种 核素。 2、同位素:同一元素的不同核素
大家来试试
1、按下列要求写出粒子的名称、原子结构 示意图和符号。 Li+ (1)核电荷数为3,核外电子数为2—— O2核电荷数为8,最外层电子数为8——。 H(2)核内有1个质子的阴离子——;核外 S22-——。 有18个电子的R (3)原子核外L层电子数是K层电子数4倍 Ne、F-、O2- Na+、Mg2+、Al3+ 的粒子是—————————————; 原子核外L层电子数是M层电子数4倍的粒 Mg 子是——。
小知识
2电子粒子 10电子 粒子 H-、Li+、Be2+、He
CH4、NH3、H2O、HF、Ne、N3-、 O2-、F-、Na+、Mg2+、Al3+、 NH4+、NH2-、OH-、H3O+
18电 SiH4、PH3、H2 S、HCl、F2 、Ar、P3-、 子 S2-、HS -、Cl-、K+、Ca2+、 PH4+、 粒 NH2-NH2、NH2-OH、CH3-OH 子 HO-OH、CH3-F、CH3-CH3
之间互称同位素。 例如:16O、17O、18O 是氧元素的三种核素,互为同位素 。 3、元素:具有相同质子数不同中子数的同一类原子的总称。 如:16O、17O、18O都是氧元素的原子。
注意
1、同一种元素,可以有若干种不同的核素。至今已发现了110多 种元素,但发现的核素远多于元素种数。一种核素就是一种不同 的原子,所以,虽然元素只有110多种,但原子却有二千余种。 2、绝大多数元素有天然同位素,而且天然存在的同位素所占 的原子百分数一般不 变。 3、 17O是一种核素,或者说是一种原子,通常不说它是一种 同位素,但可以说它是氧元素的一种同位素;也可以说氧元 素 有三种同位素。 4、同一种元素的不同同位素原子其质量数不同,核外电子层 结构相同,其原子、单质及其构成的化合物化学性质几乎完 全相同,只是某些物理性质略有差异。
三、原子核外电子排布的一般规律
1、每一电子层所容纳的电子数最多为 2n2 。 2、最外层电子数最多为 8 ,若最外层为K层,则最 多为 2 。
(1)若原子最外层已排满8个电子(He 2个),则该原子 结构为稳定结构,形成的原子为 稀有气体原子 。
(2)若原子最外层电子数 <4 ,一般易失去最外层较 8或2电 少的电子而使次外层暴露,达 的稳定结构,形成 的单质大部分为 ,表现还原 性。 金属 子 (3)若原子最外层电子数 >4 ,一般易得到电子或形 8 成共用电子对来形成最外层为 的稳定结构,形成的单质 大部分为非金属 ,表现 氧化 性。 3、次外层电子数最多为 18 ,倒数第三层最多 32 。 4、能量低的电子离原子核 近 ,能量高的电子离原子 核 远 。
4、元素相对原子质量的概念和计算:
四种相对原子质量: 同位素的 精确的 元素的
近似的
(1)同位素的相对原子质量
各同位素原子的绝对质量分别与 的绝对质量的1/12的比值
Ar=
一个同位素原子的质量 一个 C -12 原子质量的 1 / 12
(2)同位素的近似相对原子质量 也就等于其质量数
(3)元素的(精确)相对原子质量
A 所含质子数=A-n
C 所含电子数=Z+n
B 所含中子数=A-Z
D 质子数=Z+A
2、(07年宁夏卷)下列叙述错误的是( D) A.13C和14C属于同一种元素,它们互为同位素 B.1H和2H是不同的核素,它们的质子数相等 C.14C和14N的质量数相等,它们的中子数不等 D.6Li和7Li的电子数相等,中子数也相等 3、若阴离子XO3-含有42个电子,质量数为83,氧原子的 中子数等于质子数,则X元素原子核内中子数为( A ) A. 18 B. 13 C. 15 D. 7
大家来试试
1.将某文献资料上记载的相对原子质量数据摘录如下:
35Cl 37Cl
34.969 75.77% 36.966 24.23%
35Cl 37Cl
35 37
75.77% 24.23%
平均
35.453
平均
35.485
试回答下列问题: 35Cl的(精确)相对原子质量 (1)34.969是表示_______________; Cl元素的(精确)相对原子质量 (2)35.453是表示_______________; 35Cl的近似相对原子质量(质量数) (3)35是表示____________________; Cl元素的近似相对原子质量 (4)35.485是表示____________________; 37Cl的原子百分数(丰度) (5)24.23是表示______________________。
2、已知X、Y是核电荷数在18以内的 原子, X的最外层有n个电子,次 外层有n+2个电子;Y的最外层有 m-5个电子,次外层有m个电子。 试推断X、Y各为什么元素?并绘出 原子结构示意图。
(硫、铝)
3、(07年全国卷)用A+、B-、C2-、D、E、F和G分别 表示含18个电子的八种微粒(离子或分子),请回答: (1)A元素是 K 、B元素是 Cl ,C元素是 S 。 (用元素符号表示) (2)D是由两种元素组成的双原子分子,其分子式 是 HCl 。 (3)E是所有含18个电子的微粒中氧化能力最强的分子, 其分子式是 F2 。 (4)F是由两种元素组成的三原子分子,其分子式 是 H2S;电子式是 。 (5)G分子中含有4个原子,其分子式是 NH3 H2O2 。 (6)H分子中含有8个原子,分子式是 C2H6 。
