无机化学第十七章 d区元素二 ppt课件
合集下载
卤素无机化学课件

碘等元素。
03
卤素也存在于一些矿物中,如氟石(CaF2)、石盐
(NaCl)等。
2024/1/30
5
卤素化合物种类及应用
金属卤化物
如氯化钾、氯化钠等盐类,用 、漂白等领域。
卤化氢
氢氟酸、氢氯酸、氢溴酸、氢 碘酸等,在化工、医药等领域 有广泛应用。
等领域的应用。同时,也介绍多卤化物的一些重要反应,如亲核取代反
应、消除反应等。
21
06
卤素在无机合成中应用
2024/1/30
22
氟化反应
2024/1/30
氟化氢的制备
01
通过硫酸与氟化钙反应得到氟化氢。
氟化物的合成
02
利用氟化氢或其盐类与金属氧化物、氢氧化物或碳酸盐等反应
,生成相应的氟化物。
氟化有机物的合成
2024/1/30
25
07
实验部分:卤素相关实验操作与注意事项
2024/1/30
26
实验一:制备氯气并验证其性质
2024/1/30
• 实验目的:掌握氯气的制备方法,了解其性质及 应用。
27
实验一:制备氯气并验证其性质
实验步骤
1. 在实验室中搭建制备氯气的装置。
2024/1/30
2. 将浓盐酸与二氧化锰混合,加热反应制取氯气。
04
卤素氧化物和含氧酸
2024/1/30
15
卤素氧化物
2024/1/30
一氧化卤
卤素与氧直接结合形成的化合物,如Cl2O、Br2O、I2O等。
二氧化卤
卤素与两个氧原子结合形成的化合物,如ClO2、BrO2等。部分 二氧化卤具有强氧化性。
其他卤素氧化物
无机化学ds区、d区和f区过度元素ppt课件

上页 下页 目录 返回
8.2 铜族和锌族化合物 8.2.1 概述 价电子构型: (n-1)d10ns1-2 对于铜族元素,又称IB族,可失去s上的电子,又可失 去d上电子,氧化数+1、+2、+3。常见的是:Cu→+2, Ag→+1,Au→+3。 因 IB 族离子具有较强的极化力,变形性也大,故其二 元化合物一般有相当程度的共价性,难溶于水。 对于ⅡB族,只能失去最外层2个电子,形成+2价化合 物。汞有+1(以双聚离子[Hg-Hg]2+形式存在) 从 Zn2+→Cd2+→Hg2+ 极化力和变形性依次增强,当与 易变形的阴离子形成的化合物,有相当程度的共价性, 所以Hg2+的这类化合物溶解度较小,且显色。
上页 下页 目录 返回
AgNO3: 最重要的可溶性银盐,Ag与65%HNO3,反应后制得, Ag+具有氧化性 。 遇光或加热易分解而析出银,注意保存在棕色瓶中。 2AgNO3→2Ag+2NO2+O2 AgI在人工降雨中作冰核形成剂 HgCl2: Hg取sp杂化,为共价化合物,直线构型。熔点较低 (280℃),易升华,故俗名升汞,能溶于水(25℃, 7g/100g水),有毒,稀溶液可杀菌,∴外科用作手术器 械的消毒剂。
无机化学ds区 、d区和f区过 度元素
8.1 过渡元素概述
8.1.1 基本划区 价电子构型:(n-1)d1-10ns1-2 铜族:货币元素 锌族:低熔点重金属;汞(常温下唯一的一种液体金属) 钒族:酸土元素 铁系元素 铂系元素 镧系元素和锕系元素
上页 下页 目录 返回
8.1.2 过渡元素的特性 ● 过渡元素都是金属 ● 许多元素形成多种氧化态 除了s电子参与成键,d电子也部分或全部参与成键( ⅡB族除外) ,从而导致丰富的氧化还原行为。 ● 过渡元素的水合离子多具有特征颜色 过渡元素的离子在水溶液中常呈现一定的颜色,这与该 离子存在未成对d电子有关, d-d跃迁,一般d0, d10没有颜 色。 ● 形成配合物的能力比较强 过渡元素的离子存在空的ns,np和部分填充或全空的(n1)d轨道,可接受配位体的出对孤对电子。
无机化学基础全套课件ppt全册电子教案

的分子,都是通过共价键形成的,称为共价分子,它包括单质分子和化合
物分子。
化学键
共价键
H2、HCl两分子虽然都是由共价键形成的分子,但这两个分子中的共价键是有
区别的。H2分子是由同种元素的原子形成的共价化合物,由于两个原子吸引电
子的能力相同,共用电子对不偏向任何一个原子,因此成键原子不显电性。这
样的共价键叫做非极性共价键,简称非极性键。如Cl2、O2、N2等是由非极性键
空间绕原子核做高速运动。
原子的组成
原子核
原子核发现以后,科学家又进一步证明,原子核还可以再分,它是由更小的
微粒质子和中子组成。一个质子带一个单位正电荷,中子不带电,原子核所
带的正电荷数等于核内质子数。由于原子显中性,所以核电荷数等于质子数
,也等于核外电子数。既表示为:
核电荷数(Z)=质子数=核外电子数
+
- +
极性
分子
+非极性
分子
- +
固有偶极
-
+
诱导偶极
诱导力
分子的作用力
色散力
非极性分子的偶极矩为零,似乎不存在相互作用。事实上分子中的电子和原子核都处在不断运动
中,经常会发生正、负电荷重心的瞬间相互位移,从而产生偶极。这类偶极称为瞬时偶极。当两个
或多个非极性分子在一定条件下充分靠近时,就会由于瞬时偶极而发生异性相吸的作用。这种由瞬
1s2
2
3
Li
1s22s1
2
1
4
Be
1s22s2
2
2
5
B
1s22s22p1
2
3
6
C
1s22s22p2
物分子。
化学键
共价键
H2、HCl两分子虽然都是由共价键形成的分子,但这两个分子中的共价键是有
区别的。H2分子是由同种元素的原子形成的共价化合物,由于两个原子吸引电
子的能力相同,共用电子对不偏向任何一个原子,因此成键原子不显电性。这
样的共价键叫做非极性共价键,简称非极性键。如Cl2、O2、N2等是由非极性键
空间绕原子核做高速运动。
原子的组成
原子核
原子核发现以后,科学家又进一步证明,原子核还可以再分,它是由更小的
微粒质子和中子组成。一个质子带一个单位正电荷,中子不带电,原子核所
带的正电荷数等于核内质子数。由于原子显中性,所以核电荷数等于质子数
,也等于核外电子数。既表示为:
核电荷数(Z)=质子数=核外电子数
+
- +
极性
分子
+非极性
分子
- +
固有偶极
-
+
诱导偶极
诱导力
分子的作用力
色散力
非极性分子的偶极矩为零,似乎不存在相互作用。事实上分子中的电子和原子核都处在不断运动
中,经常会发生正、负电荷重心的瞬间相互位移,从而产生偶极。这类偶极称为瞬时偶极。当两个
或多个非极性分子在一定条件下充分靠近时,就会由于瞬时偶极而发生异性相吸的作用。这种由瞬
1s2
2
3
Li
1s22s1
2
1
4
Be
1s22s2
2
2
5
B
1s22s22p1
2
3
6
C
1s22s22p2
《d区元素》PPT课件

精选PPT
11
• ②第一过渡系列的低氧化态化合物具有还 原性
TiCl2 +TiOCl2 +H2
4CrCl2 +4HCl +O2 == 2CrCl3 +2H2O 2V2VO2 (aq)
Cr3/ Cr2 = 0.41V
VO2 / V2 = 0.05V
2CrCl2 +2HCl== 2CrCl3 +H2
==TiO2·XH2O + 4C4H9OH
精选PPT
22
• 钛的检验: • 以H2SO4—HCl溶解式样生成TiO2+ • TiO2+ +H2O2 ==[TiO(H2O2)]2+ • 3TiO2+ +Al +6H+ ==3Ti3+ +Al3+ +3H2O • Ti3+ +Fe3+ +H2O ==TiO2+ +Fe2+ +2H+ • 以FeCl3滴定,NH4SCN(aq)作指示剂
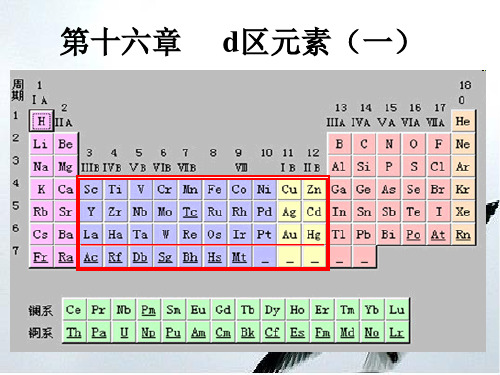
第十六章 d区元素(过渡)元素
IIIB —VIII 25个元素 (n-1)d 1-9ns1-2
Sc Ti V Cr Mn Fe Co Ni
Y Zr Nb Mo Tc Ru Rh Pd
La Hf Ta W Re Os
Ir Pt
Ac
精选PPT
1
§16—1过渡金属元素的通性
• 第一过渡系列 3d1-84s2 例外Cr : 3d54s1
精选PPT
16
• 三、钼的冶炼
• 辉钼矿 MoS2
• 灼烧 MoS2+2O2 == 2MoO3 +4SO2
无机化学 p,d区元素

无机化学
20
第三节 氧族元素
一、氧族元素的通性
性质 氧(O) 硫(S) 硒(Se) 碲(Te) 钋(Po)
原子序数 相对原子质量 价电子层结构 共价半径/pm 第一电离能 第一电子亲和能 电负性 主要氧化数
8 16.00 2s22p4 66 1314 -141 3.44 -2 0
16 32.07 3s23p4 104 1000 -200 2.58 -2 0 +2 +4 +6
性质 常况时物态 常况时颜色 熔点/K 沸点/K 溶解度
(298K,mol/L)
氟(F2) 气 浅黄色 53.56 84.96
-
氯(Cl2) 气 黄绿色 172.16 238.46 0.090(g) 246.7
溴(Br2)
碘(I2)
液 固 红棕色 紫黑色 265.96 386.86 331.16 456.16 0.21(g) 1.310-3(g) 193.2 150.9
无机化学
7
2. 与水作用 卤素与水反应有下列2种类型: (1) 2X2+2H2O==4H++4X-+O2 (2) X2+H2O==H++X-+HXO 3. 卤素间的置换反应 X2与X-离子间的氧化还原反应称为卤素间的 置换反应。
0 0 F C l C l 0 Br 0 I F2 Br2 I2 2 2.87 1.358 1.066 0.5355
p区元素(一)
第二节 卤 素
无机化学
1
卤 素的 基 本 性 质
性质 原子序数 相对原子质量 价电子层结构 原子半径/pm 离子半径/pm 电子亲和能 第一电离能 电负性 主要氧化数 X-的水合能 氟(F) 9 18.99 2s22p5 64 136 -322 1682 3.98 -1,0 -507 氯(Cl) 17 35.45 3s23p5 99 181 -348.7 1251 3.16 溴(Br) 35 79.90 4s24p5 114 196 -324.5 1141 2.96 碘(I) 53 126.9 5s25p5 133 216 -295 1008 2.66
大学无机化学 d区元素介绍
性质:Cr2O3 6H Cr 3H2O
△ Δ
△
3
3H2O Cr2O3 2OH- Cr(OH)4
(2) Cr(OH)3
Cr 3
(适量)OH- (灰绿)
H
பைடு நூலகம்
Cr(OH)3 (s) H ∆ H2O Cr2O3 (绿)
OH -
(亮绿色)
Cr(OH)
4
(3) Cr(H2O)3 6 的水解
Ac, (104-112,人工合成元素)
57-71
89-103
2
第十六章
d区元素(一)
§16.1 d区元素概述
§16.2 钛 钒
§16.3 铬 钼 钨 多酸型配合物 §16.4 锰
§16.5 铁 钴 镍
§16.1 d区元素概述
16.1.1 d区元素通性
1.原子的价电子层构型:
(n-1)d1-10ns1-2
3Sn 2Cr 7H 2 O 3Cl 2 2CrCl 3 2KCl 7H 2 O
4
14H
K 2 Cr2 O 7 (s) 14HCl(浓)
☆2 ☆铬(Ⅲ)的化合物
(1) Cr2O3的制备与性质 △ Δ 2Cr2O3 制备:4Cr 3O2
(NH4 ) 2 Cr2O7 Cr2O3 N 2 4H2O
-7
2Ag2 CrO4 (s, 砖红) 2H 2BaCrO4 (s, 柠檬黄) 2H 2PbCrO4 (s, 黄) 2H
(3) K2Cr2O7的氧化性
E (Cr2 O /Cr ) = 1.33V
2 Cr2 O 3SO 3 8H 27 3 3SO 2Cr 4H 2 O 24
△ Δ
△
3
3H2O Cr2O3 2OH- Cr(OH)4
(2) Cr(OH)3
Cr 3
(适量)OH- (灰绿)
H
பைடு நூலகம்
Cr(OH)3 (s) H ∆ H2O Cr2O3 (绿)
OH -
(亮绿色)
Cr(OH)
4
(3) Cr(H2O)3 6 的水解
Ac, (104-112,人工合成元素)
57-71
89-103
2
第十六章
d区元素(一)
§16.1 d区元素概述
§16.2 钛 钒
§16.3 铬 钼 钨 多酸型配合物 §16.4 锰
§16.5 铁 钴 镍
§16.1 d区元素概述
16.1.1 d区元素通性
1.原子的价电子层构型:
(n-1)d1-10ns1-2
3Sn 2Cr 7H 2 O 3Cl 2 2CrCl 3 2KCl 7H 2 O
4
14H
K 2 Cr2 O 7 (s) 14HCl(浓)
☆2 ☆铬(Ⅲ)的化合物
(1) Cr2O3的制备与性质 △ Δ 2Cr2O3 制备:4Cr 3O2
(NH4 ) 2 Cr2O7 Cr2O3 N 2 4H2O
-7
2Ag2 CrO4 (s, 砖红) 2H 2BaCrO4 (s, 柠檬黄) 2H 2PbCrO4 (s, 黄) 2H
(3) K2Cr2O7的氧化性
E (Cr2 O /Cr ) = 1.33V
2 Cr2 O 3SO 3 8H 27 3 3SO 2Cr 4H 2 O 24
第17章 卤族元素 大学一年级 无机化学 课件

• 2. F半径特小,非键电子斥力和核电荷斥力特别大, 也可使F-F键削弱。
(二) 标准电极电势与卤素的化学反应性能 1.卤素单质的强氧化性
Ø (X2/X-):依次减小
F2 > Cl2 > Br2 > I2 卤素单质氧化性: F2最强 2. 卤离子X-的的还原性
F - < Cl - < Br - < I -
1.673 HClO2
1.458
HClO
1.513
1.630
1.360
Cl2
Cl-
BrO4- 1.760
BrO3- 1.490 HBrO 1.209
1.604
1.077
Br2
Br-
H3IO62- 1.600 IO3-
1.150 HIO
1.431 I2
0.534 I-
4、HF特殊性
氢氟酸具有与二氧化硅或硅酸盐(玻璃的主要成分) 反应生成气态SiF4的特殊性质,反应式为:
②分子间缔合:
(H2O)n;
③物质的沸点升高: H2O 100℃
氢键键能:5–40KJ/mol,约为化学键能的 1/10。 与范德华力相当。
氢键的分类
1400
分子间的氢键
分子内的氢键
• 分子内氢键的生成,一般会使化合物沸点、熔点降低,汽化热、 升华热减小。也常影响化合物的溶解度,如邻位硝基苯酚比其 间位、对位更不易溶于水,而更易溶于非极性溶剂中。
第17章 卤族元素
The Halogens
§17-1 通性
基本性质 价层电子结构
主要氧化数 解离能/kJ·mol 溶解度/g/100mgH2O 原子半径/pm X-离子半径/pm 第一电离能/kJ·mol-1 第一电子亲合能/kJ·mol电负性 (Pauling) X-离子水合能/kJ·mol-1
(二) 标准电极电势与卤素的化学反应性能 1.卤素单质的强氧化性
Ø (X2/X-):依次减小
F2 > Cl2 > Br2 > I2 卤素单质氧化性: F2最强 2. 卤离子X-的的还原性
F - < Cl - < Br - < I -
1.673 HClO2
1.458
HClO
1.513
1.630
1.360
Cl2
Cl-
BrO4- 1.760
BrO3- 1.490 HBrO 1.209
1.604
1.077
Br2
Br-
H3IO62- 1.600 IO3-
1.150 HIO
1.431 I2
0.534 I-
4、HF特殊性
氢氟酸具有与二氧化硅或硅酸盐(玻璃的主要成分) 反应生成气态SiF4的特殊性质,反应式为:
②分子间缔合:
(H2O)n;
③物质的沸点升高: H2O 100℃
氢键键能:5–40KJ/mol,约为化学键能的 1/10。 与范德华力相当。
氢键的分类
1400
分子间的氢键
分子内的氢键
• 分子内氢键的生成,一般会使化合物沸点、熔点降低,汽化热、 升华热减小。也常影响化合物的溶解度,如邻位硝基苯酚比其 间位、对位更不易溶于水,而更易溶于非极性溶剂中。
第17章 卤族元素
The Halogens
§17-1 通性
基本性质 价层电子结构
主要氧化数 解离能/kJ·mol 溶解度/g/100mgH2O 原子半径/pm X-离子半径/pm 第一电离能/kJ·mol-1 第一电子亲合能/kJ·mol电负性 (Pauling) X-离子水合能/kJ·mol-1
d 区元素

(3)
金属单质的物理性质
●熔点、沸点高 熔点最高的单质: 钨(W) 3683±20℃
●硬度大
硬度最大的金属:铬(Cr) 摩氏 9.0
●密度大
密度最大的单质: 锇(Os ) 22.48 g· -3 cm ●导电性,导热性,延展性好
上页 下页 目录 返回
(4)
金属元素的原子化焓
原子化焓是金属内部原子结合力强弱的一种标志,较 高的原子化焓可能是由于较多的价电子(特别是较多的未 成对电子)参与形成金属键。
2 Cr2+(aq) + 2 H3O+(aq) Mn2+(aq)
2 Cr3+(aq) + H2(g) + 2 H2O(l)
Ni和Cu(当然还有Zn)的稳定水合离子只能是二价的
上页 下页 目录 返回
3. 同族元素族氧化态稳定性变化趋势
● 同族元素自上而下形成族氧化态的趋势增强 ● 需要指出的是,这条规律对第3族 和第12族
△H1
△Hh M+(g) + e–
△H=△HI + △H1 + △Hh
s 区元素从上到下总热效应 △H (吸热)总的来说 是变小的,这就表明它们在水溶液中变成水合离子的倾 向从上到下变大,而 d 区元素从上到下总热效应 △H (吸热)增大,因此它们的活性都变小。
上页 下页 目录 返回
15.1.2 无机颜料和化合物的颜色
上页 下页 目录 返回
荷移跃迁举例
副篇内容
● 晶格缺陷
SnI4 的电荷迁移
晶格缺陷一种是晶格中某些负离子没有,空位由自由
电子占据,以此达到电荷平衡;第二种是晶体中金属离 子过剩,占据晶格间隙位置,电荷由占据另一些间隙位 置的电子来平衡。两种缺陷中都包含自由电子,被激发 所需的能量一般较小,若吸收峰落在可见光区,就现出 颜色。
苏州大学《无机化学》d区元素

MnO4
-
强OHH+歧化/强氧化剂/电解
MnO42-
紫红
暗绿
三、Fe
1、常见的价态有: Fe2+(实际上是淡绿色的[Fe(H2O)6]2+);
Fe3+(实际上是淡紫色的[Fe(H2O)6]3+,此离子水解 后才略显黄色); 2、主要反应有:
(1) Fe
2+
NH3/OH-
淡绿色
Fe(OH)2
白色
O2
2H[CuCl2] + H2SO4
6、Cu2+的其它主要反应有:
CuS(s)
H2S 黑色
盐 血 赤 2+ u C 鉴别
Cu2[Fe(CN)6](s) 红棕色
Cu2+
蓝色 I-
OH-/NH3 Cu(OH)2(s) 蓝色沉淀 S 2O 2
3 -
NH3
[Cu(NH3)4]2+
深蓝色
C6H12O6葡萄糖
CuI(s)
Cr2O72橙红
CrO42黄
分别生成砖红、淡黄、黄色沉淀
其中,上图中常见的还原剂为:Fe2+、I ˉ、H2S、 SO32-等;强氧化剂通常用过硫酸盐(S2O82-)。
二、Mn
1、常见的价态有: MnO4-(+7); MnO2(+4); MnO42- (+6) Mn2+ (+2)
2、重要化合物(离子)之间的转化:
(4). Fe3+比Fe2+易水解,水解产物为胶状物,可使 在水中悬浮的杂质聚沉下来,从而使混浊的水变清, 所以FeCl3可作净水剂。 (5). Fe3+/Fe2+常见的配合物有: 6配位的水合配离子[Fe(H2O)6]2/3+; “棕色环”配离子[Fe(NO)(H2O)5]2+——可用 来鉴别NO2-/NO3-; 可鉴别Fe3+的血红色配离子;氰根配离子 (黄血盐/赤血盐)→Prussian或Turnbull蓝。
无机化学D区元素核化学PPT128页

6、最大的骄傲于最大的自卑都表示心灵的最软弱无力。——斯宾诺莎 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰出的人谈话。——笛卡儿
Thank you
无机化学D区元素核化学
1、纪律是管理关系的形式。——阿法 纳西耶 夫 2、改革如果不讲纪律,就难以成功。
3、道德行为训练,不是通过语言影响 ,而是 让儿童 练习良 好道德 行为, 克服懒 惰、轻 率、不 守纪律 、颓废 等不良 行为。 4、学校从集体,养 成儿童 自觉的 纪律性 ,这是 儿童道 德教育 最重要 的部分 。—— 陈鹤琴
课件化学--d区元素

Ti的丰度居元素分布序列中第十位,属于含量较 为丰富的金属元素。钛的熔点为1680℃,沸点3260℃, 密度为4.5g·cm-3。钛具有特强的抗腐蚀作用,无论在 常温或加热下,或在任意浓度的硝酸中均不被腐蚀。 钛矿物有钛铁矿FeTiO3和金红石TiO2。
钛或钛合金的密度与人的骨 骼相近,对体内有机物不起化学 反应,且亲和力强,易为人体所 容纳,对任何消毒方式都能适应, 因而常用于接骨、制造人工关节 等。又称为生命金属。
用水浸取除去可溶盐,得海绵状钛,电弧熔 融得钛锭。
§ 2-2 钛的重要化合物
1. 二氧化钛
天然二氧化钛称“金红石”,含杂质。
人工制备纯TiO2俗称“钛白粉”,是优良的白色 涂料,着色力强,遮盖力强,化学稳定性好,优于
除s电子外,d电子可参与成金属键,自左向右未成对价电 子增多,至VIB族(铬族)可能提供6个单电子,相互作用力大, 金属键强,因此在过渡系中,铬族(Cr,Mo,W)熔点最高, 硬度也很大,除Mn和Tc外(熔点反常)随后自左向右熔点又有 规律下降。
铬族价电子层构型: (n-1)d5ns1
熔点变化示意图
此外,钛或钛合金还具有特 殊的记忆功能、超导功能和储氢 功能等。
Zr,Hf是稀有金属,锆矿主要有锆英石ZrSO4, 价电子结构(n-1)d2ns2,d0电子结构较稳定, 所以除最外层s电子,次外层d电子也参加成键, Ti,Zr,Hf最稳定的氧化态是+4。其次是+3, +2较少见。
由于镧系收缩,铪的离子半径与锆接近,所以
FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2O TiOSO4 + 2H2O = H2TiO3 + H2SO4 H2TiO3 = TiO2 + H2O
钛或钛合金的密度与人的骨 骼相近,对体内有机物不起化学 反应,且亲和力强,易为人体所 容纳,对任何消毒方式都能适应, 因而常用于接骨、制造人工关节 等。又称为生命金属。
用水浸取除去可溶盐,得海绵状钛,电弧熔 融得钛锭。
§ 2-2 钛的重要化合物
1. 二氧化钛
天然二氧化钛称“金红石”,含杂质。
人工制备纯TiO2俗称“钛白粉”,是优良的白色 涂料,着色力强,遮盖力强,化学稳定性好,优于
除s电子外,d电子可参与成金属键,自左向右未成对价电 子增多,至VIB族(铬族)可能提供6个单电子,相互作用力大, 金属键强,因此在过渡系中,铬族(Cr,Mo,W)熔点最高, 硬度也很大,除Mn和Tc外(熔点反常)随后自左向右熔点又有 规律下降。
铬族价电子层构型: (n-1)d5ns1
熔点变化示意图
此外,钛或钛合金还具有特 殊的记忆功能、超导功能和储氢 功能等。
Zr,Hf是稀有金属,锆矿主要有锆英石ZrSO4, 价电子结构(n-1)d2ns2,d0电子结构较稳定, 所以除最外层s电子,次外层d电子也参加成键, Ti,Zr,Hf最稳定的氧化态是+4。其次是+3, +2较少见。
由于镧系收缩,铪的离子半径与锆接近,所以
FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2O TiOSO4 + 2H2O = H2TiO3 + H2SO4 H2TiO3 = TiO2 + H2O
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2 C O 2 H u 2 O C 2 O C 2 (u O 2 C 3 ( 绿 H O )
2020/12/2
碱式碳酸铜 9
(2) 与X2作用
Cu Cl2 常温下反应 AgC2l 常温下反应较慢 AuC2l 只能在加热条件下进行
活泼性:Cu>Ag>Au
2020/12/2
10
(3) 与酸作用
• 不能置换稀酸中的H+;
• 生成难溶物或配合物,使单质还原能力增强;
2Ag
2H
4I
2AgI
2
H2
(g)
2C 2u H 4C Cl2 S )2 (2N CH u2)[2]2 C H 2 S (g
硫脲
4Ag 2H2S O2 2Ag2S 2H2O
4 M O 2 22 O H 8C 4 N [M 2 ] 4 (C O
2020/12/2
6
1.物理性质
• 特征颜色:Cu(紫红),Ag(白),Au(黄) • 熔点、沸点较其它过渡金属低 • 导电性、导热性好,且Ag>Cu>Au • 延展性好
2020/12/2
7
熔点 沸点 密度(g/cm3) 导电率(Hg=1) 导热率(Hg=1)
Cu 紫红 1356℃ 2840℃ 8.96 56.9 51.3
Au 4H 浓 )C H l(3 N (浓 )O H[A 4]N uC O 2 lH (2O g
2020/12/2
13
17.1.2 铜族元素的化合物
1.铜的化合物 Cu(Ⅰ)的化合物呈白色或无色,Cu+价
电子构型为d10,不发生d-d跃迁。
Cu(Ⅱ)的化合物呈现颜色,Cu2+价电子 构型为d9,发生d-d跃迁。
Ag 银白 ℃ 2485℃ 10.50 59 57.2
Au 黄色 1337℃ 3553℃ 19.30 39.6 39.2
2020/12/2
8
2.化学性质
(1) 与O2, H2O作用 • 化学活泼性差,室温下 不与O2,H2O作用; • 加热时与O2,H2O作用。
2Cu O2 2CuO(黑)
潮解,能溶于 中,易溶于甲
乙醇
醇和乙醇中
+1 氯化亚铜
CuCl
白色四面体 晶体
3.53~3.68 425℃熔化, 约 1000℃沸
腾
1.5(25℃), 难溶于水。在 空气中吸湿 后变绿,溶于
氨水
2020/12/2
15
(1) 铜(Ⅰ)的化合物 • Cu+在溶液中不稳定:
+0.153V +0.521V Cu2+ ———— Cu+ ———— Cu
M 2020/12/2 Cu, Ag, Au
11
4C O 2 u 22 H O 8N 3 H 4[C3)u 2](无 N) H 色 4OH
O2
[Cu(NH 3 )4 ]2 (蓝)
所以不可用铜器盛氨水。
2020/12/2
12
• 与氧化性酸作用
Cu 4HNO3(浓) Cu(NO3)2 2NO2 2H2O
Cl2
16
• Cu(Ⅰ)化合物难溶于水,溶解度相对大小:
CuCl>CuBr>CuI>CuSCN>CuCN>Cu2S
• Cu(Ⅰ)化合物与氧作用:
2C 2O u O2 2 0 C 0 4CuO
(除去氮气中微O量2)
• Cu+为软酸,与下列配位体形成配合物, 稳定性大小顺序:
2Cu+ Cu2++Cu , K =1.0×106
• 固态Cu(Ⅰ)化合物比Cu(Ⅱ)化合物稳定性高
2C u 1 O 1 C 0 (C s0 2 O )u暗 (s ) ,1 2 红 O 2
1800℃
2Cu(s)
1 2
O2
2020/12/2 CuCl 2 (s)
990C CuCl(s)
1 2
CuSO4 粉末, 解为碱式盐, HCl 气流中 653℃以上分 后变为 CuO。 加热可得无
解为 CuO 和 用硝酸铜和 水 CuCl2,呈
SO3
乙醇溶液浸 黄褐色,比重
湿的纸,干后 为 3.05
可自燃
20.7,无水 137.8(0℃)在 77.0,能溶于
CuSO4 易吸 湿空气中易 乙醚和丙醇
水
A 2 gH 3 (浓 )N A O3 g N N 2 H O O 2 O C 2 u 2 S H 4 ( 浓 O ) C4 u S 2 S O 22 O O H
2 2 A 2 S H 4 ( 浓 g O ) A 2 S 4 ( g O s S 2 ) 2 O 2 O H
或 Cu
几乎不溶于 水(2.3×
10-3%),易溶 于氨水
+2 硫酸铜 CuSO4·5H2O
蓝色晶体
+2
硝酸铜 Cu(NO3)2·
3H2O 蓝色晶体
+2 氯化铜 CuCl2·2H2O
绿色晶体
2.29
2.05
2.50
260℃以上变 114.5℃熔 在 140~150℃
为无水白色 化,强热时分 时在干燥的
➢ 价键特征
离子为18e或9―17e电子构型,具有较
强的极化力和变形性。化合物有较高程度
的共价性。如:CuCl2、AgI等
2020/12/2
5
铜族元素除以单质形式存在外,还
以矿物形式存在。如:
Cu:辉铜矿(Cu2S) 孔雀石(Cu2(OH)2CO3)
Ag:辉银矿(Ag2S) Au:碲金矿(AuTe2)
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
2020/12/2
4
17.1.1 铜族元素的单质
IB 族
铜 29Cu
银 47Ag
金 79Au
➢ 价电子层结构 (n-1)d10ns1 n=4,5,6,7
➢ 氧化数 +1、+2、+3
Cu(Ⅲ)的化合物:K3CuF6(淡绿色),具 有强氧化性。
2020/12/2
14
几种常见的铜的化合物:
氧化态 化合物
颜色和状态 密度(g/cm-2)
熔点/℃ 受热时的情
况
溶解度 (g/100gH2O)
(无水盐)
+2 氧化铜
CuO
棕黑色粉末
6.32~6.43 1148
1000℃时分 解为,加热时 能被 H2、CO 还原为 Cu2O
第十七章 d区元素(二)
§17.1 铜族元素 §17.2 锌族元素
§17.1 铜族元素
17.1.1 铜族元素的单质 17.1.2 铜族元素的化合物
精品资料
• 你怎么称呼老师?
• 如果老师最后没有总结一节课的重点的难点,你 是否会认为老师的教学方法需要改进?
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
