2009年东辰高中招生考试新生入学化学试题及答案
绵阳东辰学校高一入学分班考试化学试题模拟试题1(含答案)
绵阳东辰学校高中入学考试化学试题模拟一可能用到的相对原子质量:C —12 H —1 O —16 N —14 P —31一、选择题(每小题只有一个正确选项,将答案填在下列方框中,共33分)1、下列物质长期露置在空气中,因发生化学变化而使溶液质量减少的是( ) A .浓硫酸 B.烧碱溶液 C.浓盐酸 D.澄清的石灰水2、.喷墨打印机的工作原理是:将溶解在打印墨水(pH7.5~9.0)中的染料喷到打印纸(p H4.5~6.5)上,形成不溶于水的固体。
下列有关叙述正确的是A.打印墨水偏酸性B.打印墨水显中性C.打印纸偏酸性D.打印纸偏碱性3、目前世界上已证明”达菲”(分子式为C 16H 31N 2PO 8)是治疗禽流感的唯一良方,其生产原材料是作为中国传统香料和中药的八角中所含的一种重要成分莽草酸(分子式为C 7H 10O 5),据统计,全球90%有八角产于中国。
下列叙述中不正确的是 ( ) A.莽草酸的相对分子质量是174B.一个“达菲”分子中含有5种元素的58个原子C.莽草酸分子中C 、H 、O 三种元素的原子个数比为7:10:5D.莽草酸和“达菲”分子中所含氧元素的质量分数之比为5:84、常温下,若将一杯新制的浑浊的石灰水澄清,则下列有关推断错误的是 ( ) A 、上层是Ca(OH)2的饱和溶液B 、向烧杯中加一冰块后,烧杯底部的沉淀会增多C 、向烧杯内通入少量的CO 2,烧杯内的沉淀会增多D 、向烧杯内加入一定量的CaO ,溶质的质量分数会减小5、如图1所示的物品中,不是利用合成有机高分子材料制成的是( )A B C D图1 6、.如图2所示的装置操作图不能用于检查气密性的是 ( )图27、鉴别下列各组物质,括号中选用的试剂或方法,不合理的是( )A 、C 2H 5OH 和NaCl 溶液(闻气味)B 、NaOH 溶液和稀H 2SO 4(酚酞试液)考生姓 来源学校 考C、Ca(OH)2溶液和NaOH溶液(稀盐酸)D、KMnO4和KClO3(观察颜色)8、传统“陈醋”生产过程中有一步称为“冬捞夏晒”,是指冬天捞出醋中的冰,夏日曝晒蒸发醋中的水分,以提高醋的品质,假设用醋酸的质量分数为3﹪的半成醋,生产500g 5.4%的优级醋,过程中醋酸没有损失,捞出的冰和蒸发的水的总质量为()A、500gB、400gC、200gD、100g9、我校高2007级方源同学(已被保送读北大),力挫群雄、过关斩将,光荣地入选为国家化学奥赛集训队(全国仅4人),他将代表中国参加在俄罗斯举行的国际化学奥林匹克竞赛。
2009年普通高等学校招生全国统一考试全国卷Ⅱ理综化学部分

2009年普通高等学校招生全国统一考试(全国卷H)理科综合化学部分本试卷分第I卷(选择题)和第H卷(非选择题)两部分。
第I卷1至5页,第H卷6至14 页。
考试结束后,将本试卷和答题卡一并交回。
第I卷选择题共126分一、选择题(本题共13 小题,在每小题给出的四个选项中,只有一项是符合题目要求的。
)本卷共21 小题,每小题 6 分,共126分。
6.物质的量之比为2:5 的锌与稀硝酸反应,若硝酸被还原的产物为N2O ,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是A.1:4 B.1:5 C.2:3 D.2:57.下列关于溶液和胶体的叙述,正确的是A .溶液是电中性的,胶体是带电的B .通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动C.溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动D •一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有8.下列叙述中正确的是A •向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成。
B. 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na? CO3的物质的量之比为 1 :2.C. 等质量的NaHCO3和Na? CO3分别与足量盐酸反应,在同温同压下,生成的CO?体积相同D. 向Na2 CO3饱和溶液中通入CO?, 有NaHCO3结晶析出9.某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。
下列叙述中错误.的是A .它是副族元素B .它是第六周期元素C.它的原子核内有63个质子 D .它的一种同位素的核内有89个中子10.现有等浓度的下列溶液:①醋酸、②苯酚、③苯酚钠、④碳酸、⑤碳酸钠、⑥碳酸氢钠。
按溶液pH 由小到大排列正确的是B .④①②⑥⑤③C .①④②⑥③⑤D .①④②③⑥⑤11. 2H 2 (g ) +O 2 (g ) =2出0 (I )△ H=-571.6kJ mol -1 CH 4 (g ) +2O 2 (g ) = CO 2 (g )+ 2H 2O (I )△ H= -890kJ mol _1现有H 2与CH 4的混合气体112L (标准状况),使其完全燃烧生成 CO 2和H 2O (I ),若实验 测得反应放热3695KJ 。
绵阳东辰国际学校高一分班考试化学试题及答案

2017年绵阳东辰国际学校高一入学分班测试题化学(时间50分钟满分80分)亲爱的同学们:四川名优高中——绵阳东辰国际学校热烈欢迎你的到来,并由衷的为你即将“进一流高中,跟一流名师,创一流前途”而高兴!预祝你成功!可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Na-23Al-27一、选择题(每小题只有1个正确答案,共36分)1.对中国古代着作涉及化学的叙述,下列解读错误..的是()A.《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐B.《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2C.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3 D.《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油2.归纳是化学学习的重要方法之一,小明在以下的归纳中你认为不正确...的是()A.中和反应生成盐和水,但生成盐和水的反应不一定是中和反应B.分解反应就是一种物质生成两种或两种以上物质的反应C.合金是金属材料,所以合金都是由金属元素组成的D.酸溶液呈酸性,碱溶液呈碱性,盐溶液不一定呈中性3.分类法是化学学习的重要方法。
下列说法不正确...的是()A.HNO3、H2SO4、CH3COOH、HF都属于酸B.铁、锌、碘元素都属于人体必需微量元素C.单质是由同种元素组成的物质D.CO2、SO2、Mn2O7都是酸性氧化物4.下列离子方程式中不正确...的是()A.盐酸滴在石灰石上:CaCO3+2H+=Ca2++H2O+CO2↑B.少量CO2通入氢氧化钠溶液中:CO2+2OH-=CO32-+H2OC.NaOH溶液和NaHSO4溶液反应:H++OH-=H2OD.稀H2SO4滴在铁片上:2Fe+6H+=2Fe3++3H2↑5.下列实验中,能达到相应实验目的的是()A.鉴别稀HCl、NaOH和NaCl三种溶液:取样,分别滴入酚酞溶液后再相互混合B.制备Fe(OH)3:将Fe2(SO4)3溶液和适量的Ba(OH)2溶液混合,过滤C.除去NaNO3溶液中混有的少量Na2SO4:加入适量的BaCl2溶液,过滤D.分离CaCO3和CaCl2固体:取样,加足量水溶解,过滤6.将一定质量金属M的粉末放入盛有Cu(NO3)2溶液的烧杯中,充分反应后溶液呈无色;继续向烧杯中加入一定量的AgNO3溶液,待充分反应后过滤,得蓝色滤液和滤渣。
东辰中学高2010级招生考试化学试题及答案(2)[1]
![东辰中学高2010级招生考试化学试题及答案(2)[1]](https://img.taocdn.com/s3/m/4725632bed630b1c59eeb5d0.png)
绵阳东辰国际学校高一招生考试化学试题可能用到的相对原子质量:C-12 H-1 O-16 N-14 S-32 Cu-64 Ca-40一、选择题(每小题只有一个正确答案,38分)1、下列变化中属于化学变化的是( )A .浓盐酸在空气中敞口放置一段时间后,质量减少B .用活性炭吸附毒气C .工业上把石油分馏得到煤油、汽油、柴油等化工产品D .用煮沸的方法将硬水软化 2、吸烟有害健康,是因为香烟中含有尼古丁(C 10H 14N 2)等有害物质,下列有关尼古丁的说法正确的是( )A.尼古丁是有机物,所以有害健康B.尼古丁中碳、氢、氮元素的质量比为 10:14:2C.尼古丁的相对分子质量为 162D.尼古丁由10个碳原子、14个氢原子和2个氮原子构成 3、许多金属元素均是以化合物的形式存在于矿石中,只有经过冶炼方可获得金属单质,而越活泼的金属越难冶炼成功,冶炼活泼金属的技术比冶炼不活泼金属的技术高得多。
对于铝、铁、铜、金四种单质,你猜测发现和利用得最晚的是( )A. 铝B. 铁C. 铜D. 金4、我国计划在2007年发射一颗绕月探测卫星,其任务之一是寻找一种新能源氦3。
氦3原子核内有2个质子和1个中子。
下列有关氦3原子的说法正确的是( )A.氦3原子核外有2个电子层B.氦3原子在元素周期表中的原子序数是2C.氦3原子的相对原子质量为2D.氦3原子易失去2个电子 5、下列化学方程式符合事实且书写正确的是( ) A.铁和稀盐酸反应:2Fe+6HC1=2FeC13+3H 2 ↑B.用稀硫酸去洗附着在试管壁上的铜:Cu+H 2SO 4=CuSO 4+H 2↑C.某废液中含有盐酸,可用熟石灰处理:2HCl+Ca(OH)2=CaC12+2H 2OD.除去NaOH 中少量的Na 2CO 3:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑6、海水中含有MgC12、KC1、NaC1和MgSO 4 等多种 物质,根据如图1所示的溶解度曲线回答,下列说法 中不正确的是( )A. 海水晒盐,是利用阳光和风力,使水分蒸发,析出NaCl 晶体B. 将含有MgC12、KC1和NaC1三种物质的热溶液降温, 析出的晶体主要是MgC12和KC1的混合物C. 将海水在高于60℃的温度加热蒸发水分,析出的晶体主要是硫酸镁 图1D. 海水晒盐所得的食盐有少量MgC12、KC1,可用少量水洗涤即可得纯净食盐,实际生产用冷水洗涤比用热水效果更好。
高二入学考试(化学)试题含答案

高二入学考试(化学)(考试总分:100 分)一、 单选题 (本题共计20小题,总分60分)1.(3分)以下化学用语正确的是( )A.生石膏的化学式:CaSO 4·2H 2OB.明矾的化学式:KAlSO 4·12H 2OC.氨分子的结构式:D.NH 4H 的电子式:2.(3分)钓鱼岛的附近蕴藏着大量石油和天然气。
下列关于石油及石油炼制的叙述中,错误的是( )A.石油是多种碳氢化合物组成的混合物B.石油中含有含5~11个碳原子的烷烃,可以通过石油的常压分馏得到直馏汽油C.重油(20C 以上)经减压分馏可以得到煤油和柴油D.石油经分馏得到的各馏分主要是多种烃的混合物3.(3分)应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。
下列预测中正确的是( ) ①Be 的最高价氧化物的水化物可能具有两性②Tl(对应元素位于第IIIA 族)与盐酸和NaOH 溶液作用均能产生氢气 ③At(第VIIA 族元素)的单质为有色固体,AgAt 不溶于水也不溶于稀硝酸 ④Li 在氧气中剧烈燃烧,产物是22Li O ,其溶液是一种强碱溶液 ⑤4SrSO (Sr 位于第IIA 族)是难溶于水的白色固体 ⑥2H Se 是无色、有毒、比2H S 稳定的气体 A.①②③④ B.②④⑥ C.①③⑤ D.②④⑤4.(3分)下列说法不正确的是( )①N 2H 4分子中既含极性键又含非极性键②若R 2-和M +的电子层结构相同,则原子序数:R>M ③F 2、Cl 2、Br 2、I 2熔点随相对分子质量增大而升高 ④NCl 3、PCl 3、CO 2、CS 2分子中各原子均达到8e -稳定结构 ⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键 ⑥HF 分子很稳定是由于HF 分子之间能形成氢键 ⑦Na 2O 2固体中的阴离子和阳离子个数比是1:2 ⑧由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI A.②⑤⑥⑧B.①③④⑤C.②④⑤⑦D.③⑤⑦⑧5.(3分)化学与生活、社会发展息息相关,下列有关说法不正确的是( )A.在元素周期表的金属和非金属分界线附近寻找半导体材料B.“青蒿一握,以水二升溃,绞取汁”,对青蒿素的提取过程属于化学变化C.“霾尘积聚难见路人",雾霾所形成的气溶胶有丁达尔效应D.氢氧燃料电池是一种能量转换率较高、符合绿色化学理念的新型动力能源6.(3分)一定量的2CO 与量的碳在体积可变的恒压密闭容器中反应:C(s)+CO 2(g)2CO(g),平衡时体系中气体体积分数与温度的关系如图所示:已知:气体分压(p 分)=气体总压()p 总体积分数。
四川省绵阳市东辰国际学校高一化学下学期第一次月考试卷(含解析)

2015-2016学年四川省绵阳市东辰国际学校高一(下)第一次月考化学试卷一.选择题(每小题只有一个正确选项符合题意,每小题2分,共50分)1.现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理,②少用原煤做燃料,③燃煤时鼓入足量空气,④开发清洁能源.其中能减少酸雨产生的措施的是()A.①②③B.②③④C.①②④D.①③④2.对于下列事实的解释错误的是()A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应D.氨水可使酚酞试剂变为红色,说明氨水显碱性3.下列化学用语正确的是()A.N2的电子式:B.H2O2的电子式C.氨分子的结构式D.14C的原子结构示意图4.主族元素在周期表中的位置,取决于该元素的()A.最外层电子数和相对原子质量B.相对原子质量和核外电子数C.次外层电子数和电子层数D.电子层数和最外层电子数5.有六种微粒,它们分别是,,,,,,它们隶属元素的种类()A.2种B.3种C.4种D.5种6.816O、818O、O2﹣、O2、O是()A.氧元素的五种不同微粒 B.五种氧元素C.氧的五种同元素异形体 D.氧的五种同位素7.下列关于化学用语“NH4Cl”的意义,不正确的是()A.氯化铵分子中含有一个NH4+和一个Cl﹣B.氯化铵由N、H、Cl三种元素组成C.氯化铵晶体由NH4+和Cl﹣构成D.氯化铵晶体中阴、阳离子个数比为1:18.下列有关原子结构、元素性质的说法正确的是()A.Si、P、S、Cl元素的单质与氢气化合越来越容易B.元素原子最外层电子数越多,元素金属性越强C.元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族D.F﹣、O2﹣、Mg2+、Na+离子半径逐渐减小9.下列物质中不含非极性共价键的是:①Na2O2②CCl4③O2④NH4Cl ⑤H2O2⑥Ca(OH)2()A.①②③④ B.④⑤⑥C.②④⑥D.②③⑤10.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.图为N2(g)和O2(g)生成NO(g)过程中的能量变化下列说法中正确的是()A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJB.通常情况下,N2(g)和O2(g)混合能直接生成NOC.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水11.某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为()A.HX B.H2X C.XH3D.XH412.对于具有相同电子层结构的三种微粒:A n+、B n﹣、C,下列分析正确的是()A.原子半径:r a>r b>r cB.微粒半径:B n﹣>A n+C.C元素不一定是稀有气体元素D.原子序数:C>B>A13.将盛有NH4HCO3的试管加热,使放出的气体依次通过盛有足量Na2O2的干燥管,足量浓H2SO4的洗气瓶,最后得到的气体()A.NH3B.O2C.H2O D.CO214.3717Cl、3517Cl为不同的核素,N A为阿伏加德罗常数,下列说法正确的是()A.常温下,4.48L3717Cl2含有0.72N A个中子B.3717Cl、3517Cl互为同位素,3717Cl2、3517Cl2互为同素异形体C.通常情况下,氯气做氧化剂,但氯气也具有还原性D.3717Cl2的摩尔质量是7415.下列说法正确的是()A.化学反应中的能量变化都表现为热量的变化B.需要加热才能发生的反应一定是吸热反应C.放热反应在常温下一定很容易发生D.反应是吸热还是放热必须看反应物和生成物的总能量的大小16.运用元素周期律分析下面的推断,其中不正确的是()A.锂(Li)与水反应比钠与水反应剧烈B.砹(At)为有色固体,HAt极不稳定C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂D.HBrO4的酸性比HIO4的酸性强17.下列过程中,共价键被破坏的是()A.碘升华B.溴蒸气被木炭吸附C.蔗糖溶于水D.硫酸溶于水18.下列叙述正确的是()①非金属元素构成的物质的化学键都是共价键②两种不同非金属元素原子间形成的化学键都是极性键③金属元素构成的化合物里一定含有离子键④难失去电子的原子,易形成阴离子⑤单质分子中不存在化学键,化合物的分子才存在化学键⑥离子化合物中一定含有离子键.A.只有②⑥ B.只有①⑤⑥C.只有③⑥ D.只有①④⑥19.下列各组离子,在强碱性溶液中可以大量共存的是()A.Na+、Ba2+、Cl﹣、SO42﹣B.Na+、Ba2+、AlO2﹣、NO3﹣C.NH4+、K+、Cl﹣、NO3﹣D.Na+、K+、NO3﹣、SiO32﹣20.下列变化属于吸热反应的是()①液态水汽化②将胆矾加热变成白色粉末③浓硫酸稀释④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰.A.①④ B.②③ C.①④⑤D.②④21.A、B、C均为短周期元素,它们在周期表中的位置如图所示.已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍.则A、B、C分别是()A.C、Al、P B.N、Si、S C.0、P、Cl D.F、S、Ar22.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是()A.PCl3B.Cl2C.N2D.HBr23.下列叙述能肯定A金属比B金属活泼性强的是()A.A原子的最外层电子数比B原子的最外层电子数多B.A原子的电子层数比B原子的电子层数多C.1mol A从酸中置换出的氢比1mol B从酸中转换出的氢多D.常温下,A能从冷水中置换出氢,而B不能24.X、Y是短周期元素,两者组成化学式为X2Y2的化合物,已知X的原子序数为n,则Y的原子序数可能是()(1)n+3(2)n﹣3(3)n+5(4)n﹣5(5)n+11.A.(1)(2)(3) B.(2)(4) C.(1)(4)(5) D.全部25.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之积与L层的电子数相同.则下列判断不正确的是()A.氢化物的稳定性甲>乙>丙B.甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:丙<甲C.原子半径由大到小的顺序为:甲>乙D.乙元素的族序数比甲元素的族序数大二.填空题26.根据元素周期表1﹣18号元素的性质和递变规律,回答下列问题(按要求作答)(1)金属性最强的元素与非金属性最强的元素形成的化合物电子式为.(2)最高价氧化物对应水化物酸性最强的化学式(填化学式.)(3)单质既能与HCl反应,又能与NaOH反应的元素是(填元素符号).(4)推测Si、N最简单氰化物的稳定性最稳定的是.(填化学式)27.已知X、Y、Z、W四中元素是短周期元素,且原子序数依次增大,X、W同主族,Y、Z为短周期的相邻元素.W原子的质子数等于Y、Z原子的最外层电子数之和,Y和X形成的分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.试推断:(1)X、Z两种元素的元素符号为:X Z .(2)由以上元素两两形成的化合物中,溶于水显碱性的气态氢化物的结构式为,它的共价键属于(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为.(3)由X、Y、Z所形成的常见离子化合物是(写化学式).28.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.(1)M的离子结构示意图为;元素T在周期表中位于第族.(2)J和氢组成10电子的化合物,其结构式为,R、T的氢化物的稳定强的(填化学式)(3)R最高价氧化物对应的水化物的浓溶液在常温下与M发生现象,M和T的最高价氧化物对应的水化物反应的离子方程式为.三.实验室(每空2分,共16分)29.已知非金属单质硫(S)难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:(1)装置A的分液漏斗中盛装的试剂是,烧瓶中加入的试剂是.(2)装置D所加试剂的作用.(3)装置B中盛放的试剂是(选填下列所给试剂的代码),实验现象为,化学反应方程式是,该反应属于四种基本反映类型中的反应.A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液(4)从原子结构的角度简要分析氧元素的非金属性比硫元素的非金属性强的原因.四.计算题30.已知:6.4克铜与适量的浓硝酸反应,当铜完全溶解后,共收集到NO和NO2混合气体共2.24升(已折算为标准状况).求:(1)生成的NO2离子方程式,被还原的HNO3的物质的量(2)混合气体中NO L,NO2 L.2015-2016学年四川省绵阳市东辰国际学校高一(下)第一次月考化学试卷参考答案与试题解析一.选择题(每小题只有一个正确选项符合题意,每小题2分,共50分)1.现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理,②少用原煤做燃料,③燃煤时鼓入足量空气,④开发清洁能源.其中能减少酸雨产生的措施的是()A.①②③B.②③④C.①②④D.①③④【考点】常见的生活环境的污染及治理;二氧化硫的污染及治理.【分析】根据酸雨的形成分析,大气中的二氧化硫和二氧化氮溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨.【解答】解:二氧化硫和二氧化氮是形成酸雨的主要成分,所以只要减少二氧化硫和二氧化氮的生成就能减少酸雨的产生.①对燃烧煤时产生的尾气进行除硫处理,就能减少二氧化硫的排放,所以可以减少酸雨的产生;②原煤中含有硫、氮元素,少用原煤做燃料,就能减少二氧化硫的排放,所以可以减少酸雨的产生;③燃煤时鼓入足量空气,只能使燃料燃烧的充分,而不能减少二氧化硫和二氧化氮的排放,所以不能减少酸雨的产生;④开发清洁能源,能减少二氧化硫的排放,所以可以减少酸雨的产生;故选C.【点评】本题考查了减少酸雨的形成措施,难度不大,明确酸雨的成因是解本题的关键.2.对于下列事实的解释错误的是()A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应D.氨水可使酚酞试剂变为红色,说明氨水显碱性【考点】硝酸的化学性质;氨的化学性质;浓硫酸的性质.【分析】A、浓硫酸能按水的组成比脱去有机物中的氢、氧元素,即脱水性,据此分析;B、根据浓硝酸的不稳定性分析;C、根据铝与浓硝酸的钝化现象分析;D、根据酚酞的性质判断氨水溶液的酸碱性;【解答】解:A、浓硫酸能按水的组成比脱去蔗糖中的氢、氧元素,生成C,使蔗糖出现发黑现象,此现象证明浓硫酸具有脱水性,故A正确.B、浓硝酸在光照条件下分解生成二氧化氮、氧气和水,二氧化氮溶于硝酸使溶液呈黄色,故B正确.C、铝和浓硝酸反应生成一层致密的氧化物薄膜,阻止了进一步的反应,故C错误.D、使酚酞试液变红的物质是碱,氨水可使酚酞试剂变为红色,所以氨水呈碱性,故D正确.故选C.【点评】本题考查了元素化合物的性质,难度不大,需要注意的是钝化现象不是物质间不反应,而是物质间反应生成致密的氧化物薄膜,阻止了进一步的反应.3.下列化学用语正确的是()A.N2的电子式:B.H2O2的电子式C.氨分子的结构式D.14C的原子结构示意图【考点】电子式、化学式或化学符号及名称的综合;电子式;原子结构示意图;结构式.【分析】A.N原子满足8电子稳定结构,漏写N上的孤对电子;B.H2O2为共价化合物,不含离子;C.氨分子中只存在N﹣H共价键,为三角锥型;D.C的质子数为6.【解答】解:A.N原子满足8电子稳定结构,漏写N上的孤对电子,则电子式为,故A错误;B.H2O2为共价化合物,不含离子,分子中存在两个氧氢键和一个O﹣O键,其电子式为,故B错误;C.氨分子中只存在N﹣H共价键,为三角锥型,NH3的电子式为,结构式为,故C正确;D.C的质子数为6,14C的原子结构示意图为,故D错误;故选C.【点评】本题考查化学用语,涉及电子式、结构式及原子结构示意图等,为高频考点,把握化学用语的区别及规范使用为解答的关键,侧重分析与应用能力的考查,题目难度不大.4.主族元素在周期表中的位置,取决于该元素的()A.最外层电子数和相对原子质量B.相对原子质量和核外电子数C.次外层电子数和电子层数D.电子层数和最外层电子数【考点】元素周期表的结构及其应用.【分析】主族元素电子层数等于周期数,最外层电子数等于主族数,它们决定了主族元素在元素周期表中的位置.【解答】解:对主族元素而言,其电子层数就是该元素在元素周期表中的周期序数;其最外层上的电子数就是该元素在周期表中的族序数.由该元素在周期表中的周期和族决定元素的位置.故选:D.【点评】考查原子结构与位置关系,难度不大,注意基础知识的积累掌握.5.有六种微粒,它们分别是,,,,,,它们隶属元素的种类()A.2种B.3种C.4种D.5种【考点】元素;核素.【分析】具有相同核电荷数(即质子数)的同一类原子的总称叫元素;元素符号的左下角表示质子数,左上角表示质量数,质子数相同中子数不同的同一类原子互称同位素,据此分析判断.【解答】解:因为1940X、1940Q+的质子数相同,所以是同一元素,只是1940M是原子,1940Q+是带一个单位正电荷的离子;2040Y,,,质子数相同,所以是同一元素,只是2040Y,2040N是原子,2040K2+是带两个单位正电荷的离子;1840Z是质子数为18的元素;所以共有3种元素.故选B.【点评】本题考查了元素的定义,难度不大,注意元素概念的外延和内涵,由原子变成离子,变化的是核外电子数,不变的是核内质子数.6.816O、818O、O2﹣、O2、O是()A.氧元素的五种不同微粒 B.五种氧元素C.氧的五种同元素异形体 D.氧的五种同位素【考点】同位素及其应用;同素异形体.【分析】A.分子、原子、离子是构成物质的三种微粒;B.元素是具有相同核电荷数(质子数)的一类原子的总称;C.相同元素组成,不同形态的单质互为同素异形体;D.质子数相同,不同中子数的原子互为同位素.【解答】解:A.816O表示8个质子、8个中子的氧原子,818O表示8个质子、10个中子的氧原子,O2﹣表示得到2个电子带两个单位负电荷的氧离子,O2表示由两个氧原子构成的氧分子,O表示氧元素或1个氧原子,属于氧元素的五种不同微粒,故A正确;B.氧元素只有一种,它们属于氧元素的五种不同微粒,故B错误;C.同素异形体必须是单质,168O、188O属于原子,O2﹣属于离子,O2、O3属于单质,所以五种物质不能称为同素异形体,故C错误;D.同位素必须指原子,O2﹣是离子,O2、O3是单质,故D错误;故选A.【点评】本题考查元素、同位素、同素异形体的概念,题目难度不大.对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题,注意概念的要点.7.下列关于化学用语“NH4Cl”的意义,不正确的是()A.氯化铵分子中含有一个NH4+和一个Cl﹣B.氯化铵由N、H、Cl三种元素组成C.氯化铵晶体由NH4+和Cl﹣构成D.氯化铵晶体中阴、阳离子个数比为1:1【考点】不同晶体的结构微粒及微粒间作用力的区别.【分析】NH4Cl是由N、H、Cl三种元素形成的阳离子NH4+以及阴离子Cl﹣按照个数比为1:1构成的离子晶体,不存在分子.【解答】解:NH4Cl是由N、H、Cl三种元素形成的离子化合物,不存在分子,构成微粒为阳离子NH4+和阴离子Cl﹣,二者个数比为1:1.故A错误,B、C、D均正确.故选:A.【点评】本题考查了氯化铵的结构和组成问题,难度不大,明确氯化铵属于离子化合物,不存在单个的分子.8.下列有关原子结构、元素性质的说法正确的是()A.Si、P、S、Cl元素的单质与氢气化合越来越容易B.元素原子最外层电子数越多,元素金属性越强C.元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族D.F﹣、O2﹣、Mg2+、Na+离子半径逐渐减小【考点】物质的组成、结构和性质的关系;元素周期表的结构及其应用.【分析】A.同周期元素从左到右非金属性依次增强,非金属性越强与氢气化合越容易;B.元素原子最外层电子数越多,失去电子能力越弱;C.依据周期表中各族的位置关系解答;D.电子数相同,质子数越大,半径越小.【解答】解:A.Si、P、S、Cl为同周期元素非金属性依次增强,所以单质与氢气化合越来越容易,故A正确;B.元素原子最外层电子数越多,失去电子能力越弱,金属性越弱,故B错误;C.元素周期表共有18列,第3列是第ⅢB族,第17列是第ⅦA族,故C错误;D.O2﹣、F﹣、Mg2+、Na+离子具有相同的电子数,离子半径O2﹣、F﹣、Na+、Mg2+逐渐减小,故D 错误;故选:A.【点评】本题考查了物质的结构、元素性质,熟悉原子结构、元素周期表结构、元素性质的递变规律是解题关键,题目难度不大.9.下列物质中不含非极性共价键的是:①Na2O2②CCl4③O2④NH4Cl ⑤H2O2⑥Ca(OH)2()A.①②③④ B.④⑤⑥C.②④⑥D.②③⑤【考点】化学键.【分析】同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键,以此来解答.【解答】解:①Na2O2中钠离子和过氧根离子之间以离子键结合,过氧根离子中氧原子和氧原子之间以非极性共价键结合,故①错误;②CCl4中碳原子和氯原子之间以极性共价键结合,故②正确;③O2中O原子与O原子子之间以非极性共价键结合,故③错误;④NH4Cl中氯离子和铵根离子之间存在离子键,铵根离子中氮原子和氢原子之间存在极性共价键,故④正确;⑤H2O2中氢原子和氧原子之间以极性共价键结合,氧原子和氧原子之间以非极性共价键结合,故⑤错误;⑥Ca(OH)2中含有离子键和O﹣H极性键,故⑥正确.故选C.【点评】本题考查化学键,为高频考点,侧重于基本概念的考查,明确元素的类别及元素的成键是解答本题的关键,难度中等.10.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.图为N2(g)和O2(g)生成NO(g)过程中的能量变化下列说法中正确的是()A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJB.通常情况下,N2(g)和O2(g)混合能直接生成NOC.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水【考点】反应热和焓变.【分析】A.分析能量变化黑球代表氧原子,依据反应焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量计算判断;B.氮气和氧气在放电条件才能反应;C.依据A计算的焓变判断反应能量变化,结合反应前后能量守恒分析;D、一氧化氮不能和氢氧化钠反应.【解答】解:A.焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,则N2+O2═2NO的焓变△H=946kJ/mol+498kJ/mol﹣2×632kJ/mol=+180kJ/mol,该反应是吸热反应,故A错误;B.通常情况下,N2(g)和O2(g)混合不能直接生成NO,需要放电条件下反应,故B错误;C.由图中数据可得反应物键的断裂吸收(946+498)=1444kJ/mol的能量,生成物键的形成放出2×632=1264 kJ/mol的能量,故该反应是吸热反应,依据能量守恒,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故C正确;D、一氧化氮不能和氢氧化钠反应,不是酸性氧化物,故D错误;故选C.【点评】本题考查了反应热与焓变的计算,题目难度中等,明确热化学方程式中焓变与反应物、生成物总键能的关系为解答关键,注意掌握化学反应与能力变化的关系,试题培养了学生的分析能力及化学计算能力.11.某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为()A.HX B.H2X C.XH3D.XH4【考点】元素周期律和元素周期表的综合应用.【分析】某元素最高正价氧化物对应的水化物的化学式是H2XO4,则最高价为+6价,其最低价为﹣2价,以此来解答.【解答】解:由元素最高正价氧化物对应的水化物的化学式是H2XO4,则最高价为+6价,其最低价为+6﹣8=﹣2价,即元素的气态氢化物中的化合价为﹣2价,A、HX中X的化合价为﹣1价,故A不选;B、H2X中X的化合价为﹣2价,故B选;C、XH3中X的化合价为﹣3价,故C不选;D、XH4中X的化合价为﹣4价,故D不选;故选B.【点评】本题考查元素的化合价,明确化合物中正负化合价的代数和为0来计算最高正价,元素在氢化物中的化合价为最高正价﹣8是解答本题的关键,难度不大.12.对于具有相同电子层结构的三种微粒:A n+、B n﹣、C,下列分析正确的是()A.原子半径:r a>r b>r cB.微粒半径:B n﹣>A n+C.C元素不一定是稀有气体元素D.原子序数:C>B>A【考点】原子结构与元素周期律的关系.【分析】A n+、B n﹣、C具有相同的电子层结构,则C原子一定具有稳定结构,即为稀有气体元素中的一种,由A n+、B n﹣的电子层结构再转化为原子结构可知,A必定在C(即稀有气体)的后面,B必定在C的前面〔称为“阴前阳下”(第一周期除外)〕,故A、B、C的原子序数关系为A>C>B,以此解答该题.【解答】解:A、B、C为同一周期的元素,同周期原子半径从左到右逐渐减小,但C为稀有气体元素,其原子半径一般大于同周期的ⅤⅡA族非金属元素,而与其它非金属元素的原子半径不确定,故A错误;B、因A n+、B n﹣具有相同的电子层结构,核电荷数越大半径越小,阴离子半径大于阳离子半径,即B n﹣>A n+,故B正确;C、A n+、B n﹣都应具有稀有气体的电子层结构,C的电子层结构相同于A n+、B n﹣,所以C必为稀有气体元素的原子,故C错误;D、设C的原子序数为Z,则A的原子序数为Z+n,B的原子序数则为Z﹣n,则原子序数为A >C>B,故D错误;故选B.【点评】本题考查原子结构与元素周期律,为高频考点,此类题目首先要根据题给信息,确定各元素在周期表中的相对位置,然后根据元素周期律加以对照,题目难度不大.13.将盛有NH4HCO3的试管加热,使放出的气体依次通过盛有足量Na2O2的干燥管,足量浓H2SO4的洗气瓶,最后得到的气体()A.NH3B.O2C.H2O D.CO2【考点】钠的重要化合物.【分析】发生反应NH4HCO3NH3↑+H2O+CO2↑,过氧化钠与二氧化碳、水反应生成氧气,浓硫酸可以吸收氨气,据此解答.【解答】解:发生反应NH4HCO3NH3↑+H2O+CO2↑,放出的气体通过盛有足量过氧化钠的干燥管,过氧化钠与二氧化碳、水反应生成氧气,从盛放过氧化钠的干燥管出来气体为氨气、氧气,在通过足量浓H2SO4的洗气瓶,浓硫酸稀释氨气,最后得到的气体为氧气,故选B.【点评】本题考查铵盐与过氧化钠等性质、物质推断等,难度不大,掌握物质的性质是关键.14.3717Cl、3517Cl为不同的核素,N A为阿伏加德罗常数,下列说法正确的是()A.常温下,4.48L3717Cl2含有0.72N A个中子B.3717Cl、3517Cl互为同位素,3717Cl2、3517Cl2互为同素异形体C.通常情况下,氯气做氧化剂,但氯气也具有还原性D.3717Cl2的摩尔质量是74【考点】阿伏加德罗常数.【分析】A.常温下,不能使用标准状况下的气体摩尔体积计算;B.3717Cl2、3517Cl2都是氯气,不属于同素异形体;C.氯气是常见的氧化剂,但是氯气也具有还原性;D.摩尔质量的单位为g/mol.【解答】解:A.不是标准状况下,不能使用标准状况下的气体摩尔体积计算氯气的物质的量,故A错误;B.同素异形体为同种元素形成的不同单质,而3717Cl2、3517Cl2都是氯气,不属于同素异形体,故B错误;C.一般情况下,氯气为常见的氧化剂,但是氯气与氢氧化钠溶液反应时,氯气也具有还原性,故C正确;D.3717Cl2的摩尔质量是74g/mol,故D错误;故选C.【点评】本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.15.下列说法正确的是()A.化学反应中的能量变化都表现为热量的变化B.需要加热才能发生的反应一定是吸热反应C.放热反应在常温下一定很容易发生D.反应是吸热还是放热必须看反应物和生成物的总能量的大小【考点】反应热和焓变.【分析】A.化学反应能量变化有热能、光能、电能、机械能等多种;B.吸热反应不一定加热才能进行;C.有些放热反应需要加热才能进行;D.从能量守恒的角度判断.【解答】解:A.化学反应中的能量变化可表现为热能、光能、电能、机械能等多种,故A 错误;B.需要加热才能发生的反应可能为放热反应,如铝热反应等,故B错误;C.有些放热反应需要加热才能进行,如铝热反应,故C错误;D.反应物总能量大于生成物总能量,则反应放热,反之吸热,故D正确.故选D.【点评】本题考查反应热与能量变化,题目难度不大,注意能量的表现形式以及常见吸热反应、放热反应.16.运用元素周期律分析下面的推断,其中不正确的是()A.锂(Li)与水反应比钠与水反应剧烈B.砹(At)为有色固体,HAt极不稳定C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂D.HBrO4的酸性比HIO4的酸性强。
2009年全国普通高等学校招生统一考试 上海 化学试卷 (WORD版,含答案)2009年全国普通高等

2009年全国普通高等学校招生统一考试上海化学试卷后二位校验码号码本试卷分为第I卷(第1—4页)和第II卷(第5—10页)两部分。
全卷共10页。
满分150分,考试时间120分钟。
第Ⅰ卷(共66分)考生注意:1. 答第I卷前,考生务必在答题卡上用钢笔或圆珠笔清楚填写姓名、准考证号、校验码,并用2B铅笔正确涂写准考证号和校验码。
2. 第I卷(1—22小题),由机器阅卷,答案必须全部涂写在答题卡上。
考生应将代表正确答案的小方格用2B铅笔涂黑。
注意答题纸编号与试题编号一一对应,不能错位。
答案需要更改时,必须将原选项用橡皮擦去,重新选择。
答案不能涂写在试卷上,涂写在试卷上一律不得分。
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 V-51 Cr-52Mn-55 Fe-56 Cu-64一、选择题(本题共10分,每小题2分,只有一个正确选项,答案涂写在答题卡上。
)①幕布的着火点升高②幕布的质量增加③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气 A. ①②B. ③④C. ①③D. ②④5. 下列对化学反应的认识错误的是 A. 会引起化学键的变化 B. 会产生新的物质C. 必然引起物质状态的变化D. 必然伴随着能量的变化7. 在下列变化: ①大气固氮;②硝酸银分解;③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是 A. ①②③ B. ②①③ C. 8. A. 熔点: CO 2 > KCl > SiO 2 B.C. 沸点: 乙烷 > 戊烷 > 丁烷D. 9. 结构如右图。
下列叙述正确的是 A. 迷迭香酸属于芳香烃B. 1 mol 迷迭香酸最多能和9 molC. 迷迭香酸可以发生水解反应、D. 1 mol 迷迭香酸最多能和含5 mol NaOH10. 9.2 g 金属钠投入到足量的重水中,A. 0.2 mol 中子B. 0.4 mol 电子 11. 1–度为115~125 ºC A. 不能用水浴加热B. 长玻璃管起冷凝回流作用C. D. 加入过量乙酸可以提高1–丁醇的转化率12. N A 代表阿伏加德罗常数。
高中招生考试成绩及录取名单
陈科佑 杜玮旗 胡文奇 胡杜静 韩文爽 伍鹏霖 彭豪 陈南西 昝亚洲 陈潇舒 邓玥 卿于蓝 彭欣月 邹爽 蒲昊天 蒲瑶 陶香君 唐娟 何讯 涂阳 甘雨禾 唐甫 孙浩然 何林潞 冯一辉 姚星 魏成一然 唐溢 唐唯峰 张冬垚 青炼 任锦林 柯春平 罗佳林 胡倩 张翼 廖雪龙 陈奕成 任磊 屈诗云 朱航 文康 易小童
文山 南溪 南溪 江安 珙县 珙县 珙县 珙县 高县 高县 翠屏 翠屏 翠屏 翠屏 翠屏
大同中 一中 南溪一中 宜宾江安中学 珙县中学 珙中 巡场中学 英才实验学校 柳瑚中学 高县文江中学 外国语 外国语 绵阳外国语 宜宾二中 宜宾八中
S100922 S101052 S100011 S100075 S100787 S101045 S100836 S100710 S100547 S101144 S100598 S100597 S101060 S101140 S101143 S100718 S101070 S101098 S100092 S100230 S100228 S100614 S100558 S100797 S100551 S100615 S100589 S100965 S100964 S101108 S100719 S100369 S100036 S100482 S100521
内江 乐至 乐至 乐至 乐至 乐文 简阳 简阳 简阳 简阳 简阳 简阳 简阳 简阳 简阳 东至 东至 东至 东至 东至 东至 东至 东至
外国语 简阳三岔初中 简阳城南义务教育校 简阳施家九年义务教育校 简阳中学 简阳三岔初中 简阳施家九年义务教育校 云龙职中 简阳施家九年义务教育校 三岔初中 外国语 外国语 仲良中学 实验中学 外国语 外国语 外国语 实验中学
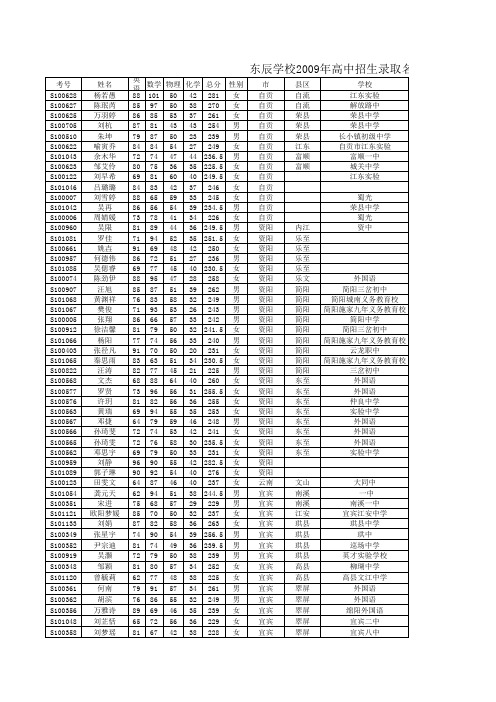
东辰学校2009年高中招生录取名单
考号 S100628 S100627 S100625 S100705 S100510 S100622 S101043 S100623 S100122 S101046 S100007 S101042 S100006 S100960 S101081 S100661 S100957 S101085 S100074 S100907 S101068 S101067 S100005 S100912 S101066 S100403 S101065 S100822 S100568 S100577 S100576 S100563 S100567 S100566 S100565 S100562 S100959 S101089 S100123 S101054 S100351 S101121 S101133 S100349 S100352 S100919 S100348 S101120 S100361 S100362 S100356 S101048 S100358 姓名 杨若愚 陈珉芮 万羽婷 刘杭 朱坤 喻寅乔 余木华 邹艾伶 刘早希 吕璐璐 刘雪婷 吴再 周婧媛 吴限 罗佳 姚壵 何德伟 吴偲睿 陈劲伊 汪旭 黄渊祥 樊俊 张翔 徐洁馨 杨阳 张径凡 秦思雨 汪涛 文杰 罗贤 许玥 黄瑞 邓捷 孙琦斐 孙琦雯 邓思宇 刘静 郭子琳 田雯文 龚元天 宋进 欧阳梦媛 刘娟 张星宇 尹宗迪 吴灏 邹颖 曾毓莉 何南 胡滨 万雅诗 刘芷恬 刘梦瑶 英语 88 85 86 87 79 84 72 80 69 84 88 86 73 81 71 91 86 69 88 85 76 71 86 81 77 91 83 82 68 73 81 69 64 72 72 69 96 90 64 62 75 85 87 74 81 72 81 62 79 76 89 65 81 数学 物理 化学 总分 性别 101 50 42 281 女 97 50 38 270 女 85 53 37 261 女 81 43 43 254 男 87 50 23 239 男 84 54 27 249 女 74 47 44 236.5 男 75 36 35 225.5 女 81 60 40 249.5 女 83 42 37 246 女 65 59 33 245 女 56 54 39 234.5 男 78 41 34 226 女 89 44 36 249.5 男 94 52 35 251.5 女 69 48 42 250 女 72 51 27 236 男 77 45 40 230.5 女 95 47 28 258 女 87 51 39 262 男 83 58 32 249 男 93 53 26 243 男 66 57 33 242 男 79 50 32 241.5 女 74 56 33 240 男 70 50 20 231 女 63 51 34 230.5 女 77 45 21 225 男 88 64 40 260 女 96 56 31 255.5 女 82 56 36 255 女 94 55 35 253 女 79 59 46 248 男 74 53 42 241 女 76 58 30 235.5 女 79 50 33 231 女 90 55 42 282.5 女 92 54 40 276 女 87 46 40 237 女 94 51 38 244.5 男 68 57 29 229 男 70 50 32 237 女 82 58 36 263 女 90 54 39 256.5 男 74 49 36 239.5 男 79 50 38 239 男 80 57 34 252 女 77 48 38 225 女 91 57 34 261 男 86 55 32 249 男 69 46 35 239 女 72 56 36 229 女 67 42 38 228 女 市 自贡 自贡 自贡 自贡 自贡 自贡 自贡 自贡 自贡 自贡 自贡 自贡 自贡 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 资阳 云南 宜宾 宜宾 宜宾 宜宾 宜宾 宜宾 宜宾 宜宾 宜宾 宜宾 宜宾 宜宾 宜宾 宜宾 县区 自流 自流 荣县 荣县 荣县 江东 富顺 富顺 学校 江东实验 解放路中 荣县中学 荣县中学 长小镇初级中学 自贡市江东实验 富顺一中 城关中学 江东实验 蜀光 荣县中学 蜀光 资中
09年山东卷化学答案.doc

【答案】B【解析】合金是两种或两种以上的金属或金属与非金属熔合而成的,A正确;光导纤维主要成分是SiOz ,属于无机物,B错误;加热会使蛋白质发生变性,C正确;在机动车排气管上加装"催化转化器”能将有毒的CO和NO转化为无毒的CO?和Nz, D正确。
【考点分析】化学基本概念、化学与生活、化学与社会的综合考查。
【答案】C【解析】CL中的氯元素化合价为0处于中间价态,既有氧化性又有还原性,A错误;同位素原子的质子数和电子数分别相等,所以化学性质几乎完全相同,B错误;通过实验室制得的CL中含有少量HC1, CL在饱和食盐水中溶解度很小,而HC1,易溶,C正确;没有指明气体所处状态,D错误。
【考点分析】考查基本概念、基本理论、实验室制法等【答案】B【解析】处于元素周期表金属与非金属分界线附近的元素,既表现金属性,又表现非金属性, A 错误;主族元素的最高正化合价等于它所处的主族序数,也等于其最外层电子数,B正确; H*的最外层电子分别是0, C项错误;同一主族的元素的原子最外层电子数虽相同,但是核电荷数、原子半径不同,化学性质不完全相同学,D错误。
【考点分析】物质结构、元素周期律的综合考查。
【答案】D【解析】CC1,可由CH,和氯气光照取代制得,可萃取碘水中的碘,A正确;石油和天然气的主要成分都是炷,B正确;向乙醇、乙酸和乙酸乙酯分别加入饱和N&CO,溶液分别现象为:互溶;有气泡产生;溶液分层,可以鉴别,C正确;苯虽不能使KMnO,溶液褪色,但可以燃烧,能发生氧化反应,D错误。
【考点分析】有机物的性质、基本反应类型、有机物鉴别的综合考查【答案】A【解析】KAI (S04) 2 • 12足0电离出的A1"能水解,生成Al (0H) 3胶体,可用作净水剂,A 正确;金刚石能够与氧气发生反应,生成二氧化碳,B错误;浓压SO,有强氧化性,在加热条件下与Cu可剧烈反应,C错误;SO?使品红溶液褪色,加热颜色能复原;S0?和漠水发生氧化还原反应,加热不能恢复原来颜色,D错误。
东辰高中考试化学题

绵阳东辰国际学校高中招生化学测试题(满分:60分, 时间:40 分钟)欢迎来到中国科技城、绵阳东辰国际学校——四川高中前三强。
为你将“进入一流高中、跟随一流名师、创造一流前程”而感到高兴。
祝你考试成功!可能用到的相对原子质量:H —1 O —16 Cl —35.5 Fe —56 Zn —65 K —39 Mn —55 一、选择题:(每小题3分,共27分。
每小题只有一个最佳选项符合题意)1.人类只有一个地球,为了社会的可持续发展,必须解决环境保护问题,化学在这方面可以发挥重要作用。
下列处理不符合这一思想的是( )A .增加污水处理工厂B .垃圾的分类回收和处理C .向燃煤中加生石灰固硫D .使用含Na 3PO 4的洗衣粉 2.通过下列实验得出的结论,其中正确的是( )①既可说明甲烷具有可燃性,又说明了甲烷是由氢元素和碳元素组成②既可说明二氧化碳的密度比空气大,又说明了二氧化碳不能燃烧也不支持燃烧 ③既说明水电解产生的氢气和氧气的体积比为2:1,又说明是由氢元素、氧元素组成的 ④既可探究可燃物的燃烧条件,又说明了白磷的着火点比红磷低 ⑤既可说明二氧化碳易溶于水,又说明了二氧化碳具有酸性 A .①②③④ B .②③④⑤ C .②③④ D .①②③④⑤ 34 A .水、硝酸银溶液、稀硝酸B .水、氢氧化钠溶液C .水、氢氧化钾溶液、稀盐酸D .水、氢氧化钠溶液、稀盐酸干冷烧杯 源 省 市 县 学校 联系电话 姓名 考号5.NaNO2(亚硝酸钠)、NaCl和物质M (不含结晶水)的溶解度曲线如右图1所示,下列有关说法正确的是()A.t2 ℃时,NaNO2、NaCl和M的溶解度由大到小的顺序是NaNO2> M > NaClB.如图2示,当往试管中加入5mL稀盐酸时,发现烧杯中饱和溶液变浑浊(不考虑水分蒸发)。
则该饱和溶液中的溶质是MC.分别将NaNO2、NaCl和M的饱和溶液图1 图2从t2℃降温到t1℃时,三种溶液中溶质的质量分数由大到小的顺序是NaNO2>NaCl=M D.为了区别NaNO2、NaCl固体,可以在20℃时分别取NaNO2、NaCl各10.0g于两只小烧杯中,分别加入10mL水(水的密度近似看作1g/cm3),用玻璃棒充分搅拌后,通过观察到现象区分6.已知许多盐如CaCl2、NaCl等物质的水溶液呈中性。
09年高二理科化学下册开学考试题

高二理科化学下册开学考试题高二化学(理科)试卷2月11日说明:1.试卷分第I卷(选择题)和第II卷(非选择题)两部分,将第I卷每小题答案涂在答题卡上,将第II卷各题的答案直接答在答题卷的相应位置上。
2.考试时间90分钟,满分100分。
考试结束只交答题卷。
3.可能需要的相对原子质量H 1,C 12,N 14,O 16, Cu 64 Fe 56第I卷选择题(48分)一、选择题(单选,每题3分,共48分)1. 下列有关说法不正确的是()A.在空气中,纯铁比含碳量较高的生铁腐蚀快B.用明矾净水是因为Al3+水解生成的胶状Al(OH)3具有很强的吸附性C.除去镁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤D.冶金工业可以利用铝热反应原理冶炼钒、铬、锰等金属2. 某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,则()A.分子中C、H、O个数之比为1:2:3 B.分子中C、H个数之比为1:2C.分子中可能含有氧原子 D.此有机物的最简式为CH43.用酚酞作指示剂,以0.100 mol·L-1的NaOH溶液测定装在锥形瓶中的一定体积的盐酸溶液的物质的量浓度。
下列操作将导致测定值高于实际值的是()A.标准液在“0”刻度线以上,未予调整就开始滴定B.碱式滴定管用蒸馏水洗涤后未用标准NaOH溶液润洗C.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视D.酚酞指示剂由无色变为红色时立即停止滴定4.对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是()A.加适量的醋酸钠晶体后,两溶液的pH均增大B.使温度都升高20℃后,两溶液的pH均不变C.加水稀释2倍后,两溶液的pH均减小D.加足量的锌充分反应后,两溶液中产生的氢气一样多5. 列离子方程式中,属于水解反应的是()A.CH3COOH+H2O CH3COO-+H3O+B.CO2+H2O HCO3-+H+C.CO32-+H2O HCO3-+OH-D.HS-+H2O S2-+H3O+6.下列各组物质中,一定互为同系物的是()A. CH CH CH CH CH3332和=B.CH CH CH CH C CCH3233=≡和C. C H C H 2448和D. CH C H 438和7.可逆反应:m A (s)+nB (g)eC (g)+fD (g),在反应过程中,当其它条件不变时,C 的百分含量(C %)与温度(T )和压强(P )的关系如下图所示。
09届高三化学入学考试理科综合试题

09届高三化学入学考试理科综合试题化学试题6、下列说法正确的是A、蛋白质属于天然高分子化合物,组成元素只有C、H、O、NB、用浓Na2SO4、CuSO4溶液或浓HNO3溶液使蛋清液发生盐析,进而分离提纯蛋白质C、蛋白酶是蛋白质,它不仅可以催化蛋白质的水解反应,还可以催化淀粉的水解反应D、甘氨酸(H2N-CH2-COOH)既有酸性,又有碱性,是最简单的氨基酸7、下列有关物质分类或归类正确的是①混合物:盐酸、漂白粉、水玻璃、水银②化合物:CaCl2、NaOH、HCl、HD③电解质:明矾、石膏、冰醋酸、石炭酸④同素异形体:C60、C70、金刚石、石墨⑤同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2⑥同分异构体:乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯A、①③④B、②③④C、③④D、②④⑥8、等质量的三份锌a、b和c,分别加入稀H2SO4中,a中同时加入适量CuSO4溶液,c 中加入适量CH3COONa。
下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中可能正确的是9.室温时,下列混合溶液的pH一定小于7的是A.pH=3的盐酸和pH=11的氨水等体积混合B.pH=3的盐酸和pH=11的氢氧化钡等体积混合C.pH=3的醋酸和pH=11的氢氧化钡等体积混合D.pH=3的硫酸和pH=11的氨水等体积混合10.右上图是恒温下某反应的反应速率随时间变化示意图。
下列叙述与图不相符合的是A .反应达平衡时,正反应速率和逆反应速率相等B .该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态ⅡC .该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态ⅡD .同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等11.在盛有稀H 2SO 4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是A .正极附近的SO 42—离子浓度逐渐增大B .电子通过导线由铜片流向锌片C .正极有O 2逸出D .铜片上有H 2逸出12.在一定条件下,将钠与氧气反应的生成物1.5g 溶于水,所得溶液恰好能被80mL 浓度为0.5mol/L 的HCl 溶液中和,则生成物的成分是A .Na 2OB .Na 2O 2C .Na 2O 和Na 2O 2D .Na 2O 2和NaO 2 13.下列物质之间的相互转化不符合(“→”表示一步反应)的是26. 水煤气(主要成分:CO 、H 2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s) + H 2O(g)CO (g) + H 2 (g);△H = +131.3kJ•mol -1(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。
四川绵阳东辰国际学校人教版高中化学选修1-第2章填空题专项复习题(培优练)

一、填空题1.(1)对于下列反应:2SO2 + O22SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为___________,用O2浓度变化来表示的反应速率为___________。
如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为___________。
(2)如图表示在密闭容器中反应:2SO2+O22SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是__________;b c过程中改变的条件可能是__________;若增大压强时,反应速度变化情况画在cd处__________。
答案:2mol/(L•min)1mol/(L•min)2mol/L升高温度减小SO3浓度【详解】(1)2min内SO2的浓度由6mol/L下降为2mol/L,二氧化硫的反应速率为:v(SO2)=6mol/L-2mol/L2min=2mol/(L•min),用O2浓度变化来表示的反应速率为:v(O2)=12×2mol/(L•min)=1mol/(L•min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L•min),二氧化硫的反应速率为:v(SO2)=2v(O2)=2×0.5mol/(L•min)=1mol/(L•min),反应消耗的二氧化硫的物质的量浓度为:c(SO2)=1mol/(L•min)×2min=2mol/L,则2min时SO2的浓度为:4mol/L-2mol/L=2mol/L,故答案为:2mol/(L•min);1mol/(L•min);2mol/L;(2)a时刻逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b 时刻正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的浓度;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为:。
2009年高中阶段教育学校统一招生考试模拟试卷(东辰)

2009年高中阶段教育学校统一招生考试化学模拟试卷(一)(满分100分,考试时间90分钟)命题:绵阳东辰学校化学组彭敬国第Ⅰ卷(选择题,共40分)可能用到的相对原子质量:H—1 O—16 N—14 Fe—56 C—12 S—32 Ca— 40 Zn—65一.选择题(本题包括20个小题,每小题2分,共40分。
每小题只有一个选项符合题意)1.下列有关说法中不正确的是( D )A.侯德榜为纯碱和氮肥工业技术的发展做出了杰出的贡献B.门捷列夫发现了元素周期律和元素周期表,使化学学习和研究有规律可循C.道尔顿和阿伏加德罗通过研究,得出了物质是由分子和原子构成的重要结论。
D.拉瓦锡为相对原子质量的测定做出了卓越的贡献2.有下列变化,其中不属于化学变化的是( D )A.自然界中石笋、钟乳石、溶洞等喀斯特地貌的形成B.用乙烯作原料,制取聚乙烯塑料C.在生铁中加入铬、镍等金属,融合成具有优良的抗腐蚀性能的合金D.日常生活中把青菜腌制成酸菜3.亚硝酸钠(NaNO2)是一种工业用盐,有较强的毒性,人食用0.2克到0.5克就可能出现中毒症状,如果一次性误食3 克,就可能造成死亡。
饮水机中的水反复沸腾、锅炉中水长时间沸腾等,都会产生亚硝酸钠,因此不能饮用。
则亚硝酸钠中氮元素的化合价是(B)A.+2B.+3C.+4D.+54.物质的性质决定其用途,有下列物质及其用途:①氩气和氮气作灯泡的保护气;②用铝做炊具;③用氧气作助燃剂;④在大棚中常施用二氧化碳做气肥;⑤用花岗岩铺地面。
以上用途中主要是利用了其物理性质的是(C )A.①②③④B.①③⑤C.②⑤D.②④⑤5.下列物质不属于碱的是(D)A.烧碱B.消石灰C.氨水D.纯碱6.往硝酸铜、硝酸镁和硝酸银的混合物溶液中加入过量的金属铁粉,充分反应后溶液中含有的大量的金属离子是(C)A.Cu2+、Mg2+、Ag+B.Cu2+、Mg2+、Fe2+C.Mg2+、Fe2+D. Mg2+、Fe2+、Ag+7.下列说法中,正确的是(A)A.在化学反应前后,催化剂的质量和化学性质都不变B.通常所说的“煤气中毒”就是指一氧化碳和二氧化碳中毒C.淬火后的缝衣钢针可以做钓鱼钩D.“白色污染”是指塑料和白色烟尘所形成的污染8.下列化学方程式符合事实且书写正确的是(C)A.铁和稀盐酸反应:2Fe+6HC1=2FeC13+3H2 ↑B.用稀硫酸去洗附着在试管壁上的铜:Cu+H2SO4=CuSO4+H2↑C.某废液中含有盐酸,可用熟石灰处理:2HCl+Ca(OH)2=CaC12+2H2OD.除去NaOH中少量的Na2CO3:Na2CO3+2HCl=2NaCl+H2O+CO2↑9.下列实验操作正确的是(D )10.下列有关说法中正确的是(D )A.元素周期表中共有7个周期、18个族B.每个周期开头的元素都是金属元素C.钾钙钠镁都是人体需要的微量元素,在周期表中居于左方D.原子序数与元素原子核电荷数在数值上相同11.如图所示是硝酸钾和氯化钠的溶解度曲线,下列叙述中不正确...的是( A ) A.在t 1℃ KNO 3的溶解度是20B.在t 2℃ KNO 3和NaCl 的溶解度相等C.当温度大于t 2℃时,KNO 3的溶解度大于NaCl 的溶解度D.可用降温的方法把接近饱和的KNO 3溶液变为饱和溶液12.下列有关实验现象的描述正确的是(B )A.硫在空气中燃烧,火焰呈蓝紫色B.向石灰水中滴入酚酞,溶液由无色变红C.塑料吸管放在试管中加热,会逐渐融熔化,冷却后会变成固体,再加热不会熔化D.将生锈的铁钉放入盛有稀盐酸的烧杯中,铁锈消失,溶液逐渐变成浅绿色13.下列粒子结构示意图中,属于阳离子的是( D )14.下列有关能源的叙述中不正确的是( D )A.天然气是比较清洁的化石燃料 ,海底的“可燃冰”有望成为未来的新型能源B.使用车用乙醇汽油既可不耗石油资源,还可促进农业生产C.煤燃烧会产生大量的有害气体,如二氧化硫、二氧化氮,会形成酸雨D.石油可以燃烧,在工厂也经常使用它作燃料15.欲将粗盐提纯,并用制得的精盐配制质量分数一定的氯化钠溶液。
高中招生化学试题及答案

高中招生化学试题及答案一、选择题(每题3分,共30分)1. 下列物质中,属于纯净物的是:A. 矿泉水B. 蒸馏水C. 空气D. 盐水2. 化学反应中,质量守恒定律指的是:A. 反应前后原子的种类不变B. 反应前后原子的数目不变C. 反应前后物质的总质量不变D. 反应前后元素的种类不变3. 以下哪种物质是单质?A. 氧气B. 二氧化碳C. 氯化钠D. 氢氧化钠4. 根据化学方程式计算,若要制取4g氢气,需要锌的质量至少为:A. 65gB. 32.5gC. 16gD. 8g5. 以下哪种物质在常温下是液体?A. 铁C. 氮气D. 水6. 根据酸碱中和反应的规律,以下哪种物质是酸?A. 氢氧化钠B. 碳酸钠C. 硫酸D. 氯化钠7. 根据元素周期表,下列元素中属于金属元素的是:A. 碳B. 氧C. 钠D. 硫8. 以下哪种物质是化合物?A. 氢气B. 氧气C. 氮气D. 水9. 根据化学方程式,以下反应属于氧化还原反应的是:A. 碳酸钙分解B. 铁与盐酸反应C. 碳酸钠与盐酸反应D. 氢氧化钠与盐酸反应10. 以下哪种物质是碱?A. 硫酸B. 氢氧化钠D. 碳酸钠二、填空题(每题4分,共20分)1. 化学方程式2H2 + O2 → 2H2O表示的意义是:______。
2. 根据元素周期表,第IA族元素的原子最外层电子数为______。
3. 铁在氧气中燃烧生成的化合物是______。
4. 化学反应中,若反应物的总能量大于生成物的总能量,则该反应是______反应。
5. 根据化学方程式,若要制取2mol的二氧化碳,需要碳酸钙的质量至少为______。
三、简答题(每题10分,共20分)1. 描述铁在氧气中燃烧的实验现象,并写出相应的化学方程式。
2. 解释为什么说水是生命之源,并简述水的化学性质。
四、计算题(每题15分,共30分)1. 已知某化学反应方程式为:2A + B → 3C,若反应物A的摩尔质量为32g/mol,B的摩尔质量为64g/mol,生成物C的摩尔质量为40g/mol。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2009年化学试题
考试时间:30分钟总分:50分
姓名:考号:
特别提示,请将选择题的答案填写在第Ⅱ卷相应的表格里!
可能用到的相对原子质量:
C—12 H—1 O—16 N—14 Na—23 Mg—24 Ca—40 C1—35.5
一、选择题:(每小题只有一个最佳选项符合题意,共20分)
1、下列所述的工业生产过程中主要发生物理变化的是()
A 转炉炼钢B发酵生产沼气 C 石油蒸馏 D 高炉炼铁
2、莫尔盐,浅蓝绿色结晶,可用做织物染色的媒染剂,化学分析试剂,还可用于印刷,电镀等。
其化学式为(NH4)2 Fe(SO4)2·6H2O则铁元素的化合价为()
A 0 B+1 C +2 D+3
3、下列物质都是我们日常生活所接触的,其中属于纯净物的是()
A医用消毒酒精B可燃冰 C 天然气D高锰酸钾
4、下列各组溶液,不使用其他试剂,就能一一鉴别的是()
① NaOH , FeCl3, MgCl2, Na2SO4
②HCl, BaCl2, KCl, Na2CO3
③KNO3, NaCl, AgNO3, CaCl2
④H2SO4, Na2CO3, BaCl2
A①②B③④C①②④D①②③④
5、目前化学家可合成新元素,他们计划用质子数为20的钙离子,轰击核电荷数为98的锎(音:Kāi)元素靶,使两元素的原子核合并在一起,合成核电荷数为118的新元素。
对此理解正确的是()
A 核电荷数为118的元素的原子核内质子数为116
B核电荷数为118的元素的原子核内质子数为118
C核电荷数为118的元素的原子的相对原子质量为118
D变化过程中元素种类没有发生改变
6、金属元素在自然界中可以以游离态(单质形式)或(化合物形式)两种形态存在,稳定的金属,在自然界中以游离态形式存在的可能性越大,越有利于人类开采,因此,金属单质发现和利用的先后顺序与金属活动的强弱有着某种内在联系。
试推断,下列金属中,人类开发利用最后的是()
A Al
B Cu
C Fe
D Zn
7、使一定温度,一定压强下的氨气饱和溶液转变为不饱和溶液,可采用()
A 增大压强,降低温度
B 减小压强,升高温度
C 压强不变,升温
D 温度不变,减压
8、某兴趣小组在密闭容器中分别将1.2g镁放在一定量氧气中燃烧,得如下实验数据:
第一次所给氧气的质量为0.4g,生成氧化镁的质量为1.0g;
第二次所给氧气的质量为0.8g,生成氧化镁的质量为2.0g;
第三次所给氧气的质量为1.6g,生成氧化镁的质量为2.0g。
下列实验分析错误的是()
A第一次实验中镁没有燃烧完 B 只有第二次实验遵守质量守恒定律
C第三次实验中氧气没有消耗完D三次实验后固体质量都增加了
9、欲除去物质中的少量杂质(括号内为杂质,少量),所采取的方法以及反应的基本反应类
10、将40℃等质量的两份饱和石灰水,一份冷却到10℃,另一份加少量的CaO,温度仍为40℃。
这两种情况下,都不改变的是()
A 氢氧化钙的溶解度
B 溶液的质量
C 溶质的质量分数
D 溶液中Ca2+的数目
2009级高中招生考试化学试题选择题
一、选择题(每小题只有一个选项符合题意,共20分)
二、分析填空与实验探究(总计22分):
1、(6分)有一包密封放置的氢氧化钙粉末。
某同学担心因为包装损坏氢氧化钙可能与空气中的二氧化碳反应而变质,于是进行实验探究。
提出问题:氢氧化钙是否变质?
进行猜想:①氢氧化钙没有变质;②氢氧化钙部分变质;③氢氧化钙全部变质。
设计实验方案、进行实验、步骤如下:
①取样,加适量水,搅拌,过滤;
②取少量滤液于试管中,滴入酚酞试液;
③取少量滤渣于试管中,加入盐酸。
根据你所学的化学知识,回答:
⑴能证明猜想①的实验现象是;
⑵能证明猜想②的实验现象是;
⑶能证明猜想③的实验现象是。
2、(6分)肾病患者需要食用低钠盐的食品。
某种低钠盐的食品。
某种低钠盐可能是有NaCl ,K2SO4 , MgCl2等物质组成的,某同学进行以下实验:
①将少量低钠盐样品溶于水配成溶液,然后加入足量的BaCl2溶液,有白色沉淀X生成;
②过滤,向滤液中加入W溶液,有白色沉淀Y生成。
⑴写出步骤①的化学方程式:,为了确定白色沉淀X的组成,还应该进行的操作是。
(2)当W是AgNO3和足量稀硝酸的混合溶液时,白色沉淀Y是,此实验能否证明低钠盐中含有NaCl,MgCl2等物质?说明理由:。
当W是NaOH时,白色沉淀Y是。
3、(10分)在新鲜的菠菜中含有草酸(化学式为C2H2O4),当菠菜与含钙的食物一块烹调时易结合形成沉淀,不利于钙质的吸收。
同学们对这一物质产生了浓厚的兴趣。
甲、乙两位同学对草酸受热分解产物检验做了如下探究:
(猜想和假设)(1)草酸分解产物是CO2和H2O; (2)草酸分解产物为CO2和H2; (3)草酸分解产物为CO2、CO和H2O。
(查阅资料)(1)碱石灰为N a OH和C a O的固体混合物;
(2)白色的无水硫酸铜遇水变蓝;
(3)草酸晶体熔点较低,加热到182 ℃时开始熔化。
(实验设计)甲同学设计了如图1所示的装置,乙同学设计了如图2所示的装置。
(图中铁架台略去)
(进行实验)甲同学按图1实验,观察到澄清石灰水变浑浊;乙同学按图2实验,观察到无水硫酸铜由白色变成蓝色,澄清石灰水变浑浊,且生成的气体通过碱石灰后,在尖嘴处能被点燃,在火焰上方罩一个内壁涂有澄清石灰水的烧杯,澄清石灰水变浑浊。
(结论)乙同学证明产物中含有。
若草酸分解后的产物就是乙同学证明的结果,请写出草酸分解的化学方程式:。
(反思与评价)乙同学认为甲同学设计的实验装置有不足之处。
甲同学认为乙同学的设计是科学合理的。
图2装置优于图1装置有如下几点:
图2中试管向上倾斜。
其原因是(1);
(2);
(3)。
三、计算题:(8分)
小亮同学学习了石灰石的主要成分为碳酸钙后,找到一块石灰石,取15g该石灰石样品(杂质不溶于水且不与酸反应)与足量的稀盐酸反应,进行实验探究。
他将产生的气体依次通过浓氢氧化钠溶液和澄清石灰水溶液,当反应中无气体产生时测得装有氢氧化钠溶液的试剂瓶的质量增加了4.7g;装有澄清石灰水溶液的集气瓶的质量没有发生变化且无明显现象。
有关数据如下:
请你回答:
⑴15g样品最多生成二氧化碳气体的质量为g
⑵所用稀盐酸的溶质的质量分数是多少?写出计算过程
答案:
一、选择题(每小题只有一个选项符合题意,共20分)
二、分析填空与实验探究(总计22分)
1、(6分)⑴滤液中加入酚酞后变为红色,滤渣中加入盐酸没有气泡放出
⑵滤液中加入酚酞后变为红色,滤渣中加入盐酸有气泡放出
⑶滤液中加入酚酞后不变为红色,滤渣中加入盐酸有气泡放出
2、(6分)(1)K2SO4+BaCl2=== BaSO4+2KCl
向白色沉淀X中加入足量稀硝酸,沉淀不溶解,说明白色沉淀X确实为BaSO4
⑵AgCl 不能,因为K2SO4和BaCl2反应的产物中有KCl,它也能和AgNO3反应生成AgCl
Mg(OH)2
3、(10分)‹H2O、CO2、CO
C2H2O4====H2O + CO2 + CO
‹反思与评价›
原因:⑴防止了熔化的草酸流入导气管影响后续实验
⑵乙同学设计的装置可同时证明H2O、CO2、CO的存在
⑶乙同学的设计在验证了CO的同时又解决了CO污染的问题
三、(8分)计算题:
⑴4.4
⑵7.3﹪。
