有机合成设计基础知识
有机合成(全部整合)

官能团 引入
CH3CH2OH
浓硫酸 170℃
CH2=CH2+H2O
NaOH醇△
CH3CH2Br
CH2=CH2+HBr
2、 C≡C不完全加成等
催化剂
CH≡CH + HBr △ CH2=CHBr
Cu △
2CH3CH2OH+O2
2H3CC=O+2H2O
醛基CHO或羰基的引入
(1) R—CH2OH氧化
O R
C
R C C OH
R OH
OH
试以甲醇、丙酮和HCN为原料,制备有机 玻璃-聚甲基丙烯酸甲酯 COOH
[ C CH2 ]n
CH3
C—H C—H
O
CH2
以乙醇为原料,合成乙二酸乙二酯
COOH
5
COOH
6
4 CH2OH
CH2OH
CH2OH CH2OH
CH2Br
3
2
CH2Br
CH2==CH2
1
CH3CH2OH
以乙醇为主要原料如何制备乙二醇?
例2。用乙烯和乙苯为原料(其它无机物 自选), 合成下列有机物
?
分 析
合成1
整个过程的反应
叶绿 素分 子的 结构 式
维 生 素
B12 的 化 学 结 构
用化学方法人工合成物质
• 修饰 • 自然 • 物质
解热镇痛药物——阿司匹林
卡托普利、青霉素
CH3
HSCH2CHCO N COOH
CH3 CH3C CHCOOH
SH NH2
用化学方法人工合成物质
• 创造新物质,如尼龙、涤纶、炸药、医 药等等
大学有机化学有机合成全面总结

OH
α -氰 醇
α -羟 基 酸
应用范围:醛、甲基脂肪酮 、C8以下环酮
2. 增加二个碳原子的反应
R MgX + CH2 CH2 O
R CH2CH2 H3O+ RCH2CH2OH OMgX
3. 增加多个碳原子的反应
① R-C CH NaNH2 R-C CNa R/X R-C C-R/
其中:R/ 为伯卤代烃 X 为Cl、Br、I
H2O / OH- PX3 Mg
NH3 R-NH2
R-MgX
R-X
① ②
CO2 H3O+
R-COOH
H3O+
NaCN
R-CN
R-NH2 R-NHR
[H]
R-CH2NH2
R-X
R-NR2
2. 羧酸及其衍生物的转换
R-COCl
NH3
R-CONH2
R/OH
R-COOH
NH3
R-COOR/
R/OH
(RCO)2O
H2SO4 H2O
① (BH3)2 ② H2O2 /
OH-
R-CH-CH3(符合马氏规则) OH
R-CH2CH2OH(反马氏规则)
[H]
② R-C=O H(R/) [ O ]
R-CH-OH H(R/)
[ H ] = LiAiH4 、NaBH4 、 H2 / Ni、Pt、Pd等
③ R-COOR/ [ H ] R-CH2OH + R/OH [ H ] = LiAiH4 、C2H5OH + Na 、 H2 / Ni、Pt、Pd等
R-NH2
● 碳环的合成
① 双烯合成(D-A反应)
X△
-X
有机合成基础

HY +δ C+ 4=C3−C2=Oδ 1- 碱
重排
[ Y−C-C=C-OH ]
Y−C-C-C=O
H
反应物: 有活性亚甲基化合物
反
α、β-不饱和醛酮、酯、腈等
应
催化剂: 强碱
特
点 产 物: 1,5—二羰基化合物
过 程:1,4-加成(表面上若3.4-加成)
Chapter 17
(3)偶联反应
CH3CH2CH2MgBr + CH3CCH CH3CCCH2CH=CH2
R '
亲核取代反应
C 2 H 5 O N a C H 2 ( C O O C 2 H 5 ) 2
B r - C H 2 - C H 2 - C H 2 - B r
① O H /H 2 O ② H +
Chapter 17
C O O H
2.形成四元环 亲核取代: 二卤代物脱卤环化: [2+2]反应: 1,3 – 二烯电环化反应
➢从反应类型分:亲核取代、亲核加成、亲电取代、亲电加成等
Chapter 17
1.烃基化反应
(1)通过亲核取代反应引入烃基 亲核试剂---碳负离子或潜在的碳负离子
➢活泼亚甲基烃化:丙二酸酯、β-酮酸酯、 β-二酮等.
Chapter 17
➢烯胺在有机合成中的应用
O X
R
RX
N
+
O XR
O R
Chapter 17
Chapter 17
(2)有机合成是改造世界的工具 人工合成自然界中存在或不存在的人类需要的化合物。
➢尿素的合成 (1828年,德国化学家 Wohler)
O
N H 4O C N
高中《化学》有机合成思路与方法
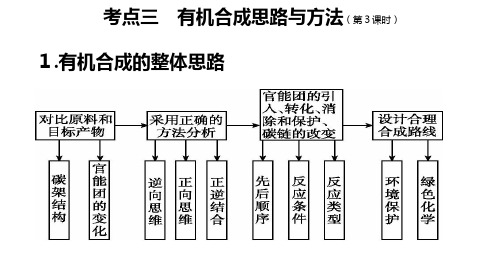
(2).官能团的消除 (1)消除双键:加成反应。 (2)消除羟基:消去、氧化、酯化反应。 (3)消除醛基:还原和氧化反应。 (3).官能团的保护 在引入一个新官能团或将某一官能团加以转换时,若反应会影响分子中原有的官能 团,则应对这一官能团进行保护。例如在含有碳碳双键的分子中,欲将羟基氧化时, 应先把碳碳双键保护起来,以防被破坏。为了保护其他官能团而人为引入的基团, 称为保护基。保护基的选择应满足以下条件:①易于引入且不影响分子中其他部位 结构;②形成的保护基在后续反应中保持稳定;③在保持分子其他部位结构不被破 坏的情况下易于除去。试题中出现的大多是对(酚)羟基、醛基、氨基、碳碳双键 等易于被氧化的官能团进行保护。
(3)成环的方法
①二元醇脱水成环醚; ②二元醇与二元羧酸成环酯; ③羟基酸分子间成环酯; ④氨基酸分子间成环等。 ⑤ 双烯合成[狄(弟)尔斯-阿尔德反应]
4. 有机合成路线的设计
能力要求:能利用不同类型有机化合物之间的转化关系及能
够从题给合成路线中选用必要的合成方法,设计合理路线
合成目标化合物。 综合能力要求高,是考查的难点! 一般是3分,也是拉开差距的部分!!!
和
为原料制备
的路线(无机试剂任选)。
(1)合成路线为:
(1)
(2)已知 :
。设计以
的路线(无机试剂任选)。
和
为原料制备
理解信息中给出的成环反应, 虚线左边来自于二烯烃,虚线右边来自于单烯烃,结合原
料中有含醛基物质,可推出
可由
与氢气加成反应得到,而
可
由 CH2=CHCH=CH2 和 CH2=CHCHO 加成得到。而 CH2=CHCH=CH2 可由 CH3CH=CHCH3 与溴发生加成反应,然后再发生卤代烃的消去反应得到,进而得到合成路线图。
有机合成设计-1
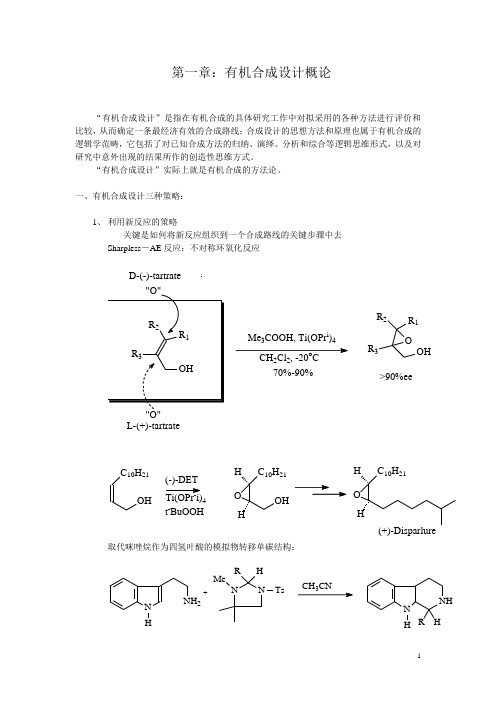
第一章:有机合成设计概论“有机合成设计”是指在有机合成的具体研究工作中对拟采用的各种方法进行评价和比较,从而确定一条最经济有效的合成路线;合成设计的思想方法和原理也属于有机合成的逻辑学范畴,它包括了对已知合成方法的归纳、演绎、分析和综合等逻辑思维形式,以及对研究中意外出现的结果所作的创造性思维方式。
“有机合成设计”实际上就是有机合成的方法论。
一、有机合成设计三种策略:1、利用新反应的策略关键是如何将新反应组织到一个合成路线的关键步骤中去Sharpless-AE反应:不对称环氧化反应D-(-)-tartrate"O"L-(+)-tartrate M e3C O O H, T i(O P r i)4C H2C l2, -20o C70%-90%OR1R2R3O H>90%eeC10H21O H(-)-D E TC10H21O HOHHC10H21OHH(+)-D isp arlu re T i(O P r i)4t-B u O O H取代咪唑烷作为四氢叶酸的模拟物转移单碳结构:N H N H2N NHRT sM e+C H C NN HNH HR2、 由原料而定的策略:关键是如何充分利用原料的结构特征及反应特性葡萄糖用于白三烯A4的合成:O H OHHPHP O O HM sO O C H 3H C l23OOHHC O O C H3以L-谷氨酸合成(+) or(-)-Butyl nonoctaeHO O CC O O N H 2H2(+)-b u ty l n o n o ctate2(-)-b u ty l n o n o ctate3、特定目标分子的合成策略:有机合成设计最常遇到的情况,以上两种情况最终都会归结到一个特定目标分子的合成有机合成的目标分子包括天然的与非天然的有机化合物。
二、有机合成设计的三个步骤:1、对目标分子的结构特征和已知的理化性质进行收集和观察,由此可以简化合成或避免不必要的弯路角鲨烯:30个碳,具有中心对称性,可以从中间向两边对称合成C H O C H OL i+2C H OO H C同上CH O C H O前列腺素E2分子中β-羟基酮体系不稳定,因此在合成时应把这一结构单元的形成放在最后几步:HH2、在对目标分子考察的基础上,采用反合成分析的方法,倒推出合成目标分子的各种路线和各种易得起始原料。
高中化学 有机合成基础知识(基础)知识讲解学案 新人教版选修5

有机合成基础知识【学习目标】1、掌握有机化学反应的主要类型:取代反应、加成反应、消去反应的概念,反应原理及其应用;2、了解有机化学反应中的氧化还原反应,能根据碳原子的氧化数法判断有机化学反应是氧化反应还是还原反应;3、了解加成聚合反应和缩合聚合反应的特点,能写出简单的聚合反应的化学方程式;4、了解官能团与有机化学反应类型之间的关系,能判断有机反应类型,能正确书写有机化学反应的方程式。
【要点梳理】要点一、有机化学反应的主要类型 1.取代反应。
(1)取代反应指的是有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应。
(2)有机物与极性试剂发生取代反应的结果可以用下面的通式来表示。
888811221221A B A B A B A B +-+--+-→-+-(3)烃的卤代、芳香烃的硝化或磺化、卤代烃的水解、醇分子间的脱水反应、醇与氢卤酸的反应、酚的卤代、酯化反应、酯的水解和醇解,以及即将学到的蛋白质的水解等都属于取代反应。
①卤代。
CH 4+X 2−−→光CH 3X+HX②硝化。
③磺化。
④α—H 的取代。
Cl 2+CH 2=CH —CH 3500600C︒−−−−−→:CH 2=CH —CH 2Cl+HCl ⑤脱水。
CH 3CH 2OH+HOCH 2CH 3140C ︒垐垐垎噲垐垐浓硫酸CH 3CH 2OCH 2CH 3+H 2O ⑥酯化。
CH 3COOH+HO —CH 3∆垐垐垎噲垐垐浓硫酸CH 3COOCH 3+H 2O ⑦水解。
R —X+H 2O NaOH∆−−−−→R —OH+HX R —COOR '+H 2O H +垐垎噲垐RCOOH+R 'OH(4)取代反应发生时,被代替的原子或原子团应与有机物分子中的碳原子直接相连,否则就不属于取代反应。
(5)在有机合成中,利用卤代烷的取代反应,将卤原子转化为羟基、氨基等官能团,从而制得用途广泛的醇、胺等有机物;也可通过取代反应增长碳链或制得新物质。
有机合成设计知识点

有机合成设计知识点有机合成是有机化学的重要分支,它涉及到设计和合成有机分子的方法和策略。
在本文中,我们将介绍一些常用的有机合成设计知识点,并探讨它们在实际合成中的应用。
1. 反应类型有机合成中常见的反应类型包括加成反应、消除反应、置换反应、重排反应等。
加成反应是指两个或两个以上的分子发生化学键的形成,而消除反应则是指一个分子中的两个官能团结合生成一个小分子。
置换反应涉及到官能团之间的交换,而重排反应则是通过破裂和重新组合化学键来重新排列分子结构。
2. 反应试剂的选择在有机合成设计中,选择合适的反应试剂十分重要。
不同的试剂会导致不同的反应路径和产物选择。
例如,氢化试剂(如氢气、氢化锂、氢化铝)可用于加成反应中,而强碱(如氢氧化钠、氢氧化钾)则可用于消除反应。
根据所需的官能团转化和键的形成或断裂,选择合适的反应试剂是实现合成目标的关键。
3. 保护基策略在有机合成中,分子中的某些官能团可能对特定反应条件敏感或会发生副反应。
为了解决这一问题,保护基策略被广泛应用。
保护基是一种通过引入可逆官能团来保护敏感官能团的方法。
在需要时,保护基可被去除以恢复原始官能团。
常见的保护基包括酯保护基、醚保护基和酮保护基等。
4. 合成路径设计在有机合成设计中,合理的合成路径设计是实现复杂分子合成的关键。
合成路径设计需要考虑反应条件、试剂的选择、中间体的稳定性等因素。
既要考虑反应的高效性,又要尽量避免副反应的发生。
此外,还可以利用保护基策略和合适的反应序列来实现所需的官能团转化。
5. 纯化和分离技术合成有机化合物后,纯化和分离是必要的步骤。
常用的纯化技术包括结晶、蒸馏、析出、萃取和柱层析等。
这些技术可以去除杂质,提高产物的纯度。
在纯化过程中,合适的溶剂选择和条件控制也至关重要。
6. 分子结构确定合成有机化合物后,需要通过多种技术手段对其结构进行确定。
常见的方法包括核磁共振(NMR)波谱、红外光谱(IR)、质谱(MS)等。
这些技术可以提供关于分子中官能团和键的信息,从而确认和验证合成产物的结构。
有机合成设计

+
Suzuki-Miyaura 反应
R1 R3
R2 X
R1 R
3
R2 R
R
O
结构特点: 反式聚醚
CH3 CH 3 O O H H O
HO CH3 H O O H O H O H H H CH3 H
H
CH3 H
O
CH3
H
H O
O
O
H
H
O
H
CH3
Brevetoxin B
O R 1O 9-BBN-H OP R 1O
有机合成设计
The Design of Organic Synthesis
第一章:概论 第二章:目标分子的考察 第三章:反合成分析
第四章:合成路线的评价和选择
第五章:合成原料、砌块和手性源 第六章: 有机合成中的保护基 第七章、复杂天然产物合成举例
第一章:概论
第一节:有机合成
1.1什么是有机合成? 有机合成是利用化学方法将单质、简单的无机物或简单的有机 物制备成较复杂的有机物的过程。
3、 特定目标分子的合成 三种情形的有机合成设计,需把握的关键点不同
1、利用新反应的有机合成设计 关键是如何将新反应组织到一个合成路线的关键步骤中去 (需掌握新反应的本质和适用范围)
Sharpless-AE反应:不对称环氧化反应
D-(-)-tartrate "O" R2 R1 R3 OH Me3COOH, Ti(OPri)4 CH2Cl2, -20oC 70%-90% R3 R1 O OH >90%ee
R2
"O" L-(+)-tartrate
C10H21 OH
【新教材】有机合成

【新教材】有机合成一、有机合成的主要任务1.构建碳骨架:包括碳链的增长、缩短与成环等(1)碳链的增长③羟醛缩合反应:含有αH的醛在一定条件下可发生加成反应,生成β羟基醛,进而发生消去反应。
(2)碳链的缩短(3)碳链成环共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃,如1,3丁二烯)与含碳碳双键的化合物在一定条件下发生第尔斯阿尔德反应(DielsAlder reaction),得到环加成产物,构建了环状碳骨架。
2.引入官能团引入官能团的反应类型常见的有取代、加成、消去、氧化还原等。
(1)引入—OH生成醇的反应有烯与H2O加成,卤代烃水解,酯水解,酮、醛与H2加成等。
(2)引入的反应有醇与卤代烃的消去反应等。
3.官能团的保护含有多个官能团的有机物在进行反应时,非目标官能团也可能受到影响。
此时需要将该官能团保护起来,先将其转化为不受该反应影响的其他官能团,反应后再转化复原。
如—OH保护过程:二、有机合成路线的设计与实施1.合成的设计方法(1)从原料出发设计合成路线的方法步骤基础原料通过有机反应形成一段碳链或连上一个官能团,合成第一个中间体;在此基础上,利用中间体的官能团,加上辅助原料,进行第二步反应,合成出第二个中间体……经过多步反应,最后得到具有特定结构和功能的目标化合物。
示例:乙烯合成乙酸的合成路线为(2)从目标化合物出发逆合成分析法的基本思路基本思路是在目标化合物的适当位置断开相应的化学键,目的是使得到的较小片段所对应的中间体经过反应可以得到目标化合物;接下来继续断开中间体适当位置的化学键,使其可以从更上一步的中间体反应得来;依次倒推,最后确定最适宜的基础原料和合成路线。
可以用符号“”表示逆推过程,用箭头“→”表示每一步转化反应。
示例:乙烯合成乙二酸二乙酯的合成路线逆向合成图(用“”表示逆推过程)可以得出正向合成路线图:。
有机合成

第四节有机合成一、有机合成的原则、方法、关键 1、有机合成遵循的原则(1)起始原料要价廉、易得、简单,通常采用四个碳以下的单官能团化合物和单取代苯。
(2)尽量选择步骤最少的合成路线。
(3)“绿色、环保”。
(4)操作简单、条件温和、能耗低,易于实现。
(5)不能臆造不存在的反应事实。
2、有机合成的解题方法首先要看目标产物属于哪一类、带有何种官能团。
然后结合所学过的知识或题给信息,寻找官能团的引入、转换、保护或消去的方法。
3、解答有机合成题的关键在于:(1)选择合理简单的合成路线。
(2)熟练各类物质的组成、结构、性质、相互衍生关系以及官能团的引进和消去等基础知识。
▲二、有机物的种类、官能团之间的转换 1、官能团的引入(1)引入羟基(—OH ):烯烃与水加成,卤代烃水解,酯的水解,醛、酮与H 2加成还原等。
(2)引入卤原子(—X ):烃的取代,不饱和烃与X 2、HX 的加成,醇或酚与HX 的取代等。
(3)引入C=C :卤代烃消去 醇消去 炔烃不完全加成。
引入:醇的催化氧化【例】:已知+HCN催化剂 △,R 为烃基或H ,以丙酮为原料合成有机玻璃的路线如下,在框内填入相应化合物的结构简式。
生成B 时同时生成的副产物是______________________(写化学式)。
【解析】: 据题给信息,可写出丙酮→A :再据题给信息,可写出A →B :B→C是醇的消去反应:+H2O(B)(C)C→D是酸和醇的酯化反应:(D)答案:NH3【思维启示】:羰基加成遵循正负电性相吸的原则,即加成时,正电基团与负电基团相互吸引而结合在一起。
2、官能团的消除(1)通过加成消除不饱和键。
(2)通过加成(加H)或氧化(加O)消除醛基。
(3)通过消去或氧化或酯化等消去羟基。
【例】:某种医用胶的成分为某同学以乙烯为起始物,设计了这种医用胶的合成路线:请思考:在上述合成过程中,碳骨架是如何构建的?官能团是如何转化的?【思路分析】:逐步分析如下:反应①,乙烯水化,烯键转化为醇羟基。
有机合成

O O O O
认目标
巧切断
再切断
…… 得原料 得路线
1、逆合成分析:
O C C
O O O O
O
OH
H H
Br CH2 CH2 Br
OH OH
C C O
CH 2 CH 2 OH
CH2 CH2
O
OH
Br
Br Br
OH
Br
2、合成路线:
Br
OH
CH2 CH2
Br2
CH2 CH2 Br
NaOH CH2
水
△
官能团的消除
CH2=CH2+H2 △ CH3CH3 1.加成消不饱和键 O 催化剂 CH CH OH CH3-C-H + H2 3 2 Δ 2.消去、氧化、酯化除羟基 CH3CH2OH 170℃ 2CH3CH2OH+O2 CH3OH+HCOOH
浓硫酸
Ni
CH2=CH2+H2O 2CH3CHO+2H2O
CH 2 OH
Cu O2
O C C O H H
O
O2
C C O
OH OH
O
浓H2SO4
OH
O
O O
Br2
Br Br
NaOH C2H5OH
Br2
Br
NaOH 水
Br
OH
化合物A的钙盐是人们喜爱的补钙剂之一。A 在某催化剂的存在下进行氧化,其产物不能发生 银镜反应。在浓硫酸存在下,A可发生如下图所示 的反应:
3、有机合成的任务:
对目标化合物分子骨架的构建和官能团的转化
副产物 副产物
基础原料
中间体
中间体
目标化合物
专题1 有机化合物的合成
例1、设计的合成路线。
例2、设计的合成路线
例3、设计的合成路线
例5、设计 的合成路线。
例6、由苯酚合成
例7、设计 的合成路线
例8、用C3化合物合成
例9、由苯合成对溴乙苯
例10、由苯合成对硝基苯甲酸。
例11、由苯合成间硝基苯乙酮。
例12、由C2化合物合成叶醇
练习题
1、由指定原料及其他必要的无机及有机试剂合成下列化合物:
CH3(CH2)5CH2C≡CCH2OHCH3(CH2)5CH2C≡CCH2C≡CCH2OH
B C
CH3(CH2)11CH2OH
D E
(1)用反应式表示由电石和甲醛以及必要的无机试剂为原料制备A的各步反应,并注明必要的反应条件。
(2)用系统命名法命名化合物B,C,D。
(3)以乙烯、丙烯、乙炔、化合物A以及必要的无机试剂为原料合成B和C,以反应式表示。
(2)引入一种基团,这种基团具有一定的定位作用,待第二基团引入后,再除去这种基团,例如由苯合成间二溴苯。
(3)当用取代苯作为起始物时,可通过改变起始物取代基转化的先后顺序来决定最终产物分子中基团的相对位置,例如由甲苯合成硝基苯甲酸。
在将两个基团引入到苯环上时,应考虑以下两个问题:
(1)在有选择余地时,首先引入最强的致活基团或最弱的致钝基团进入苯环。
专题一有机化合物的合成
一、有机合成的一般原则
1、反应步骤较少,总产率高。2、每步的主要产物易于分离提纯。3、原料易得价格便宜。
二、有机物的合成方法(包括碳架的建立、各种官能团引进等)
(一)芳香族化合物的合成
1、合成苯环上仅连有一个基团的化合物
①一般以苯为原料,通过芳香烃的亲电取代反应引入基团,如表1:
邢其毅《基础有机化学》笔记和课后习题(含考研真题)详解(有机合成基础)

第24章有机合成基础24.1 复习笔记逆合成分析理论与生源合成学说为现代有机合成设计思想的基石。
一、有机合成的要求和驱动力1.有机合成的要求(1)合成的反应步骤越少越好,每步反应的产率越高越好,以及原料越便宜越易得越好;(2)有机合成的目的是尽可能地选择最便宜最易得的原料,通过各种有机反应将原料化合物经“拼接”和“剪裁”最终转化成复杂的目标分子结构;(3)有机反应的作用是使原来分子中的某一个或几个化学键断裂并形成一个或几个新的化学键,从而完成由原料分子到目标分子的转换。
2.有机合成的驱动力(1)将各种新的有机反应应用于有理论或实用意义分子的合成中;(2)利用天然的或未被充分利用的原料合成各种具有应用价值的物质;(3)合成一些满足特定需求的特殊有机分子。
二、有机合成设计的基本概念1.起始原料、目标分子和逆合成分析(1)通过逆合成分析得到的最简单的化合物,即整个合成利用的第一个化合物称为起始原料(starting material,简写为SM)。
起始原料通常是一些商业化的产品或在自然界中大量存在的化合物。
在合成过程中需要各种试剂(reagent),通过试剂和起始原料或中间体反应可以生成各种新的中间体或目标分子。
试剂也是合成子的合成等价物。
(2)计划合成的分子称为目标分子(target molecule),通常用TM表示。
(3)逆合成分析是一种逻辑推理的分析过程。
它将目标分子按一定的规律通过切断或转换推导出目标分子的合成子或与合成子相对应的试剂。
逆合成分析用双线箭头“ ”表示。
其一般式可表达为:2.合成子、反合成子、合成等价物和切断(1)在分子中的化学键进行切断时所产生的分子碎片称为合成子或叫合成元(synthon)。
(2)合成子可以是正、负离子,也可以是电中性的。
正离子称为受体合成子(acceptor synthon),简称a,负离子称为供体合成子(donor synthon),简称d,电中性的合成子简写为e,其中的中性原子(radical)简写为r。
有机化学中的合成路线设计与优化

有机化学中的合成路线设计与优化在有机化学领域,合成路线的设计与优化是一个至关重要的环节。
它涉及到合成方法的选择、反应条件的确定以及中间体合成的规划等多个方面。
一个良好的合成路线可以提高合成效率,减少副产物的生成,并确保所需目标化合物的高产率合成。
本文将介绍有机化学中的合成路线设计与优化的基本原则和方法。
一、合成路线的选择合成路线的选择是合成路线设计的第一步。
在选择合成路线时,需要考虑以下几个方面:1. 反应类型:根据目标化合物的结构和功能团,选择适合的反应类型,如酯化反应、胺化反应等。
2. 反应条件:考虑反应条件对产率和选择性的影响,选择适合的反应条件,如温度、反应时间、溶剂等。
3. 原料的选择:选择高质量的原料,确保反应的可控性和可重复性。
4. 副反应副产物的控制:考虑副反应和副产物的生成,选择合适的保护基或选择其他反应方式来避免副反应的发生。
二、中间体的合成规划在合成路线设计中,中间体的合成规划是非常重要的。
中间体是连接各个反应步骤的关键化合物,其选择和合成方法将直接影响到合成路线的成功与否。
合成中间体时需要考虑以下几个方面:1. 中间体的稳定性:选择稳定性较好的中间体,以确保其在后续反应中不发生不必要的副反应。
2. 中间体的合成路径:选择最简单、最高效的合成路径来合成目标中间体,避免过多的反应步骤和废弃物的产生。
3. 中间体的纯度:确保中间体的高纯度,以避免杂质对后续反应的干扰。
三、反应条件的优化在合成路线设计的过程中,反应条件的优化是提高合成效率和产率的关键。
反应条件的优化可以从以下几个方面入手:1. 温度和时间的确定:通过调节反应温度和时间,可以控制反应速率和产物选择性。
2. 催化剂的选择:选择适当的催化剂可以加速反应速率,降低反应活化能。
3. 溶剂的优化:选择合适的溶剂可以改善反应的溶解度和反应速率。
4. 物料比的优化:调整物料比可以提高反应的产率和选择性。
四、副产物的减少与处理在合成路线设计和优化的过程中,副产物的减少和处理是一个重要的环节。
第二四章有机合成基础

CH2CH3
CH2CH3
b、普尔金(Perkin)反应
1 定义:在碱性催化剂的作用下,芳香醛与酸酐反 应生成β-芳基-α,β-不饱和酸的反应叫做 普尔金(Perkin)反应.
Ar C=O +
H
Ar βα CC
H
H(R)
H2 C
CH3COONa
C O CCH2 H(R) 180℃
OO
H(R)
+
CH3COOH (RCH2COOH)
Ar
OO
CCHCOCCH3
H OH H
-H2O
Ar
OO
CCHCOCCH3
H
Ar
H
CC
+H2O
水解
H
COOH
例1.
OO
CH = O + H2CH-C-O-C-CH3 CH3COOK
H+
170~180℃
例2.
CH=CHCOOH + CH3COOH
肉桂酸
CH=O
+ (CH3CO)2O CH3COOK
OH
O C
CH2
O
NaOC2H5
C OC2H5
Na OC2H5 RX
RX
O CH3 C CHCOOC2H5
R
OR O CH3 C C C OC2H5
R'
醛酮与仲胺加成,首先生成 a-氨基醇,由于仲氨 基上不再有氢原子,故在脱水剂存在下,脱水作
用发生在β-碳上产生烯胺。
O
C C + HNR2
NR2
C C - H2O
一、有机合成的过程
1、有机合成的概念
利用简单、易得的原料,通过有机反应, 生成具有特定结构和功能的有机化合物。
有机合成化学:第八章 有机合成路线的设计

(5)拆解原则 A,切割目标分子时,如果反过来合成时要有合理的反应机 理和合理的合成子(即原料),二者缺一不可。如果没有合 理的反应机理或反应例子,合成子即相应的原料再方便得 到,也可能行不通。即原料易得是一回事,能否反应得到产 物则是更重要的另一回事。 如合成十八烷基苯:
CH3(CH2)16CH3
高,会发生二分子R-同时参与反应,不能停留在酮阶段。如:
RCO2CH3 + 2R'MgBr
RC(OMgBr)R'2
第八章 有机合成路线的设计
5) 羧酸衍生物的切割 A、伯醇氧化得到羧酸,所以羧酸可以按它的前体伯醇方式切割。
O R--C-OH
R-CH2-OH
HCHO + R-
如:
H3C H3C
CO2H
第八章 有机合成路线的设计
(4)官能团的消除或转换: 一个有机分子,特别是药物分子,往往含有几个官能团,在 设计合成路线时,把不紧要的官能团除去或置换掉,反应完 成后,再利用适当方法加入或回复过来。如:
H3CO O2N
HNO3 + H2SO4 H3CO
H3CO O2N
SO3H
H3CO
SO3H
H3CO
X
HO
OH
以X
OH为原料如何?
N
(
CH2 )3N
N
R
3)简单烯烃的切割:
N
(
CH2 )3N + RX
ROH
N
H
醇脱水得到烯烃,烯烃的切割可以把醇作为前体。由于醇脱水有时会有
两种可能,考虑到这一问题。
第八章 有机合成路线的设计
OH
Ph
O
PhMgBr + Ph
有机合成实验基本知识

有机合成实验基本常识图1-6 抽滤装置图1-7 气体吸收装置图1-8 搅拌装置图1-9 回流滴加装置图1-10 分馏装置1.5 玻璃仪器的洗涤和保养1.5.1 玻璃器皿的洗涤在进行合成实验时为了避免杂质混入反应物中,必须使用清洁的玻璃仪器。
实验用过的玻璃器皿必须立即洗涤,应该养成习惯。
若日子久了,会由于忘记污垢的性质,增加洗涤的困难。
洗涤玻璃仪器的一般方法是用水、洗衣粉或去污粉刷洗湿润的的器壁,直至玻璃表面的污物除去为止,然后用自来水清洗,倒置时器壁不挂水珠,可供一般实验用。
若用于精制或有机分析用的器皿,除用上述方法处理外,还须用蒸馏水冲洗。
清洁器皿的标志是:加水倒置,水随着器壁流下,内壁被水均匀浸润,有一层即薄又均匀的水膜,不挂水珠。
但若难于洗涤时,则可根据污垢的性质选用适当的洗液进行洗涤。
如酸性(或碱性)的污垢可用碱性(或酸性)洗液洗涤;有机污垢用碱液或有机溶剂洗涤,但用腐蚀性洗液时则不能用刷子。
表1.2为常见污垢的洗脱方法。
表1.2 常见污垢的洗脱污垢的性质处理方法1.二氧化锰、碳酸盐和氢氧化物等用盐酸处理2.硫黄煮沸的石灰水3.铜或银附在器壁上用硝酸处理,难溶的银盐可以用硫代硫酸钠溶液。
4.少量炭化残渣铬酸洗液浸泡一段时间后在小火上加热,直至冒出气泡,炭化残渣可被除去。
5.油脂和一些有机物(如有机酸)碱液和合成洗涤剂配成的浓溶液6.胶状或焦油状的有机污垢可选用丙酮、乙醚、苯等有机溶剂浸泡,要加盖以免溶剂蒸发,或用NaOH的乙醇溶液(有机溶剂作洗涤剂,使用后可回收)7.煤焦油污迹浓碱浸泡一段时间(约一天),再用水冲洗。
合成实验室中常用超声波清洗器来洗涤玻璃仪器,既省时又方便。
操作方法:用过的仪器放入盛有洗涤剂的超声波清洗器清洗槽中,接通电源,利用超声波的振动和能量,达到清洗仪器的目的。
清洗过的仪器,再用自来水清洗。
1.5.2 玻璃仪器的干燥化学合成实验中一般需要使用干燥的仪器,因此在每次实验后应立即把玻璃仪器洗涤干净并倒置使之干燥,以备下次实验使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
逆向切断、连接和重排
逆向切断(dis):用切断化学键的方法把目 标分子骨架剖析成不同性质的合成子。
逆向连接(con):将目标分子中两个适当碳 原子用新的化学键连接起来。
逆向重排(rearr):把目标分子骨架拆开和重 新组装。
逆向官能团转化
在不改变目标分子基本骨架的前提下变换官 能团的性质或所处位置的方法。 逆向官能团互换(antithetical functional group interconversion)(FGI) 逆向官能团消除(antithetical functional group removel)(FGR) 逆向官能团添加(antithetical functional group addition)(FGA)
有机合成的基本术语
目标分子(TM):又称“靶分子”(target molecule),就有机合成而言,凡需要合成的有机 分子均可称为目标分子。 合成子(synthon)是组成目标分子或中间体骨架的 各个单元结构形成。 根据形成碳-碳键的需要,合成子可以是离子形式, 也可以是自由基或周环反应所需的中性分子,前两 者合成子是不稳定的,其实际存在的形式称为“等 效试剂”(equivolent reagent)
获得单一构型的对映异构体通常有四种方法
第一个方法是以拆分为基础。这个方法包含使用手 性材料来拆分合成过程的一些中间体。 第二个常用方法是使用手性底物控制的立体选择性。 在底物控制的立体选择性中,反应的立体选择性是 由底物已有的手性中心控制或诱导。这类方法最大 的优点在于反应的起始原料一般来自于天然的手性 化合物或衍生物,具有很高的光学活性。
OH O OC2H5
OH OH
2、区域选择性 (regioselectivity)
相同官能团在同一分子的不同位置上起反应 时,若试剂只能与分子的某一特定位置作用, 而不与其他位置上相同官能团作用。 选择性通常涉及羰基两个α位、烯丙基的1, 3位、双键或者环氧两侧位置上的选择性以及 α,β-不饱和体系的1,2-和1,4-加成选择反 应等。
O + OAc E
O
E
AcO
O
O
O OAc 20: 1
3、两方面差别很小
较困难,只能采取分离的手段或改变合成的路线 以避免这种情况
H+ HO HOOC HOOC
+ HOOC 1: 1
4、被选择的两方面情况完全相同
即分子存在一定的对称性,这时可以选择合适的 反应条件和试剂量,或利用部分反应后的中间产物 进一步反应的活性下降,达到可以接收的单边反应效果。
1.0 eq NaH 1.1 eq BnBr O HO O OH DMF -20 oC, 90% HO
O
O
+ OBn BnO
O
O OBn
> 10: 1
选择性的控制-试剂和反应条件的调节
高选择性有机合成反应:在一个结构较为复 杂的有机分子的合成中,常常要涉及上述三 种选择性问题。涉及的中间体一般是多官能 团,而目标化合物又都是特定构型的,因此, 采取的最好办法就是使用高选择性的反应。 通过试剂和反应条件的调节实现选择性的控 制,这也是目前有机合成方法学研究的一个 主要的方向。
有机合成的任务
有机合成工业(基本有机合成工业、精细有机合成工业)
基本有机合成工业:从廉价易得的天然资源(煤、石 油、天然气或农副产品,加工成如甲、乙、丙烷、 炔、苯、萘、乙醇、乙酸等)。 精细有机合成工业:用基本有机合成工业加工的有机 产品,合成较复杂、质量更高的化合物,主要应用 于合成药物、农药、染料和香料等。
O
O O H I 1.0 O O I IV I Re III Si
O
H 4.7
II 0
H
I和III、II和IV:区域选择性 I和II、III和IV:立体选择性
选择性反应的底物自身的影响
一个合成路线要对中间体进行选择性反应, 选择的成功与否,首先取决于这一中间体 即反应底物的结构情况。
1、被选择的两方面状况有质的不同
1、羟基的选择性氧化
烯丙基羟基在其他羟基的存在下可被选择性氧化,这 些试剂有活性MnO2、Ag2CO3/Celite等。
OH OH MnO2 OH O O
伯羟基和仲羟基同时存在时,二者均可选择性地被区 别氧化。
OH OH HO OBut O2/Pt 80-85% HO OBut O O
利用一些特定的化学试剂也可以选择性将仲羟基氧化为酮, 而同时存在于一个分子内的伯羟基保持不变。
邻羟基参与反应
TBHP/VO(acac)2
O OH OH
模板反应
立体化学的控制
在设计合成路线时,对所有新的双键、环连结处和 手性中心的立体化学都必须予以考虑。如果立体中 心数为n,可能的立体异构体数为2n。 在合成含多个立体中心的化合物时,不能有效控制 立体化学将导致立体异构混合物的产生,这至少会 导致目标产物的产量下降,更为严重的是可能产生 不能分离的立体异构体混合物。 尽管非对映异构体混合物通常能够分离,但整个合 成效率也因拆分而随之下降。 立体选择性是合成设计过程中需要特别考虑的重要 因素之一。
HO Ph3C+BF4CH2Cl2 O
OH
OH
化学性质完全一致的仲羟基在试剂用量控制的条件也能达到 单边氧化目的。
Ag2CO3 Celite
HO
OH
HO
O
2、羰基的选择性反应
α,β-不饱和酮和饱和酮由于它们的电子离域情况不 同,亲核还原剂H-可选择性进攻饱和酮,而亲电性 试剂B2H6则可选择与不饱和酮反应。
OH HO MnO2 HO
OH
HO
O
3、立体选择性 (stereoselectivity)
立体选择性:顺/反异构、对映异构、非 对映异构选择性。 如果某个反应只生成某一种异构体,而没 有另一种,就叫立体专一性反应 (stereospecificity)。
O I H γ COOH γ' I2, CH2Cl2 aq. NaHCO3 20 oC, 79% 142 O I
逆向官能团互换(FGI)
逆向官能团消除(GFR)
逆向官能团添加(FGA)
有机合成中应用上述变换的主要目的
将目标分子变换成在合成中比母体化合物更 容易制备的前体化合物; 为了作逆向切断、连接和重排等变换,必须 将目标分子上原来不合适的官能团变成所需 要的形式或暂时添加某些必要的官能团; 添加某些活化基、保护基、阻断基或诱导基, 以提高化学、区域和立体选择性。
有机合成的特点
良好的有机合成路线; 反应条件温和、操作简便、得率高; 很高的化学和立体选择性; 适应力强,适用面广,实用性好; 原料价廉易得,有丰富的来源; 不产生公害,不污染环境。
有机化学中最困难的问题之一就是复杂有机 分子的有效合成路线设计。 路线设计决定着合成工作的成败,在合理的 合成路线之间,也有着非常大的差别。
四种方法的绝对效率具如下顺序:手性拆分 < 天然 手性源 < 手性辅助剂 < 手性催化剂。 手性拆分仅仅利用了消旋体的一半。 第二种方法的主要局限在于手性原料的种类和来源 比较有限。尽管天然起使原料能够100%的被利 用,但是一但被消耗掉,就不能再利用,而且往往 只有一种特定的构型易得,例如,糖只有D-型, 氨基酸则为L-构型。 理论上,手性辅助剂能够被回收再使用,但它们需 要化学计量。 最有效率的方法就是使用手性催化剂,理论上,手 性催化剂能够产生无限量的单一对映异构体材料。
NaBH4 HO HOOC O HOOC
MeMgI HO HOOC
2、被选择的两方面在量上差别较大
不是数量的意思,而是相同的活性官能团处于 不同的化学环境中产生的反应性差异。
O 烯烃的活性差异 CO2Me + O CH2OAc 电性差异
区域选择性和立体选择性 O CO2Me
Trans: 较小的立体位阻
有机合成反应的选择性
化学选择性 区域选择性 立体选择性
பைடு நூலகம்
1、化学选择性 (chemoselectivity)
指不使用保护或活化等策略,反应试剂对不 同的官能团或处于不同化学环境的相同官能 团进行选择性反应 一个官能团在同一反应体系中可能生成不同 官能团产物的控制情况
O O OC2H5 O O OC2H5 LiAlH4 NaBH4
第二章 有机合成设计 基础知识
有机合成的基本知识
什么是有机合成? 将结构简单、价格低廉的原料(单质、 简单的无机物或有机物),通过一系列有机 反应转化成结构复杂的有机物的过程,称为 有机合成。
A) 在实验室中仿造自然界中已存在的化学物质,同 时在分子结构上能够验证。 B)依据物质分子的结构与性质,合成一些自然界 中不存在的新物质。 C)设计和合成预期有优异性能的或具有重大意义 的化合物。
O 1 eq. NaBH4 O O 1 eq B2H6 70% O HO O O OH
醛、酮之间也可选择性反应。在一般条件下,醛基 的活性要稍高些,通常优先发生反应。但某些情况 也可获得相反的选择性,即酮也可以优先反应。
O CHO TMSCl, Ni2B DMF-Diglyme rt, 95%
OH COOMe CHO NaBH4, CeCl3 EtOH, H2O CHO COOMe
第三种方法是使用化学计量的手性辅助剂 (Chiral auxiliary),单一构型的对映异构 体能够控制一步或多步反应的立体化学。一 但手性辅助剂达到目的,能够从分子中除掉。 第四种方法是使用手性催化剂来创造一个或 多个立体中心。如果手性催化剂效率足够高, 完全可以得到单一对映异构体。
