高三化学原电池PPT优秀课件
合集下载
人教版高中化学选修四4.1《原电池》课件 (共22张PPT)

(1)把氧化反应和还原反应分开在不同区域进行,再以 适当方式连接,可以获得电流。
①在这类电池中,用还原性较强的物质作为负极,负极向 外电路提供电子;用氧化性较强的物质作为正极,正极从 外电路得到电子。 ②在原电池的内部,两极浸在电解质溶液中,并通过阴阳 离子的定向运动而形成内电路。
练习:锌铜原电池产生电流时,阳离子( B ) A 移向Zn 极,阴离子移向Cu 极 B 移向Cu 极,阴离子移向Zn 极 C 和阴离子都移向Zn极 D 和阴离子都移向Cu 极
宏观判断:
①根据电极材料 ②根据原电池电极发生 的反应
较不活泼的电极材料 ——正极 发生氧化反应的极 ——负极
发生还原反应的极 ——正极 质量增加的电极 ——正极
工作后
③根据电极增重还是减重
质量减少的电极 ——负极
8
④根据电极有气泡冒出:工作后,有气泡冒出的电极为正极
锌铜原电池工作原理
9
一、对锌铜原电 池工作原理的进一步探究
Zn Cu
Zn
Zn
Fe
Cu
Fe
Cu
A
V H SO
2
B
Hale Waihona Puke XH 2 SO 4
Zn Cu
C
4
XNaCl溶液 XNaCl溶液
Cu
Zn Cu
D
E
X
F
酒精
G
H 2S O 4
V
X H SO
2
4
H2SO4
7
三、原电池的正负极的判断方法 微观判断
(根据电子流动方向)
电子流出的极 电子流入的极
较活泼的电极材料
——负极
——正极 ——负极
第四章 电化学基础
①在这类电池中,用还原性较强的物质作为负极,负极向 外电路提供电子;用氧化性较强的物质作为正极,正极从 外电路得到电子。 ②在原电池的内部,两极浸在电解质溶液中,并通过阴阳 离子的定向运动而形成内电路。
练习:锌铜原电池产生电流时,阳离子( B ) A 移向Zn 极,阴离子移向Cu 极 B 移向Cu 极,阴离子移向Zn 极 C 和阴离子都移向Zn极 D 和阴离子都移向Cu 极
宏观判断:
①根据电极材料 ②根据原电池电极发生 的反应
较不活泼的电极材料 ——正极 发生氧化反应的极 ——负极
发生还原反应的极 ——正极 质量增加的电极 ——正极
工作后
③根据电极增重还是减重
质量减少的电极 ——负极
8
④根据电极有气泡冒出:工作后,有气泡冒出的电极为正极
锌铜原电池工作原理
9
一、对锌铜原电 池工作原理的进一步探究
Zn Cu
Zn
Zn
Fe
Cu
Fe
Cu
A
V H SO
2
B
Hale Waihona Puke XH 2 SO 4
Zn Cu
C
4
XNaCl溶液 XNaCl溶液
Cu
Zn Cu
D
E
X
F
酒精
G
H 2S O 4
V
X H SO
2
4
H2SO4
7
三、原电池的正负极的判断方法 微观判断
(根据电子流动方向)
电子流出的极 电子流入的极
较活泼的电极材料
——负极
——正极 ——负极
第四章 电化学基础
《原电池》PPT课件

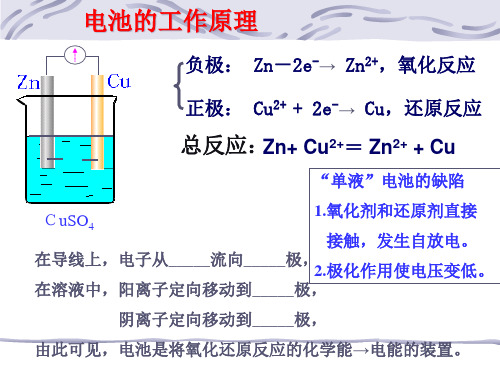
Cu2++2e- =Cu 内电路
2e-
电极反应总式: Zn + Cu2+ = Zn2+ + Cu 原电池反应本质:化学能 氧化还原反应 电能
6、原电池的设计
(1)电解质溶液一般要能够与负极发生反应。但若是两个半反 应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应 与电极材料具有相同的阳离子。
Fe3+被还原 C. 电流计读数为零时,反应达到
化学平衡状态 D. 电流计读数为零后,在甲中溶
入FeCl2固体,乙中石墨电极为负极
7、原电池的表示方法:
(-) Zn|Zn2+ (C1) ‖ Cu2+ (C2)|Cu (+)
“|”表示液-固相有一界面;“‖”表示盐桥。 在有气体参加的电池中还要表明气体的压力,
(2)银电极为电池的 正 极,
发生的电极反应为
;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 X 电极
流向 Ag 电极。
3.控制适合的条件,将反应2Fe3++2I-
⇌ 2Fe2++I2 设计成如右图所示的原 电池。下列判断不正确的是 D
A. 反应开始时,乙中石墨电极上 发生氧化反应
B. 反应开始时,甲中石墨电极上
CuSO4 溶液
思考:如何才能得到持续稳定的电流?
实验探究
在原有实验基础上进行改进,设计成一个能 产生持续稳定电流的原电池。
导线
锌铜原电池装置示意图
装置特点:
由两个半电池组成,锌 和锌盐组成锌半电池,铜和 铜盐组成铜半电池;每个半 电池中的电极与电解质溶液 互不反应,中间通过盐桥连接 形成闭合回路。
化学选修《原电池》PPT课件
(2)原电池中,电极材料可能与电解质反应,也可能 与电解质不反应。 (3)形成闭合回路的方式有多种,可以是导线连接,也 可以直接连接。
(4)有的原电池产生电流大,可以对外做功;有的原电池, 电极上发生的反应极慢,产生的电流及其微弱,不能对外 做功。
5.定向移动方向:电子、离子
“负极给出电子,并流向正极”
A.Mg
B.Fe
C.Al
D.Cu
2.由铜锌和稀硫酸组成的原电池工作时,电解质
溶液的 pH( C )
A.不变
B.先变大后变小
C.逐渐变大
D.逐渐变小
例3.市场上出售的“热敷袋”,其主要成分是: 铁屑、炭粉、木屑与少量NaCl、水等。它在使 用之前,需要塑料袋与空气隔绝。使用时开启 塑料袋上的小孔,轻轻揉搓就会有热量放出。 当使用完后还会发现有铁锈生成。
必发生 失电子
的 氧化反应 原电池
必发生 得电子
的 还原反应
例1. 下列哪几个装置能形成原电池?
Zn Cu
Fe Cu
Zn Zn
Fe
Cu
√A
√B
C
√D
H2SO4
H2SO4
H2SO4
NaCl溶液
Zn Cu Zn Cu
Fe
Cu
Zn
Cu
√E
F
M
N
Cu2SSOO44
酒精
NaCl溶液
H2SO4 H2SO4
例2. 在盛有稀H2SO4的烧杯中放入用导 线连接的锌片和铜片,下列叙述正确
(1) 热敷袋使用时,为什么会放出热量?
(2)碳粉的主要作用是什么?氯化钠又起了什 么作用? (3)试写出有关的电极反应式和化学方程式。
(1) 热敷袋使用时,为什么会放出热量?
(4)有的原电池产生电流大,可以对外做功;有的原电池, 电极上发生的反应极慢,产生的电流及其微弱,不能对外 做功。
5.定向移动方向:电子、离子
“负极给出电子,并流向正极”
A.Mg
B.Fe
C.Al
D.Cu
2.由铜锌和稀硫酸组成的原电池工作时,电解质
溶液的 pH( C )
A.不变
B.先变大后变小
C.逐渐变大
D.逐渐变小
例3.市场上出售的“热敷袋”,其主要成分是: 铁屑、炭粉、木屑与少量NaCl、水等。它在使 用之前,需要塑料袋与空气隔绝。使用时开启 塑料袋上的小孔,轻轻揉搓就会有热量放出。 当使用完后还会发现有铁锈生成。
必发生 失电子
的 氧化反应 原电池
必发生 得电子
的 还原反应
例1. 下列哪几个装置能形成原电池?
Zn Cu
Fe Cu
Zn Zn
Fe
Cu
√A
√B
C
√D
H2SO4
H2SO4
H2SO4
NaCl溶液
Zn Cu Zn Cu
Fe
Cu
Zn
Cu
√E
F
M
N
Cu2SSOO44
酒精
NaCl溶液
H2SO4 H2SO4
例2. 在盛有稀H2SO4的烧杯中放入用导 线连接的锌片和铜片,下列叙述正确
(1) 热敷袋使用时,为什么会放出热量?
(2)碳粉的主要作用是什么?氯化钠又起了什 么作用? (3)试写出有关的电极反应式和化学方程式。
(1) 热敷袋使用时,为什么会放出热量?
高中化学《41原电池》66页PPT

B Cu Fe
稀盐酸
C Ag Zn 硝酸银溶液
D Zn Fe 硫酸亚铁溶液
思考:这个装置能否构成原电池?
Zn A
Cu
ZnSO4 CuSO4
Zn A
Cu
Zn A
Cu
ZnSO4 CuSO4
ZnSO4 CuSO4
Zn A
Cu
Zn A
Cu
ZnSO4 CuSO4
ZnSO4 CuSO4
盐桥
什么是盐桥?
什么是盐桥?
负极材料本身被腐蚀
正极(铜片): 2H++2e- =H2↑(得电子,发生还原反应)
一般为溶液中易得电子的离子发生反应, 正极材料被保护,不被腐蚀。
3. 电极反应
负极(锌片): Zn-2e- =Zn2+ (失电子,发生氧化反应)
负极材料本身被腐蚀
正极(铜片): 2H++2e- =H2↑(得电子,发生还原反应)
(3)两极相连形成闭合电路 (4)能自发的发生氧化还原反应
3. 电极反应
3. 电极反应
负极(锌片):
3. 电极反应
负极(锌片): Zn-2e- =Zn2+ (失电子,发生氧化反应)
3. 电极反应
负极(锌片): Zn-2e- =Zn2+ (失电子,发生氧化反应)
负极材料本身被腐蚀
3. 电极反应
M
P
N
MN
P
A Zn Cu 稀硫酸溶液
B Cu Fe
稀盐酸
C Ag Zn 硝酸银溶液
D Zn Fe 硫酸亚铁溶液
3. 如下图所示的装置的中,观察到电流计指正偏 转,M棒变粗,N棒变细,并测得电解质溶液的质 量减小,由此判断下表中所列M、N、P物质,
高中化学第四章第一节原电池课件新人教选修4.ppt

Zn+Cu2+===Zn2++Cu
二、原电池的设计 从理论上讲,能自发进行的氧化还原反应均可以设计成原 电池,实际设计时应注意以下几点: 1.外电路 负极( 还原性 较强的物质)――e-→正极( 氧化性 较强的物质)
导线 2.内电路 将两电极浸入 电解质溶液 中,阴、阳离子作定向运动 。
3.闭合回路
1.判断正误(正确打“√”号,错误打“×”号)。
(1)原电池是把化学能转化为电能的一种装置。( )
(2)原电池正极发生氧化反应,负极发生还原反应。
()
(3)不能自发进行的氧化还原反应,通过原电池装置可
以实现。
()
(4)碳棒不能用来作原电池的电极。
()
(5)反应Cu+2Ag+===2Ag+Cu2+能以原电池的形
[解析] 本题考查原电池原理及化学平衡,难度较大, 根据所给原电池的反应原理可知,Fe3+在正极发生还原 反应,甲池中存在Fe3+,故A错误;乙池为负极,失电 子的物质是I-,B错误;此反应是可逆反应,电流计的 读数为零时说明反应处于平衡状态,但c(Fe3+)≠0,故C 正确,D项错误。
[答案] C
设计原电池有以下三个关键点: (1)电解质溶液:一般能与负极反应或者溶解在溶 液中的物质(如O2)与负极反应。 (2)电极材料:一般较活泼的金属作负极,较不活 泼的金属或导电的非金属作正极。 (3)若是两个半反应分别在两个烧杯中进行,则负 极中的电解质溶液应有与电极材料相同的阳离子。
点击下图进入“课 堂10分钟练习”
[例2] (2012·金华十校期末考试)控制适合的条件,
KI溶液过量,将反应2Fe3++2I-
2Fe2++I2设计
成如下图所示的原电池。下列判断正确的是 ( )
《原电池》教学PPT课件高中化学优质课

《原电池》教学PPT课件高 中化学优质课
目 录
• 课程介绍与背景 • 原电池基本原理 • 原电池类型与特点 • 原电池性能参数与评价标准 • 原电池应用领域与前景展望 • 实验设计与操作演示 • 课程总结与拓展延伸
01
课程介绍与背景
高中化学课程目标
掌握化学基本概念和原理
拓展化学视野
通过本课程的学习,学生应能熟练掌 握化学基本概念、原理和规律,为后 续学习奠定坚实基础。
优点,但能量密度较低。
碱性锌锰电池
在锌锰电池的基础上,采用氢氧 化钾作为电解质,提高了电池的
能量密度和放电性能。
锂原电池
以金属锂或其合金为负极,使用 非水电解质溶液的电池。具有比 能量高、放电电压平稳、工作温 度范围宽等优点,但成本较高。
充电式原电池
铅酸蓄电池 以铅为负极,二氧化铅为正极,硫酸为电解质。具有技术 成熟、成本低廉等优点,但能量密度较低,且充电时间较 长。
原电池的电极反应和电池反应
原电池的应用和发展前景
详细讲解原电池的电极反应和电池反应,包 括氧化还原反应、离子迁移等过程。
介绍原电池在日常生活、工业生产、能源利 用等领域的应用,以及未来发展趋势和前景。
02
原电池基本原理
原电池定义及组成
原电池定义
将化学能转变为电能的装 置。
原电池组成
正极、负极、电解质溶液、 导线。
大小决定了电池能够提供的驱动力大小,影响电池的使用效果。
02 03
电流
原电池的电流是指在单位时间内通过导体横截面的电荷量,通常用安培 (A)表示。电流大小决定了电池输出功率的大小,影响电池的使用时 间。
容量
原电池的容量是指电池在一定条件下所能放出的电量,通常用安时 (Ah)表示。容量大小决定了电池能够持续供电的时间长短。
目 录
• 课程介绍与背景 • 原电池基本原理 • 原电池类型与特点 • 原电池性能参数与评价标准 • 原电池应用领域与前景展望 • 实验设计与操作演示 • 课程总结与拓展延伸
01
课程介绍与背景
高中化学课程目标
掌握化学基本概念和原理
拓展化学视野
通过本课程的学习,学生应能熟练掌 握化学基本概念、原理和规律,为后 续学习奠定坚实基础。
优点,但能量密度较低。
碱性锌锰电池
在锌锰电池的基础上,采用氢氧 化钾作为电解质,提高了电池的
能量密度和放电性能。
锂原电池
以金属锂或其合金为负极,使用 非水电解质溶液的电池。具有比 能量高、放电电压平稳、工作温 度范围宽等优点,但成本较高。
充电式原电池
铅酸蓄电池 以铅为负极,二氧化铅为正极,硫酸为电解质。具有技术 成熟、成本低廉等优点,但能量密度较低,且充电时间较 长。
原电池的电极反应和电池反应
原电池的应用和发展前景
详细讲解原电池的电极反应和电池反应,包 括氧化还原反应、离子迁移等过程。
介绍原电池在日常生活、工业生产、能源利 用等领域的应用,以及未来发展趋势和前景。
02
原电池基本原理
原电池定义及组成
原电池定义
将化学能转变为电能的装 置。
原电池组成
正极、负极、电解质溶液、 导线。
大小决定了电池能够提供的驱动力大小,影响电池的使用效果。
02 03
电流
原电池的电流是指在单位时间内通过导体横截面的电荷量,通常用安培 (A)表示。电流大小决定了电池输出功率的大小,影响电池的使用时 间。
容量
原电池的容量是指电池在一定条件下所能放出的电量,通常用安时 (Ah)表示。容量大小决定了电池能够持续供电的时间长短。
高三化学复习原电池课件 (共26张PPT)

高三复习 原电池
1
2
CuCl2
ZnCl2
3
一、复习原电池的相关知识
1、概念。 2、实质。 3、构成条件。 4、电子和电流的移动方向。 5、阴阳离子定向移动的方向。 6、原电池正负极的判断方法。 7、原电池原理的应用。
4
原电池正负极的判断方法
5
6
原电池原理的应用
1、加快氧化还原反应的速率。 2、寻求和制造干电池和蓄电池等化学电源。 3、比较金属活动性强弱。 4、用于金属的防护。 5、设计化学电源。 (1)、分析氧化还原反应,找出正负电极反应式。 (2)、确定电极材料。 (3)、确定电解质溶液。 (4)、构成闭合回路。
(2)燃料电池的正极(O2作氧化剂) 反应式一般为: ①酸性条件:O2+4e-+4H+===2H2O ②碱性或中性条件:O2+4e-+ 2H2O===4OH- ③高温无水固体电解质:O2+4e-===2O2-
23
(2)甲烷-氧燃料电池
该电池用金属铂片插入KOH溶液中作电极,又 在两极上分别通甲烷和氧气: 负极:CH4 + 10OH- - 8e- = CO32- + 7H2O 正极:2O2 + 4H2O + 8e- = 8OH电池总反应式为:CH4+2O2+2KOH =K2CO3+3H2O
优点:比能量和储存时间有所提高,适用于大电流和连续放电 缺点:多数只能一次使用,不能充电;价格较贵
14
(2)锌银电池:
锌银电池的负极是Zn,正极是Ag2O,电解质是KOH,
电极方程式:
负极: Zn + 2OH- -2e- = Zn(OH)2 正极: Ag2O + H2O + 2e- =2Ag + 2OH-
1
2
CuCl2
ZnCl2
3
一、复习原电池的相关知识
1、概念。 2、实质。 3、构成条件。 4、电子和电流的移动方向。 5、阴阳离子定向移动的方向。 6、原电池正负极的判断方法。 7、原电池原理的应用。
4
原电池正负极的判断方法
5
6
原电池原理的应用
1、加快氧化还原反应的速率。 2、寻求和制造干电池和蓄电池等化学电源。 3、比较金属活动性强弱。 4、用于金属的防护。 5、设计化学电源。 (1)、分析氧化还原反应,找出正负电极反应式。 (2)、确定电极材料。 (3)、确定电解质溶液。 (4)、构成闭合回路。
(2)燃料电池的正极(O2作氧化剂) 反应式一般为: ①酸性条件:O2+4e-+4H+===2H2O ②碱性或中性条件:O2+4e-+ 2H2O===4OH- ③高温无水固体电解质:O2+4e-===2O2-
23
(2)甲烷-氧燃料电池
该电池用金属铂片插入KOH溶液中作电极,又 在两极上分别通甲烷和氧气: 负极:CH4 + 10OH- - 8e- = CO32- + 7H2O 正极:2O2 + 4H2O + 8e- = 8OH电池总反应式为:CH4+2O2+2KOH =K2CO3+3H2O
优点:比能量和储存时间有所提高,适用于大电流和连续放电 缺点:多数只能一次使用,不能充电;价格较贵
14
(2)锌银电池:
锌银电池的负极是Zn,正极是Ag2O,电解质是KOH,
电极方程式:
负极: Zn + 2OH- -2e- = Zn(OH)2 正极: Ag2O + H2O + 2e- =2Ag + 2OH-
高三一轮复习原电池的工作原理PPT课件
•
X电极上发生的电极反应为________。
三、金属的腐蚀与防护
钢铁生锈
Cu2(OH)2CO
3
铜器表面生成铜绿
一、金属的腐蚀:
1. 含义:
金属或合金与周围接触到的气体或液体发生 反应而氧损化耗还的原现象。
2. 本质:
金属单质失电子被氧化成阳离子
M – ne→Mn+
3、金属腐蚀的类型: (1)化学腐蚀
阴离子定向移动到_____极,
由此可见,电池是将氧化还原反应的化学能→电能的装置。
双液电池
盐桥制法: 1)将热的琼胶溶液倒入U形管中,
将冷却后的U形管浸泡在KCl 饱和溶液中即可。 2)将KCl饱和溶液装入U形管, 用棉花堵住管口即可。
盐桥的作用:
1)避免氧化剂和还还剂直接接触 2)连通原电池的内电路 3)平衡溶液中的离子电荷
• 依据氧化还原反应: • 2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s) • 设计的原电池如图所示:
A
盐桥 电流计
X
Ag
• 请回答下列问题: CuSO4溶液
Y
• (1)电极X的材料是________;电解质溶液Y是_______。
• (2)银电极为电池的________;
[交流研讨]
你知道自行车的金属部件采用了什么样的防护措施吗?
烤蓝
烤漆
镀铬
涂机油 涂凡士林
镀锌
写在最后
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量 Study Constantly, And You Will Know Everything. The More
You Know, The More Powerful You Will Be
高考化学总复习课件:6-2原电池 (共17张PPT)

第二节 原电池原理及其应用
Cu-Zn原电池原理示意图
e- G e-
-+
H2SO4
Zn
Cu
H2
2+
+
Zn
H
一、原电池的定义
化学能转化为电能的 装置。
二、原电池的实质
氧化还原反应中,还原剂失去的电 子经导体传递给氧化剂,使氧化还原反 应在两极上发生。
三、原电池的组成条件
1、电极材料:活动性不同的金属或金属 和其他导体。 2、两电极必须插入电解质溶液。 3、必须构成回路。
五、化学电源
Zn-Mn干电池
e-
+
e-
C棒
MnO2 、NH4Cl
C
Zn
氢氧燃料电池
A
2e -
2e -
氢气
H+ OH-
氧气
H+ OH-
H2O
负极
正极
六、电化腐蚀
钢铁的电化学腐蚀(一)
(吸氧腐蚀)
2+
Fe
O2 OH -
Fe 2e-
C
钢铁的电化学腐蚀(二)
(析氢腐蚀)
Fe2+ H + H2
Fe 2e-
3、Zn-Mn干电池
负极:Zn – 2e-
2+
= Zn
正极:2MnO2+2NH4+ +2e- = 2NH3 + H2O+Mn2O3
总反应式:Zn+2MnO2+2NH4+=Zn2++2NH3 +H2O+Mn2O3
4、氢氧燃料电池 负极:2H2 – 4e- = 4H + 正极:O2 +4e- +2H2O = 4OH-
Cu-Zn原电池原理示意图
e- G e-
-+
H2SO4
Zn
Cu
H2
2+
+
Zn
H
一、原电池的定义
化学能转化为电能的 装置。
二、原电池的实质
氧化还原反应中,还原剂失去的电 子经导体传递给氧化剂,使氧化还原反 应在两极上发生。
三、原电池的组成条件
1、电极材料:活动性不同的金属或金属 和其他导体。 2、两电极必须插入电解质溶液。 3、必须构成回路。
五、化学电源
Zn-Mn干电池
e-
+
e-
C棒
MnO2 、NH4Cl
C
Zn
氢氧燃料电池
A
2e -
2e -
氢气
H+ OH-
氧气
H+ OH-
H2O
负极
正极
六、电化腐蚀
钢铁的电化学腐蚀(一)
(吸氧腐蚀)
2+
Fe
O2 OH -
Fe 2e-
C
钢铁的电化学腐蚀(二)
(析氢腐蚀)
Fe2+ H + H2
Fe 2e-
3、Zn-Mn干电池
负极:Zn – 2e-
2+
= Zn
正极:2MnO2+2NH4+ +2e- = 2NH3 + H2O+Mn2O3
总反应式:Zn+2MnO2+2NH4+=Zn2++2NH3 +H2O+Mn2O3
4、氢氧燃料电池 负极:2H2 – 4e- = 4H + 正极:O2 +4e- +2H2O = 4OH-
原电池工作原理-22张ppt精讲

一、原电池的工作原理
电子沿导线传递,
产生电流
Zn
Cu
阳离子
Zn2+ -
Cu2+
SO42-
阴离子
1.负极失电子,电子经导线 流向正极,溶液中的阳离 子在正极表面得电子。
2.电极反应 负极(Zn):Zn-2e- ====Zn2+
(氧化反应) 正极(Cu ): Cu2++2e- ==== Cu
(还原反应)
电能
能不能直接转化?
将锌粉加入CuSO4溶液中,会发生反应:Zn+Cu2+====Zn2++Cu。 该反应是放热反应,请设计实验将该反应所释放的能量转 化为电能并实施你设计的实验。画出装置图并标出名称。
试剂和仪器: CuSO4溶液,锌粉,
Zn G Cu
锌片,铜片,检流计(G),
导线,大烧杯
CuSO4溶液
4.银锌电池广泛用作各种电子仪器的电源,其充电和放电
过程可以表示为:
+2
充电
0
2Ag+ Zn(OH)2 放电 Ag2O + Zn+H2O,则电池放电时,
负极上发生反应的物质是( D )
A.Ag
B.Zn(OH)2
C.Ag2O
D. Zn
5.盐酸与锌片反应时,若加入可溶性醋酸铜〔(CH3COO)2Cu〕 固体,将产生两种影响反应速率的因素。 其一是:_Z_n_置__换__出__C_u_形__成__了__原__电__池__,__加__快__了__反__应__速__率____; 其二是:_H_+与__C_H_3_C_O_O_-_结__合__生__成__C_H_3_C_O_O_H_,__使__H_+_浓__度__减__小__,____ _从___________________。 而减慢了反应速率
高中化学:原电池课件

燃料电池的优点是能量密度高,效率高,但缺点是需要持 续供应燃料和氧化剂。
太阳能电池
太阳能电池是一种利用太阳能产生电 能的装置。它通常由多个光伏电池组 成,可以将太阳能转化为直流电。
太阳能电池的优点是环保、可再生、 无噪音、无污染,但缺点是成本较高 ,受天气影响较大。
03
原电池的应用
日常生活中的应用
原电池的工作原理
当原电池中的电极和电解质溶液接触 时,会发生氧化还原反应,即电子从 负极流向正极,形成电流。
负极上的物质失去电子,发生氧化反 应;正极上的物质得到电子,发生还 原反应。
原电池的组成
负极
通常由金属或金属氧化 物制成,负责提供电子
。
正极
通常也是由金属或金属 氧化物制成,负责接收
电子。
电动汽车
电动汽车的发展需要高性能的电池支持 ,原电池是电动汽车的主要动力来源。
VS
风能与太阳能储存
原电池可以用于储存风能和太阳能发电产 生的电能,解决可再生能源不稳定的缺点 。
原电池技术的未来发展方向
提高能量密度
提高原电池的能量密度是未来发 展的重要方向,可以延长电动汽
车的续航里程。
降低成本
降低原电池的成本可以扩大其应 用范围,使其更广泛地应用于电 动汽车和可再生能源储存领域。
二次电池
二次电池是一种可以充电的电池,也称为可充电电池。它们 通常由多个电极和电解质组成,可以通过充电和放电反复使 用。
二次电池的优点是可以反复使用,减少了对环境的污染,但 缺点是价格较高,需要定期维护和充电。
燃料电池
燃料电池是一种将燃料中的化学能转化为电能的装置。它 通常由一个负极和一个正极组成,通过燃料和氧化剂的反 应产生电流。
太阳能电池
太阳能电池是一种利用太阳能产生电 能的装置。它通常由多个光伏电池组 成,可以将太阳能转化为直流电。
太阳能电池的优点是环保、可再生、 无噪音、无污染,但缺点是成本较高 ,受天气影响较大。
03
原电池的应用
日常生活中的应用
原电池的工作原理
当原电池中的电极和电解质溶液接触 时,会发生氧化还原反应,即电子从 负极流向正极,形成电流。
负极上的物质失去电子,发生氧化反 应;正极上的物质得到电子,发生还 原反应。
原电池的组成
负极
通常由金属或金属氧化 物制成,负责提供电子
。
正极
通常也是由金属或金属 氧化物制成,负责接收
电子。
电动汽车
电动汽车的发展需要高性能的电池支持 ,原电池是电动汽车的主要动力来源。
VS
风能与太阳能储存
原电池可以用于储存风能和太阳能发电产 生的电能,解决可再生能源不稳定的缺点 。
原电池技术的未来发展方向
提高能量密度
提高原电池的能量密度是未来发 展的重要方向,可以延长电动汽
车的续航里程。
降低成本
降低原电池的成本可以扩大其应 用范围,使其更广泛地应用于电 动汽车和可再生能源储存领域。
二次电池
二次电池是一种可以充电的电池,也称为可充电电池。它们 通常由多个电极和电解质组成,可以通过充电和放电反复使 用。
二次电池的优点是可以反复使用,减少了对环境的污染,但 缺点是价格较高,需要定期维护和充电。
燃料电池
燃料电池是一种将燃料中的化学能转化为电能的装置。它 通常由一个负极和一个正极组成,通过燃料和氧化剂的反 应产生电流。
高中化学原电池公开课ppt课件(人教版化学选修4)

由两个半电池组成原电池的工作原理
(1)把氧化反应和还原反应分开在不同区域进行,再以 适当方式连接,可以获得电流。 ①在这类电池中,用还原性较强的物质作为负极,负极向 外电路提供电子;用氧化性较强的物质作为正极,正极从 外电路得到电子。 ②在原电池的内部,两极浸在电解质溶液中,并通过阴阳 离子的定向运动而形成内电路。 ③用导线和盐桥分别将两个半电池连接在一起
(2)探究组成原电池的条件
设计盐桥原电池的思路:
Zn+2Ag+=Zn2++2Ag 还原剂和氧化产物为负极的
半电池
氧化剂和还原产物为正极的
半电池
根据电极反应确定合适的电极材料
和电解质溶液
外电路用导线连通,可以接用电器 内电路是将电极浸入电解质溶液中,
并通过盐桥沟通内电路
小结
能产生稳定、持续电流的原电 池应具备什么条件?
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移, 阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的 电中性,因而放电作用不间断地进行,一直到锌片全部溶解或 CuSO4溶液 中的 Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可 用NH4NO3代替KCl作盐桥。
3.离子流向:阴离子 负极,阳离子 正极
-
+ Cu-Zn原电池工作原理
Zn
ee-
Cu 负极:(氧化反应)
锌片:Zn-2e-=Zn2+
正极:(还原反应)
铜片:2H++2e-=H2↑
H+
Zn2+
总反应:
H+
Zn+2H+=Zn2++H2↑
原电池课件(含精美图片)

总反应式: 2Fe+ 2H2O + O2 =2 Fe(OH)2
第二十第七二页十,七共页41页。
第二十八第页二十,八页共41页。
用途广泛的电池
用于“神六”的太阳能电池
笔记本电脑专用电池
手机专用电池
各式各样的纽扣电池
摄像机专用电池
第二十第九二页十,九共页41页。
用于汽车的铅蓄电池和燃料电池
第三十第页三,十共页41页。
18世纪末意大利生物学家伽伐尼在解剖青蛙时, 偶然发现若将两种不同金属的手术刀接触,蛙腿 就会抽搐。大名鼎鼎的伏特认为这是金属与蛙腿 组织液(电解质溶液)之间产生的电流刺激造成 的。1799年,伏特据此设计出第一个电池―― 伏打电池:锌为负极,银为正极,用盐水作电解 质溶液。1836年,丹尼尔发明了世界上第一个 实用电池,曾用于铁路信号灯的电源。1801年, 拿破仑亲自接见了伏特,给予伏特极高的评价。
第七页第,七共页41页。
电极 材料
Zn片
现象 电子 得失
Zn片 溶解
失
电极反应
Zn-2e-= Zn2+
原电池的 电极
负极
Cu片 有气 体产 生
得 2H++ 2e-= H2↑
正极
总的离子反应方程式 Zn+ 2H+ = Zn2+ + H2↑
第八页,第八共页41页。
⑴原 电 池 原 理
பைடு நூலகம்
必发生
失电子
的 氧化反应
第十九第页十,九共页41页。
通过新型电池(锂电池、燃料电池)体科学 的发展性
锂离子电池
第二十页第二,十共页41页。
燃料电池
干电池
碱性电池
第二十第七二页十,七共页41页。
第二十八第页二十,八页共41页。
用途广泛的电池
用于“神六”的太阳能电池
笔记本电脑专用电池
手机专用电池
各式各样的纽扣电池
摄像机专用电池
第二十第九二页十,九共页41页。
用于汽车的铅蓄电池和燃料电池
第三十第页三,十共页41页。
18世纪末意大利生物学家伽伐尼在解剖青蛙时, 偶然发现若将两种不同金属的手术刀接触,蛙腿 就会抽搐。大名鼎鼎的伏特认为这是金属与蛙腿 组织液(电解质溶液)之间产生的电流刺激造成 的。1799年,伏特据此设计出第一个电池―― 伏打电池:锌为负极,银为正极,用盐水作电解 质溶液。1836年,丹尼尔发明了世界上第一个 实用电池,曾用于铁路信号灯的电源。1801年, 拿破仑亲自接见了伏特,给予伏特极高的评价。
第七页第,七共页41页。
电极 材料
Zn片
现象 电子 得失
Zn片 溶解
失
电极反应
Zn-2e-= Zn2+
原电池的 电极
负极
Cu片 有气 体产 生
得 2H++ 2e-= H2↑
正极
总的离子反应方程式 Zn+ 2H+ = Zn2+ + H2↑
第八页,第八共页41页。
⑴原 电 池 原 理
பைடு நூலகம்
必发生
失电子
的 氧化反应
第十九第页十,九共页41页。
通过新型电池(锂电池、燃料电池)体科学 的发展性
锂离子电池
第二十页第二,十共页41页。
燃料电池
干电池
碱性电池
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
负极: Fe 正极: 比Fe不活泼的金属或石墨 电解质溶液: CuSO4 、CuCl2等
练一练
X、Y、Z都是金属,把X浸入Z的硝 酸盐溶液中,X的表面有Z析出,X 与Y组成原电池时,Y为电池的负极。 X、Y、Z三种金属的活动性顺序为
A.X>Y>Z B.X>Z>Y
CC..YY>>XX>>Z D.Y>Z>X Z
原电池原理 及其应用
第一课时
实验步骤
现象
锌片上有气泡
结论或解释
锌与稀硫酸反应
铜片上无气泡 铜与硫酸不反应
Cu
铜片上有气泡
?
思考:
1.铜片上的气体是什么? 2.氢元素原来以什么形式存在? 3. 从电子得失的角度分析,H+如 何
转变成氢气?
讨论:
1. 电子从何而来? 2. H+为何不直接在锌片上 得电子而在铜片上得电子?
②电极材料均插入电解质溶液中 ③两极相连形成闭合电路
未构成闭合回路
负极(锌片): Zn -2e - = Zn 2+ 正极(石墨): 2H++2e - = H2 ↑
负极(锌片): Zn -2e - = Zn 2+ 正极(铜片): Cu2+ + 2e - = Cu
请将氧化还原反应:Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。
实验步骤
现象
结论或解释
电流计指针偏转
导线中有 电流通过
测干电池时,电流计指
针偏向正极方向
测铜锌原电池时,电流
计指针偏向 铜片方向
锌片为负极 铜片为正极
下列哪些装置能构成原电池?自己动手做一做。
Zn Cu
A
B
√C
√D
Zn
Cu
水果
E
F
√G
组成原电池的条件
①有两种活动性不同的金属(或 一种是非金属导体)作电极
THANKS
FOR WATCHING
演讲人: XXX
PPT文档·教学课件
练一练
X、Y、Z都是金属,把X浸入Z的硝 酸盐溶液中,X的表面有Z析出,X 与Y组成原电池时,Y为电池的负极。 X、Y、Z三种金属的活动性顺序为
A.X>Y>Z B.X>Z>Y
CC..YY>>XX>>Z D.Y>Z>X Z
原电池原理 及其应用
第一课时
实验步骤
现象
锌片上有气泡
结论或解释
锌与稀硫酸反应
铜片上无气泡 铜与硫酸不反应
Cu
铜片上有气泡
?
思考:
1.铜片上的气体是什么? 2.氢元素原来以什么形式存在? 3. 从电子得失的角度分析,H+如 何
转变成氢气?
讨论:
1. 电子从何而来? 2. H+为何不直接在锌片上 得电子而在铜片上得电子?
②电极材料均插入电解质溶液中 ③两极相连形成闭合电路
未构成闭合回路
负极(锌片): Zn -2e - = Zn 2+ 正极(石墨): 2H++2e - = H2 ↑
负极(锌片): Zn -2e - = Zn 2+ 正极(铜片): Cu2+ + 2e - = Cu
请将氧化还原反应:Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。
实验步骤
现象
结论或解释
电流计指针偏转
导线中有 电流通过
测干电池时,电流计指
针偏向正极方向
测铜锌原电池时,电流
计指针偏向 铜片方向
锌片为负极 铜片为正极
下列哪些装置能构成原电池?自己动手做一做。
Zn Cu
A
B
√C
√D
Zn
Cu
水果
E
F
√G
组成原电池的条件
①有两种活动性不同的金属(或 一种是非金属导体)作电极
THANKS
FOR WATCHING
演讲人: XXX
PPT文档·教学课件
