药品抽样参考数量
药品抽样参考数量
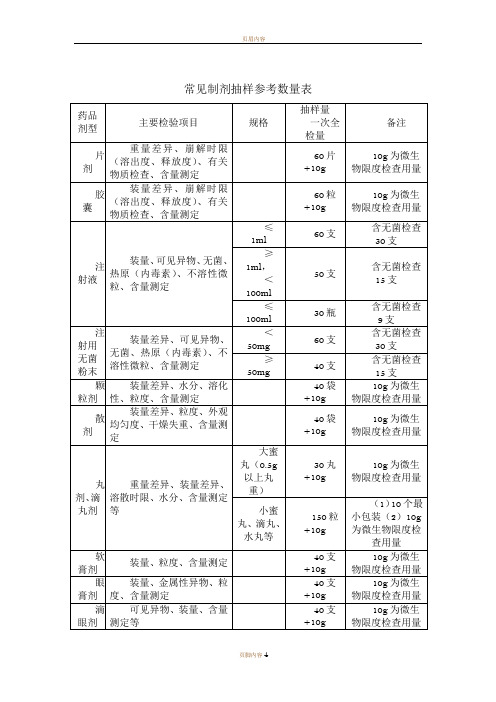
常见制剂抽样参考数量表一、以上提供的制剂抽样数量,是按《中国药典》2005版(一部、二部)收载的药品的常用剂型、类别和规格大致测算得到的,不可能准确地涵盖每个具体品种,仅供现场抽样人员参考,如有必要,应该进一步查阅药品质量标准中规定的检验用量。
二、除膏药、橡皮膏剂等少数剂型外,非灭菌制剂均需按药典规定进行“微生物限度检查”,即检查样品受微生物污染程度的方法,检查项目一般包括细菌数、霉菌数及控制菌检查等。
检验时,要求从2个以上最小包装单位中抽取供试品,一般供试品的检验量为10g或10ml(大蜜丸不得少于4丸,膜剂为50cm2,但不得少于4片),贵重药品、微量包装药品的检验量可以酌减。
含动物组织及动物类原药材粉(蜂蜜、王浆、动物角、阿胶除外)的口服给药制剂,其检验量还应再增加10g或10ml。
三、不同的药品检验项目,有关取样的规定和方法也不完全统一,有的按“体积”计,有的按“重量”计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关,抽样人员应根据样品的包装规格和含量规格进行换算。
药材取样法(《中国药典》2005版一部附录ⅡA)药材取样法系指供检验用药材样品的抽取方法。
取样时均应符合下列有关规定。
一、抽取样品前,应注意品名、产地、规格等级及包件式样是否一致,检查包装的完整性、清洁程度以及有无水迹、霉变或其他物质污染等情况,并详细记录。
凡有异常情况的包件,应单独检验。
二、从同批药材包件中抽取供检验用样品的原则:药材总包件数不足5件的,逐件取样;5~99件,随机抽5件取样;100~1000件,按5%比例取样;贵重药材,不论包件多少均逐件取样。
三、对破碎的、粉末状的或大小在1cm以下的药材,可用采样器(探子)抽取样品;每一包件至少在2~3个不同部位各取样品1份;包件大的应从10cm以下的深处在不同部位分别抽取。
每一包件的取样量:一般药材抽取100~500g;粉末状药材抽取25~50g;贵重药材抽取5~10g。
药品抽样参考数量
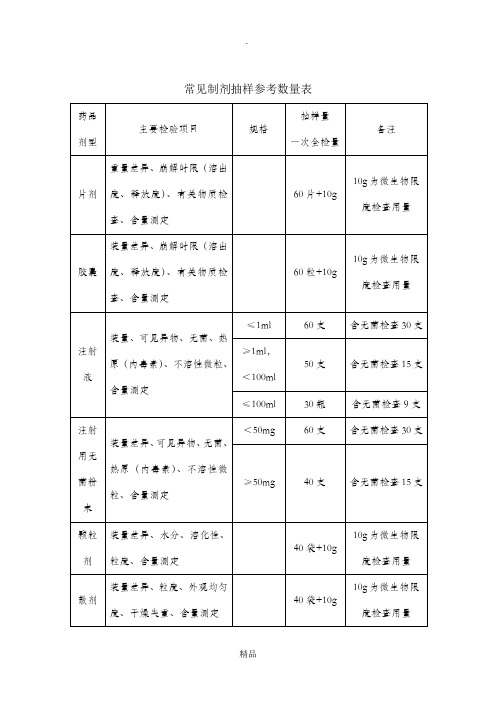
常见制剂抽样参考数量表一、以上提供的制剂抽样数量,是按《中国药典》2005版(一部、二部)收载的药品的常用剂型、类别和规格大致测算得到的,不可能准确地涵盖每个具体品种,仅供现场抽样人员参考,如有必要,应该进一步查阅药品质量标准中规定的检验用量。
二、除膏药、橡皮膏剂等少数剂型外,非灭菌制剂均需按药典规定进行“微生物限度检查”,即检查样品受微生物污染程度的方法,检查项目一般包括细菌数、霉菌数及控制菌检查等。
检验时,要求从2个以上最小包装单位中抽取供试品,一般供试品的检验量为10g或10ml(大蜜丸不得少于4丸,膜剂为50cm2,但不得少于4片),贵重药品、微量包装药品的检验量可以酌减。
含动物组织及动物类原药材粉(蜂蜜、王浆、动物角、阿胶除外)的口服给药制剂,其检验量还应再增加10g或10ml。
三、不同的药品检验项目,有关取样的规定和方法也不完全统一,有的按“体积”计,有的按“重量”计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关,抽样人员应根据样品的包装规格和含量规格进行换算。
药材取样法(《中国药典》2005版一部附录ⅡA)药材取样法系指供检验用药材样品的抽取方法。
取样时均应符合下列有关规定。
一、抽取样品前,应注意品名、产地、规格等级及包件式样是否一致,检查包装的完整性、清洁程度以及有无水迹、霉变或其他物质污染等情况,并详细记录。
凡有异常情况的包件,应单独检验。
二、从同批药材包件中抽取供检验用样品的原则:药材总包件数不足5件的,逐件取样;5~99件,随机抽5件取样;100~1000件,按5%比例取样;贵重药材,不论包件多少均逐件取样。
三、对破碎的、粉末状的或大小在1cm以下的药材,可用采样器(探子)抽取样品;每一包件至少在2~3个不同部位各取样品1份;包件大的应从10cm以下的深处在不同部位分别抽取。
每一包件的取样量:一般药材抽取100~500g;粉末状药材抽取25~50g;贵重药材抽取5~10g。
药品抽样参考数量
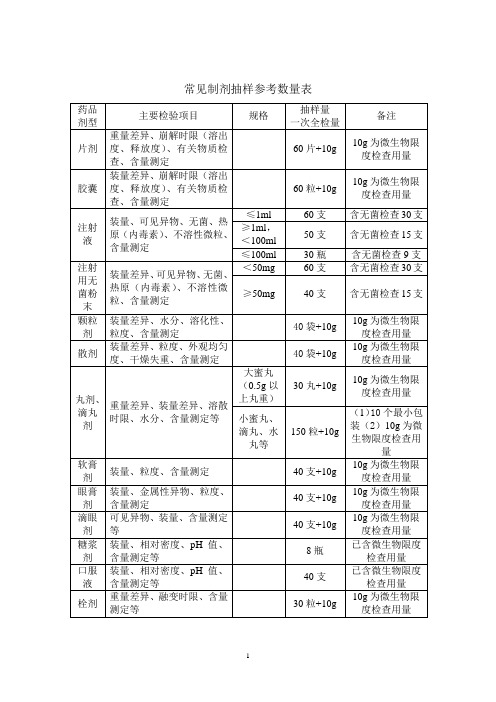
常见制剂抽样参考数量表一、以上提供的制剂抽样数量,是按《中国药典》2005版(一部、二部)收载的药品的常用剂型、类别和规格大致测算得到的,不可能准确地涵盖每个具体品种,仅供现场抽样人员参考,如有必要,应该进一步查阅药品质量标准中规定的检验用量。
二、除膏药、橡皮膏剂等少数剂型外,非灭菌制剂均需按药典规定进行“微生物限度检查”,即检查样品受微生物污染程度的方法,检查项目一般包括细菌数、霉菌数及控制菌检查等。
检验时,要求从2个以上最小包装单位中抽取供试品,一般供试品的检验量为10g或10ml(大蜜丸不得少于4丸,膜剂为50cm2,但不得少于4片),贵重药品、微量包装药品的检验量可以酌减。
含动物组织及动物类原药材粉(蜂蜜、王浆、动物角、阿胶除外)的口服给药制剂,其检验量还应再增加10g或10ml。
三、不同的药品检验项目,有关取样的规定和方法也不完全统一,有的按“体积”计,有的按“重量”计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关,抽样人员应根据样品的包装规格和含量规格进行换算。
药材取样法(《中国药典》2005版一部附录ⅡA)药材取样法系指供检验用药材样品的抽取方法。
取样时均应符合下列有关规定。
一、抽取样品前,应注意品名、产地、规格等级及包件式样是否一致,检查包装的完整性、清洁程度以及有无水迹、霉变或其他物质污染等情况,并详细记录。
凡有异常情况的包件,应单独检验。
二、从同批药材包件中抽取供检验用样品的原则:药材总包件数不足5件的,逐件取样;5~99件,随机抽5件取样;100~1000件,按5%比例取样;贵重药材,不论包件多少均逐件取样。
三、对破碎的、粉末状的或大小在1cm以下的药材,可用采样器(探子)抽取样品;每一包件至少在2~3个不同部位各取样品1份;包件大的应从10cm以下的深处在不同部位分别抽取。
每一包件的取样量:一般药材抽取100~500g;粉末状药材抽取25~50g;贵重药材抽取5~10g。
药品抽样参考数量.doc
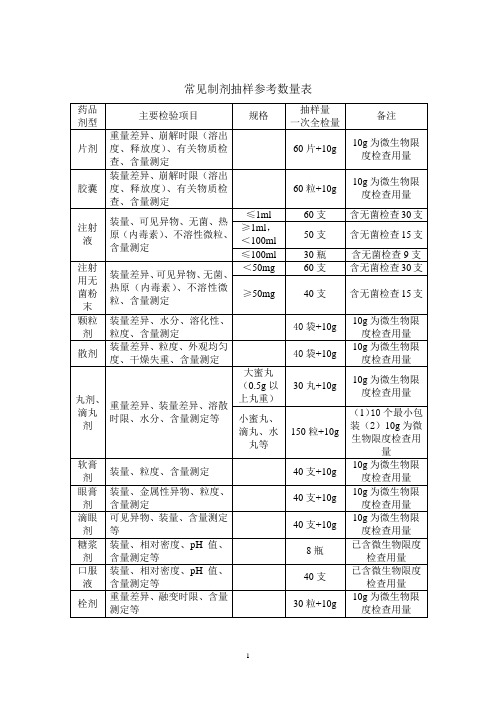
常见制剂抽样参考数量表一、以上提供的制剂抽样数量,是按《中国药典》2005版(一部、二部)收载的药品的常用剂型、类别和规格大致测算得到的,不可能准确地涵盖每个具体品种,仅供现场抽样人员参考,如有必要,应该进一步查阅药品质量标准中规定的检验用量。
二、除膏药、橡皮膏剂等少数剂型外,非灭菌制剂均需按药典规定进行“微生物限度检查”,即检查样品受微生物污染程度的方法,检查项目一般包括细菌数、霉菌数及控制菌检查等。
检验时,要求从2个以上最小包装单位中抽取供试品,一般供试品的检验量为10g或10ml(大蜜丸不得少于4丸,膜剂为50cm2,但不得少于4片),贵重药品、微量包装药品的检验量可以酌减。
含动物组织及动物类原药材粉(蜂蜜、王浆、动物角、阿胶除外)的口服给药制剂,其检验量还应再增加10g或10ml。
三、不同的药品检验项目,有关取样的规定和方法也不完全统一,有的按“体积”计,有的按“重量”计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关,抽样人员应根据样品的包装规格和含量规格进行换算。
药材取样法(《中国药典》2005版一部附录ⅡA)药材取样法系指供检验用药材样品的抽取方法。
取样时均应符合下列有关规定。
一、抽取样品前,应注意品名、产地、规格等级及包件式样是否一致,检查包装的完整性、清洁程度以及有无水迹、霉变或其他物质污染等情况,并详细记录。
凡有异常情况的包件,应单独检验。
二、从同批药材包件中抽取供检验用样品的原则:药材总包件数不足5件的,逐件取样;5~99件,随机抽5件取样;100~1000件,按5%比例取样;贵重药材,不论包件多少均逐件取样。
三、对破碎的、粉末状的或大小在1cm以下的药材,可用采样器(探子)抽取样品;每一包件至少在2~3个不同部位各取样品1份;包件大的应从10cm以下的深处在不同部位分别抽取。
每一包件的取样量:一般药材抽取100~500g;粉末状药材抽取25~50g;贵重药材抽取5~10g。
常见制剂抽样参考数量表

常见制剂抽样参考数量表
备注:
1、不同的药品检验项目,有关取样的规定和方法也不完全统一。
有的按“体积”计,有的按“重量”计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关。
本表为了能较准确地列出抽样量,故没有使用统一计量单位,在现场抽样时,抽样人员可根据品种的含量规格和包装规格进行换算,得出抽样量。
2、表中主要检验项目中,各剂型均未列入“微生物限度”检查,除注射剂、膏药、橡胶膏剂,其余剂型应根据药典规定进行“微生物限度”检查。
“微生物限度”均应至少从二个包装中取样。
药品抽样参考数量(1)
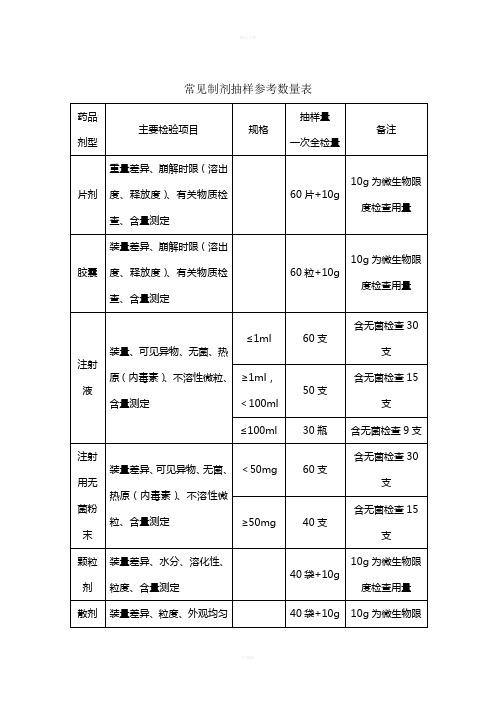
常见制剂抽样参考数量表一、以上提供的制剂抽样数量,是按《中国药典》2005版(一部、二部)收载的药品的常用剂型、类别和规格大致测算得到的,不可能准确地涵盖每个具体品种,仅供现场抽样人员参考,如有必要,应该进一步查阅药品质量标准中规定的检验用量。
二、除膏药、橡皮膏剂等少数剂型外,非灭菌制剂均需按药典规定进行“微生物限度检查”,即检查样品受微生物污染程度的方法,检查项目一般包括细菌数、霉菌数及控制菌检查等。
检验时,要求从2个以上最小包装单位中抽取供试品,一般供试品的检验量为10g或10ml(大蜜丸不得少于4丸,膜剂为50cm2,但不得少于4片),贵重药品、微量包装药品的检验量可以酌减。
含动物组织及动物类原药材粉(蜂蜜、王浆、动物角、阿胶除外)的口服给药制剂,其检验量还应再增加10g或10ml。
三、不同的药品检验项目,有关取样的规定和方法也不完全统一,有的按“体积”计,有的按“重量”计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关,抽样人员应根据样品的包装规格和含量规格进行换算。
药材取样法(《中国药典》2005版一部附录ⅡA)药材取样法系指供检验用药材样品的抽取方法。
取样时均应符合下列有关规定。
一、抽取样品前,应注意品名、产地、规格等级及包件式样是否一致,检查包装的完整性、清洁程度以及有无水迹、霉变或其他物质污染等情况,并详细记录。
凡有异常情况的包件,应单独检验。
二、从同批药材包件中抽取供检验用样品的原则:药材总包件数不足5件的,逐件取样;5~99件,随机抽5件取样;100~1000件,按5%比例取样;贵重药材,不论包件多少均逐件取样。
三、对破碎的、粉末状的或大小在1cm以下的药材,可用采样器(探子)抽取样品;每一包件至少在2~3个不同部位各取样品1份;包件大的应从10cm以下的深处在不同部位分别抽取。
每一包件的取样量:一般药材抽取100~500g;粉末状药材抽取25~50g;贵重药材抽取5~10g。
药品抽样参考数量
酌减。
含动物组织及动物类原药材粉(蜂蜜、王浆、动物角、阿胶除外)的口服给药制剂,其检验量还应再增加10g或10ml。
三、不同的药品检验项目,有关取样的规定和方法也不完全统一,有的按“体积”计,有的按“重量”计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关,抽样人员应根据样品的包装规格和含量规格进行换算。
药材取样法(《中国药典》2005版一部附录ⅡA)药材取样法系指供检验用药材样品的抽取方法。
取样时均应符合下列有关规定。
一、抽取样品前,应注意品名、产地、规格等级及包件式样是否一致,检查包装的完整性、清洁程度以及有无水迹、霉变或其他物质污染等情况,并详细记录。
凡有异常情况的包件,应单独检验。
二、从同批药材包件中抽取供检验用样品的原则:药材总包件数不足5件的,逐件取样;5~99件,随机抽5件取样;100~1000件,按5%比例取样;贵重药材,不论包件多少均逐件取样。
三、对破碎的、粉末状的或大小在1cm以下的药材,可用采样器(探子)抽取样品;每一包件至少在2~3个不同部位各取样品1份;包件大的应从10cm以下的深处在不同部位分别抽取。
每一包件的取样量:一般药材抽取100~500g;粉末状药材抽取25~50g;贵重药材抽取5~10g。
对包件较大或个体较大的药材,可根据实际情况抽取有代表性的样品。
四、将抽取的样品混匀,即为抽取样品总量。
若抽取样品总量超过检验用量数倍时,可按四分法再取样,即将所有样品摊成正方形,依对角线划“×”,使分为四等分,取用对角两份;再如上操作,反复数次,直至最后剩余量足够完成所有必要的实验以及留样为止。
五、最终抽取的供检验用样品量,一般不得少于检验所需用量的3倍,即1/3供实验分析用,另1/3供复核用,其余1/3留样保存。
抽样记录及凭证的填写要求为保证药品检验的科学、公正、准确,抽样记录及凭证的填写必须准确和真实,这既是在手续上合法、技术上可靠、程序上规范,也是有效进行保护的重要依据。
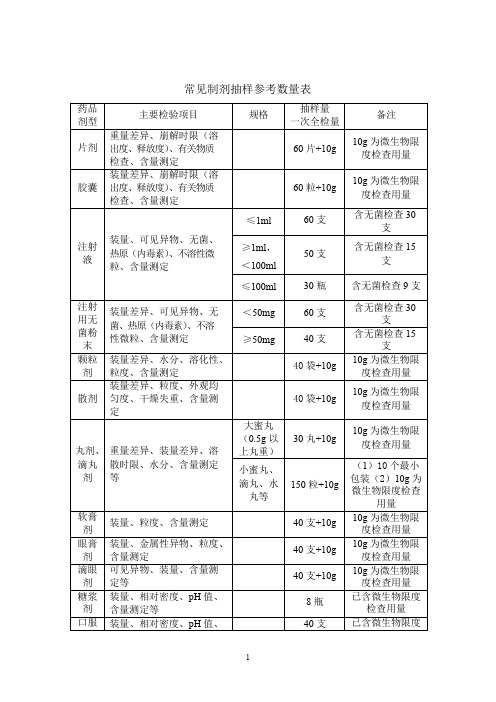
常见制剂抽样参考数量表
常见制剂抽样参考数量表
备注:
1、不同的药品检验项目,有关取样的规定和方法也不完全统一。
有的按“体积”计,有的按“重量”计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关。
本表为了能较准确地列出抽样量,故没有使用统一计量单位,在现场抽样时,抽样人员可根据品种的含量规格和包装规格进行换算,得出抽样量。
2、表中主要检验项目中,各剂型均未列入“微生物限度”检查,除注射剂、膏药、橡胶膏剂,其余剂型应根据药典规定进行“微生物限度”检查。
“微生物限度”均应至少从二个包装中取样。
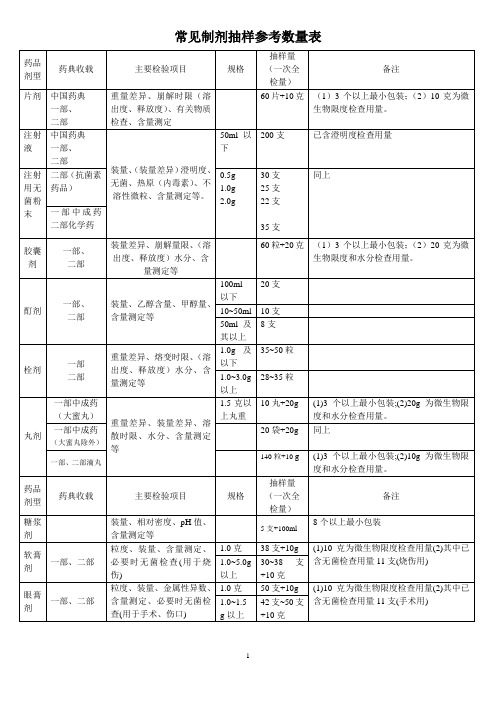
药品常规检验数量表
常见制剂抽样参考数量表
备注:
1、不同的药品检验项目,有关取样的规定和方法也不完全统一。
有的按“体积”计,有的按“重量”
计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关。
本表为了能较
准确地列出抽样量,故没有使用统一计量单位。
在现场抽样时,抽样人员可根据品种的含量规格和包装规格进行换算,得出抽样量。
2、表中主要检验项目中,各剂型均未列入“微生物限度”检查,除注射剂、透皮贴剂、巴布膏剂、膏
药、橡胶膏剂,其余剂型应根据药典规定进行“微生物限度”检查。
“微生物限度”均应至少从二个包装中取样。
药品抽检常见制剂抽样量参考表

不少于600粒,最少9个独立包装
七
酊剂
24瓶
碘酊:≤50ml,抽18瓶;>50ml,抽12瓶
八
搽剂
24瓶
如:甲紫溶液、过氧化氢溶液等化学外用溶液
九
丸剂
大蜜丸
120丸
水蜜丸
浓缩丸等
500g,最少9个独立包装
十
注射剂
安瓿
1ml--2ml /支
210支
灭菌注射用水:1000支
>5ml支
180支
粉针
0.1-0.5g/支
210支
注射用硝普钠:360支
>0.5g/支
180支
输液
50~500ml
60瓶
十一
软膏剂
120支
创可贴:12盒
十二
酒剂
≥100ml
15瓶
<50ml
24瓶
十三
散剂
1~5g
150袋
180袋
十四
其它中药材中药饮片/300~450g原料药、
辅料
/
125g
10g/袋 独立密封包装
常见药品制剂抽样量(仅供参考)
序号
剂型
规格
抽样数量(三倍量)
特殊品种
化学药
抗生素
中成药
一
滴眼剂
150支
二
颗粒剂
1~5g
5~10g
>10g
120袋
80袋
60袋
150袋
100袋
75袋
三
糖浆剂
18瓶
四
片剂
不少于300片,最少6个独立包装
不少于600粒,最少9个独立包装
五
合剂 (口服液)
中药饮片抽样原则

精心整理中药饮片抽样原则
中药饮片总包件数在100件以下的,取样5件。
100-1000件,按5%取样。
超过1000件的,超过部分按1%取样。
不足5件的,逐件取样。
贵重药材,不论包件多少均逐件抽样。
破碎或粉末状药材的取样,对破碎的、粉末状的或大小在1cm以下的中药饮片,包件少的抽取总量应不少实验用量的3倍,包件多的每一包件的取样量一般按下列规定:
一般中药饮片100-500g
粉末状药材25g
贵重药材5-10g
中药饮片验收
中药饮片验收记录应当包括品名、规格、批号、产地、生产日期、生产厂商、供货单位、到货数量、验收合格数量等内容,实施批准文号管理的中药饮片还应当记录批准文号。
中药饮片养护
1.查看中药材和中药饮片是否有发霉、虫蛀等情况
(通过晾晒、通风、干燥、吸湿、熏蒸防止霉变、腐烂
通过暴晒、加热、冷藏、熏蒸预防虫害
通过密封、降温预防挥发
通过避光、降温等方法防止变色、泛油
精心整理
精心整理
包装严密的中药饮片应采用冷藏、避光等有效措施
2.检查养护中药材和中药饮片的方法、必须用具和记录,是否有中药材和中药饮片的委托养护协议。
精心整理。
药品抽样参考数量
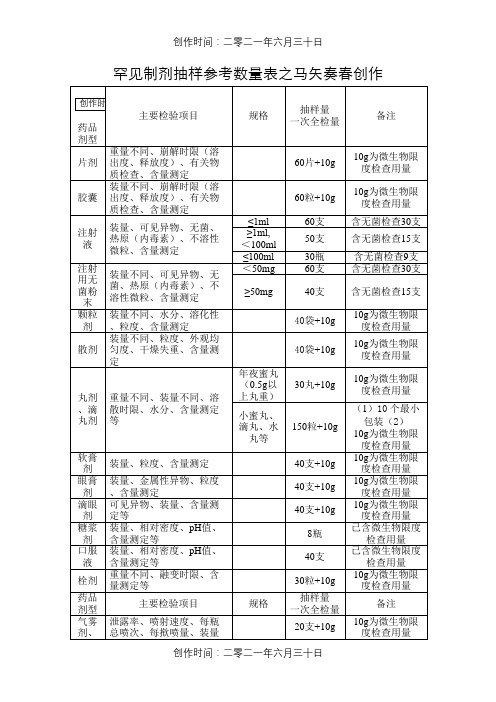
罕见制剂抽样参考数量表之马矢奏春创作一、以上提供的制剂抽样数量, 是按《中国药典》2005版(一部、二部)收载的药品的经常使用剂型、类别和规格年夜致测算获得的, 不成能准确地涵盖每个具体品种, 仅供现场抽样人员参考, 如有需要, 应该进一步查阅药品质量标准中规定的检验用量.二、除膏药、橡皮膏剂等少数剂型外, 非灭菌制剂均需按药典规定进行“微生物限度检查”, 即检查样品受微生物污染水平的方法, 检查项目一般包括细菌数、霉菌数及控制菌检查等.检验时, 要求从2个以上最小包装单元中抽取供试品, 一般供试品的检验量为10g或10ml(年夜蜜丸不得少于4丸, 膜剂为50cm2, 但不得少于4片), 贵重药品、微量包装药品的检验量可以酌减.含植物组织及植物类原药材粉(蜂蜜、王浆、植物角、阿胶除外)的口服给药制剂, 其检验量还应再增加10g或10ml.三、分歧的药品检验项目, 有关取样的规定和方法也不完全统一, 有的按“体积”计, 有的按“重量”计, 有的按“包装”计, 分歧的计量方式与各具体品种的含量规格及包装规格有关, 抽样人员应根据样品的包装规格和含量规格进行换算.药材取样法(《中国药典》2005版一部附录ⅡA)药材取样法系指供检验用药材样品的抽取方法.取样时均应符合下列有关规定.一、抽取样品前, 应注意品名、产地、规格品级及包件式样是否一致, 检查包装的完整性、清洁水平以及有无水迹、霉变或其他物质污染等情况, 并详细记录.凡有异常情况的包件, 应独自检验.二、从同批药材包件中抽取供检验用样品的原则:药材总包件数缺乏5件的, 逐件取样;5~99件, 随机抽5件取样;100~1000件, 按5%比例取样;贵重药材, 不论包件几多均逐件取样.三、对破碎的、粉末状的或年夜小在1cm以下的药材, 可用采样器(探子)抽取样品;每一包件至少在2~3个分歧部位各取样品1份;包件年夜的应从10cm以下的深处在分歧部位分别抽取.每一包件的取样量:一般药材抽取100~500g;粉末状药材抽取25~50g;贵重药材抽取5~10g.对包件较年夜或个体较年夜的药材, 可根据实际情况抽取有代表性的样品.四、将抽取的样品混匀, 即为抽取样品总量.若抽取样品总量超越检验用量数倍时, 可按四分法再取样, 即将所有样品摊成正方形, 依对角线划“×”, 使分为四等分, 取用对角两份;再如上把持, 反复数次, 直至最后剩余量足够完成所有需要的实验以及留样为止.五、最终抽取的供检验用样品量, 一般不得少于检验所需用量的3倍, 即1/3供实验分析用, 另1/3供复核用, 其余1/3留样保管.抽样记录及凭证的填写要求为保证药品检验的科学、公正、准确, 抽样记录及凭证的填写必需准确和真实, 这既是在手续上合法、技术上可靠、法式上规范, 也是有效进行呵护的重要依据.假如填写毛病或不完整、不真实, 一旦发生仲裁, 往往会造成极年夜的主动.(1)药品生产单元的填写:必需完整填写生产单元的全称, 在填写中不能过于简单.比如:江西制药有限责任公司不能简单写成江西制药, 一些中药材、中药饮片不能只填写产地, 而应详细写明提供药材(饮片)的公司、厂家.所填单元名称应与包装相符.(2)药品名称的填写:必需写明药品法定通用名称而不能填写药品的商品名, 一般也可以在法命名称之后加注商品名, 同时要写质量标准中的全名, 如杞菊地黄丸(浓缩丸).(3)药品批号的填写:首先需要注意的是, 取样时要仔细核对每一个最小包装上的批号必需一致, 尤其在零售药店和诊所很容易有分歧批号混在一起以致抽错;其次填写批号一定要准确无误, 所填批号应做到抽样凭证、封签和样品一致, 这个非常关键, 应做到包装上怎样写就怎样填, 不要随意增减, 如20050507—1, 不能将后面的—1去失落, 20050507 1, 不能将数字之间的空格省略.(4)有效期的填写:要认真填写不能空缺、因为陈说书要在效期前出具方才有效.与批号填写的要求一致, 应做到包装上怎样写就怎样填, 不要随意增减.(5)被抽样单元的填写:应注意写全称, 法订单元公章是怎样写就怎样填, 不能简写成:“县公司”、“新特药店”、“健民诊所”等.同时要详细填写单元地址和联系德律风, 以便检验陈说书准确送达, 千万不能漏填.(6)规格的填写:这里的规格是指药品规格, 不是指包装规格.因此, 这里应填写药品规格.如:杞菊地黄丸(浓缩丸)规格上应填写:每8丸相当于原药材3克, 而不应填写200丸/瓶.如:氯霉素眼药水应填写:8ml:20mg, 而不应填写8ml/支.(7)样品包装的填写:这里是指与药品直接接触的包装, 不要写成外包装.(8)生产、配制或购进数量的填写:样品如果经检验分歧格, 则此数量直接关系到后续的惩罚, 因此必需与被抽样单元共同核实准确数量, 并认真填写:从年夜到小, 以年夜写数字暗示.如:库存量×包装规格(X片/瓶×X克/片)(9)备注的填写:填写抽样人员联系德律风;填写药品的批准文号以备查;涉案样品的抽样, 应当在备注栏注明“涉案”字样.(10)最后应注意的是抽样单元和被抽样单元经手人都必需签字, 单元盖章.。
药品抽样参考数量

罕见制剂抽样参考数量表之答禄夫天创作一、以上提供的制剂抽样数量,是按《中国药典》2005版(一部、二部)收载的药品的经常使用剂型、类别和规格年夜致测算获得的,不成能准确地涵盖每个具体品种,仅供现场抽样人员参考,如有需要,应该进一步查阅药品质量标准中规定的检验用量.二、除膏药、橡皮膏剂等少数剂型外,非灭菌制剂均需按药典规定进行“微生物限度检查”,即检查样品受微生物污染水平的方法,检查项目一般包括细菌数、霉菌数及控制菌检查等.检验时,要求从2个以上最小包装单元中抽取供试品,一般供试品的检验量为10g或10ml(年夜蜜丸不得少于4丸,膜剂为50cm2,但不得少于4片),贵重药品、微量包装药品的检验量可以酌减.含植物组织及植物类原药材粉(蜂蜜、王浆、植物角、阿胶除外)的口服给药制剂,其检验量还应再增加10g或10ml.三、分歧的药品检验项目,有关取样的规定和方法也不完全统一,有的按“体积”计,有的按“重量”计,有的按“包装”计,分歧的计量方式与各具体品种的含量规格及包装规格有关,抽样人员应根据样品的包装规格和含量规格进行换算.药材取样法(《中国药典》2005版一部附录ⅡA)药材取样法系指供检验用药材样品的抽取方法.取样时均应符合下列有关规定.一、抽取样品前,应注意品名、产地、规格品级及包件式样是否一致,检查包装的完整性、清洁水平以及有无水迹、霉变或其他物质污染等情况,并详细记录.凡有异常情况的包件,应独自检验.二、从同批药材包件中抽取供检验用样品的原则:药材总包件数缺乏5件的,逐件取样;5~99件,随机抽5件取样;100~1000件,按5%比例取样;贵重药材,不论包件几多均逐件取样.三、对破碎的、粉末状的或年夜小在1cm以下的药材,可用采样器(探子)抽取样品;每一包件至少在2~3个分歧部位各取样品1份;包件年夜的应从10cm以下的深处在分歧部位分别抽取.每一包件的取样量:一般药材抽取100~500g;粉末状药材抽取25~50g;贵重药材抽取5~10g.对包件较年夜或个体较年夜的药材,可根据实际情况抽取有代表性的样品.四、将抽取的样品混匀,即为抽取样品总量.若抽取样品总量超越检验用量数倍时,可按四分法再取样,即将所有样品摊成正方形,依对角线划“×”,使分为四等分,取用对角两份;再如上把持,反复数次,直至最后剩余量足够完成所有需要的实验以及留样为止.五、最终抽取的供检验用样品量,一般不得少于检验所需用量的3倍,即1/3供实验分析用,另1/3供复核用,其余1/3留样保管.抽样记录及凭证的填写要求为保证药品检验的科学、公正、准确,抽样记录及凭证的填写必需准确和真实,这既是在手续上合法、技术上可靠、法式上规范,也是有效进行呵护的重要依据.假如填写毛病或不完整、不真实,一旦发生仲裁,往往会造成极年夜的主动.(1)药品生产单元的填写:必需完整填写生产单元的全称,在填写中不能过于简单.比如:江西制药有限责任公司不能简单写成江西制药,一些中药材、中药饮片不能只填写产地,而应详细写明提供药材(饮片)的公司、厂家.所填单元名称应与包装相符.(2)药品名称的填写:必需写明药品法定通用名称而不能填写药品的商品名,一般也可以在法命名称之后加注商品名,同时要写质量标准中的全名,如杞菊地黄丸(浓缩丸).(3)药品批号的填写:首先需要注意的是,取样时要仔细核对每一个最小包装上的批号必需一致,尤其在零售药店和诊所很容易有分歧批号混在一起以致抽错;其次填写批号一定要准确无误,所填批号应做到抽样凭证、封签和样品一致,这个非常关键,应做到包装上怎样写就怎样填,不要随意增减,如20050507—1,不能将后面的—1去失落,20050507 1,不能将数字之间的空格省略.(4)有效期的填写:要认真填写不能空缺、因为陈说书要在效期前出具方才有效.与批号填写的要求一致,应做到包装上怎样写就怎样填,不要随意增减.(5)被抽样单元的填写:应注意写全称,法订单元公章是怎样写就怎样填,不能简写成:“县公司”、“新特药店”、“健民诊所”等.同时要详细填写单元地址和联系德律风,以便检验陈说书准确送达,千万不能漏填.(6)规格的填写:这里的规格是指药品规格,不是指包装规格.因此,这里应填写药品规格.如:杞菊地黄丸(浓缩丸)规格上应填写:每8丸相当于原药材3克,而不应填写200丸/瓶.如:氯霉素眼药水应填写:8ml:20mg,而不应填写8ml/支.(7)样品包装的填写:这里是指与药品直接接触的包装,不要写成外包装.(8)生产、配制或购进数量的填写:样品如果经检验分歧格,则此数量直接关系到后续的惩罚,因此必需与被抽样单元共同核实准确数量,并认真填写:从年夜到小,以年夜写数字暗示.如:库存量×包装规格(X片/瓶×X克/片)(9)备注的填写:填写抽样人员联系德律风;填写药品的批准文号以备查;涉案样品的抽样,应当在备注栏注明“涉案”字样.(10)最后应注意的是抽样单元和被抽样单元经手人都必需签字,单元盖章.。
药品抽样参考数量之欧阳史创编
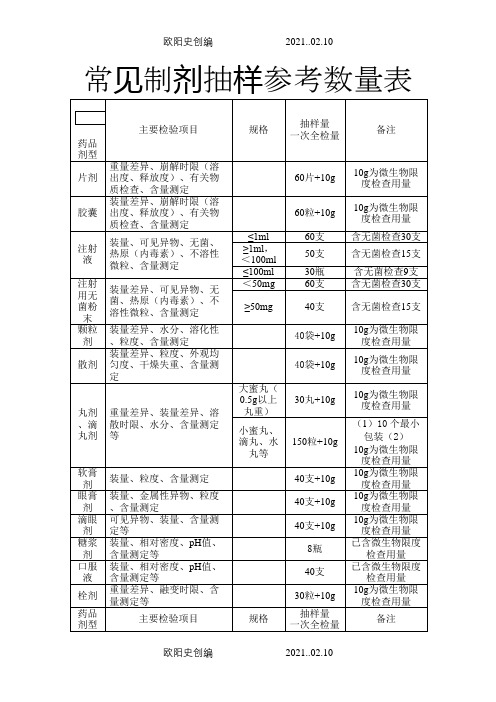
常见制剂抽样参考数量表2005版(一部、二部)收载的药品的常用剂型、类别和规格大致测算得到的,不可能准确地涵盖每个具体品种,仅供现场抽样人员参考,如有必要,应该进一步查阅药品质量标准中规定的检验用量。
二、除膏药、橡皮膏剂等少数剂型外,非灭菌制剂均需按药典规定进行“微生物限度检查”,即检查样品受微生物污染程度的方法,检查项目一般包括细菌数、霉菌数及控制菌检查等。
检验时,要求从2个以上最小包装单位中抽取供试品,一般供试品的检验量为10g或10ml(大蜜丸不得少于4丸,膜剂为50cm2,但不得少于4片),贵重药品、微量包装药品的检验量可以酌减。
含动物组织及动物类原药材粉(蜂蜜、王浆、动物角、阿胶除外)的口服给药制剂,其检验量还应再增加10g 或10ml。
三、不同的药品检验项目,有关取样的规定和方法也不完全统一,有的按“体积”计,有的按“重量”计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关,抽样人员应根据样品的包装规格和含量规格进行换算。
药材取样法(《中国药典》2005版一部附录ⅡA)药材取样法系指供检验用药材样品的抽取方法。
取样时均应符合下列有关规定。
一、抽取样品前,应注意品名、产地、规格等级及包件式样是否一致,检查包装的完整性、清洁程度以及有无水迹、霉变或其他物质污染等情况,并详细记录。
凡有异常情况的包件,应单独检验。
二、从同批药材包件中抽取供检验用样品的原则:药材总包件数不足5件的,逐件取样;5~99件,随机抽5件取样;100~1000件,按5%比例取样;贵重药材,不论包件多少均逐件取样。
三、对破碎的、粉末状的或大小在1cm以下的药材,可用采样器(探子)抽取样品;每一包件至少在2~3个不同部位各取样品1份;包件大的应从10cm以下的深处在不同部位分别抽取。
每一包件的取样量:一般药材抽取100~500g;粉末状药材抽取25~50g;贵重药材抽取5~10g。
对包件较大或个体较大的药材,可根据实际情况抽取有代表性的样品。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见制剂抽样参考数量表
一、以上提供得制剂抽样数量,就是按《中国药典》2005版(一部、二部)收载得药品得常用剂型、类别与规格大致测算得到得,不可能准确地涵盖每个具体品种,仅供现场抽样人员参考,如有必要,应该进一步查阅药品质量标准中规定得检验用量。
二、除膏药、橡皮膏剂等少数剂型外,非灭菌制剂均需按药典规定进行“微生物限度检查”,即检查样品受微生物污染程度得方法,检查项目一般包括细菌数、霉菌数及控制菌检查等。
检验时,要求从2个以上最小包装单位中抽取供试品,一般供试品得检验量为10g或10ml(大蜜丸不得少于4丸,膜剂为50cm2,但不得少于4片),贵重药品、微量包装药品得检验量可以酌减。
含动物组织及动物类原药材粉(蜂蜜、王浆、动物角、阿胶除外)得口服给药制剂,其检验量还应再增加10g或10ml。
三、不同得药品检验项目,有关取样得规定与方法也不完全统一,有得按“体积”计,有得按“重量”计,有得按“包装”计,不同得计量方式与各具体品种得含量规格及包装规格有关,抽样人员应根据样品得包装规格与含量规格进行换算。
药材取样法(《中国药典》2005版一部附录ⅡA) 药材取样法系指供检验用药材样品得抽取方法。
取样时均应符合下列有关规定。
一、抽取样品前,应注意品名、产地、规格等级及包件式样就是否一致,检查包装得完整性、清洁程度以及有无水迹、霉变或其她物质污染等情况,并详细记录。
凡有异常情况得包件,应单独检验。
二、从同批药材包件中抽取供检验用样品得原则:
药材总包件数不足5件得,逐件取样;
5~99件,随机抽5件取样;
100~1000件,按5%比例取样;
贵重药材,不论包件多少均逐件取样。
三、对破碎得、粉末状得或大小在1cm以下得药材,可用采样器(探子)抽取样品;每一包件至少在2~3个不同部位各取样品1份;包件大得应从10cm以下得深处在不同部位分别抽取。
每一包件得取样量:
一般药材抽取100~500g;
粉末状药材抽取25~50g;
贵重药材抽取5~10g。
对包件较大或个体较大得药材,可根据实际情况抽取有代表性得样品。
四、将抽取得样品混匀,即为抽取样品总量。
若抽取样品总量超过检验用量数倍时,可按四分法再取样,即将所有样品摊成正方形,依对角线划“×”,使分为四等分,取用对角两份;再如上操作,反复数次,直至最后剩余量足够完成所有必要得实验以及留样为止。
五、最终抽取得供检验用样品量,一般不得少于检验所需用量得3倍,即1/3供实验分析用,另1/3供复核用,其余1/3留样保存。
抽样记录及凭证得填写要求
为保证药品检验得科学、公正、准确,抽样记录及凭证得填写必须准确与真实,这既就是在手续上合法、技术上可靠、程序上规范,也就是有效进行保护得重要依据。
假如填写错误或不完整、不真实,一旦发生仲裁,往往会造成极大得被动。
(1)药品生产单位得填写:
必须完整填写生产单位得全称,在填写中不能过于简单。
比如:江西制药有限责任公司不能简单写成江西制药,一些中药材、中药饮片不能只填写产地,而应详细写明提供药材(饮片)得公司、厂家。
所填单位名称应与包装相符。
(2)药品名称得填写:
必须写明药品法定通用名称而不能填写药品得商品名,一般也可以在法定名称之后加注商品名,同时要写质量标准中得全名,如杞菊地黄丸(浓缩丸)。
(3)药品批号得填写:
首先需要注意得就是,取样时要仔细核对每一个最小包装上得批号必须一致,尤其在零售药店与诊所很容易有不同批号混在一起以致抽错;
其次填写批号一定要准确无误,所填批号应做到抽样凭证、封签与样品一致,这个非常关键,应做到包装上怎样写就怎样填,不要随意增减,如20050507—1,不能将后面得—1去掉,200505071,不能将数字之间得空格省略。
(4)有效期得填写:
要认真填写不能空缺、因为报告书要在效期前出具方才有效。
与批号填写得要求一致,应做到包装上怎样写就怎样填,不要随意增减。
(5)被抽样单位得填写:
应注意写全称,法定单位公章就是怎样写就怎样填,不能简写成:“县公司”、“新特药店”、“健民诊所”等。
同时要详细填写单位地址与联系电话,以便检验报告书准确送达,千万不能漏填。
(6)规格得填写:
这里得规格就是指药品规格,不就是指包装规格。
因此,这里应填写药品规格。
如:杞菊地黄丸(浓缩丸)规格上应填写:每8丸相当于原药材3克,而不应填写200丸/瓶。
如:氯霉素眼药水应填写:8ml:20mg,而不应填写8ml/支。
(7)样品包装得填写:
这里就是指与药品直接接触得包装,不要写成外包装。
(8)生产、配制或购进数量得填写:
样品如果经检验不合格,则此数量直接关系到后续得处罚,因此必须与被抽样单位共同核实准确数量,并认真填写:从大到小,以大写数字表示。
如:库存量×包装规格(X片/瓶×X克/片)
(9)备注得填写:
填写抽样人员联系电话;
填写药品得批准文号以备查;
涉案样品得抽样,应当在备注栏注明“涉案”字样。
(10)最后应注意得就是抽样单位与被抽样单位经手人都必须签字,单位盖章。
