2015年高中化学竞赛辅导无机化学18.1钛分族知识点素材
2015年高中化学竞赛辅导无机化学15.3镓分族知识点素材

§15-3 镓分族Gallium Subgroup一、General PropertiesGa 、In 的氧化数为+3,Tl 的氧化数为+1Gallium, indium and thallium 是稀散元素,不存在独立的矿石,而与其它矿共生。
这三种元素都由各自的光谱发现。
Gallium --- 紫色(门捷列夫所预言的第一个被证实的元素)Indium --- 蓝色(由特征光谱线蓝色而得名)Thallium ---(树芽)绿色二、The Simple Substances1.Ga 、In 和Tl 在电位序[H +]的前面,它们可溶于稀酸,但V 25.1/Tl Tl 3+=++ϕ,所以+−→−+Tl Tl H + H 2↑,Tl 与HCl(aq)反应有类似“passivated ”现象,这是由于生成难溶性的TlCl ,在金属Tl 表面,阻碍金属Tl 与盐酸进一步反应的缘故。
2.Ga 有两性,In 和Tl 在无氧化剂存在时,不溶于碱2Ga + 6H 2O + 6NaOH2Na 3[Ga(OH)6] + 3H 2↑三、Compounds1.[ +3 ] O.S.(1) Oxides :Ga 2O 3 In 2O 3 Tl 2O 3稳定性减弱,氧化性增强,碱性增强Tl 2O 3200℃Tl 2O + O 2M 2O 3(s) + 6HCl(aq)MCl 3(aq) + 3H 2O(l)∆r G m (kJ ·mol -1) 71 -25 -199 Ga(OH)3为两性氧化物,Ga 2O 3与Al 2O 3结构相似Ga(OH)3 + 3OH -[Ga(OH)6]3-Ga(OH)3能溶于氨水,但Al(OH)3不能(2) sulfides : Ga 2S 3(黄色)彻底水解Ga 2S 3 + 6H 2O 2Ga(OH)3↓+ 3H 2S ↑Tl 2S 3不存在:2TlCl 3 + 3Na 2STl 2S ↓+ 2S ↓+ 6NaCl In 2S 3(红色)可溶于(NH 4)2S 或M 2S 中 (3) Halides :Tl(+3)Br 3和Tl (+3)I 3都不存在,室温下只有TlF 3、TlCl 3 显然 Tl 3+ + 3I -TlI + I 22.[ +1 ] O.S. (1) Ga 和In 的+1氧化态不稳定,是强还原剂3Ga 2OGa 2O 3 + 4Ga 3Ga 2S Ga 2S 3 + 4Ga 3In +(aq)In 2In 3++In 2S (黄色)不与水反应,与酸反应放出H 2 In 2S + 4H + + 2S 2-2H 2↑+ In 2S 3(红色)(2) Tl 的+1氧化态稳定,除了TlF 外,其它TlX 难溶于水,与Ag +相似Tl 3+ + 2Tl 3Tl + 4Tl + O 22Tl 2OTiOH 是强碱,能从空气中吸收H 2O 或CO 2,并能腐蚀玻璃铊能形成同时作为一价和三价的配位化合物:如Ti 2Cl 4、Tl 4Cl 6都不能认为Tl 为+2价,而是以配合物形式存在:]Cl Tl [Tl 4)()(ⅢⅠ ]Cl Tl [Tl 6)()(3ⅢⅠ盐的水解总结:一、影响水解的因素1.内因(1) 极化a .正离子的电荷高,半径小,易水解AlCl 3 + 3H 2OAl(OH)3 + 3HCl SiCl 4 + 4H 2OH 4SiO 4 + 4HCl b .正离子电子构型的影响;18电子构型,18 + 2电子构型,不规则电子构型的离子易水解:Zn 2+、Hg 2+、Bi 3+、Fe 3+等离子易水解。
高中化学竞赛基础知识点归纳

高中化学竞赛基础知识点归纳高中化学竞赛基础知识点归纳在我们的高中阶段,化学竞赛是很受学生欢迎的,很多喜欢化学的学生都很积极参加比赛,可是想要赢得胜利,我们需要掌握哪些化学知识呢?下面是店铺为大家整理的高中化学知识点,希望对大家有用!高中化学竞赛知识一、物理性质1、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。
其它物质的颜色见会考手册的颜色表。
2、有刺激性气味的气体:HF、HCl、HBr、HI、NH3、SO2、NO2、F2、Cl2、Br2(g);有臭鸡蛋气味的气体:H2S。
3、熔沸点、状态:① 同族金属从上到下熔沸点减小,同族非金属从上到下熔沸点增大。
② 同族非金属元素的氢化物熔沸点从上到下增大,含氢键的NH3、H2O、HF反常。
③ 常温下呈气态的有机物:碳原子数小于等于4的烃、一氯甲烷、甲醛。
④ 熔沸点比较规律:原子晶体>离子晶体>分子晶体,金属晶体不一定。
⑤ 原子晶体熔化只破坏共价键,离子晶体熔化只破坏离子键,分子晶体熔化只破坏分子间作用力。
⑥ 常温下呈液态的单质有Br2、Hg;呈气态的单质有H2、O2、O3、N2、F2、Cl2;常温呈液态的无机化合物主要有H2O、H2O2、硫酸、硝酸。
⑦ 同类有机物一般碳原子数越大,熔沸点越高,支链越多,熔沸点越低。
同分异构体之间:正>异>新,邻>间>对。
⑧ 比较熔沸点注意常温下状态,固态>液态>气态。
如:白磷>二硫化碳>干冰。
⑨ 易升华的物质:碘的单质、干冰,还有红磷也能升华(隔绝空气情况下),但冷却后变成白磷,氯化铝也可;三氯化铁在100度左右即可升华。
⑩ 易液化的气体:NH3、Cl2 ,NH3可用作致冷剂。
4、溶解性① 常见气体溶解性由大到小:NH3、HCl、SO2、H2S、Cl2、CO2。
极易溶于水在空气中易形成白雾的气体,能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2(g)、H2S、NO2。
高中化学竞赛辅导 无机化学 18.1钛分族知识点素材

第十八章 过渡元素(I )Chapter 18 The Transition Elements (I )引 言(Introduction )一、Definition :具有部分充填d 或f 壳层电子的元素。
它包括第四、五、六周期从ⅢB到Ⅷ族的元素,共有8个直列,这些元素都是金属元素,也称为过渡金属。
人们也常将铜分族看作过渡元素,这是由于Cu 2+具有3d 9,Au 3+具有5d 8,且性质也与过渡元素十分相似的缘故。
二、Elements’ Symbol :Ac Pt Ir Os Re W Ta Hf La PdRh Ru Tc Mo Nb Zr Y NiCo Fe Mn Cr V Ti Sc三、Valence Orbital (n - 1)d 、n s 、n p 共九个轨道 四、Oxidation State : 1.过渡元素都有可变氧化态,2.+2氧化态几乎为所有过渡元素的特征氧化态,3.绝大部分过渡元素的最高氧化态等于其族数:Sc 2O 3、CrO 3、Mn 2O 7,4.随着原子序数的增加其高价氧化态越来越稳定:如未发现FeO 4,而发现OsO 4。
其 ∆f 4OsO m ,G = -302kJ·mol -1五、Coordination Capac ity :过渡元素有很强的配位能力,因为有空的价轨道,与配位原子形成σ配键;又有富的d 电子,可与配体的π*反键轨道或n d 空轨道形成反馈π键。
§18-1 钛分族 The Titanium Subgroup包括: Titanium (Ti) Zirconium (Zr) Hafnium (Ha) Rutherfordium (Rf) Valence electron configuration :(n - 1)d 2n s 2一、General Properties1.Radius :从Ti 到Zr 是增大的,而Zr 和Hf 是相似的,这是由于镧系收缩造成的,使Zr 、Hf 分离困难,只能采取离子交换(ion exchange )法或溶剂萃取(solventextraction )法来分离它们。
高中化学竞赛辅导无机元素练习题

(1)确定A的结构简式。写出生成A的化学反应方程式。
(2)在室温或高于室温的条件下,A能定量地分解,产生B和C。已知B的阳离子的价电子总数比C的价电子总数少4。试确定B的结构简式,写出B中阴、阳离子各中心原子的杂化形态。
3为什么NF3常温不水解,而NCl3常温可以水解?写出水解产物。
九、回答下列关于磷的问题:
高中化学竞赛练习(无机化学主族元素)
第一章卤素
一、于酸性溶液中混合等物质的量的KBrO3和KI,生成哪些氧化还原产物,它们的物质量的比是多少?
(2)用漂白粉漂白物料时,常采用以下步骤:将物料浸入漂白粉溶液,然后暴露在空气中;将物料浸在稀盐酸中;将物料浸在大苏打溶液中,最后取出放在空气中干燥;试说明每一步处理的作用,并写出有关的反应方程式。
(2)石硫合剂在空气中与H2O及CO2作用又生成具有杀虫作用的S,写出分步的反应方程式。
四.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。
1.氯化亚砜分子的几何构型是;中心原子采取杂方式,
是(等性、不等性)杂化。
2.写出亚硫酸钙和五氯化磷共热,制备氯化亚砜反应的化学方程式
3.氯化亚砜在有机化学中用作氯化剂,写出乙醇和氯化亚砜反应的化学方程式
1.写出N2O4在登月飞船的液体推进系统中所发生主要反应的方程式;
2.说明N2O4分子中N原子的杂化方式和成键情况;
3.画出偏二甲肼的构型。
4.写出我国长征系列火箭二元推进剂反应的化学方程式。
5.偏二甲肼可用二甲胺被亚硝酸氧化、再用锌还原来制备,写出各步反应方程式。
高中化学竞赛-中级无机化学-金属原子簇

1963,Robinsson, Cotton
确定[Re3Cl12]2-中存在
程碑式事件: 1964,Cotton提出 [Re2Cl8]2-中存在 Re Re 键
第三页,编辑于星期二:十五点 五十二分。
金属-金属键定义
金属原子之间所存在的一种直接相互作用
金属原子簇化合物定义
(i) 含两个或两个以上金属原子且金属原子间 至少存在一个金属-金属键的化合物
5Na4Nb6Cl18 +8H2O 浓HCl [Nb6Cl12]Cl2.8H2O +4NaCl
第三十四页,编辑于星期二:十五点 五十二分。
结构
6个金属原子常构成八面体骨架
[Mo6Cl8]4+ :[Mo6( 2–C1)8]4+
八面体每个边的上方有1个Cl
6个Mo2+的24个价电子
Cl
用于形成Mo–Mo骨架键
第五页,编辑于星期二:十五点 五十二分。
1 、 按 成 簇 原 子 类 型 分 : 同 核 簇 Fe3(CO)12 、 异 核 簇
Fe2Ru(CO)12 、 FeRu2(CO)12 。 2、按结构类型分:开式结构多核簇;闭式结构多核簇。
3、按成簇金属原子数分:双原子簇Te2(CO)10 、三原子簇 Fe3(CO)12 、多原子簇[Mo6Cl8]4+。
4、按配体类型分:“羰合物”型原子簇Re2(CO)10 、“低 价卤化物”型原子簇Mo2Cl83- 、 无配体原子簇,如 Bi4AlCl4。
第六页,编辑于星期二:十五点 五十二分。
二、金属-金属键
1. 影响形成M-M键的因素 (1)要有较低的氧化态:
因为M-M键的形成主要靠d轨道重叠,当金属处于高 氧化态时,d轨道收缩,不利于d轨道的互相重叠。因此 M-M键通常出现在金属原子处于低氧化态的化合物中。
2015年高中化学竞赛辅导无机化学20.1镧系元素(Ln)知识

第二十章镧系元素和锕系元素Chapter 20 T he Lanthanides and Actinides镧系元素La、 Ce、 Pr、 Nd、 Pm、 Sm、 Eu、 Gd、 Tb、 Dy、 Ho、 Er、 Tm、Yb、 Lu(镧) (铈) (镨) (钕) (钷) (钐) (铕) (钆) (铽) (镝) (钬) (铒)(铥)(镱) (镥)锕系元素Ac、 Th、 P a、 U、 Np、 Pu、 Am、 Cm、 Bk、 Cf、 Es、 Fm、 Md、No、 Lr(锕) (钍) (镤) (铀) (镎) (钚) (镅) (锔) (锫) (锎) (锿) (镄) (钔) (锘) (铹)§20-1 镧系元素(Ln)The Lanthanides一、General Properties:1.镧系元素从57号元素镧到第71号元素镥,共十五种元素,称为镧系元素,用Ln 表示。
2.稀土元素周期表ⅢB族中的钪(Sc)、钇(Y)和镧系元素在性质上都非常相似并在矿物中共生,由于镧系收缩,Y3+离子的半径落在Er3+附近,Sc3+离子的半径接近于Lu3+,所以Sc、Y可以看作镧系元素的成员。
在化学上把Sc、Y和镧系元素统称为稀土元素(r are earth’s elements),用RE表示。
3.Oxidation states (以+3为特征氧化态,其他还有+2或+4氧化态)4f 6、4f 74f 13、4f 14Sm2+、Eu2+Tm2+、Yb2+4f 0、4f 1、4f 2、4f 3、4f 4、4f 5、4f 6、4f 7、4f 8、4f 9、4f 10、4f 11、4f 12、4f 13、4f 14La3+、Ce3+、Pr3+、Nd3+、Pm3+、Sm3+、Eu3+、Gd3+、Tb3+、Dy3+、Ho3+、Er3+、Tm3+、Yb3+、Lu3+4f 0、4f 14f 7、4f 8Ce4+、Pr4+Tb3+、Dy3+溶液中能稳定存在的氧化态有:Ln3+、Eu2+(4f 7)、Yb2+(4f 14)、C e(IV)(4f 0)4.原子半径和离子半径(1) 镧系收缩镧系元素的原子半径和离子半径在总的趋势上都是随着原子序数的增加而逐渐地缩小,这种原子半径依次缩小的积累,称为镧系收缩。
高中化学竞赛辅导无机化学18.2钒分族知识点素材

§18-2 钒分族The Vanadium Subgroup包括:Vanadium (V) Niobium (Nb) Tantalum (Ta) Dubnium (Du) Du 金属是人造元素,制备方法为1967年:)4( 5Db)( Db Ne Am 1010261105260105M eV 120221024395n n +−−−→−+Valence electron configuration :(n - 1)d 3n s 2,例外:Nb 4d 45s1 一、General Properties1.Radius :由于镧系收缩,Nb 和Ta 半径相近2.First ionization energy 随原子序数的增加而增加3.Oxidation number :V :+2,+3,+4,+5,Ta Nb 、:+54.Coordination number :V :4,6,Ta Nb 、:7,85.Occurrence in nature: 虽然在地壳中的丰度很大,却是稀有元素。
钒铅矿(vanadinite): Pb 5(VO 4)3Cl ,Nb 、Ta 性质相似,矿共生,若矿物中Ta 占优势,称为钽钛矿(tantalite): Fe(TaO 3)2,若矿物中Nb 占优势,称为铌铁矿(columbite): Fe(NbO 3)2。
二、The Simple Subs tance1.Physical properties :熔、沸点高,有较大的熔化热和气化热,这说明钒族元素有较强的金属键;纯金属的延展性好,但金属中含O 、H 和C 等杂质时,金属弹性减弱,硬度增大。
2.Chemical properties:(1) 在常温下,由于钝态存在,钒、特别是铌、钽化学活性低,虽然与其还原电位相 矛盾 V 2.1V /V 2-=+ϕ V 1.1Nb /Nb 3-=+ϕ V 81.0Ta /O Ta 52-=ϕ加热时:4M + 5O 22M 2O 5 2M + 5F 22MF 5 (M = V 、Nb 、Ta )(2) 钒仅溶于热的硝酸、热的浓硫酸、王水中,Nb 和Ta 溶于热的HNO 3-HF 的混合酸中(Ta 连王水都难溶)。
高中化学竞赛辅导资料

高中化学竞赛辅导资料化学竞赛辅导资料(全初)赛专辑)国第一节原子结构与化学键一、原子核外电子的排列现代原子结构理论认为,电子在原子核外高速运动,而且没有一定的轨道,所以,电子在核外运动时就像一团带负电荷的云雾笼罩着带正电荷的原子核,因此,通常把核外电子的运动比喻为电子云。
原子结构理论进一步指出,核外电子是在不同层上运动,这些层叫做电子层;电子层又分为若干亚层;亚层还有不同的轨道;而在每个轨道中运动的电子还有两种不同的自旋。
电子层、亚层、轨道、自旋四个方面决定了一个核外电子的运动状态。
不同元素的原子核外有不同数量的电子。
这些电子是如何在原子核外的不同电子层、子层和轨道中排列的?原子结构理论指出,电子在原子核外的排列遵循三个定律,即泡利不相容原理、最小能量原理和亨特定律,可以写出不同元素的电子排列公式。
以上是对核外电子运动和排布的概括叙述。
这一部分内容还应着重了解以下几点:1.关于电子云的含义电子云是一个生动的隐喻,它用宏观现象来想象微观世界的场景。
电风扇通常只有三片叶片,但当它高速旋转时,它会看到一片云,就像树叶变成云一样;电子在原子核外运动的速度非常快,而且没有确定的轨道。
因此,可以想象,电子的运动“变成”一团云,一团带负电荷的云。
因此,电子云不是一个实体云,不能被理解为由无数电子组成的云。
需要指出的是,氢原子核外只有一个电子,这仍然可以用电子云来描述。
电子云常用由许多小黑点组成的图形表示。
小黑点密集的地方表示在该处的单位体积内,电子出现机会较多(或称为几率密度较大)。
电子云图中单独一个小黑点没有任何意义。
2.关于电子层、亚层、轨道的意义① 电子层——它有两种含义:一方面,它意味着电子和原子核之间的平均距离不同,另一方面,它意味着电子能量不同。
k、 l、m、n、o、p??电子到原子核的平均距离依次增加,电子的能量依次增加。
② 子层还意味着两种含义:一方面,它意味着电子云的形状不同。
S电子云是以原子核为中心的球形电子云,P电子云是以原子核为中心的固定哑铃形电子云,D和f电子云的形状更复杂;另一方面,这意味着S、P、D和F的电子能量依次增加。
2015年高中化学竞赛辅导无机化学13.3砷分族知识点素材

§ 13-3 砷分族The Arse nic Subgroup一、 General PropertiesAs、Sb 、Bi 的氧化态一般为 ;,+3和+5,由于6s 2惰性电子对效应,所 以铋的特征氧化态为+3。
在自然界中存在矿石有:雌黄 (orpiment) : As z S ?,雄黄(realgar) : A®®, 砷黄铁矿(arsenopyrite 或 mispickel) : FeAsS ,辉锑矿(antimonite) : SbS 3,辉铋矿 (bismuthinite) : BizS 二、 The Simple Substanee 1. AllotropesAs4(g) ―迅速冷却_ yellow arsenic (溶于CS 中,与白磷结构相似,nonmetallicform )| 迅速变成 .1或h vGrey arse nic(与黑磷结构相似, metallic )2.eutectic mixtures 禾口 greater hardness mixture(1) Wood s metal : Bi (50%),Pb (25%),Sn (12.5%),Cd (12.5%) m.p. = 65 —70C ,低于水的沸点。
(2) Bi (41%) ,Pb (22%),Sn (1%),Cd (8%),In (18%) m.p. = 47C(3) Type metal: Sb (25%),Pb (60%),Sn (15%)3. Properties:金属态的砷、锑、铋在通常条件下,在空气和水中稳定,排在金属活动 顺序表氢的后面,但与氧化性酸反应。
浓 HNO 使Bi 发生钝化。
Bi + 4HNO3(稀)Bi(NO) 3 + NO + 2H 2。
3As + 5HNO 3 + 2H 3HAsO + 5NO3Sb + 5HNO 3HSbO + 5NO + H 2。
钛及其化合物性质(补充))

钛及其化合物性质1、自然界存在:钛在自然界存在丰度0.42%,在所有元素居第10位,我国含量丰富。
钛的主要钛铁矿(FeTiO3)和金红石(TiO2)。
2、钛单质液态钛几乎能溶解所有的金属,因此可以和多种金属形成合金。
钛加入钢中制得的钛钢坚韧而富有弹性。
钛与金属Al、Sb、Be、Cr、Fe等生成填隙式化合物或金属间化合物。
钛合金制成飞机比其它金属制成同样重的飞机多载旅客100多人。
制成的潜艇,既能抗海水腐蚀,又能抗深层压力,其下潜深度比不锈钢潜艇增加80%。
同时,钛无磁性,不会被水雷发现,具有很好的反监护作用。
钛具有“亲生物“’性。
在人体内,能抵抗分泌物的腐蚀且无毒,对任何杀菌方法都适应。
因此被广泛用于制医疗器械,制人造髋关节、膝关节、肩关节、胁关节、头盖骨,主动心瓣、骨骼固定夹。
当新的肌肉纤维环包在这些“钛骨”上时,这些钛骨就开始维系着人体的正常活动。
钛在人体中分布广泛,正常人体中的含量为每70kg体重不超过15mg,其作用尚不清楚。
但钛能刺激吞噬细胞,使免疫力增强这一作用已被证实】3、钛的冶炼钛在1791年被发现,而第一次制得纯净的钛却是在1910年,中间经历了一百余年。
原因在于:钛在高温下性质十分活泼,很易和氧、氮、碳等元素化合,要提炼出纯钛需要十分苛刻的条件。
工业上常用硫酸分解钛铁矿的方法制取二氧化钛,再由二氧化钛制取金属钛。
浓硫酸处理磨碎的钛铁矿(精矿),发生下面的化学反应:FeTiO3+3H2SO4== Ti(SO4)2+FeSO4+3H2O FeTiO3+2H2SO4== TiOSO4+FeSO4+2H2OFeO+H2SO4 == FeSO4+H2O Fe2O3+3H2SO4 == Fe2(SO4)3+3H2O 为了除去杂质Fe2(SO4)3,加入铁屑,Fe3+还原为Fe2+,然后将溶液冷却至273K以下,使得FeSO4.7H2O(绿矾)作为副产品结晶析出。
Ti(SO4)2和TiOSO4水解析出白色的偏钛酸沉淀,反应是: Ti(SO4)2+H2O == TiOSO4+H2SO4TiOSO4+2H2O == H2TiO3+H2SO4锻烧偏钛酸即制得二氧化钛: H2TiO3 == TiO2+H2OTiO2+2C+2Cl2=TiCl4+2CO+Ti4、钛常见化合物(1) 二氧化钛钛白是经过化学处理制造出来的纯净的二氧化钛,它是重要的化工原料。
2015年高中化学竞赛辅导无机化学17.1铜分族知识点素材
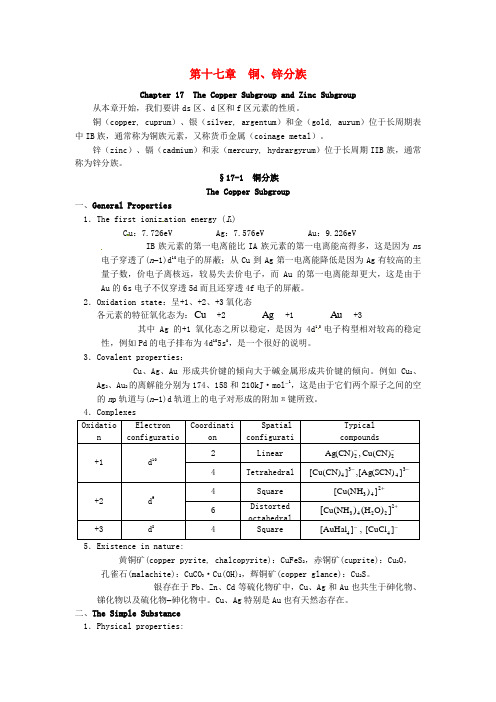
第十七章铜、锌分族Chapter 17 The Copper Subgroup and Zinc Subgroup 从本章开始,我们要讲ds区、d区和f区元素的性质。
铜(copper, cuprum)、银(silver, argentum)和金(gold, aurum)位于长周期表中IB族,通常称为铜族元素,又称货币金属(coinage metal)。
锌(zinc)、镉(cadmium)和汞(mercury, hydrargyrum)位于长周期IIB族,通常称为锌分族。
§17-1 铜分族The Copper Subgroup一、General Properties1.The first ioniz ation energy (I1)C u:7.726eV Ag:7.576eV Au:9.226eVIB族元素的第一电离能比IA族元素的第一电离能高得多,这是因为n s 电子穿透了(n-1)d10电子的屏蔽;从Cu到Ag第一电离能降低是因为Ag有较高的主量子数,价电子离核远,较易失去价电子,而Au的第一电离能却更大,这是由于Au的6s电子不仅穿透5d而且还穿透4f电子的屏蔽。
2.Oxidation state:呈+1、+2、+3氧化态各元素的特征氧化态为:Cu+2 Ag+1 Au+3其中Ag的+1氧化态之所以稳定,是因为4d10电子构型相对较高的稳定性,例如Pd的电子排布为4d105s0,是一个很好的说明。
3.Covalent properties:Cu、Ag、Au形成共价键的倾向大于碱金属形成共价键的倾向。
例如Cu2、Ag2、Au2的离解能分别为174、158和210kJ·mol-1,这是由于它们两个原子之间的空的n p轨道与(n-1)d轨道上的电子对形成的附加π键所致。
4.Complexes5.Existence in nature:黄铜矿(copper pyrite, chalcopyrite):CuFeS2,赤铜矿(cuprite):Cu2O,孔雀石(malachite):CuCO3·Cu(OH)2,辉铜矿(copper glance):Cu2S。
2015年高中化学竞赛辅导 无机化学 18.2钒分族知识点素材

§18-2 钒分族The Vanadium Subgroup包括:Vanadium (V) Niobium (Nb) Tantalum (Ta) Dubnium (Du) Du 金属是人造元素,制备方法为1967年:)4( 5Db)( Db Ne Am 1010261105260105MeV 120221024395n n +−−−→−+Valence electron configuration :(n - 1)d 3n s 2,例外:Nb 4d 45s1 一、General Properties1.Radius :由于镧系收缩,Nb 和Ta 半径相近2.First ionization energy 随原子序数的增加而增加3.Oxidation number :V :+2,+3,+4,+5,Ta Nb 、:+54.Coordination number :V :4,6,Ta Nb 、:7,85.Occurrence in nature: 虽然在地壳中的丰度很大,却是稀有元素。
钒铅矿(vanadinite): Pb 5(VO 4)3Cl ,Nb 、Ta 性质相似,矿共生,若矿物中Ta 占优势,称为钽钛矿(tantalite): Fe(TaO 3)2,若矿物中Nb 占优势,称为铌铁矿(columbite): Fe(NbO 3)2。
二、The Simple Subs tance1.Physical properties :熔、沸点高,有较大的熔化热和气化热,这说明钒族元素有较强的金属键;纯金属的延展性好,但金属中含O 、H 和C 等杂质时,金属弹性减弱,硬度增大。
2.Chemical properties:(1) 在常温下,由于钝态存在,钒、特别是铌、钽化学活性低,虽然与其还原电位相矛盾 V 2.1V /V 2-=+ϕ V 1.1Nb /Nb 3-=+ϕ V 81.0Ta /O Ta 52-=ϕ加热时:4M + 5O 22M 2O 5 2M + 5F 22MF 5 (M = V 、Nb 、Ta )(2) 钒仅溶于热的硝酸、热的浓硫酸、王水中,Nb 和Ta 溶于热的HNO 3-HF 的混合酸中(Ta 连王水都难溶)。
高中化学竞赛辅导 无机化学 18.3铬分族知识点素材-人教版高中全册化学素材

§18-3 铬分族The Chromium Subgroup包括:Chromium (Cr) Molybdenum (Mo) Tungsten (W) Seaborgium (Sg) Valence electron configuration :(n - 1)d 5n s 1,例外:W 5d 46s 2一、General Properties1.Radius :由于镧系收缩,Mo 和W 的原子半径相近。
2.First ionization energy (I 1):从Cr 到W 的次序增加 3.Oxidation numberCr :0、+1、+2、+3、+4、+5、+6,甚至还有负氧化态,其中以+3氧化态最为稳定;Mo 、W :+4、+5、+6,其+3氧化态反而不稳定。
4.Occurrence in nature :铬铁矿(chromite): Fe(CrO 2)2辉钼矿 (molybdenite): MoS 2黑钨矿(wolframite): (Fe, Mn)WO 4白钨矿 (scheelite): CaWO 4二、The Simple Substance1.Physical properties :bcc 结构(body-centered cubic ),熔点和原子化能从Cr 到W 升高。
金属中含杂质会影响其物理性质,如纯铬有可塑性,商用铬是最硬的金属之一。
2.Chemical properties:(1)Reactions with acids and basesa .从电极电位来看:V 91.0Cr /Cr 2-=+ϕ,V 74.0Cr /Cr 3-=+ϕ,Cr 的还原性强:Cr + 2H +Cr 2++ H 2↑++−→−3O2Cr Cr 2而:V 2.0Mo /Mo 3-=+ϕ,V 11.0W /W 3-=+ϕW Mo 、还原性弱。
b .实际上,由于铬有钝化性,它不溶于王水,硝酸(不论稀、浓),所以铬与铁、镍制成有各种性能的抗腐蚀的不锈钢,在Mo 和W 的表面也容易形成一层钝态的薄膜。
高中化学竞赛 无机化学第22章__钛副族和钒副族

(3)
制备:
① 工业制法:用氯化焙烧 法处理钒铅矿。 V2O5 +2 NaCl +1/2 O2 = 2 NaVO3 +Cl2 用水浸出偏钒酸钠,将溶液酸化,得到红棕色水合
五氧化二钒沉淀析出。煅烧,得到工业级五氧化二钒。
② 偏钒酸铵热分解法 2 NH4VO3 = V2O5 + 2 NH3 +H2O
③
素存在于挪威的锆石中。此元素被命名为铪 (Hafnium ,) 铪 (Hf) 位于周期系第 IVB 族,统
称钛副族,价电子层结构 (n - 1)d2ns2 ,稳定化态为
IV;
② 钛主要存在于钛铁矿 FeTiO3 和金红石 TiO2 ;
③
④
锆主要存在于锆英石 ZrSiO4 和斜锆石 ZrO2 ;
Al(C2H5)3TiCl3
CH3CHCH2
(CH(CH3) CH2 )n
(3) 四氯化锆(ZrCl4) 白色粉末,在潮湿的空气中产生盐酸烟雾,遇水剧
烈水解。
ZrCl4 + 9 H2O = ZrOCl·8 H2O + 2 HCl 但能溶于水,从溶液中析出的是四方形棱状晶体或针状
水解所得到的产物 ZrOCl2 ·8 H2O,难溶于冷盐酸中, 晶体,这可用于锆的鉴定和提纯。
原因:O22-离子的变形性。
pH 小于 1:有色配离子是 [Ti(O2)(OH)(H2O)4]+
pH = 1~3:有色配离子是 Ti2O52+
22-2
钒副族
钒: Vanadium,美女神 Vanadis 的名字。 铌:Niobium,Tantalus 的女儿 Niobe。 钽: Tantalum, 希腊神 Tantalus 。 价电子构型 (n-1)d3ns2, 最高氧化态为+5 。 属稀有元素。
2015年高中化学竞赛辅导无机化学14.3锗分族知识点素材

§14-3 锗分族T he Germanium Subgroup一、General Properties从Ge 到Pb +2氧化态稳定性增大 从Pb 到Ge +4氧化态稳定性增大 Ge(s) + GeO 2(s)2GeO(s) ∆r G m = 47kJ ·mol -1Sn(s) + SnO 2(s)2SnO(s) ∆r G m = -67kJ ·mol -1PbO2 + 4H ++ 2e Pb 2++ 2H 2O φ = +1.45V GeO 2 + 4H ++ 2eGe 2+ + 2H 2O φ = -0.15V自然界中存在锡石(tinstone):SnO 2,方铅矿(galena):PbS铅存在于Uranium 和Thorium 矿中,这是由于铅是U 和Th 的放射性衰变的产物二、The Simple Substances 1.Allotropes : 灰锡(α锡)13.6℃白锡(β锡)脆锡锡制品长期处于低温会毁坏,这是β锡转变为α锡的缘故,这一现象叫做锡瘟(Tin disease),灰锡是粉末状,β锡低于13.6℃转变为α锡,但转变速度极慢,温度降至-48℃,转变速度最快,α锡本身就是这类反应的催化剂。
2.Properties :(1) Sn 是两性金属 Sn + 2HClSnCl 2 + H 2↑Sn + 2OH -+ 2H2O -24Sn(OH)+ H 2↑Ge 只有在H 2O 2(氧化剂)存在下,才溶于碱Ge + 2KOH 2H 2O 2K 2[Ge(OH)6] Pb 也能与碱反应:Pb + 2H 2O + 2KOH K 2[Pb(OH)4] + H 2↑(2) 与氧化性酸反应:a .Pb 与任何浓度的硝酸反应都得到Pb(NO 3)2 b .Sn 与浓HNO 3反应得到Sn (IV),与稀HN O 3反应得到Sn(II)3Sn + 8HNO 3(稀)3Sn(NO 3)2 + 2NO + 4H 2O Sn + HNO 3(浓)H 2SnO 3 + 4NO 2 + H 2O三、The Compounds1.卤化物 EHal 4 EHal 2 (1) SnCl 2a .水解性 SnCl 2 + H 2OSn(OH)Cl ↓+ H ++ Cl -在配制SnCl 2(aq)必须防止氧化(4O 2SnCl SnCl 2−→−)和水解,用盐酸酸化蒸馏水,并在SnCl 2(aq)中加入Sn 粒:SnCl 4 + Sn 2SnCl 2b .还原性SnCl 2 + 2HgCl 2SnCl 4 + Hg 2Cl 2 Hg 2Cl 2 + SnCl 2SnCl 4 + 2Hg ↓ (2) GeCl 4、SnCl 4也强烈水解 GeCl4 + 2H 2O GeO 2↓+ 4HCl SnCl 4 + 4H 2O Sn(OH)4 + 4HCl在盐酸中:SnCl 4 + 2HClH 2SnCl 6(3) PbCl 2在冷水中溶解度小,但在热水中溶解度大,在盐酸中溶解度增大因为 PbCl 2 + 2Cl --24PbCl(4) PbCl 4在低温下稳定,在常温下即分解:PbCl 4PbCl 2 + Cl 2PbF 4 m.p. = 600℃ PbCl 4 m.p. = -15℃ 2.硫化物(1) SnS :H 2S + Sn 2+SnS ↓(暗棕色) + 2H+SnS 不溶于Na 2S 溶液中,但可溶解于中等浓度的盐酸和碱金属的多硫化物溶液中SnS + 4Cl -+ 2H+-24SnCl + H 2S ↑-+22S SnS −→−+-H 23SnS SnS ↓+ H 2S ↑(2) SnS 2Sn 4++ 2H 2S SnS 2↓+ 4H+SnS 2 + S 2--23SnS (3) PbS :Pb 2+ + S 2-PbS ↓(黑色)PbS 可溶于浓HCl 和稀HNO 3、H 2O 2,不溶于Na 2S 和无氧化性的稀酸 PbS + 4HCl (浓)H 2S ↑+ H 2PbCl 43PbS +-32NO + 8H +3Pb 2++ 3S ↓+ 2NO ↑+ 4H 2O由于Pb (IV)有极强的氧化性,所以PbS 2不存在3.一些铅的化合物 (1) 氧化物PbO (黄色)密陀僧,Pb 2O 3 (PbO ·PbO 2)(黄色),Pb 3O 4 (2PbO ·PbO 2)(红色)铅丹,PbO 2(黑色)Pb 2O 3、Pb 3O 4、PbO 2都具有强氧化性5PbO 2 + 2Mn 2++ 4H +5Pb 2++-42MnO +2H 2O PbO 2 + 4HCl PbCl 2 + Cl 2↑+ 2H 2O(2) Pb(NO 3)2易水解:Pb 2++-3NO + H 2O Pb(OH)NO 3↓+ H +易分解:2Pb(NO3)22PbO + 4NO 2 + 2H 2O(3) Pb(CH 3COO)2 易溶于水,难离解,毒性大 Pb(Ac)2 + Cl 2 + 4KOH PbO 2 + 2KCl + 2KAc + 2H 2O(4) PbSO 4 可溶于浓H 2SO 4中,也可溶于NH 4Ac 或NaAc 溶液中PbSO 4 + H 2SO 4(浓)Pb(HSO 4)2−−→−O H2PbSO 4+ H 2SO 4 PbSO 4(白色)−−→−-Ac PbAc 2(可溶) +-24SO(5) PbCrO4(黄色)PbCr 2O 7(可溶)(6) 铅的有机化合物Na4Pb (钠铅合金) + 4C2H5Cl Pb(C2H5)4 + 4NaCl四乙基铅(tetraethyl lead)是汽油抗震剂(antiknock agent),其△f H m = 217.6kJ·mol 1,但在常温下尚能稳定存在。
高一化学竞赛辅导资料几种重要的金属练习

高一化学竞赛辅导资料几种重要的金属——镁、铝、铁、铜【【易错指津】1.镁是活泼金属,虽不跟碱性溶液反响,但能置换出酸中的氢,也能与水解呈酸性的盐溶液反响产生H2.2.注意对Al2O3、Al(OH)3两性的理解,以及对Al3+、AlO2-存在条件的熟悉.Al2O3、Al(OH)3仅能溶于强酸和强碱溶液中〔如在氨水和碳酸中均不溶〕,Al3+、AlO2-只能分别存在于酸性与碱性溶液中.Al3+与以下离子不能大量共存:OH-、CO32-、HCO3-、SO32-、S2-、AlO2-, AlO2-与以下离子不能大量共存:H+、HCO3-、NH4+、Al3+、Mg2+、Cu2+.3.注意正确理解图象的涵义.图示中每个曲线或每条曲线的转折点〔拐点〕,都反映了特定的反响,假设没有找对,或对生成沉淀和沉淀溶解所需参加〔或通入〕溶液〔或气体〕的量之比没搞清,易导致错误.注意研究以下几个实验现象及产生沉淀的量与参加物质的量的数量关系的图象:①向AlCl3溶液中逐滴参加NaOH溶液直至过量;②向AlCl3和MgCl2混合中逐滴参加NaOH溶液直至过量;④向HCl、MgCl2、AlCl3混合液中逐滴参加NaOH溶液直至过量;③向NaAlO2溶液中逐滴参加HCl溶液直至过量;⑤向HCl溶液中逐滴参加NaAlO2溶液直至过量.这些是以化学知识为载体考查学生的综合水平的重要的命题内容,认真研究一定会有益处.4.Mg(OH)2的溶解度小于MgCO3.所以在碱性溶液中Mg2+总是转化为Mg(OH)2沉淀,产生的MgCO3也会在加热的条件下逐渐转化为Mg(OH)2[MgCO3+H2O(沸水)=Mg(OH)2+CO2↑].5.NO3-与Fe2+在酸性条件下,不能共存.6.过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中参加盐酸,要注意产生的Fe3+还可以氧化单质Fe这一隐含反响:Fe+2Fe3+=3Fe2+.7.注意FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体的区别.FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe2O3固体.但Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体.8.无视亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物.如某溶液中参加碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,而也可能含有Fe2+.9.无视铁单质与强氧化性物质反响时,也有生成二价铁化合物的可能性.反响中假设铁为足量,最终铁元素将以二价铁形式存在,由于2Fe3++Fe=3Fe2+.【典型例题评析】例1 在以下各物质中,参加过量盐酸后,最终不产生沉淀或浑浊的是〔1997年上海高考题〕A.偏铝酸钠溶液B.苯酚钠溶液C.硅酸钠溶液D.硫代硫酸钠溶液答案:A例2 将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的以下溶液中,充分反响后,放出氢气最多的是(1996年上海高考题)A.3mol/LHClB.4mol/LHNO3C.8mol/LNaOHD.18mol/LH2SO4答案:A例3以下物质能跟镁反响并生成氢气的是〔1995年全国高考题〕A.甲酸溶液B.氢氧化钠溶液C.氯化铵溶液D.碳酸钠溶液答案:A、C例4甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别参加等质量的铝粉,反响结束后测得生成的气体体积比为甲:乙=1:2,那么参加铝粉的质量为A.5.4gB.3.6gC.2.7gD.1.6g答案:A例5假设在参加铝粉能放出氢气的溶液中,分别参加以下各组离子,可能共存的是〔1995年上海高考题〕A.NH4+ NO3- CO32- Na+B.Na+ Ba2+ Mg2+ HCO3-C.NO3- Ca2+ K+ Cl-D.NO3- K+ AlO2- OH-答案:C、D了.例6 将溶液〔或气体〕X,逐渐参加〔或通入〕到一定量的Y溶液中,产生沉淀的量与参加X物质的量的关系如图,符合图中情况的一组物质是〔1991例7 怎样将氯化铝和氯化铁的混合溶液别离成氯化铝和氯化铁两种溶液?〔写出实验操作步骤和有关离子方程式〕〔1994年上海高考题〕答案:〔1〕向混合液中加过量NaOH溶液,过滤.Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓(2)把Fe(OH)3沉淀洗涤后参加盐酸到沉淀完全溶解得FeCl3溶液.Fe(OH)3+3H+=Fe3++3H2O(3)取步骤〔1〕所得滤液,参加适量盐酸〔或通入足量CO2〕至完全沉淀为止.AlO2-+H++H2O=Al(OH)3↓(或AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-)(4)再过滤,沉淀经洗涤后,再用盐酸溶解,得AlCl3溶液:Al(OH)3+3H+=Al3++3H2O例8四种化合物①NaHCO3,②Al(OH)3,③(NH4)2S,④Al中,跟盐酸和氢氧化钠溶液都能反响的是〔1991年全国高考题〕A.只有②④B.只有①②C.只有①②③D.①②③④答案:D例9在一定条件下可实现以下图所示物质之间的转化:〔1995年全国高考题〕请填写以下空白:〔1〕孔雀石的主要成分是CuCO3.Cu(OH)2(碱式碳酸铜),受热易分解.以下图中的F是_____.〔2〕写出明矾溶液与过量NaOH溶液反响的离子方程式:______________________.〔3〕图中所得G和D都为固体,混和后在高温下可发生反响,写出该反响的化学方程式:______________________.〔4〕每生成1molD,同时生成____molE.答案:〔1〕CO2〔或二氧化碳〔2〕Al3++4OH-=AlO2-+2H2O〔3〕3CuO+2Al=====Al2O3+3Cu〔4〕3/4 例10久置于空气中的以下物质,因被氧化而呈黄色的是〔2000年全国高考题〕A.浓HNO3B.氯化亚铁溶液C.溴苯D.溴化银答案:B例11某溶液中有NH4+、Mg2+、Fe2+和Al3+4种离子,假设向其中参加过量的NaOH溶液,微热并搅拌,再参加过量的盐酸,溶液中大量减少的阳离子是〔1996年全国高考题〕A.NH4+B.Mg2+C.Fe2+D.Al3+答案:A、C例12将铁屑溶于过量盐酸后,再参加以下物质,会有三价铁生成的是〔1998年全国高考题〕A.硫酸B.氯水C.硝酸锌D.氯化铜答案:B、C例4制印刷电路时常用氯化铁溶液作为“腐蚀液〞:发生的反响为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时参加铁粉和铜粉,反响结束后,以下结果不可能出现的是A.烧杯中有铜无铁B.烧杯中有铁无铜C.烧杯中铁、铜都有D.烧杯中铁、铜都无答案:B例13 在由Fe 、FeO 、和Fe 2O 3组成的混合物中参加100mL2mol/L 的盐酸,恰好使混合物完全溶解,并放出448mL 气体〔标准状况〕,此时溶液中无Fe 3+离子,那么以下判断正确的选项是〔1997年上海高考题〕A.混合物里3种物质反响时消耗盐盐酸的物质的量浓度之比为1:1:3B.反响后所得溶液中的Fe 2+离子与Cl -离子的物质的量浓度之比为1:2C.混合物里,FeO 的物质的量无法确定,但Fe 比Fe 2O 3的物质的量多D.混合物里,Fe 2O 3的物质的量无法确定,但Fe 比FeO 的物质的量多 答案:B 、C例14 Cu +在酸性溶液中不稳定,可发生自身氧化复原反响生成Cu 2+和Cu.现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl 3稀溶液及pH 试纸,简述如何用简便的实验方法来检验CuO 经氢气复原所得红色产物中是否含有碱性氧化物Cu 2O.〔1992年全国高考题〕答案:取少量待检样品放入稀硫酸 ,振荡,假设溶液变为蓝色,说明样品中有Cu 2O,假设溶液不变色,说明产物中无Cu 2O.例15 试样X 由氧化亚铁和氧化铜组成,取质量相等的两份试样按以下图所示进行实验:〔1〕请写出步骤③中所发生的全部反响的离子方程式.〔2〕假设全部的溶液Y 和全部的粉末Z 充分反响后,生成的不溶物W 的质量是m,那么每份试样X 中氧化铜的质量为 .〔用m 表示〕答案:〔1〕Fe+Cu 2+=Fe 2++Cu Fe+2H +=Fe 2++H 2↑ 〔2〕5m/8例16 “卤块〞的主要成分为MgCl 2〔含Fe 2+、Fe 3+、Mn 2+等杂质离子〕,假设以它为原料,按 如下工艺流程图,即可制得“轻质氧化镁〞.〔1997年高测试测题〕如果要求产品尽量不含杂质离子,而且本钱较低.流程中所用试剂或pH限制可参考以下附表确定.*Fe氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化成为Fe,生成沉淀Fe(OH)3而除去.表2 工业品价格表〔1〕在步骤②中参加的物质X,最正确选择应是 ,其作用是 .〔2〕在步骤③中参加的物质Y应是 ,之所以要限制pH=9.8的目的是 .〔3〕在步骤⑤时发生的化学反响方程式是: .答案:〔1〕漂液使Fe2+氧化成为 Fe3+〔2〕烧碱使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便过滤除去. 〔3〕MgCO3+H2O= Mg(OH)2↓+CO2↑【稳固练习】1、以下物质中,不属于合金的是A.硬铝B.黄铜C.钢铁D.水银2、把a g铁铝合金粉末溶于足量盐酸中,参加过量NaOH溶液.过滤出沉淀,经洗涤、枯燥、灼烧,得到红棕色粉末的质量仍为a g,那么原合金中铁的质量分数为A.70%B.52.4%C.47.6%D.30%3、将一定质量的Mg,Zn,Al混合物与足量稀H2SO4反响,生成H2 2.8L〔标准状况〕,原混合物的质量可能是A.2gB.4gC.8gD.10g4、铁屑溶于过量的稀硫酸,过滤后向滤液中参加适量硝酸,再参加过量的氨水,有红褐色沉淀生成.过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣.上述沉淀和残渣分别为A.Fe(OH)3;Fe2O3B.Fe(OH)2;FeOC.Fe(OH)2、Fe(OH)3;Fe3O4D.Fe2O3;Fe(OH)35、某同学想用实验证实高锰酸钾溶液的紫红色是MnO4-离子的颜色,而不是K+的颜色,它涉及的以下实验步骤中没有意义的是A.将高锰酸钾晶体加热分解,所得固体质量减少B .观察氯化钾溶液没有颜色,说明溶液中K+无色C .在氯化钾溶液中参加适量锌粉振荡,静置后未见明显变化,说明锌与K +无反响D .在高锰酸钾溶液中参加适量锌粉振荡,静置后见紫红色褪去,说明MnO 4-粒子为紫红色 6、以下有关纯铁的描述正确的选项是A.熔点比生铁的低B.与相同浓度的盐酸反响生成氢气的速率比生铁的快C.在潮湿空气中比生铁容易被腐蚀D.在冷的浓硫酸中可钝化7、我国报道的高温超导体中,铊是组成成分之一.铊和铝是同族元素,关于铊的判断错误的选项是 A.铊是银白色的金属 B.氢氧化铊是两性氧化物 C.能生成+3价的化合物 D.能置换出盐酸中的氢离子8、在含有Cu 〔NO 3〕2、Mg 〔NO 3〕2和AgNO 3的溶液中参加适量锌粉,首先置换出的是 A.Mg B. Cu C. Ag D. H 29、CuS 和Cu 2S 都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS 和Cu 2S 两种黑色粉末的方法合理的是A.将两种样品分别溶于硝酸,区别所产生的气体B.将两种样品分别溶于硝酸,区别溶液的颜色C .取两种同质量的样品分别在高温灼烧,区别残留固体的质量 D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色 10、将外表已完全钝化的铝条,插入以下溶液中,不会发生反响的是 A .稀硝酸 B .稀盐酸 C .硝酸铜D .氢氧化钠11、在溶液中能与AlO 2-大量共存的是A .OH -B .Al 3+C .Cu 2+D .NH 4+12、铝分别与足量的稀盐酸和氢氧化钠溶液反响,当两个反响放出的气体在相同状况下体积相等时,反响中消耗的HCl 和NaOH 物质的量之比为A .1:1B .2:1C .3:1D .1:313、把Ba(OH)2溶液滴入明矾溶液中,使SO 42-全部转化为BaSO 4沉淀,此时铝元素的主要存在形式是A.Al 3+B.Al(OH)3C.AlO 2-D.Al 3+和Al(OH)3 14、以下除去杂质的实验方法正确的选项是A .除去CO 中少量O 2:通过灼热的Cu 网后收集气体B .除去K 2CO 3固体中少量NaHCO 3:置于坩埚中加热C .除去苯中溶有的少量苯酚:参加适量浓溴水反响后过滤D .除去FeCl 3酸性溶液中少量的FeCl 2:参加稍过量双氧水后放置 15.以下除杂质的方法不可行...的是 A .用过量氨水除去Al 3+溶液中的少量Fe 3+B .将混合气体通过灼热的铜网除去N 2中的少量O 2C .用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水D .用盐酸除去AgCl 中少量的Ag 2CO 316、以下金属冶炼的反响原理,错误的选项是〔 〕A 、2NaCl(熔融) →通电2Na + Cl 2↑B 、MgO + H 2 →△Mg + H 2OC 、Fe 3O 4 + 4CO →高温3Fe + 4CO 2D 、2HgO →△ 2Hg + O 2↑ 17、将钠、镁、铝0.3mol 分别放入100mL1mol ·L -1的盐酸中,同温同压下产生的气体体积比是A 、1︰2︰3B 、6︰3︰2C 、3︰1︰1D 、1︰1︰118、铁是自然界分布最广的金属元素之一,在地壳中的质量约占5%左右.铁矿石的种类很多,重要的有磁铁矿石〔主要成分是Fe 3O 4〕、赤铁矿石〔主要成分是Fe 2O 3〕等.〔1〕写出赤铁矿炼铁的主要化学方程式 ;〔2〕红热的铁能跟水蒸气反响,有一种产物是可燃性气体,那么其反响式为 在常温下,铁跟水不起反响.但是,在水和空气里的氧气及二氧化碳等的共同作用下,铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.刷油漆是重要的防腐蚀举措之一,油漆防腐蚀的主要原理是 .〔3〕铁元素是人体的重要营养元素,举一例说明铁元素在人体中的重要作用 . 19、海水的综合利用可以制备金属镁,其流程如以下图所示:〔1〕假设在空气中加热MgCl 2·6H 2O 生成的是Mg(OH)Cl 或MgO,写出相应反响的化学方程式____________________________________________________________; 〔2〕Mg(OH)2沉淀中混有Ca(OH)2应怎样除去?写出实验步骤.__________________________________________________________________________〔3〕实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的目的:溶解时:_________________________________________________________; 过滤时:_________________________________________________________; 蒸发时:_________________________________________________________.20、锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn 〔NH 3〕42+.答复以下问题:〔1〕单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 〔用化学式表示〕. 〔2〕写出锌和氢氧化钠溶液反响的化学方程式 .〔3〕以下各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 .① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水 〔4〕写出可溶性铝盐与氨水反响的离子方程式 .试解释在实验室不适宜用可溶性锌盐与氨水反响制备氢氧化锌的原因 .21、硫酸亚铁〔FeSO 4·7H 2O 〕是一种重要的食品和饲料添加剂.实验室通过如下实验由废铁屑制备FeSO 4·7H 2O 晶体:①将5% Na 2CO 3溶液参加到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na 2CO 3溶液,然后将废铁屑用水洗涤2 ~ 3遍;②向洗涤过的废铁屑中参加过量的稀硫酸,限制温度在50 ~ 80℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2 ~ 3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存.请答复以下问题:〔1〕实验步骤①的目的是 ,加热的作用是 .〔2〕实验步骤②明显不合理,理由是 .〔3〕实验步骤④中用少量冰水洗涤晶体,其目的是;.〔4〕经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示〔仅在56.7℃、64℃温度下假设需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应限制的结晶温度〔t〕的范围为 .参考答案1、D2、A3、B4、A5、A6、D7、B8、C9、C 10、C 11、A 12、C 13、D 14、D 15、A 16、B 17、C18、〔1〕Fe2O3+3CO=2Fe+3CO2〔2〕3Fe+4H2O(气)= Fe3O4+4H2将金属与空气和水隔离〔3〕血红素中含铁,人体缺铁会造成贫血19、〔1〕MgCl2•6H2O =Mg(OH)Cl + HCl↑ + 5H2O↑MgCl2•6H2O =MgO + 2HCl↑ + 5H2O↑或Mg(OH)Cl =MgO + HCl↑〔2〕参加MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤〔3〕搅拌,加速溶解使待滤液体沿玻璃棒流入漏斗,预防外洒搅拌,预防因局部过热液滴或晶体飞溅20、〔1〕AlO2-〔或Al〔OH〕4-〕〔2〕Zn+2NaOH=Na2ZnO2+H2↑〔或Zn+2NaOH+2H2O=Na2Zn〔OH〕4+H2↑〕〔3〕①③④ 〔4〕Al3++3NH3·H2O=A l(O H)3↓+3NH4+可溶性锌盐与氨水反响产生的Zn(OH)2可溶于过量氨水中,生成Zn(NH3)42+,氨水的用量不易限制21、〔1〕除油污升高温度,溶液碱性增强,去油污水平增强〔2〕应该铁屑过量〔或反响后溶液中必须有铁剩余〕,否那么溶液中可能有Fe3+存在〔3〕用冰水洗涤可降低洗涤过程中FeSO4·7H2O的损〔4〕56.7℃<t < 64℃。
高中化学课件:钛族

钛的表面可以呈现高度的反射性 ,看起来类似于不锈钢。它的颜 色和光泽度在不同的环境下可能 会有所变化。
钛的晶体结构与状态
总结词
钛的晶体结构是面心立方,它的熔点相对较高,常温下以固态形式存在。
详细描述
在固态下,钛的晶体结构紧密,这使得它具有较高的熔点和良好的耐热性。在 常温下,钛是稳定的金属状态。
高中化学课件:钛族
目录
• 钛族元素简介 • 钛的物理性质 • 钛的化学性质 • 钛的应用 • 钛的制备与提取 • 总结与展望
01 钛族元素简介
钛元素的基本信息
原子序数:22 原子量:47.87
元素符号:Ti
钛元素的基本信息
01
元素类型:过渡金属
02
电子排布:[Ar]4s23d2
03
发现者:格雷戈尔·锰茨
钛的熔点、沸点以及密度
总结词
钛的熔点为1668°C,沸点为3287°C,密度为4.5克/立方厘米 。
详细描述
这些特性使得钛在高温环境下仍能保持其金属特性,并且在 常温下具有较高的强度和硬度。同时,钛的密度相对较低, 这意味着它具有较好的轻量化特性。
03 钛的化学性质
钛的化学反应活性
总结词
钛的化学反应活性较低,常温下不易与空气中的氧气、氮气和水等物质反应。
挑战方面,需要解决钛的资源短 缺问题,并加强技术创新,提高 钛产品的质量和附加值,以推动
钛产业的可持续发展。
谢谢聆听
钛的化合物及其性质
总结词
钛的化合物包括钛酸盐、二氧化钛等,具有不同的物理和化学性质。
详细描述
除了金属钛本身外,钛的化合物还包括各种钛酸盐和二氧化钛等。这些化合物的性质各异,如二氧化钛可用于制 造颜料和涂料,而某些钛酸盐则是陶瓷和玻璃等材料的成分之一。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十八章 过渡元素(I )
Chapter 18 The Transition Elements (I )
引 言(Introduction )
一、Definition :具有部分充填d 或f 壳层电子的元素。
它包括第四、五、六周期从ⅢB
到Ⅷ族的元素,共有8个直列,这些元素都是金属元素,也称为过渡金属。
人们也常将铜分族看作过渡元素,这是由于Cu 2+
具有3d 9
,Au 3+
具有5d 8
,且性质也与过渡元素十分相似的缘故。
二、Elements’ Symbol :
Ac Pt Ir Os Re W Ta Hf La Pd
Rh Ru Tc Mo Nb Zr Y Ni Co Fe Mn Cr V Ti Sc
三、Valence Orbital (n - 1)d 、n s 、n p 共九个轨道 四、Oxidation State : 1.过渡元素都有可变氧化态,
2.+2氧化态几乎为所有过渡元素的特征氧化态,
3.绝大部分过渡元素的最高氧化态等于其族数:Sc 2O 3、CrO 3、Mn 2O 7,
4.随着原子序数的增加其高价氧化态越来越稳定:如未发现FeO 4,而发现OsO 4。
其
∆f 4OsO m,G = -302kJ·mol -1
五、Coordination Capac ity :过渡元素有很强的配位能力,因为有空的价轨道,与配位
原子形成σ配键;又有富的d 电子,可与配体的π*
反键轨道或n d 空轨道形成反馈π键。
§18-1 钛分族 The Titanium Subgroup
包括: Titanium (Ti) Zirconium (Zr) Hafnium (Ha) Rutherfordium (Rf) Valence electron configuration :(n - 1)d 2
n s 2
一、General Properties
1.Radius :从Ti 到Zr 是增大的,而Zr 和Hf 是相似的,这是由于镧系收缩造成的,使
Zr 、Hf 分离困难,只能采取离子交换(ion exchange )法或溶剂萃取(solvent
extraction )法来分离它们。
2.First ionization energy ( I 1 ):从Ti -Zr -Hf 稍微有点升高。
3.Oxidation number
Ti Zr Hf +2,+3,+4
+4 +4
TiO 、32O Ti 、2TiO 2ZrO 2HfO 、4Hf F
从单质形成化合物必须要断开单质的键能,同时伴随原子之间的相互作用形成化合物所释放的能量。
金属的原子化所需能量比非金属的键能大得多,在形成MF 2、MF 3、MF 4的过程中,同一种金属所需要的原子化能是相同,而反应放出的能量从MF 2到MF 4是增大的。
对于原子序数大的过渡元素,原子化能是增大的,所以Zr 、Hf 应形成最高氧化态的化合物而得以稳定。
4.Coordination number :Ti :4,6 Zr 、Hf :7,8
5.Occurrence in nature :金红石(rutile):TiO 2,钛铁矿(ilmenite):FeTiO 3 钙铁矿(perovskite):CaTiO 3 二、The Simple Substances
1.Physical properties :银白色金属,Ti 为轻金属,Zr 、Hf 为高熔点的重金属 2.Chemical properties :
(1) 在室温下,Ti 表面有一层致密的保护层,抗腐蚀、抗海水,所以钛可用于航海和航空制造业上
(2) 在高温下,活性显著增强
MX H 2C 1300K
1000K
M MH 1.0~MB(MB 2)
2
MC
MN
(3) 与酸反应: a .与热的盐酸反应:
2Ti(s) + 6H +
(g) + 12H 2O(l)2[Ti(H 2O)6]3+
(aq) + 3H 2(g)
b .与HF 或含-F 离子的酸反应:
M(s) + 6HF(aq)
2H +
(aq) + 26MF -(aq) + 2H 2(g) (M = Ti 、Zr 、Hf)
3M(s) + 4HNO 3(aq) + 18HF(aq)3H 2[MF 6](aq) + 4NO(g) +
8H 2O(l)
Explanation : V 19.1Ti /TiF 26
-=-ϕ,V 23.1Ti /Ti 3-=+ϕ,而23+
TiO
/Ti
0.1V ϕ+
=+,即
23+
22
6TiO
/Ti
H /H TiF
/Ti
ϕϕϕ+
+
-
>>,所以Ti 与HCl 反应,生成+3Ti ,而与HF 或含-F 离子的酸
反应,生成-
26TiF 。
3.Preparation: 由于Ti 、Zr 和Hf 在高温时化学性质很活泼,所以制备纯态很困难
Mg 2TiCl 4+Ti 2MgCl 2+ 4Na
][ZrF K 73+Zr 3KF 4NaF ++ (magnesiothermic reaction)
(sodiothermic reaction)
提纯:Ti(粗) + 2I 2(s)200C ︒−−−
→TiI 4(s)373C ︒−−−→TiI 4(g)1000~1400K
−−−−−→Ti(s) + 2I 2(g)
三、Their Compounds 1.[+4] O.S.
(1) TiO 2钛白:用作高级颜料和皮革、塑料的添加剂
a .properties :难溶于水和稀酸,但可溶于浓H 2SO
4
)
(422SO H TiO 浓+O H TiOSO 24+, −−→−-
O H
新制钛酸盐TiO 2·n H 2O
·n H 2O α型钛酸(可溶于酸、碱)
β型钛酸(不溶于酸、碱) 其α型钛酸的反应活性大于β型钛酸
b .preparation :
干法:TiO 2(金红石) + 2Cl 2 + 2C
TiCl 4↑+ 2CO ↑
TiCl 4 + O 2700~900℃
TiO 2 + 2Cl 2 在此制备过程中,Cl 2可循环使用。
湿法(硫酸法):
)%80()(423SO H FeTiO 以上磨细的钛铁矿+O H 2FeSO TiOSO 244++ TiOSO 4水解:TiOSO 4 + H 2O TiO 2·n H 2O + H 2SO 4 促进水解的方法有:稀释水解、加碱水解、加热水解等。
c .Ti
(IV)
含量的测定:
Al 3Ti (IV)++++33Al 3Ti (用Al 还原Ti
(IV)
)
以KSCN 为指示剂,用+3Fe 标准溶液滴定+3Ti ,来测定)(Ti Ⅳ的含量
+
++33Fe Ti ++2)(Fe Ti Ⅳ 终点指示为红色
(2) TiCl 4
a .preparation: TiO 2 + 2Cl 2 + 2C
TiCl 2↑+ 2CO ↑或TiO 2 + CCl 4 + 2C TiCl 4↑+
CO 2↑
b .properties:
(i) hydrolysis : O H 2TiCl 24+4HCl TiO 2+ 用于气相反应跟踪
(ii) 溶于浓盐酸:2HCl TiCl 4++-+2H TiCl 26 (iii)与还原剂反应:2
4H 2TiCl +2HCl 2TiCl 3+
Zn
2TiCl 4+223ZnCl TiCl +
(3) Ti
(IV)
的配位化合物:
a .Ti
(IV)
在水中的形式为[Ti(OH)2(H 2O)4]2+
,简写为TiO 2+
;
b .在TiO SO 4·H 2O 晶体中不存在简单的TiO 2+
,是以―Ti ―O ―Ti ―长链存在,可
以用+
n n 2(TiO)表示;
c .在Ti (IV)中加入H 2O 2,pH <1时,为[Ti(O 2)(OH)(H 2O)4]+
单核配离子,呈红色;
pH = 1~3时,为+
252O Ti ,为双核配离子,呈橙黄色。
这些配离子之所以有颜色是由于-
22O 离子变形性较 强,发生-22O 向Ti
(IV)
上电荷跃迁(charge
transfer )
2.[+3] O.S.
(1) preparation :2TiO 2 + H 2
1200℃
Ti 2O 3 + H 2O
2TiCl 4 + H 2
650℃
2TiCl 3 + 2HCl
(2) properties :
a .易被氧化:O H 2O TiCl 223++HCl 44TiOCl 2+
b .歧化:2TiCl 3(s)
400℃
TiCl 2(s) + TiCl 4(g)
Ti
O O
O Ti O
O
2TiCl2(s)Ti(s) + TiCl4(g)
c.配位:水溶液中Ti(III) 以[Ti(H2O)6]Cl3(紫色)形式存在,若在TiCl3中加入无水乙醚,并通入HCl至饱和,则在乙醚层中得到[Ti(H2O)5Cl]Cl2·H2O(绿色)。
