脂肪烃__课件资料
合集下载
有机化学课件第二章脂肪烃
σ-π共轭
-超共轭体系
H H C H H C CH2
-超共轭效应的表示式
4、不饱和烃的结构 化合物分子中可能含有两个以上的不饱和键.根据不饱和键的相 互关系分为三类: 两个不饱和键相隔两个以上单键的叫孤立不饱和烃。 CH2=CH-CH2-CH=CH2 两个不饱和键直接相连的叫累积不饱和烃. CH2=C=CH2
CHCH 乙炔
C6H12 环己烷 C6H10 环己烯 双环[2.1.1]己烷 螺[4.4]壬烷 苯 萘
脂 环
环
烃
烃 芳 烃
单环芳烃 多环芳烃
非苯芳烃
薁
二、脂肪烃的不饱和度 脂肪烃化合物是只含有碳氢两种元素的开链烃。饱和烃又称 为烷烃,它的分子式通式为CnH2n+2。不饱和烃的不饱和程度 用不饱和度表示. 对于化合物的不饱和度,可用下式计算:
Br C CH3 C H CH3CH2 Cl CH3 C C CH2CH3 CH2CH2CH3
CH3CH3 乙烷 CH2CH2 乙烯
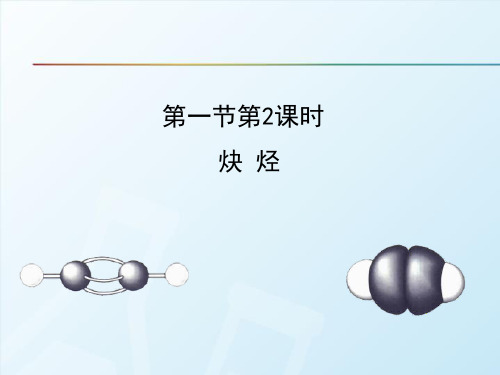
炔烃 单 环 烃
多 环 烃 环烷烃 环烯烃 桥环烃 螺环烃
CnH2n—2
CnH2n CnH2n—2 CnH2n—2 CnH2n—2 CnH2n-6 CnH2n-12
含不饱和CC叁键
含饱和C-C和C-H键 含带双键的碳环 两个环共用两个以上碳原 子 两个环共用一个碳原子 含一个芳环的碳环 含两个或以上芳环 含有结构和性质与苯环相 似的芳烃
CH=CH-CH2+
R''
H
H
H
> R C
R'
> R C
> R C
H
> H C
CH=CH-CH2
第一节 脂肪烃课件

石油的催化裂化是将重油成分(如石 油)在催化剂存在下,在460~520℃及 100kPa~ 200kPa的压强下,长链烷烃断裂 成短链烷烃和烯烃,从而大大提高汽油的 产量。
石油催化裂解是深度的裂化,使短链 的烷烃进一步分解生成乙烷、丙烷、丁烯 等重要石油化工原料。
石油催化重整的目的有两个:提高汽 油的辛烷值和制取芳香烃。
3.在标准状况下将11.2升乙烯和乙炔的混合气通入到 溴水中充分反应,测得有128克溴参加了反应,测乙 烯、乙炔的物质的量之比为( )
A.1∶2 B.2∶3 C.3∶4 D.4∶5
4.描述CH3—CH = CH—C≡C—CF3分子结构的下列叙 述中正确的是( )
A.6个碳原子有可能都在一条直线上 B.6个碳原子不可能都在一条直线上 C.6个碳原子有可能都在同一平面上 D.6个碳原子不可能都在同一平面上
1.某气态烃0.5mol能与1mol HCl氯化氢完
全加成,加成产物分子上的氢原子又可被
3mol Cl2取代,则气态烃可能是
A、CH ≡CH
B、CH2=CH2
C、CH≡C—CH3
D、CH2=C(CH3)CH3
2含一叁键的炔烃,氢化后的产物结构简式如 下,炔烃可能的结构有( )
A.1种 B.2种 C.3种 D.4种
自学时间
弄清以下问题
1、石油、天然气、煤的综合开发与 利用 2、石油的分馏 裂化、裂解 常压蒸馏、减压蒸馏
3、石油的催化重整
四、脂肪烃的来源及其应用
脂肪烃的来源有石油、天然气和煤等。
石油通过常压分馏可以得到石油气、汽油、 煤油、柴油等;而减压分馏可以得到润滑油、 石蜡等分子量较大的烷烃;通过石油的催化裂 化及裂解可得到较多的轻质油和气态烯烃,气 态烯烃是最基本的化工原料;而催化重整是获 得芳香烃的主要途径。
脂肪烃 课件

脂肪烃 课件
目录
• 脂肪烃简介 • 脂肪烃的来源与合成 • 脂肪烃的物理性质 • 脂肪烃的化学性质 • 脂肪烃的安全与环保 • 脂肪烃的未来发展与挑战
CHAPTER 01
脂肪烃简介
定义与分类
定义
脂肪烃也称为链烃,是指碳原子 之间通过单键连接形成的烃类。
分类
根据碳原子数,脂肪烃可以分为 烷烃、烯烃、炔烃等。
废物处理
废弃的脂肪烃应按照相关法规进行安全处理,以 防止对环境和人类健康造成危害。
替代品研发
鼓励研究和开发更安全、更环保的脂肪烃替代品 ,以减少其对环境和健康的负面影响。
CHAPTER 06
脂肪烃的未来发展与挑战
新技术与新应用
新型合成技术
随着科技的发展,脂肪烃的合成技术 也在不断进步,如绿色合成方法、生 物催化合成等,这些技术能够提高脂 肪烃的合成效率和纯度,降低生产成 本。
烷烃的裂化与裂解
在特定条件下,长链烷烃可以 发生裂化反应生成短链烷烃和 烯烃,或者裂解生成更为简单
的烃类。
ቤተ መጻሕፍቲ ባይዱ
烯烃的化学性质
01
02
03
04
烯烃的加成反应
烯烃容易与卤素、氢气、卤化 氢等发生加成反应,生成相应
的加成产物。
烯烃的氧化反应
烯烃可以被氧化剂氧化,生成 酮、羧酸等化合物。
烯烃的聚合反应
在特定条件下,烯烃可以发生 聚合反应,生成高分子聚合物
随着科技的进步和社会的发展,脂肪烃将在更多领域得到应用,如新能源、生物医药、高端制造等新 兴领域,这将为脂肪烃的发展提供更广阔的市场和发展空间。
THANKS FOR WATCHING
感谢您的观看
CHAPTER 05
目录
• 脂肪烃简介 • 脂肪烃的来源与合成 • 脂肪烃的物理性质 • 脂肪烃的化学性质 • 脂肪烃的安全与环保 • 脂肪烃的未来发展与挑战
CHAPTER 01
脂肪烃简介
定义与分类
定义
脂肪烃也称为链烃,是指碳原子 之间通过单键连接形成的烃类。
分类
根据碳原子数,脂肪烃可以分为 烷烃、烯烃、炔烃等。
废物处理
废弃的脂肪烃应按照相关法规进行安全处理,以 防止对环境和人类健康造成危害。
替代品研发
鼓励研究和开发更安全、更环保的脂肪烃替代品 ,以减少其对环境和健康的负面影响。
CHAPTER 06
脂肪烃的未来发展与挑战
新技术与新应用
新型合成技术
随着科技的发展,脂肪烃的合成技术 也在不断进步,如绿色合成方法、生 物催化合成等,这些技术能够提高脂 肪烃的合成效率和纯度,降低生产成 本。
烷烃的裂化与裂解
在特定条件下,长链烷烃可以 发生裂化反应生成短链烷烃和 烯烃,或者裂解生成更为简单
的烃类。
ቤተ መጻሕፍቲ ባይዱ
烯烃的化学性质
01
02
03
04
烯烃的加成反应
烯烃容易与卤素、氢气、卤化 氢等发生加成反应,生成相应
的加成产物。
烯烃的氧化反应
烯烃可以被氧化剂氧化,生成 酮、羧酸等化合物。
烯烃的聚合反应
在特定条件下,烯烃可以发生 聚合反应,生成高分子聚合物
随着科技的进步和社会的发展,脂肪烃将在更多领域得到应用,如新能源、生物医药、高端制造等新 兴领域,这将为脂肪烃的发展提供更广阔的市场和发展空间。
THANKS FOR WATCHING
感谢您的观看
CHAPTER 05
脂肪烃--课件

2) 反应原理: CaC2+ 2 H2O 3) 制取装置:
固+液
Ca(OH)2 + C2H2 气体
下列那种装置可以用来做为乙炔的制取装置?
BF
A
B
C
D
E
F
下列那种装置可以用来做为乙炔的收集装置?
A
A
B
C
能否用启普发生器制取乙炔?
因为碳化钙与水反应剧烈,启普发生器不 易控制反应;
反应放出的热量较多,容易使启普发生器炸 裂。
脂肪烃
烃的分类
什么是脂肪烃?
• 具有脂肪族化合物基本属性的碳氢化合物叫做脂肪烃。
• 分子中碳原子间连结成链状的碳架,两端张开而不成 环的烃,叫做开链烃,简称链烃。因为脂肪具有这种 结构,所以也叫做脂链烃。
• 有些环烃在性质上不同于芳香烃,而十分类似脂链烃, 这类环烃叫脂环烃。这样,脂肪烃便成为除芳香烃以 外的所有烃的总称。脂链烃和它的衍生物总称为脂肪 族化合物,脂环烃及它的衍生物总称脂环族化合物。
思考
制出的乙炔气体为什么先通入硫酸铜溶液?
因电石中含有 CaS、Ca3P2等,也会与水反 应,产生H2S、PH3等气体,所以所制乙炔气体 会有难闻的臭味。
硫酸铜溶液吸收H2S,溶解PH3。
(3)制取时在导气管口附近塞入少量棉花
目的:为防止产生的泡沫涌入导管。
(4)纯净的乙炔气体是无色无味的气体。 用电石和水反应制取的乙炔,常闻到有恶臭 气味,是因为在电石中含有少量硫化钙、砷 化钙、磷化钙等杂质,跟水作用时生成H2S、 ASH3、PH3等气体有特殊的气味所致。
乙炔合成 聚氯乙烯
炔 烃:
定义:炔烃是一类含有碳碳三键的脂肪烃。
通式:为CnH2n-2(n≥2),属于不饱和烃。 物理性质(递变性)
人教版《脂肪烃》优秀课件PPT
寄言燕雀莫相唣,自有云霄万里高。
分子里含有碳碳三键的一类链状烃称为炔烃。
CH≡CH+2HCl
催化剂
△
CH3-CHCl2
③与Br2加成,可使溴水或Br2的CCl4溶液褪色
1 , 2 —二溴乙烯 1 , 1 , 2 , 2 —四溴乙烷
(3) 加聚反应 n CH ≡ CH
催化剂
[ CH=CH ]n 导电塑料
实验注意事项:
③ 制取时在导气管口附近塞入少量棉花 目的:为防止产生的泡沫涌入导管。
④ 用电石和水反应制取的乙炔往往含有H2S、 PH3等杂质气体,因为: 电石中含有少量硫化钙、磷化钙等杂质,跟 水反应时生成H2S、PH3等气体。 除杂:用硫酸铜溶液
7. 炔烃的通性: ⑴ 物理性质: 随碳原子数的增多,熔沸点逐渐升高。一般, 碳原子数小于等于4的为气态。 ⑵ 化学性质: 与乙炔相似。 能发生氧化反应、加成反应、加聚反应。
【小结】烷烃、烯烃、炔烃的比较
器大者声必闳,志高者意必远。
①加氢气 CH≡CH+H 是无色无味,密度比空气稍小的气体,微溶于水,易溶于有机溶剂。
① 原料:电石(CaC2)与 H2O 雄鹰必须比鸟飞得高,因为它的猎物就是鸟。
2
现象:火焰明亮伴有浓烟
△ CH2=CH2 乙烯
⑵加成反应 (与H2、Br2、HX、H2O等加成):
有志登山顶,无志站山脚。
3)催化重整:获得芳香烃
CH≡CH+HCl △ CH =CHCl ②与HX、H2O的加成
催化剂
2 电石中含有少量硫化钙、磷化钙等杂质,跟水反应时生成H2S、PH3等气体。
CH≡CH+2HCl
CH3-CHCl2
氯乙烯 是无色无味,密度比空气稍小的气体,微溶于水,易溶于有机溶剂。
分子里含有碳碳三键的一类链状烃称为炔烃。
CH≡CH+2HCl
催化剂
△
CH3-CHCl2
③与Br2加成,可使溴水或Br2的CCl4溶液褪色
1 , 2 —二溴乙烯 1 , 1 , 2 , 2 —四溴乙烷
(3) 加聚反应 n CH ≡ CH
催化剂
[ CH=CH ]n 导电塑料
实验注意事项:
③ 制取时在导气管口附近塞入少量棉花 目的:为防止产生的泡沫涌入导管。
④ 用电石和水反应制取的乙炔往往含有H2S、 PH3等杂质气体,因为: 电石中含有少量硫化钙、磷化钙等杂质,跟 水反应时生成H2S、PH3等气体。 除杂:用硫酸铜溶液
7. 炔烃的通性: ⑴ 物理性质: 随碳原子数的增多,熔沸点逐渐升高。一般, 碳原子数小于等于4的为气态。 ⑵ 化学性质: 与乙炔相似。 能发生氧化反应、加成反应、加聚反应。
【小结】烷烃、烯烃、炔烃的比较
器大者声必闳,志高者意必远。
①加氢气 CH≡CH+H 是无色无味,密度比空气稍小的气体,微溶于水,易溶于有机溶剂。
① 原料:电石(CaC2)与 H2O 雄鹰必须比鸟飞得高,因为它的猎物就是鸟。
2
现象:火焰明亮伴有浓烟
△ CH2=CH2 乙烯
⑵加成反应 (与H2、Br2、HX、H2O等加成):
有志登山顶,无志站山脚。
3)催化重整:获得芳香烃
CH≡CH+HCl △ CH =CHCl ②与HX、H2O的加成
催化剂
2 电石中含有少量硫化钙、磷化钙等杂质,跟水反应时生成H2S、PH3等气体。
CH≡CH+2HCl
CH3-CHCl2
氯乙烯 是无色无味,密度比空气稍小的气体,微溶于水,易溶于有机溶剂。
人教版-选修化学脂肪烃PPT演示

自然界中存在的脂肪烃
二 十 七
烷二十九烷
水 果 中 的 胡
萝
卜
素
十一C烷10和H1十6 三烷
人教版-选修化学脂肪烃PPT演示(优 秀课件 )
人教版-选修化学脂肪烃PPT演示(优 秀课件 )
沸点℃
200
脂肪烃的物理性质
烷烃
相对密度
烷烃
100 50
烯烃 0
0.6 烯烃
0.4
1 0 0 2 4 6 8 10 12 14 16 分子中碳原子数
人教版-选修化学脂肪烃PPT演示(优 秀课件 )
1.乙炔的组成和结构:
分子式: C2H2
H C C H 电子式:
● ×
●● ●● ●●
● ×
结构式: H—C≡C—H 结构简式: CH≡CH 或 HC≡CH 空间结构: 直线形,键角1800
人教版-选修化学脂肪烃PPT演示(优 秀课件 )
人教版-选修化学脂肪烃PPT演示(优 秀课件 )
人教版-选修化学脂肪烃PPT演示(优 秀课件 )
知识回顾 烷烃和烯烃的结构与性质
烷烃
烯烃
通式 结构特点
代表物
CnH2n+2 全部单键, 饱和
CH4
代表物的结构式 和电子式
CnH2n
有碳碳双键,不 饱和
CH2﹦CH2
HH
C=C
H
H
代表物空间构型 四面体
平面构型
主要化学性质
人教版-选修化学脂肪烃PPT演示(优 秀课件 )
CH3
思考: 1,3-丁二烯分子中最少有多 少个C原子在同一平面上?最多可以 有多少个C原子在同一平面上?
人教版-选修化学脂肪烃PPT演示(优 秀课件 )
第一节脂肪烃 PPT课件

习 同点?
甲烷
乙烯
分子式 电子式 结构式 结构简式 空间结构
特点
CH4
CH4 正四面体
C2H4
‥H ‥H
H:C::C:H CH2 CH2
平面结构
化学性质: 取代
加成
2.什么叫同系物?精选版课件ppt
5
思考与交流(2)
(1)CH3CH3+Cl2 光
CH3CH2Cl+HCl
取代反应:有机物分子中某些原子或原子团被其它
精选版课件ppt
8
乙烯的化学性质:
(1)加成反应(与H2、Br2、HX、H2O等):
催化剂
CH3-CH=CH2 + H2
CH3CH2CH3
CH2==CH2+Br2
CH2BrCH2Br
使溴水褪色
精选版课件ppt
9
(2)氧化反应: ①燃烧: 火焰明亮,冒黑烟。 ②与酸性KMnO4的作用:使KMnO4溶液褪色
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2 ↑ + 12MnSO4 + 6K2SO4 + 28H2O
除去CH4中的CH2=CH2,用哪种试剂比较好 ? ① 溴的四氯化碳溶液② 酸性KMnO4
精选版课件ppt
10
(3)加聚反应:
nCH2==CH2 催化剂
[ CH2 CH2 ] n
反应(加成聚合反应)。
精选版课件ppt
6
烷烃的化学性质:
1、通常状况下,它们很稳定,跟酸、碱及氧化物 都不发生反应,也难与其他物质化合。
2 、氧化反应
燃烧:
CH4
+
2O2
第一单元脂肪烃

H Cl + CH3 Cl CH3 + Cl
链增长
Cl Cl
H3C CH3 Cl CH3
链终止
专3题脂肪烃的性质
常见的烃
化学性质——取代反应
1.含义:有机物分子中某些原子或原 子团被其它原子或原子团替代的反应
2.常见类型:卤代反应、酯化反应、 硝化反应、磺化反应
3.反应机理:P12自由基型链反应
专3题脂肪烃的性质
常见的烃
化学性质——加成反应(乙烯与氯化氢)
专3题脂肪烃的性质
常见的烃
化学性质——加成反应
1.含义:有机物分子中不饱和键的两 个原子与其它原子或原子团直接结合 生成新物质的反应
2.常见类型:烯烃、炔烃、二烯烃
3.反应机理:马氏规则
专3题脂肪烃的性质
常见的烃
化学性质——加成反应(1,3丁二烯与Br2)
除杂:CH4(C2H4)
溴水
专3题脂肪烃的性质
常见的烃
化学性质——取代反应(甲烷与氯气)
专3题脂肪烃的性质
常见的烃
化学性质——取代反应
甲烷与氯气生成氯代甲烷是按自由基机理进行:
〔1〕 Cl-Cl hn 2Cl· 自由基引发
〔2〕 〔A〕 Cl + H CH3 〔B〕 CH3 + Cl Cl
〔3〕 〔a〕 Cl + Cl 〔b〕 CH3 + CH3 〔c〕 Cl + CH3
低 温
专3题脂肪烃的性质
常见的烃
化学性质——加成反应(1,3丁二烯与Br2)
高 温
专3题脂肪烃的性质
常见的烃
化学性质——加成反应
4.实例
对称加成
不对称加成——受催化剂影响
脂肪烃课件人教版选修(演示课件)

√
实验中采用块状 CaC2和饱和食盐水,
为什么?
实验中为什么要 采用分液漏斗?
制出的乙炔气体 为什么先通入 硫酸铜溶液?
乙炔的化学性质:
(1)氧化反应:
1、燃性氧 火焰明亮,并伴有浓烟。
化: 2C2H2+5O2
点燃
4CO2+2H2O(l)+2600KJ
2、乙炔能使酸性KMnO4溶液褪色。
2KMnO4+ 3H2SO4+ C2H2→ 2MnSO4+ K2SO4+2CO2↑+ 4H2O
第二章 烃和卤代烃
第一节 脂肪烃
一、烷烃和烯烃 1、烷烃
①通式: CnH2n+2 ( n≥1 ) ②同系物:
分子结构相似,在分子组成上相差一个或若 干个CH2原子团的物质,互称为同系物。
③物理性质:
a 、随着分子中碳原子数的增多,烷烃同 系物的物理性质呈现规律性变化,即熔沸点逐 渐升高,密度逐渐增大。
气态烃可能是 C
A、CH ≡CH
B、CH2=CH2
C、CH≡C—CH3
D、CH2=C(CH3)CH3
4、描述CH3—CH = CH—C≡C—CF3分子结构的下
列叙述中正确的是 B A.6个碳原子C有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
5、CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等 都同属离子型碳化物,请通过对CaC2制C2H2 的反应进行思考,从中得到必要的启示,写出 下列反应的产物:
A.ZnC2水解生成 :C2H2 B.Al4C3水解生成:CH4 C.Mg2C3水解生成C:3H4 D.Li2C2水解生成:C2H2
实验中采用块状 CaC2和饱和食盐水,
为什么?
实验中为什么要 采用分液漏斗?
制出的乙炔气体 为什么先通入 硫酸铜溶液?
乙炔的化学性质:
(1)氧化反应:
1、燃性氧 火焰明亮,并伴有浓烟。
化: 2C2H2+5O2
点燃
4CO2+2H2O(l)+2600KJ
2、乙炔能使酸性KMnO4溶液褪色。
2KMnO4+ 3H2SO4+ C2H2→ 2MnSO4+ K2SO4+2CO2↑+ 4H2O
第二章 烃和卤代烃
第一节 脂肪烃
一、烷烃和烯烃 1、烷烃
①通式: CnH2n+2 ( n≥1 ) ②同系物:
分子结构相似,在分子组成上相差一个或若 干个CH2原子团的物质,互称为同系物。
③物理性质:
a 、随着分子中碳原子数的增多,烷烃同 系物的物理性质呈现规律性变化,即熔沸点逐 渐升高,密度逐渐增大。
气态烃可能是 C
A、CH ≡CH
B、CH2=CH2
C、CH≡C—CH3
D、CH2=C(CH3)CH3
4、描述CH3—CH = CH—C≡C—CF3分子结构的下
列叙述中正确的是 B A.6个碳原子C有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
5、CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等 都同属离子型碳化物,请通过对CaC2制C2H2 的反应进行思考,从中得到必要的启示,写出 下列反应的产物:
A.ZnC2水解生成 :C2H2 B.Al4C3水解生成:CH4 C.Mg2C3水解生成C:3H4 D.Li2C2水解生成:C2H2
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1,2-二溴乙烷
二)烯烃
有机物分子中双键或叁键两端的碳原子与其他原子或 原子团直接结合生成新的化合物的反应叫加成反应。
练习:请写出乙烯与H2、HCl、H2O反应的化学方程式
CH2= CH2 + H2 催化剂 CH3CH3
CH2= CH2 + HCl 催化剂
CH2= CH2 + H2O
催化剂 高温高压
通常情况下,性质比较稳定,与强酸、强碱和强氧化 剂等一般不发生化学反应。
(1)氧化反应
CH4 + 2O2 点燃 CO2 + 2H2O
甲烷在空气中的体积分数为5%~15.4% 时,点燃会爆炸。 点燃前必须验纯!
练习:
1、请写出丙烷燃烧的化学方程式
C3H8 5O2 3CO2 4H2O
2、请写出烷烃完全燃烧的反应通式
CH3CH2Cl CH3CH2OH
• 自然界中的脂肪烃较少,但其衍生物则广泛存在,而 且与生命有极密切的关系。如:樟脑—常用驱虫剂、 麝香— 常用中草药和冰片。
一、 烷烃和烯烃
• 【概念】
• 烷烃:仅含C—C键和C—H键的饱和链烃, 又叫烷烃。(若C—C连成环状,称为环烷 烃。)通式:CnH2n+2 (n≥1)
• 烯烃:分子里含有一个碳碳双键的不饱和 链烃叫做烯烃。通式:CnH2n (n≥2)
0.4
点、沸点逐渐升
高,相对密度逐
渐增大,常温下
0.2
状态由气态到液
态到固态。
0
2 4 6 8 10 12 14 16 分子中碳原子数
一、脂肪烃的物理性质
在常温常压下,脂肪烃分子中C4以下的烃为 气态,C5 C15之间的一般为液态, C16以上 的烃一般是固体。脂肪烃的密度都比水小, 且难溶于水,易溶于有机溶剂。
Cl H
HH
H-C-C-H
H-C-C-H
Cl H
Cl Cl
2、写出C5H12的一氯代物的所有同分异构体的结构 简式。
一、烷烃
(3)裂化反应(分解反应)
CH4
高温 C + 2 H2
CH3CH2CH2CH3 CH4 CH3CH CH2
CH3CH2CH2CH3 CH3CH3 CH2 CH2
CH3CH2CH2CH3 CH3CH2CH CH2 H2
脂肪烃
烃的分类
什么是脂肪烃?
• 具有脂肪族化合物基本属性的碳氢化合物叫做脂肪烃。
• 分子中碳原子间连结成链状的碳架,两端张开而不成 环的烃,叫做开链烃,简称链烃。因为脂肪具有这种 结构,所以也叫做脂链烃。
• 有些环烃在性质上不同于芳香烃,而十分类似脂链烃, 这类环烃叫脂环烃。这样,脂肪烃便成为除芳香烃以 外的所有烃的总称。脂链烃和它的衍生物总称为脂肪 族化合物,脂环烃及它的衍生物总称脂环族化合物。
C-C
CnH2n CnH2n-2 CnH2n-2
C2H4 CH2=CH2 C=C C2H2 CH≡CH C≡C C H4 6(丁二烯)CH2=CH-CH=CH2 C=C-C=C
烷烃的分子结构
一、烷烃
1、结构特点: 单键、链状、饱和
2、组成通式: CnH2n+2(n≥1)
一)烷烃
烷烃的化学性质:
丙烷
子 数 CH3CH2CH3目 增
变 气体 化-189.7
渐 增 -42.1 0.585*** 大
多
丁烷 CH3(CH2)2CH3 气体 -138.4 -0.5 0.5788
戊烷 CH3(CH2)3CH3 液体
-130
36.1 0.6262
十七烷 CH3(CH2)15CH 固体
22
301.8 0.7780
烷烃同系物随着分子中碳原子数的递增, 熔 点、沸点逐渐升高,相对密度也逐渐增大。
烯烃、炔烃及其同系物的熔点和沸点一般 也随着其分子中碳原子数的递增而呈现上升 的趋势。
【练习】
• 1、由沸点数据:甲烷-146℃,乙烷- 89℃,丁烷-0.5℃,戊烷36℃,可以判
断丙烷的沸点可能是(C )
• A.高于-0.5℃ B.约是+30℃
3
同碳原子数的 烷烃,支链越多 熔沸点越低。
一、脂肪烃的物理性质 直链烷烃的熔点和沸点
200 150 100 50 常温
0 -50 -100 -150
沸点 熔点
0 2 4 6 8 10 12 14 16 18 分子中的碳原子数
直链烷烃的相对密度
结论:
随着分子中碳
0.6
原子数的递增,
烷烃同系物的熔
Cn HБайду номын сангаасn2
3n 2
1
O2
nCO2
(n
1) H 2O
3、请写出烃完全燃烧的反应通式
y
y
CxH y (x 4 )O2 xCO2 2 H2O
一、烷烃
(2)取代反应
一氯甲烷(气体)
取代反应: 有机物分子里的某些原子或原子团被 其它原子或原子团所代替的反应叫做 取代反应。
练习:
1、写出乙烷(CH3CH3)与氯气(Cl2) 发生二氯取代 反应的产物结构式。
三、烯烃
烯烃的结构
二)烯烃
电子式、结构式、结构简式书写注意事项: H︰‥C︰︰‥C︰H HH
正:CH2=CH2 误:CH2CH2
H2C=CH2
HH HC CH
二)烯烃
1、结构特点: 双键、链状、不饱和
2、组成通式: CnH2n(n≥2)
二3、)化烯学烃性质:
(1)氧化反应 ①燃烧:CH2=CH2 + 3O2 点燃 2CO2 + 2H2O
• (分子里含有两个双键的链烃叫做二烯烃)
几种烷烃的物理性质* ** *** 分别指-164 0C-100 0C-45 0C数据
名称
结构简式 常温状态 熔点/0C 沸点/0C 相对密度
甲烷
CH4
气体 -182 -164 0.466*
碳
状
乙烷 CH3CH3 原 气体 态-183.3 -88.6 0.572** 逐
• C.约是-40℃ D.低于-89℃
• 2、下列烷烃沸点最高的是( C )
• A.CH3CH2CH3 B.CH3CH2CH2CH3 • C.CH3(CH2)3CH3 • D.(CH3)2CHCH2CH3
二、脂肪烃的结构
烃的类型 烷烃 烯烃 炔烃
二烯烃
通式
实例
结构简式 结构特点
CnH2n+2
C2H6 CH3-CH3
明亮火焰,少量黑烟 ②使酸性高锰酸钾溶液褪色(被氧化)
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2 ↑ + 12MnSO4 + 6K2SO4 + 28H2O
可鉴别乙烯与甲烷 等饱和气态烷烃
二)烯烃
(2)加成反应 乙烯可使溴水或溴的四氯化碳溶液颜色褪色
CH2=CH2 + Br-Br → CH2Br-CH2Br
二)烯烃
有机物分子中双键或叁键两端的碳原子与其他原子或 原子团直接结合生成新的化合物的反应叫加成反应。
练习:请写出乙烯与H2、HCl、H2O反应的化学方程式
CH2= CH2 + H2 催化剂 CH3CH3
CH2= CH2 + HCl 催化剂
CH2= CH2 + H2O
催化剂 高温高压
通常情况下,性质比较稳定,与强酸、强碱和强氧化 剂等一般不发生化学反应。
(1)氧化反应
CH4 + 2O2 点燃 CO2 + 2H2O
甲烷在空气中的体积分数为5%~15.4% 时,点燃会爆炸。 点燃前必须验纯!
练习:
1、请写出丙烷燃烧的化学方程式
C3H8 5O2 3CO2 4H2O
2、请写出烷烃完全燃烧的反应通式
CH3CH2Cl CH3CH2OH
• 自然界中的脂肪烃较少,但其衍生物则广泛存在,而 且与生命有极密切的关系。如:樟脑—常用驱虫剂、 麝香— 常用中草药和冰片。
一、 烷烃和烯烃
• 【概念】
• 烷烃:仅含C—C键和C—H键的饱和链烃, 又叫烷烃。(若C—C连成环状,称为环烷 烃。)通式:CnH2n+2 (n≥1)
• 烯烃:分子里含有一个碳碳双键的不饱和 链烃叫做烯烃。通式:CnH2n (n≥2)
0.4
点、沸点逐渐升
高,相对密度逐
渐增大,常温下
0.2
状态由气态到液
态到固态。
0
2 4 6 8 10 12 14 16 分子中碳原子数
一、脂肪烃的物理性质
在常温常压下,脂肪烃分子中C4以下的烃为 气态,C5 C15之间的一般为液态, C16以上 的烃一般是固体。脂肪烃的密度都比水小, 且难溶于水,易溶于有机溶剂。
Cl H
HH
H-C-C-H
H-C-C-H
Cl H
Cl Cl
2、写出C5H12的一氯代物的所有同分异构体的结构 简式。
一、烷烃
(3)裂化反应(分解反应)
CH4
高温 C + 2 H2
CH3CH2CH2CH3 CH4 CH3CH CH2
CH3CH2CH2CH3 CH3CH3 CH2 CH2
CH3CH2CH2CH3 CH3CH2CH CH2 H2
脂肪烃
烃的分类
什么是脂肪烃?
• 具有脂肪族化合物基本属性的碳氢化合物叫做脂肪烃。
• 分子中碳原子间连结成链状的碳架,两端张开而不成 环的烃,叫做开链烃,简称链烃。因为脂肪具有这种 结构,所以也叫做脂链烃。
• 有些环烃在性质上不同于芳香烃,而十分类似脂链烃, 这类环烃叫脂环烃。这样,脂肪烃便成为除芳香烃以 外的所有烃的总称。脂链烃和它的衍生物总称为脂肪 族化合物,脂环烃及它的衍生物总称脂环族化合物。
C-C
CnH2n CnH2n-2 CnH2n-2
C2H4 CH2=CH2 C=C C2H2 CH≡CH C≡C C H4 6(丁二烯)CH2=CH-CH=CH2 C=C-C=C
烷烃的分子结构
一、烷烃
1、结构特点: 单键、链状、饱和
2、组成通式: CnH2n+2(n≥1)
一)烷烃
烷烃的化学性质:
丙烷
子 数 CH3CH2CH3目 增
变 气体 化-189.7
渐 增 -42.1 0.585*** 大
多
丁烷 CH3(CH2)2CH3 气体 -138.4 -0.5 0.5788
戊烷 CH3(CH2)3CH3 液体
-130
36.1 0.6262
十七烷 CH3(CH2)15CH 固体
22
301.8 0.7780
烷烃同系物随着分子中碳原子数的递增, 熔 点、沸点逐渐升高,相对密度也逐渐增大。
烯烃、炔烃及其同系物的熔点和沸点一般 也随着其分子中碳原子数的递增而呈现上升 的趋势。
【练习】
• 1、由沸点数据:甲烷-146℃,乙烷- 89℃,丁烷-0.5℃,戊烷36℃,可以判
断丙烷的沸点可能是(C )
• A.高于-0.5℃ B.约是+30℃
3
同碳原子数的 烷烃,支链越多 熔沸点越低。
一、脂肪烃的物理性质 直链烷烃的熔点和沸点
200 150 100 50 常温
0 -50 -100 -150
沸点 熔点
0 2 4 6 8 10 12 14 16 18 分子中的碳原子数
直链烷烃的相对密度
结论:
随着分子中碳
0.6
原子数的递增,
烷烃同系物的熔
Cn HБайду номын сангаасn2
3n 2
1
O2
nCO2
(n
1) H 2O
3、请写出烃完全燃烧的反应通式
y
y
CxH y (x 4 )O2 xCO2 2 H2O
一、烷烃
(2)取代反应
一氯甲烷(气体)
取代反应: 有机物分子里的某些原子或原子团被 其它原子或原子团所代替的反应叫做 取代反应。
练习:
1、写出乙烷(CH3CH3)与氯气(Cl2) 发生二氯取代 反应的产物结构式。
三、烯烃
烯烃的结构
二)烯烃
电子式、结构式、结构简式书写注意事项: H︰‥C︰︰‥C︰H HH
正:CH2=CH2 误:CH2CH2
H2C=CH2
HH HC CH
二)烯烃
1、结构特点: 双键、链状、不饱和
2、组成通式: CnH2n(n≥2)
二3、)化烯学烃性质:
(1)氧化反应 ①燃烧:CH2=CH2 + 3O2 点燃 2CO2 + 2H2O
• (分子里含有两个双键的链烃叫做二烯烃)
几种烷烃的物理性质* ** *** 分别指-164 0C-100 0C-45 0C数据
名称
结构简式 常温状态 熔点/0C 沸点/0C 相对密度
甲烷
CH4
气体 -182 -164 0.466*
碳
状
乙烷 CH3CH3 原 气体 态-183.3 -88.6 0.572** 逐
• C.约是-40℃ D.低于-89℃
• 2、下列烷烃沸点最高的是( C )
• A.CH3CH2CH3 B.CH3CH2CH2CH3 • C.CH3(CH2)3CH3 • D.(CH3)2CHCH2CH3
二、脂肪烃的结构
烃的类型 烷烃 烯烃 炔烃
二烯烃
通式
实例
结构简式 结构特点
CnH2n+2
C2H6 CH3-CH3
明亮火焰,少量黑烟 ②使酸性高锰酸钾溶液褪色(被氧化)
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2 ↑ + 12MnSO4 + 6K2SO4 + 28H2O
可鉴别乙烯与甲烷 等饱和气态烷烃
二)烯烃
(2)加成反应 乙烯可使溴水或溴的四氯化碳溶液颜色褪色
CH2=CH2 + Br-Br → CH2Br-CH2Br
