L_天冬氨酸_精氨酸多元体系中希土_和钙_化学形态
l-天冬酰胺结构式 -回复

l-天冬酰胺结构式-回复什么是天冬酰胺?天冬酰胺,又称为L-天冬氨酸酰胺,是一种非必需氨基酸,其化学结构式为L-glutamine。
它是蛋白质的组成部分之一,也被广泛应用于医药和食品工业中。
天冬酰胺在体内起着许多重要的生理功能,具有促进肠道健康、增强免疫系统功能、调节蛋白质合成等作用。
天冬酰胺的结构及合成过程天冬酰胺的分子结构由一个氨基基团、一个羧基基团和一个天冬酰胺基团组成。
氨基基团与羧基基团之间通过一个碳原子相连,这也是天冬酰胺的骨架结构。
天冬酰胺的合成可以通过多种方法进行。
浓缩氨和谷氨酸可以在酸性条件下反应,生成L-谷氨酰肼,再进一步反应生成天冬酰胺。
此外,还可以通过谷氨酸和钠氰化物的反应合成天冬酰胺。
应用领域天冬酰胺在医药领域有广泛的应用。
由于其具有调节免疫系统功能的特性,天冬酰胺常被用作器官移植术后的免疫抑制剂。
它可以减少器官移植术后的排斥反应,并提高移植成功的机会。
此外,天冬酰胺还被应用于肠道疾病的治疗,如炎症性肠病和溃疡性结肠炎。
它可以修复受损的肠黏膜、促进肠道健康,并改善肠道功能。
在食品工业中,天冬酰胺常被添加到保健品和营养补充剂中。
它可以增强肌肉组织的合成,促进蛋白质的吸收,帮助身体更好地利用蛋白质。
此外,天冬酰胺还可以改善运动后的恢复能力,缓解疲劳感。
天冬酰胺的副作用及风险天冬酰胺在一般情况下被认为是安全的,但在某些特殊情况下可能有副作用。
长时间高剂量服用天冬酰胺有可能引起胃肠道不适,如腹胀、腹泻和恶心等。
对于存在某些过敏反应的人士,可能会出现过敏症状,如皮疹和呼吸问题。
因此,在使用天冬酰胺之前,最好咨询医生或专业人士的建议。
结语天冬酰胺作为非必需氨基酸,对人体健康有着重要的作用。
它具有调节免疫系统、促进肠道健康和提高蛋白质利用率等功效,在医药和食品工业中应用广泛。
然而,使用天冬酰胺时需要谨慎,根据个人情况和专业意见进行使用,以降低潜在的风险。
最新关于药品“精氨酸”的认识

感谢观看!
3. 电泳法则是利用电场的作用,使样品中的精氨酸分子在凝胶 中移动,根据其迁移距离和时间来测定精氨酸的含量。
2. 精氨酸的分析技术
01
1. 精氨酸的分析技术 主要包括色谱法、质谱 法和电化学分析法等。
02
2. 色谱法是精氨酸分 析中常用的一种方法, 包括高效液相色谱法和 气相色谱法等。
03
3. 质谱法则可以对精 氨酸进行精确的定量和 定性分析,具有高灵敏 度和高分辨率的特点。
2. 精氨酸的化学结构是由 一个氨基、一个羧基和一个 胍基组成的,这使得它在生 物体内具有重要的生理功能 。
03
3. 随着科学技术的发展, 人们对精氨酸的研究越来越 深入,发现它在人体健康和 疾病治疗中具有重要作用。
2. 精氨酸的化学结构
01
1. 精氨酸是一种含有碱性官 能团的非蛋白质氨基酸,其 化学名称为2-氨基-5-胍基戊 酸。
3. 精氨酸对于成年人的身体 健康也有着重要的影响,它 可以提高人体的新陈代谢率 ,帮助身体更好地吸收营养 。
2. 精氨酸对免疫系统的作用
1. 精氨酸能够增强免疫系 统的功能,提高机体的抵抗 力。
2. 精氨酸可以促进免疫 细胞的增殖和分化,增强 免疫应答。
3. 精氨酸对免疫系统的调 节作用有助于预防和治疗多 种疾病。
1 病等。
2. 精氨酸可以作为
3. 精氨酸还可以用
药物的原料,用于生
于制备营养补充剂,
产一些重要的药物,
帮助人们增强免疫力
如胰岛素、抗生素等
和改善身体健康。
2。
3
3. 精氨酸在饲料添加剂中的应用
3. 精氨酸在饲料添加剂中的使用量需要严格控制,过量或过
3
20种氨基酸的名称--结构-及分类
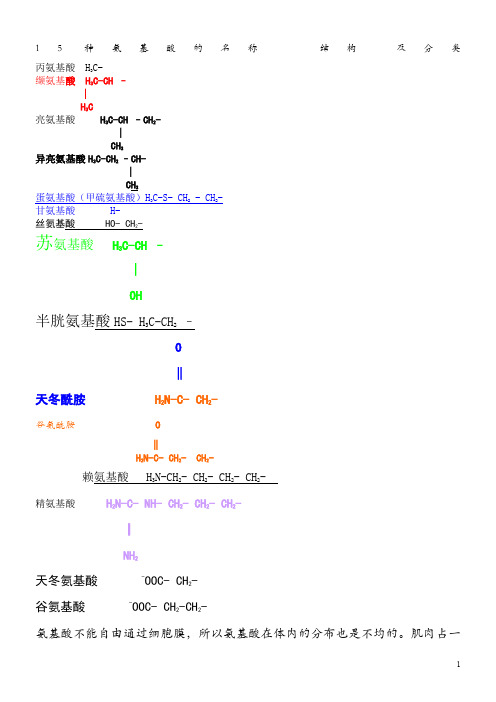
15种氨基酸的名称结构及分类丙氨基酸H3C-缬氨基酸H3C-CH –∣H3C亮氨基酸H3C-CH –CH2- ∣CH3异亮氨基酸H3C-CH2–CH-∣CH3蛋氨基酸(甲硫氨基酸)H3C-S- CH2- CH2-甘氨基酸 H-丝氨基酸 HO- CH2-苏氨基酸H3C-CH –∣OH半胱氨基酸HS- H3C-CH2–O‖天冬酰胺 H2N-C- CH2- 谷氨酰胺O‖H2N-C- CH2- CH2-赖氨基酸 H3N-CH2- CH2- CH2- CH2-精氨基酸 H2N-C- NH- CH2- CH2- CH2-║NH2天冬氨基酸-OOC- CH2-谷氨基酸-OOC- CH2-CH2-氨基酸不能自由通过细胞膜,所以氨基酸在体内的分布也是不均的。
肌肉占一半,肝脏占10%,肾占4%,血浆占1%。
由于肾脏肝脏体积较小,它们所含的游离氨基酸的浓度较高,氨基酸的代谢也很旺盛。
代谢能,除了一点体增热量以外余下的都是净氨基酸随同血液运输到全身各组织去进行代谢,其主要去向是合成蛋白质和多肽,此外,也可以转变成嘌呤嘧啶卟啉儿茶酚胺。
多余的氨基酸通常用于分解供能。
虽然不同的氨基酸由于结构不同,各有其自己的分解方式,但它们都有α–氨基和α–羧基,因此有共同的代谢途径。
氨基酸的一般分解代谢就是指这种共同的分解途径。
氨基酸分解时,在多数[68]大多数人95%,绝大多数人99—%在大多数情况,96.5%情况下,是首先脱去氨基生成氨和α–酮酸。
氨可转变成尿素、尿酸排出体外,而生成的α–酮酸则可以再转变为氨基酸、或者是彻底分解为二氧化碳和水并释放出能量,或是转变为糖或脂肪作为能量的储备,这是氨基酸分解的主要途径。
在酶的作用下,氨基酸脱掉氨基的作用称脱氨基作用。
动物的脱氨基作用主要在肝肾中进行,其主要方式有氧化脱氨基转氨基联合脱氨基。
多数情况是氨基酸以联合脱氨基作用脱去氨基的。
把在体内可以转变成葡萄糖的氨基酸称为生糖氨基酸,包括丙氨基酸、半胱氨基酸、甘氨基酸、丝氨基酸、苏氨基酸、天冬氨基酸、天冬酰胺、蛋氨基酸、缬氨基酸、精氨基酸、谷氨基酸、谷氨酰胺、脯氨基酸组氨基酸。
精氨酸化学

精氨酸化学
精氨酸是一种重要的氨基酸,它对于人体的健康和生理功能有着重要的作用。
下面我将详细介绍精氨酸的化学性质、生物合成和生理功能。
一、精氨酸的化学性质
精氨酸是一种含有两个氨基和一个羧基的氨基酸,化学式为C5H14N4O3。
它是一种无色结晶性固体,在水中能够溶解。
精氨酸的分子结构中含有一个较长的碳链,使得它在化学反应中具有一定的活性。
精氨酸可以通过与其他氨基酸或化合物发生反应,产生一系列的化学变化。
二、精氨酸的生物合成
精氨酸在人体内可以通过多个途径进行生物合成。
一种途径是通过精氨酸合成酶的作用,将精氨酸前体分子转化为精氨酸。
另一种途径是通过精氨酸的代谢产物亚精氨酸的转化,最终生成精氨酸。
精氨酸的合成过程需要多个酶的参与,其中涉及到多个代谢途径的调节。
三、精氨酸的生理功能
精氨酸在人体内具有多种重要的生理功能。
首先,精氨酸是一种重要的氮源,可以参与蛋白质的合成和氨基酸的代谢。
其次,精氨酸是一种重要的抗氧化剂,能够对抗自由基的产生和氧化损伤。
此外,精氨酸还参与能量代谢和神经传导等生理过程。
精氨酸还与一些疾
病的发生和发展有一定的关联,如心血管疾病、糖尿病和神经系统疾病等。
总结:
精氨酸是一种重要的氨基酸,具有广泛的生理功能。
它的化学性质和生物合成过程为我们了解其作用机制提供了基础。
精氨酸的生理功能与人体的健康密切相关,因此对其进行深入的研究具有重要的意义。
通过进一步的研究,我们可以更好地理解精氨酸在人体内的作用机制,并为相关疾病的预防和治疗提供新的思路和方法。
我国L天冬氨酸生产方法分析

我国L天冬氨酸生产方法分析提示:我国L-天冬氨酸生产方法分析,首先利用少根根霉(RhizopusarrhizusA.Fisch)发酵产生反丁烯二酸,再接种普通变形杆菌(ProteusvulgarisHauser)发酵生产L-天冬氨酸。
发酵法是早期工业化生产L-天冬氨酸的主要方法,其生产周期长,副产物多,生产成本较高且技术风险大,限制了当时的L-天冬氨酸产品仅应用于医药领域。
导读:我国L-天冬氨酸生产方法分析,首先利用少根根霉(RhizopusarrhizusA.Fisch)发酵产生反丁烯二酸,再接种普通变形杆菌(ProteusvulgarisHauser)发酵生产L-天冬氨酸。
发酵法是早期工业化生产L-天冬氨酸的主要方法,其生产周期长,副产物多,生产成本较高且技术风险大,限制了当时的L-天冬氨酸产品仅应用于医药领域。
L-天冬氨酸生产始于20世纪60年代,日本田边制药公司利用反丁烯二酸发酵技术率先实现了工业化生产,之后,又在固定化技术的基础上研发出固定化大肠杆菌细胞法连续生产L-天冬氨酸。
1973年,Chibata 等从大肠杆菌中提取天门冬氨酸酶,包埋在交联聚丙烯酰胺中制成固定化酶,催化富马酸和氨合成L-天冬氨酸。
1985年,日本三菱石油化学公司利用黄色短杆菌(BrevibacteriumflavumOkumuraetal.)游离细胞将富马酸转化为L-天冬氨酸。
20世纪80年代初,我国开始研制生产L-天冬氨酸,80年代中期采用固定化细胞法进行了生产中试,随后进行了工业化生产。
由于固定化细胞法工艺设备投入多,技术要求高,产品的生产成本相对较高。
随着市场竞争的日趋激烈,2000年,王雪根等研制出游离整体细胞法替代固定化细胞法工业化生产L-天冬氨酸,简化了工艺流程,降低了生产成本,而且减少了对环境的污染。
到目前为止,工业化生产L-天冬氨酸的主要方法包括:传统发酵法、固定化酶或固定化细胞法和游离整体细胞法。
2021届人教版高中生物必修二第5章 基因突变及其他变异 第1节有详细答案

第5章第1节基因突变和基因重组一、选择题1.关于基因突变的叙述正确的是()A.基因突变只发生在有丝分裂间期DNA复制过程中B.基因突变会引起基因所携带的遗传信息的改变C.基因碱基对的缺失、增添、替换方式中对性状影响较小的通常是增添D.基因突变的方向与环境变化有明确的因果关系,能为进化提供原材料解析:选B基因突变主要发生在有丝分裂间期或减数第一次分裂前的间期DNA复制过程中;基因突变会导致遗传信息的改变;基因碱基对的替换对性状的影响通常较小;基因突变是不定向的,与环境之间没有必然的因果关系。
2.人类血管性假血友病基因位于X染色体上,长度为180 kb。
目前已经发现该病有20多种类型,这表明基因突变具有()A.不定向性B.可逆性C.随机性D.重复性解析:选A由题意可知,X染色体上控制人类血管性假血友病的基因有20多种类型,说明由于基因突变的不定向性,该位点上的基因产生了多个等位基因。
3.果蝇某染色体上的DNA分子中一个脱氧核苷酸发生了改变,其结果最可能是()A.变成其等位基因B.DNA分子内部的碱基配对方式改变C.此染色体的结构发生改变D.此染色体上基因的数目和排列顺序改变解析:选A DNA分子中发生碱基对(脱氧核苷酸对)的替换、增添和缺失引起的基因结构的改变叫基因突变,可产生原基因的等位基因;DNA分子内部的碱基配对方式不变,A与T配对,C与G配对;基因突变改变的是基因结构,不会改变染色体的结构;基因突变不会改变染色体上基因的数目和排列顺序。
4.央视一则报道称,孕妇防辐射服不仅不能防辐射,反而会聚集辐射,辐射对人体危害很大,可能导致基因突变。
下列相关叙述正确的是() A.碱基对的替换、增添和缺失都是由辐射引起的B.环境所引发的变异可能为可遗传变异C.辐射能导致人体遗传物质发生定向改变D.基因突变可能造成某个基因的缺失解析:选B导致基因突变的因素有很多,如物理因素、化学因素等;环境所引发的变异,若导致遗传物质发生改变,则为可遗传变异;辐射导致的基因突变是不定向的;基因突变是碱基对的增添、缺失或替换,并非基因的缺失。
L 天冬氨酸

英文同义词
ASP;ASPARTIC(L-);ASPARTIC ACID;ASPARTIC ACID, L-;H-ASP-OH;FEMA 3656;H-L-ASP-OH;L-ALPHAAMINOSUCCINIC ACID
物化性质
呈白色结晶或结晶性粉末,味微酸。溶于沸水,25℃时微溶于水 (0.5%),易溶于稀酸和氢氧化钠溶液中, 不溶于乙醇、乙醚、加热至270℃分解,等电点2.77,其比旋度与所溶的溶剂有关。在酸溶液中为右旋,碱溶液 中为左旋,水溶液中为右旋 。
L 天冬酸
化学品
目录
01 英文同义词
03 产品用途
02 物化性质 04 生产方法
L-天冬氨酸是一种有机化合物,化学式为C4H7NO4。白色结晶或结晶性粉末,味微酸。溶于沸水,25℃时微 溶于水 (0.5%),易溶于稀酸和氢氧化钠溶液中,不溶于乙醇、乙醚、加热至270℃分解,等电点2.77,其比旋度 与所溶的溶剂有关。在酸溶液中为右旋,碱溶液中为左旋,水溶液中为右旋。
三、用于合成甜味剂,医药上用于治疗心脏病,用作肝功能促进剂、氨解毒剂、疲劳消除剂和氨基酸输液成 分等。
四、营养增补剂、调昧增香剂。添加于各种清凉饮料。医药上用作氨解毒剂、肝功能促进剂、疲劳恢复剂。
五、用于生化研究,用作疲劳恢复剂、氨解毒剂、临床诊断药。
生产方法
左旋天冬氨酸的制法有合成法和发酵法。1.合成法主要是以马来酸或富马酸或它们的酯为原料,在加压下用 氨处理,然后水解。较容易合成得到外消旋天冬氨酸,但至今还没有理想的拆分外消旋体的方法。2.发酵法在酶 作用下,将富马酸与氨加成,可高收率地得到产品。采用这种方法只生成左旋体,收率高,因此是工业生产的主 要方法。
感谢观看
产品用途
n-乙酰-l-天冬氨酸分子式c5h9no3s

乙酰-L-天冬氨酸(N-acetyl-L-aspartate)是一种天然存在的化合物,分子式为C5H9NO3S。
它在人体中具有重要的生物学功能,广泛存在于中枢神经系统和外周组织中。
乙酰-L-天冬氨酸作为一种代谢产物,对于神经元的代谢活动和神经保护具有重要意义。
以下是有关乙酰-L-天冬氨酸的一些相关内容。
一、乙酰-L-天冬氨酸的结构特征乙酰-L-天冬氨酸是一种天然存在的氨基酸衍生物,其结构特征如下:1. 分子式:C5H9NO3S2. 分子量:175.19 g/mol3. 结构:乙酰-L-天冬氨酸由L-天冬氨酸和乙酰CoA经催化作用形成,含有一个乙酰基团。
二、乙酰-L-天冬氨酸在中枢神经系统中的作用乙酰-L-天冬氨酸在中枢神经系统中起着重要的代谢和信号传导作用,具体表现在以下几个方面:1. 能量代谢:乙酰-L-天冬氨酸参与神经元的能量代谢过程,对神经元的正常功能和存活起着重要作用。
2. 代谢标志物:乙酰-L-天冬氨酸的水平变化与许多神经系统疾病和损伤有关,因此被认为是一种重要的神经代谢标志物。
3. 神经保护:乙酰-L-天冬氨酸可通过多种途径对神经元的保护起到作用,具有一定的神经保护作用。
三、乙酰-L-天冬氨酸与神经系统疾病的关系乙酰-L-天冬氨酸在许多神经系统疾病的发生发展过程中起着重要作用,下面以几种常见的神经系统疾病为例,说明其与乙酰-L-天冬氨酸的关系:1. 脑卒中:研究表明,脑卒中患者乙酰-L-天冬氨酸的代谢水平明显下降,与脑损伤程度密切相关。
2. 癫痫:癫痫发作时乙酰-L-天冬氨酸水平显著升高,成为癫痫发作的生物标志。
3. 脑肿瘤:乙酰-L-天冬氨酸在脑肿瘤的诊断和生物学监测中具有重要意义,可作为肿瘤生长的生物标志。
四、乙酰-L-天冬氨酸的检测方法为了更好地研究和了解乙酰-L-天冬氨酸在生物体内的作用和意义,科学家们发展了多种检测乙酰-L-天冬氨酸的方法,主要包括:1. 液质联用技术(LC-MS):利用液相色谱联用质谱技术,可以对乙酰-L-天冬氨酸进行高效准确的检测。
氨基酸的基本组成元素

氨基酸的基本组成元素氨基酸是构成蛋白质的基本组成单位,它由氨基(NH2)、羧基(COOH)、一个α碳原子以及一个侧链组成。
每个氨基酸在其α碳原子上都有一个氢原子和一个侧链(R基),这个侧链决定了氨基酸的特性和功能。
1.氨基(NH2):氨基是氨基酸中的一个基本组成元素。
它由一个氮原子和三个氢原子组成,带有正电荷。
氨基存在于所有氨基酸的分子结构中,连接到α碳原子上的一个顺式氢原子。
2.羧基(COOH):羧基是氨基酸中的另一个基本组成元素,也称为羧酸基团。
它由一个碳原子、一个氧原子和一个氢原子组成,带有负电荷。
羧基连接到α碳原子的另一侧,与氨基相对。
3.α碳原子:α碳原子是氨基酸分子中的一个碳原子,连接氨基和羧基。
α碳原子是支链氨基酸形成分子之间的骨架,决定了氨基酸的立体构型和空间结构。
4.侧链(R基):侧链,也称为R基团,是氨基酸分子中与α碳原子连接的一个原子或基团。
侧链决定了每种氨基酸的特性和功能,使不同的氨基酸具有不同的化学性质。
侧链可以是一个单独的原子(如氢、氧)或一个复杂的分子(如苯环),它们可以是疏水的、亲水的、带电的等等。
根据侧链的性质,氨基酸可以分为以下几类:1. 酸性氨基酸(Aspartic acid和Glutamic acid):它们的侧链中包含一个或两个羧基,这使它们带有负电荷。
2. 硫氨酸(Cysteine):它的侧链中包含一个硫原子,可以形成二硫键,对蛋白质的稳定性和结构起重要作用。
3. 亮氨酸(Leucine)、异亮氨酸(Isoleucine)和缬氨酸(Valine):它们的侧链中含有疏水的碳链,使得这些氨基酸在蛋白质的内部起到填充和增强结构的作用。
4. 赖氨酸(Lysine)和精氨酸(Arginine):它们的侧链中含有氨基,带有正电荷,在蛋白质的抗原性和酶活性中起着重要作用。
除了上述几类常见的氨基酸,还有其他氨基酸,如丝氨酸(Serine)、苏氨酸(Threonine)、蛋氨酸(Methionine)等。
天门冬氨酸生产工艺小总

天冬氨酸生产工艺的研究进展一、天冬氨酸简介天冬氨酸(Aspartic acid)又称氨基丁二酸,是构成机体蛋白质的主要氨基酸之一。
结构式为:HOOC-CH2-CH(NH2)-COOH,分子量133.10。
它有两种旋光异构体:D型和L型。
通常所说的天冬氨酸是指等量的D型和L型的混合物,为无色单斜棱柱形结晶,溶于水,微溶于75%(w/w)乙醇,不溶于乙醚,熔点278℃~280℃;L型为无色菱形片状结晶,溶于水,微溶于醇,熔点269℃~271℃;D型溶于水、盐酸,不溶于乙醇及乙醚,熔点251℃。
二、合成方法2.1化学合成法化学法主要用于生产天冬氨酸的外消旋体DL-天冬氨酸。
顺丁烯二酸酐和过量氨水与NHC反应,反应在一间歇反应釜中,于140℃、40.4MPa下反应2.5h。
将得到的混合物冷却至70℃后用盐酸酸化至pH2.5,再冷却至室温,此时天冬氨酸沉淀析出,将沉淀过滤,4℃下水洗后得到产品,产率为55%。
成都有机化学研究所的邓润华等采用微波法合成的收率为61.4%。
该方法采用苯亚甲氨基乙酸乙酯为原料,在相转移催化剂(TEBA)催化下进行卤化反应,经水解生成天冬氨酸外消旋体。
2002年,浙江大学的邢亚军等在一钛材高压釜中,对顺丁烯二酸酐)进行氨化反应合成了DL-天冬氨酸。
通过实验研究对原有合成工艺作出了改进,使产品收率提高到70%以上,并且对产品的分离提纯采用顺丁烯二酸(马来酸)代替盐酸进行酸化结晶从而提高了反应物的利用和减少反应剩余物的污染。
2003年天津大学的王亚权等提出了一种简便的、不使用任何催化剂的化学合成法。
实验在聚四氟衬里的250ml高压釜中进行。
实验步骤如下:将32.5g 顺丁烯二酸酐(分析纯)溶于70ml水中,加入氨水(分析纯)至pH8,充1MPa氮气,然后在电磁搅拌下加热至453K,反应6h,反应后冷却至室温,过滤后得无色晶体,收率63.1%,熔点338℃。
产物的红外光谱与DL-天冬氨酸的标准谱图吻合,容量分析表明天冬氨酸含量≥98%。
天冬氨酸分子结构

天冬氨酸分子结构天冬氨酸(Aspartate)是一种非必需氨基酸,属于六种氨基酸之一。
天冬氨酸在生物体内起着重要的生理功能和代谢作用。
本文将介绍天冬氨酸的分子结构及其生物学功能。
天冬氨酸的分子结构表现为一个二元酸,由一个氨基(NH2)和两个羧基(COOH)组成。
它的化学式为C4H7NO4,分子量为133.10 g/mol。
天冬氨酸的分子结构使其具有特殊的性质和功能。
天冬氨酸在生物体内具有多种重要的生理功能。
首先,天冬氨酸是合成蛋白质的基本组成部分之一。
在蛋白质合成过程中,天冬氨酸与其他氨基酸通过肽键连接在一起,形成多肽链,最终组装成蛋白质分子。
天冬氨酸在生物体内参与能量代谢过程。
它可以通过一系列酶的作用,转化为丙酮酸,进一步参与三羧酸循环的代谢。
天冬氨酸在三羧酸循环中起着重要的催化作用,将能量从食物中释放出来,为生物体提供能量。
天冬氨酸还参与体内的氨基转移反应。
在氨基转移过程中,天冬氨酸接受氨基团,形成谷氨酸,同时释放出一个酮基。
这个过程在氨基酸代谢以及尿素循环中起着重要的作用,有助于维持氨基酸的平衡和氮代谢的正常进行。
天冬氨酸还参与神经递质的合成和传递。
在中枢神经系统中,天冬氨酸是一种主要的兴奋性神经递质,在兴奋性突触传递过程中发挥着重要的作用。
它可以与谷氨酸酸化酶结合,生成谷氨酸,进而参与神经冲动的传导。
天冬氨酸还参与一些重要的生物合成过程。
例如,它是一些激素、类固醇和其他生物活性物质的前体分子,在生物体内通过一系列酶的作用,形成这些重要的生物化合物。
总结起来,天冬氨酸作为一种重要的氨基酸,在生物体内具有多种生理功能和代谢作用。
它参与蛋白质合成、能量代谢、氨基转移、神经递质合成等重要过程,对维持生物体的正常功能和代谢具有重要意义。
通过研究天冬氨酸的分子结构和生物学功能,可以进一步深入了解生物体的代谢机制和生理过程,对疾病的预防和治疗具有重要的指导意义。
l-精氨酸结构

l-精氨酸结构精氨酸是一种天然有机化合物,存在于生物体内,也是人体必需的氨基酸之一。
其化学式为C5H14N4O3,分子量为174.2。
精氨酸的化学结构具有独特的特征,具有多种反应性,可以在生物体内进行氧化、还原、羟化、甲基化、脱氨等反应。
精氨酸的分子结构由三个氨基酸组成,分别是天冬氨酸、甘氨酸和精氨酸。
其中,天冬氨酸和甘氨酸联接成为三元环,形成了精氨酸的骨架结构。
而精氨酸的侧链则是由一个氨基和一个胍基组成,侧链上还有一个一氧化磷酸基团,它可以和ATP(三磷酸腺苷)发生反应,形成磷酸二酯化合物,从而使精氨酸成为高能化合物,对于许多细胞代谢过程具有重要作用。
精氨酸具有两种异构体,分别是L-精氨酸和D-精氨酸。
在生物体内,只有L-精氨酸是有意义的,它是生物体合成肌氨酸和尿素的重要前体物质。
D-精氨酸则主要存在于某些细菌和植物中,没有生理功能。
在人体内,精氨酸具有多种生理功能。
首先,精氨酸是肌肉蛋白的主要组成部分之一,对于肌肉组织的生长和维护具有重要作用。
此外,精氨酸还可以通过与精氨酸转移酶反应,生成肌氨酸。
肌氨酸是一种能量储备物质,能够为肌肉提供能量,使其持续收缩。
此外,精氨酸还参与体内尿素循环过程,将胺基团转化为无害氨基,在人体中具有降低氨毒性的作用。
此外,精氨酸还具有一些其他的生理功能。
例如,在体内合成精子过程中,需要大量的精氨酸参与。
此外,精氨酸还具有调节胰岛素、生长激素等激素的分泌,调节脑内神经递质的代谢等作用。
总的来说,精氨酸是一种重要的生物活性物质,在人体内具有多种生理功能。
其结构独特,反应性强,对于一些细胞代谢过程具有重要作用。
此外,精氨酸还能够作为生物体合成肌氨酸和尿素的重要前体物质,在人体内具有广泛的应用价值。
二十种氨基酸结构式

20种罕见氨基酸的名称和结构式之邯郸勺丸创作创作时间:二零二一年六月三十日名称中文缩写英文缩写结构式非极性氨基酸甘氨酸(a 氨基乙酸)Glycine甘Gly G丙氨酸(a 氨基丙酸)Alanine丙Ala A亮氨酸(g甲基a氨基戊酸)*Leucine亮Leu L异亮氨酸(b 甲基a氨基戊酸)*Isoleucine异亮Ile I缬氨酸(b甲基a氨基丁酸)*Valine缬Val V脯氨酸(a四氢吡咯甲酸)Proline脯Pro P苯丙氨酸(b苯基a氨基丙酸)*Phenylalanine苯丙Phe F蛋(甲硫)氨酸(a氨基g甲硫基戊酸) *Methionine蛋Met M色氨酸[a氨基b(3吲哚基)丙酸]*色Trp W Tryptophan非电离的极性氨基酸丝氨酸(a氨基b羟基丙酸)丝Ser S Serine谷氨酰胺(a氨基戊酰胺酸)谷胺Gln Q Glutamine苏氨酸(a氨基b羟基丁酸)*苏Thr T Threonine半胱氨酸(a氨基b巯基丙酸)半胱Cys C Cysteine天冬酰胺(a氨基丁酰胺酸)天胺Asn N Asparagine酪氨酸(a氨基b对羟苯基丙酸)酪Tyr Y Tyrosine酸性氨基酸天冬氨酸(a氨基丁二酸)天Asp D Aspartic acid谷氨酸(a氨基戊二酸)谷Glu E Glutamic acid碱性氨基酸赖氨酸(a,w二氨基己酸)*赖Lys K Lysine精氨酸(a氨基d胍基戊酸)精Arg R Arginine组氨酸[a氨基b(4咪唑基)丙酸]组His H Histidine创作时间:二零二一年六月三十日。
稀土与氨基酸固体配合物的合成及性质探讨

稀土与氨基酸固体配合物的合成及性质探讨摘要:随着稀土在各个方面的广泛应用,人们开始了对稀土的研究,稀土具有独特的化学性质,在医学、农业、生物分子等方面的应用研究不断的扩大,其可以通过不同的途径,进入生物体。
氨基酸是人体结构中的基本组成,目前研究的稀土氨基酸配合物,其合成和性质,被人们认识,并且现在已经在农业、医药等方面得到了广泛的应用。
本文针对稀土与氨基酸配合物的合成及性质,进行分析研究。
关键词:稀土;氨基酸;配合物;性质1 稀土与氨基酸配合物的合成稀土在农业、医学等方面的广泛应用,有效的发挥其作用,稀土进入生物体内后,会产生生物效应、生物化学变化等,可以对生物体内的多种效应进行抑制,对酶的生物活性进行抑制。
想将稀土应用在临床医学中,具有消毒、杀菌、抗凝血作用等,而且其产生的毒性、副作用较小。
氨基酸是人体基本结构的组成单元,在人生存的过程中,所需的氨基酸种类繁多,其中人体必需的氨基酸有8种。
稀土氨基酸配合物在生物学领域的应用,不仅可以满足生物生长所需的各种氨基酸,还可以在稀土的作用下,促进生物的生长,抑制病菌的繁殖。
稀土与氨基酸配合物,有二元配合物、三元配合物、多元配合物,因为稀土氨基酸配合物具有多种作用和功效,所以受到了人们的关注。
稀土与氨基酸配合物的合成过程如下:试剂:硝酸稀土(单一稀土氧化物自制而成)、白氨酸(层析纯生化试剂)、精氨酸(层析纯生化试剂)、苯、无水乙醇、A.R级其他试剂。
方法、仪器:针对稀土与氨基酸配合物中稀土的含量进行测定,使用EDTA 进行络合滴定测得,稀土与氨基酸配合物中的C、H、N含量的测定,则使用1106型元素分析仪器进行测定,其他使用到的仪器主要有IR-440红外光谱仪、KBr 压片、X射线衍射仪、DDS-IA型电导率仪器、AC-80核磁共振仪器[1]。
合成:将苯与无水乙醇混合,形成均匀的混合溶剂,将RE(NO3)3·nH2O:Leu=1:3(摩尔比),放入苯与无水乙醇形成的混合溶剂中,在65~75℃下,进行回流搅拌,时间维持4h。
精氨酸

精氨酸精氨酸在体内起生理作用的主要是左旋精氨酸。
正常情况下,体内精氨酸一部分来源于膳食,一部分通过几个器官间的协同作用由鸟氨酸通过瓜氨酸合成,其前体物质是谷氨酸或谷氨酰胺。
机体中所有组织均利用精氨酸合成细胞浆蛋白和核蛋白,同时精氨酸也是脒基的唯一提供者,进而合成肌酸。
精氨酸是碱性氨基酸,可广泛参与机体组织代谢,与机体免疫功能、蛋白质代谢、创面愈合等密切相关。
它还能促进血氨进入尿素循环,防止氨中毒,其代谢中间产物多胺是重要的胃肠粘膜保护剂,能促进粘膜增殖。
精氨酸也是合成一氧化氮的唯一底物,可参与免疫和血管张力调节。
精氨酸不仅是机体蛋白质的组成成分,而且还是多种生物活性物质的合成前体,如多胺和NO等,通过刺激部分激素分泌,参与内分泌调节和机体特异性免疫调节等生物学过程,因而L-Arg被科学家誉为“神奇分子”。
L-Arg还是内生性一氧化氮(NO)的唯一前体。
精氨酸为条件性必需氨基酸,对胎儿期和哺乳期动物来说是一种必需氨基酸,而对成年动物来说是非必需氨基酸,在体内能自身合成,但体内生成速度较慢,有时需要部分从食物中补充。
精氨酸的多种生物学功能引起了营养和医学科研工作者的广泛关注,从而成为目前氨基酸研究的热点之一。
精氨酸是幼龄哺乳动物的必需氨基酸,是组织蛋白中最丰富的氮载体。
精氨酸是碱性氨基酸,在动物体内有重要的生理生化功能,其不仅是细胞质和核酸蛋白的主要成分,还是将天门冬氨酸、谷氨酸、脯氨酸、羟脯氨酸、聚胺(腐胺、精脒、精胺)等转换为高能磷酸化合物肌酸磷酸的中间体,是肌酐酸唯一的氨来源;还作为尿素循环的中间体,通过尿素循环解除氨中毒,避免由于氨过量造成的代谢紊乱;在机体的匀质代谢方面也起着重要的作用,可用于多种代谢途径,包括精氨酸酶、一氧化氮合酶、精氨酸/甘氨酸胍基转移酶(AGAT)、精氨酰-tRNA 合成酶等。
另外,精氨酸不仅作为蛋白质合成的重要原料,同时也是机体内肌酸、多胺和一氧化氮(NO)等物质的合成前体,在动物体营养代谢与调控过程中发挥着重要作用,是新生哺乳动物的必需氨基酸,也是成年哺乳动物的条件性必需氨基酸。
纳米钙NanoCalcium了解L天门冬氨酸螯合钙

纳米钙 Nano Calcium 了解L 天门冬氨酸螯合钙纳米钙 Nano Calcium 了解L 天门冬氨酸螯合钙氨基酸氨基酸Amino Acid:是构成蛋白质的基本单位,赋予蛋白质特定的分子结构形态,使其分子具有生化活性,催化人体新陈代谢的酵素和酶。
不同氨基酸脱水缩合形成肽(蛋白质的原始片段),是蛋白质生成的前提。
天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸有22种。
分为:非必要氨基酸必要氨基酸(人体无法自身合成)另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。
天门冬氨酸天门冬氨酸 asparticacid:是20种蛋白质氨基酸之一,是天然存在的重要氨基酸,其再人体内有着重要的生理功能。
- 天门冬氨酸对细胞有较强的亲和力,特别是对体内的能量代谢、氮代谢起着重要作用。
亦在中枢神经系统和脊索某些部位有兴奋神经递质左右。
- 天门冬氨酸可用于治疗缺铁性贫血,亦可与铁形成螯合物,能增加胃肠道对铁的吸收。
天门冬氨酸还用于洋地黄中毒所引起的心率不齐、心肌炎后遗症、慢性心功能不全及冠心病的辅助治疗。
- 临床广泛用于治疗肝炎、肝硬化、肝昏迷,可延缓氨中毒,改善肝功能。
其退黄、降酶作用均较显著,并能促进酒精代谢及减少酒精对肝脏损伤。
- 天门冬氨酸可加速体内代谢产物的排泄,清除体内垃圾,清除疲劳、参与受损的心机和肝脏细胞的修复过程。
同时能促进成熟的T淋巴细胞的生产,从而增强人体的免疫力。
L-天门冬氨酸学名:L-氨基丁二酸分子式:C4H7NO4分子量:133.10医学方面主要作为人体心脏病、肝功能促进剂及疲劳消除剂主要功能1、增加活力、消除疲劳,特别是慢性疲劳;2、通过协助消除过多的氨来保护肝脏;3、与其它氨基酸结合所形成的分子能吸收毒素并能将它们从血液中清除;4、协助细胞运作DNA/RNA(核酸)的形成,在食品工业方面是一种良好的营养增补剂,热量低、不蚀牙。
运动型饮料中常用作疲劳消除剂。
20种常见氨基酸分子式

20种常见氨基酸分子式氨基酸是构成蛋白质的基本组成单元,共有20种常见的氨基酸。
它们具有不同的分子式、结构和功能,在生物体内发挥着重要的作用。
下面我们将逐一介绍这20种常见氨基酸的分子式及其特点。
1.丙氨酸(Ala)的分子式为C3H7NO2。
它是一种非极性的氨基酸,可以作为能源物质供应给肌肉。
2.苏氨酸(Cys)的分子式为C3H7NO2S。
它含有硫原子,可以形成二硫键,对蛋白质的结构稳定性具有重要作用。
3.异亮氨酸(Ile)的分子式为C6H13NO2。
它是一种非极性的氨基酸,具有支链结构,对蛋白质的稳定性和功能发挥具有重要影响。
4.赖氨酸(Lys)的分子式为C6H14N2O2。
它是一种碱性氨基酸,在细胞内参与DNA合成、细胞分裂和修复等重要过程。
5.精氨酸(Arg)的分子式为C6H14N4O2。
它也是一种碱性氨基酸,对蛋白质的折叠和结构稳定性发挥着重要作用。
6.丝氨酸(Ser)的分子式为C3H7NO3。
它是一种极性氨基酸,对蛋白质的功能和结构具有重要影响。
7.苏维酸(Thr)的分子式为C4H9NO3。
它也是一种极性氨基酸,对蛋白质的磷酸化修饰和信号传导起关键作用。
8.苯丙氨酸(Phe)的分子式为C9H11NO2。
它是一种非极性的氨基酸,对蛋白质的结构稳定性发挥着重要作用。
9.缬氨酸(Val)的分子式为C5H11NO2。
它是一种非极性氨基酸,它的存在能够影响蛋白质的折叠性质。
10.苏嘌呤(Gln)的分子式为C5H10N2O3。
它是一种极性氨基酸,是谷氨酰胺的衍生物,对蛋白质折叠和功能发挥具有重要作用。
11.苏跤氨酸(Asn)的分子式为C4H8N2O3。
它是一种极性氨基酸,参与蛋白质的N-糖基化修饰和信号传导。
12.苯丙烟酸(Tyr)的分子式为C9H11NO3。
它是一种非极性氨基酸,对蛋白质的结构调节和信号传导具有重要作用。
13.色氨酸(Trp)的分子式为C11H12N2O2。
它是一种非极性氨基酸,是许多重要蛋白质的组成部分。
天冬氨酸的结构描述

天冬氨酸的结构描述
天冬氨酸的结构描述:
天冬氨酸又称天门冬氨酸,是一种α-氨基酸,天冬氨酸的
L-异构物是20种蛋白胺基酸之一,即蛋白质的构造单位。
它的密码子是GAU和GAC。
它与谷氨酸同为酸性氨基酸。
天冬氨酸普遍存在于生物合成作用中。
它是生物体内赖氨酸、苏氨酸、异亮氨酸、蛋氨酸等氨基酸及嘌呤、嘧啶碱基的合成前体。
它可作为K+、Mg2+离子的载体向心肌输送电解质,从而改善心肌收缩功能,同时降低氧消耗,在冠状动脉循环障碍缺氧时,对心肌有保护作用。
它参与鸟氨酸循环,促进氧和二氧化碳生成尿素,降低血液中氮和二氧化碳的量,增强肝脏功能,消除疲劳。
天冬氨酸(Aspartic acid)是构成蛋白质的20种基本氨基酸之一,其在生化试剂和临床医学方面具有广泛的应用。
它的化学名称为氨基丁二酸,其结构式为HOOC-CH2-CH(NH2)-COOH,分子量为133.10。
它有两种旋光异构体:D 型和L 型。
D型中文同义词:坏血酸;D-天冬氨酸;2-氨基丁二酸;D-天门冬氨酸;D-天冬氨酸,99%;D-天门冬氨酸, D-天冬氨酸;D(-)氨基丁二酸;D(-)氨基琥珀酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第4期1999年7月无 机 化 学 学 报CHIN ESE JO U RN A L OF IN OR GA N IC CHEM IST RYVo l.15,N o.4July,1999研究简报L-天冬氨酸、精氨酸多元体系中希土(Ⅲ)和钙(Ⅱ)化学形态韩景芬 柳艳敏 牛春吉* 杨魁跃 倪嘉缵(中国科学院长春应用化学研究所希土化学与物理开放实验室,长春 130022)关键词: 希土 钙 氨基酸 化学形态分类号: O614.33为有助于阐明体内希土化学形态,在前文工作基础上[1~4],本文报道在模拟生理条件下用pH电位法和模拟计算法研究了希土和生命金属离子Ca(Ⅱ)在L-天冬氨酸(L-Asp)、L-精氨酸(L-A rg)多元体系中的化学形态,并比较T b(Ⅲ)和Ca(Ⅱ)离子在三元及四元体系中的行为特点。
1 实验部分以盐酸溶解镨、铽和镱氧化物(99.9%)配制氯化希土溶液,其浓度以标准EDTA溶液标定。
L-Asp、L-Arg为生化试剂。
其他试剂皆为分析纯以上。
实验用水为去离子水。
用上海雷磁仪器厂生产pHs-3C型精密pH计(精密度为±0.01)测定pH值。
滴定方法和数据处理同前文[1]。
配体质子化常数和二元配合物稳定常数取自文献值[2,3]。
2 结果和讨论研究的多元体系存在的化学平衡及相应稳定常数的表达式如下:p M+q Asp+r Ar g+s H=M p(Asp)q(Arg)r H sB pqrs=[M p(Asp)q(Arg)r H s]/[M]p[Asp]q[Arg]r[H]s上式中p、q、r、s分别代表配合物中金属离子[Pr(Ⅲ)、T b(Ⅲ)、Yb(Ⅲ)、Ca(Ⅱ)],L-天冬氨酸, L-精氨酸和可解离质子的数目。
三元体系:经计算机优化确定了在天冬氨酸、精氨酸三元体系中希土(Ⅲ)和钙(Ⅱ)的物种,并测得了三元配合物的稳定常数(表1)。
与希土和钙的天冬氨酸、精氨酸二元体系[2,3]不同,钙(Ⅱ)的三元体系中除1100型和1011型配合物外,还生成了1113型配合物。
希土(Ⅲ)的三元体系除了二元体系中已经存在的1100型、1200型、1011型配合物物种外,又生成了1111型和1113型配合物。
由表1可见,对1113型配合物,钙配合物稳定性与希土配合物的相近,但对二元配合物,钙配合物稳定性则小于希土配合物的。
这可能是由于多元配合物中统计因素和a 收稿日期:1998-07-21。
收修改稿日期:1998-11-05。
国家自然科学基金资助项目(No.29671029和No.29890280)。
*通讯联系人。
第一作者:韩景芬,女,27岁,硕士;研究方向:生物无机化学。
空间位阻效应起重要作用[5],从而导致钙配合物稳定性与希土配合物的相近。
三元体系中Tb (Ⅲ)和钙(Ⅱ)的物种随溶液pH 变化情况分别见图1、2。
在较低pH 范围,铽主要以自由离子形式存在,随pH 值升高,自由Tb(Ⅲ)减少,1113型配合物增加,pH 约为5.5时达到最大值,此后随pH 值升高自由T b(Ⅲ)和1113型配合物逐渐转化成1111型、1100型、1011型和1200型配合物。
三元体系中,T b (Ⅲ)物种随溶液pH 值升高转化情况为1000→1113→1111+1100+1011+1200。
在pH 2~10的变化过程中,T b(Ⅲ)的1100型、1011型配合物始终很少,图上几乎难以显示出来。
Ca(Ⅱ)的物种随溶液pH 值升高转化情况是:1000→1113→1100+1011。
比较图1和图2明显可见pH 4.5~7.5之间Ca (Ⅱ)大部分以自由离子形式存在,而Tb (Ⅲ)大部分以1113型、1111型配合物存在。
表1 三元配合物的稳定常数Table 1 Stabilty Constants of the Ternary C omplexess ystem p q r s log B pqrs Ca-Asp -Arg 111335.97±0.11Pr-Asp-Arg 111121.36±0.15111335.57±0.16Tb -Asp-Arg 111122.16±0.09111335.90±0.11Yb-Asp-Arg111123.24±0.10111336.47±0.10图1 三元体系T b 的物种分布Fig.1 Distribution of T b species in ter nary system[A sp]=[A rg ]=0.0022mo l ・L -1[T b]=0.001mol ・L -1图2 三元体系Ca 的物种分布F ig.2 D istribut ion o f Ca species in ter nar y sy stem[A sp]=[A rg ]=0.0022mo l ・L -1[Ca]=0.001mol ・L -1四元体系:为进一步考察希土(Ⅲ)与Ca(Ⅱ)的竞争取代情况,以Tb(Ⅲ)为希土代表,用Comics 程序,利用已有二、三元配合物稳定常数对T b (Ⅲ)、Ca (Ⅱ)、L -Asp 、L -Ar g 四元体系中Tb(Ⅲ)和Ca(Ⅱ)的物种分布进行了计算研究,结果如图3、4。
由图1和图3可见,与三元体系相比,T b (Ⅲ)四元体系中1113型配合物含量明显减少,在pH 为5.0时,1113型配合物含量达到最大值(约34%),三元体系中,1113型物种却可高达60%(pH =5.5)。
而1100型物种554 无机化学学报 第15卷含量显著增大,pH 为7.0时约为45%,相应的三元体系中1100型物种含量低于6%。
T b (Ⅲ)四元体系中,在pH 2~5之间自由T b(Ⅲ)变化也较为平缓。
考察图4可知,Ca(Ⅱ)四元体系中,因受Tb(Ⅲ)竞争作用的影响,自由Ca(Ⅱ)含量增加且变化较为复杂,在pH 7~9之间出现小峰。
其原因是此时T b(Ⅲ)稳定的1111型配合物开始大量生成,pH 为9.0时达到最大值(75%以上),同时伴有稳定的Tb (Ⅲ)1200型配合物生成。
可见pH 7~9之间,铽能强烈地与钙竞争天冬氨酸和精氨酸这两种生物配体。
上述结果表明Tb(Ⅲ)和Ca(Ⅱ)间存在明显竞争作用。
图3 四元体系中T b 物种分布Fig.3 Distr ibutio n o f T b species in quat ernar ysystem[A sp ]=[A r g ]=0.0022mol ・L -1[T b ]=[Ca ]=0.001mo l ・L -1图4 四元体系中Ca 物种分布F ig.4 Distr ibutio n of Ca species in quat ernar y sys-t em[A sp ]=[A r g ]=0.0022mol ・L -1[T b ]=[Ca ]=0.001mol ・L -1参 考 文 献[1]Z HAO Shu-Fu (赵淑富)et al Gaodeng X uex iao H uax ue (Chemical J ournal of Chinese U niver sities ),1995,16(6),847.[2]L IU Yan -M in (柳艳敏)M aster D egr ee T hesis of Changchun I nstitute of A pp lied Chemistry ,Chinses e A -cad emy of S ciences (中国科学院长春应用化学研究所硕士学位论文),1997.[3]Z HAO Hui(赵 晖)M aster D egr ee T hesis of Changchun I ns titute of Ap p lied Chemistry ,Chinsese A cade -my of Sciences (中国科学院长春应用化学研究所硕士学位论文),1996.[4]T ewar i R .C .et al J .I nor g .N ucl .Chem .,1973,35,3044.[5]Sigel H.A ngew .Chem .I nter nat .Ed it .,1975,14(6),394.555第4期 韩景芬等:L -天冬氨酸、精氨酸多元体系中希土(Ⅲ)和钙(Ⅱ)化学形态556 无机化学学报 第15卷SPECIES OF RARE EARTH(Ⅲ)AND CALCIUM(Ⅱ)IN THE PRESENCE OF L-ASPARTIC ACID AND L-ARGININEHAN Jing-Fen LIU Yan-Min NIU Chun-Ji YAN G Kui-Yue NI Jia-Zuan (L abor atory of Rare Earth Chemistry and P hy sics,Changchun I nstitute of A pp liedChemistry,Chines e A cadem y of Sciences,Changchun130022)Rare earth(Ⅲ)-Asp-Arg and Ca(Ⅱ)-A sp-Arg sy stem s w er e studied by potentiometric titration under phy siolo gical condito n.The species o f each system w ere deter mined.The dis-tr ibutio n of T b(Ⅲ)and Ca(Ⅱ)species w as discussed,as w ell as in the quaternary system o f Tb(Ⅲ)-Ca(Ⅱ)-Asp-Arg.Keywords: rare earth calcium amino acid speices。
