亲电加成反应.ppt
合集下载
《亲电加成反应》课件

反应机理
01
02
03
初始阶段
反应物分子在催化剂的作 用下形成正碳离子或正碳 自由基。
中间阶段
正碳离子或正碳自由基与 π键发生加成反应,形成 新的碳-碳键。
最终阶段
产物从催化剂中解离,完 成整个反应过程。
反应条件
催化剂
01
常用的催化剂包括酸、金属卤化物、金属氧化物等,它们能够
促进正碳离子的形成,提高反应速率。
详细描述
碳碳双键的亲电加成反应是常见的有机化学反应之一,通常在酸性或碱性的条件下进行。在反应过程 中,亲电试剂(如氢离子、卤素离子、硫酸根离子等)进攻双键的一端,与另一端的氢原子结合,形 成新的碳碳单键。这种反应类型广泛应用于合成有机化合物。
碳碳叁键的亲电加成
总结词
在碳碳叁键的亲电加成反应中,亲电试剂进攻叁键的一个碳原子,与另一个碳原子上的氢原子结合,形成新的碳 碳单键。
THANKS
感谢观看
详细描述
与碳碳双键的亲电加成类似,碳碳叁键的亲电加成反应也是通过亲电试剂进攻不饱和键来完成的。在反应过程中 ,亲电试剂进攻叁键的一个碳原子,与另一个碳原子上的氢原子结合,形成新的碳碳单键。这种反应类型在合成 有机化合物中也有广泛应用。
羰基的亲电加成
总结词
在羰基的亲电加成反应中,亲电试剂进 攻羰基碳原子,与氧原子结合形成水或 醇,同时生成新的碳氧单键。
讨论
影响亲电加成反应的因素有哪些?如何优化实验条件以提高产物的 纯度和收率?
05
亲电加是亲电加成反应的重要指标之 一,目前仍存在一些挑战。例如,在 某些情况下,反应可能发生在对称不 敏感的位置,导致产物复杂化。
催化剂的合理设计和筛选是提高反应 选择性的关键。通过优化催化剂的结 构和性质,可以实现对反应位点的精 确控制,从而提高选择性。
第五章 加成与消除反应

*2
+ CH2I2 + Zn(Cu)
*3
O CH2=CH-C-CH3 =
Zn/Cu CH2I2
5.1.9 烯烃的复分解反应
+ cat. +
CH3
[M]
H
H
H H3C H H H3C C C H H H
H H
H3C
[M]
C CH3
H H
C C H
[M]
C CH3 H H
“舞伴交换”
[M]
H3C
H3C
(CH3)2CHCH=CH2
HBr
+
+
(CH3)2C-CH2CH3
(CH3)2CHCHBrCH3 + (CH3)2CBr-CH2CH3
次要产物
主要产物
(3) 速率问题 *1 HI > HBr > HCl
*2 双键上电子云密度越高,反应速率越快。
CH3 2C C CH3 2 > CH3 2C CHCH3 > CH3 2C CH2
5.1.3 烯的酸催化水合反应
例1
CH2=C(CH3)2 + H+
慢
CH3C+(CH3)2
H2O
CH3C(CH3)2
+
-H+
CH3C(CH3)2
OH
CH3 H CH3
H 2O
OH2
CH3 CH3 + H 2O
例2
H+
OH CH3 CH3 + H
CH3 OH CH3 H
5.1.4 卤素与烯键的加成
E
C
反应特点:
C
C
亲电加成2012070311

按碳正离子的AdE2历程进行的加成反应, 一般不具有立体选择性。
某些烯烃的加成反应,除得正常的加成产物 外,还得到重排产物,这是碳正离子的AdE2 历程的有利证据之一。
某些烯烃与HX的加成反应另一种历程是经过三分子 的过渡态而进行的,烯烃先以较快的速度形成H-X烯 烃络合物,然后再与另一分子H-X作用,完成加成反 应,得反式加成产物。总的反应是三级动力学, ,
亲电加成
郭勤2012070311
亲电加成
electrophilic addition reaction
亲电加成反应(EA), 简称亲电加成,是亲电 试剂(带正电的基团) 进攻不饱和键引起的加 成反应。反应中,不饱 和键(双键或三键)打 开,并与另一个底物形 成两个新的σ键。亲电加 成中最常见的不饱和化 合物是烯烃和炔烃。
三.协同的加成反应
硼的电负性比氢小,甲硼烷BH3是缺电子分子, 甲硼烷是亲电试剂,与烯烃亲电加成,生成烷 基硼,称为硼氢化反应。硼氢化反应属于“亲 电型”的通过四元环状过渡态而进行的协同反 应,反应的立体化学是顺式加成。
烷基硼再在碱性条件下,用H2O2氧化,使烯烃转变 为醇。整个过程称为硼氢化—氧化反应,经该反应制 备醇,是由烯烃制备特定取向和特定结构醇的好方法, 反应步骤简单、副产物少、产率高,生成的醇恰好相 当于烯烃酸催化水合的反马产物。反应具有高度的立 体专一性。
不饱和烃都含有π键。 如烯烃分子中π轨 道处于双键的上方 和下方,π电子是 裸露的,易于受亲 电试剂的攻击 。
亲电试剂:
亲电试剂(electrophiles)在进攻反应中心时, 试剂的正电部分较活泼,总是先加在反应中心 电子云密度大的原子上,即电子云密度较大的 双键碳上。常见的亲电试剂有卤素(Cl2、Br2), 无机酸(H2SO4、HCl、HBr、Hl、HOCl、 HOBr),有机酸(F3C—COOH、CI3C— COOH)等。
某些烯烃的加成反应,除得正常的加成产物 外,还得到重排产物,这是碳正离子的AdE2 历程的有利证据之一。
某些烯烃与HX的加成反应另一种历程是经过三分子 的过渡态而进行的,烯烃先以较快的速度形成H-X烯 烃络合物,然后再与另一分子H-X作用,完成加成反 应,得反式加成产物。总的反应是三级动力学, ,
亲电加成
郭勤2012070311
亲电加成
electrophilic addition reaction
亲电加成反应(EA), 简称亲电加成,是亲电 试剂(带正电的基团) 进攻不饱和键引起的加 成反应。反应中,不饱 和键(双键或三键)打 开,并与另一个底物形 成两个新的σ键。亲电加 成中最常见的不饱和化 合物是烯烃和炔烃。
三.协同的加成反应
硼的电负性比氢小,甲硼烷BH3是缺电子分子, 甲硼烷是亲电试剂,与烯烃亲电加成,生成烷 基硼,称为硼氢化反应。硼氢化反应属于“亲 电型”的通过四元环状过渡态而进行的协同反 应,反应的立体化学是顺式加成。
烷基硼再在碱性条件下,用H2O2氧化,使烯烃转变 为醇。整个过程称为硼氢化—氧化反应,经该反应制 备醇,是由烯烃制备特定取向和特定结构醇的好方法, 反应步骤简单、副产物少、产率高,生成的醇恰好相 当于烯烃酸催化水合的反马产物。反应具有高度的立 体专一性。
不饱和烃都含有π键。 如烯烃分子中π轨 道处于双键的上方 和下方,π电子是 裸露的,易于受亲 电试剂的攻击 。
亲电试剂:
亲电试剂(electrophiles)在进攻反应中心时, 试剂的正电部分较活泼,总是先加在反应中心 电子云密度大的原子上,即电子云密度较大的 双键碳上。常见的亲电试剂有卤素(Cl2、Br2), 无机酸(H2SO4、HCl、HBr、Hl、HOCl、 HOBr),有机酸(F3C—COOH、CI3C— COOH)等。
第10章 亲电加成反应

2010-9-1
咸宁学院化学与生命科学学院 ©版权所有
第10章 亲电加成反应
4.2.3.σ键参与 4.2.3.σ键参与
X2 X syn-add
邻基参与
X
X
X X 进攻C1
1 2
X 进攻C2 X
X
2010-9-1
咸宁学院化学与生命科学学院 ©版权所有
第10章 亲电加成反应
二、 炔烃的亲电加成反应
CH3 C C CH3
咸宁学院化学与生命科学学院 ©版权所有
2010-9-1
第10章 亲电加成反应
试剂: 的酸性顺序一致, 试剂:与HX的酸性顺序一致, 给出质子能力越大, 的酸性顺序一致 给出质子能力越大, 亲电性越强。 亲电性越强。 HI > HBr > HCl > HF 同理: 同理: ICl > IBr > I2 溶剂: 溶剂极性越强, 利于E- 的异裂 的异裂; 溶剂 溶剂极性越强,①利于 -Nu的异裂; 利于C 型离子的生成。 ②利于 +、鎓型离子的生成。
1.1.2. 鎓型离子历程
C C
2010-9-1
δ
δ
C C
Br Br
Br + Br
咸宁学院化学与生命科学学院 ©版权所有
第10章 亲电加成反应
Br C Br C Br
C C
反式加成
Br
按鎓型离子机理进行反应的事实: 按鎓型离子机理进行反应的事实:
Br Br CH3 C C
SbF5 CH3 SO 60 .C 2
咸宁学院化学与生命科学学院 ©版权所有
第10章 亲电加成反应
三、 共轭二烯烃的亲电加成反应
C C C C C C
兰州大学化学化工学院有机化学课件 第7章 烯烃 亲电加成反应

C
C
cis-2-丁烯
trans-2-丁烯
如果一个双键碳上连有两个相同的取代基,则不存在顺反异构体,例如:
H H C C
CH3 Cl
H3CH2C H C C
CH3 CH3
7.3.2 Z、E命名
cis、trans(顺、反)命名体系只适用于双键碳上各有一个相同的
原子或相同取代基的烯烃,当烯烃分子含取代基不同的三取代或四 取代双键时,无法用cis、trans或顺、反来命名其构型,可采用Z、E 命名
u=
2 x C数 +2-(H数 + X数 )
2
(2)含C、H、O的有机分子 由于氧形成两个键,不影响分子的碳氢个数,因此计 算分子的饱和度时,可以忽略氧的存在。
(3)含C、H、N的有机分子
由于氮形成三个键,因此有机氮化合物比相应的烃多一个氢,例如, C-C变成C-NH-C或C-H变成C-NH2均多了一个氢,如果含两个氮则 多两个氢,于是在计算不饱和度时,应从氢数中减去氮的数目。
+
CH3CH2CH=CH2
热裂过程是自由基反应,涉及到多种自由基,产物很复杂。
CH3 CH3CH2CH2CH3
+
CH2 CH3CH3
CH4 +
CH3CH=CH2 2CH2 =CH2 + H2 CH3CH2CH=CH2+ H2
CH3CH2 + CH2CH3 H + CH2CH2CH3 CH3
7.2 烯烃和其它有机分子的不饱和度
因此正电荷不再是定域在一个原子上,而是离域到更大的空间,即 产生了p-σ超共轭作用(见图7.4),因此稳定了碳正离子。
碳正离子上的烷基越多,超共轭作用发生的机会越多,碳正离子的 稳定性越大。
亲电加成反应课件
亲电加成反应
1
碳-碳重键的加成反应有四种途径:亲电加成 (electrophilic addition)、亲核加成(nucleophilic addition)、自由基加成(radical addition)和环加 成(cycloaddition) 。其中前三种加成反应是两 步过程,首先是亲电试剂、亲核试剂或自由基 进攻重键碳原子,分别生成碳正离子、碳负离 子或自由基中间体,再分别与负的、正的或自 由基中间体反应,完成整个加成过程。环加成 则是试剂同时进攻两个重键碳原子,是一步的 协同反应。
为什么形成溴鎓离子而不是碳正离子? 溴鎓离子具有八隅体结构,碳正离子为六电子体,前者比后者稳定。
哪些亲电试剂与烯烃可形成鎓型离子中间体? Br2, I2, IN3, RSCl or ArSCl, Hg(OCOCH3)2
+
X CC
亲电试剂的原子半径要足够大 9
ArSCl
鎓离子存在的直接证据?
+
SAr Cl-
CC = alkene
键
C键 C
烯烃活泼的原因: 电子受核束缚力小,容易极化
3
1.1 亲电加成反应的历程
1.烯烃的亲电加成反应可用通式表示如下:
历程有两种可能:一步历程,试剂的两部分E+和Nu-同时 分别加到两个双键碳原子上;两步历程,首先E+加到双 键的一个碳原子上,然后Nu-加到双键的另一个碳原子上。
SAr Cl
Biadamantylidene bronomium
其他一些亲电试剂,如异氰酸碘(INCO)、叠氮化碘(IN3)、烷 烃和芳基硫基氯(RSCl、ArSCl),以及在水或醇存在的汞盐 (Hg(OCOCH3)2)等对烯烃的加成,按相似历程进行。
1
碳-碳重键的加成反应有四种途径:亲电加成 (electrophilic addition)、亲核加成(nucleophilic addition)、自由基加成(radical addition)和环加 成(cycloaddition) 。其中前三种加成反应是两 步过程,首先是亲电试剂、亲核试剂或自由基 进攻重键碳原子,分别生成碳正离子、碳负离 子或自由基中间体,再分别与负的、正的或自 由基中间体反应,完成整个加成过程。环加成 则是试剂同时进攻两个重键碳原子,是一步的 协同反应。
为什么形成溴鎓离子而不是碳正离子? 溴鎓离子具有八隅体结构,碳正离子为六电子体,前者比后者稳定。
哪些亲电试剂与烯烃可形成鎓型离子中间体? Br2, I2, IN3, RSCl or ArSCl, Hg(OCOCH3)2
+
X CC
亲电试剂的原子半径要足够大 9
ArSCl
鎓离子存在的直接证据?
+
SAr Cl-
CC = alkene
键
C键 C
烯烃活泼的原因: 电子受核束缚力小,容易极化
3
1.1 亲电加成反应的历程
1.烯烃的亲电加成反应可用通式表示如下:
历程有两种可能:一步历程,试剂的两部分E+和Nu-同时 分别加到两个双键碳原子上;两步历程,首先E+加到双 键的一个碳原子上,然后Nu-加到双键的另一个碳原子上。
SAr Cl
Biadamantylidene bronomium
其他一些亲电试剂,如异氰酸碘(INCO)、叠氮化碘(IN3)、烷 烃和芳基硫基氯(RSCl、ArSCl),以及在水或醇存在的汞盐 (Hg(OCOCH3)2)等对烯烃的加成,按相似历程进行。
高等有机化学 亲电加成反应

有时有重排产物出现
CH3 H3C C CH CH2 CH3 CH3 H3C CH3 rearrangement H3C CH3 C CH CH3
+
H+
+
C CH CH3
X-
CH3 H3C C CH CH3 X CH3
CH3
重排产物的出现可作为经碳正离子中间体历程的证据之一。
6
(2)鎓型离子历程
H Br H H CH3 CH3 Br H CH3 CH3
+
CH3 CH3
OH
CH3 CH3
H
CH3 C C H H
DCl CH3COOD
D
+C
D Cl C C CH3 H H
C CH3 H
H
5
通常不具有立体选择性
CH CH3 3 + CH3 + H2O CH3 H
+
CH3 CH3 顺式 OH HO + H CH3
H
OH
OH CH3 H CH3
反式
CH3 H
H+ F C C F F F HF FF F FF F
F C C F
F F
NC C NC C
CN CN
H C C+ F F F F F
H C C F F F F F F
C CF F
H+
C C H F F
亲核加成产物
19
2. 亲电试剂对加成速率的影响
对于特定烯烃,卤化氢的加成速率与酸性强弱一致 HI > HBr > HCl > HF 对于特定烯烃,混合卤素的加成速率与其异裂难易程度相符 ICl > IBr > I2
第四章 加成反应

②
4.2.3. 亲核加成反应的实例 1. Wittig 反应
Wittig 试剂与羰基发生亲核加成反应,生成烯烃:
C O
Ph3P C
R R'
R C C R'
2. 羟醛缩合
CH3CHO + CH3CHO
OH
O CH3CHCH2C H OH
3. Claisen 酯缩合反应及相关反应
两个酯分子至少有一个酯分子是含有α-氢,在 强碱的作用下,相互缩合成β-羰基酯。
例如溴与烯烃的加成反应。烯烃与溴首先生成π络合物, 然后Br+对π键进行亲电加成生成三元环状正离子中间体-溴 鎓离子,最后Br-从体积较大的溴鎓离子反面进攻原双键碳 原子之一,生成1,2-二溴化物。
H CH3 Br2 H CH3 Br Br- H CH3 H Br CH3 Br Br H CH3 H CH3 H CH3 H CH3 H Br H Br CH3 -Br- Br CH3
典型代表:Cl2、Br2、I2、HOCl、HOBr等与烯烃的亲 电加成反应。
2、三分子亲电加成
Y
2E
E
Y
C C
+ Y
Y+ C C Y
C C E
E
E
一般来说,烯烃与卤化氢的加成,若生成比较不稳定的 正碳离子时,则倾向于按AdE3历程进行,加成的立体化学 特征是反式加成。
4.1.2 亲电加成反应立体化学
Nu E 顺和反异构体
(1)正碳离子历程
a、若生成的正碳离子中间体的正电荷能够在碳骨架中发生 离域,则有利于按正碳离子历程进行; 典型代表:卤化氢、溴和氯与双键碳原子上连有苯基的烯烃 所进行的加成反应。
解释3,3-二甲基-1-丁烯与卤化氢的加成得到2,3-二甲基2-卤丁烷的历程。
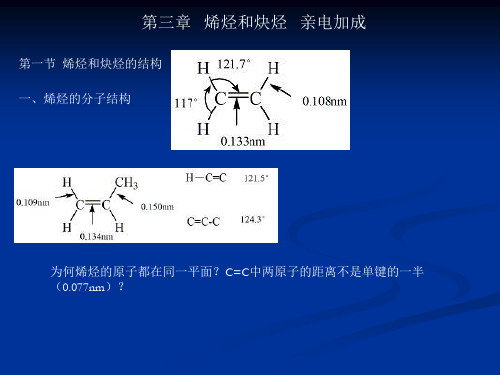
第三章-烯烃和炔烃-亲电加成反应

2S2
2Px1 2Py1 Pz
3SP2 Pz
.
a)SP2杂化轨道由1/3s轨道和2/3p轨道组成;
b)成键能力较sp3杂化轨道弱,但比未杂化轨道强
c)杂化轨道对称轴在同一平面,夹角120°,未杂化 2p轨道垂直这一平面。
3、π键:
未杂化的p轨道沿对称轴平行方向(“肩并肩”)重 叠成形成π键,构成π键的电子叫做π电子。
C2H5C CC2H5 P-2 催化剂
C2H5 C
H
C2H5 C
H
液氨钠与二取代乙炔反应得反式产物
C2H5C
Na , 液NH3
C(CH2)3CH3
- 78 。C
C2H5 C
H
H
C (CH2)3CH3
烯炔与氢加成优先发生在三键上
H2 RC C (CH2)n-CH=CH2 Pt-BaSO4 喹啉 CHR CH (CH2)n-CH=CH2
CH2 CHCH2C CH
+ Br2
-C20C。lC4
CH2 CHCH2C CH Br Br
4,5-二溴-1-戊炔
(2)加卤化氢 烯烃与卤化氢加成生成一卤代烷
C = C + HX
C-C
HX的反应活性:
HX
HI > HBr > HCl > HF (HF加成无实用价值 )
如乙烯的加成
CH2=CH2 + HX → CH3CH2X
C
C
4. 键与 键的差异: 键
①存在的情况
键
a.可以单独存在
键必须与键共存仅存
b.存在于任何共价键中 在于不饱和键如双键等
②成键方式 沿对称轴平行方向“肩并
沿轴向“头碰头”重叠 肩”重叠
亲电加成

Example: 与Br2加成的相对反应速度
H2C CH2 CH3CH CH2 C6H5CH CH2 1 2 3.4 (CH3)2C CH2 (CH3)2C C(CH3)2 BrCH CH2 10.4 14 <0.04
一、烯烃的亲电加成——X2和XOH
2.1 Facts about the Addition of X2 and XOH —— Stereochemistry of Br2 Addition
2mol HX
H C C X H 较稳定
C C H X H
第十章 不饱和碳-碳键的加成反应
Additions to Carbon-Carbon Multiple Bonds
不饱和碳-碳键的加成反应概述
加成反应特点
p键断裂,与亲电试剂或另一反应物形成
加和产物。
不同的加成反应,其机理、区域选择性、
立体化学以及产物各异。
一、烯烃的亲电加成——HX 和H2O
H H3C H CH3
Br2
±
CH3 H Br Br H CH3
H H3 C
CH3 H
Br2
CH3 H Br H Br CH3
一、烯烃的亲电加成——X2和XOH
2.1 Facts about the Addition of X2 and XOH —— Stereochemistry of Br2 Addition
2) Triplet Carbenes —— two singly occupied orbitals —— to act as a biradical
Ph H H : CPh2 (triplet) (Z) H H3C C H CH3 H H3C Ph Ph C H CH3 cis-, mesoPh
亲电加成

Br H H CH3 + CH3 Br2 H CH3 Br Br H CH3 H
+
H CH3 + Br H
CH3 Br CH3
Br
CH3 CH3
Br
-
H H3C H Br
H
6
3. 三分子历程(AdE3)
• 两个亲电试剂E-Nu分子分别与烯烃起反应,其中 一个E-Nu分子先与C=C双键形成p络合,具有亲 电性。而另一个E-Nu分子则表现为亲核性,但总 的是以亲电性为主,因此把这种反应称为三分子 亲电加成反应。
H
+
H2C CH2CH2CH3 H3C CHCH2CH3
+
+
2个C-H键s-p共轭 5个C-H键s-p共轭
18
H2C CHCH2CH3
H2C CHCH2CH3
H+
+
H2C CH2CH2CH3 H3C CHCH2CH3
+
+
ClCl-
Cl H2C CH2CH2CH3 H3C CHCH2CH3 Cl
• 但对含强吸电子基团的烯烃与不对称亲电试剂的 加成,从表面来看是反Markovnikov's规则的。
+ + +
C CH2 H
E+
+ C CH2 H E
亲电加成反应活性: C CH2 H
>
H2C CH2
>
C C H H
13
• 当双键碳原子上连有吸电子基团(如卤素、氰基时,由于 吸电子基吸引电子的结果,降低了C=C双键间的电子云密 度,而不利于亲电试剂的进攻。从过渡态或活性中间体考 虑,因吸电子基对中间体起着去稳定作用,也不利于反应 的进行。 E+
+
H CH3 + Br H
CH3 Br CH3
Br
CH3 CH3
Br
-
H H3C H Br
H
6
3. 三分子历程(AdE3)
• 两个亲电试剂E-Nu分子分别与烯烃起反应,其中 一个E-Nu分子先与C=C双键形成p络合,具有亲 电性。而另一个E-Nu分子则表现为亲核性,但总 的是以亲电性为主,因此把这种反应称为三分子 亲电加成反应。
H
+
H2C CH2CH2CH3 H3C CHCH2CH3
+
+
2个C-H键s-p共轭 5个C-H键s-p共轭
18
H2C CHCH2CH3
H2C CHCH2CH3
H+
+
H2C CH2CH2CH3 H3C CHCH2CH3
+
+
ClCl-
Cl H2C CH2CH2CH3 H3C CHCH2CH3 Cl
• 但对含强吸电子基团的烯烃与不对称亲电试剂的 加成,从表面来看是反Markovnikov's规则的。
+ + +
C CH2 H
E+
+ C CH2 H E
亲电加成反应活性: C CH2 H
>
H2C CH2
>
C C H H
13
• 当双键碳原子上连有吸电子基团(如卤素、氰基时,由于 吸电子基吸引电子的结果,降低了C=C双键间的电子云密 度,而不利于亲电试剂的进攻。从过渡态或活性中间体考 虑,因吸电子基对中间体起着去稳定作用,也不利于反应 的进行。 E+
第九章-亲电加成反应-课件
CC = alkene
键
C键 C
烯烃活泼的原因: 电子受核束缚力小,容易极化
3
1.1 亲电加成反应的历程
1.烯烃的亲电加成反应可用通式表示如下:
历程有两种可能:一步历程,试剂的两部分E+和Nu-同时 分别加到两个双键碳原子上;两步历程,首先E+加到双 键的一个碳原子上,然后Nu-加到双键的另一个碳原子上。
实验结果表明,反应是分步进行的。
烯烃与溴的加成反应
这一结果说明:反应不是一步历程,因为Br2分子中的两 个Br原子相距非常近,不可能同时从C=C双键所在平面 的两侧加到双键的两个碳原子上,即不可能通过一步完 成反式加成。
5
双分子历程 动力学研究表明,不同的亲电试剂与烯烃的加 成表现出两种不同的反应级数,一种是二级反 应,另一种是三级反应。双分子亲电加成动力 学上表现为二级反应,可用AdE2表示。这一 类反应历程还可以分为两种情况,即生成碳正 离子中间体和环状鎓离子中间体两种历程:
CH3 CH3 H OH
顺式 45%
CH3 H
H CH3
OH CH3
CH3 OH
反式 55%
15
问题:
解释双键碳原子上连有苯基的烯烃与溴加成时,顺式加成产物增多。如:溴与反-1-苯 基丙烯反应所得反、顺式加成产物之比为88:12;当双键碳原子所连的苯基上有给电子 基团时,顺式加成产物的比例也明显升高。
26
27
4. 邻基参与
(1)当双键邻位有带未共用电子对的基团存在时,该基团会 对碳正离子中间体进行亲核进攻
X
H2C CH CH2X Br2
H2C CH CH2X Br Br
H2C CH CH2
Br
精细有机合成技术之加成反应介绍课件

02
亲电加成反应:反应物 中的亲电试剂进攻不饱 和键,形成新的共价键
03
自由基加成反应:反应 物中的自由基进攻不饱 和键,形成新的共价键
加成反应的特点
反应过程中,反应物分 子中的原子或原子团被 加成到另一个分子上, 形成新的化学键。
加成反应产物的化学性 质与反应物不同,通常 具有更高的稳定性和反 应活性。
演讲人
目录
01. 加成反应基本概念 02. 加成反应机理 03. 加成反应的应用 04. 加成反应的挑战与展望
1
加成反应基本概 念
加成反应的定义
加成反应是一种有机化学反应,其中两个或多 个分子通过共价键结合形成一个新的分子。
加成反应通常涉及不饱和化合物(如烯烃、炔烃 等)与反应物(如氢气、卤素等)之间的反应。
药物合成中的关键步骤:加成反应在药物合成中占据重 要地位,是合成药物的关键步骤之一。
药物合成中的选择性:加成反应具有高度的选择性,可 以精确控制药物分子的结构,提高药物的疗效和稳定性。
药物合成中的高效性:加成反应具有较高的反应速率和 产率,可以缩短药物合成的时间,提高生产效率。
药物合成中的环保性:加成反应通常具有较低的污染性 和能耗,符合绿色化学和可持续发展的理念。
3
加成反应的应用
有机合成中的应用
01
合成高分子材料:加 成反应可用于合成高 分子材料,如聚乙烯、
聚丙烯等。
04
合成染料:加成反应 可用于合成染料,如
靛蓝、靛青等。
02
合成药物:加成反应在 药物合成中应用广泛, 如抗生素、激素等。
03
合成香料:加成反应 可用于合成香料,如 香兰素、香豆素等。
药物合成中的应用
加成反应的结果是生成一个饱和的、更复杂的 分子,并且反应过程中不产生副产物。
亲电加成的一般机理 ppt课件

NaOH
H OH
O
➢ 机理:
Cl H
分子内 SN2
(p237-242)
H O H OH
O
OH在Cl邻位,反应较容易
2020/10/22
亲电加成的一般机理
23
4. 烯烃亲电加成取向(反应的区域选择性) —— Markovnikov规则(马氏规则)
HBr CH3CH2 CH CH2
CH3 CH CH2
2020/10/22
亲电加成的一般机理
24
烯烃亲电加成反应小结
XX R CH CH2
邻二卤代烷
X
R CH CH3
HX
卤代烷
X2
H OSO3H
O S O 3H
R CH CH3
硫酸氢酯
H2O
OH X
X2
R CH CH2 H2O
b-卤代醇
O R CH CH2
取代环氧乙烷
2020/10/22
R CH CH2
H R'C O O H OCOR'
H 2O H
HOR' H
OH R CH CH3
醇
OR' R CH CH3
醚
R CH CH3 酯
亲电加成的一般机理
25
5. 亲电加成反应机理 (I)—— 经碳正离子的加成机理
① 与HX的加成机理
CC + HX
机理:
双键为电子供体 (有亲核性或碱性)
CC HX
碳正离子中间体
是电子供体是电子供体与亲电试剂结合与亲电试剂结合与氧化剂反应与氧化剂反应烯烃加成的三种主要类型烯烃加成的三种主要类型亲电加成亲电加成自由基加成自由基加成催化加氢催化加氢均裂均裂重点重点烯烃的亲电加成反应烯烃的亲电加成反应electrophilicaddition一些常见一些常见的烯烃亲电的烯烃亲电加成反应加成反应xclbrxclbrccl亲电试剂亲电试剂硫酸氢酯硫酸氢酯醇醇烯烃与烯烃与hhxx的加成的加成clbrhcl150hbr30br80卤代烃消除卤代烃消除的逆反应的逆反应烯烃与烯烃与hhosooso33hh硫酸的加成硫酸的加成合成上应用合成上应用水解制备醇水解制备醇通过与硫酸反应可除去烷烃通过与硫酸反应可除去烷烃卤代烃中的少量烯烃杂质卤代烃中的少量烯烃杂质
第三章烯烃和炔烃 亲电加成
(E)-3-甲基-2-戊烯
(Z)-3-甲基-2-戊烯
(E)-3-methyl-2-pentene
cis-3-methyl-2-pentene
(Z)-3-methyl-2-pentene
trans-3-methyl-2-pentene
3, 3-二甲基-2-乙基丁烯
(Z)-3-甲基-2-戊烯
2,4-二甲基己烯
3-甲基-2-乙基- 1- 丁烯
2. 主链编号
编号时从有不饱和键的一端开始,这样使不饱和键的位次最小。在主链的名 称前写出不饱和键的位次并用“-”隔开。取代基的表示方法和烷烃相同,但是 取代基和主链间也要用“-”隔开。
3. 分子中有两个以上的不饱和键时,用“二烯”或“二炔”等表示主链的名称,并在 名称前标出双键的位次。
三、催化氢化 1. 催化加氢 在催化剂存在下,有机化合物与氢分子发生的反应称为催化氢化(catalytic hydrogenation).
2. 氢化热及烯烃稳定性 1mol不饱和化合物氢化时放出的热量称为氢化热。 氢化热越大,分子的内能越高,越不稳定。 相同数目碳原子的烯烃,反式比顺式稳定,双键碳原子上的基团越多,越稳定。
O
H = 226.9KJ mol-1
H2C
HC
CH
CH
CH2
2H2
CH3CH2CH2CH2CH3
H =254.4KJ mol-1
共轭能=254.4-226.9=27.5KJ.mol-1
(3)折射率较高
2. p- π共轭
π轨道中的电子
H
P轨道中的电子
Cl C C H
H H C H C H C H
空的p轨道
数的烯烃和环烷烃还有功能团异构。
亲电加成反应的机理

亲电加成反应的机理
3. 中间体的稳定化:中间体通常是不稳定的,因此需要通过一些方式来稳定它。这可以通 过负离子的吸引、质子转移体经过一系列的步骤,如质子转移、负离子的离去等,最终形 成产物。产物的结构取决于亲电试剂和底物的性质,以及反应条件。
亲电加成反应的机理
亲电加成反应是一种有机化学反应,通常涉及亲电试剂(如卤素、酸、醛、酮等)与亲电 位较高的双键(如烯烃、炔烃等)之间的反应。其机理可以分为以下几个步骤:
1. 亲电试剂的亲电攻击:亲电试剂通过吸引双键上的电子密度,发生亲电攻击。这个步骤 通常是速率决定步骤,因为它涉及到化学键的形成。
2. 形成中间体:亲电试剂的攻击使得双键中的一个碳原子带有一个正电荷,形成一个中间 体。这个中间体可以是一个正离子或一个复杂的中间体,取决于亲电试剂和底物的性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H H+ CH3
trans cis
Br H +
H H CH3
H H
H Br CH3
H Br H
H CH3
major
(4) 羟汞化-脱汞化反应
烯烃与醋酸汞在水存在下反应,首先生成羟烷基汞 盐,然后用硼氢化钠还原,脱汞生成醇。例如:
CH3CH2CH2CH=CH2
Hg(OAc)2 , H2O 四氢呋喃
(羟汞化)
Br Br
Br Cl
Br OH
(少量)
三种产物均含溴,但无ClCH2CH2Cl生成!
Why?
对实验三的解释:
反应是分步进行的,首先生成环状溴正离子:
Br Br CH2 CH2 Br -
CH2=CH2
慢
Br
快
溴 离子
Br CH2 CH2 Br
三种负离子的对环状溴正离子的竞争形成三种产物:
Br+ CH2 CH2
COHH3 HCH3
按正碳离子机理进行反应的底物结构是: ① 环状非共轭烯烃 ② 正电荷能够离域在碳骨架的体系 2) 重排产物的生成
CH3 HCl
H3C C HC CH2
CH3
CH3
CH3
H
H3C C HC CH3 + H3C C C CH3
Cl CH3 major
CH3 Cl
CH3
CH3
CH3
2E Nu + C C
E Nu CC E Nu
E CC Nu
H Cl
H
CH3
CC
H3C H Cl CH3
HH H3C C C CH3
Cl CH3
常见的亲电试剂:
Cl2,Br2,ICl,IBr, HOCl, RSCl,卡宾 ,
Br
RCO, B2H6.
H3C
H
H3C
H
CC
H
CH3CH3 HH H3HOAc HAc烷基取代增多,双键上电子云密度增大, 亲电加成反应速率增大
CH3-是给电子基!
说明双键上电子云密度越大,反应速率越大。 即该反应是由亲电试剂首先进攻的加成反应---亲电加成!
实验三:
当体系中存在氯化钠时,则反应产物为混合物:
CH2=CH2 + Br2 H2O,NaCl
CH2-CH2 + CH2-CH2 + CH2-CH2
ArSCl
SAr Cl
SAr Cl
按鎓型离子机理进行反应的事实:
实验事实:
* 动力学上测得该反应为二级反应 * 立体化学:产物为反式加成产物 * 核磁共振已检测出鎓离子的存在
CH3
Br Br
C
C
CH3
SbF5 SO2
60
.
C
CH3 CH3
H3C Br CC
H3C
CH3 CH3
按翁型离子机理进行反应的事实: 超强酸介质
BrClOH-
BrCH2CH2Br BrCH2CH2Cl 无ClCH2CH2Cl !! BrCH2CH2OH
烯烃加卤素的立体化学:反式加成!
C=C
+
Br
Br
慢
烯烃
B+r
CC
Br
快
Br-
CC
Br
溴分子中Br原子距离很近,不可能同时从平面两 侧加成,因此反应不是通过一步完成反式加成
例:
+ Br2
CCl4
OH OH
Syn-1,2-diols
顺式环状锇酸酯
HH
+ OsO4
NaHSO3
HH
O
O
Os
OH OH
O
O
cis-1,2-Cyclopentanediol (a meso compound)
However, osmium tetroxide is highly toxic(毒) and is very expensive.
H2O2 OH-
(RCH2CH2O)3B
❖ 水解:
(RCH2CH2O)3B + 3H2O 3RCH2CH2OH +B(OH)3
对-烯烃是制备伯醇的一个好方法. •比较下列反应产物:
CH2CH=CH2
H+ H2O
1) BH3 2)H2O2/OH-
CH2CHCH3
2o
OH
CH2CH2CH2OH
1o
1. 立体专一性--顺式加成 2. 区域选择性好--氢加在含氢较少的碳原子 上,硼基选择位阻较小的碳原子上 3. 对-烯烃是制备伯醇的一个好方法.
10.1.2 反应的立体化学
CC
Addition + A-B
ACCB
Syn and anti additions
A Syn addition
+ XY
X
Y
An anti addition
Y
+ XY
X
顺式加成:反应的两部分从底物同侧加成
CC
O
O
Os
O
O
OsO4, Na2SO3
OO Os
O O-
OHH2O
E Nu
E
2E Nu + C C
CC
CC
E Nu
Nu
* 一般说来,烯烃与卤化氢的加成为三分子亲电加成反应 机理
* 按照三分子机理进行反应时,由于烯烃与一分子HX中 的H+结合的同时,另一方向又与第三个分子中的HX或 X-结合,故加成的立体化学特征是反式加成
3. 三分子亲电加成机理 亲电试剂为H-X
CC HX
+ X-
Cl
H+
+H2O
H
叔碳正离子
Ph H
H + DCl
CH3
H CH3 Cl D
Ph H
苄基碳正离子
H Cl
CH3
D
Ph H
H CH3
+ Ph
D H
Cl
反应特点:
1) 产物是大约定量的顺反异构体:没有立体选择性
CH3
H+
CH3 + H2O
CH3
H CH3
H2O
OH HCCHH33 +
Br2
H Br CH3
Br
H
CH3
Br
H
CH3
H Br CH3
H
CH3 Br2
H Ph
H Br Ph
Br
H3C
H
Ph CH CH
H Ph Br
Evidence for Cyclic Bromonium Ions
Dichloro and diiodo compounds behave much like the dibromide Two distinct types of methyl groups for the fluoro compound indicates that a β-fluoro carbocation is the major intermediate for this compound. The fluorine resonance is also indicative of an open carbocation. The bromo compound exhibits only one methyl resonance even when cooled to -120° C.
第10章 碳碳重键的加成反应 (Addition to Carbon - Carbon Multiple Bonds)
试剂进攻碳碳重键的途径
碳碳重键的加成
π电子易于极化, 利于亲电试剂的进攻, 容易发生亲电加成反 应。
CC
Y
叁键可以发生 亲电加成反应, 但更易发生亲 核加成反应。
10.1. C-C双键的亲电加成反应
C
溴鎓离子
C Br + Br
C
Br
C
C
Br
Br C
C Br
反式加成
Br-从体积较大的溴鎓离子的反面进攻碳原子
烯烃加溴历程:
C=C
+
Br
Br
慢
烯烃
B+r
快
CC
Br-
炔烃加溴历程:
环状溴正离子
Br
CC
Br
可见,烯、炔与Br2、I2的加成反应是由Br+首 先进攻的,是亲电加成反应。
其它亲电试剂如异氰酸碘氯、碘、次卤酸(HOCl、 HOBr)芳基硫基氯(RSCl、ArSCl)以及在水或 醇存在下汞盐如Hg(OCOCH3)2的加成
Br2 CCl4
Br H It is anti addition (反式加成)
H Br
trans-1,2-Dibromocyclopentane (E)-1,2-Dibromocyclopentane
cyclopentene
Br2 CCl4
Br-
H
Br H
+
Bromonium ion
Br H
+
HH
Br
CH3
Br Br
C
C
CH3
SbF5 .
SO2 60 C
CH3 CH3
H3C Br CC
H3C
CH3 CH3
核磁共振表明12个氢是等同的
按翁型离子机理进行反应的体系结构特点:
1) 底物是简单的烯烃或非共轭链的烯烃, 即C + 不稳定的体系;
2) 亲电试剂的进攻原子是第二周期以上的元素。
3) 三分子亲电加成机理
H
H
CH3
