原子结构讲义
高中化学选择性必修二教案讲义:原子结构(教师版)

原子结构1、根据构造原理写出1~36号元素原子的电子排布式2、核外电子的运动状态,电子云与原子轨道,基态、激发态和光谱3、泡利原理、洪特规则一、原子结构模型的演变1.1869年,俄国化学家门捷列夫发现了元素周期表2.19世纪初,道尔顿提出了近代原子学说3.1913年,丹麦科学家玻尔提出了氢原子模型4.1920年,丹麦科学家波尔提出了构造原理5.1925年,丹麦科学家波尔的“壳层”落实为“能层”与“能级”厘清了核外电子的可能状态6.1936年,德国科学家马德隆发表了以原子光谱事实为依据的完整的构造理论二、能层与能级1.能层(相当于必修中的电子层)(1)定义:核外电子按能量不同分成能层。
(2)电子的能层由内向外排序,其序号、符号以及所能容纳的最多电子数及能层的能量与能层离原子核距离的关系:能层一二三四五六七符号K L M N O P Q最多电子数281832507298离核远近近远能量高低低高即能层越高,电子的能量越高(3)能层数量规律:①每一层最多容纳的电子数:2n2个。
②最外层电子数不超过8个(K层为最外层时不超过2个)。
③次外层电子数不超过18个,倒数第三层不超过32个。
(4)能层能量规律:①原子核外电子总是尽可能先排布在能量较低的能层上,然后由内向外依次排布在能量逐渐升高的能层。
②能层越高,电子的能量越高。
③能量的高低顺序为E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)。
2.能级(1)定义:同一能层的电子,还被分成不同能级。
(2)表示方法:分别用相应能层的序数和字母s、p、d、f等表示。
(3)能级的符号和所能容纳的最多电子数如下表:能层12345能层符号K L M N O 能级1s2s2p3s3p3d4s4p4d4f5s5p……最多电子数226261026101426 281832……2n2(4)能层与能级的有关规律①能级的个数=所在能层的能层序数②能级的字母代号总是以s、p、d、f排序,字母前的数字是它们所处的能层序数,它们可容纳的最多电子数依次为自然数中的奇数序列1,3,5,7…的2倍。
原子结构讲义

原子结构【知识梳理】(一)原子结构学说的发展历程及原子结构模型的演变1. 古代朴素的原子观:我国战国时期的惠施认为物质是无限可分的;我国战国时期的墨翟认为物质被分割是有条件的;古希腊哲学家德谟克利特提出古典原子论(原子是构成物质的微粒,万物是由间断的、不可分割的微粒即原子构成的,原子的结合和分割是万物变化的根本原因)。
2. 英国科学家道尔顿提出近代原子学说——实心球模型:①物质由原子组成;②原子不能创造,也不能被毁灭;③原子在化学变化中不可再分割,它们在化学变化中保持本性不变。
3.汤姆生的―葡萄干面包式‖原子结构模型:①原子中存在电子,电子的质量为氢原子质量的1/1836;②原子中平均分布着带正电荷的粒子,这些粒子之间镶嵌着许多电子。
4. 英国物理学家卢瑟福的 ―行星式‖原子结构模型(核式原子结构模型):①原子由原子核和核外电子组成,原子核带正电荷,位于原子的中心,电子带负电荷,在原子核周围作高速运动;②电子的运动形态就像行星绕太阳运转一样。
思考:卢瑟福的α粒子散射实验有哪些现象发生?能得出什么结论?5. 原子结构的现代模型:电子云模型。
由丹麦物理学家波耳的轨道理论演变而来。
该模型的要点是:用电子在给定时间内在空间的几率分布的图像来描述电子的运动,这些图像就是电子云。
电子出现几率密度大的地方,电子云―浓密‖一些;几率密度小的地方,电子云―稀薄‖一些。
但电子云的正确意义并不是说电子真的像云那样分散,电子云只是一种几率云。
(二)原子结构和相对原子质量1.元素:具有相同核电荷数(即质子数)的同一类原子叫做元素。
2.原子的构成:Z A Z Z ⎧⎫⎧⎨⎪⎪⎨⎬⎩⎪⎪⎩⎭质子 个原子核原子中子 (-)个核外电子 个3.质量数:忽略电子的质量,将原子核内所有的质子和中子相对质量取近似整数值,加起来所得的数值,叫做质量数,用符号A 表示。
(A Z X )注:4.构成原子的粒子间数量关系①质量数(A)=质子数(Z)+中子数(N)②核电荷数(Z)=质子数=原子序数=核外电子数5.(1)同位素:具有相同质子数和不同中子数的同一种元素的原子互称为同位素。
初三化学2原子结构讲义

第三单元物质构成的奥秘课题2原子的结构原子和原子核的结构示意图a、原子是由居于原子中心的带正电的和带负电的两部分组成。
b、在原子中:一个质子带一个单位,一个电子带一个单位,中子。
C、在原子中,电子的质量很小,只有质子和中子质量的1 / 1836,故原子的质量主要集中在d、每一个原子只有一个原子核,的多少决定了原子的种类,所以同一类的原子中,其核内的一定相同。
e、原子中,核电荷数==问题:1、原子对外不显电性的原因是什么?2、为什么原子的质量主要集中在原子核上总结:1)原子的构成情况:核外电子(在核外作高速的无规则的运动)广原子 Y 「质子' 原子核士1(居于原子中央)昌工I中子注意:构成原子的粒子有三种:质子、中子、电子。
但并不是所有的原子都是由这三种粒子构成的。
如有一种氢原子中只有质子和电子,没有中子。
b、电性关系不带电的微粒:中子、原子(分子);带负电荷的微粒:电子;带正电荷的微粒:原子核、质子c、电量关系:核电荷数=质子数(原因是中子不带电);质子数=电子数(原因是原子不带电)所以在原子中:核电荷数二质子数=电子数注意:在原子中,原子核所带的正电荷数(核电荷数)就是质子所带的电荷数(中子不带电),而每个质子带1个单位正电荷,因此,核电荷数二质子数,由于原子核内质于数与核外电子数相等,所以在原子中核电荷数=质子数=核外电子数。
2)原子的性质:a.都很小;b.原子之间存在;c.原子总在不断。
1.原子核外电子的排布原子结构示意图:钠原子的原子结构示意图、事(+11)2 8 1—>Y 777I ----- >在化学反应中,金属原子易电子,非金属原子易电子;稀有气体原子电子。
决定了原子的化学性质。
离子形成:原子失去电子后,变成带正电荷的,得到电子后,变成带负电荷的离子是构成物质的一种基本微粒,例如食盐是由离子构成的。
注意:原子得失电子后,核外电子数一定改变,而质子数不变。
观察1---18号元素的原子结构示意图,探究元素周期表编排的规律。
高中化学选修三第一章原子结构与性质讲义及习题含答案

第一章 原子构造及性质一.原子构造1、能级及能层2、原子轨道3、原子核外电子排布规律(1)构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按下图依次填入核外电子运动轨道(能级),叫做构造原理。
能级交织:由构造原理可知,电子先进入4s 轨道,后进入3d 轨道,这种现象叫能级交织。
(PS :构造原理并非4s 能级比3d 能级能量低,而是指这样依次填充电子可以使整个原子的能量最低。
)(2)能量最低原理原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
(3)泡利(不相容)原理:一个轨道里最多只能包容两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利原理。
(4)洪特规则:当电子排布在同一能级的不同轨道(能量一样)时,总是优先单独占据一个轨道,而且自旋方向一样,这个规则叫洪特规则。
比方,p3的轨道式为,而不是。
洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充溢或全充溢时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。
前36号元素中,全空状态的有4Be 2s 22p 0、12Mg 3s 23p 0、20Ca 4s 23d 0;半充溢状态的有:7N 2s 22p 3、15P 3s 23p 3、24Cr 3d 54s 1、25Mn 3d 54s 2、33As 4s 24p 3;全充溢状态的有10Ne 2s 22p 6、18Ar 3s 23p 6、29Cu 3d 104s 1、30Zn 3d 104s 2、36Kr 4s 24p 6。
4、基态原子核外电子排布的表示方法(1)电子排布式↑↓ ↑ ↑ ↑ ↑①用数字在能级符号的右上角说明该能级上排布的电子数,这就是电子排布式,例如K:1s22s22p63s23p64s1。
②为了避开电子排布式书写过于繁琐,把内层电子到达稀有气体元素原子构造的局部以相应稀有气体的元素符号外加方括号表示,例如K:[Ar]4s1。
鲁科版高一化学必修二第一单元第一节原子结构经典讲义
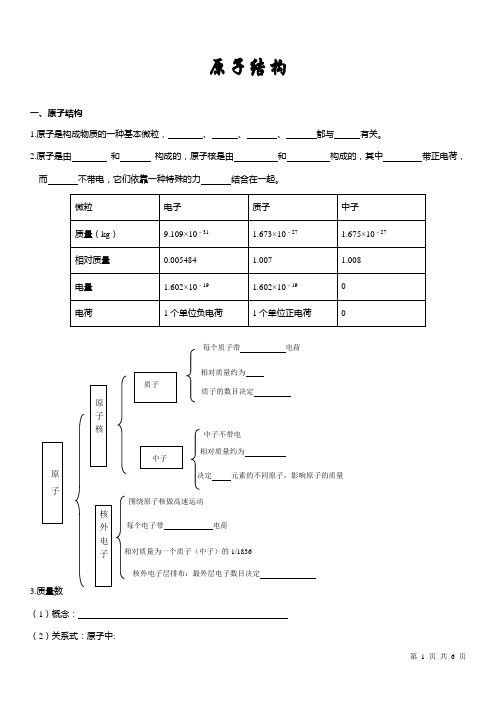
原子结构一、原子结构1.原子是构成物质的一种基本微粒,、、、都与有关。
2.原子是由和构成的,原子核是由和构成的,其中带正电荷,而不带电,它们依靠一种特殊的力结合在一起。
3.质量数(1)概念:(2)关系式:原子中:相对质量约为质子的数目决定中子不带电相对质量约为决定元素的不同原子,影响原子的质量围绕原子核做高速运动每个电子带电荷相对质量为一个质子(中子)的1/1836核外电子层排布:最外层电子数目决定每个质子带电荷核电荷数(Z )= =质量数(A )= ( )+ ( ) 4.原子结构的表示方法:AZX【思考】①阳离子中A Z X n +:核外电子数=质量数(A )= + ②阴离子中A Z X m -:核外电子数= 质量数= + 二、元素、核素、同位素1.元素是 , 元素的种类由 决定。
填写下表并思考:①分别写出氕、氘、氚的原子符号表达式:氕 氘 氚 ②氕、氘、氚的原子结构有什么异同?它们是同一种元素吗?它们是同一种原子吗? ③原子核都是由质子和中子组成的吗?2.核素: 。
几种常见的核素(写出相应的核素符号)氢 ,碳 ,氧 ,氯 ,铀目前已经发现了112种元素,是否表示发现了112种原子?理由是什么?3.同位素: 。
它分为和两种,放射性同位素最常见的应用是制造氢弹原料的是,制造原子弹和核反应堆燃料的是。
三、核外电子排布1.核外电子运动的特征2.核外电子的分层排布看表2总结每层最多可以排布的电子数目?元素的性质与元素原子的最外层电子排布的关系(1)稀有气体原子最外层电子数为8(氦除外),结构稳定,性质;金属原子最外层电子数一般少于4个,易电子;表现性;非金属原子最外层电子数4个,较易获得电子,表现性。
(2)化合价是的一种重要性质。
元素化合价的数值,与特别是有关。
题型一:有关原子结构、元素、核素、同位素练习题例1.对于A Z X 和A+1Z X+ 两种粒子,下列叙述正确的是( ) A .质子数一定相同,质量数和中子数一定不同 B .化学性质几乎相同C .一定都由质子、中子、电子构成D .核电荷数,核外电子数一定相同 例2.、、、H +、H 2是 可以表示为 ( )。
2022届高三人教版化学一轮复习讲义:原子结构 核外电子排布
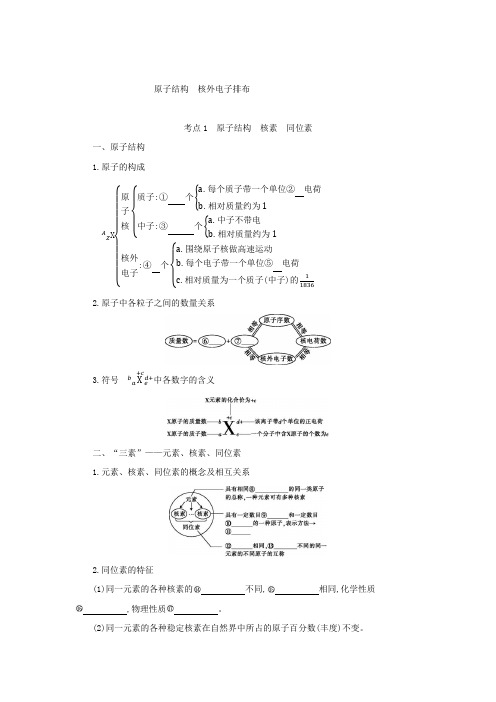
原子结构 核外电子排布考点1 原子结构 核素 同位素一、原子结构1.原子的构成A Z X {原子核{质子:① 个{a .每个质子带一个单位② 电荷b .相对质量约为1中子:③ 个{a .中子不带电b .相对质量约为1核外电子:④ 个{ a .围绕原子核做高速运动b .每个电子带一个单位⑤ 电荷c .相对质量为一个质子(中子)的118362.原子中各粒子之间的数量关系3.符号ba X +ce d+中各数字的含义二、“三素”——元素、核素、同位素1.元素、核素、同位素的概念及相互关系2.同位素的特征(1)同一元素的各种核素的不同, 相同,化学性质 ,物理性质 。
(2)同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
3.氢元素的三种核素11H:名称为,不含中子。
12H:用字母表示,名称为或重氢。
13H:用字母表示,名称为或超重氢。
4.几种重要核素的用途核素92235U614C12H、13H818O用途核燃料用于考古断代制氢弹示踪原子【答案】①Z②正③A-Z④Z⑤负⑥中子数⑦质子数⑧核电荷数⑨质子⑩中子⑪Z A X 质子数中子数中子数质子数几乎完全相同差异较大氕 D 氘T氚判断正误(正确的打“√”,错误的打“×”)。
(1)一种元素只有一种核素,有多少种核素就有多少种原子。
( )(2)1735Cl与1737Cl得电子能力几乎相同。
( )(3)1 mol重水和1 mol水中,中子数之比为2∶1。
( )(4)中子数不同而质子数相同的微粒一定互为同位素。
( )(5)1H218O的摩尔质量为20 g·mol-1。
( )(6)16O与18O间的相互转化为化学变化。
( )(7)核聚变如12H+13H He+01n,因为有新微粒生成,所以该变化是化学变化。
( )(8)H2、D2、T2是氢元素的三种不同核素。
( )(9)32S、34S的原子结构示意图均为。
( )【答案】(1)×(2)√(3)×(4)×(5)√(6)×(7)×(8)×(9)√▶能力1 “三素”“两同”概念辨析 要点提醒1.同位素的“六同和三不同”2.元素、核素和同位素之间的关系3.(1)同位素——同种元素的核素(原子)之间的关系,如 11H 、12H;(2)同素异形体——同种元素形成的不同单质之间的关系,如O 2、O 3;红磷与白磷。
《原子结构与元素的性质》 讲义

《原子结构与元素的性质》讲义一、原子结构的基本概念原子是构成物质的基本单位,它由原子核和核外电子组成。
原子核位于原子的中心,由质子和中子构成,质子带正电荷,中子不带电。
核外电子围绕原子核高速运动,带负电荷。
质子的数量决定了原子的元素种类,我们称之为原子序数。
例如,氢原子的原子序数为 1,意味着它有 1 个质子;氧原子的原子序数为 8,即有 8 个质子。
电子在原子核外分层排布,离核越近的电子能量越低,越稳定;离核越远的电子能量越高,越活泼。
这些电子层又称为能层,用字母K、L、M、N、O、P、Q 等表示。
每个能层中又包含不同的能级,用 s、p、d、f 等表示。
例如,第一能层(K 层)只有一个能级,即 1s;第二能层(L 层)有两个能级,分别是 2s 和 2p。
二、原子结构的表示方法为了更清晰地表示原子的结构,我们常用原子结构示意图。
以钠原子(Na)为例,其原子序数为 11,原子核内有 11 个质子,核外电子排布为 2、8、1 ,原子结构示意图为:+11 2 8 1除了原子结构示意图,还有电子排布式。
例如,钠原子的电子排布式为 1s²2s²2p⁶3s¹。
三、原子结构与元素周期表元素周期表是化学中非常重要的工具,它反映了元素的性质随原子序数递增而呈现周期性变化的规律。
周期表的横行称为周期,共有 7 个周期。
周期的序数等于该周期元素原子具有的电子层数。
第一周期只有两种元素,氢(H)和氦(He);第二、三周期各有 8 种元素;第四、五周期各有 18 种元素;第六、七周期为长周期,分别有 32 种元素。
周期表的纵列称为族,共有 18 个纵列,16 个族。
族又分为主族(A 族)和副族(B 族)。
主族元素的族序数等于其最外层电子数。
例如,第ⅠA 族元素(氢、锂、钠、钾等)的最外层电子数均为 1 。
四、原子结构与元素性质的关系1、原子半径原子半径是描述原子大小的一个重要参数。
它受到电子层数、核电荷数等因素的影响。
《原子结构模型》 讲义

《原子结构模型》讲义一、引言原子,这个构成物质世界的基本单位,一直以来都是科学家们探索和研究的重要对象。
而对于原子结构的理解,我们经历了一个漫长而曲折的过程。
从最初的简单猜测到如今相对完善的理论,原子结构模型的发展见证了人类科学的不断进步。
二、早期的原子观念在古代,人们对于物质的构成已经有了一些初步的思考。
古希腊哲学家德谟克利特提出了“原子”这个概念,他认为原子是不可分割的、坚实的、微小的粒子,物质是由这些原子的不同组合而成。
然而,这种早期的原子观念更多的是一种哲学上的思辨,缺乏科学的实验依据。
三、道尔顿的原子学说到了 19 世纪初,英国科学家约翰·道尔顿提出了较为系统的原子学说。
道尔顿认为:化学元素是由不可再分割的原子组成的;同种元素的原子性质和质量都相同,不同元素原子的性质和质量各不相同;不同元素化合时,原子以简单整数比结合。
道尔顿的原子学说为化学的发展奠定了重要的基础,使人们对物质的构成有了更为清晰的认识。
但道尔顿的原子模型仍然是比较简单和粗糙的,没有考虑到原子内部的结构和电子的存在。
四、汤姆逊的“葡萄干布丁”模型19 世纪末,随着科学技术的发展,人们开始能够通过实验研究原子的结构。
英国物理学家约瑟夫·约翰·汤姆逊发现了电子,并提出了原子的“葡萄干布丁”模型。
他认为,原子是一个带正电的球体,电子像葡萄干一样镶嵌在其中,整个原子呈电中性。
这个模型虽然在一定程度上解释了原子的一些性质,但很快就被新的实验发现所挑战。
五、卢瑟福的核式结构模型1911 年,新西兰物理学家欧内斯特·卢瑟福通过著名的α粒子散射实验,对原子结构有了全新的认识。
实验中,卢瑟福用一束高速的α粒子(氦核)轰击金箔。
结果发现,大部分α粒子能够顺利穿过金箔,但有少数α粒子发生了较大角度的偏转,甚至有的被直接反弹回来。
基于这个实验结果,卢瑟福提出了原子的核式结构模型。
他认为,原子的中心有一个很小的原子核,原子核带正电,几乎集中了原子的全部质量;而电子则在原子核外的空间绕核运动,就像行星围绕太阳运转一样。
《原子结构与元素周期表》 讲义

《原子结构与元素周期表》讲义一、原子结构1、原子的构成原子是由位于原子中心的原子核和核外电子构成的。
原子核带正电荷,由质子和中子组成,其中质子带正电,中子不带电。
核外电子带负电,围绕着原子核做高速运动。
质子的数量决定了原子的元素种类,我们将其称为原子序数。
在同一元素中,质子数相同,但中子数可能不同,这种具有相同质子数但不同中子数的原子互称为同位素。
2、电子的排布电子在原子核外并不是随意分布的,而是遵循一定的规律分层排布。
目前我们用能层(也称为电子层)来描述电子的能量差异和离核远近。
能层从内到外依次为 K、L、M、N、O、P、Q 等。
每个能层又分为不同的能级,用 s、p、d、f 等表示。
s 能级只有一个轨道,p 能级有三个轨道,d 能级有五个轨道,f 能级有七个轨道。
每个轨道最多容纳两个电子,且它们的自旋方向相反。
电子排布遵循三个原则:能量最低原则、泡利不相容原理和洪特规则。
能量最低原则指的是电子总是优先占据能量最低的轨道,然后依次填充能量较高的轨道。
泡利不相容原理表明一个原子轨道最多只能容纳两个电子,且这两个电子的自旋方向必须相反。
洪特规则指出在等价轨道(相同能级的不同轨道)上,电子会优先单独占据不同的轨道,并且自旋方向相同。
例如,氢原子只有一个电子,它会排布在 1s 轨道上;而碳原子有 6 个电子,其排布为 1s² 2s² 2p²。
二、元素周期表1、周期表的结构元素周期表是元素性质周期性变化的体现。
它具有横行和纵列的结构。
横行称为周期,目前周期表共有 7 个周期。
第一、二、三周期称为短周期,第四、五、六、七周期称为长周期。
周期的序数等于该周期元素原子具有的电子层数。
纵列称为族,分为主族(A 族)和副族(B 族)。
主族包括ⅠA 族、ⅡA 族、ⅢA 族、ⅣA 族、ⅤA 族、ⅥA 族、ⅦA 族;副族包括ⅢB 族、ⅣB 族、ⅤB 族、ⅥB 族、ⅦB 族、ⅠB 族、ⅡB 族。
《原子结构》 讲义

《原子结构》讲义一、原子的概念在我们探讨原子结构之前,先来了解一下什么是原子。
原子是化学变化中的最小粒子,也就是说,在化学变化中,原子不能再被分割。
想象一下,世界上的所有物质,无论是我们呼吸的空气、喝的水,还是脚下的大地,都是由无数微小的原子组成的。
二、原子的构成原子就像一个小小的“宇宙”,它由原子核和核外电子构成。
原子核位于原子的中心,体积很小,但却集中了原子的绝大部分质量。
原子核由质子和中子组成。
质子带一个单位的正电荷,中子不带电。
而核外电子则在原子核外的空间里,以极高的速度围绕着原子核运动。
电子带一个单位的负电荷。
一个原子中,质子数等于核外电子数,所以整个原子呈电中性,即不带电。
比如说,氢原子的原子核内只有一个质子,核外有一个电子;氧原子的原子核内有 8 个质子和 8 个中子,核外有 8 个电子。
三、原子核让我们更深入地了解一下原子核。
原子核的直径大约只有原子直径的十万分之一,如果把原子比作一个巨大的体育场,那么原子核就像体育场中心的一只蚂蚁。
但千万别小看这只“蚂蚁”,它可是原子的核心所在。
质子和中子的质量几乎相等,约为一个电子质量的 1836 倍。
这也就解释了为什么原子核集中了原子的绝大部分质量。
质子数决定了原子的种类。
不同元素的原子,质子数是不同的。
例如,氢原子的质子数是 1,氦原子的质子数是 2。
四、核外电子核外电子的排布是有规律可循的。
电子在不同的能量层(也称为电子层)上运动。
离原子核越近的电子层,能量越低;离原子核越远的电子层,能量越高。
电子总是先占据能量较低的电子层,当低能量层填满后,才会进入能量较高的电子层。
最内层电子层最多能容纳 2 个电子,第二层最多能容纳 8 个电子,第三层最多能容纳 18 个电子……电子的排布情况决定了原子的化学性质。
比如,最外层电子数为 8 的原子(氦原子最外层电子数为 2)通常化学性质稳定。
五、原子的质量原子的质量非常小,为了方便计量,我们引入了相对原子质量的概念。
《原子的结构》 讲义

《原子的结构》讲义在我们探索物质世界的奥秘时,原子无疑是其中最基本的构成单位。
了解原子的结构,就如同打开了一扇通往微观世界的大门,让我们能够更深入地理解物质的性质和变化。
首先,让我们来思考一下,为什么要研究原子的结构呢?这是因为几乎所有的化学和物理现象都与原子的行为有关。
从化学反应中的物质转化,到材料的物理性质,都可以从原子的结构中找到答案。
那么,原子到底是由什么组成的呢?简单来说,原子由位于中心的原子核以及围绕原子核运动的电子构成。
原子核非常小,但却集中了原子的绝大部分质量。
原子核由质子和中子组成。
质子带正电荷,中子则不带电。
一个原子的质子数决定了它是什么元素。
例如,氢原子的原子核只有一个质子,而氧原子的原子核则有 8 个质子。
电子则带负电荷,它们在原子核外的特定区域内运动。
这些区域被称为电子层或能层。
电子在不同的能层上具有不同的能量。
离原子核越近的电子层,电子的能量越低;离原子核越远的电子层,电子的能量越高。
电子在原子中的分布遵循一定的规律。
科学家们通过大量的实验和理论研究,提出了原子结构的模型。
其中,最为著名的当属玻尔模型。
玻尔认为,电子只能在特定的轨道上运动,这些轨道具有固定的能量,称为能级。
当电子从一个能级跃迁到另一个能级时,就会吸收或放出能量。
然而,随着科学的发展,玻尔模型逐渐被更精确的量子力学模型所取代。
量子力学告诉我们,电子的运动不能像行星绕太阳那样简单地描述,而是具有不确定性和波动性。
我们只能用概率来描述电子在某个位置出现的可能性。
原子的大小通常用原子半径来表示。
原子半径的大小取决于原子核对外层电子的吸引力以及电子之间的排斥力。
一般来说,同一周期的元素,从左到右原子半径逐渐减小;同一主族的元素,从上到下原子半径逐渐增大。
原子的质量主要集中在原子核上。
质子和中子的质量几乎相等,而电子的质量非常小,通常可以忽略不计。
因此,原子的质量数等于质子数与中子数之和。
了解原子的结构对于我们理解元素的化学性质也非常重要。
《原子的结构》 讲义

《原子的结构》讲义一、原子的发现与概念在探讨原子的结构之前,让我们先回溯一下原子是如何被发现的。
很久以前,人们对于物质的构成并没有清晰的认识。
直到近代科学的发展,科学家们通过一系列的实验和观察,逐渐揭开了原子的神秘面纱。
原子,简单来说,是化学变化中的最小粒子。
它是构成物质的基本单位。
当我们观察周围的各种物质,无论是固体、液体还是气体,它们都是由无数微小的原子组合而成。
二、原子的构成原子并不是一个实心的球体,而是由位于中心的原子核以及围绕原子核高速运动的电子组成。
原子核带正电荷,由质子和中子构成。
质子带正电,中子不带电。
电子带负电,它们在原子核外的特定区域内运动。
这些区域被称为电子层或能层。
原子的质量主要集中在原子核上,因为电子的质量相对来说非常小,可以忽略不计。
以一个常见的氢原子为例,它只有一个质子和一个电子。
而像氧原子,就有 8 个质子、8 个中子和 8 个电子。
三、原子核的结构质子和中子的大小和质量相近,但它们的性质却有所不同。
质子的数量决定了原子的种类和元素的性质。
不同元素的原子,其质子数是不同的。
中子的数量则会影响原子的稳定性和放射性。
原子核虽然体积很小,但却蕴含着巨大的能量。
四、电子的运动电子在原子核外的运动并非像行星绕太阳那样有固定的轨道,而是以一种概率分布的方式存在。
这种概率分布可以用电子云来形象地描述。
电子云密集的地方,表示电子在该区域出现的概率较大;电子云稀疏的地方,则表示电子出现的概率较小。
电子的能量不同,其所在的能层也不同。
能层又可以细分为不同的能级,每个能级上能容纳的电子数量也有一定的规律。
五、原子的大小和质量原子的直径通常在 10^-10 米左右,这是一个非常小的尺度。
虽然原子的质量很小,但科学家们通过相对原子质量的概念,来比较不同原子的质量大小。
相对原子质量是以一种碳原子(碳 12)质量的 1/12 为标准,其他原子的质量跟它相比较所得到的比。
六、原子的稳定性原子的稳定性与原子核内的质子数和中子数的比例有关。
《原子的结构》 讲义

《原子的结构》讲义在我们探索物质世界的奥秘时,原子是一个关键的基石。
理解原子的结构,就如同掌握了一把打开微观世界大门的钥匙。
原子,这个构成物质的基本单位,虽然极其微小,但却蕴含着无穷的奥秘。
让我们一起来揭开它神秘的面纱。
首先,我们来了解一下原子的中心部分——原子核。
原子核由质子和中子组成。
质子带正电荷,中子不带电。
质子的数量决定了原子的元素种类,这被称为原子序数。
比如氢原子,它只有一个质子,而氧原子则有 8 个质子。
原子核虽然体积很小,但却集中了原子绝大部分的质量。
如果把原子比作一个巨大的体育场,原子核就如同场中央的一只蚂蚁,然而就是这只“小蚂蚁”,承载着原子的“重量担当”。
围绕着原子核运动的是电子。
电子带负电荷,它们以极高的速度在原子核外的特定轨道上运动。
这些轨道被形象地称为“电子层”或“能层”。
电子在不同的能层上具有不同的能量。
电子的排布遵循一定的规律。
最内层的电子能量最低,越往外的能层,电子的能量越高。
而且,每个能层所能容纳的电子数量也是有限的。
比如,第一层最多容纳 2 个电子,第二层最多容纳 8 个电子,第三层最多容纳 18 个电子等等。
电子的排布情况决定了原子的化学性质。
当原子通过得失电子形成离子,或者与其他原子共用电子形成共价键时,就会发生化学反应。
为了更直观地理解原子的结构,我们以钠原子为例。
钠原子有 11个质子和 12 个中子,组成原子核。
核外有 11 个电子,分别分布在 3个能层上。
第一层有 2 个电子,第二层有 8 个电子,第三层有 1 个电子。
由于最外层只有 1 个电子,钠原子容易失去这个电子,形成带正电的钠离子,从而表现出活泼的化学性质。
再来看碳原子。
碳原子有 6 个质子和 6 个中子,核外有 6 个电子。
第一层 2 个,第二层 4 个。
这种电子排布使得碳原子能够通过与其他原子共用电子形成多种稳定的化合物,这也是有机物种类繁多的重要原因之一。
随着科学技术的不断发展,我们对原子结构的认识也在不断深入。
原子结构讲义
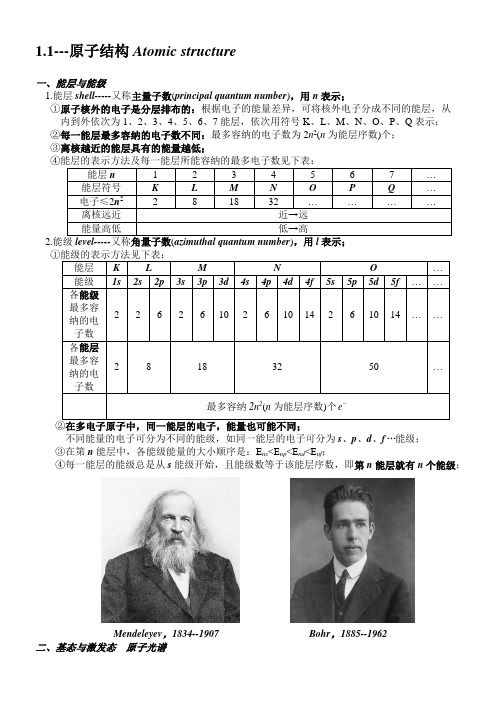
1.1---原子结构Atomic structure一、能层与能级1.能层shell-----又称主量子数(principal quantum number),用n表示;①原子核外的电子是分层排布的:根据电子的能量差异,可将核外电子分成不同的能层,从内到外依次为1、2、3、4、5、6、7能层,依次用符号K、L、M、N、O、P、Q表示;②每一能层最多容纳的电子数不同:最多容纳的电子数为2n2(n为能层序数)个;③离核越近的能层具有的能量越低;④能层的表示方法及每一能层所能容纳的最多电子数见下表:能层n 1 2 3 4 5 6 7 …能层符号K L M N O P Q …电子≤2n2 2 8 18 32 …………离核远近近→远能量高低低→高2.能级level-----又称角量子数(azimuthal quantum number),用l表示;①能级的表示方法见下表:能层K L M N O …能级1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f……各能级最多容2 2 6 2 6 10 2 6 10 14 2 6 10 14 ……纳的电子数各能层最多容2 8 18 32 50 …纳的电子数最多容纳2n2(n为能层序数)个 e②在多电子原子中,同一能层的电子,能量也可能不同;不同能量的电子可分为不同的能级,如同一能层的电子可分为s、p、d、f…能级;③在第n能层中,各能级能量的大小顺序是:E ns<E np<E nd<E nf;④每一能层的能级总是从s能级开始,且能级数等于该能层序数,即第n能层就有n个能级;Mendeleyev,1834--1907 Bohr,1885--1962二、基态与激发态原子光谱1.基态与激发态ground state & excited state处于最低能量的原子叫做基态原子(ground state atom);基态是原子最基本的状态,是稳定的状态;当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子(excited atom);激发态原子不稳定,电子又会跃迁到能量较低的能级,并释放能量;其转化关系如下:光(辐射)是电子释放能量的重要形式之一,在日常生活中,我们看到的许多可见光,如灯光、激光、焰火……都与原子核外电子发生跃迁释放能量有关;2.原子光谱atomic spectrum①原子光谱:不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱;②发射光谱(emission spectrum)是暗色背景的明亮谱线,吸收光谱(absorption spectrum)则是明亮背景的暗色谱线,两者谱线一一对应(因为两个能级之间电子跃迁,吸收的能量和释放的能量相同);※铯cesium,1860年发现,其光谱图中有特征的蓝光,在拉丁语里,铯的含意是天蓝色;※铷rubidium,1861年发现,其光谱图中有特征的红光,在拉丁语里,铷的含意是深红色;※氦helium,1868年分析太阳光谱发现的,来源于希腊文,原意是“太阳”;③原子光谱的应用不同元素产生不同的原子光谱,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析(spectrum analysis),历史上,利用光谱分析也曾发现了许多新元素;④玻尔的理论成功地说明了原子的稳定性和氢原子光谱线规律,但对稍复杂一点的原子如氦原子,玻尔理论就无法解释它的光谱现象;三、构造原理与电子排布式1.多电子原子核外电子的排布顺序电子最先排布在能量低的能级上,然后依次排布在能量较高的能级上;2.构造原理aufbau principle随着原子核电荷数的递增,绝大多数元素原子的核外电子是按照如图所示的能级顺序填充的,填满一个能量低的能级后,再填一个能量高的新能级,这种规律称为构造原理;3.能级交错现象energy level overlap phenomenon由构造原理可知,从第三能层开始各能级不完全遵循能层顺序,产生了能级交错排列,即产生“能级交错”现象;【产生原因:钻穿效应、屏蔽效应】【H原子由于核外只有一个电子,没有屏蔽效应,不存在能级交错,所以能级的能量高低只取决于主量子数;对于3d、4s、4p,显然3d小于4s等于4p】4.电子排布electronic configuration①根据构造原理可表示出一些元素原子的电子排布式,先按能量由低到高的顺序依次写出能级 符号,再用数字在能级符号右上角表明各能级上排布的电子数,这就是原子的电子排布式;【在书写电子排布式时,能层低的能级要写在左边,不能按填充顺序写,例如钪Sc 的电子 排布式为:1s 22s 22p 63s 23p 63d 14s 2,而不能按照填充顺序先写4s 2后写3d 1】②电子排布式的简化写法为了避免电子排布式过于繁琐,可以把内层电子达到稀有气体元素原子结构的部分以相应的 稀有气体元素符号外加方括号表示,例如:K 的电子排布式可表示为:[Ar]4s 1,其中[Ar]叫 1四、电子云与原子轨道 electron cloud & atomic orbital1.核外电子运动的特点核外电子质量非常小(kg m e 311010953.9-⨯=),且运动速度快,不能同时准确地测定它的位置和 速度,更无法确定具有一定空间运动状态的核外电子在某个时刻处于原子核外空间何处;2.核外电子运动状态的描述---电子云(electron cloud )①电子云的定义虽然无法确定核外电子在某个时刻处于原子核外空间何处,但可以确定它出现在原子核外各 处的概率(probability ),下图就是1s 及2p 电子在原子核外出现的概率密度(probability density ) 分布图:小黑点越密,表明概率密度越大,表示电子在那里出现的概率越大;小黑点稀疏的地方,表明概率密度小,表示电子在那里出现的概率小;这种形象描述电子在空间出现的概率大小的图像称为电子云(electron cloud );【概率密度通常用VP 表示,P 表示电子在某处出现的概率,V 表示该处的体积】 ②电子云轮廓图电子云图很难绘制,使用不便,我们常使用电子云轮廓图;绘制电子云轮廓图的目的是表示 电子云轮廓的形状,对核外电子的空间状态有一个形象化的简便描述;绘制时只需注意不同空间状态的电子云轮廓图的标准一致即可;一般情况,把电子在原子核外空间出现概率P=90%的空间圈出来即可;③电子云轮廓图汇总3.原子轨道atomic orbital①concept :把电子在原子核外的一个空间运动状态称为一个原子轨道(atomic orbital ); 原子的电子云轮廓图可以表示电子在原子核外的一个空间运动状态,也叫做原子轨道; ②原子轨道的空间伸展方向s 电子的电子云轮廓图是球形的,ns 能级只有一个轨道,可以表示为: ;p 电子的电子云轮廓图是哑铃形的,np 能级有 3个轨道,可表示为: ;d 电子的电子云轮廓图是花瓣形的,nd 能级有5个轨道,可表示为: ; nf 能级有7个轨道,可表示为: ;③各原子轨道的能量高低多电子原子中,电子填充原子轨道时,原子轨道能量的高低存在如下规律:A.相同能层上原子轨道能量的高低顺序为:ns <np <nd <nf …B.形状相同的原子轨道能量的高低顺序为:1s<2s<3s<4s…C.能层和形状相同的原子轨道的能量相同,如2p x、2p y、2p x轨道的能量是相等的,同理,同能层d能级的5个轨道的能量相同,同能层f能级的7个轨道的能量也相同;【同一能层中的同一能级中所有轨道能量相同,称为简并轨道】④磁量子数(magnetic quantum number):决定原子轨道(电子云)在空间的伸展方向,用m表示;五、泡利原理、洪特规则、能量最低原理1.电子自旋与泡利原理spin of the electron & Pauli exclusion principle①电子自旋spin of the electron量子力学告诉我们,电子除了空间运动状态外,还有一种状态叫做自旋;电子自旋可比喻成地球的自转;电子的自旋有顺时针和逆时针两种相反的状态,常用上下箭头“↑”“↓”表示;【电子自旋(spin of the electron)是电子的基本性质之一,属于量子物理学科,电子自旋先由实验上发现,然后才由狄拉克(Dirac)方程从理论上导出的】【自旋量子数(spin quantum number)是描述电子自旋运动的量子数,自旋磁量子数用m s表示,即↑代表正方向自旋电子,↓代表逆方向自旋电子】②泡利原理Pauli exclusion principle1925年,泡利正式提出,在一个原子轨道里,最多只能容纳2个电子(通常称为电子对),而且它们的自旋状态相反,称为泡利原理(也称泡利不相容原理);Pauli,1900--1958 Dirac,1902--1984 Hund,1896--19972.电子排布图原子核外电子排布可利用电子排布图来表示,这是用方框(或圆圈)和箭头表明核外电子排布的另一种方法,也叫轨道表示式;每一个方框表示一个轨道,能量相同的轨道连在一起,与电子排布式相比,它具有轨道上自旋方向和成键时电子变化明晰的特点,但是稍微麻烦些,书写时先写元素符号,再根据能量最低原理、泡利原理、洪特规则等书写,例如:3.洪特规则Hund rule基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,称为洪特规则;洪特规则不仅适用于基态原子,也适用于基态离子;【洪特规则特例】在等价轨道(同一能级)上的电子排布为全充满(p6、d10、f14)、半充满(p3、d5、f7)和全空(p0、d0、f0)状态时,具有较低的能量和较大的稳定性,可以理解为洪特规则特例;例如:铬(24Cr):[Ar]3d54s1正确,[Ar]3d44s2错误;铜(29Cu):[Ar]3d104s1正确,[Ar]3d94s2错误;4.能量最低原理lowest energy principle①基态是能量最低的状态,基态原子的电子排布式能量最低的原子轨道组合;②在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低,这就是能量最低原理lowest energy principle;③多电子原子的核外电子要先占据能量低的能层,在能量低的能层中又优先占据能量低的能级,然后再依次进入能量较高的能层,这样使整个原子处于最低的能量状态,原子轨道能量的高低依据构造原理来判断;5.补充:26Fe:1s2 2s22p6 3s23p63d6 4s2①电子的运动状态=电子数;(26)②电子的空间运动状态=电子所占的轨道数;(15)③电子的运动范围=能层数;(4)④电子的能量=能级数;(7)Planck,1858--1947。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
微观结构与物质的多样性⑴已知短周期元素的离子:a A2+、b B+、c C3-、d D-都具有相同的电子层结构,则下列叙述正确的是 ( )A、原子半径A>B>D>CB、原子序数d>c>b>aC、离子半径C>D>B>AD、单质的还原性A>B>D>C⑵质量数为23,中子数为12的原子的原子结构示意图:⑶甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙阴离子发生氧化还原反应得到乙单质;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。
能说明甲比乙的非金属性强的是。
⑷元素最高氧化物对应的水化物为H2XO3,它的气态氢化物为()A、HXB、H2XC、XH3D、XH4⑸一些科学家预言,存在稳定的超重元素,如:中子数为184的原子,它位于元素周期表第七周期,第ⅣA族。
由此,下列说法正确的是()A、第七周期有50种元素B、该原子的质子数是184C、该元素的相对原子质量是298D、该原子核外有114个电子⑹在短周期元素中,原子最外电子层只有1个或2个电子的元素()A、是非金属元素B、是稀有气体元素C、是金属元素D、无法确认为哪一类元素⑺X、Y、Z、W四种元素在元素周期表中序数逐渐增大。
X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素。
W原子的质子数等于Y、Z原子最外层电子数之和。
Y的氢化物分子中有3个共价键。
Z原子最外层电子数是次外层电子数的3倍。
试推断:①X、Y、Z的元素符号分别是:②有X、Y、Z所形成的离子化合物是它与W的最高价氧化物对应水化物的溶液加热时反应的离子方程式是⑻X、Y、Z均为短周期元素,它们的原子核外最外层电子数依次为1、6、6,Z位于Y的上一周期,则X、Y、Z三种元素形成的某种化合物的化学式可能为()A、X2YZ4B、 XY2Z3C、 X3YZ4D、X3YZ3⑼下列说法正确的是()A.离子键就是使阴、阳离子结合成化合物的静电引力B.所有金属与所有非金属原子之间都能形成离子键C.在化合物CaCl2中,两个氯离子之间也存在离子键D.含有离子键的化合物一定是离子化合物⑽列物质中,只存在共价键的是()A、NeB、NaOHC、SO2 Na2O⑾断物质在下列变化过程中克服的微粒之间的作用力类型。
(1)碘升华(2)氯化钠晶体融化(3)硫化氢受热分解生成硫和氢气(4)电解水生成氢气和氧气(5)酒精(C2H5OH)挥发⑿①氯化钾、②氧化钠、③氢氧化钠、④氯气、⑤氯化氢、⑥二氧化碳、⑦二氧化硅、⑧硝酸等物质中,若从化合物分类角度看,属于氧化物的有,属于氢化物的有,属于酸的有,属于碱的有,属于盐的有。
若从所含的化学键类型看,属于离子化合物的有,属于共价化合物的有,不属于上述两种类型,但分子内含有共价键的有,物质中既含离子键又含共价键的有。
⒀列电子式的书写是否正确?不正确的请改正。
K︰Cl︰Mg2+[︰F︰]- [︰F︰]- H+[︰Cl︰]-⒁列电子式正确的是()A、H2O2 C、HClO••••••••••••••OClHB、MgCl2 D、CCl4⒂126C与136C ②O2与O3③金刚石与石墨④冰与水⑤正丁烷和异丁烷(1)互为同位素的是(2)互为同素异形体的是(3)互为同分异构体的是(4)属于同一化合物的是⒃列物质属于离子晶体,属于分子晶体的是,原子晶体,金属晶体。
①铁②干冰③金刚石④铜⑤水晶⑥氯化钠⑦碘⑧氢氧化钠⒄SO3晶体融化或升华时,下述发生变化的是()A、分子内的化学键B、分子内的原子个数C、分子的空间构型D、分子间的距离一、元素周期表的结构:Cl-Cl-2+MgO O2-+H+H‥‥‥‥‥‥‥CClCl ClCl二、原子结构、元素周期表和元素性质的关系三、化学键四、化学键与晶体类型五、化学键与分子间作用力:化学键 分子间作用力 氢键 概念 相邻的两个或多个原子间强烈的相互作用把分子聚集在一起的作用力,又叫范德华力 某些具有强极性键的氢化物分子间相互作用(静电作用) 范围 分子内或某些晶体内分子间 分子间(HF 、H 2O 、NH 3) 能量 强弱 较强 性质影响 主要影响化学性质 主要影响物质熔点、沸 点、溶解性 主要影响物质熔点、沸 点、密度五、从微观结构看物质的多样性实例 Cl 2、金刚石、HCl 、CO 2、H 2SO 4、 NH 4Cl 、NaOH 、Na 2O 2NaOH 、KOH 、NaCl 、CaCl 2、Na 2SO 4、Na 2O 、CaO经典题型:【题型一】原子结构组成1、已知A n+离子有m个电子,它的质量数为A,则原子核内的中子数为 ( )+n +n +m-n【题型二】化合物2、下列原子序数所表示的两种元素,能形成AB2型离子化合物的是 ( )A、6和8B、11和13C、11和16D、12和173、物质的下列性质能肯定该物质为离子化合物的是 ( )A、水溶液能导电的化合物B、由金属元素和非金属元素组成的化合物C、在熔化状态下能导电的化合物D、熔点高的物质【题型三】核外电子排布4、两种微粒的核外电子数相同,核电荷数不同,则它们可能是 ( )A.两种元素的不同原子B.两种不同的离子C.同种元素的原子和离子D.两种不同元素的原子和离子5、某元素的原子最外层只有一个电子,它跟卤素结合时 ( )A、一定形成共价键B、可能是共价键,也可能是离子键C、一定是离子键D、以上说法都不对6、有X、Y、Z、W四种主族元素,已知阳离子X、Y和阴离子Z、W具有相同的电子层结构,并且离子半径X>Y,阴离子所带电荷数Z>W,则四种元素的原子序数为()A、X>Y>Z>WB、Y>X>W>ZC、Y>X>Z>WD、Z>Y>X>W【题型四】位、构、性7、已知某非金属元素R的气态氢化物的分子式为RHm,它的最高价氧化物对应的水化物的分子中有b个氧原子,则这种酸的分子式为 ( )+m RO b+8+2b RO b8、从下列叙述中,可以肯定金属A比金属B的活泼性强的是 ( )原子的最外层电子数比B原子的最外层电子数少从酸中置换H+生成H2的速率比B从酸中置换H+生成H2的速率大mo A从酸中置换出H+生成的H2比1 mol B从酸中置换出H+生成的H2多D.常温时,A能从水中置换出氢气,而B不能9、短周期元素x和y可以相互形成化合物x2y,那么x和y所在族的族数之差可能是()10、元素A的阳离子与元素B的阴离子具有相同的电子层结构。
以下关于A、B元素性质的比较中,正确的是 ( )①原子半径:A<B ②原子序数:A>B③原子最外层电子数:B>A ④元素所在的周期数:A>B⑤A的最高正价与B的最低负价的绝对值相等A.②③④B.①②C.④⑤D.②⑤11、下列分子结构中,各原子的最外层电子不能满足8电子稳定结构的是 ( )【题型五】化学键分子间作用力12、下列物质的变化过程中,需克服分子间作用力的是 ( )A.碘和干冰的升华B.生石灰的熔化C.氯化钠和铁的熔化D.酒精和醋酸的蒸发13、下列变化中破坏离子键的是 ( )A、NaOH溶于水B、HCl溶于水C、SiO2熔化D、酒精(C2H5OH)溶于水14、下列说法正确的是 ( )A、NO、NO2互为同素异形体B、相同温度下冰的密度比水小,与水分子间的氢键有关C、水分子间存在氢键使水分子间作用力增加,导致水的沸点较高D、化学键是指物质中相邻的原子或离子间的强烈的吸引作用【题型六】“四同”的考查15、下列各组物质,既不是同位素,也不是同素异形体,也不是同分异构体的是()A.白磷和红磷和14CC.正丁烷和异丁烷D.乙醇和乙醛(CH3CHO)16、下列各组物质中属于同分异构体的是 ( )A、H2O和D23CH2OH和二甲醚CH3-O-CH3C、和和【题型七】晶体知识17、下列物质按熔点由高到低排列的顺序正确的是 ( ) 、SiO2、CO2、Na 、NaCl、CO2、SiO2、CO2、NaCl、SiO2、NaCl、Na、CO2【题型八】综合推断18、A、B、C、D是元素周期表中的短周期元素,它们的核电荷数依次增大。
A元素原子核内仅有1个质子;C元素原子的M电子层上的电子只有1个;B元素原子L电子层上的电子总数是K电子层电子总数的3倍;D元素原子最外电子层上的电子数是次外电子层上电子数的1/4。
(1)、A、B、C、D分别为___、___、___、___。
(2)、A和B形成的化合物的电子式为____________________。
(3)、B原子和A原子之间形成的化学键为________。
B 和C形成的化合物化学式为____________,属于_____化合物,_____晶体。
19、有A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。
B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。
C为原子核内有12个中子的二价金属,当与足量热水反应时,在标准状态下放出氢气。
D的M层上有7个电子。
(1) A、B、C、D各是什么元素?A B C D(2) 写出B、C、D最高价氧化物的水化物化学式,并比较其酸碱性。
,,。
(3) 比较D的气态氢化物与H2S和HF的稳定性。
