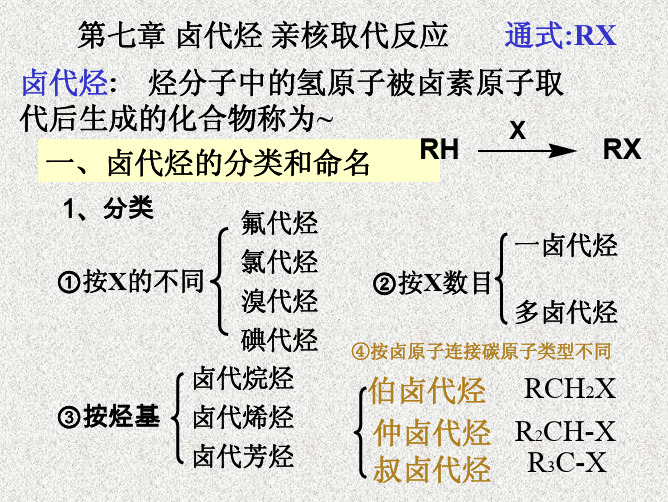
第七章卤代烃亲核取代反应
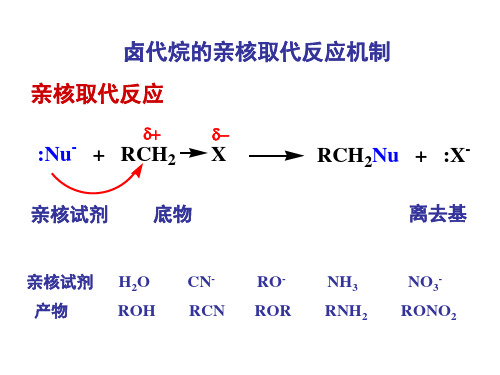
卤代烃亲核取代反

CH3I (碘甲烷)
鉴别反应
卤代烃
CH2Cl H2C CHCH2Cl
试剂
室温
AgCl
立即
加热
(CH3)3CCl RI (CH3)2CHCl CH3CH2CH2Cl CH2 CHCl Cl
AgNO3 EtOH
AgCl
稍慢
× ×
加热 AgCl ×
烯丙式卤
RCH
C2H5OH, H2O Reflux 8h, 75%
NCCH2(CH2)5CN + 2KBr
d、 与 NH3反应制备胺(Amine):
ClCH2CH2Cl 4 NH3 密闭容器 H2NCH2CH2NH2 115-120℃,5h 2NH4Cl
e、 卤离子的交换反应:
氯代烷、溴代烷与碘代烷反应 SN2:伯 > 仲 > 叔 丙酮 CH3CHCH3 NaBr CH3CHCH3 NaI 25℃ Br I
慢
(CH3)3C
Br
(CH3)3C+ + Br
过渡态T1
第二步 叔丁基正离子与亲核试剂 OH-作用:
(CH3)3C
+
+ OH
快
(CH3)3C
OH
(CH3)3C OH
过渡态T2
反应进程与能量关系图:
T1
能 量
C
T2
+ Br
C Br + OH
C OH + Br
反应进程
SN1反应的化学特征 :
10%NaOH,Cu粉
Cl
ONa H2O,H
+
270℃ ,20MPa
第七章 卤代烃亲核取代和β-消除

(C有H3助)3C于Br 1分×散10电8
荷,使
=
CH2=CCHH2–=CCHH2+>R3C+>R2CH+>RCCHH2 2+>CH过 稳3+渡 定态 。
按SN2反应活性:烯丙型>CH3X >伯>仲>叔>乙烯型
CH3Br CH3CH2Br (CH3)2CHBr (CH3)3CBr
SN2速率 150
1.0
CH3CH2Br CH3CH2CH2Br (CH3)2CHCH2Br (CH3)3CCH2Br
1.0
0.28
0.030
0.000042
《有机化学》教学课件(76-04-首页
凡是有利于生成C+,使C+稳定的因素,都有利于SN1。 ① R–X + AgNO3 乙醇 R–ONO2 + AgX↓ 反应活性:叔>仲>伯>CH3X (都按SN1反应) Ag+能够促使C+的生成 极性溶剂,通过溶剂化作 用使C+稳定 ② R–X + NaI 丙酮 R–I + NaX
0.01
0.001
用空间效应解释——空间阻碍越大,越不利于SN2。
《有机化学》教学课件(76-04-1.0版)—第十九讲
不同烃基结构的反应趋势
R3CX SN1
R2CHX
RCH2X
返回首页
SN2 CH3X
SN1
SN1 SN2
SN2
CH3 CH3C–CH2Br
H2O
? SN1 、SN2
CH3
空间阻碍对SN2反应速率的影响
–CH2CH2CH3 Br2
hv
–CH=CHCH3
碱性:C2H5ONa>NaOH
有机化学-卤代烃

(4)被硝酸根取代
RX + AAgg+NOONO32— 醇
R ONO2 + AgX
硝酸酯
•卤化银沉淀产生,反应可作为卤代烃的鉴别反应。
卤代烃反应活性: 烯丙基卤>叔卤代烃>仲~>伯~
(5)卤素交换
丙酮
R-Br(Cl) + KI
R-I + NaBr(Cl)
难溶于丙酮
难溶于丙酮
(6)被氨基(-NH2)取代
三、命名
普通命名法 俗名 系统命名法
1.普通命名法
在烃基名称之前(或后)加上卤素的名 称,称为卤(代)某烃或某烃基卤。
CHCl3
三氯甲烷 氯 仿 (俗名)
C2H5Cl
氯乙烷 乙基氯
(CH3)3CBr
叔丁基溴
CH2=CHBr 溴乙烯
H2C CH CH2 烯丙基溴
Br
Br
溴苯
CH3
Br
邻-溴甲苯(2-溴甲苯) 2-bromotoluene
3-甲基-5-氯庚烷 3-chloro-5-methylheptane
H2C C CH3
Cl
2-氯丙烯 2-chloro-propene
CH3CH CHCH2Cl
1-氯-2-丁烯 1-chloro-2-butene
H37C
CH
6
CH
5
C4H2
CH
3
CH
2
C1H3
CH3 I
Cl CH3
2,6-二甲基-3-氯-5-碘庚烷
•(一) 亲核试剂:具有孤对电子的物质, 能与底物中带部分正电荷的碳发生反应, 这 种 物 质 称 为 亲 核 试 剂 。 ( 也 是 Lewis 碱)。
卤代烃亲核取代反应历程

Substrate
Nucleophile
亲核试剂(Nucleophile): H O
RO
NC
O
H
H
N
H
H
H
两个典型反应为例:
1) H3C Br + OH-
H3C OH + Br-
动力学特征: υ = k [ H3CBr ] [ OH- ], 二级反应;
2) (CH3)3C
Br + OH-
(CH3)3C
HH
(4)瓦尔登转化
E
H
HO
Br
H H
反应历程
图1 SN2 反应势能图
二、亲核反应历程:SN1
(CH3)3C
Br + OH-
(CH3)3C OH + Br-
慢
(CH3)3C-Br
(CH3)3C
Br
(CH3)3C+ + OH 快
(CH3)3C+ + Br
(CH3)3C
OH
ΔE2
ΔE1
慢
H3)3C-Br
SN1
(1)两步反应 (2)单分子反应: υ= K [ R-X ] (3)生成碳正离子中间体 (4)构型翻转 + 构型保持
一切有利于过渡态形成的因素, 均有利于SN2
一切有利于中间体形成的因素, 均有利于SN1
(CH3)3C ++ OH-
δ+
[ (CH3)3C
δ-
OH ]
(CH3)3C + + Br- (CH3)3C OH
(2) 决定反应速率的一步为单分子反应: v = k [ (CH3)3CBr ]
卤代烃—亲核取代反应(有机化学课件)

卤代烃在有机合成的多种用途
灭火器
制冷剂
管材
薄膜
墙板地板
日用品
目录CONTENT来自01亲核取代反应
02
亲核取代反应实例
01
亲核取代反应
亲核取代反应 1.卤代烷结构分析
导入动画
结论:卤代烃的取代是一个亲核取代的过程。
亲核取代反应 2. 定义 亲核取代反应(SN):
有机化合物分子中的原子或原子团被亲核试剂取代的反应。
2. 被烷氧基取代
卤代烷与醇钠作用,卤原子被烷氧基取代而生成醚类化合物。
+ R X
△ R'ONa
+ ROR'
NaX
Williamson 醚合成法
伯卤代烷 > 仲卤代烷 > 叔卤代烷
亲核取代反应实例
3. 被氰基取代
卤代烷与氰化钠或氰化钾在乙醇溶液中共热回流,卤原子被氰基(—CN)取代,
得到腈。
乙醇
+ RX
亲核取代反应实例
6. 卤化物的互换
氯代烷或溴代烷的丙酮溶液与碘化钠共热,可生成氯化钠和溴化钠沉淀。
丙酮
+ RCl NaI
丙酮
+ RBr NaI
+ RI
NaCl
+ RI
NaBr
卤代烷的 定性鉴定
伯卤代烷>仲卤代烷>叔卤代烷
小结
100% 80% 60% 40% 20%
R-X
NaOH
ROH 醇类
R’ONa ROR’ 醚类
NaCN
+ RCN
NaX
乙醇
+ CH 3CH 2CH 2Cl
NaCN
有机化学课件卤代烃2亲核取代反应机理

卤代烃(RXn)—— 烃类分子中一个或多个氢原子 被卤素原子取代后生成的化合物。
官能团—— 卤素原子
SN2 反应的机理
一步反应 亲核试剂是从离去基团的背面进攻
—— 因此发生构型的转化(构型翻转,Walden转化)
SN2 反应的机理
SN2反应中过渡态结构: sp2杂化 新键已部分形成 旧键已部分断裂
卤代烯烃与硝酸银反应
• 与硝酸银的醇溶液反应条件(SN1)
+ R XAg3-N EO tO RHON 2 O AgX
» 烯丙基(苄基)型卤代烯烃
» 叔(R卤-C代H烷=C(RH3-CC-HX)2-X) » 仲孤卤立代型烷卤(代R烯2C烃H-(X)n2A)gNO3-EAtOgNHO3
» 伯(R卤-C代H烷=C(RHC-[CHH2-2X]n)-X)
反应势能变化图如: 凡能影响过渡态稳定 性的因素都将影响反应 活性和选择性
Free energy
Nu、C、X在同一直线上
HH
#
HO Br
CH3
Ea
CH3Br + HO-
CH3O H+ Br-
progress of the reaction
底物(Substrate)对SN2 反应的影响
—— 空间效应(Steric Effects)
EtOH
» 乙烯(苯)型卤代烯烃
(R-CH=CH-X)
室温 室温立即 与室卤 温代放烷置类2m似in 加热
不反应
卤代苯的取代
• 卤代苯与乙烯型卤代物类似,不易发生水解、醇解、氰 解、卤素交换等亲核取代,反应须在强烈条件(高温、 高压、强碱)下;消除反应亦较难;氯苯生成格氏试剂 须在THF中,溴苯则可在无水乙醚中生成。
卤代烃亲核取代

能量曲线: 溴甲烷水解反应
溴甲烷水解反应的能量曲线
伯卤烷易发生 SN2 反应: 空间阻碍小 CH3
叔卤烷: CH3-C-Br : 空间阻碍大(立体效应): 为主 CH3 烷基对α-C 的供电诱导效应(电子效应)
故不易发生 SN2 反应 ,(易 SN1)
SN2 特点: 速度取决于卤代烷与亲核试剂浓度,一步完成, 构型翻转. 反应决定于过渡状态是否容易生成.
SN1 反应特点: 速度只决定于卤代烃,两步完成,反应 只取决于第一步中活性中间体正碳离子的是否容易生成, 产物主要为外消旋体,且有正碳离子的重排可能.(两大标 志)
§7-58:亲核取代反应的影响因素
R-X 可表示成 R-L : L : Leaving Group
主要影响因素: R-L 结构,亲核试剂浓度,性质,溶剂 极性等.
因 SN1 或 SN2 都须把 C-X 键拉长断开,只决 定于 C-X 键的键能和极化度.
可极化性 : C-I > C-Br > C-Cl 键能(kcal/mol): 56 < 70 < 84
例 : (CH3)3C-X + H2O C2H5OH (CH3)3C-OH + HX
F Cl Br I 相对速度: 10-5 1 39 99
I > Br > Cl
二: 单分子亲核取代反应历程
② SN1 历程 : 叔丁基溴水解
(CH3)3C-Br + OH-
(CH3)3C-OH + Br-
速度 V = k [(CH3)C-Br] 一级反应: 只与卤代烃有关
附: V=k [A]a [B]b ,级数 n= a+b ,由实验确定. 对一般反应先确定动力学级数,后确定单,双分子反应, 一般为: 单分子反应---一级;双分子反应----二级.
卤代烃亲核取代和消除、和金属反应

六, 卤代烃的亲核取代反应、消除反应及和金属的反应卤代烃的亲和取代和消除是有机化学中的难点,希望同学们能比较仔细地阅读本部分内容。
这里有一些内容和一般的教科书中介绍的有所不同。
6-1 卤代烃的亲核取代反应,S N1和S N2在有机化学反应中,常常把反应物分为底物和试剂。
在讨论卤代烃的反应中,卤代烃就是底物。
本节主要讨论卤代烷作为底物的取代反应。
卤代烷就是烷烃中的一个氢为卤素取代的“结构为RX(R=烷基,X=卤素)的化合物,又称为烷基卤[化物],P5。
”取代反应就是“分子中某一原子或基团被另一原子或基团替换的基元或分步反应,P86。
”卤代烷的亲核取代反应就是富电子的或带负电荷的试剂把卤代烃中卤素取代下来的反应。
这个反应在合成中非常有用。
例如:RX + Na+ -OH −→ROH + Na+X-RX + Na+ -OR’−→ROR’ + Na+X-制醚的重要方法,称为Williamson醚合成法RX + Na+ -CN −→RCN + Na+X-制腈的重要方法RX + Na+ -C≡CH −→RC≡CH + Na+X-把炔键引入分子从上面的几个反应来看,钠离子没有在反应中起作用,起作用的是-OH、-OR、-CN、-C≡CH等负离子。
是这些负离子把卤素负离子取代了下来。
在这个反应中卤代烷中的卤素是带着一对电子成为卤素负离子离去的,叫做离去基团。
如果把带负电荷的亲核试剂写成Nu-而把离去基团写成-L。
那么卤代烷的亲核取代反应就可以拓展为:R-L + Nu-−→RNu + L-这实际上可看成是一个广义的酸碱反应。
只要是带负电荷的亲核试剂Nu-的碱性比取代下来的离去基团L-的碱性强,这种反应就能发生。
亲核试剂可以是:HO-、RO-、CN-、HC≡C-、RCOO-、CH3COC-HCOOC2H5(以后会知道这就是乙酰乙酸乙酯的合成法)、C2H5OOCC-HCOOC2H5(丙二酸二乙酯合成法)……如果把上面的氧原子换成硫原子,又是一批亲核试剂。
第七章 卤代烃 亲核取代反应

X
H
H CH3
Ph
H
Br Ph
Br X
H H
Ph 顺式消除
Ph CH3
Ph C
H3C
H C
Ph
Ph H
OH- H Br Ph
反式H消除HOHP3-hC C
Ph C
H
CH3
产物
Ph
H H3C
Br H H3C
H Br H
Ph
Ph
Ph
苏式
Br
H H H3C Ph
Ph 顺式消除
Ph H
H Br H3C
④亲核原子为同族元素时,亲核性与碱性强弱顺序相反。 碱性:I- < Br- < Cl- < F- HS- < HO-
亲核性:I- > Br- > Cl- > F- HS- > HO⑤在质子性溶剂中,常用的亲核试剂的亲核性强弱顺序为:
亲核性:RS-≈ArS->CN->I- >NH3> RO- > OH- > Br>PhO-> Cl- >H2O> F-
CH3CH2CH CH2
19%
实验证明:消除反应的主要生成双键碳原子上连有烃基最多的 烯烃,这一经验规律称为查衣采夫(Saytzeff)规律。
消除反应的活性顺序: 叔卤代烷>仲卤代烷>伯卤代烷
五 与金属反应 RX + Mg 绝对乙醚
R MgX 烷基卤化镁
格氏试剂,Grignard reagent
Br
I
39 99
卤代烷的反应活性顺序:RI > RBr > RCl > RF
(三)亲核试剂的影响
卤代烃亲核取代和消除反应机理

亲核取代反应历程卤代烃的亲核取代反应是一类重要反应,由于这类反应可用于各种官能团的转变,在有机合成中具有广泛的用途,因此,对其反应历程的研究也就比较重要。
在亲核取代反应中,研究最多的是卤代烃的水解,在反应的动力学、立体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动力学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进行的,即双分子亲核取代反应(S N 2反应)和单分子亲核取代反应(S N 1反应)。
一、双分子亲核取代反应(S N 2反应)实验证明:伯卤代烃的水解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为水解速率,k 为水解常数。
因为RCH 2Br 的水解速率与RCH 2Br 和OH -的浓度有关,所以叫做 双分子亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背面进攻中心碳原子。
当亲核试剂与中心碳原子之间逐渐成键时,离去基团与中心碳原子之间的键逐渐断裂,新键的形成和旧键的断裂是同步进行的协同过程,其反应过程如下所示。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可用反应进程-势能曲线图表示如下:S N 2反应进程中的能量变化3.S N 2反应的立体化学:背面进攻和构型翻转。
(1)背面进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同一边或离去基团的背面进攻中心碳原子(C δ+)。
若从离去基团的同一边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升高,不利于反应的进行。
若从离去基团的背面进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进行。
(2)构型翻转:在S N 2反应中,中心碳原子由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中心碳原子的两边,且与中心碳原子处在同一直线上,中心碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu子与它上面的其他三个基团处于同一平面内。
第七章卤代烃12

叔丁醇 (CH3)3CONa CH3(CH2)3Br (CH3)3CO (CH2)3CH3
这是制备混合醚的方法,叫 醚合成法。 这是制备混合醚的方法 叫Williamson 醚合成法。伯卤烷效果 最好, 仲卤烷效果较差, 易发生消除生成烯烃)。 最好 仲卤烷效果较差 叔卤烷不能用 (易发生消除生成烯烃 。 易发生消除生成烯烃
-CN可转化为-COOH、-CONH2、 -CH2NH2等,在合成 CN可转化为-COOH、 可转化为 上用于增长碳链。氰化钠( 剧毒, 上用于增长碳链。氰化钠(钾)剧毒,使用时特别小 心。
酯等, -CN可转化为-COOH、-CONH2、 -CH2NH2、酯等,在 CN可转化为-COOH、 可转化为 合成上用于增长碳链。氰化钠( 合成上用于增长碳链。氰化钠(钾)剧毒,使用时特 剧毒, 别小心。 别小心。
C2H5Br _ HBr
(C2H5)2NH
NHC2H5Br _ H源自r(C2H5)3NN氰化钠( 反应) 3. 被氰基取代 (与氰化钠(钾)反应)
CH3CH2Br + NaCN
EtOH CH CH CN NaBr + 3 2
H3O+ CH3CH2COOH
BrCH2(CH2)5Br + 2KCN
C2H5OH, H2O Reflux 8h, 75%
NCCH2(CH2)5CN + 2KBr
结构、 第一节 结构、分类和命名 一、结构 卤代烷中的C 键的碳原子为sp 杂化, 卤代烷中的C-X键的碳原子为sp3杂化,碳原子与
。
卤素以 卤素以б键相连,价键间的夹角都接近109.5 。 相连,价键间的夹角都接近109.5 代烷常用通式R 一卤代烷常用通式 —X表示。 一卤代烷常用通式R—X表示。
第七章 卤代烷 亲核取代反应

CH3 CH3CH2 C CH3
Br 叔卤代烷
KOH, C2H5OH
CH3 CH3CH CCH3 +
2-甲基-2-丁烯 (71%)
ห้องสมุดไป่ตู้
CH3 CH3CH2C CH2
2-甲基-1-丁烯 (29%)
实验证明: 消除反应的主要产物是C=C碳原子上连有最多
烃基的烯烃,这一经验规律称为Saytzeff规则。 此规则说明,卤代烷脱卤化氢时,氢原子主要
δ+ δ-
[(CH3)3C Br]
决定速率的过渡态
δ+
δ-
[(CH3)3C OH]
Ea2 Ea1
(CH3)3C+
E
(CH3)3CBr + OH-
H (CH3)3CO +
H
(CH3)3COH + HBr
反应进展
图6-1 叔丁基溴水解反应(SN1)的能量曲线
(四)碳正离子的结构、相对稳定性和重排
First
实验证明:叔丁基溴在碱性溶液中的水解反应速 率v仅与卤代烷的浓度成正比,而与 亲核试剂OH—的浓度无关。
第一步:
慢 (CH3)3C Br
+ (CH3)3C Br
过渡态A
第二步:
(CH3)3C+ + OH- 快
+ (CH3)3C OH
过渡态B
(CH3)3C+ + Br叔丁基正碳离子
(CH3)3C OH
CHI3
碘仿
(三)系统命名法 以烃为母体,对母体进行编号,把卤素看成取代基。
H3C CH CH2Br
CH3CH2 CH CH2 CH CH2CH3
卤代烃的亲核取代反应机制
慢 (CH3)3C Br
+ -
(CH3)3C Br
过渡态A
(CH3)3C+ + Br叔丁基正碳离子
第二步
(CH3)3C+ + OH- 快
+ -
(CH3)3C OH 过渡态B
(CH3)3C OH
叔丁基溴水解反应动画
SN1反应的能量变化曲线
上页 下页 首页
SN1反应立体化学 反应动画
构型保持
R
H3C C
CH3CH2CH2 CH3CH2
Br
Br + CH3 C
R OH
+
CH2CH2CH3 CH2CH3
A
OH-
CH3
C CH2CH2CH3 CH2CH3
OH-
CH3
CH2CH3 C CH2CH2CH3
OH S
制作:邓健 出版:人民卫生出版社
构型转化
10
SN1反应的特点:
①属于单分子反应。 ②反应分两步进行,决定步骤是活泼中间体-正碳
SN2
E CH3Br + OH-
反应进程
活化能
CH3OH + Br-
上页 下页 首页
•SN2反应的立体化学 例:2-溴丁烷水解
反应动画
CH3
H C Br + NaOH
CH3CH2
R-2-溴丁烷
CH3 HO C
H CH2CH3
S-2-丁醇
• 瓦尔登转化是SN2反应的一个重要标志。
SN2反应历程的特点:
离子的形成。
③产物构型外消旋化。
制作:邓健 出版:人民卫生出版社
12
放映结束 感谢各位批评指导!
卤代烃亲核取代反应

卤代烃亲核取代反应
卤代烃亲核取代反应是有机化学中常见的一个类型的反应。
它是指一个亲核试剂(通常是一个亲电性离子或分子)与一个卤代烃反应,取代掉烃分子中的卤素原子。
在反应中,亲核试剂与卤代烃发生反应,亲核试剂中的亲核原子(通常是负电荷的氧、硫、氮等)攻击卤代烃中的卤素原子,形成一个新的化合物。
反应机制通常涉及一个亲核试剂的核攻击、卤素原子的离去以及负电荷的平衡。
常见的卤代烃亲核取代反应包括:醇的亲核取代反应(例如SN1和SN2反应)、硫醇的亲核取代反应、醛和酮的亲核加成反应、羧酸和酰氯的亲核取代反应等。
卤代烃亲核取代反应在有机合成中非常重要,它可以用于合成新的有机化合物、引入功能团或产生新的化学键。
卤代烃亲核取代反应
4、被硝酸根(-ONO2)取代
_
5、被烃氧基(-OR)取代
RNu X
H2O NaCN/醇
NaOR'
卤代烃的合成意义
ROH + HX
NaOH
RX
ROH + HX
RCN + NaX H2O/H+ RCOOH
ROR' + NaX Williamson合成混醚
NH3
RNH2 + NH4X 氨ān、胺àn、铵ǎn
变快 变快 不变
1.SN1反应机理
(CH3)3C Br + OH
(CH3)3C OH + Br
υ= K[(CH3)3CBr]
慢
(1) (CH3)3C Br
δδ
(CH3)3C Br
(CH3)3C + Br
慢
sp3
Sp3~sp2
过渡态A
空助效应 sp2
快
(2) (CH3)3C + OH
两侧进攻
δδ
(CH3)3C OH
卤代烃:
饱和卤代烃 不饱和卤代烃 芳香卤代烃
RCH2X
RCH CHX
2、命名
普通命名法:
卤(代)某烃
Br
X
烃基 + 卤素
某 基 卤 CH2 CH CH2Br
俗名
CHCl3
比较复杂的卤代烃一般用系统命名法
CH3I
甲基碘
CH2 CH Br
乙烯基溴
Cl 烯丙基氯
Br
丙烯基溴
Cl
2-甲基-4-氯-1-丁烯
(R)-3-甲基-3-己醇 外
构型保持
消
旋
CH3
卤代烃—亲核取代反应机理(有机化学课件)

υ=k [(CH3)3CBr]
导入动画
磺化反应 2. SN1历程的特点
反应分两步进行 在反应中有活性中间体—碳正离子生成,有可能发生重排反应 为1级反应ν=k[R-X]
磺化反应 练一练
写出2,2-二甲基-3-溴丁烷的水解历程
03
双分子亲核取代 反应(SN2)
双分子亲核取代反应(SN2) 1. 溴甲烷的水解历程
CH3Br + OH-
CH3OH
= k[CH3Br][OH-]
υ=k [CH3Br][OH-]
+ Br-
双分子亲核取代反应(SN2)
1. 溴甲烷的水解历程
C—O 键部
分形成
过渡态
Cr HO
亲核试剂从远离Br 的一边进攻底物
Br fastHO
中心碳构型转化
双分子亲核取代反应(SN2) 2. SN2历程的特点
反应一步完成,属于协同反应 v=k[CH3X][OH-],为二级反应 构型转化(Valden inversion)
小结
100% 80 % 60 % 40 % 20 %
卤代烃亲核 取代机理
导入
卤代烃不仅在有机合成中有广泛的应 用,而且在有机化学理论研究方面也 占有重要的地位。
01
亲核取代反应
目录
CONTENT
02
单分子亲核取 代反应( SN1 )
03
双分子亲核取 代反应(SN2)
01
亲核取代反应
亲核取代反应
02
单分子亲核取 代反应(SN1)
单分子亲核取代反应(SN1) 1. 叔丁基溴的水解历程
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
21
b CH3CH CHCH2C=CH2
CH2= CH-CH-CH2-Cl 3- 甲
CH2= CBHr-CCHH-C3H2-CCl H2CH3-3甲基 -4- 氯 -1-丁烯CH3
2- 甲
4-甲基-2C-乙H3基- 5-溴-12--己甲基烯-1- 氯3--甲3C-丁基l 烯-4-氯×-1-丁烯
Cl CH3
碱性试剂
H
βα
KOH
RC C X 醇
R CC
+ HX
BBrr CC22HH55OOHH KKOOHH
H3HC3CCBrHCBrHCBrHCB2rH2C2KCHO2K5HHOO5HHOH H3HC3CC C CHCH
CH3CHCHCH2 H Br H
KOH C2H5OH
CH3CH CH2CH3
81%
第七章 卤代烷 亲核取代反应
第一节 结构、分类和命名
一、结构
X
C
X=F,Cl,Br,I
键的极性 C F C Cl C Br C I 键长 C F C Cl C Br C I
二 分类 1 按与卤素相连的C原子的类型不同分
伯卤代烷 RH2C X
仲卤代烷
R2HC X
叔卤代烷
R3C X
氟代烃
2 按卤素的不同分: 氯代烃 溴代烃
2°CN可进一步转化为–COOH,-CONH2等基团。
RRCCNN H+H/HH++2//HHO22OO RRCCOOOOHH
RCN
RCOOH
[H]
RCH2NH2
4 被硝酸根取代
R X + AgNO3
RONO2 + AgX
活性顺序:RI > RBr > RCl
。 3 RX
>2。RX
>1。RX
( X 原子相同 )
例: CH3(CH2)3Br CH3CH2CH(Br)CH3 (CH3)3CBr
AgNO3/醇
加热出现AgBr 片刻出现AgBr 立刻出现AgBr
5 被其他卤素原子取代
丙酮
R Cl + NaI
RI + NaCl
6 被氨基取代
NH3 RX RNH2 RX R2NH RX R3N RX R4NX
二 消除反应(Elimination)
4-甲4基-甲-5基-氯-5环- 氯己C环H烯己3 烯
4 -甲基
CH3 Br
CH3
H
Cl
CH2CH3
Br C=C
CH3
H
Br
邻-溴甲苯 (S)-2-氯丁烷 E-1,2 -二溴丙烯
第二节 物理性质
物态:1C-3C的氟代烷、1C-2C的氯代烷和溴甲烷为气 体,其他一卤代烷为液体,15C以上为固体。 沸点:
CH3CH2CH CH2
19%
实验证明:消除反应的主要生成双键碳原子上连有烃基最多的 烯烃,这一经验规律称为查衣采夫(Saytzeff)规律。
消除反应的活性顺序: 叔卤代烷>仲卤代烷>伯卤代烷
五 与金属反应 RX + Mg 绝对乙醚
R MgX 烷基卤化镁
格氏试剂,Grignard reagent
碘代烃
三 命名 (一)普通命名法
烃名称前或后加卤素的名称。
CH3CH2CH2CH2Cl
正丁基氯
CH2 CH CH2Br
烯丙基溴
CH2Cl
苄基氯(氯苄) benzyl chloride
CH3 H3C C Cl
CH3 氯代叔丁烷,叔丁基氯
(二)俗名
CHCl3 氯仿 (三氯甲烷)
(三)系统命名
CHI3 碘仿
绝对乙醚——无水、无乙醇的乙醚。
RMgX + O2
RMgX+ CO2
ROMgX H2O ROH
RCOOMgX H2O RCOOH H
HHOOHH RR′-′-OOHH
OOHH RR--HH ++ MMgg
XX OORR RR--HH ++ MMgg XX
RRMMggXX ++
RR′C′COOOOHH RR--HH ++ MMgg OOCCOORR′′ XX
CH3CH2CH2CH3
n-C8H17Br + LiAlH4
O
C8H18
第四节 亲核取代反应和消除反应机理
一 亲核取代反应机理 (一)双分子亲核取代反应(SN2)机理
Ò CH3Br NaOH-H2O CH3OH + Br- ÒÒÒ 反应速率方程: v=k[CH3Br][OH-]
R-X一般为1°RX,(仲、叔卤代烷与醇钠反应时,主要发 生消除反应生成烯烃)。
+ (CH3)3CCl NaOCH2CH3
(CH3)3C O CH2CH3 次要反应
H3C C CH2 CH3
主要反应
3氰解—与氰化钠作用
R X + -CN
R CN + X-
1°反应后分子中增加了一个碳原子,是有机合成中增长碳链的 方法之一。
HHXX
XX RR--HH ++ MMgg
XX
RR′-′-CC
CCHH
RR--HH ++
XX MMgg
CC CCRR′′
新新的的格格氏氏试试剂剂,,很很有有用用
CH2 CHCH2Cl + RMgBr
CH2 CHCH2R
三 还原反应
催化剂
RX + H2
RH + HX
CH3CH2CHCH3 Br
Zn CH3COOH
随碳原子数增加而升高,比相应的烷烃高;
溶解性:绝大多数卤代烃不溶于水,但能溶于许多常 用的有机溶剂,有些卤代烃可以直接作溶剂使用。
第三节 化学反应
(一)亲核取代和亲核试剂
Nu - + R-X
R-Nu + X -
Nu + R-X
R-Nu+ + X -
亲核试剂:带负电荷 (OH-,RO-,CN-,HS-)或具有未共
按烃的命名原则进行命名,把卤素当一般的取代 基对待。
Cl CH3
Br
CH3
H3
H3C CH CH CH2 CH3 H3C CH CH2 CH CH3
H
12
34
5
54
3
2
1
3-甲3-甲基基-2--2氯-氯戊戊烷烷
2-2甲-甲基基-4--溴4-戊溴烷戊烷
(取代基离两端等距离,
优先考虑列出的基团 )
6
543
1°加NaOH是为了加快反应的进行,是反应完全。 2°此反应是制备醇的一种方法
2醇解—与醇钠作用——威廉森(Williamson)合成法
R X + -OR'
R OR' + X-
CCHH33CCHH22BBrr ++ NNaaOOCC((CCHH33))33
CCHH33CCHH22OOCC((CCHH33))33 ++ NNaaBBrr
用电子对的试剂(H2O,ROH,NH3) 亲核取代反应:由亲核试剂对显正电性的原子的进 攻而引起的取代反应。以SN表示。 底物:与亲核试剂反应的卤代烷
离去基团:在反应中被取代的基团。
(二)常见的亲核取代反应
1水解
R X + -OH
R OH + X-
离去基 X 的碱性越弱,越容易被 OH 取代。
水解反应的相对活性: RI>RBr>RCl>RF (烷基相同)
